標準壓力從
1 atm 變成 1 bar
對熱力學數據的影響
邱智宏
壹、前言
國 際 純 化 學 與 應 用 化 學 聯 合 會(IUPAC) 於 1982 年 將 標 準 狀 態 的 壓 力 (pressure of standard state)由 過 往 大 家 熟悉 的 1 大 氣壓 力(1 atm = 101,325 Pa)改 為 1 bar (105 Pa)。 其
所 持 的 理 由 為Pa 為 國 際 標 準單 位(SI unit), 目前 已 廣為 各 國 科 學界 所 使 用 ;在 處 理 平 衡 常 數 時 , 常 使 用 到 對 數 的 關 係 式 :ln(p/p0), 若 p0 = 1 bar 時 ,使 用 上 甚 為方 便 。 然 而, 在 許 多 化 學 教 科 書 上 , 仍 沿 用 舊 制 , 其 拒 抗 的 原 因 除 了 因 循 習 慣 以 外 , 對 於 初 學 壓 力 的 學 子 , 一 大 氣 壓 相 較 於 1 bar 是 一 個 較為 具 體 、 不抽 象 的 概 念。 可 喜 的 是目 前 國 內 的高 中 化 學 教 科 書,自95 課 綱 後,已 經 開 始逐 漸 調 整 中。本 文 擬 探討 壓 力 由 1 atm 改 為 1 bar 時 , 對 於 熱 力 學 的 數 據(thermodynamic data)究 竟 有多 大 的 影 響, 尤 其 是 查表 經 常 會 使用 到 的ᇞfH0、ᇞfG0、S0及 平 衡 常 數(K)等 數值,並 提 供它 們 在 二 種不 同 壓 力 系統 間 的 轉 換方 法 。
貳、標準壓力改變對焓、熵及自由能的影響
欲觀 察 等 溫下、壓 力 改變 對 焓(enthalpy, H)、自 由能(Gibbs free energy, G)及 熵(entropy,
S)的影 響 , 必 須從 熱 力 學 的基 本 公 式 開始 推 導 。 首先 討 論 焓 ,若 經 由 下 列公 式 : dH TdS Vdp 當 溫 度 為 定 值 時 , 可 知 壓 力 改 變 對 焓 的 影 響 : ( H)T T( S)T V p P (1) 另外,由 麥克 斯 爾 關 係式(Maxwell relation):( S)T ( V)p p T 及 體 積 膨 脹 係 數(volume expansion coefficient, α): 1( )p V V T , 代 入(1)式 可得(2)式 如 下: ( H)T V(1 T) p (2) 將 α 直 接 代 入 右式 :( S)T ( V)p p T , 可 得 熵 隨 壓 力 變 化 的 關 係 式 :
( )T S V p (3) 由dG SdT Vdp 可 知 當 T 為 定值 時 , 壓 力改 變 對 自 由能 的 影 響 : ( G)T V p (4) 由(2)、(3)、(4)式,可以 求 出物 質 由 1 atm 降 至 1 bar 時,焓、自 由 能 及 熵 的 改 變 量 , 下 列 分 成 氣 體 和 固 、 液 體 ( 凝 態 ) 兩 部 分 討 論 :
一、理想氣體部分
一 般 處 理 熱 力 學 數 據 時 , 均 將 氣 體 的 參 考 狀 態(reference state)當 做 是 理 想 氣 體 。 由 於 理 想 氣 體 的 焓 僅 和 溫 度 有 關 , 因 此 在 恒 溫 下 , 改 變 壓 力 其 數 值 不 變 , 所 以 1 bar 時 的焓(H0,bar)和 1atm 時 的 焓 (H0,atm)兩 者 相 等。 當 然 經 由(2)式 也 可 導出 相 同 的 結果 , 由 理 想
氣 體 方 程 式pV = nRT 可 知: 1 1 ( ) ( )p ( )p nRT V p nR V T V T pV , 代 入(2)式後 再 積 分, 由 於 為 理 想 氣 體 其 nRT 1 pV , 因 此 積 分 式 內 為 0,結 果 如 下 :(另 為 簡 潔 起 見, 文 中 1 atm
換 算 為bar 時 ,均 以 1.01 bar 替 代 1.01325bar 表 示)
1 0, 0, 1 1.01 1.01
(1bar bar atm bar ) 0
bar bar nRT dH H H V dp pV
0,bar 0,atm H H (5) 至 於 熵 的 變 化 , 直 覺 地 判 斷 兩 者 就 不 會 相 等 , 因 為 數 量 相 同 的 氣 體 分 子 , 在 等 溫 下 壓 力 較 小 的1 bar 所 佔 有 的 體 積,自 然 比 1 atm 的 多,因 此 亂 度 較大。1 bar 下 的熵(S0,bar)和 1atm 下 的 熵(S0,atm)之間 的 差 異可 由(3)式 求得 , 每 莫 耳增 加 0.109 J/K。
1 1 1 1.01 1.01 1.01 1 1.01 nR dS V dp dp nRln p
0,bar 0,atm (1.01) 0.109 S S nRln n (6) 自 由 能 的 變 化 可 經 由(4)式 中求 得 :
1 1 1.01dG 1.01Vdp nRTln 1.01 0.109nT
0,bar 0,atm (1.01) 0.109 G G nRTln - nT (7) 由(7)式可 算 出 在 298.15 K 時 ,1 莫 耳 氣體 當 壓 力 由 1 atm 改 變 為 1 bar 後 , 其 自 由 能的 改 變(G0,bar−G0,atm)為-3.26×10-2 kJ/mol。二、固、液體部分
由 於 壓 力 從 1 atm 改 變 至 1 bar 是 一 個很 小 的 範 圍,因 此 這 段區 間 內,可 將 α、V 視 為 定 值 , 因 此 上 列(2)、 (3)、(4)式可 分 別改 寫 如 下 : 0,bar 0,atm (1 ) H H V T p (8) 0,bar 0,atm S S Vp (9) 0,bar 0,atm G G V p (10) 若 將 一 些 純 物 質 的 實 際 數 值 代 入 上 列 各 式 計 算 , 可 得 結 果 如 表 一 , 例 如H2O(l)的 部 分
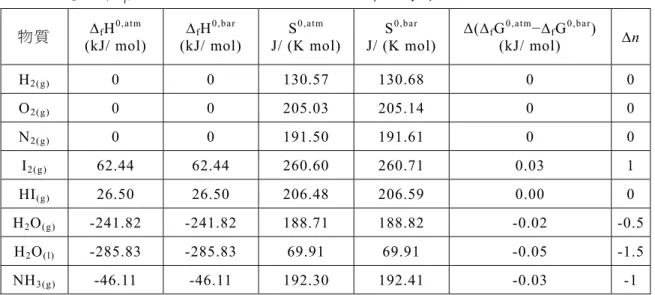
0,bar 0,atm 18 10 6 3 1 1 2.10 10 4 298.15 10000 101325 H H m mol 2 1 5 1 2.24 10 Jmol 2.24 10 kJmol 表 一、溫度在298.15 K,壓力由 1 atm 改變成 1 bar 時,一些純物質熱力學數值的改變情形 項 目 Vm (cm3/mol) (Kα -1) 0,bar 0,atm H H (kJ/mol) 0,bar 0,atm G G (kJ/mol) 0,bar 0,atm S S (J/mol·K) 理 想 氣 體 RT/p 3.35×10-3 0 -3.26×10-2 0.11 凝 態 H2O(l) 18 2.10×10-4 -2.24×10-5 -2.39×10-5 5.00×10-6 C6H6(l) 121 1.24×10-4 -1.54×10-4 -1.60×10-4 1.99×10-5 NaCl(s) 27 1.20×10-4 -3.45×10-5 -3.58×10-5 4.29×10-6 由 表 一 可 看 出 , 在 定 溫 為 298.15 K 時 ,氣 態 的H0,bar H0,atm, 壓 力 改 變 對 焓 没 有 影 響 , 但 對 於 自 由 能 及 熵 由 1 atm 改 變 為 1 bar 時 , 前 者 每 一 莫 耳 減 少 0.109T (3.26×10-2kJ/mol),後 者 增 加 0.109 J/mol·K,因此 若 壓力 改 變 時 使用 到 這 些 數據,則 必 須 經 過 適 當 的 調 整。至 於 凝 態 的 部 分,可 看 出 通 常 以 千 焦 為 單 位 的 焓 和 自 由 能,在1bar 和 1 atm 二 者 間 的差 別 , 由 表中 可 看 出 最大 的 差 異 也不 會 大 於 0.00016kJ/mol,相 較 於 實際 測 量 時 的 不 準 度 , 兩 者 幾 乎 可 以 看 成 相 等 。 另 外 , 熵 的 情 況 也 是 相 同 的 情 況 , 兩 者 的 差 距 均 在10-5到 10-6之 間 相 對 於 氣 體 的 0.109J, 可 以忽 略 不 計 。參、壓力改變對莫耳生成焓及莫耳生 成自由能的影響
由 表 一 可 知 , 對 於 固 體 及 液 體 , 其 傳 統 表 達 的 焓(conventional enthalpy), 或 稱 相對 焓、相 對 自 由 能 及 相 對 熵,當 壓 力 由 1 atm 改 變 成 1 bar 時 是不 需 要 調 整的,除 非 是進 行 極 精 密 的 檢 測 。 至 於 氣 體 除 了 焓 以 外 , 自 由 能 及 熵 均 需 經 過 適 當 的 調 整 。 然 而 我 們 平 常在 查 表 時 , 焓 及 自 由 能 均 以 莫 耳 生 成 焓 (molar enthalpy of formation) 及 莫耳 生 成 自 由 能 表 示 , 那 麼 它 們 在 壓 力 由1 atm 變 成 1 bar 時 應如 何 調 整 ? 首 先 莫 耳 生 成 焓 的 部 分 不 需 要 調 整 , 原 因 己 如 上 述 , 至 於 熵 查 表 時 均 以 相 對 熵 表 示,其 調 整 方 式 亦 如 上 述,將 增 大nRln(1.01)。最 終 需 要 關 注 的 僅 為 莫 耳 生 成 自 由 能 的 部 分 , 其 調 整 必 需 依 據 其 生 成 反 應 式 中 各 相 關 物 質 的 狀 態 加 以 考 量 , 例 如 下 列 水 蒸 氣 及 水 的 莫 耳 生 成 自 由 能 的 調 整 就 不 一 樣 : 2( ) 2( ) 2 ( ) 1 2 g g g H O H O (11) 2( ) 2( ) 2 ( ) 1 2 g g l H O H O (12) 純物質的標準莫耳生成自由能(ᇞfG0,bar)即為 1bar 下某特定溫度時,該純物質 1 莫耳的 自由能減去其各成份元素最穩定狀況的自由能。例如(11)式之標準莫耳自能可表示如下: 2 ( ) 2 ( ) 2 2 ( ) 0, 0, 0, 0, ( ) 1 1 1 2 g g g
bar bar bar bar
fGH O GH O GH g GO 而1bar 和 1atm 的 標 準 莫 耳生 成 自 由 能的 差 別 如 下: 2 ( ) 2 ( ) 2 ( ) 2 ( ) 2 ( ) 2 ( ) 2 ( ) 2 ( ) 0, 0, 1 ( 0, 0, ) 1 ( 0, 0, ) 1 ( 0, 0, ) 2 g g g g g g g g
bar atm bar atm bar atm bar atm
fGH O fGH O GH O GH O GH GH GO GO
2 ( ) 2 ( ) 0, 0, 1 ( (1.01) 1 ( 1.01 ) 1 ( 1.01 ) 2 g g bar atm fGH O fGH O RTln RTln RTln
2 ( ) 2 ( ) 0, 0, 1 ( 1.01 ) 2 g g bar atm fGH O fGH O RTln
0,bar 0,atm ( 1.01 ) fG fG n RTln (13) 上 式 的Δn 等 於氣 態 生 成 物的 總 莫 耳 數減 去 氣 態 反應 物 的 總 莫耳 數,所 以(12)式 中 生 成 水 的 情 況,其Δn = -1.5,有 別生 成 水 蒸氣 的(11)式,其 Δn = -0.5。表 二 是 在 298.15 K、 1atm 的 條 件 下,將一 些 純 物質 的 熱 力 學數 據 直 接 由 普 化 的 教 科 書 擷 取,並 利 用 公 式 (5)、 (6)、(13)將 標 準壓 力 由 1 atm 改 變 為 1 bar 時 , 其數 值 的 變 化情 形 條 例 出來 。 由 表 二 可 知 , 若 非 作 精 密 計 算 , 基 準 壓 力 小 幅 的 改 變 , 對 莫 耳 生 成 自 由 能 的 差 異 , 其 實 影 響 甚 小。表 二 中 物 質 的 熱 力 學 數 據 是 以 1 atm 做 為 標 準 壓力,再 經 公式 轉 換 成 以 1 bar 為 基 準 , 若 再 將 此 計 算 得 出 的 數 值 , 直 接 和 物 化 教 科 書 上 相 對 應 的 查 表 數 值 相 互 比 較 , 其 相 對 熵 的 部 分 計 算 值 和 查 表 值 相 差 不 到 萬 分 之 2, 至 於莫 耳 生 成 自由 能 的 部 分, 也 小 於 千 分 之 2, 基 本 上 若考 慮 不 準 度的 因 素 , 兩者 實 際 上 是相 等 的 , 因此 上 述 公 式的 推 導 是 合 乎 邏 輯 的 。表 二 、 一 些 純 物 質 在298.15 K, 1 atm 及 1 bar 下 的 熱 力 學數 值 物 質 ∆fH0,atm (kJ/ mol) ∆fH 0,bar (kJ/ mol) S 0,atm J/ (K mol) S 0,bar J/ (K mol) Δ(∆fG 0,atm−∆ fG0,bar) (kJ/ mol) ∆n H2(g) 0 0 130.57 130.68 0 0 O2(g) 0 0 205.03 205.14 0 0 N2(g) 0 0 191.50 191.61 0 0 I2(g) 62.44 62.44 260.60 260.71 0.03 1 HI(g) 26.50 26.50 206.48 206.59 0.00 0 H2O(g) -241.82 -241.82 188.71 188.82 -0.02 -0.5 H2O(l) -285.83 -285.83 69.91 69.91 -0.05 -1.5 NH3(g) -46.11 -46.11 192.30 192.41 -0.03 -1
肆、標準壓力改變對平衡常數的影響
化學 反 應 的平 衡 常 數(K)可以 由 標 準反 應 自 由 能( 0 rG )經由 下 式計 算 出 來 : 0 ln( ) rG RT K (14) 以 1 bar 為 基 準的 標 準 反 應自 由 能( 0,bar rG )可 由反 應 式 中 各物 質 的 相 對自 由 能 求 出, 以 氨 的 合 成 為 例 : 2( ) 2g 3 g N H 2NH3( )g 3( ) 2 ( ) 2 ( ) 0, 2 0, 1 0, 3 0, g g gbar bar bar bar
rG GNH GN GH 利 用(7)式 代 入 上式 右 半 部 ,可 得 3( ) 2 ( ) 2 ( ) 0, (2 0, 1 0, 3 0, ) (2 1 3) (1.01) g g g
bar atm atm atm
rG GNH GN GH RTln 0,bar 0,atm (1.01) rG rG n RTln 上 列 如 以 通 式 表 示,Δn = (反 應式 中 氣 相生 成 物 的 係數 和)−(氣 相反 應 物 的 係數 和)。將(14) 式 代 入 上 式 可 得 (1.01) bar atm RTlnK RTlnK n RTln (1.01) bar atm n K K (15) 由(15)式 可 知,標 準 壓 力 使用 不 同 的 基準 時,平 衡常 數 的 數 值會 不 一 樣,依 Δn 的 大小 而 互 異 , 每 增 加1, 大約 產 生 1%的 差 別。 標 準 反 應 自 由 能 也 可 由 反 應 式 中 各 個 相 對 應 的 物 質 之 標 準 生 成 自 由 能 求 得 , 例 如 在 1 atm 時 , 下 式的 反 應 自 由能 可 依 表 二的 數 據 計 算如 下 : 2 ( )l H O H O2 ( )g
2 ( ) 2
0, 0, 0, 228.59 237.18 8.59 /
g l
atm atm atm
rG fGH O fGH O kJ mol 將 此 數 值 代 入(14)式 , 可 得 Katm = 3.13× 10-2。 利 用(15)式 可 求 Kbar: 1 2 (1.01) 3.17 10 bar atm K K - 水 在 298.15 K 蒸 發 為水 蒸 氣之 平 衡 常 數,盡 管 在 數值 上 因 為 標準 壓 力 的 基準 不 同 而 相 異 , 但 其 飽 和 蒸 氣 壓 力 的 測 定 值 則 應 該 相 同 , 並 不 會 因 為 基 準 不 同 而 有 所 改 變 , 我 們 可 以 檢 驗 如 下 : 2 ( ) 2 ( ) 2 0, 1 3.13 10 g g H O H O atm atm p p K p atm , pH O2 ( )g 0.0313atm23.8torr 2 ( ) 2 ( ) 2 0, 1 3.17 10 g g H O H O bar bar p p K p bar , pH O2 ( )g 0.0317bar23.8torr
伍、結論
當 標 準 狀 態 的 壓 力 由 1 atm 改 變 為 1 bar 時,在「 凝 相」物 質 的 相對 焓、自 由能 及 熵 的 改 變 量 不 是 不 變 就 是 微 乎 其 微 , 可 以 不 用 調 整 。 在 「 氣 相 」 時 , 焓 僅 為 溫 度 的 函 數 , 也 是 不 需 要 變 動 , 但 是 自 由 能 則 需 要 減 少 (1.01)nRTln , 熵 的 部 分 則 需 增 加 (1.01)nRTln 。 至 於 查 表 時 焓 及 自 由 能 經 常 不 是 列 出 各 物 質 的 相 對 焓 及 相 對 自 由 能 , 而 是 列 出 莫 耳 生 成 焓 及 莫 耳 生 成 自 由 能 , 當 標 準 壓 力 改 變 時 , 前 者 無 需 修 正 , 後 者 則 需 調 整 如 下 :
0,bar 0,atm ( 1.01 ) fG fG n RTln 另 外 ,平 衡 常 數 也 會 隨 著 標 準 壓 力 的 基 準 改 變 而 不 同 , 它 們 之 間 的 關 係 為 : (1.01) bar atm n K K 。 目 前 高 中 的 教 科 書 有 關 焓 的 數 據 , 大 部 分 取 自 大 學 的 普 化 教 科 書 , 通 常 使 用 之 標 準 壓 力 均 為 1 atm, 而 非 1 bar,唯 如 上 所述 有 關 焓 的數 值 ,1 atm 和 1bar 的 狀況 下 , 兩 者 是 相 等 的 , 因 此 標 準 壓 力 在 不 同 基 準 下 交 互 使 用 , 並 不 會 產 生 問 題 。 但 是 到 了 大 學 , 開 始 討 論 熵 及 自 由 能 , 若 作 精 密 計 算 , 則 必 需 作 局 部 調 整 , 而 不 能 混 用 , 本 文 提 供 兩 者 互 相 轉 換 的 方 法 , 希 望 對 學 子 有 所 助 益 。參考資料
葉 名 倉 , 劉 如 熹 , 邱 智 宏 , 周 芳 妃 , 陳 建 華 , 陳 偉 民 , 高 級 中 學 基 礎 化 學(一), 南 一書 局 , 第111~119 頁 ,2013 年 。J. P. Birk (1994), Chemistry. Appendix C, A12~A19. Houghton Mifflin Company.
P. W. Atkins (1994), Physical Chemistry (5th ed.). Data section, C8~C15. Oxford University Press, Oxford.