行政院國家科學委員會專題研究計畫 成果報告
提升高科技產業酸鹼廢氣處理系統的處理效率
計畫類別: 個別型計畫 計畫編號: NSC93-2622-E-009-005-CC3 執行期間: 93 年 05 月 01 日至 94 年 04 月 30 日 執行單位: 國立交通大學環境工程研究所 計畫主持人: 蔡春進 計畫參與人員: 陳開亨, 陳茂銓 報告類型: 精簡報告 處理方式: 本計畫為提升產業技術及人才培育研究計畫,不提供公開查詢中 華 民 國 94 年 7 月 26 日
摘要
現行高科技產業所排放的酸鹼廢氣皆使用填充式洗滌塔來做處理,但在先前的研究當 中顯示,目前傳統的填充塔對於低濃度、高風量之酸鹼氣狀污染物的處理效果不佳,無法 符合半導體法規對於酸性廢氣處理效率必需大於 95 %的規定,因此處理效率必需大幅提 昇。 為了達到提高酸鹼氣體污染物的去除效率,本研究設計並建造及測試一個高效率的洗 滌系統模場,在原有的填充塔前加設一個噴霧塔,利用噴霧塔中產生之細微水霧的大比表 面積、及極佳的吸收效果,來提昇洗滌系統的去除效率。本研究中針對高科技業常排放之 HCl 氣體做為模擬的污染氣體進行各種試驗,並將在各操作條件下的實驗結果與理論做一 比較。 本研究所設計的高效率洗滌塔的測試風量為 1.3~7.2 CMM,填充部分之滯留時間為 0.7~2.5 秒,其他之設計條件符合半導體製造業空氣污染管制及排放標準中所規定。噴霧塔 之滯留時間為0.8~2.4 秒;噴霧塔之氣液比為 13000~60000 m3/m3,水滴之梭特直徑(Sauter diameter)為 28.4 µm,水滴之 pH 值為 5~7 之間(去除鹼性氣體時)或 7~10(去除酸性氣體時)。 本研究先針對填充塔部分進行研究測試。結果顯示填充塔對 HCl 的去除效率會和進口 濃度有相當大的關係。當進口濃度低於1 ppm 時去除效率會快速的下降,而當進口濃度逐 漸上升後,去除效率會漸漸穩定而達到一平衡的效率。當改變洗滌水導電度時,發現導電 度升高,去除效率會下降,且在愈低濃度的區間此現象會更加明顯。在洗滌水的pH 方面, 增加pH 值由 7 到 10,對於去除 HCl 上也有幫助,但並不是非常顯著。反而在降低風速以 延長滯留時間由0.7 秒到 2.5 秒時,在進口濃度為 220 ppb 的條件下可以得約 11%的效率提 升。Abstract
The packed scrubbers are used to control the acid and basic exhaust gas in high-tech industries. However the earlier researches indicate that the efficiency of packed tower is limited when the inlet concentration is low and flow rate of the acid and basic gas pollutant is high and thus fails to meet the emission standard of semiconductor manufacture. Thus there is urgent need to improve the removal efficiency. This study aims to design and build a new scrubbing system to increase efficiency of removing acid and basic gas pollutant. A spray tower was designed to produce the high surface ratio of the fine mist before the packed tower to absorb the pollutant with better efficiency. An experiment was conducted using HCl gas as pollutant in the new scrubbing system to study its performance under different conditions & the results were compared with the theory.
The test flow rate of the new scrubbing system was kept between 1.3 and 7.2 CMM; the retention time of the packed tower was set 0.7~2.5 sec, and other design parameters was met the semiconductor manufacturing emission standard. The retention time in the spray was adjusted between 0.8 to 2.4 sec; the gas to liquid ratio of the spray tower was varied from 13000 to 60000 m3/m3; the sauter diameter of the mist was 28.4μm; The pH of the mist was used between 5 and 7 when removing the basic gas & it was set 7 and 10 when removing acid gas.
Firstly the efficiency of packed tower of our new scrubbing system was tested & the results show the removal efficiency is highly related to the HCl inlet concentration. When the HCl inlet concentration is lower than 1 ppm, the removal efficiency was 35~90% & when inlet concentration become higher than 1 ppm, the removal efficiency increased to about 95% and reach a equilibrium removal efficiency. The removal efficiency show decreases with increase in the conductivity of the scrubbing water. The removal efficiency of HCl gas show when pH of scrubbing was increased from 7 to 10. However the increase of the retention time from 0.7 for 2.5 sec under 220 ppb inlet concentration show 11% improvement of HCl removal efficiency.
The most important parameter in spray tower experiment is Qg/Ql. When the ratio
decreases from 19500 to 13000, spray tower can increase the HCl removal efficiency more than 10%. Besides this, it can work very well in low inlet concentration region. The trends under other operation parameters are the same with the packed tower, but the performances of the spray tower are better than the packed tower.
The new scrubbing system containing the spray tower and packed tower was tested with Qg/Ql=13000, mist pH=7, scrubbing water pH=7 and scrubbing water flow rate is 25
lpm & the results show that the removal efficiency reach to 95% only with the inlet concentration of 600 ppb by adding the spray tower instead of inlet concentration of 1350
ppb while using packed only. The removal efficiency of 90% was achieved with inlet concentration of 300 ppb can also reach to 90%. These results show that the new scrubbing system dose strengthen the ability of removing HCl gas pollutant in low inlet concentration.
目錄
摘要...Ⅰ Abstract ...II 目錄... IV 圖目錄... VI 表目錄... VII 第一章 前言...1 1.1 研究動機...1 1.2 研究目的...2 第二章 文獻回顧...6 2.1 噴霧塔相關研究...6 2.2 填充塔之設計理論...6 2.3 液滴吸理論...9 2.3.1 污染物質傳公式之推導...9 2.3.2 攝入係數(uptake coefficient) ...10 2.3.3 有效亨利係數...12 2.4 噴霧塔吸收效率理論...13 第三章 研究方法...26 3.1 實驗設備...26 3.2 氣液比參數計算...26 3.3 操作步驟...27 3.4 採樣方法及步驟...28 3.4.1 採樣器介紹...28 3.4.2 採樣準備工作...28 3.4.4 樣品的分析...29 3.4.5 無機酸、鹼氣體分析程序的品保品管...29 第四章 結果與討論...40 4.1 傳統洗滌塔之效率研究...40 4.1.1 循環水質及進口濃度對去除效率之影響...40 4.1.2 循環水pH 質對去除效率之影響...40 4.1.3 除霧器(demister)之影響 ...41 4.1.4 滯留時間對去除效率之影響...41 4.2 噴霧塔之效率研究...41 4.2.1 氣液比對去除效率之影響...424.2.2 噴霧pH 值對去除效率之影響...42 4.2.3 滯留時間對去除效率之影響...42 4.3 新式洗滌系統之結合及效率分析...43 4.3.1 新式洗滌系統之去除效率表現...43 4.3.2 新式洗滌系統與噴霧塔之效率關係...43 4.3.3 填充塔的氣提現象...43 4.4 模場數據與理論之比較...44 第五章 結論與建議...62 5.1 模場實驗結論...62 5.2 建議...63 第六章 參考文獻...65
圖目錄
圖1.1 實場中 HCl 氣體去除效率對進口濃度之關係圖(黃, 2003) 5 圖2.1 雙膜理論圖...17 圖2.2 填充塔設計示意圖...18 圖2.3 填充塔內各點吸收濃度示意圖...19 圖2.4 (1 )(1 ) 1 i y y − − 對y 關係圖 ...20 圖2.5 填充塔滯留時間對去除效率理論圖...21 圖2.6 模擬不同粒徑之水霧對污染物之去除效率圖...22 圖2.7 Hago M1 噴頭模擬在不同氣液比下之去除效率對時間關係圖...23 圖2.8 pH=6 時之吸收效率對時間關係圖...24 圖2.9 pH=5 時之吸收效率圖...25 圖3.1 實驗系統示意圖...35 圖3.2 噴霧系統示意圖...36 圖3.3 本研究採用之固氣分離器組合剖面圖...37圖3.4 固氣分離器的多孔金屬片的採樣效率與採樣容量實驗系統(Tsai et. al., 2001a) 38 圖3.5 三種不同無機酸鹼檢測方法效率比較(Tsai et. al., 2001a)...39
圖4.1 填充塔內不同循環水質對 HCl 去除效率圖 ...48 圖4.2 填充塔內不同循環水 pH 值對 HCl 去除效率圖 ...49 圖4.3 除霧器對去除效率影響比較圖...50 圖4.4 填充塔內滯留時間對去除效率圖...51 圖4.5 噴霧塔氣液比不同時 HCl 進口濃度對去除效率關係圖 ...52 圖4.6 不同噴霧 pH 值對 HCl 去除效率關係圖 ...53 圖4.7 不同噴霧 pH 下之滯留時間對去除效率關係圖...54 圖4.8 新式洗滌系統之去除效率改善圖...55 圖4.9 噴霧塔去除效率與新式洗滌系統去除效率之關係圖...56 圖4.10 填充塔內滯留時間對氣提效率關係圖...57 圖4.11 噴霧塔在 pH=7 時滯留時間對去除效率圖...58 圖4.12 噴霧塔在 pH=8 時滯留時間對去除效率圖...59 圖4.13 噴霧塔在 pH=10 時滯留時間對去除效率圖...60 圖4.14 填充塔滯留時間對去除效率與理論公式之比較...61 圖5.1 實場中安排裝噴霧系統示意圖...64
表目錄
表1.1 半導體製造業空氣污染管制及排放標準...3 表1.2 半導體製造業空氣污染管制及排放標準(續)...4 表2.1 Accommoation coefficient α ...15 表2.2 液滴吸收理論代號表...16 表3.1 在不同壓力下各型號噴嘴之流量(加倫/小時) ...31 表3.2 IC 操作條件表...32 表3.3 各離子之方法偵測極限...33 表3.4 多孔金屬片對各離子之回收率...34 表4.1 洗滌水中導電度與氯離子濃度關係...45 表4.2 新式洗滌系統之效率分析Ⅰ...46 表4.3 新式洗滌系統之效率分析Ⅱ...47第一章 前言
1.1 研究動機
國內高科技產業中以半體產業的產值最高,但其無機酸鹼廢氣排放量也相對 的最高。在半導體的製程的氧化、光罩、顯影、蝕刻等步驟中會使用到硫酸、硝 酸等許多的無機酸鹼,這些被大量使用的 HF、HCl、NH3及 H2SO4液體最後都 會產生大量的無機酸鹼廢氣,必須經由工廠的空氣污染防制設備處理後,才能排 入大氣中。若這些處理設備沒有辦法有效的去除無機酸鹼廢氣,則勢必會對週遭 的環境及居民健康產生重大的危害。 而我們身處的新竹科學工業園區為國內高科技產業之重鎮。園區內有 151 家基體電路廠、58 家電腦週邊、57 家通訊產業、59 家光電產業及 11 家精密機 械工廠與 26 家生物科技工廠(新竹科學園區網站,2004)。新竹工業園區內所有 相關半導體與光電產業的高科技廠總共約有70 家,而整個新竹地區約有超過 380 餘家的高科技工廠。隨著產能的增加,園區各產業所使用的化學原料、毒性化學 物質以及大量的有機溶劑更是與日俱增。為了能夠在產業發展與永續經營上尋求 平衡點,我們必須尋求一個解決污染的有效方法,才能使經濟發展不與環境生活 品質之提昇相衝突。 行政院環保署在民國八十八年公告了「半導體製造業空氣污染管制及排放標 準」(行政院環保署, 1999)如表 1.1,其中規範了各種無機酸如 HF、HCl 及 H2SO4 之去除效率須達到 95 %以上, 或是各酸性物種在每廠排放量必須小於 0.6 kg/hr (HNO3、H3PO4、HF、HCl)或 0.1 kg/hr (H2SO4)。若是無法達以上之標準時,則 需符合洗滌塔的操作條件,其中潤濕因子應大於0.1m2/hr、循環水 pH 值應大於 7、填充塔之滯留時間應大於 0.5 秒及填充物比表面積應大於 90 m2/m3等規定如 表1.2。在鹼性 NH3廢氣方面,雖然在「半導體製造業空氣污染管制及排放標準」 中並沒有明確的規定,但NH3是一種具有臭味之氣體,當濃度超過43 ppb~53 ppm 時(ACGIH, 1989),人類便可聞到臭味,此時便容易引起工廠附近居民的反感。 我們推測環保署在未來亦有可能針對 NH3 訂出一個類似酸性氣體之嚴格排放標 準,所以NH3廢氣之處理亦是未來重要的研究課題。 基於經濟考量,國內一般廠房主要是利用濕式洗滌設備來處理工廠所產生之 有機或無機化合物,但依據學者針對洗滌塔去除效率之研究(Tsai et al., 2004; 蔡,2002b;Tsai et al., 2003) ,發現洗滌塔對於 HF、HCl 及 NH3的去效率不佳, 往往無法達到法規規定的95 %去除率。例如圖 1.1 是洗滌塔對 HF 去除效率對進 口濃度之關係圖。由圖可知,當進口濃度低於650 g/m 3時去除效率大部都低於 70 %,且進口濃度愈低時去除效率愈低,對於 HCl 也有類似的研究結果。且因 成本考量,洗滌塔之循環水無法時常更換以維持一定的乾淨程度,造成當廢氣的 進口濃度低時,洗滌塔更是無法有效的去除廢氣。此為一般低濃度污染物排放的 工廠往往無法達到行政院環保署所規定之90%削減率的原因。 為解決這個問題,以達到提高濕式洗滌設備的污染物整體去除效率的目的, 本研究將設計並測試一個高效率的洗滌器系統,在原有的填充洗滌塔前加設的一 個噴霧塔,利用噴霧塔裝設之噴頭來產生極細水霧(梭特直徑在 20 至 40 µm 間)並藉由水霧的大比表面積及極佳的吸收效果,來處理傳統填充塔所無法去除的低 濃度無機酸鹼氣體或是將酸排中的鹼性氣體加以去除,以提昇洗滌系統的去除效 率。在去除的過程中,噴霧塔會使用的適當氣液比並應該所去除的氣體的酸鹼來 更改噴霧水所使用的pH 值,利用酸鹼中和的原理來增加此系統對無機酸鹼氣體 的去除效率。
1.2 研究目的
本研究之目的在於利用由噴霧塔及填充塔組合而成的新式洗滌系統來有效 的改善現行的填充塔設備對於半導製程中所排放的一些無機污染物(如 HF、 HCl、HBr、NH3 等)的去除效率,特是針對低濃度污染氣體的去除問題。在本 研究中將以HCl 做為污染物來進行研究。 在研究的方向上將會依循下列目標逐步研究、開發: (1) 污染物質傳理論之推導。 (2) 利用理論模式針對各參數條件進行模擬。 (3) 由模擬結果進行新式洗滌系統實驗設計。 (4) 研究現行填充塔去除效率特性。 (5) 針對噴霧塔在不同操作條件下之去除效率進行研究。 (6) 找出對於新式洗滌系統較佳的操作條件。表
1.1 半導體製造業空氣污染管制及排放標準
空氣污染物 排放標準 揮發性有機物 排放削減率應大於90%或工廠總排放量應<0.6 kg/hr (以甲烷為計算基準) 三氯乙烯 排放削減率應大於90%或工廠總排放量應<0.02 kg/hr 硝酸、鹽酸、磷酸及氫氟酸 各污染物排放削減率應大於95%或各污染物工廠 總排放量應<0.6 kg/hr 硫酸 排放削減率應大於95%或工廠總排放量應<0.1 kg/hr表
1.2 半導體製造業空氣污染管制及排放標準(續)
控制條件 法規標準 潤濕因數(m2/hr): 洗滌循環水量/(填充物比表面積×洗滌塔填充段水準 截面積) > 0.1 設備洗滌循環水槽之pH 值 > 7 填 充 物 比 表 面 積 (m2/m3) : 濕式洗滌設備之填充物單位體積內所能提供之氣液接 觸面積。 > 90 填充段空塔滯留時間(sec) > 0.5 註: 1. 若廠方無法證明符合上述規定時,需提出其他可證明同等處理效果或較優之 控制條件向中央主管機關申請認可者。 2. 上述規範適用於硝酸、鹽酸、磷酸、氫氟酸及硫酸等廢氣若以濕式洗滌設備 處理,而廠方無法證明符合表2(a)中的規範時。0 1000 2000 3000 4000 5000
Inlet concentration (µg m
-3)
0 20 40 60 80 100Re
mo
val
e
fficiency, %
mearsured data regression line圖 1.1 實場中 HCl 氣體去除效率對進口濃度之關係圖(黃, 2003)
第二章 文獻回顧
2.1 噴霧塔相關研究
對於噴霧塔的部份,已有學者做過許多研究,其中欲處理的污染物以NOx、
SOx、 VOC 等為主,對於低濃度的酸鹼廢氣的處理則甚少著墨。Chien and Chu
(2000)曾使用 NaClO2 和 NaOH 來當作吸收劑,利用噴霧加上多孔板(spraying
sieve tray wet scrubber)的方法同時去除 SOx和NOx,結果發現最大的DeNOx去
除效率在36.6 至 71.9 %之間,而最大的 DeSOx的去除效率在89.4 至 100.0 % 之間。以DeNOx而言,此系統的測試參數為NOx之進氣濃度-300 及 800 ppm, L/G 比為 5 或 10 (l/m3),平均的水滴直徑 595 至 1085 µm 之間。研究發現影響 去除效率的重要操作參數有添加劑的濃度、氣液比及滯留時間。Vinci et al., (1997) 曾利用噴霧塔來控制出流液體的溶氧量(DO),結果發現噴霧塔的塔高及氧氣的 供給為改變 DO 的重要影響因素,且噴霧塔的出口液體的溶氧比填充塔低。 Santacesaria et al., (1999) 以數值模擬方法研究偱環式噴霧塔吸收乙烯的氧化物 (ethylene oxide)的過程,從理論值與實驗值比較的結果得知噴出之液滴內部並非 靜止的,而是呈現紊流混合的情形。Chen(2001)也曾模擬過以終端沉降速度下落 的雨滴吸收 SO2酸氣的過程,結果發現雨滴內部亦有環流產生,且當有液滴有 內部環流時會增加質傳速率。 針對上述有關噴霧塔的相關研究文獻,我們得知噴霧系統對於氣體的吸收效果 可以優於傳統式的填充塔設備。我們發現氣液比、滯留時間和添加物的濃度均 為控制噴霧效率的重要操作因素,且過去的研究所使用的液滴較大,直徑數佰 微米為主,在高科技業的用水量受限的情況下,本研究要朝向小粒徑的水霧(20 至40 µm 梭特直徑),低氣液比的方向作設計,並以基本的質傳理論作基礎,以 期得到最佳的去除效率的要求。
2.2 填充塔之設計理論
為了探討低濃度污染氣體在傳統填充洗滌塔的去除效率低的問題,我們首先 回顧傳統洗滌塔的設計理論。 填充塔去除氣體污染物的原理係基於氣體吸收理論,藉著填充塔內之填充物 潤濕表面,達到污染物由氣相傳輸到液相的吸收過程。此吸收作用通常以雙膜理 論(two-film theory)(Cooper and Alley, 1998)來計算通過液-氣介面的污染物的傳輸速率。由圖2.1 之雙膜理論我們可得知污染物在氣相之通量等於液相中之通量,
) ( ) (y y k x x kG − i = L i − (2.1.1) 式中kG為氣相質傳係數,單位為s m2 mole ⋅ ; y 為氣體中污染物的莫耳分率,單位 為mole mole ;yi為氣液膜交界面上氣相污染物的莫耳分率,單位為mole mole ;kL為液相質 傳係數,單位為s m2 mole ⋅ ;xi為氣液膜交界面上液相污染物的莫耳分率,單位為mole mole ; x為污染物在洗滌水中之莫耳分率,單位為mole mole 。
以下的填充塔設計理論參考Cooper and Alley(1998)一書。在圖 2.2 填充塔的
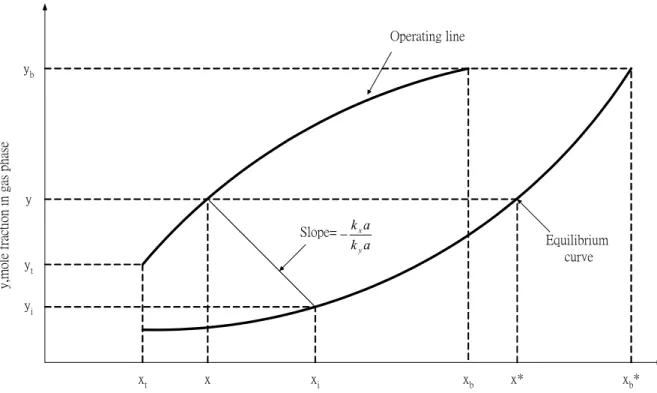
設計示意圖中,通常我們可以預知填充塔底部氣體的莫耳流率 VMb,以及底部 和頂端的氣體污染物莫耳分率yb 和 yt 和洗滌水裡污染物莫耳分率 x,x 取決於 洗滌水的循環流率。洗滌水的循環流率通常為最小循環流率的1.5~3.0 倍,為了 計算最小循環流率我們先畫出平衡曲線及填充塔底部和頂端的操作點,如圖2.3。 考慮從填充塔底端至塔裡任何一點作質量平衡,我們可以得到下式: Lmx+Vmbyb =Lmbxb+Vmy (2.1.2) m L 為洗滌水的莫耳流率,單位為 s mole ;V 為填充塔底部氣體莫耳流率,單位mb 為 s mole ;y 為填充塔底部氣體污染物的莫耳分率,單位為b mole mole ;L 為填充塔mb 底部洗滌水的莫耳流率,單位為 s mole ;x 為填充塔底部洗滌水裡污染物的莫耳b 分率,單位為 mole mole ;V 為氣體的莫耳流率,單位為m s mole 。 現在我們假設L' 和m V ' 分別為在洗滌水及氣體中不含污染物時的莫耳流m 率,則我們可以得到以下式子: y V V m m = − 1 ' and x L L m m = − 1 ' (2.1.3) b m mb y V V − = 1 ' and b mb x m L L − = 1 ' (2.1.4) 把(2.1.3)式和(2.1.4)式代入(2.1.2)式,整理後得到 )] 1 ( ' ' 1 [ ) 1 ( ' ' 1 b b m m b b m m x x V L y y x x V L y y − − − + − = − (2.1.5) 由(2.1.5)式可畫出填充塔的操作曲線(Operating line),此曲線表示塔裡各 點污染物在洗滌水及氣體中的莫耳分率比率,把填充塔頂端的操作點(xt,yt)連 接至平衡曲線中填充塔底端的濃度點(xb*,yb),此直線的斜率代表操作的最小液
氣比 ) ' ' ( min m m V L ,只要我們知道氣體流率就可以輕易求得最小液體循環流率。 為了表現液體和氣體在單位面積下界面的傳送速率,可用下式來表示: d(Vmy)=ky(y−yi)dA=d(Lmx)=kx(xi −x)dA (2.1.6) A 為垂直擴散方向之擴散面積,單位為 m2,擴散面積可再利用下式轉換: dA=aSdZ (2.1.7) a為填充塔裡單位體積之有效質傳面積,單位為 3 2 m m ;S 為填充塔的截面積, 單位為m ;2 dZ為填充塔之一小段塔高,單位為m。 把(2.1.7)式代入(2.1.6)式並且把d(Vmy)以 dy y Vm − 1 表示,整理後得到氣膜及液 膜的平衡方程式: y dy S V dZ y y a k m i y − = − 1 ) ( (2.1.8) x dx S Lm dZ x x a kx i − = − 1 ) ( (2.1.9) 要得到填充塔塔高ZT,必須把(2.1.8)式或(2.1.9)式作積分。我們先建立各點 濃度(x,y)和界面濃度(xi,yi)的關係,由(2.1.6)式可得到 a k a k x x y y y x i i =− − − (2.1.10) 從(2.1.10)式得知操作曲線上點(x,y)連接到平衡曲線上點(xi,yi)為一條直線且 斜率為 a k a k y x − ,整理(2.1.8)式得到
∫
∫
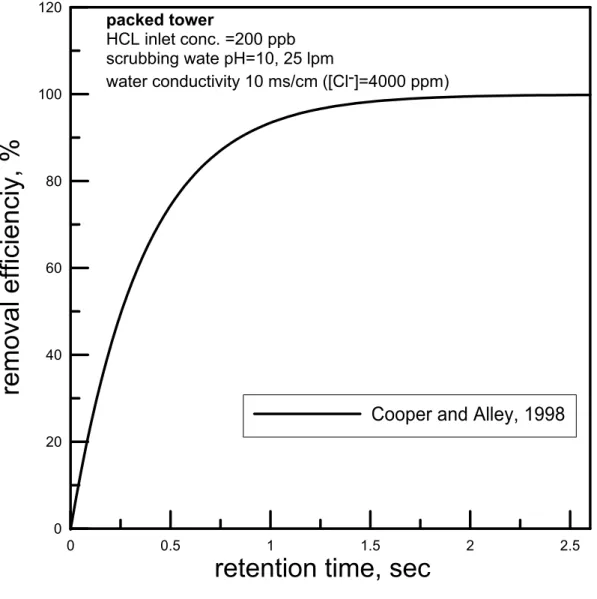
− − = = b t T y y i Z my y T my y y y y dy G a k Z dZ G a k ) )( 1 ( ) ( ) ( 0 (2.1.11) 上式 S V G m my = ,為塔中單位面積氣體莫耳流率,單位為s m2 mole ⋅ 。 要得到填充塔高ZT則必須將(2.1.11)式作積分,但 yi為氣液膜交界面上氣相 污染物的莫耳分率不易由實驗值得到,為了得到ZT我們在圖2.3 中從 yt到yb之 間畫數個斜率為 a k a k y x − 的平行線,再利用(10)式得到(x,y)和其對應的(xi,yi)值,計 算出 ) 1 )( 1 ( 1 i y y − − 的值,畫(1 )(1 ) 1 i y y − − 對y 作圖如圖 2.4,可以計算出曲線下面 積(Area),則塔高 ZT如下。 a k Area G Z y my T = (2.1.12)由(2.1.12)式所得之塔高經由換算可得通過填充塔之滯留時間,便可畫出填充塔 滯留時間對去除效率之關係,如圖2.5。由圖中可知,當我們所需要的去除效率 愈高時,所需要的滯留時間亦愈長。
2.3 液滴吸理論
液滴吸收空氣中的氣狀汙染物有幾個步驟:1.污染物分子由氣相擴散至氣液 介面,2.污染物分子通過氣液交界面進入液滴內部,3.污染物分子在液滴內部解 離、擴散、進行化學反應。因此在計算質傳通量時,需考慮以下四點對於質傳量 的影響:1.污染物分子在氣相中的擴散速率,2.真正通過氣液介面的分子比率, 3.分子在液相中的擴散速率,4.分子和水作用解離或進行化學反應使液滴中污染 物濃度變化。 傳統上在計算質傳通量時,均假設所有接觸到氣液介面的氣狀污染物分子皆 能通過氣液介面進入液滴中,並假設污染物在液滴中的解離及化學反應能很快達 到平衡狀態,如前述的雙膜理論即是基於這種假設。然而並非所有接觸到氣液介 面的分子皆會通過介面而進入液滴內部,所以當我們在計算質傳通量時,必須考 慮到真正會進入液滴內部的分子的比率。現在我們將以分子運動的觀點來推導質 傳通量,並考慮到所有限制質傳速率的因素。2.3.1 污染物質傳公式之推導
氣體分子在三維隨機運動中,單位時間、單位面積會碰撞到氣液介面的分子數目 為 1 4N cA A ,其中NA表示污染物A 的莫耳濃度,單位為 3 mole m ;c 是污染物的分A子平均運動速度,單位為ms,可計算如下(Seinfeld and Pandis, 1998, pp 600-601):
A 8 A RT c m π = (2.2.1) 其中mA為汙染物 A 的分子量,單位為kgmole;R 為理想氣體常數,單位為 atm mole K ⋅ ⋅ A ;T 為氣體溫度,單位為K 。若是考慮真正會通過介面進入液滴的 分子比率,分子的氣相、液相擴散速率,分子在液滴中與水作用、解離、反應等 因素,則實際的質傳通量可表示為(Worsnop et al., 1989):
1 4 A A A J = N c γ (2.2.2) 上式中之γ 是攝入係數(uptake coefficient),其值≦1.0,它的計算過程將於稍後 再加以說明。另外,理想氣體方程式為: A A A n P RT N RT V = = (2.2.3) 其中PA為 A 在氣相中之分壓,單位為 atm;V 是環境氣體的體積,單位為 m3。 將理想氣體方程式中的PA與NA的關係代入(2.2.2)式中,則可得到污染物種 A 從 氣相進入液相的莫耳通量如下: 1 1000 4 A A A P J c RT γ + = × (2.2.4) 污染物 A 在氣液介面上由液滴表面返回氣相的莫耳通量可由亨利定律得出 如下: * aq A A C =H P (2.2.5) 上式中之H 為污染物 A 的有效亨利係數,單位為 M atm。將(2.2.5)式代入(2.2.3)A* 式再將所得之結果代入(2.2.2)式,則可得到從液滴表面返回氣相的莫耳通量為: 1 * 1000 4 aq A A A C J c H RT γ − = × (2.2.6) 所以,污染物A 真正進入液滴中的淨莫耳通量為(2.2.4)式與(2.2.6)式之差,亦即: * 1000 4 aq A A A A C c J P RT H γ = − × (2.2.7)
2.3.2 攝入係數(uptake coefficient)
計算質傳通量時,在大多數的情形下我們比須同時考慮氣體的擴散速率、通過氣液介面進入液相的分子比率、及液相的擴散和反應。公式(2.2.2)的攝入
係數 γ(≦1)即是為了考慮這些因素對於質傳通量的影響,其推導過程如下
(Seinfeld and Pandis, 1998, pp 627-634):
污染物 A 在氣液介面上的傳輸速率Raq f, ( M s ),可由下式表示: aq f, mt A s A C R k P H = − (2.2.8) 其中C 為 A 在介面上的液相濃度,單位為 M;s HA為亨利係數,單位為 M atm; 1 2 2 12 6 A mt g D m RT D RT k D π α − = + ,單位為 M atm s⋅ ;D 為液滴直徑,單位為 m;Dg 為 A 的氣相擴散係數,單位為m2s 。α 為調和係數(mass accommodation coefficient),其物理意義為分子碰撞到氣液介面後會真正進入液滴的數目比 率,目前已有許多學者曾做過研究來求得各污染物種被水溶液吸收的α 值。 當污染物通過氣液介面後,A 在液相中的擴散與反應速率Raq l, ( M s ), 可由下式導出: Raq l, =QkCs (2.2.9) 其中 k 為反應速率常數,單位為 1s 。(2.2.9)式中的Q 3 cothq 12 q q = − ,且 2 aq D k q D = ,D 為污染物 A 的液相擴散係數,單位為aq m2s 。Q 與 q 皆為無因 次參數。 在穩定狀態(steady state)下,A 在氣液介面的傳輸速率必須等於 A 在液相中 的擴散及反應速率,即(2.2.8)式與(2.2.9)式相等,藉此可以求得Cs如下: 6 mt A s aq mt A k P C kD k H D = + (2.2.10) 在ㄧ般情形下,q 遠大於 1,則Q≅ 3q,且A 在氣液介面上的傳輸通量會等於(2.2.2) 式所計算出來之傳輸通量:
(
)
3 2 3 1 6 4 s A A kC D P c D q RT π γ π = (2.2.11)將(2.2.10)式代入(2.2.11)式,則可求出攝入係數γ 如下: 1 1 8 4 A A g A aq Dc c D RTH kD γ α − = + + (2.2.12) 由(2.2.12)式計算出 γ 之後,即可求得污染物 A 在氣液介面的質傳通量。然 而在計算 γ 的過程中,我們必須先知道各物種之 α 值才行。目前已有許多學者 以實驗推測出 α 或 γ 值,如表2.1 所示。
2.3.3 有效亨利係數
亨利係數是指污染物在液滴中以分子狀態存在,且與周圍氣體的污染物分壓 達平衡時的吸收平衡係數。而在(2.2.5)式中的有效亨利係數,是考慮了污染物被 液滴吸收以後會在液滴中解離,進而增加污染物的吸收量所得到的吸收平衡係 數。當氣體污染物被液滴吸收,是先以分子態結合水分子存在於液滴中,有時候 會再解離為離子態,因此我們必須修正亨利定律,以期能得到更精確的關係式。 現以 HNO3為例,說明如下: HNO3被吸收至液滴中,再解離為硝酸根離子與氫離子的過程為: HNO3+H O2 ⇔HNO H O3⋅ 2[
]
3 3 3 2 HNO HNO HNO H O⋅ =H P (2.2.13) HNO H O3⋅ 2 ⇔NO3−+H+[
3]
1 3 2 n NO H K HNO H O − + = ⋅ (2.2.14) 上二式中, 3 HNO H 為亨利係數,單位為 M atm ;K 為平衡常數,單位為 M。n1 所有被溶解在水中的硝酸為: HNO3T=[
HNO H O3⋅ 2]
NO3− + (2.2.15) 將(2.2.13)式與(2.2.14)式代入(2.2.15)式,我們得到 3 1 3 * 3 3 3 1 T nHNO HNO HNO HNO
K HNO H P H P H+ = + = 所以我們可求得有效亨利係數 3 * HNO H 為: * 3 3 1 n1 HNO HNO K H H H+ = + (2.2.16)
同理可得其他物種的有效亨利係數為 * 3 3 1 n1 NH NH w K H H H K + = + (2.2.17) * 1 n1 HCl HCl K H H H+ = + (2.2.18) 既然液滴能吸收的污染物的量與有效亨利係數有關,而氫離子的濃度又能決 定有效亨利係數的大小,因此,液滴的pH 值將會是影響噴霧系統的吸收效率的 因素之ㄧ。
2.4 噴霧塔吸收效率理論
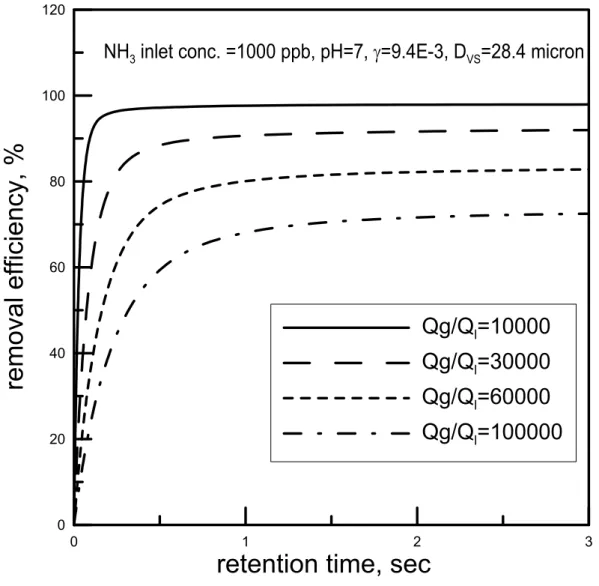
當我們將水霧加進洗滌塔內上端,水霧由塔頂噴出與污染氣體混合而落下, 污染物氣體自空氣中傳輸至單顆液滴表面的質傳通量如式(2.2.7)所示。由於水霧 的粒徑很小,在塔內幾乎是順著氣流在移動,故可視為一靜止(無相對速度)之水 滴,而由某粒徑 D 之液滴表面傳入之污染物量會等於液滴內部的污染物的改變 量,亦即 1000 6 1 3 2 = × ⋅ dt dC D D JA π π aq (2.3.1) 其中D : 水滴直徑(m) 再將式(2.2.7)與式(2.3.1)合併就可得到塔中水滴內污染物濃度對時間之關係式如 下: γ ⋅ − = * 2 3 H C P DRT C dt dC aq g A aq (2.3.2) 水滴所吸收的污染物的量等於空氣中減少的污染物的量,藉此我們可以求得噴霧 塔內污染物氣體之濃度對時間變化之關係式。在實際情況下,塔中的細水霧是由 不同粒徑所組成,而氣相中污染物的濃度改變亦是由不同粒徑之水霧共同吸收所 造成之結果。所以污染物氣體濃度對時間的關係可以寫成:∑
⋅
−
∆
−
=
i aq g A i i i gH
C
P
C
D
D
D
n
dt
dP
γ
π
2 *)
(
4
1
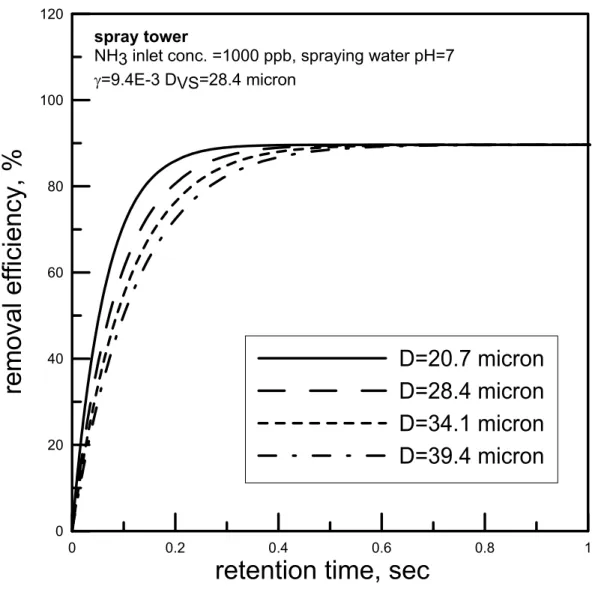
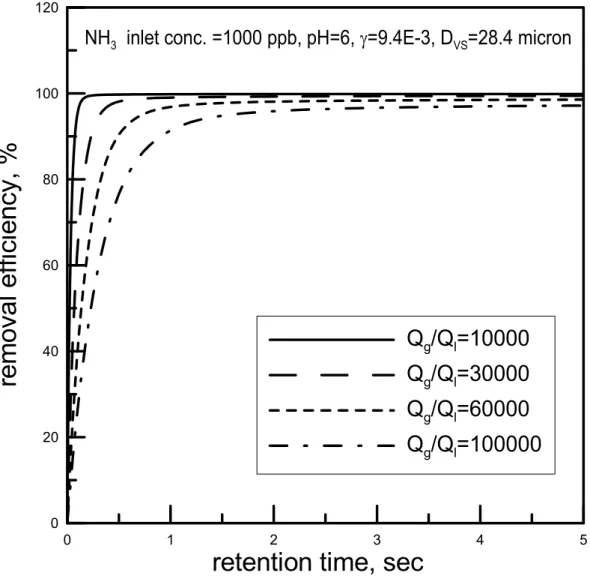
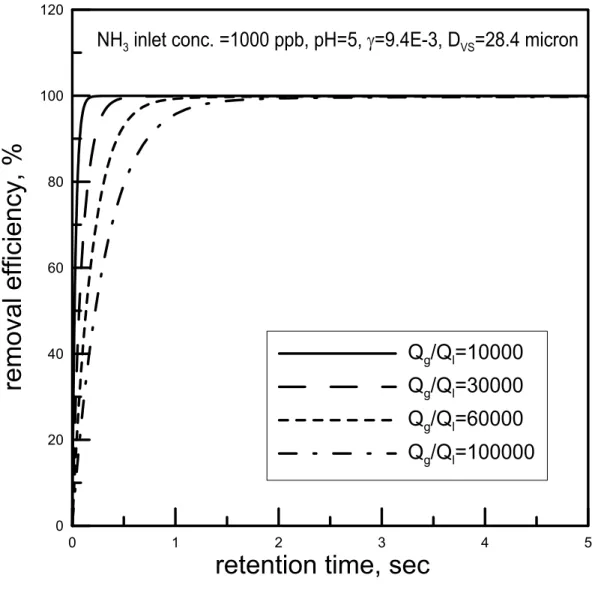
(2.3.3) 其中n(Di)∆Di為粒徑Di之水滴數目濃度(#/m3)。 在以下的初步計算結果中,我們以Hago 公司 M 型號(M1~M10)的不同噴頭 (水霧梭特直徑在 20.7~39.4 µm 之間),利用公式(2.3.2)、(2.3.3)模擬 NH3污染物 的去除效率對時間的關係在氣液比為30000、pH 值為 7 且 γ 依照式(2.2.12)計算 為9.4×103的情況下的關係圖,如圖2.6 所示。由圖可發現,在同一氣比(30000)之下,梭特直徑為 39.4 µm 之水霧欲達到吸 收效率約90 %所需吸收時間為 0.4 sec,而梭特直徑為 20.7 µm 之水霧約只需 0.2 sec 的時間。可見當噴頭的梭特直徑(Sauter diameter)愈小時,水滴之數目愈多表 面積也愈大,對於污染物之吸收速度會愈快。因此水霧直徑之大小會明顯的影響 水霧吸收污染的速率。 為了繼續了解氣液比及水滴 pH 對效率的影響,我們選擇水霧粒徑較小的 M1 型號噴頭(噴霧壓力為 100 psi 時 D=28.4 µm)來做計算。當改變氣液比進行模 擬時,可得吸收效率圖,如圖 4.6。我們可以發現到其氣液比在 100,000 時,可 在2 秒後達到吸收飽和且吸收效率只有約 70%,而在氣液比在 10,000 的時候則 只需要將近一秒的時間就能達到飽和且效率可達到約97%。由此可知,氣液比為 影響吸收效率之重要因素之一。 pH 值之影響 由圖2.7 中可知,當 pH=7 時水霧對於鹼性氣體的吸效果在氣液比為 100000 時並不十分理想,必需把氣液比往下降到30000 左右才能有好的吸收效果。在氣 液比為100000 時,經過約 1 秒左右的吸收時間後,液滴內污染物濃度會較容易 達到吸收平衡,此時污染物進入液滴的通量等於污染物由液滴返回外界氣體的通 量,液滴即不再具有吸收作用。 但若我們在噴霧水中加入酸,將pH 值降低到 6 或 5,則平衡時的效率可以 獲得提升,如圖 2.8、2.9 所示。我們比較圖 2.7 到 2.9 可發現當加入酸降低 pH 值時,液滴所能吸收的污染物也相對的增加。如圖 2.7 中 pH 值等於 7、氣液比 為60000 時,約在 80 %便達到飽和,而在圖 2.9 中 pH 值為 5、氣液比亦為 60000 時,則吸收效率可達到約100 %。且在 pH 值小於 7 的情況下當滯留時間大於 1 秒時,氣液比大小對於吸收效率的影響並不是很顯著。因此適當控制細水霧的 pH 值可以節省本洗滌系統的需水量,降低操作成本。 綜合上述的理論模擬可知,在短滯留時間下(< 1 sec),氣液比為影響吸收效 率的重要因素,而在較長滯留時間下,則液滴的pH 值會嚴重的影響吸收的效率。 我們若要提高塔內之污染物去除效率,可以朝向(1)較小的水霧粒徑 (2)較小的氣 液比 (3)較長的滯留時間且利用酸、鹼吸收的原理來增加去除效率。所以在本研 究的洗滌系統中我們所設計的參數如下:(1)噴頭選用 Hago M1 型號,噴霧壓力 為100 psi,梭特直徑 Dvs=28.4~39.6 µm (2)氣液比--10000~60000(m3/m3) 之間 (3) 滯留時間--0.5~2.5 秒 (4)水霧 pH 值--5~7(針對鹼性 NH3)或 7~10(針對酸性 HCl、 HF)。 以上的模擬僅針對鹼性 NH3 氣體,若是相同的理論應用在酸性氣體時,應 該會得到類似的結論(在去除酸性氣體時,pH 值須大於 7)。在本研究中主要以 HCl 為模擬污染物,但是因為 HCl 的理論模擬效果太過理想,使得各條件下的去 除效率差距非不明顯,故先使用 NH3 氣體來模擬做為趨勢的探討。然而這些推 論尚待後續的理論的改進及實驗的驗證。
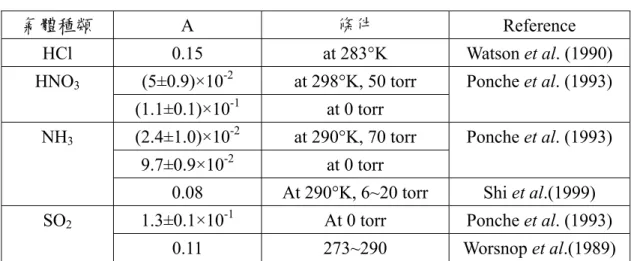
表
2.1 Accommoation coefficient α
氣體種類 Α 條件 Reference HCl 0.15 at 283°K Watson et al. (1990) (5±0.9)×10-2 at 298°K, 50 torr HNO3 (1.1±0.1)×10-1 at 0 torr Ponche et al. (1993) (2.4±1.0)×10-2 at 290°K, 70 torr 9.7±0.9×10-2 at 0 torr Ponche et al. (1993) NH30.08 At 290°K, 6~20 torr Shi et al.(1999) 1.3±0.1×10-1 At 0 torr Ponche et al. (1993) SO2
表
2.2 液滴吸收理論代號表
代號 物理意義 單位 A J 莫耳通量 2 mole m s⋅ G k 氣相質傳系數 m s * G k * G G k k = RT molem s Pa2⋅ ⋅ U 液滴速度 m s L k 液相質傳系數 m s 0 p 污染物在氣體的氣相分壓 Atm s p 污染物在液滴表面的氣相分壓 Atm s C 污染物在液滴表面的液相濃度 mole l aq C 污染物在液滴內部的濃度 molel A H 有效亨利係數 mole atm ⋅ A p R 液滴半徑 M p D 液滴直徑 M A c 分子平均運動速度 ms R 理想氣體常數 3 o atm m mole k ⋅ ⋅ T 絕對溫度 °kk corresponding rate constant
Dg 污染物的氣相擴散係數 m2/s Daq 污染物的液相擴散常數 m2/s A n 污染物分子的數目濃度 3 mole m A m 污染物的分子量 G
Bulk gas xi x Bulk liquid interface Gas film Liquid film y yi
圖
2.1 雙膜理論圖
Z T Lmt xt Lmb xb Vmb yb dZ 液體分配器 Vm y Lm x Vmt yt
圖
2.2 填充塔設計示意圖
x y xi yi xt yt xb yb x* xb* Operating line Slope= a k a k y x − Equilibrium curve
x,mole fraction in liquid phase
y, m ol e fra ction in gas phase
圖
2.3 填充塔內各點吸收濃度示意圖
1/[(1-y)(y-y
i)]
Area
y
ty
by
圖
2.4
) 1 )( 1 ( 1 i y y − −對
y 關係圖
0 0.5 1 1.5 2 2.5
retention time, sec
0 20 40 60 80 100 120
removal e
fficienciy, %
Cooper and Alley, 1998
packed tower
HCL inlet conc. =200 ppb scrubbing wate pH=10, 25 lpm
water conductivity 10 ms/cm ([Cl-]=4000 ppm)
0 0.2 0.4 0.6 0.8 1
retention time, sec
0 20 40 60 80 100 120
rem
ov
al
ef
fic
ienc
y,
%
D=20.7 micron
D=28.4 micron
D=34.1 micron
D=39.4 micron
spray towerNH3 inlet conc. =1000 ppb, spraying water pH=7 γ=9.4E-3 DVS=28.4 micron
0 1 2 3
retention time, sec
0 20 40 60 80 100 120
removal efficiency, %
Qg/Q
l=10000
Qg/Q
l=30000
Qg/Q
l=60000
Qg/Q
l=100000
NH
3inlet conc. =1000 ppb, pH=7, γ=9.4E-3, D
VS=28.4 micron
0 1 2 3 4 5
retention time, sec
0 20 40 60 80 100 120
rem
oval
ef
fici
en
cy
, %
Q
g/Q
l=10000
Q
g/Q
l=30000
Q
g/Q
l=60000
Q
g/Q
l=100000
NH
3inlet conc. =1000 ppb, pH=6, γ=9.4E-3, D
VS=28.4 micron
0 1 2 3 4 5
retention time, sec
0 20 40 60 80 100 120
removal efficiency, %
Q
g/Q
l=10000
Q
g/Q
l=30000
Q
g/Q
l=60000
Q
g/Q
l=100000
NH
3inlet conc. =1000 ppb, pH=5, γ=9.4E-3, D
VS=28.4 micron
第三章 研究方法
3.1 實驗設備
本研究所使用之實驗系統如下圖 3.1 所示。在氣體的供應方面,我們使用
一個可變頻控制之風車來產生0.6~8 m3/min 的氣體量。此氣體量可由風車出口
所接的層流流量計(Laminar flow element, Meriam Instrument, Model 50MC2-8) 藉由量測進出口之壓差值而換算得到氣體的流量。乾淨空氣混合了由曝氣瓶所 產生的污染物即形成模擬的煙道廢氣。
在我們的實驗模廠中,本洗滌系統的噴霧塔及填充塔之內徑為35 cm,在
上半部為長度一公尺的透明噴霧塔,噴霧塔上端裝設了一隻噴管,噴管可以依 實驗需求來裝設1~8 個 Hago (New Jersey, U.S.)廠牌之 M 型號噴頭,並可以依 實驗需要更換噴頭來產生粒徑為28.4~55.8 µm 之水霧;在下半部為長度 60 cm 的填充塔,內填充有比表面積為155 m2/m3之填充物。 我們在整個系統中設有三個採樣點,分在噴霧塔前之風管、洗滌塔上端及 出口處。若此三個位置採得的污染物濃度分別為c1、c2、c3,則噴霧段效率為: 1 2 1 c c spray = − η (3.1.1) 填充段效率為: 2 3 1 c c packed = − η (3.1.2) 而整體的去除效率為 1 3 1 c c total = − η (3.1.3) 而在噴霧的產生部分,為了達到水霧均勻分配在管子截面的目的,噴嘴位 置經過仔細的安排,我們在管子截面上插入一根噴管,在不同角度上分別設計 了八個噴頭的位置以使水霧能均勻的分部整個截面,如圖3.2 所示。
3.2 氣液比參數計算
A. 假設風速等於 1 m/sec 廢氣流量為03.5×0.35×π×0.25=0.096 m3/sec=5772.6 lpm 依HAGO 之手冊所述如表 3.1 假設選用M1 nozzle 在 100 psi 下流量為 1.00 gal/hr=63 ml/min= 0.063 lpm假設選用M2 nozzle 在 100 psi 下流量為 2.00 gal/hr=0.126 ml/min=1.26×10-4 m3/min
B. 若 Qg/Ql = 20000,廢氣流速 V = 1 m/sec,噴霧區長 L = 1 m,因此廢氣在 管中滯留時間為 1 秒。為效率考量使用噴霧粒徑較小的 M1 噴頭。假設 M1 噴嘴數共有 n 個: 30000 ) 063 . 0 ( 6 . 5772 = × n n = 5 個噴頭(至少) C. 水霧蒸發量的計算 塔中氣體的流量為5.77 CMM,而空氣在 23°C 相對溼度 45%時之絕對溼度 為0.0078,而經由絕熱增溼至飽和時之絕對溼度為 0.0108。 故將塔中氣體增溼至飽和所需要的水量為: min) / ( 02078 . 0 ) / )( 0078 . 0 0108 . 0 ( ) / ( 2 . 1 min) / ( 77 .
5 m3 × Kg m3 × − kgwater kgair = kgwater
此值小於a 步驟所計算之 M1 噴頭流量。所以要達到飽和蒸氣壓所需要的 水量,多加1 個 M1 噴頭應是足夠的。 由以上計算可知,在進口風量為5.77 CMM、氣液比為 20000 下且噴霧粒徑 為M1 型號的 28.4μm 等操作條件下,我們需要 6 顆噴頭,而我們的噴霧塔是設 計為可以安裝1~8 個噴頭,是可以涵蓋這個範圍的。
3.3 操作步驟
(1) 調整實驗設備至所需求的操作條件(噴頭數、水質導電度、pH 值、確 定曝氣瓶內容量) (2) 安裝採樣器 (3) 由控制盤上打開噴霧泵及循環水泵 (4) 將風車打開由變頻器及 LEF 之壓差讀值換算所需的風量 (5) 調整噴霧水量及循環水量 (6) 打開曝氣泵使污染物進入風管 (7) 開始採樣3.4 採樣方法及步驟
3.4.1 採樣器介紹
本計畫使用如圖 3.3 所示的多孔金屬固氣分離器進行酸鹼氣體及微粒的採 樣,採樣流量為2.0 lpm,採樣時間為 30 分鐘。微粒先由前端的鐵氟龍濾紙採集 後進行萃取,再以離子層析儀分析微粒化學成分,酸鹼氣體則由後端的多孔金屬 片採集。 本固氣分離器的多孔金屬片的採樣效率與採樣容量, 曾在實驗室中利用如 圖 3.4 所 示 的 糸 統 進 行 實 驗 , 並 與 環 保 署 檢 驗 所 的 標 準 檢 驗 方 法 NIEA A435.70C(矽膠法)與 NIEA A430.10C(吸收瓶法)相比較,測試結果如圖 3.5 所示, 發現本多孔金屬片的固氣分離器的採樣效率及容量均優於環檢所的標準方法。當 塗敷3%與 5% Na2CO3 且測試濃度為2 PEL 時,時,多孔金屬片對 HNO3的破出 時間分別為3.35 hr 與 3.58 hr,吸附容量分別為 4.18 mg 與 4.47 mg; 多孔金屬片 對HCl 的破出時間分別為 3.5 hr 與 4 hr,吸附容量分別為 6.3 mg 與 7.2 mg; 多孔 金屬片對HF 的破出時間均為 4 hr,吸附容量均為 0.096 mg。 塗敷 2%與 4% citric acid 時,則多孔金屬片對NH3的破出時間為2.9 hr 與 4 hr,吸附容量分別為 24.36 mg 與 33.6 mg。3.4.2 採樣準備工作
多孔金屬片的清洗 多孔金屬片為可以重複使用之採樣介質,因此實驗前必需要先將多孔金屬片 徹底清洗乾淨。將多孔金屬片置入血清瓶中,加入去離子水,並用真空泵浦將內 部抽真空至0.2 atm,同時把血清瓶置入超音波振盪器中震盪 15 分鐘,然後再更 換乾淨的去離子水,如此反覆更換去離子水清洗8 ~ 10 次後,再萃取經由 IC 檢 測無殘留後才算清洗完成。 採樣器的清洗 將採樣器置於含清潔液的清水中,以超音波震盪器震盪30 分鐘後,用清水 將採樣器沖洗乾淨直到沒有清潔液殘留為止。再將採樣器以去離子水震盪清洗 25 分鐘,反覆更換去離子水後共 4 次震盪,然後將採樣器置於 45 ℃的烘箱烘乾。 多孔金屬片塗敷藥劑的配製 酸氣吸收劑:將約30 mL 的去離子水倒入 100mL 的定量瓶中,加入 5g 碳 酸鈉(Na2CO3,Sodium Carbonate)以及 3.9 mL 甘油(C3H8O3,Glycerin 99 %),再倒入去離子水至標示100 mL 的刻度為止,配製成濃度為 5 %之碳酸鈉溶液,再 利用超音波震盪器震盪至完全溶解。 氨氣吸收劑:將約30 mL 甲醇(Methanol)倒入 100 mL 的定量瓶中,加入 4 g 檸檬酸(Citric Acid),再倒入甲醇直至標示 100 mL 的刻度為止,配製成濃度為 4 % 之檸檬酸溶液,再利用超音波震盪器震盪至完全溶解。 多孔金屬片的塗敷 針對酸性氣體的採樣,多孔金屬片以5 %之碳酸鈉溶液做塗敷;針對氨氣的
採樣,則以4 %之檸檬酸溶液做塗敷。將乾淨的多孔金屬片放入盛有塗敷溶液的 血清瓶中,並將血清瓶內部用真空幫浦抽至壓力 0.2 atm,同時以超音波水浴振 盪器震盪25 分鐘。當振盪時間一到,立刻取出多孔金屬片,以金屬夾持圓環將 其固定並置入特殊採樣器內。將該採樣器銜接在充滿氮氣的密閉箱內之岐管 (Manifold)上,用氮氣吹乾(約 10 分鐘),然後馬上將金屬片置入採樣器中,並以 封口膜密封保存。 採樣幫浦流量的校正 使用泡沫流量計時,先加入適量專用清潔劑後,再連接管線。因管線為抽氣 狀態,故將管線連到流量計上方的接口,再啟動抽氣泵浦。然後再依照泡沫流量 計之讀值,調整抽氣泵浦進行流量的校正。
3.4.3 樣品的萃取
當採樣結束返回實驗室後,立刻拆解採樣器,取出多孔金屬片進行萃取。本 實驗以去離子水當作萃取液,將多孔金屬片置入血清瓶中,加入 15 mL 的去離 子水,再將血清瓶內部抽真空至0.2 atm,以超音波水浴振盪器震盪 25 分鐘,再 將此萃取液放入樣品罐中,置於4 ℃的冰箱中保存。萃取時間為 25 分鐘,萃取 完畢後同樣置於4 ℃的冰箱中保存。3.4.4 樣品的分析
研究中利用離子層析儀(IC)分析樣品濃度,分析對象包括 F-、Cl-、NO2-、Br-、 NO3-、PO43-、SO42-等陰離子與NH4+陽離子。分析儀器使用Dionex 公司 Model 120之離子層析儀,其陰離子層析管柱為IonPac AS12A,陽離子層析管柱為 IonPac
CS12。F-、Cl-、NO
2 -、Br-、NO3-、PO43-、SO42-等陰離子停留時間為依序為2.03、
3.35、4.13、6.48、7.58、8.83 及 10.85 分鐘,NH4+陽離子的停留時間則為 4.78 分鐘,陰陽離子操作狀況如表3.2 所示。樣品分析時,需配置各離子的檢量線, 以校正層析儀及定量樣品之濃度,各離子的檢量線線性迴歸係數需大於0.995。
3.4.5 無機酸、鹼氣體分析程序的品保品管
空白值(Blank) 為了確認清洗後的多孔金屬片是完全乾淨,以提高本實驗採樣結果的準確 度。因此必須進行空白分析,以了解多孔金屬片的污染對實驗結果之影響程度。 本實驗以洗淨過的多孔金屬片放入15 mL 的去離子水,再置於血清瓶中保持 0.2 atm 的低壓,以超音波振盪器水浴萃取 25 分鐘,再以 IC 分析該萃取液,即可測 得其空白值。 檢量線範圍 在分析採樣樣品之前,必須先利用標準液(Merck Taiwan Ltd.)配製 8 種不同 物種的已知濃度標準品,而且標準品的濃度要涵蓋所有樣品的濃度值。每個標準品吸取 0.5 mL 至 1.0 mL 的體積注入 IC 中分析,檢量線的相關係數 R2必須在 0.995 以上才符合規定,否則應重新配製標準液再做一次。 方法偵測極限的測定 本實驗方法之偵測極限,為IC 分析時所能檢測到之最小濃度。於檢量線線 性範圍最低濃度附近,以稀釋 1~5 倍之待測水溶液做分析,將該樣品依標準檢 測方法重複分析7 次,求其標準偏差值(SD),3 倍標準偏差值即為本實驗之方法 偵測極限。若無法達到上述要求,則應提高最低濃度重新進行測試,表3.3 為各 離子偵測極限。 回收率(或脫附效率)評估 本方法之回收率採用勞委會之標準分析方法,以直接滴入法(spiked method) 作分析。回收率分析的目的是為了確保整個萃取操作程序之準確性,回收率必須 符合品管標準(85 ~ 115 %)。方法為先配製採集氣體體積範圍內乘以 2 倍 PEL 所 得到的重量,添加此重量的標準溶液於空白多孔金屬片,然後立刻取出多孔金屬 片放入100 ml 純水中超音波振盪萃取 30 分鐘,將此萃取液以 IC 分析,分析結 果與原添加量比較,即可求得回收率,其計算公式如下: % 100 ] ) ( [ 1− − × = 原始添加質量 萃取分析之質量 原始的添加質量 回收率 此時檢量線濃度範圍必須包括待測物濃度,而且每個濃度至少需檢測7 個樣 品。若回收率無法達到85 %以上,則需探討誤差原因並考慮使用其它脫附溶劑 或其它輔助回收劑使回收率提昇。當分析變異係數大於品質管制標準時,可能表 示儀器本身或條件之精密度不夠、脫附溶劑不適合或需要更新採集介質。表 3.4 為多孔金屬的回收率,由表中可知各離子回收率皆在90 %以上。 重複分析 重複分析的主要目的是要確認儀器本身的穩定度與精密度,並查核儀器的再 現性。本實驗在相同的條件下,將相同樣品以IC 隨機分析兩次,其相對百分誤
差(Relative Percent Difference,RPD)需在正負 25 %以內。本研究之重覆分析各物
表
3.1 在不同壓力下各型號噴嘴之流量(加倫/小時)
Nozzle Size 40 psi 60 psi 80 psi 100 psi 200 psi 300 psi 500 psi M1 0.63 0.77 0.89 1.00 1.14 1.73 2.24 M2 1.26 1.55 1.79 2.00 2.83 3.46 4.47 M3 1.90 2.32 2.68 3.00 4.24 5.20 6.71表
3.2 IC 操作條件表
陰離子 陽離子
使用管柱 IonPAC CS12 IonPAC AS12A
流洗液 Na2CO3(2.69 mM) NaHCO3(0.30 mM) CH3SO2OH(20.6 mM) 操作壓力(psi) 2200 ~ 2400 1250 ~ 1350 流速(mL/min) 1.5 1 電導度(µs) 16 ± 1 1 ± 0.5 分析時間(min) 12 6
表
3.3 各離子之方法偵測極限
各離子之方法偵測極限
F
-Cl
-NO
2 -Br
-NO
3 -PO
4 3-SO
4 2-NH
4 +單位
ppm ppm Ppm ppm ppm ppm ppm ppm
1 0.02
0.023
0.011
0.02 0.016 0.026 0.046 0.017
2 0.017
0.027
0.015 0.013 0.011 0.041 0.042 0.02
3 0.014
0.029
0.009 0.016 0.021 0.032 0.023 0.016
4 0.022 0.03 0.025 0.012 0.013
0.03 0.045 0.015
5 0.027
0.032
0.017 0.012 0.018 0.035 0.032 0.016
6 0.019
0.035
0.013 0.019 0.009 0.039 0.038 0.019
7 0.013
0.032
0.011 0.022 0.013 0.033 0.031 0.013
average 0.019 0.030 0.014 0.016 0.014 0.034 0.037 0.017
SD 0.005 0.004 0.005 0.004 0.004 0.005 0.008 0.002
MDL 0.014 0.012 0.016 0.012 0.012 0.015 0.025 0.007
表
3.4 多孔金屬片對各離子之回收率
多孔金屬片對各離子之回收率 添加量及回收量單位: µg F - Cl - NO2- Br - NO3- PO43- SO42- NH4+ 樣本 編號 添加 量 回收 量 回收 率% 添加 量 回收 量 回收 率% 添加 量 回收 量 回收 率% 添加 量 回收 量 回收 率% 添加 量 回收 量 回收 率% 添加 量 回收 量 回收 率% 添加 量 回收 量 回收 率% 添加 量 回收 量 回收 率% 1 10 9.7 96.5 10 10.5 104.6 10 10.3 102.7 10 9.4 93.8 10 8.8 87.7 10 10.1 101.3 10 9.6 96.3 10 9.6 96 2 10 9.4 93.8 10 9.8 97.8 10 9.9 99.3 10 9.6 96.4 10 9.3 92.8 10 9.7 97.3 10 9.7 97.0 10 9.8 98 3 10 10.2 101.7 10 9.9 98.9 10 9.5 94.7 10 9.9 98.8 10 9.5 94.9 10 9.2 92.0 10 8.9 88.8 10 9.5 95 4 15 14.7 98.1 15 14.8 98.9 15 14.0 93.3 15 15.1 100.7 15 14.2 94.5 15 14.5 96.3 15 14.9 99.2 30 29.8 99.3 5 15 15.1 100.8 15 14.9 99.3 15 14.4 95.7 15 14.9 99.1 15 14.8 98.6 15 14.5 96.4 15 14.5 96.9 30 30.2 100.7 6 15 14.6 97.1 15 14.0 93.1 15 14.8 98.3 15 14.4 95.7 15 14.4 95.9 15 14.3 95.2 15 14.0 93.1 30 29.0 96.7 7 30 28.9 96.4 30 30.9 102.9 30 29.8 99.2 30 28.7 95.5 30 27.9 92.9 30 29.8 99.2 30 30.8 102.5 50 49.6 99.2 8 30 29.5 98.2 30 29.6 98.6 30 29.3 98.2 30 29.3 97.7 30 29.2 97.2 30 29.6 98.8 30 29.1 97.1 50 49.3 98.6 9 30 30.0 99.9 30 28.9 96.3 30 28.8 96.0 30 29.0 96.5 30 29.7 98.8 30 28.9 96.6 30 29.9 99.6 50 49.9 99.8 平均回收率 % 98.1 98.9 97.5 97.1 94.8 97.0 96.7 98.1○1 空氣過濾器 ○13 浮球開關一組 ○2 風車 ○14 水泵×2 ○3 層流流量計 ○15 壓克力去霧氣上蓋 ○4 壓克力塔上蓋,直徑為30 cm ○16 控制盤 ○5 壓克力塔,直徑為30 cm,長度為 1 m ○17 PH 值控制面板 ○6 不鏽鋼塔,直徑為30 cm,長度為 1 m ○18 加藥機 ○7 壓克力除霧器,直徑為60 cm ○19 10 l 藥捅 ○8 採樣口 ○20 曝氣瓶 ○9 自來水濾心×2,孔徑 10 µm 及 1 µm ○21 曝氣泵 ○10 噴頭 ○22 H2O 流量計,1 lpm ○11 不鏽鋼灑水頭×4 ○23 H2O 流量計,40 lpm ○12 水桶 ○24 壓差計
圖
3.1 實驗系統示意圖
<側視圖>
<上視圖>
35 cm
20 cm
28 cm
80° 80° 80° 80°圖
3.2 噴霧系統示意圖
圖
3.3 本研究採用之固氣分離器組合剖面圖
泵 採樣器出口 第二階多孔金 屬片(無機酸) 第一階多孔金 屬片(無機鹼) 採樣器本體 濾紙screen
採樣器入口 煙道氣入口圖
3.4 固氣分離器的多孔金屬片的採樣效率與採樣容量實驗系統(Tsai
et. al., 2001a)
excess air porous-metal denuder impinger 3 pump HEPA filter
zero air supply
R.H. sensor and
temperature sensor filter mass flow controller
4-channel readout (247c MKS) filter impinger 4 hotplate rotameter impinger 1 impinger 2 silica gel tube heating tape
test gas bubbler mixing bottle
圖
3.5 三種不同無機酸鹼檢測方法效率比較(Tsai et. al., 2001a)
(a) (b) (c) (d) breakthroughHNO
3 0 2 4time, hr
60 70 80 90 100co
llec
tion
ef
fic
ien
cy
, %
porous metal (3 %) porous metal (5 %) silica gel impingerNH
3 0 2 4time, hr
60 70 80 90 100co
llec
tion
ef
fic
ie
nc
y,
%
HCl
0 2 4time, hr
60 70 80 90 100co
llec
tion
ef
fic
ie
nc
y,
%
HF
0 2 4time, hr
60 70 80 90 100co
lle
ct
io
n e
ff
ici
en
cy
, %
impinger porous metal (4 %) porous metal (2 %)第四章 結果與討論
本研究之目的在於研發一個新式的洗滌系統,以改善現行傳統填充塔對於 無機酸鹼去除效率不佳的問題,在進行新式洗滌系統的研究之前,我們必須對於 現有的傳統填充式洗滌塔的操作特性做一研究,了解傳統填充塔在不同的操作條 件時的效率表現。本研究選定在現行半導體產業使用量較大且排放量亦很大的 HCl 來做為本研究的模擬污染物,並針對各濃度的 HCl 污染物氣體在傳統填充塔 中的去除效率表現做一研究了解。進而能夠加入我們所設計的新式噴霧塔來針對 傳統填充塔之效率不足處達到改善的目標。4.1 傳統洗滌塔之效率研究
在過去的研究中發現,傳統填充塔在去除無機酸鹼時的整體效果不佳,尤 其在進口濃度不到 1 ppm 時,所有的去除效率均會大幅下降而無法接近法定的 95%的去除率標準。本研究在進行改善之前特別針對傳統填充塔的許多操作條件 進行研究瞭解。4.1.1 循環水質及進口濃度對去除效率之影響
傳統的填充塔是利用內含的填充物的比表面積上所覆蓋的洗滌水來對污染氣體 進行吸收的作用,以達到去除的效果。而現行的許多半導體業工廠均會為了節省 成本而無法時常的更換洗滌水,以保持一定的乾淨程度。所以我們對於洗滌水的 水質對去除效率的影響亦有相當大的興趣。 我們利用在實驗室建立的新式洗滌系統模場中的填充塔部分(下半部)更換 不同導電度的水質進行效率測試。我們總共測試了三種不同導電度 0.35、5、10 ms/cm 的洗滌水,其相對應之氯離子濃度如表 4.1 所示。實驗在循環水量 25 lpm、 pH=7、滯留時間為 0.71 秒的條件下,得到三條進口濃度對去除效率的曲線,如 圖 4.1。由圖中顯示,在高進口濃度(大於 1000 ppb)時,其間的差距並不大,約 在5%以內,且在 1000 ppb 後都會達到一個吸收的平衡,即去除效率不再增加。 但當濃度降到1000 ppb 以內時,去除效率的差距則逐漸拉大,且隨著濃度愈低 差距愈大,在100 ppb 時導電度 0.35 ms/cm 與 10 ms/cm 所產生的去除效率會相 差到約20 %。 由此實驗結果可得知,一般工廠在處理低濃度 HCl 氣體污染時,水質的需 求相對於高濃度是要重要的許多,但在一般工廠的成本考量下是比較難達到的。4.1.2 循環水 pH 質對去除效率之影響
在一般傳統填充塔中均會利用酸鹼中和的原理來去除污染物,且在「半導 體製造業空氣污染管制及排放標準中」法規中也明確規定了洗滌循環水需要 pH 值大於7。故我們亦需要針對循環水 pH 值對填充塔的去除效率影響多寡做一研 究。在本研究中利用模廠中的填充塔比較了中性 pH 為 7 的清水及填加 NaOH 後 pH 值為 10 的兩種條件下對 HCl 的去除效率,同時控制條件在循環水量為 25 lpm 及滯留時間為0.71 sec 的情況下,得到結果如圖 4.2。在圖中我們可以看到在 HCl 進口濃度大於1000 ppb 時,去除效率達到一個平衡不再隨濃度增加而增加,此 時pH 7 與 pH 10 的差異僅有約 2~3%,而在 250~1000 ppb 的範圍內的去除效率 亦不超過10%,而在更低濃度時,增加 pH 值似乎就沒有改善的效果了。 由此實驗可知道,在傳統填充塔的操作下且洗滌循環水質很髒時,增加 pH 值並無法得到很好的改善效果。