綜合論述
台灣昆蟲 22: 1-18 (2002) Formosan Entomol. 22: 1-18 (2002)前 言
Wolbachia 是一種共生於細胞內的立克次
氏體,最早由Hertig and Wolbach (1924)於 尖音家蚊(Culex pipiens)的生殖細胞中發現, 並將之命名為Wolbachia pipientis。當時對於 Wolbachia 和寄主之間的關係並不清楚,後 來,有學者發現家蚊屬(Culex)種內之混交會導 致 遺 傳 上 的 細 胞 質 不 親 和 性 (cytoplasmic incompatibility)(Laven, 1951; Ghelelovitch, 1952)。而且,這種細胞質不親和的現象,經證 實係由於蚊蟲體內之共生物Wolbachia 所導致
(Yen and Barr, 1971; Barr, 1980; Jamnongluk et al., 2000)。Wolbachia 引起 寄主產生細胞質不親和的現象,已陸續發現於 許多種昆蟲及其它多種無脊椎動物(Hoffmann and Turelli, 1997; Moran and Telang, 1998)。感染 Wolbachia 也可能誘發寄主出現
細胞內共生物
Wolbachia 之生物學特性
蔡坤憲 吳文哲
國立台灣大學昆蟲學研究所 台北市羅斯福路四段 113 巷 27 號陳維鈞
* 長庚大學公共衛生暨寄生蟲學科 桃園縣龜山鄉文化一路 259 號摘 要
Wolbachia 普遍存在於節肢動物的生殖細胞及體細胞中,是一種藉由母系遺傳的 立克次氏體。感染Wolbachia 的寄主,可能導致細胞質不親和性、孤雌生殖、以及子 代雌性化等生殖現象的改變。近年來的研究報告顯示有超過 16﹪的昆蟲種類帶有 Wolbachia,其它節肢動物如甲殼綱的等足目、蜘蛛綱的 類、以及圓形動物線蟲綱 的寄生性絲蟲等無脊椎動物,也陸續被發現有感染 Wolbachia 的情形。Wolbachia 之所以日漸受到重視主要的原因有四: (1) Wolbachia 在寄主體內分佈廣泛,並能影 響寄主的生殖和發育,這種機制在種化過程中可能扮演重要的角色。(2) Wolbachia 為細胞內共生物,其發育與有絲分裂都在寄主身上完成,兩者之間的交互作用,有許 多值得深入探討之處。(3) Wolbachia 可能用來傳遞一些抗病及抗蟲基因,以抑制昆 蟲族群或昆蟲的病媒能力。(4) Wolbachia 在寄生性絲蟲中的發現,可能開啟絲蟲病 治療的新契機。本文主要著重於介紹Wolbachia 的生物學特性,包括 Wolbachia 在 自然界的存在、地位及其與寄主之間的關係,並論及應用Wolbachia 作為寄主個體間 傳遞基因之工具的可能性。 關鍵詞:立克次氏體、細胞內共生物、細胞質遺傳、節肢動物。孤 雌 生 殖(parthenogenesis) 及 子 代 雌 性 化 (feminization)等 異 常 的 生 殖 現 象 (Werren, 1997),這類現象也可能發生於感染不同種,或 同種但不同品系 Wolbachia 的寄主(Beard et al., 1993)。雖然 Wolbachia 主要寄生於寄主的 生殖細胞,最近的研究卻顯示,體細胞的感染 其實也很普遍(O'Neill et al., 1993; Dobson
et al., 1999; Cheng et al., 2000)。
此外,Wolbachia 普遍存在於絲蟲並影響
其發育及生殖則是近年來另一項重大的發現 (McLaren et al., 1975),由於 Wolbachia 對 寄主的發育及生殖有明顯的影響,一般認為, 這 將 為 絲 蟲 病 治 療 帶 來 突 破 的 契 機(Taylor and Hoerauf, 1999)。理論上,Wolbachia 也 可能被利用來攜帶具有抑制病原體或抗蟲性 的基因,以阻止病原體在寄主發育,或直接令 寄主無法存活(Sinkins et al., 1997; Curtis and Sinkins, 1998)。同時,Wolbachia 也被 寄 望 可 能 作 為 寄 主 個 體 間 基 因 傳 遞 的 工 具
(Turelli and Hoffmann, 1991; Beard et al., 1993; Curtis and Sinkins, 1998),雖然其運 用 方 式 仍 待 進 一 步 確 立 , 但 隨 著 人 類 對 於 Wolbachia 基 因 體 (genome) 的 內 容 日 益 清 晰,對其與寄主間的關係也就瞭解得更深刻, 相對地其可行性就更值得期待 (Pintureau et al., 2000)。
Wolbachia 的形態特徵及鑑定
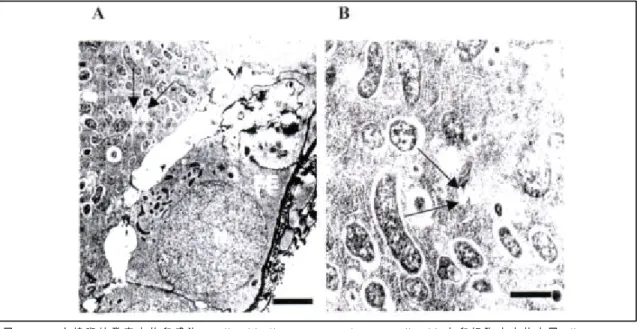
Wolbachia 的 體 型 極 小 , 平 均 直 徑 約 0.6~4.0μm,通常須藉由穿透式電子顯微鏡才 能 觀 察 其 特 徵 。 Wolbachia 為 多 形 性 (pleomorphic),其形狀從小球粒狀到桿狀皆有 (圖一),表面無鞭毛,也不具運動性,常集結 成鏈狀或不規則的塊狀聚集。主要分佈於細胞 質 內 ,Wolbachia 的 最 外 層 為 一 周 質 腔 (periplasmic space),其外側有數層波浪狀厚 度約10nm 的膜質物(Hayes and Burgdorfer,圖一 A. 白線斑蚊發育中的卵感染 Wolbachia ( bar = 800 nm)。B. Wolbachia 在卵細胞 中之放大圖 (bar = 300 nm)。FE, 濾泡表皮層;N, 細胞核;O, 卵細胞;W, Wolbachia。
Fig. 1. A. Electron micrographs showing Wolbachia in a developing egg of Aedes albopictus (bar = 800 nm). B. Higher magnification of Wolbachia with various shapes in the oocyte (bar = 3 00 nm). F E, follicular epithelium; N, nucleus; O, oocyte; W, Wolbachia.
1981),呈不連續性地圍繞著 Wolbachia 的菌 體,最外側則是由一層寄主所形成的膜質小泡 所 圍 繞 , 據 推 測 此 結 構 可 能 是 含 月太 聚 醣 (peptidoglycan) 之 物 質 (Hayes and Burgdorfer, 1981)。在周質腔的內部可見斑紋 狀的核質(nucleoplasm),整個核質又分成皮 質 層(cortical layer)和 髓 質 層 (medullary layer)兩部份,皮質層多有核糖體(ribosome) 分 佈 , 髓 質 層 則 為 緻 密 的 核 質 體(nucleoid body),有時則呈現纖細的螺旋狀(Hayes and Burgdorfer, 1981)。 以往,在確認寄主感染Wolbachia 時,電 子顯微鏡(主要為穿透式)通常是不可或缺的工
具(Wright and Barr, 1980; Hayes and Burgdorfer, 1989; Louis and Nigro, 1989),然而,鑒於 Wolbachia 的形態和其它 立克次氏體區別不易,儘管電子顯微鏡的診斷 功能仍然存在(Peixoto et al., 2001),多數情 況下卻已被蓬勃發展的基因擴增等分子生物 技術所取代。目前常用於診斷Wolbachia 感染 的 基 因 包 括 16S rDNA、 ftsZ 及 wsp 等 (O'Neill et al., 1992, 1993; Sironi et al., 1995; Cui et al., 1999)。同時,經由這些基 因序列所建立的親緣關係,亦有助於探究其分 類地位及彼此間的演化關係 (Taylor et al., 1999)。
Wolbachia 的分佈及親緣關係
節肢動物感染 Wolbachia 的情形極為常 見,目前已知至少有80 種昆蟲、17 種等足類 (isopods)以及多種蛛形綱的 類等生物有感 染Wolbachia 的記錄(Johanowicz and Hoy,1995; Werren, 1997)。而屬於圓形動物線蟲 綱(Nematoda)的寄生性絲蟲,最近亦被發現 普遍受到Wolbachia 感染(Sironi et al., 1995;
Taylor and Hoerauf, 1999; Taylor, 2000) 。 據 估 計 , 在 新 熱 帶 區(Neotropical region)約有 16﹪的昆蟲被 Wolbachia 感染 (表一),涵蓋範圍包括鞘翅目(Coleoptera)、雙 翅目(Diptera)、半翅目(Hemiptera)、同翅目 (Homoptera)、膜翅目(Hymenoptera)、鱗翅 目(Lepidoptera) 和 直 翅 目 (Orthoptera) 等 (Werren et al., 1995; Werren, 1997)。在新 溫帶地區(Neotemperate region)的昆蟲感染 比例也類似(Werren, 1997)。以此推估,全世 界一千萬到三千萬的昆蟲種類當中,可能有一 百五十萬到五百萬種被感染 (Werren et al., 1995) 。 而 類 與 絲 蟲 相 繼 被 證 實 感 染
Wolbachia (Johanowicz and Hoy 1995;
Taylor and Hoerauf, 1999),更進一步顯示 此共生物分佈的涵蓋面極廣。 垂直傳播(Vertical transmission)雖然是 Wolbachia 在自然界中生生不息的常態,但從 等足目的土鱉(Armadillidium vulgare)之生 殖組織分離到的Wolbachia,與從昆蟲分離者 的 親 緣 關 係 相 近 (O'Neill et al., 1992; Werren et al., 1995)。另一方面,已知節肢 動物所感染的 Wolbachia 依其遺傳結構可分 成A、B 兩群(group),而每一群又可分成若干 亞群 (subgroup)。而在蚊蟲中有些分類地位 相 距 較 遠 的 種 類 , 卻 感 染 同 一 亞 群 的
Wolbachia (Kittayapong et al., 2000),這些
都反映出 Wolbachia 在自然界中可能有水平
感染的現象。若以人工方式將白線斑蚊(Aedes
albopictus) 卵巢中的 Wolbachia 接種到果蠅
(Drosophila simulans)的卵巢(Braig et al., 1994) ; 或 者 將 已 感 染 的 蚊 蟲 體 內 的
Wolbachia,接種到未感染的蚊蟲體內,都能
成 功 得 到 新 感 染 的 族 群 , 顯 示 特 定 品 系 之
Wolbachia 對寄主的選擇,在自然界中雖有一
表一 Wolbachia 的感染寄主以及感染後寄主的表現型 (改自 Bourtzis and O’Neill, 1998)
Table 1. Host spectrum and phenotypes of the endosymbiont Wolbachia (modified from Bourtzis and O’Neill, 1998).
Host of Wolbachia Phenotype
Phylum Nematoda Class Phasmidia Order Spirurida Family Filariidae Phylum Arthropoda Class Crustacea Order Isopoda Family Armadillidiidae Family Oniscidae Family Ligiidae Family Porcellionidae Family Sphaeromatidae Class Arachnida Order Acari Family Phytoseiidae Family Tetranychidae Class Insecta Order Coleoptera Family Chrysomelidae Family Cleridae Family Curculionidae Family Dermestidae Family Tenebrionidae Order Diptera Family Calliphoridae Family Culicidae Family Drosophilidae Family Glossinidae Family Neriidae Family Psychodidae Family Stratiomyidae Family Tephritidae) Order Hemiptera Family Reduviidae Family Delphacidae Order Hymenoptera Family Agaonidae Family Aphelinidae Family Apidae Family Braconidae Family Cynipidae Family Encyrtidae Family Eulophidae Family Eucoilidae Family Formicidae Family Proctotrupoidae Family Pteromalidae Family Sphecidae Family Trichogrammatidae Order Lepidoptera Family Nympahalidae Family Pyralidae Order Orthoptera Family Gryllidae Family Tettigonidae unknown F F F F, CI F unknown CI unknown unknown CI unknown CI unknown CI CI unknown unknown unknown unknown CI unknown CI unknown P unknown unknown unknown unknown unknown P unknown CI CI, P unknown P unknown CI unknown unknown CI, cytoplasmic incompatibility; P, parthenogenesis; F, feminization
卻是事實,換句話說,Wolbachia 所能忍受的
寄主環境,事實上具有多樣性的風貌(Boyle et
al., 1993; Rousset and de Stordeur,
1994)。一般而言,Wolbachia 與其寄主共同 演化的歷史越悠久,和其他物種水平感染的機 率就越低,反之,其可能性則越高。 在分類學上,Wolbachia 隸屬於原細菌的 alpha-proteobacteria。如上所述,下列三個 基因是最常被用於辨識種別及品系(圖二),並 做為瞭解親緣關係的工具:(1) 16S rDNA 基 因:16S rDNA 基因的進化速率較慢,其序列 歧異性約每五千萬年相差1-2% (O'Neill et al., 1992; Stouthamer et al., 1993)。Wolbachia 大約在中生代晚期到新生代早期 (5800-6700 萬年) 演化成 A、B 兩個群體 (group),若以 16S rDNA 序 列 為 偵 測 對 象 , 則 不 僅 可 將 Wolbachia 分成 A、 B 兩群體(以昆蟲為寄 主),同時可辨別出 C、D 群體(以絲蟲為寄 主)(Taylor et al., 1999)。(2) fts Z 基因:ftsZ 是一個調控原核細胞週期的基因(Werren et al., 1995) ,在基因序列及蛋白質立體結構 上,都和表現在細胞內微小管壁(microtubule wall)之 tubulin 有一定程度的相似性(Gull, 2001)。因其具保守及高度變異等區段,故可 用來分辨Wolbachia 的群體,並建立其親緣關 係。(3) wsp 基因:wsp 是表現 Wolbachia 表 面蛋白的基因(Braig et al., 1998),其演化速 率較快,故不同品系之間基因序列的變異也較 大,目前,利用該基因可進一步將Wolbachia
區分成 12 個亞群 (subgroup) (Zhou et al., 1998),而這樣細分的結果,對於寄主細胞質 不親和性預測的正確性也隨之提高。
Wolbachia 感染與生殖現象改變
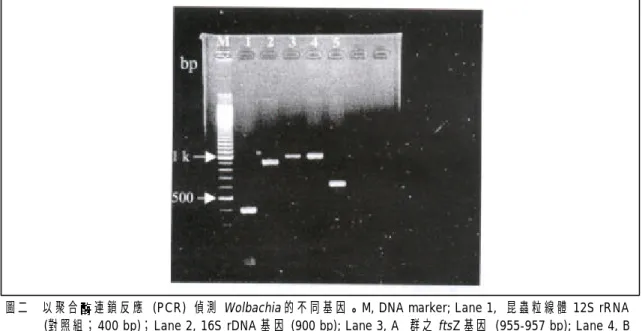
Wolbachia 的分佈廣泛,並能影響寄主的 生殖和發育,這種現象在種化(speciation)過程 中可能扮演重要的角色。而 Wolbachia 之所以圖二 以 聚 合 連 鎖 反 應 (PCR) 偵測 Wolbachia 的 不 同 基 因 。 M, DNA marker; Lane 1, 昆蟲粒線體 12S rRNA (對照組;400 bp);Lane 2, 16S rDNA 基 因 (900 bp); Lane 3, A 群之 ftsZ 基因 (955-957 bp); Lane 4, B 群之 ftsZ 基因 (955-957 bp);Lane 5, wsp 基因 (590-632 bp)。
Fig. 2. Detection of Wolbachia genes using poly merase chain reaction. M, DNA marker; Lane 1, Insect mitochondrial 12S rRNA (control; 400 bp); Lane 2, 16S rDNA (900 bp); Lane 3, ftsZ gene of group A (955-957 bp); Lane 4, ftsZ gene of group B (955-957 bp); Lane 5, wsp gene (590-632 bp).
有此影響力,乃因其具有母系遺傳的特性,也 因 此 演 化 出 趨 向 感 染 生 殖 細 胞 的 機 制 (Hadfield and Axton, 1999)。寄主一旦感染
Wolbachia,常導致下列三種生殖現象的改變: 一、細胞質不親和性 所 謂 細 胞 質 不 親 和 性 , 是 指 感 染 Wolbachia 的雄性個體的精子,與未受感染雌 性個體的卵子結合後,胚胎無法順利發育以產 出子代。由於細胞質不親和現象可能促成或強 化昆蟲群體間的生殖隔離,因此在種化的過程 中具有一定的重要性(Bourtzis and O'Neill, 1998)。根據已有的資料顯示,細胞質不親和 性形成的方式有單向性(unidirectional)以 及 雙向性(bidirectional)兩種(圖三)。單向性指的
是細胞質不親和性的形成由單一品系(群或亞
群)所決定(Subbarao, 1982; Sinkins et al.,
1995b),亦即只有被感染的雄性與未感染的雌 性交配,才會出現細胞質不親和性,反之則可 得到有存活能力的子代(Perrot-Minnot et al., 1996)。若是由於雄性及雌性個體分別感染不 同品系 Wolbachia 而導致的細胞質不親和 性 , 則 稱 之 為 雙 向 性 不 親 和 性(Clancy and Hoffmann, 1996)。由此可知,細胞質不親和 性的表現和細菌的品系、密度、甚至是寄主的 基因型都有關係,彼此之間複雜的交互作用也 可能有所影響,其中細菌的品系所扮演的角色 可 能 是 其 中 最 為 重 要 者 (Barr, 1980; Subbarao, 1982; Kambhampati et al., 1993; Sinkins et al., 1995a)。
在自然界中,不少昆蟲種類同時感染A 群
及 B 群 的 Wolbachia , 形 成 所 謂 superinfection (在同一寄主體內同時感染一 種 以 上 的 Wolbachia) (Werren et al.,
圖三 細 胞 質 不 親 和 性 表 現 的 形 式 可 分 成 : A. 單 向性 (unidirectional) : 當 感 染 Wolbachia 的 雄 性 個 體 與 未 感 染 Wolbachia 的雌性個體交配後,造成細胞質不親和性 ( 四方形內);黑點符號代表個體感染 Wolbachia。B. 雙向 性 (bidirectional):若以感染不同品系 Wolbachia ( 黑點及黑底白點符號) 之昆蟲進行回交,亦可得到 “A” 之結 果。(改自 Beard et al., 1993)
Fig. 3. Two types of cytoplasmic incompatibility. A. Unidirectional: Cytoplasmic incompatibility occurs when an infected male mates with an uninfected female (shown in the square). Symbols with black dots represent an infected individual. B. Bidirectional: Cytoplasmic incompatibility also occurs when mating occurs between hosts infected by different strains of Wolbachia (black or white dots) (modified from Beard et al., 1993).
1995)。由於同一群的 Wolbachia 事實上是由 許多不同的亞群所組成,而同一種寄主的不同 個 體 , 卻 可 能 感 染 不 同 亞 群 的 Wolbachia
(Fialho and Stevens, 1996),因此同為感染 A 群或 B 群的寄主,也可能因配對的個體所感 染的Wolbachia 分屬不同亞群,而導致細胞質 不親和性,因此,若只是僅以“群”的標準去 界定細胞質不親和性的發生與否,必須注意判 斷上所可能出現的偏差。除此之外,寄主年齡 也 被 認 為 和 細 胞 質 不 親 和 性 的 發 生 有 所 關 聯。從白腹叢蚊(Armigeres subalbatus)、熱 帶 家 蚊(Culex quinquefasciatus) 及 果 蠅 (Drosophila sechellia)等例子來看,年齡較大 的雄蟲(感染 Wolbachia)和未感染的雌蟲交 配後,細胞質不親和的特性即大為降低(Singh
et al., 1976; Giordano et al., 1995;
Jamnon gluk et al., 2000),據報導,這種現 象可能和其精子內 Wolbachia 的含量變少有
關 (Bressac and Rousset, 1993),亦即配對 的雌雄寄主間所含細菌密度的差異,確實會對 細胞質不親和性產生稀釋或抑制作用(Noda
et al., 2001)。
細胞質不親和性形成的作用機制目前並 不十分清楚,據推測,可能肇因於下述原因而 使 早 期 胚 胎 呈 現 發 育 異 常(Ryan and Saul, 1968):(1) 雄性個體所感染的 Wolbachia 擷 取精子穿透卵子所需要的物質,使得精子的頂 體 (acrosome) 無 法 鑽 過 透 明 帶 (zona pellucida)而 完 成 授 精(Reed and Werren, 1995);(2) 感染 Wolbachia 之雄性個體精子 在精卵結合過程中被抑制或傷害,除非由卵內 之相同Wolbachia 予以“解救”(rescue),否
則 無 法 進 行 授 精(Curtis and Sinkins, 1998)。 二、孤雌生殖 孤雌生殖指的是雌性個體可經由無性生 殖之方式產下雌性個體,Wolbachia 誘發孤雌 生 殖 的 現 象 只 發 生 於 膜 翅 目 昆 蟲 (Stouthamer et al., 1999),其機制主要是透 過Wolbachia 的操控,而使感染有 Wolbachia 的 未 受 精 卵 的 第 一 次 有 絲 分 裂 於 後 期 (anaphase)中止,形成一個具有雙套核的未受 精卵(Stouthamer and Kazmer, 1994),已知
膜翅目昆蟲的性別係決定於卵為單套(雄性)或 雙套(雌性),因此 Wolbachia 感染所促成的雙 套 未 受 精 卵 自 然 而 然 就 發 育 為 雌 性 (Stouthamer et al., 1999)。當雌蟲飼養在高 溫 之 下 , 孤 雌 生 殖 之 赤 眼 寄 生 蜂 (Trichogramma spp.)也可能產下雄性的個體 (Stouthamer et al., 1990; Louis et al., 1993)。若將之飼養於中間溫度(28℃),則可能 因Wolbachia 的濃度被降低,而產下兼具雌雄
兩 性 性 徵 的 中 間 性 (intersex) 後 代 (Stouthamer et al., 1999)。由於 Wolbachia 是此寄生蜂體內最常見的共生物(Pintureau et al., 2000),其存在顯然是維持其孤雌生殖 的重要因素。 三、子代雌性化 子 代 雌 性 化 只 發 生 於 感 染 B 群 Wolbachia 的 寄 主 , 係 指 寄 主 在 感 染 Wolbachia 的情形下,所產的子代個體,在基 因型雖為雄性,卻轉變成具有雌性功能的現 象。例如土鱉的雄性個體為同型配子(ZZ),雌 性為異型配子(WZ),由於土鱉體內的大部份組 織均含有Wolbachia,而且是由母方傳給下一 代,感染的雌性所產下的後代雖然在遺傳特徵 上 為 雄 性 , 但 卻 表 現 出 雌 性 的 性 狀(Rigaud and Juchault, 1993)。因為 Wolbachia 具有
決定性的作用,一旦以抗生素或 30℃以上的
即會終止,並恢復以染色體決定性別的功能, 雄性個體亦將再出現於子代中(Rigaud et al., 1991a, b)。促成子代雌性化現象的機制雖不清 楚,但可能是由於調控雄性性腺發育及分化的 基因被抑制,導致尚未分化的雄性性腺轉而發 育成卵巢,並誘發出雌性的外貌(Bourtzis and O'Neill, 1998)。但何以只發生於感染 B 群 Wolbachia 的寄主?原因仍待進一步探討。
Wolbachia 與寄主間之交互作用
一、共生 (Symbiosis) 或寄生 (Parasitism) “共生”一詞係指兩種生物密切地生活 在 一 起 , 而 這 種 關 係 通 常 具 有 專 一 性 。 Wolbachia 包括發育及繁殖等生活史都在細 胞內完成,但絕大多數對細胞都沒有具體的傷 害,對被感染寄主的族群亦無明顯的負面效 應,反倒是一旦去除Wolbachia,寄主的發育 及生殖都可能受到不利的影響(Bandi et al., 1999)。絲蟲(filarial worms)感染 Wolbachia 的情形即是一個明顯的例子,若以抗生素(如四 環黴素)處理,絲蟲體內的 Wolbachia 將被去 除 , 則 不 僅 其 胚 胎 形 成 被 抑 制 , 微 絲 蟲 (microfilaria)的產量也降低 (Hoerauf et al., 2000),似乎隱含著兩者之間已演化成一種互 利共生(mutualism)的關係。另一方面,感染 Wolbachia 的擬穀盜(Tribolium spp.),其雌 蟲 的 生 殖 力 雖 會 降 低 , 但 反 而 促 使 帶 有 Wolbachia 的少數雌性個體,在整個族群中獲 得較多的生殖利益,而因細胞質不親和性所衍 生對Wolbachia 的不良效應降低,相對地則提 升 Wolbachia 延續於自然界的機會,就此而 言,Wolbachia 在上述寄主中確實扮演著稱職 的共生物(O'Neill, 1995)。 不過仍有些例子顯示,被Wolbachia 感染 的寄主必須付出重大的生理成本,例如果蠅的 寄 生 蜂(Leptopilina heterotoma) , 一 旦 被 Wolbachia 感 染 , 其 致 病 性 即 十 分 明 顯 (Fleury et al., 2000),這種現象在果蠅本身 也有類似的情形(Min and Benzer, 1997)。 二、立克次氏體間的競爭關係 在實驗室的人工感染試驗中,若分別以含 Rickettsia typhi(人類地方性斑疹傷寒之病原) 和 Rickettsia felis 的血餵食貓蚤,則可發現 少部份個體同時感染二種以上的立克次氏體 (Noden et al., 1998),顯示節肢動物雙重感染 立克次氏體的可能性。在自然界裡,同時感染 兩種立克次氏體的節肢動物也所在多有,同時 感染於同一寄主細胞內的立克次氏體之間,在 生理功能上的關係為互補?或競爭?對立克 次氏體有何影響?對寄主的效應又如何?目 前,有關這些問題的答案並不明確。在安氏革 蜱(Dermacentor andersoni)的研究模式裡, 發現其體內除了Rickettsia rickettsii,另有一 種非致病性之共生立克次氏體,而且兩者皆可 經卵傳播至下一代(Burgdorfer and Brinton, 1975)。當同時感染這兩種立克次氏體的蜱飼 養數代之後,其雌性個體死亡率提高、產卵率 降低。觀察自然界中有雙重感染的蜱族群,其 卵的成熟、產卵量、胚胎形成同樣都受到不利 的影響,並導致蜱族群逐漸減少;反之,單純 感 染 非 致 病 性 共 生 物 的 蜱 族 群 卻 得 以 存 活 (Burgdorfer, 1988),顯示兩者之間確實存在 著競爭關係,而這樣的競爭關係對寄主的發育 顯然有負面的效應。同樣地,原先就存在於寄 主 體 內 的 Rickettsia montana 或 R. rhipicephali 等非致病性的立克次氏體,對於 後來再感染的R. rickettsii 亦可能產生干擾效 應,致使其不適於生存,終致無法長留於寄主 的子代中(Burgdorfer and Brinton, 1975)。和R. felis 等立克次氏體的情形極為常見,但
在一寄主個體同時發現這兩種立克次氏體的 例子卻相當罕見,顯示這種兩立克次氏體之間 必 然 存 有 競 爭 性 , 甚 至 具 有 相 互 排 斥 性 (Williams et al., 1992)。而 Wolbachia 既是 節肢動物的共生物,其長期存在於寄主體內乃 屬必然,一旦有其它微生物再進入該寄主,其 與 Wolbachia 之間的關係為何?則是個令人 好奇,也頗值得深入探討的議題。 三、Wolbachia 與絲蟲 絲 蟲 是 除 節 肢 動 物 外 , 另 一 類 可 被 Wolbachia 感染的生物,已知絲蟲亦是透過經 卵 傳 播 而 將 Wolbachia 傳 至 胎 蟲 之 中 (McLaren et al., 1975; Taylor and Hoerauf, 1999)。大多數寄生於人體的絲蟲(包 括曾經流行於台灣的班氏絲蟲)常致使被感染 者出現組織增生,甚至形成象皮腫等嚴重病 變,長久以來,一直是許多熱帶開發中國家公 共衛生上的一大負擔。過去,絲蟲的治療多仰 賴海喘散(Hetrazan/DEC) 或 Ivermectin 等 藥物,但這些藥物有些有副作用,也可能因死 亡蟲體釋放出Wolbachia,或直接藉由絲蟲體 內的 Wolbachia 促成白血球的化學誘引作用 (chemotaxis),而使寄主出現發炎反應,甚至 進一步產生病變(Taylor, 2000; Brattig et al. 2001)。由於 Wolbachia 與絲蟲正常的生理功 能 有 密 切 的 關 係(Taylor and Hoerauf, 1999),故一旦將之去除,即直接傷害到絲蟲 的發育及生殖,就絲蟲病患而言,卻可因而有 效減輕絲蟲感染所引發的病變,依此概念所衍 生出來的是一種既安全、又少副作用的治療方 式,由於其不僅具有療效,又可抑制傳播以降 低大規模流行的危險,也等於為絲蟲防治開啟 了 明 亮 的 一 扇 窗(Taylor and Hoerauf, 1999)。截至目前為止,至少有包括 Brugia
malayi, Brugia pahangi, Dirofilaria immitis, Litomosoides sigmodontis, Onchocerca gutturosa, Onchocerca lienalis, Onchocerca ochengi, Onchocerca volvulus
和 Wuchereria bancrofti 等絲蟲已被偵測出
感染Wolbachia(Taylor et al., 1999; Taylor,
2000),其中班氏絲蟲(W. bancrofti)、馬來絲 蟲 (B. malayi) 以 及 蟠 尾 絲 蟲(O. volvulus) 都是人類重要的寄生蟲。
Wolbachia 應用於限制疾病傳播之展
望
人類有許多重要的傳染病必須藉助節肢 動物來媒介,近年來,國際交通日趨發達,人 民往來頻率增加,疾病的散播相對地也變得更 為容易。為求有效地防治這類蟲媒疾病,若能 降低病媒昆蟲的密度或是限制其病媒能力,應 該都具有公共衛生上的意義。過去許多年來, 人類在病媒防治上對殺蟲劑的仰賴極深,但根 據世界衛生組織(WHO)的估計,大約有 125 種 節 肢 動 物 至 少 已 對 一 種 殺 蟲 劑 產 生 抗 性 (WHO, 1992),因此,以不應用化學藥物的遺 傳工程技術,來降低病媒昆蟲的密度,不僅無 污染環境之虞,更沒有誘發宿主產生抗藥性的 顧慮,未來在制定害蟲防治的策略上,已是個 必須思考的重要方向(Crampton et al., 1994; Gwadz, 1994; Beard et al., 1998)。就此而 言,Wolbachia 因會促成寄主的細胞質不親和 性,這種特性不僅有助於Wolbachia 在寄主族 群中散播 (Fleury et al., 2000),一旦能野放 有效規模的被感染雌蟲,在理論上也有降低自 然族群密度的可能。Wolbachia 也可能被用作 傳遞不利於寄主生存的特定基因,或使寄主成 為不具傳病能力者,一旦這些經過改造的個體 能進入田間的病媒族群,藉由競爭關係,自然有可能使疾病傳播的速度與機率降低(Curtis, 1992; Beard et al., 1993; Crampton et al., 1994; Gwadz, 1994; Collins and Paskewitz, 1995; Sinkins et al., 1997)。最 近有研究顯示,除生殖細胞外,Wolbachia 尚
可感染寄主的各種體細胞,準此以觀,未來應 用 Wolbachia 於病媒防治的潛力將更值得重
視(Rigaud and Juchault, 1995; Min and Benzer, 1997; Dobson et al., 1999; Cheng
et al., 2000)。譬如利用遺傳工程技術以轉形 Wolbachia ,使其能順利表現病原體之反相 (antisense) DNA,將可有效干擾該病原體之 複製與增殖(Beard et al., 1998)。這樣的概念 應用於蚊蟲及蚊媒疾病的防治,尤其具有重大 的意義,因為蚊蟲不僅是人類許多重要疾病的 病媒,在自然界中蚊蟲感染 Wolbachia 的比 例 , 也 明 顯 高 於 其 它 的 昆 蟲 種 類 (Kitta- yapong et al., 2000)。 整體而言,欲求有效應用Wolbachia 於管 制疾病的傳播,必須同時考慮下列三個重要的 因素:(1) 所欲轉殖至 Wolbachia 的基因確能 抵 抗 特 定 的 病 原 體 , 才 能 使 轉 殖 後 的 Wolbachia 在順利導入病媒昆蟲的自然族群 後,可以有效降低該族群的病媒能力,可惜的 是,自然界中並非所有的昆蟲族群都感染有 Wolbachia。就蚊蟲而言,曾有報導指出,在 89 種被調查的種類中僅有 25 種(28.1%)可偵測 出有 Wolbachia 共生,但是一些重要的病媒 昆蟲如埃及斑蚊(Aedes aegypti)、三斑家蚊 (Culex tritaeniorhynchus) 及 各 種 瘧 蚊 (Anopheles spp.)的自然族群卻都未曾發現有 被 感 染 的 記 錄(Kittayapong et al., 2000; Tsai, K. H., Wu, W. J., Lien, J. C., and Chen, W. J., unpublished. data),是否這些
蚊蟲在生理上就不利於 Wolbachia?目前並 未 有 明 確 的 答 案(Kittayapong et al., 2000)。未來,或許可藉人工感染的方式,來 了 解 其 中 之 控 制 機 轉(Braig et al., 1994; Pintureau et al., 2000);(2) 所轉殖的基因必 須能在寄主昆蟲體內穩定地表現,並能遺傳至 其子代。Wolbachia 通常透過母系遺傳至下一 代,因此,只要感染的Wolbachia 適合該寄主 之體內環境,代代延續所攜帶的基因應可預期 (Beard et al., 1993);(3) 此基因要能大量散 佈於病媒的自然族群。曾有報導指出,在加州 感染Wolbachia 的果蠅(D. simulans)族群, 每年以100 公里的速率散播出去(Turelli and Hoffman, 1991),顯示其散播能力十分快速, 而這對特定基因在自然界的有效散播,無疑是 具有正面意義的。
結 語
Wolbachia 可以透過細胞質遺傳,快速地 散播至未感染的族群,並影響寄主的生殖特 性,當一個族群引入Wolbachia 後,其與寄主 間 如 何 交 互 作 用 以 取 得 妥 協 並 維 持 平 衡 ? Wolbachia 操控寄主的生殖和發育,並影響物 種演化的機制又如何?都是演化學及生態上 值得思考的問題。雖然Wolbachia 可以感染許 多種節肢動物及絲蟲,但尚未有證據顯示它們 也是脊椎動物的寄生或共生物。不過,已知從 死亡絲蟲釋放出來的Wolbachia,會促使脊椎 動物寄主出現發炎反應(Taylor et al., 2000; Brattig et al. 2001),Wolbachia 和脊椎動物之間的關係確實令人好奇。由於 Wolbachia
可 能 被 用 作 寄 主 個 體 間 傳 遞 基 因 的 工 具 (Curtis and Sinkins, 1998),一般相信,或 許可利用其引入抑制或抗病基因於病媒昆蟲 族群,以限制其傳病的能力,此構想在實現之 前雖仍有待諸多突破,然而,Wolbachia 體內
構,已在最近獲得證實(Masui et al., 2000, 2001),藉此結構在不同 Wolbachia 間穿梭而 傳遞基因的可能性,也因而大為提高。比較棘 手的難題,反而是如何在不破壞原有生態平衡 的原則下,將攜帶適當基因的病媒昆蟲野放, 以取代原有之自然族群。
參考文獻
Bandi, C., B. Slatko, and S. L. O'Neill.
1999. Wolbachia genomes and the many faces of symbiosis. Parasitol. Today 15: 428-429.
Barr, A. R. 1980. Cytoplasmic incom-
patibility in natural populations of a mosquito, Culex pipiens L. Nature 283: 71-72.
Beard, C. B., R. V. Durvasula, and F. F. Richards. 1998. Bacterial symbiosis
in arthropods and the control of disease transmission. Emerg. Infect. Dis. 4: 581-591.
Beard, C. B., S. L. O'Neill, P. Mason, L. Mandelco, C. R. Woese, R. B. Tesh, F. F. Richard, and S. Aksoy. 1993.
Genetic transformation and phylogeny of bacterial symbionts from tsetse. Insect Mol. Biol. 1: 123-131.
Bourtzis, K., and S. L. O'Neill. 1998. Wolbachia infections and arthropod
reproduction. BioScience 48: 287-293.
Boyle, L., S. L. O'Neill, H. M. Robertson, and T. L. Karr. 1993. Interspecific and
intraspecific horizontal transfer of
Wolbachia in Drosophila. Science 260:
1796-1799.
Braig, H. R., H. Guzman, R. B. Tesh, and S. L. O'Neill. 1994. Replacement of
the natural Wolbachia symbiont of
Drosophila simulans with a mosquito
counterpart. Nature 367: 453-455.
Braig, H. R., W. Zhou, S. L. Dobson, and S. L. O'Neill. 1998. Cloning and
characterization of a gene encoding the major surface protein of the bacterial endosymbiont Wolbachia
pipientis. J. Bacteriol. 180: 2373-2378. Brattig, N. W., D. W. Buttner, and A.
Hoerauf. 2001. Neutrophil accumu-
lation around Onchocerca worms and chemotaxis of neutrophils are dependent on Wolbachia endobacteria. Microbes Infect. 3: 439-446.
Bressac, C., and F. Rousset. 1993. The
reproductive incompatibility system in
Drosophila simulans, DAPI-staining
analysis of the Wolbachia symbionts in sperm cysts. J. Invertebr. Pathol. 61: 226-230.
Burgdorfer, W. 1988. Ecological and
epidemiological consideration of Rocky Mountain spotted fever and scrub typhus. pp. 33-50. In: D. H. Walker, ed. Biology of Rickettsial Disease. CRC Press, Boca Raton, FL.
Burgdorfer, W., and P. L. Brinton. 1975.
Mechanisms of transovarial infection of spotted fever rickettsiae in ticks. Ann. NY Acad. Sci. 266: 61-72.
Cheng, Q., T. D. Ruel, W. Zhou, S. K. Moloo, P. Majiwa, S. L. O'Neill, and S. Aksoy. 2000. Tissue distribution and
prevalence of Wolbachia infections in tsetse flies, Glossina spp. Med. Vet. Entomol. 14: 44-50.
Clancy, D. J. and A. A. Hoffmann. 1996.
Cytoplasmic incompatibility in Drosophila
simulans: Evolving complexity. TREE 11:
145-146.
Collins, F. H., and S. M. Paskewitz. 1995.
Malaria: current and future prospects for control. Annu. Rev. Entomol. 40: 195-219.
Crampton, J. M., A. Warren, G. J. Lycett, and M. Hughes. 1994. Genetic
manipulation of insect vectors as a strategy for the control of vector - borne disease. Ann. Trop. Med. Parasitol. 88: 3-12.
Cui, L., S. F. Chang, D. Strickman, and E. Rowton. 1999. Frequency of Wolbachia
infection in laboratory and field sand fly (Diptera: Psychodidae) populations. J. Am. Mosq. Control Assoc. 15: 571-572.
Curtis, C. F. 1992. Selfish genes in
mosquitoes. Nature 357: 450.
Curtis, C. F., and S. P. Sinkins. 1998. Wolbachia as a possible means of
driving genes into populations. Parasitology 116: s111-s115.
Dobson, S. L., K. Bourtzis, H. R. Braig, B. F. Jones, W. Zhou, F. Rousset, and S. L. O'Neill. 1999. Wolbachia infections
are distributed throughout insect somatic and germ line tissues. Insect Biochem. Mol. Biol. 29: 153-160.
Fialho, R. F. and L. Stevens. 1996.
Wolbachia infections in the flour
beetle Tribolium confusum: evidence for a common incompatibility type across strains. J. Invertebr. Pathol. 67: 195-197.
Fleury, F., F. Vavre, N. Ris, P. Fouillet, and M. Bouletreau. 2000. Physiological cost
induced by the maternally-transmitted endosymbiont Wolbachia in the
Drosophila parasitoid Leptopilina heterotoma. Parasitology 121: 493-500. Ghelelovitch, S. 1952. Sur le deter -
minisme genetuque de la sterilite dans le croisement entre differentes souches de Culex autogenicus
Roubaud. C. R. Acad. Sci. Paris 24: 2386-2388 (Cited by Weren, 1997).
Giordano, R., S. L. O'Neill, and H. M. Robertson. 1995. Wolbachia infections
and the expression of cytoplasmic incompatibility in Drosophila sechellia and D. mauritiana. Genetics 140: 1307-1317.
Gull, K. 2001. Protist tubulins: new
arrivals, evolutionary relationships and insights to cytoskeletal function. Curr. Opin. Microbiol. 4: 427-432.
Gwadz, R. W. 1994. Genetic approaches to
malaria control: how long the road? Am. J. Trop. Med. Hyg. 50: 116-125.
Hadfield, S. J., and J. M. Axton. 1999.
Reproduction: germ cells colonized by endosymbiontic bacteria. Nature 420: 482.
Hayes, S. F., and W. Burgdorfer. 1981.
Wolbachia-like symbiotes of ticks
(Acari: Ixodidae). pp. 281-289. In: W. Burgdorfer, and R. L. Anacker, eds. Rickettsiae and Rickettsial Disease. Academic Press, New York.
Hayes, S. F., and W. Burgdorfer. 1989.
Interaction between rickettsial endocy- tobionts and their tick hosts. pp. 235-251. In: W. Schwemmler, and G. Gassner, eds. Insect Endocytobiosis: Morphology, Physiology, Genetics, Evolution. CRC Press, Boca Raton, FL.
Hertig, M., and S. B. Wolbach. 1924.
Studies on rickettsia-like micro- organisms in insects. J. Med. Res. 44: 329-374 (Cited by Werren, 1997).
Hoerauf, A., L. Volkmann, K. Nissen-Paehle, C. Schmetz, I. Autenrieth, D. W. Buttner, and B. Fleischer. 2000. Targeting of Wol- bachia endobacteria in Litomosoides sigmodontis: comparison of tetracy-
clines with chloramphenicol, mac- rolides and ciprofloxacin. Trop. Med. Intl. Hlth 5: 275-279.
Hoffmann, A. A., and M. Turelli. 1997.
Cytoplasmic incompatibility in in- sects, pp. 42-80. In: S. L. O'Neill, A. A. Hoffmann and J. H. Werren, eds. Influential Passengers: Inherited Microorganisms and Arthropod Re- production. Oxford Uni. Press, Oxford, UK.
Jamnongluk, W., P. Kittayapong, K. J. Baisley, and S. L. O'Neill. 2000. Wolbachia infection and expression of
cytoplasmic incompatibility in Armi-
geres subalbatus (Diptera: Culicidae).
J. Med. Entomol. 37: 53-57.
Johanowicz, D. L., and M. A. Hoy. 1995.
Molecular evidence for A-Wolbachia endocytobiont in predatory mite
Metaseiulus occidentalis. J. Cell.
Biochem. 21: 198.
Kambhampati, S., K. S. Rai, and S. J. Burgun. 1993. Unidirectional cyto-
plasmic incompatibility in the mos - quito, Aedes albopictus. Evo- lution 47: 673-677.
Kittayapong, P., K. J. Baisley, V. Baimai, and S. L. O'Neill. 2000. Distribution
and diversity of Wolbachia infections in Southeast Asian mosquitoes (Diptera: Culicidae). J. Med. Entomol. 37: 340-345.
Laven, H. 1951. Crossing experiments
with Culex strains. Evolution 5: 370-375.
Louis, C., and L. Nigro. 1989. Ultras-
tructural evidence of Wolbachia rickettsiales in Drosophila simulans and their relationships with uni- directional cross-incompatibility. J. Invertebr. Pathol. 54: 39-44.
Louis, C., B. Pintureau, and L. Chapelle.
1993. Research on the origin of unisexuality: thermotherapy cures both rickettsia and thelytokous parthenogenesis in a Trichogramma species. C. R. Acad. Sci. III Paris 316: 27-33.
Ishikawa. 2000. Distribution and
evolution of bacteriophage WO in
Wolbachia, the endosymbiont causing
sexual alterations in arthropods. J. Mol. Evol. 51: 491-497.
Masui, S., H. Kuroiwa, T. Sasaki, M. Inui, T. Kuroiwa, and H. Ishikawa. 2001.
Bacteriophage WO and virus-like particles in Wolbachia, an endo- symbiont of arthropods. Biochem. Biophys. Res. Com. 283: 1099-1104.
McLaren, D. J., M. J. Worms, B. R. Laurence, and M. G. Simpson. 1975.
Micro-organisms in filaria larvae (Nematoda). Trans. Roy. Soc. Trop. Med. Hyg. 69: 509-514.
Min, K. T., and S. Benzer. 1997. Wolbachia, normally a symbiont of Drosophila, can be virulent, causing
degeneration and death. Proc. Natl. Acad. Sci. USA 94: 10792-10796.
Moran, N. A., and A. Telang. 1998.
Bacteriocyte-associated symbionts of insects. BioScience 48: 295-304.
Noda, H., Y. Koizumi, Q. Zhang, and K. Deng. 2001. Infection density of Wolbachia and incompatibility level
in two planthopper species,
Laodelphax striatellus and Sogatella furcifera. Insect Biochem. Mol. Biol.
31: 727-737.
Noden, B. H., S. Radulovic, J. A. Higgins, and A. F. Azad. 1998. Molecular
identification of two closely related rickettsial species, Rickettsia typhi and R. felis, in individual cat fleas,
Ctenocephalides felis (Siphonaptera:
Pulicidae). J. Med. Entomol. 35: 410-414.
O'Neill, S. L. 1995. Wolbachia pipientis:
symbiont or parasite? Parasitol. Today 11: 168-169.
O'Neill, S. L., R. H. Gooding, and S. Aksoy. 1993. Phylogenetically dis -
tant symbiotic microorganisms reside in Glossina midgut and ovary tissues. Med. Vet. Entomol. 7: 377-383.
O'Neill, S. L., R. Giordano, A. M. Colbert, T. L. Karr, and H. M. Robertson. 1992.
16S rRNA phylogenetic analysis of the bacterial endosymbionts associated with cytoplasmic incompatibility in insects. Proc. Natl. Acad. Sci. USA 89: 2699-2702.
Peixoto, C. A., L. F. Silva, K. M. Teixeira, and A. Rocha. 2001. Ultrastructural
characterization of intracellular bacteria of Wuchereria bancrofti. Trans. Roy. Soc. Trop. Med. Hyg. 95: 566-568.
Perrot-Minnot, M. J., L. R. Guo, and J. H. Werren. 1996. Single and double
infections with Wolbachia in the parasitic wasp Nasonia vitripennis: effects on compatibility. Genetics 143: 961-972.
Pintureau, B., S. Grenier, B. Boleat, F. Lassabliere, A. Heddi, and C. Khatchadourian. 2000. Dynamics of Wolbachia population in transfected
lines of Trichogramma. J. Invertebr. Pathol. 76: 20-25.
Reed, K. M., and J. H. Werren. 1995.
Induction of paternal genome loss by the paternal-sex-ratio chromosome and cytoplasmic incompatibility bacteria (Wolbachia): a comparative study of early embryonic events. Mol. Reprod. Dev. 40: 408-418.
Rigaud, T., and P. Juchault. 1993.
Conflict between feminizing sex ratio distorters and an autosomal masculinizing gene in the terrestrial isopod Armadillidium vulgare Latr. Genetics 133: 247-252.
Rigaud, T., and P. Juchault. 1995. Success
and failure of horizontal transfer of feminizing Wolbachia endosymbionts in woodlice. J. Evol. Biol. 8: 249-255.
Rigaud, T., P. Juchault, and J. P. Mocquard. 1991a. Experimental
study of temperature effects on the sex ratio of broods in terrestrial Crustacean Armadillidium vulgare Latr. Possible implications in natural populations. J. Evol. Biol. 4: 603-617.
Rigaud, T., C. Souty-Grosset, R. Raimond, J. P. Mocquard, and P. Juchault.
1991b. Feminizing endocytobiosis in the terrestrial crustacean Arma-
dillidium vulgare Latr. (Isopoda):
recent acquisitions. Endocytobiol. Cell Res. 7: 259-273.
Rousset, F., and E. de Stordeur. 1994.
Properties of Drosophila simulans strains experimentally infected by different clones of the bacterium
Wolbachia. Heredity 72: 325-331.
Ryan, S. L., and G. B. Saul, II. 1968.
Post-fertilization effect of incom - patibility factors in Mormoniella. Mol. Gen. Genet. 103: 29-36.
Singh, K. R., C. F. Curtis, and B. S. Krishnamurthy. 1976. Partial loss of
cytoplasmic incompatibility with age in males of Culex fatigans. Ann. Trop. Med. Parasitol. 70: 463-466.
Sinkins, S. P., H. R. Braig, and S. L. O'Neill. 1995a. Wolbachia superin-
fections and the expression of cytoplasmic incompatibility. Proc. R. Soc. Lond. B. 261: 325-330.
Sinkins, S. P., H. R. Braig, and S. L. O'Neill. 1995b. Wolbachia pipientis:
Bacterial and unidirectional cytoplas- mic incompatibility between infected populations of Aedes albopictus. Exp. Parasitol. 81: 284-291.
Sinkins, S. P., C. F. Curtis, and S. L. O'Neill. 1997. The potential use of
symbionts to manipulate arthropod populations. pp. 25-37. In: S. L. O'Neill, A. A. Hoffman, and J. H. Werren, eds. Influential Passengers: Inherited Microorganisms and Arth- ropod Reproduction. Oxford Univ. Press, Oxford, UK.
Sironi, M., C. Bandi, L. Sacchi, B. Di. Sacco, G. Damiani, and C. Genchi.
1995. Molecular evidence for a close relative of the arthropod endosym - biont Wolbachia in a filarial worm. Mol. Biochem. Parasitol. 74: 223-227.
Cytogenetics of microbe-associated parthenogenesis and its consequences for gene flow in Trichogramma wasps. Heredity 73: 317-327.
Stouthamer, R., J. A. Breeuwer, and G. D. D. Hurst. 1999. Wolbachia pipientis:
Microbial manipulator of arthropod reproduction. Annu. Rev. Microbiol. 53: 71-102.
Stouthamer, R., R. F. Luck, and W. D. Hamilton. 1990. Antibiotics cause
parthenogenetic Trichogramma (Hy- menoptera/Trichogrammatidae) to revert to sex. Proc. Natl. Acad. Sci. USA 87: 2424-2427.
Stouthamer, R., J. A. Breeuwer, R. F. Luck, and J. H. Werren. 1993.
Molecular identification of microor - ganisms associated with partheno- genesis. Nature 361: 66-68.
Subbarao, S. 1982. Cytoplasmic incom -
patibility in mosquitoes, pp. 313-342.
In: W. M. Steiner, W. J. Tabachnick,
K. S. Rai, and S. Narang, eds. Recent Development in the Genetics of Disease Vectors. Champaign Press, IL.
Taylor, M. J. 2000. Wolbachia bacteria of
filarial nematodes in the patho- genesis of disease and as a target for control. Trans. Roy. Soc. Trop. Med. Hyg. 94: 596-598.
Taylor, M. J., and A. Hoerauf. 1999. Wolbachia bacteria of filarial nema-
todes. Parasitol. Today 15: 437- 442.
Taylor, M. J., K. Bilo, H. F. Cross, J. P.
Archer, and A. P. Underwood. 1999.
16S rDNA phylogeny and ultras- tructural characterization of Wol-
bachia intracellular bacteria of the
filarial nematodes Brugia malayi, B.
pahangi, and Wuchereria bancrofti.
Exp. Parasitol. 91: 356-361.
Turelli, M., and A. A. Hoffmann. 1991.
Rapid spread of an inherited incompatibility factor in California
Drosophila. Nature 353: 440-442. Werren, J. H. 1997. Biology of Wolbachia.
Annu. Rev. Entomol. 42: 587-609.
Werren, J. H., D. Windsor, and L. Guo.
1995. Distribution of Wolbachia among neotropical arthropods. Proc. R. Soc. Lond. B. 262: 197-204.
Williams S. G., J. B. Sacci, Jr., M. E. Schriefer, E. M. Anderson, K. Fujioka, and F. J. Sorvilo. 1992. Typhus and
typhus-like rickettsiae associated with opossums and their fleas in Los Angeles County, California. J. Clin. Microbiol. 30: 1758-1762.
World Health Organization. 1992. Vector
resistance to pesticides. 15th Report of the WHO Expert Committee on Vector Biology and Control. WHO Tech. Rep. Ser. 818: 62.
Wright, J. D., and A. R. Barr. 1980. The
ultrastructure and symbiotic relation - ships of Wolbachia of mosquitoes of the Aedes scutellaris group. J. Ultrastruct. Res. 72: 52-64.
Yen, J. H., and A. R. Barr. 1971. New
plasmic incompatibility in Culex
pipiens. Nature 232: 657-658.
Zhou, W., F. Rousset, and S. L. O'Neill.
1998. Phylogeny and PCR-based classification of Wolbachia strains
using wsp gene sequences. Proc. R. Soc. Lond. B. 265: 509-515.
收件日期:2001 年 11 月 27 日 接受日期:2001 年 12 月 11 日
Biological Characteristics of the Endosymbiont Wolbachia
Kun-Hsien Tsai, Wen-Jer Wu Department of Entomology, National Taiwan University, Taipei 106, Taiwan Wei-June Chen* Department of Public Health and Parasitology, Chang Gung University, Kwei-San, Tao-Yuan 333, Taiwan
ABSTRACT
Wolbachia spp. are maternally inherited rickettsiae that infect both
germ cells and somatic cells of various arthropods. They have been found to infect more than 16% of insect species, as well as a number of other invertebrates such as mites, isopods, and filarial nematodes. Infection by
Wolbachia is distinguished by its ability to modify host reproductive
phenotypes including cytoplasmic incompatibility, parthenogenesis, and feminization. Recent studies on interactions between Wolbachia and hosts have shed light on: (1) its potential role in rapid speciation of the host; (2) its ability to alter early development and mitotic processes of the host; (3) its significance in spreading desirable genetic modifications in an insect population, and the subsequent inhibition of insect populations and/or vector competence; and (4) developments of new strategies to control infection of filaria in which Wolbachia is usually harbored and eventually becomes essential to the nematodes. In this report, the application of Wolbachia for the management of vector -borne diseases through transgenic techniques is also discussed.