山藥在高血脂兔子上之抗氧化及抗粥狀動脈之影響; Effect of the Antioxidant and Antiatherogenic of Dioscorea Rhizome on the Hypercholesterolemic Rabbits
全文
(2) 圖目錄 Fig 7. 兔子體重在 0, 2, 4, 6, 8, 12 週之結果 Fig 8. 兔子 GOT 在 0, 2, 4, 6, 8,週之結果 Fig 9. 兔子 GPT 在 0, 2, 4, 6, 8,週之結果 Fig 10. 兔子 cholesterol 在 0, 2, 4, 6, 8,週之結果 Fig 11. 兔子 TG 在 0, 2, 4, 6, 8,週之結果 Fig 12. 兔子 LDL 在 0, 2, 4, 6, 8,週之結果 Fig 13. 兔子 HDL 在 0, 2, 4, 6, 8,週之結果 Fig 14. 兔子血液自由基之結果(Luminal) Fig 15. 兔子血液自由基之結果(Lucigemin) Fig 16. 兔子肝臟自由基之結果 Fig 17. 第 0 週紅血球抗氧化 Fig 18. 第 2 週紅血球抗氧化 Fig 19. 第 4 週紅血球抗氧化 Fig 20. 第 6 週紅血球抗氧化 Fig 21. 第 8 週紅血球抗氧化 Fig 22. 兔子肝臟中抗氧化酵素(SOD)之結果 Fig 23. 兔子肝臟中抗氧化酵素(GSH)之結果 Fig 24. 兔子肝臟中抗氧化酵素(catalase)之結果 Fig 25. 兔子粥狀動脈斑塊堆積之結果 Fig26. Sudan IV stained at 12th week 2.
(3) Fig. 27 Western blot assay of the apoptosis protein (caspase-3) expression level in rabbit livers Fig. 28 Western blot assay of the apoptosis protein (Fas) expression level in rabbit livers Fig. 29 Western blot assay of the apoptosis protein (FasL) expression level in rabbit livers Fig. 30 Western blot assay of the apoptosis protein (Bcl-x) expression level in rabbit livers Fig. 31 Western blot assay of the apoptosis protein (P53) expression level in rabbit livers. 3.
(4) 表目錄 Table 1.. 兔子體重在 0, 2, 4, 6, 8, 12 週之變化. Table 2. 兔子 GOT 在 0, 2, 4, 6, 8,週之變化. Table 3. 兔子 GPT 在 0, 2, 4, 6, 8 週之變化. Table 4. 兔子 cholesterol 在 0, 2, 4, 6, 8 週之變化. Table 5. 兔子 TG 在 0, 2, 4, 6, 8 週之變化. Table 6. 兔子 HDL 在 0, 2, 4, 6, 8 週之變化. Table 7. 兔子 LDL 在 0, 2, 4, 6, 8 週之變化. 4.
(5) 摘要 粥狀動脈硬化的形成是心臟血管疾病一個重要疾病,而粥狀動 脈硬化主要是因為血液中膽固醇及低密度脂蛋白在血漿中的含量過 高,受到自由基氧化,形成氧化態的脂質,進而形成內皮增生及粥狀 動脈斑塊之現象。若能降低血中膽固醇、低密度脂蛋白及提高抗氧化 能力,則可以有效預防粥狀動脈硬化形成。因此本實驗的目的主要在 探討中藥山藥在高血脂中抗粥狀動脈硬化、抗氧化作用。本實驗利用 含有 2%山藥的膽固醇飼料,餵食體重約 2-3 公斤的紐西蘭白兔 12 週,分別於不同時間測量血液中膽固醇、低密度脂蛋白、自由基含量、 觀察主動脈粥狀動脈硬化情形、及測量組織內自由基含量及抗氧化酵 素之活性。結果發現膽固醇組血中膽固醇含量為 1522.5 mg/dl,山藥 組血中膽固醇含量為 700-740 mg/dl,統計上顯著下降之情形,其 P < 0.05,除了膽固醇外,血液中 LDL 含量也有明顯的差異;在主動脈 粥狀動脈硬化斑塊堆積方面膽固醇組堆積面積約 81%,山藥組堆積 約為 38%;在組織自由基含量方面,膽固醇組含量為 3989.36 ± 98.39,山藥組含量為 2869.83 ± 689.87,統計上 P<0.05 有顯著差異; 山藥可有效增加抗氧化酵素活性,例如:SOD、catalase,進而減低 粥狀動脈硬化之形成。根據實驗結果顯示山藥對於粥狀動脈硬化及抗 氧化具有良好的作用,對於應用在人體抗粥狀動脈硬化可提供進一步 探討。. 5.
(6) 英文摘要. New Zealand White (NZW) rabbits were assigned randomly into four dietary groups. The normal group was fed with regular rabbit chow and the cholesterol group was fed with a chow containing 0.5 % cholesterol. The Dioscorea Rhizoma (DR) group and the probucol group were fed with the same diet as the control group plus 2% DR or 200mg/kg/day probucol, respectively. The plasma level of total cholesterol and LDL were increased in the cholesterol group compared to the normal group, and decrease in the probucol group and DR group compared to the cholesterol group. The emzyme activities of SOD and catalase were increased in the DR group as compared to the cholesterol group. Eighty-one percent of the intimal surface of the thoracic aorta was covered with atherosclerotic plaque in the cholesterol group but only 38 % of the surface was covered in the DR group. Therefore, the atherosclerotic plaque can be significantly reduced with subsequent prevention of atheroma formation. A 28 % increase in antioxidation activity was also noted, as measured by lucigenin -chemiluminscence and luminal- chemiluminscence. These results suggest that the antioxidant and antiatherogenic effects of DR can be useful in the prevention of the atherosclerotic formation.. 6.
(7) 前言 第一節、高血脂症(hypercholesteromic)及粥狀動脈硬化 (atherosclerosis)之關係 一、 高血脂症(hypercholesteromic) 人體脂肪代謝途徑為,攝入的脂質在小腸中會以乳糜微粒 的型式,運送到身體各部位(Fig. 1)。而在肝臟中多以及低密 度脂蛋白之型式運送利用. 1,2. 。體內的膽固醇,約有 2/3 是以. LDL 之形式存在,在 1970 年 Brown 和 Goldstein 指出 5,體內 的血液中超過三分之二的 LDL 的清除是由 LDL receptors 來調 節,清除的位置主要是在肝臟 1,LDL receptors 有極高的親和 力,當體內脂質接受器或 LDL receptors 缺乏時,LDL 清除的 比率會顯著地降低,身體總 LDL 的生成和清除的比率會比正 常高出很多,進而產生高血脂之情形。. Fig. 1 脂質代謝情形 二、 粥狀動脈硬化(atherosclerosis) 7.
(8) 當血中 LDL 濃度上升時,會使 atherogenesis 加速形成, 粥狀動脈硬化為一種漸進性之疾病 5,是一種脂質與發炎細胞 的聚積並伴隨著平滑肌細胞(smooth muscle cell)增生與細胞外 間質液分泌(extracellular matrix secretion)所引起的細胞內膜纖 維變性(intimal fibrosis)。在早期,粥狀動脈硬化發展的過程 中,單核細胞(monocytes)會向內皮的表面黏著(adhesion)。這 種黏著現像是由存在於白血球與內皮細胞的黏著分子 (adhesion molecules)互相作用而形成的(Fig. 2)。內皮細胞粘著 分子的作用可由單核細胞、巨噬細胞、T 淋巴球所分泌的細胞 漿(cytokines)如: Interlukin-1,Interlukin-4,interfiron-? (干擾 素-?),Tumor Necrosis Factor (TNF) 所啟動。單核細胞與內皮 表面黏著之後,會移動到內皮下間隙(subendothelial space), 分化成常駐的巨噬細胞(resident macrophages)。T 淋巴球早期 也會粘著並穿透內膜組織 5, 16。. Fig. 2 LDL 氧化情形 (Nature 2000; 407(14): 233-241) 8.
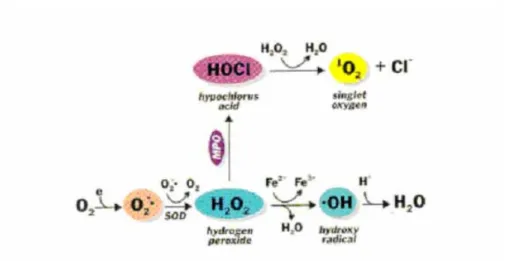
(9) 第二節、自由基(Free radical)之簡介 氧在生命中的地位非常重要,氧氣通過血液迴流運往全身以 滿足細胞呼吸之用,但少部分氧分子在粒腺體內氧化,伴隨? 生 氧自由基,它們在人體內到處遊離,活躍且富於攻擊性。自由基 是指在電子軌域中具有一個或多個不對稱的分子、原子或離子, 則稱之為自由基。當一個分子有不對稱的電子圍繞在外層軌域上 時,會迅速的與周圍的分子碰撞而引起化學變化,進而引起傷害 18. 。在正常情況下,自由基能保護身體免受微生物、細菌等有害. 物質侵害,但是當自由基過量時,情況就大不一樣,它會攻擊細 胞,促使蛋白質、核? 酸、脂肪的代謝異常,細胞? 生突變而引 起疾病。 一、 自由基之種類: 體內細胞所產生的活性氧(reactive oxygen species, ROS),是 一群具有強氧化力的含氧分子,包括超氧化陰離子(superoxide anion,O2-),過氧化自由基(hydorxyl radical,OH-)、以及過氧化 氫(hydrogen peroxide)等. 20, 21, 22. 。自由基具不成對電子其化學活性. 很活潑、不穩定,很容易去找一個電子配對,使之穩定,因此產 生氧化還原反應 18。生物細胞內多種氧化反應及代謝途徑都會產 生具有活性的氧分子,因此生物體常會遭受到活性氧分子之威 脅。當生物體老化或環境惡劣時,粒線體電子傳遞鍊進行不順利 時,其電子會在途中被氧分子作用形成超氧自由基 21。若超氧自 9.
(10) 由基與過氧化氫自由基同時存在,則會產生毒性更強的氫氧自由 基 24。自由基有下面幾種: 1、. 超氧自由基(Superoxide, O2-):O2-是所有耗氧生物都會 產生的型式,當細胞吞噬外來物或與免疫複合物接觸時 也會產生。而 O2-為最早產生的自由基,其半衰期非常 短暫,且較少直接對生物體造成傷害,但超氧自由基會 引發連鎖反應產生其他自由基,進而對生物體造成嚴重 傷害 27, 28。. 2、. 過氧化氫自由基(Hydrogen peroxide, H2O2):過氧化氫與 其他自由基不同,其為一非常安定物質,若以原狀態存 在,並不會造成太大傷害,但過氧化氫容易通過細胞 膜,與體內的微量金屬(鐵或銅)離子發生 Fenton 反應, 而形成殺菌力非常強的氫氧自由基。雖然過氧化氫安 定,但在體內時間過長,分解出的氫氧自由基越多,破 壞心臟冠狀動脈或動脈細胞;或產生過氧化脂質,而降 低心臟心肌的功能 29。. 3、. –. 氫氧自由基(Hydroxyl radical, OH ):其主要來源有二: (1) O-2 與 H2O2 經過鐵離子催化後產生的;(2) H2O 經過 其他過渡性金屬離子依賴性的 Fenton reaction 反應而產 生的。主要會造成脂質過氧會進而破壞細胞,並會與醣 類、氨基酸、磷脂質、核糖體等反應,造成嚴重傷害。. 10.
(11) 特別也會和 DNA 中的 purine 及 pyrimide 作用,造成細 胞突變或死亡 26。 4、. 過氧化脂質(Lipid peroxide):此種為最多自由基反應 物。當不飽和脂肪酸被自由基氧化後,會造成一連串反 映並產生極多的自由基。而過氧化脂質可在斷裂為其他 自由基,形成有害的醛類,如脂質的代謝物 malondialdehyde (MDA)等。細胞構造為脂質雙層,若細 胞膜上不飽和脂肪酸遭受到氧化,則可能導致細胞膜失 去功用。而過氧化脂質也會直接影響蛋白質或和酸,進 而造成細胞變性及死亡的情形 25。. 二、 體內抗氧化系統: 體內抗氧化反應系統,由抗氧化? 和多種抗氧化劑組成(Fig. 3)。抗氧化? 主要有超氧化物歧化? (Zn-Cu superoxide dismutase, SOD)、麩胱甘? 過氧化? (glutathione peroxidase)、catalase 和過 氧化氫? (Hyarogen peroxidase)等. 31. ,抗氧化劑主要包括維生素. E、維生素 C、β -胡蘿蔔素、還原型谷胱甘? 等,此外尿酸、膽 紅素,蛋白等也具有一定的抗氧化活性。這些抗氧化? 和抗氧化 劑有機的結合在一起,把氧自由基轉化成殺傷力比較不強的東 西,使組織細胞免於受損。. 11.
(12) Fig. 3 自由基及抗氧化之關係 第三節、 高血脂症及粥狀動脈硬化與自由基之關係 自由基可反映細胞在生理或病理情況下,細胞功能之變化, 如細胞膜電位變化、細胞內氧化還原代謝、胞器完整性、細胞內 鈣離子流動、pH 值變化、酵素活性改變、乃至於細胞死亡。 Steinberg et al. (1990). 32. 提出 Ox-LDL 在體外對粥狀動脈硬. 化有潛在的重要性質。氧化低密脂蛋白(oxidative modification of LDL, ox-LDL)是膽固醇被巨噬細胞吞噬,和造成細胞內對膽固醇 之堆積的必要條件。LDL 是大分子量蛋白質、apolipoprotein B、 中 性 和 極 性 脂 質 (neutral and polar lipids)和 親 脂 性 抗 氧 化 物 (lipophilic antioxidants)如:維生素E和 ß 胡蘿蔔素的複合物。 Jessup et al. (1990) 33 指出 LDL 氧化主要是經由一個自由基反應的 過程,其脂質被過氧化作用 (lipid peroxidation) 轉換成脂氫過氧 化物,之後再被分解成不同的產物,包括 malondialdehyde (MDA) ,4-hydroxynonenal 等 3。Rosenfeld et al. (1990) 34 認為 lipid peroxidation 和 lipid peroxidation 的產物在導致粥狀動脈瘤之啟始 12.
(13) 作用過程中,扮演著一個重要的角色。當 ox-LDL 或其產物,會 阻礙含氮氧化物(nitric oxide, NO)所調節之冠狀動脈擴張,而高膽 固醇血症(hypercholesterolaemia)會在內膜產生更多的 ox-LDL 或 在易氧化的環境下,使內皮細胞釋放出更多的超氧陰離子 (superoxide anion, O2-),結果則造成在沒有明顯傷害時也可能會造 成血管痙攣或收縮。Ox-LDL 會改變動脈壁的特性而造成臨床上 之疾病,其會刺激組織釋出因數並造成凝血(initiate coagulation)。 因為血管受傷處之週圍,會產生斑塊破裂(plaque rupture),造成 栓塞,在傷害處有許多含有 ox-LDL 之泡沫細胞(foam cell)。因此 除了巨噬泡沫細胞(macrophage foam cell)之形成以外,ox-LDL 也 是促成粥狀動脈硬化之因素 12。. LDL 氧化的初期產物會產生許多效應,等到巨噬細胞能辨識 ox-LDL 之時,在某些地方已存在產生粥狀動脈硬化因數。因此 巨噬細胞之吞噬作用也具有保護作用。但有太多的 ox-LDL 堆積 時則會造成不可逆的傷害,而導致細胞死亡並釋放出不溶解脂蛋 13.
(14) 白(insoluble lipid-protein),而形成粥狀動脈瘤(atheroma) 3。. 第四節、高血脂症及粥狀動脈硬化與抗氧化之關係 Colles et al. (2001) 37 在其動脈疾病方面的研究中指出,導致 這些血管受損最早是因為 LDL 氧化,而不是 LDL 聚集在血管 中。最近研究指出,脂蛋白的氧化造成細胞死亡其機制可能是經 由細胞凋亡(apoptosis)或細胞壞死(necrosis),或是細胞本體之毒 素(toxin)所引起的傷害。Stehbens et al. (1999). 22. 超氧自由基、過. 氧化氫自由基、氫氧自由基… 等,都屬於 reactive oxygen species (ROS) ,當體內 ROS 上升時,加上血液中的膽固醇含量增加時, 體內 LDL 含量濃度也會明顯上升,LDL 即會遭受到 ROS 的攻 擊,形成 ox-LDL,Ross R. (1999) 45 指出此種氧化態的 LDL 會促 使與血管內皮的黏著因數分泌增加,並促使 macrophage 進行吞 噬作用,進而形成泡沫細胞,造成許多黏著因數、ox-LDL、白 血球、單核球堆積,產生粥狀動脈斑塊及粥狀動脈硬化。. Subrahmanyam et al. (1996). 59. 體內抗氧化酵素增加時,可. 以減少脂質氧化產物增加,如:可抑制 MDA 產生,減少 LDL 受到自由基破壞,使 ox-LDL 減少,進而改善粥狀動脈硬化之情 形。. 14.
(15) Fig. 4 膽固醇、粥狀動脈斑塊及自由基之關係 第五節、細胞凋亡與粥狀動脈硬化之關係 增生、增殖(Proliferation) 和細胞凋亡(apoptosis)是血管平滑 肌細胞(VSMCs)造成粥狀動脈硬化、血管再阻塞及高血壓的兩個 重要因數。Pei-Feng et al. (1997) 指出不同氧的反應種類 VSMCs 會有不同的影響,例如超氧陰離子其會造成細胞增生;H2O2 會 引起 apoptosis。因此 ROS 會參與粥狀動脈硬化之形成,而粥狀 動脈硬化在 O2- 及 H2O2 的影響下,刺激 proliferation 和引發 VSMCs 的 apoptosis。 Apoptosis 是一個維持體內環境平衡,及個體生長發育的一個 重要因素。細胞可藉由表面接受器接收來自細胞外的死亡訊號。 在 Apoptosis 過程中,有多種 caspase 會轉為活化型,並具有蛋白 質分解之能力。過量的 caspase 表現會誘導細胞引發 Apoptosis, 例如:DNA 斷裂或細胞核濃縮等等。而與粥狀動脈硬化相關之 15.
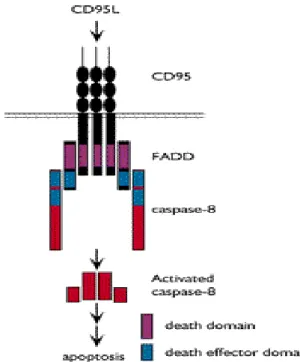
(16) Apoptosis 基因相關的有 Fas、FasL、RIP、FADD… 等。 Fas 又稱 Apo-1 或 CD95,其與 TNF-receptor 為同一家族, 一般表現在標的細胞之細胞膜上( traget-cell membrane)。當粥狀 動脈斑塊形成時,體內 FasL 會大量表現。而 FasL 與 Fas 結合後, 會進入細胞膜而活化 pro-caspase-8, pro-caspase-8 一般是不具活 性,當受到活化後,會轉變成具活性 caspase-8, 進 而 刺 激 pro-caspase-3 變成 caspase-3,隨即進入細胞核促使細胞進行凋 亡。Schneider et al. (2000) 39 指出,在粥狀動脈硬化患者內皮中測 量之 FasL 有過度表達之情形,而其所造成的傷害包括動脈粥狀 硬化之細胞如:SMCs,T cell, macrophages,和 endothelial cells (ECs),另外 FasL 若在組織有高度的表現,可能會造成類似免疫 缺乏及肝功能不良之情形 39, 41。. Fig.6 Fas 及 FasL 之機轉圖 (Arteriosclerosis, Thrombosis & Vascular Biology 2000, 20(2):298-308). 16.
(17) Fig. 6 中可知到 FasL 機轉之主要為增加 intimal SMC 累積 和保護 ICAM - 1 表現:首先, FasL 以 autocrine 模式可能使 ECs 產生, 導引 mitogenic 或者 chemotactic molecules 分泌。 二、ECs 旁邊的 FasL 表現可能引起 T-cell apoptosis , 且這些 apoptotic T cells 可能釋放 mesenchymal growth factors 。三、ECs 的 mitogenic 或者 SMCs 釋出 chemotactic effects 可能可溶解 FasL 39。. Fig. 6 Fas 及 FasL 之過程. p53 是一種 tumor-suppressor protein,Ira Tabas(2001). 42. P53. 主要為 antiproliferative 及 proapoptotic 之作用,當細胞受到壓力 時,例如:DNA 受傷、缺氧、脂蛋白氧化時,都會造成 P53 受 到抑制而降低。P53 與粥狀動脈硬化的研究,最早是在 (1999) Guevara et al.. 44. 利用 P53 及 apolipoprotein E 缺乏的老鼠,與單只. 有 apolipoprotein E 缺乏的老鼠,餵食高膽固醇食物 6、10、15 週 17.
(18) 後,發現兩者缺乏的老鼠其傷害程度增加 50-100%,則表示在無 P53 的情況下,粥狀動脈硬化的表現較明顯。因此在粥狀動脈硬 化的病人身上,其表現情形是下降的。. Fig. 7 P53 及 Atherosclerosis 關係圖. 第六節、山藥(Dioscorea batatas Decne)的簡介 薯芋科(Dioscoreaceae),別名:山薯、薯蕷、田薯、大薯、 淮山;其味甘性平,是一味藥食兼用、滋補強壯的保健佳品。它 既能補脾肺腎之氣,又能滋養脾肺腎之陰,為氣陰雙補之要藥。 同時還有抗衰老,增強機體免疫功能,降血糖等多方面的藥理作 用。臨床上對脾虛泄瀉、食少便溏、腎虛腰痛、肺虛久咳、肥胖. 18.
(19) 等頗有良效。脾腎為先後天之本,脾腎虧虛,則必然虛勞贏瘦, 皮枯肌少,皺紋叢生 58,, 59。 本實驗所用山藥為長形山藥:其成分含 16%為澱粉、3%是 蛋白質,另外含有薯蕷皂元 (Diosgenin)、類固醇皂元結構、粘液 質(mucin)、尿囊素 (allantoin)、膽鹼(choline)、纖維素、脂肪、維 生素 A、B1、B2、C 及鈣、鐵、磷、碘等礦物質。類固醇皂元結 構:為合成重要醫療用類固醇(Medicinal steroids)的原料在人體的 腸內轉為脫氫表雄甾酮(Dehydroepiandrosterone, DHEA),DHEA 是人體製造雌激素,睪丸素及其他荷爾蒙的前導物,DHEA 可能 對幫助預防及緩和一般與老化有關的健康問題有正面作用。薯蕷 皂元能增加精力和幫助控制壓力及含有七種人體必需胺基酸,含 量最多之胺基酸是 Glutamic acid,具有抗炎、平喘、降低膽固醇 及抗腫瘤的生理活性作用,可抑制細胞突變作用,是合成激素性 藥物的原料,另有擴張冠狀動脈、增加冠脈流量、改善微循環及 輕度抗凝作用。尿囊素能促進細胞活化,使潰瘍面和傷口癒合, 可和其他藥配合治療胃潰瘍。粘液質含有許多糖蛋白質,含有消 化酵素,可提高人體內的消化能力,滋補身體。澱粉? 能刺激胃 腸道運動,促進胃腸內容物排空,因此有助消化作用 57, 58, 59, 60。. 19.
(20) Fig. 7 長形山藥 (Dioscorea batatas Decne). 20.
(21) 實驗目的 粥狀動脈硬化是一種進行性之疾病,體內的 LDL 上升,是造 成粥狀動脈硬化的主要危險因數。當 LDL 產生氧化後,巨噬細胞會 進行吞噬作用,粥狀動脈斑塊也逐漸形成,進而產生粥狀動脈硬化情 形。若可以將 LDL 氧化情形降低,對於粥狀動脈硬化的產生則有下 降情形。粥狀動脈硬化的氧化假說是非常合理的假說,但只是一個假 說,且它對人類的重要性還有待進一步證實。流行病學上的資料發現 服用抗氧化維生素和冠狀動脈疾病(CAD)的罹患率呈反比的關係。 山藥在中藥中具有抗氧化之效果,但目前對於山藥抗氧化機 轉尚未明瞭,因此在本實驗中,利用山藥做進一步研究。 本篇主要利用兔子引發高血脂,觀察在高血脂兔子中,山藥 抗粥狀動脈及抗氧化之效果及機轉。針對不同時間測量血中生化值、 自由基,並於第 12 週將兔子犧牲,利用組織測量主動脈血管粥狀動 脈斑塊堆積情形,及利用肝臟組織測量自由基含量、基因表現情況, 及其抗氧化酵素之活性,例如:GSH、SOD、catalase… 等。. 21.
(22) 實驗材料與方法. 第一節、誘導高血脂症兔子之動物模式 本實驗所使用之動物為購買自台灣省家畜衛生試驗所動物用 藥品檢定分所之純種紐西蘭白兔(New Zealand white rabbit, NZW rabbit)。NZW rabbit 皆為 6 週大,體重約為 1.5 公斤。飼養於動 物中心,給予 12 小時照明 12 小時黑暗環境,室內溫度約維持於 25±2℃。每天餵食 100mg 的飼料,飲水則不予控制,共飼養 12 週。於第 0 週開始餵食含有膽固醇飼料,以此種方式誘導正常兔 子具有高膽固醇血症,最後形成粥狀動脈硬化的動物模式。 A 藥物 膽固醇 (Fluka, Switzerland) probucol (衛達, Taiwan) 山藥 (東倫,Taiwan) 玉米油 (台糖, Taiwan) B 步驟 將兔子隨機分成四組,每組 4 隻,給予不同飼料,敘述如 下: 第一組:餵食正常兔子飼料 第二組:餵食含 0.5%膽固醇飼料 第三組:餵食含 0.5%膽固醇加 2%山藥 (100mg/kg/day) 第四組:餵食含 0.5%膽固醇飼料加 probucol 22.
(23) (200mg/kg/day). 第一組的兔子餵食正常飼料為對照組;第二組給予含 0.5%膽 固醇飼料為高膽固醇對照組;第四組則給 0.5% 膽固醇飼料加 probucol (200mg/kg/day),視為 positive control group。 0.5%膽固醇飼料配置方式如下:利用小火將 10 ㏄玉米油燒熱 後,加入 0.5g 膽固醇,使其溶解於玉米油中,再加入 100g 一般 兔子飼料充分攪拌均勻即可。另外加有山藥、西藥(probucol)之飼 料則為小火將 10 ㏄玉米油燒熱後,加入 0.5g 膽固醇,依不同劑 量加入油中,使其溶解於玉米油中,再加入 100g 一般兔子飼料 充分攪拌均勻即可。. 第二節、測量兔子血清中之 cholesterol、 triglycerides、GOT、 GPT、 HDL、 LDL 的含量 A 儀器 全自動生化分析儀 Smartlab (EREA, U.S.A.) B 試劑 — Cholesterol reagent; FL (Chema DIAGNOSTICA, Italy) — Triglycerides reagent; FL (Chema DIAGNOSTICA, Italy) — GOT/AST reagent; FL (Chema DIAGNOSTICA, Italy) — GPT/ALT reagent; FL (Chema DIAGNOSTICA, Italy). 23.
(24) — HDL Cholesterol reagent; FL (Chema DIAGNOSTICA, Italy) — LDL Cholesterol reagent; (Biocon DIAGNOSTICA, Germany) C 步驟 抽血前兔子需禁食約 6-8 小時。利用 10 ㏄ 23G 注射針筒 由兔子耳動脈採血,取血後靜置約 2 小時,以 3000rpm 離心 10 分鐘,取得血清。取 300µl 血清放入生化分析儀,並放入 膽固醇試劑. (Cholesterol reagent) 、 三 酸 甘 油 脂 試 劑. (Triglycerides reagent)、GOT 試劑(GOT/AST reagent)、GPT 試 劑(GPT/ALT reagent),即可測得 cholesterol、TG、GOT、GPT 值。高密度脂蛋白(HDL)之測量,取血清與 HDL Cholesterol reagent 以 1:1 比例混合後靜置 5 分鐘,以 3000g (5791rpm) 離心 10 分鐘後,取上清液 300µl 放入生化分析儀,並放入膽 固醇試劑(Cholesterol reagent),可得到 HDL 值。低密度脂蛋 白(LDL)將血清與 LDL Cholesterol reagent 以 1:10 比例混合 後靜置 10 分鐘,4000rpm 離心 15 分鐘後,取上清液 300µl 放入生化分析儀,並放入膽固醇試劑(Cholesterol reagent),可 測得一數值,將 total cholesterol 量減去此數值得到結果即為 LDL 含量。. 第三節、測量兔子血液中之超氧自由基含量 24.
(25) A 儀器 自由基分析儀 Small animal Sample Chamer for CLD-110 (Chemiluminescence, Tohoku, JAPAN) B 試劑 — 1X PBS KH2PO4. 0.2586g. K2HPO4. 1.8487g. NACL. 8.0647g. KCL. 0.2013g Add doubly distilled water to 1 litter. — 1000µM Luminal (SIGMA, U.S.A.) — 25µM Lucigenin (SIGMA, U.S.A.) — Zymosan (SIGMA, U.S.A.) C 步驟 採全血約 3 ㏄放入含 Heparin tube 以錫箔紙包好並冰浴。 測量空白值:取兔子全血 200µl 及 100µl PBS 放入自由基分析 儀中,利用波長激發,每 10 秒鐘記錄一次血中光子數目持續 1020秒。測量過氧化氫自由基含量:取兔子全血 200µl及 100µl PBS 放入自由基分析儀中,每 10 秒鐘記錄至 200 秒時加入 1000µM Luminal 1 ㏄,持續測量到 600 秒時再加入 Zymosan 200µl,測量過氧化氫自由基至 1020 秒。測量超氧自由基含 量:取兔子全血 200µl 及 100µl PBS 放入自由基分析儀中,每 25.
(26) 10 秒鐘記錄至 200 秒時加入 25µM Lucigenin 1 ㏄,持續測量 到 600 秒時再加入 Zymosan 200µl,測量超氧自由基至 1020 秒。數值分析方法是將自由基值減空白值後除以全血中白血 球數目,即可得到自由基相對值。. 第四節、測量兔子肝臟中之超氧自由基含量 A 儀器 自由基分析儀 Small animal Sample Chamer for CLD-110 (Chemiluminescence, Tohoku, JAPAN) 均質機 Polytron (IKA,U.S.A) B 試劑. — Tris-sucrose buffer Tris-Hcl. 3.152 g. Sucrose. 85.575 g. EDTA (ethylenediaminetetra-acetic acid) 0.37224 g Add doubly distilled water to 1 litter — Luminal (SIGMA, U.S.A.) 0.0025 g in 500 ml dd water (pH: 7.4) — TBHP (SIGMA, U.S.A.) C 步驟 取 2g 組織加入 Tris-sucrose buffer 2cc,利用均質機於 4℃ 以 5.5 ×1000 rpm 均質 30 秒,將均質液離心 400g 於 4℃下 30 分鐘,取出上清液,此時需予避光冰浴。取上清液 0.4ml 加 26.
(27) 入 Luminal 0.2ml 於 37℃培養 10 分鐘。 利用自由基分析儀,將儀器設定為每 10 秒讀取一次,共 1000 秒。培養液放入儀器中,先跑 100 秒,再加入 TBHP 0.1ml, 跑至 1000 秒即可。數值分析方法是將自由基值除以蛋白質含 量,即可得到自由基相對值。. 第五節、測量兔子血液中紅血球抗氧化之程度 A 儀器 水浴鍋 water bath (Taiwan) 分光光譜儀 BECKMAN INSTRUMENTS SPECTROPHOTOMETER Du-600 SERIES (BECKMAN COVLTER U.S.A.) B 試劑 — 1X PBS KH2PO4. 0.2586g. K2HPO4. 1.8487g. NaCl. 8.0647g. KCl. 0.2013g Add doubly distilled water to 1 litter. — Na2HPO4 — AAPH (SIGMA, U.S.A.) C 步驟. 27.
(28) 採全血約 3 ㏄放入含 EDTA tube 以錫箔紙包好並冰浴,將 water bath 加水淹過容器 1/2,加熱至 37℃,取 1 ml 一倍 PBS 放入避光容器中,放入 0.1 ml 全血,加入 1 g AAPH in 15 ml of 10mM Na2HPO4 soln. 1ml,加蓋後 shake 90 str/min,於 10 分 鐘後各取出 0.2 ml 放入含 2.5 ml H2O 及 2.5 ml PBS 試管中, 分別於 30 分、60 分、90 分、120 分、150 分、180 分、210 分、各取出 0.2 ml 放入含 2.5 ml PBS 試管中,並冰浴避光, 於 4℃離心 2000 rpm 10 分鐘後放於室溫 15 分鐘,利用 spectrophotometer 540 nm 測得。 計算方式: Sample 100%lysis-1 100%lysis-2. 10. 30. 60. 90. 120. 180. 210. Sample-1. 0.5674. 0.5675. 0.0056 0.0035 0.0067 0.0145 0.0338 0.1064 0.1416. Sample-2. 0.5605. 0.599. 0.0051 0.004 0.0079 0.0151 0.0374 0.1147 0.156. 將 100%lysis-1 及 100%lysis-2 平均,將上表 Sample-1 與 Sample-2 的 10. 30. 60. 90. 120. 180. 210 除以 100%lysis 之平 均後乘以 100 即可得到下表之數字,將下表數字製作成曲線 圖,即可觀察出 hemolysis 之關係。 Reagent. 10. 30. 60. 90. 120. 180. 210. Sample-1 0.0056 0.0035 0.0067 0.0145 0.0338 0.1064 0.1416 Sample-2 0.0051. 0.004. 0.0079 0.0151 0.0374 0.1147. 第六節、兔子肝臟蛋白質(抗氧化酵素)之萃取 28. 0.156.
(29) A 儀器 均質機 Polytron (IKA,U.S.A) B 試劑 — Sucrose (MERCK, U.S.A.) — Ethanol (MERCK, U.S.A.) — 1X PBS buffer KH2PO4. 0.2586g. K2HPO4. 1.8487g. NACL. 8.0647g. KCL. 0.2013g Add doubly distilled water to 1 litter. — Triton X-100 C 步驟 SOD、GSH 之萃取:取肝臟組織放於 0.25 M sucrose buffer (4 w/v),利用均質機於 4℃以 5.5 ×1000 rpm 均質 10 秒,利 用 10000g 於 4℃離心 60 分鐘後,取出上清液冷藏於-80℃備 用。. Catalase 之萃取:取 肝臟組織放於 0.25 M sucrose buffer (4 w/v),利用均質機於 4℃以 5.5 ×1000 rpm 均質 10 秒,利用 700g 於 4℃離心 10 分鐘後,取上清液加入 0.17 M ethanol 混 合後,放於冰上培養 20 分鐘,取 1 ㏄混合液加入 100 µl PBS buffer (內含 100 ml Triton X-100/L) ,取出上清液冷藏於-80℃ 29.
(30) 備用。. 第七節、測量兔子肝臟中 SOD 之含量 A 儀器 分光光譜儀 BECKMAN INSTRUMENTS SPECTROPHOTOMETER Du-64B SERIES (BECKMAN COVLTER U.S.A.) B 試劑 — Xanthine (SIGMA, U.S.A.) — DETAPAC (SIGMA, U.S.A.) — Bovine serum albumin (BSA) — Nitroblue tetrazolium (SIGMA, U.S.A.) — BCS (SIGMA, U.S.A.) — Xanthine oxidase (SIGMA, U.S.A.) — Na2CO3 (pH:10.2) C 步驟 Cu/Zn SOD:將 xanthine 0.3 mmol/1 litter、 EDTA 0.6 mmol/1 litter、BSA 1g/L、nitroblue tetrazolium (NBT) 150µmol/1 litter、 dsiodium bathocuproine disulfonate (BCS) 250µmol/1 litter、xanthime oxidase 1ku/g 及 Na2CO3 (pH:10.2) 40mmol/1 litter 混合均勻後,加入 Liver homogenat supernatant 0.1 ml (200-500µg protein),於 37℃培養 20 分鐘後,加入 0.8 mmol/1 litter CuCl2,利用 spectrophotometrically at 560 nm 持續測量 30.
(31) 20 分鐘。. 第八節、測量兔子肝臟中 Catalase 之含量 A 儀器 分光光譜儀 BECKMAN INSTRUMENTS SPECTROPHOTOMETER Du-64B SERIES (BECKMAN COVLTER U.S.A.) B 試劑 — 1X PBS (PH 7.4) KH2PO4. 0.2586g. K2HPO4. 1.8487g. NaCl. 8.0647g. KCl. 0.2013g Add doubly distilled water to 1 litter. — 50 mM PB buffer (PH 7.4) NaH2PO4.H2O Na2HPO4.12H2O. 6.9g 17.9g. Add doubly distilled water to 1 litter — 30mM H2O2 (SHOWA, Japan) H2O2. 3.0603g Add doubly distilled water to 300 ml. C 步驟 取 Liver homogenat supernatant 0.1 ml (200-500µg 31.
(32) protein),加入 1.9 ml of 50mM phosphate buffer 混合後,加 入 1.0 ml of 30 mM H2O2,mixture,利用 spectrophotometrically at 240 nm 持續測量 30 秒。. 第九節、測量兔子肝臟中 GSH-Px 之含量 A 儀器 分光光譜儀 BECKMAN INSTRUMENTS SPECTROPHOTOMETER Du-64B SERIES (BECKMAN COVLTER U.S.A.) B 試劑 — 1X PBS (PH 7.4) KH2PO4. 0.2586g. K2HPO4. 1.8487g. NaCl. 8.0647g. KCl. 0.2013g Add doubly distilled water to 1 litter. — 75 mM PB buffer (PH 7.4) NaH2PO4.H2O. 10.35g. Na2HPO4.12H2O. 26.85g. Add doubly distilled water to 1 litter — 60mM Glutathion (SIGMA, U.S.A.) — 30 U/ml Glutathion reductase (SIGMA, U.S.A.) — 15 mM EDTA (SIGMA, U.S.A) 32.
(33) — 3 mM NADPH (SIGMA, U.S.A.) — 7.5 mM H2O2 (SHOWA, Japan) C 步驟 取 Liver homogenat supernatant 50-200µl (200-500µg protein),加入 phosphate buffer 20 ml of 75 mM、glutathion 50µl of 60mM、glutathion reductase 0.1ml of 30 U/ml、disodium salt of EDTA 0.1 ml of 15mM、NADPH 0.1 ml of 3mM 及 0.3-0.45 ml of H2O 混合後,取 3.0 ml 加入 0.1 ml of 7.5 mM H2O,利 用 spectrophotometer 340 nm 測量 4 分鐘。. 第十節、兔子肝臟蛋白質(Western Blot)之萃取 A 儀器 均質機 Polytron (IKA,U.S.A) Sonicater B 試劑 — Sheer′s buffer 50 mM Hepes (pH 7.5). 50 ml. 150 mM Nacl. 75 ml. 1 mM EDTA. 1 ml. 2.5mM EGTA. 2.5 ml. Tween 20. 0.5 ml. Glycerol. 50 ml Add doubly distilled water to 0.5 litters 33.
(34) C 步驟 取 Liver 約 0.5×0.5×0.5 cm,加入 500 µl sheer′s buffer 剪 碎,利用均質機將組織均質,用 sonicater 將細胞震破,來回 三次,利用 13000 rpm 在 4℃時離心 10min,取上清液。. 第十一節、兔子肝臟蛋白質之定量 A 儀器 DU Series 500 Spectrophotometer (Beckman, U.S.A) B 試劑 — Bradford reagent (BIO-RAD, U.S.A) — Bovine serum albumin (BSA) C 步驟 先將 Spectrophotometer暖機 30分鐘後,分別以 0. 5. 10. 15. 20. 25 µg /的蛋白質標準品 (BSA),製作。測出將標準曲線 後,將所萃取到的蛋白質萃取液取 10µl 加入二次水 790µl 中 混合均勻,再加入 Bradford reagent 200µl反應 1-2 分鐘後,放 入石英管中利用 595nm 波長測定吸光值。. 第十二節、蛋白質電泳(SDS-PAGE) A 儀器 Mini VE complete (Hoefer, U. S. A) Power supply (Hoefer, U. S. A) B 試劑 34.
(35) — 1.5M Tris (pH 8.8) Tris. 9.086 g Add doubly distilled water to 50 ml Adjust pH to 8.8 with 12N HCl. — 1.5M Tris (pH 6.8) Tris. 6.057 g Add doubly distilled water to 50 ml Adjust pH to 6.8 with 12N HCl. — 30% Acri/Bis — 10%APS — 10% SDS. SDS. 4g Add doubly distilled water to 40 ml. — Running Buffer Tris. 12 g. Glycine. 57.6 g. SDS. 4g Add doubly distilled water to 4 L. — Transfer Buffer Glycine. 86.4 g. Tris. 18.2 g. Methanol. 1200 ㏄ Add doubly distilled water to 6 L. 35.
(36) — PBST Add 0.1% Tween 20 to 1X PBS — 5% fat free Milk. Fat free milk 2.5 g Tween 20. 50µl Add 1X PBS to 50 ml. — Rainbow Marker (Amersham, U.S.A) — 0.1% Commassie blue Coomassie brillant bule. 0.25g. Methanol. 45 ml. Glyaceial acetic acid. 10 ml. Add doubly distilled water to 100 ml — Destain buffer Methanol. 10 c.c. Acetic acid. 10 c.c. Add doubly distilled water to 100 ml — Dry buffer Methanol. 20 c.c. Glycerol. 0.6 ml. Add doubly distilled water to 100 ml C 步驟 SDS-PAGE 是由 stacking gel 及 separating gel 所構成。取 含有 80µg 蛋白質萃取液與 5X dye 及 Running Buffer 混合使 其總量為 20µl,於 95℃下加熱 5 分鐘。取反應後之蛋白質, 36.
(37) 將蛋白質分別加入膠中,並加入 Marker 8µl,利用 100V 跑電 泳約 2 小時。2 小時後取下膠,進行 Transfer。將 Transfer 後 的膠以 0.1% Commassie blue 染色約 20 分鐘,後以 destain buffer 脫色,利用 dry buffer 及玻璃紙將脫色完畢的膠風乾保 存。. 第十三節、西方點墨法(Western Blot) A 儀器 Mini VE blotter (Hoefer, U. S. A) Power supply (Hoefer, U. S. A) B 試劑 — Membrane — 3M papers — First Ab: anti-Apoptosis — Second Ab:Anti-mouse — X-ray flim (Kodak, Taiwan) — Developer (Kodak, Taiwan) — Fixer (Kodak, Taiwan) — Methanol (MERCK, U.S.A.) — ECL C 步驟 將跑完的 SDS-PAGE 的膠取下,進行 Transfer,取海綿撲 於底層,將 3M paper 以 Transfer buffer 潤濕後鋪平於海綿上, 37.
(38) 平鋪上膠,取 membrane 先以 Methanol潤濕再覆蓋於 3M paper 上,在於 membrane 上蓋上 3M paper 及海綿,和上轉漬夾, 利用 50V 進行 2 小時 30 分的轉漬。將轉漬好的 membrane 以 5% fat free milk 之 PBST buffer 於 37℃下 blocking 一小時, 後將 membrane 放入含有 First Ab anti-apoptosis 之 PBST buffer 於 4℃反應隔夜。利用 PBST 將與 First Ab anti-apoptosis 反應完的 membrane 清洗 3 次,一次約 20 分鐘,後與 PBST buffer 內加入 Second Ab,於 37℃下反應 1 小時。再以 PBST buffer 清洗 3 次,每次 20 分鐘。. 第十四節、Sudan IV 染色法 A 儀器 Shake (Taiwan) B 試劑 — Methanol (MERCK, U.S.A.) — Sudan IV (SIGMA, U.S.A.) — 1X PBS (PH 7.4) KH2PO4. 0.2586g. K2HPO4. 1.8487g. NaCl. 8.0647g. KCl. 0.2013g Add doubly distilled water to 1 litter 38.
(39) — Urethane C 步驟 將餵食約 12 週後的兔子利用 Urethane (1000mg/Kg)以靜 脈注射方式麻醉後,將其犧牲由取出主動脈至胸主動脈之血 管,清除血管周圍外膜及脂肪組織,將處理過後的血管以縱 向方式切開。將切開的血管放入 Sudan IV (2% w/v)溶於 100 %Methanol,染色約 3 分鐘,再依 100%、90%、80%、70%、 60% Methanol 及 PBS 去染後攤平於培養皿上。Sudan IV 為一 種嗜脂性之染料,會與脂肪結合而產生紅色斑塊,在利用電 腦數位元元影像分析軟體分析其動脈硬化斑塊與血管面積之 比值,依此依據評估山藥是否可改善粥狀動脈硬化之情形。. 第十五節、平滑肌細胞培養 A 儀器 Incubator B 試劑 — Rat smooth muscle of thoracic aorta — DMEM (Dulbeco’s Modified Eagle Medium, Gibco, USA) — DMSO (Dimethy1Sulfoxide, Sigma, U.S.A.) — FBS (Fetal Bovine Serum) (Biowest, France) — Trypsin (Gibco, U.S.A.) — 1X PBS (PH 7.4) 39.
(40) KH2PO4. 0.2586g. K2HPO4. 1.8487g. NaCl. 8.0647g. KCl. 0.2013g Add doubly distilled water to 1 litter. — 75% alcohol — probucol (衛達, Taiwan) —山藥 (東倫,Taiwan) C 步驟 先將 1X PBS、DMSO、medium… 等放入 37℃水域槽回 溫,以 75% alcohol 消毒雙手、工作臺及所有物品。 取以培養的 SMC,先利用顯微鏡觀察,需長至八分滿後 才可使用,加入 1 ㏄ tripsin 均勻後放回含 5% CO2 /95% O2 incubator 5 分鐘後,加入等量含有 10%FBS 之 medium,利 用 pipette 來回沖吸,將所有細胞吸至血清瓶中,並每盤加入 10 ㏄ 10%FBS 之 medium,Mix 均勻後,計算細胞數。推算 公式為: 計算總數 / 5 * 2 * 104 = 細胞總數 細胞總數 / 稀釋後總體積 = 3.5 * 104 ~ 4 * 104 (每盤細胞 數) / X (每盤欲加入體積) 每 well 按算出的體積加入,並補至 2 ㏄放入含 5% CO2 /95% O2 incubator overnight (24 hr),取出細胞,開 pump 將 40.
(41) DMEM 部分用 pipette 吸去,以 1X PBS 清洗兩次,加入含有 0.5%FBS 之 medium 於 5% CO2 /95% O2 incubator 24 hr。取 出細胞,吸除之 DMEM 部分,加入含有 15%FBS 之 medium, 並分別加入藥物,每組需三重複,在 5% CO2 /95% O2 incubator 24 hr 後即可收細胞,保存於 -20℃以下備用。. 第十六節、MTT 分析 A 儀器 ELISA Incubator B 試劑 — Rat smooth muscle of thoracic aorta — DMEM (Dulbeco’s Modified Eagle Medium, Gibco, USA) — DMSO (Dimethy1Sulfoxide, Sigma, U.S.A.) — FBS (Fetal Bovine Serum) (Biowest, France) — Trypsin (Gibco, U.S.A.) — 1X PBS (PH 7.4) KH2PO4. 0.2586g. K2HPO4. 1.8487g. NaCl. 8.0647g. KCl. 0.2013g Add doubly distilled water to 1 litter 41.
(42) —MTT (Sigma, U.S.A.) — Isopropanol — 75% alcohol — probucol (衛達, Taiwan) —山藥 (東倫,Taiwan) C 步驟 先將 1X PBS、DMSO、medium… 等放入 37℃水域槽回 溫,以 75% alcohol 消毒雙手、工作臺及所有物品。 取以培養的 SMC,先利用顯微鏡觀察,需長至八分滿後才 可使用,加入 1 ㏄ tripsin 均勻後放回含 5% CO2 /95% O2 incubator 5 分鐘後,加入等量含有 10%FBS 之 medium,利 用 pipette 來回沖吸,將所有細胞吸至血清瓶中,並每盤加入 10 ㏄ 10%FBS 之 medium,Mix 均勻後,計算細胞數。 利用 96 well 培養盤,每 well 放入約 1.0 * 104 細胞數/ 100 μl,放入含 5% CO2 /95% O2 incubator overnight (24 hr),取 出細胞,開 pump 將 DMEM 部分用 pipette 吸去,以 1X PBS 清洗兩次,加入含有 0.5%FBS 之 medium 於 5% CO2 /95% O2 incubator 24 hr。取出細胞,吸除之 DMEM 部分,加入含有 15%FBS 之 medium,並分別加入藥物,每組需三重複,在 5% CO2 /95% O2 incubator 24 hr 後,吸去 medium 以 1X PBS 清洗兩次,加入 100μl 之 MTT incubator 3 hr,吸去液體並加 入 isopropanol 100μl 或 DMSO 100μl,shaker 15 分鐘,利用. 42.
(43) 570nm 比色。. 第十七節、DNA 萃取 A 儀器 均質機 Polytron (IKA,U.S.A) Pasteur pipette 分光光譜儀 BECKMAN INSTRUMENTS SPECTROPHOTOMETER Du-64B SERIES (BECKMAN COVLTER U.S.A.) B 試劑 — 1X PBS (PH 7.4) KH2PO4. 0.2586g. K2HPO4. 1.8487g. NaCl. 8.0647g. KCl. 0.2013g. Add doubly distilled water to 1 litter — Lysis buffer 0.2 % Triton X-100 10 mM EDTA 20 mM Tris. Hcl Add doubly distilled water to 1 litter (pH:8.0) — Proteinase K (BOEHRINGER MANNHEIM, U.S.A) — BHT (SIGMA, U.S.A.). 43.
(44) — 酚:氯仿:異戊醇 (phenol:chlorhorm:isoamyl alcohol) = 25:24:1 (USB, U.S.A) — 氯仿 (chlorform ) (TEDIA,U.S.A) — 醋酸鈉 (Sodium Acetate Trihydrate) (Fisher Scientific) — 95% 冰乙醇 (MERCK, U.S.A.) — 70% 乙醇 (MERCK, U.S.A.) — Tris. HCl (pH=7.4) (USB, U.S.A) — RNase A (BM, German) — RNase T1 (BM, German) — HPLC water (MERCK, U.S.A.) C 步驟 取 1.5g 組織置於 10ml PBS 中,利用平均磨碎後,放入離 心機中 3200rpm,4℃離心 10 分鐘後,將液體部份倒掉,留 下 pellet 於離心管中;加入 Lysis buffer 10mL,加入 50µl 的 Proteinase K 及 50µl 的 BHT 溶液,置於水浴槽中以 150rpm、 37℃之條件反應隔夜。出樣本,於每管中加入等體積的酚: 氯仿:異戊醇=25:24:1 的溶液,進行萃取,下混合後, 放入離心機中 3200rpm,4℃離心 10 分鐘後,以 Pasteur pipette 小心吸取上層溶液至有相同標示的新離心管,此步驟重覆一 次;第二次取出之溶液中加入等體積的氯仿,一樣將之混合 均勻並且以相同條件離心 10 分鐘。取出上清液至新的離心 管,並且加入 0.1 倍體積的 3M 醋酸鈉溶液,及兩倍體積的冰. 44.
(45) 乙醇,上下搖晃混合使 DNA 沈澱出來,小心將 95%的冰乙 醇倒出。再加入濃度為 10mM 的 Tris Cl 3mL,然後將樣本放 入 shaking incubation 中反應隔夜。取出樣本,並且加入 RNase A 20µl 以及 RNase T1 25µl,放入 shaking incubation 中反應一 小時,加入等體積的氯仿,3200rpm,4℃離心 10 分鐘後,取 出上清液至新的離心管,並且加入 0.1 倍體積的 3M 醋酸鈉溶 液,及兩倍體積的冰乙醇,上下搖晃混合使 DNA 沈澱出來, 小心將 95%的冰乙醇倒出,最後加入 0.5 ㏄ DEPC water 使 DNA 溶於的水中,於 4℃下反應隔夜,取出液體置於 1.5 ㏄ 離心管中保存在 -20℃以下,以便跑膠使用。. 第十八節、DNA 定量 A 儀器 DU Series 500 Spectrophotometer (Beckman, U.S.A) B 試劑 — HPLC water (MERCK, U.S.A.) C 步驟 利用 260/280 nm 測量,先取 dd H2O 歸零,取 HPLC water 990µl 與 50µl 混合均勻後,放入 Spectrophotometer 測量。計 算方式: UD260 * 50 * 20 * 0.5 = Total DNA. 45.
(46) 第十九節、DNA 電泳分析 A 儀器 Power supply (Hoefer, U. S. A) Gel Electrophoresis Apparatus (GIBCOBRL, U.S.A.) B 試劑 — 1X TBE buffer (GIBCOBRL, U.S.A.) — Agarose (GIBCOBRL, U.S.A.) — 5X DNA dye — Ethidium bromide (Sigma, U.S.A.) C 步驟 配置 2 %agarose gel 於 1X TBE 中,將 agarose 加熱溶 解,趁熱加入微量 Ethidium bromide,到入膠台中,靜置冷卻, 取 sample 每一 sample 含 10µg DNA,與 5X DNA dye 2µl混合 均勻,加入 gel 中,於 4℃下以 50V 跑電泳 5-6 小時,利用 UV 燈照相裝置拍照。觀察 apopttosis 情形。. 第二十節、統計分析法 實驗結果以 mean ± SE 表示各項值,各組間差異以 ANOVA 統計後比較。圖中*表示與膽固醇組相比 P < 0.05,P < 0.05;#表示與 normal 組相比,P< 0.05。在表中**是與膽 固醇組相比 P < 0.05,皆為具有統計差異。. 46.
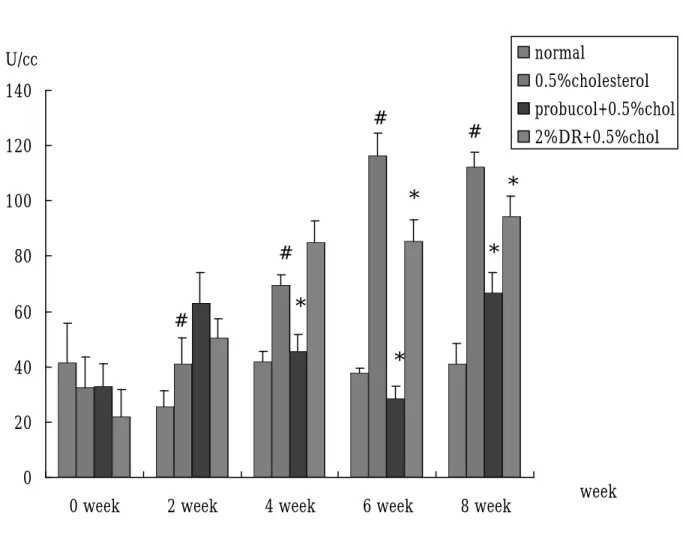
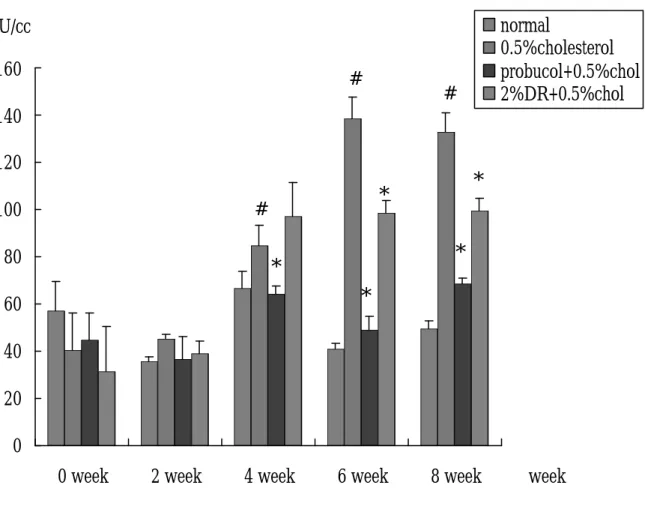
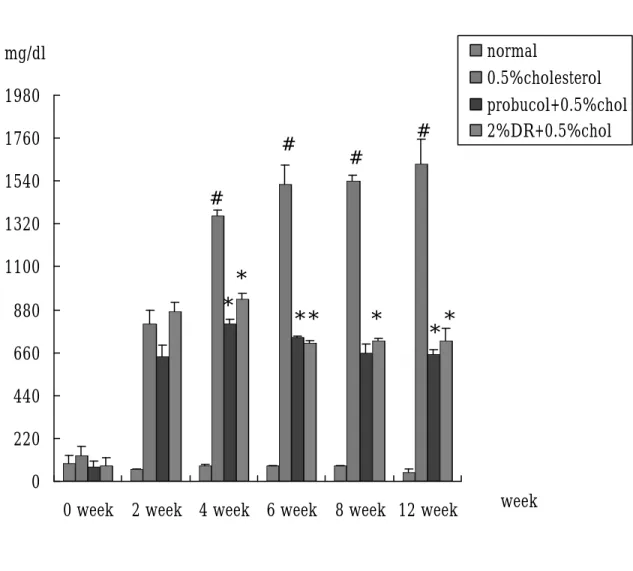
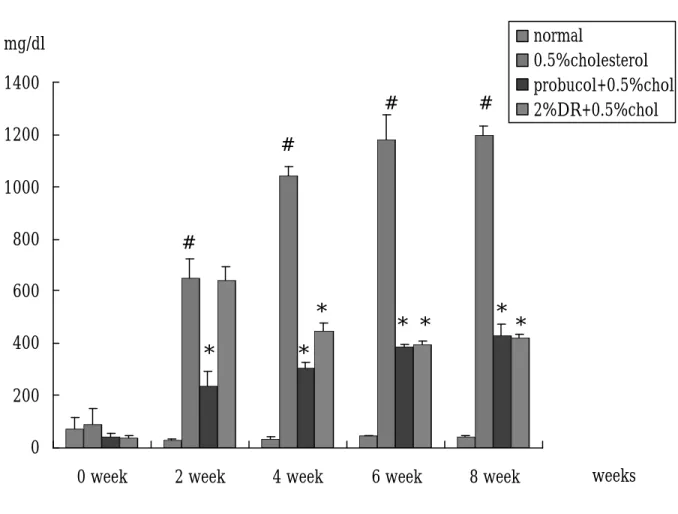
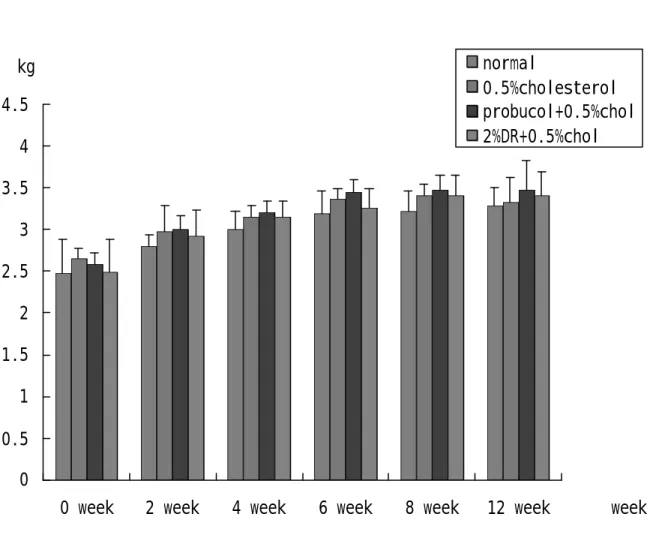
(47) 結果 第一節、兔子體重之結果 四組兔子分別給予不同飼料,在體重的變化上,不論是第 0 週、第 2 週、第 4 週、第 6 週、第 8 週、第 12 週,其體重約為 2.5-3 kg,相比較後其 P > 0.05,無統計學上差異,表示兔子在進 食方面沒有問題,每天 100 g 的飼料皆有吃完。(Fig 7,Table 1). 第二節、兔子血清生化值之結果 1、. 在肝功能方面:(Fig. 8, table. 1) GOT 之變化,在 0 週其各組血液中 GOT 並無明顯差異,在. 第 2、4、6、8 週時與各組 normal 組相比皆有有顯著之情形。第 4 週時,膽固醇與山藥組 GOT 漸漸上升,但並無統計上差異;當 8 週時, probucol 之組別其 GOT 也出現上升之情形。GPT 方面 (Fig. 9, table. 2) ,normal 組約為 40-60 U/㏄,從第 4 週開始與膽 固醇組相比有顯著差異;probucol 組中,可觀察到,0、2 週時血 液中 GPT 則無明顯差異,但到了第 4 週、第 6 週時與膽固醇相比 有顯著較低之情形產生。山藥組的部分第 6、8 週與膽固醇組相 比有顯著下降之情形,其 P < 0.05 具統計差異。. 2、. Cholesterol 方面:(Fig. 10, table. 3) Cholesterol 在第 0 週時,其血液膽固醇含量約 50-100mg/dl,. 將第 2-12 週的血清稀釋 3 倍後測量,所得到的值在第 2 週 normal 47.
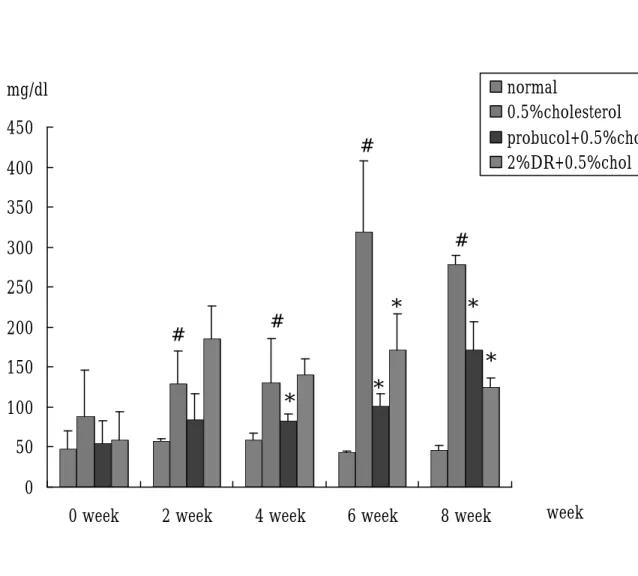
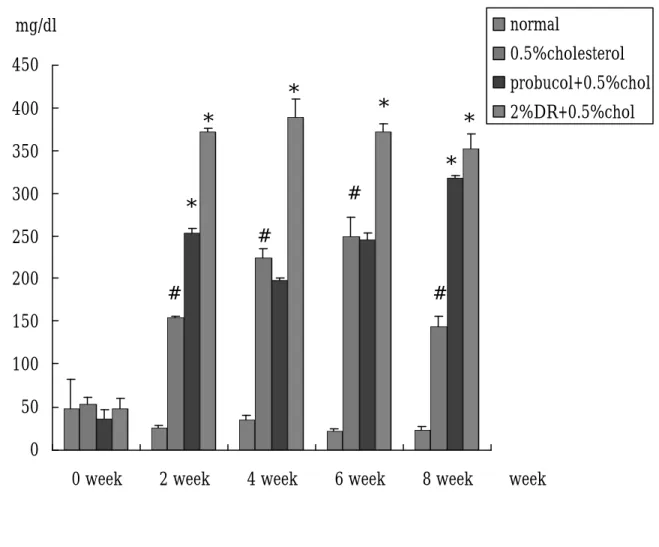
(48) 為 61.475 mg/dl;膽固醇組方面所測得到約 806.75 mg/dl;probucol 得到值約為 641.75 mg/dl,山藥治療後則可使血中膽固醇 873.5 mg/dl 左右,但與膽固醇相比則無顯著差異。第 4 週血中膽固醇 值分別為 normal 組 49.725 mg/dl,probucol 組為 809.75 mg/dl,山 藥組為 933.75 mg/dl, 膽固醇組為 1360.5 mg/dl,經過統計後發 現 probucol 及山藥治療後與膽固醇相比 P < 0.05 ,有顯著差異。 在第 6 週 normal 組其膽固醇濃度為 78.95 mg/dl,probucol 及山藥 組約為 700-740 mg/dl,膽固醇組之數據為 1522.5 mg/dl,統計後 發現,而 probucol、山藥組及 normal 組與膽固醇相比,也有顯著 下降之情形,其 P < 0.05。在第 8 週及第 12 週時,不論是 normal、 probucol、山藥或膽固醇組,其血漿中膽固醇之含量,皆與第 6 週相似。. 3、. Triglyceride 的變化:(Fig. 11, table. 4) 在 TG 方面,0、2 週膽固醇、probucol 組及山藥並無顯著差. 異。在第 4 週時 probucol 組與週膽固醇組相比較,含量有較低情 形,而膽固醇組及山藥組,則與 0 週情形相似。第 6 週時血漿中 的 TG 含量之變化則與 4 週類似。到了第 8 週,probucol 組與山 藥組與膽固醇組比, P<0.05,有顯著下降的情形出現。. 4、. LDL:(Fig. 14, table. 7) LDL 在第 0週中,probucol及山藥組其血中 LDL含量與 normal 48.
(49) 組或膽固醇組相比較都有偏高情形;而在餵食後第 2 週 normal 與膽固醇相比較,血中 LDL 含量則較低;probucol 與膽固醇比較, 其 LDL 含量也有顯著下降之情形。第 4、6、8 週,可觀察到膽固 醇組血中 LDL 上升情形以到達 1000-1200 mg/dl,與其他組別相 比較,則有非常明顯升高之趨勢。其在統計學上 P < 0.05 有顯著 差異。而 probucol 及山藥組,從第 4 週起血中 LDL 濃度大約維 持在 400 mg/dl 左右,與餵食膽固醇之兔子相比,則有顯著降低 之情形。. 5、. HDL:(Fig. 13, table. 6) 在 HDL 方面,可由 Fig. 13 中發現,第 0 週時血液中的 HDL. 含量約為 40-60 mg/dl;而為食後第二週起,山藥組因飲食中也具 有 0.5%但膽固醇,因此其 HDL 含量與膽固醇組相比並無顯著差 異。到第八週時,經過probucol 治療後其血中 HDL 含量約為 80-90 mg/dl,山藥組及膽固醇組其 HDL 含量約為 80-100 mg/dl,。. 第三節、兔子血液中超氧自由基之結果 在血液中自由基之部分,利用 luminal 及 lucigenin 來測量血 液中白血球釋放自由基能力,觀察超氧化自由基及過氧化氫自由 基含量之變化。Luminal 用來觀察過氧化氫自由基,lucigenin 則是 測量超氧化自由基。在 luminal 方面,第二週給予膽固醇或給予山 藥治療之組別,其血中利用 luminal 所測量出的自由基與 0 週或當 49.
(50) 週 normal 相比則有上升趨勢,probucol 方面則只與 0 週相比有上 升約 2 倍情形;第四週血液中自由基變化為:其各組間差異變化 則無統計差異;第八週時,山藥組其血液中的自由基則有上升約 2-2.5 倍。而在 lucigenin 方面則不論第 0. 2. 4. 6. 8.週,在血液中無 明顯變化。(Fig. 14-15). 第四節、兔子肝臟超氧自由基之結果 於第 12 週將兔子犧牲後,利用肝臟組織觀察組織自由基之 變化情形。肝臟自由基中可由 Fig. 16 中可觀察到給予山藥治療組 大約是 3000 count,probucol 治療後其組織自由基為約為 2000 count,兩組與膽固醇組的 4000-4500 count 組織自由基相比,其 P < 0.05,在統計學上則有顯著差異。(Fig. 16). 第五節、兔子血液中紅血球抗氧化之結果 在 0 週時 (Fig. 17),normal 組之抗氧化效果較不理想,在 10 分鐘時,其氧化比例以達到 25%左右,而其餘的膽固醇組、 probucol 組及山藥組大約在第 120 分中時才達到氧化程度約 25 %,normal 組到 210 分鐘時,其氧化程度已到 98%,與膽固醇組 及 probucol 組的 40-55%相比,其氧化程度有偏高情形,但與山藥 組的 80%相比則是相似情形。在 Fig. 18 中可看到第二週的變化, 膽固醇組在第 90 分鐘其氧化程度已達 72%,但 normal 組及 probucol 組在 90 分鐘其氧化程度只有 20-25%,山藥組其氧化比 50.
(51) 例約為 56%,可觀察到膽固醇組氧化比例及速率比 normal 組及 probucol 組高出 2-3 倍。第四週在圖 19 中,可看到在 120 分鐘時 normal 組、膽固醇組及 probucol 組其紅血球氧化程度達到 45-50 %左右,但山藥組在 120 分鐘時紅血球氧化比例則達到 71%。第 六週 normal 組在 90 分鐘時,其紅血球氧化比例只有約 6%,同一 時間膽固醇組、probucol 組及山藥組其氧化比例為 20-40%,但到 150 分鐘時膽固醇組已有 90%氧化情形產生,但 normal 組、 probucol 組及山藥組則只有約 50-60%氧化情形產生(Fig. 20)。第 八週雖然在 210 分鐘 normal 組氧化達 95%,但在 120 分鐘時膽固 醇組紅血球氧化比例已達一半,而 normal 組、probucol 組及山藥 組紅血球約有 30-40%產生氧化情形。當到 150-180 分鐘時,膽固 醇組氧化程度約為 70%左右,但 normal 組、probucol 組及山藥組 約為 60%左右,所以,雖然 normal 組最後紅血球氧化比例達 95 %,但其氧化時間較晚,膽固醇組雖然在 210 分鐘時氧化比例達 80%,但在 120-150 分鐘時其紅血球氧化程度則已達到 70%。. 第六節、兔子肝臟中抗氧化酵素含量結果 在 SOD 方面:從 Fig. 22 可觀察到,在 normal 組的組織中 SOD 含量約為 20 U/mg protein,在 probucol 治療組其含量有明顯 上升之情形,含量大約為 140-160 U/mg protein,與 normal 組或 膽固醇相比是有顯著差異的;在山藥治療之兔子,其肝臟內含的 SOD 約為 40-60 U/mg protein,與 normal 組或膽固醇相比也有升 51.
(52) 高之情形,在統計上具有顯著差異的;在膽固醇組中 SOD 含量 約為 10 U/mg protein。 在 GSH 方面:由 Fig. 23 中可觀察到,餵食膽固醇 12 週後, 其肝臟組織中的 GSH 活性為 2.5µmoles /min /mg protein 與 normal 組的 0.5-1 相比較有顯著上升現象;在給予 2%山藥及 probucol 治療組中可明顯看到,山藥組組織中 GSH 活性約為 0.5-1µmoles /min /mg protein 與膽固醇相比較,則有降低之情形;而給予膽固 醇經山藥治療之兔子,其 GSH 量則與 normal 組相似。(Fig. 23) 在 catalase 方面:在 Fig. 24 中,發現在山藥組以及 normal 組組織中 catalase 含量相似,約為 0.03-0.04 U/ mg protein,和膽 固醇組 0.01 U/ mg protein 相比較具有顯著的上升情況;但是在 Probucol 組中僅對於餵食 normal 的組別呈現下降的情況,其含量 約為 0.01-0.02 U/ mg protein,然而與膽固醇的組比較卻是沒有差 異性的。(Fig. 24). 第七節、兔子肝臟中 apoptosis 基因表現之結果 在 apoptpsis 中,Fas 的表現 (Fig. 27),在 normal 組表現最 顯著,經由影像分析後得到,設 normal 組的表現為 100;則 Probucol 組表現為 103.57;膽固醇組的表現幾乎沒有為 8.85;山藥組的表 現為 93.8;因此可知 normal 組為膽固醇組的 11.3 倍;Probucol 組 為膽固醇組的 11.72 倍;山藥組為膽固醇組的 10.6 倍。在 caspase-3 (Fig. 26)的表現則以膽固醇組最為明顯,經由影像分析後可觀察 52.
(53) 到,normal 組的表現為;Probucol 組表現為;膽固醇組的表現幾 乎沒有;山藥組的表現為;而 Fig. 28 的 FasL 在 normal 組表現最 顯著,經由影像分析後得到,可知 normal 組為膽固醇組的 56.50 倍;Probucol 組為膽固醇組的 54.67 倍;山藥組為膽固醇組的 42.8 倍;在 Bcl-x 方面,也是以 normal 的表現最為明顯,而膽固醇則 只有些微之表現(Fig. 29);P53 經由影像分析後得到,normal 組的 表現為 100;則 Probucol 組表現為 87.14;膽固醇組的表現為 26.95;山藥組的表現為 56.98;因此可知 normal 組為膽固醇組的 13.7 倍;Probucol 組為膽固醇組的 3.23 倍;山藥組為膽固醇組的 2.11 倍(Fig. 30)。. 第八節、平滑肌細胞培養之結果 細胞培養方面,以 0.5% medium 為一般正常情形,15% medium 為促進增生,給予藥物治療後發現,probucol 組不論濃度 為 1/5、1/10、1/100,其細胞生長之情形並未受到抑制;而在山藥 之部分,給予濃度 1/100 時,細胞存活情況良好,當給予 1/10 時, 細胞則有逐漸邁向死亡之情況產生,而濃度 1/5 時,其細胞幾乎呈 現死亡狀態。 MTT 之部分以下表為例:1、2 欄代表給予含 0.5%FBS 之 medium;3、4 欄代表給予含 15%FBS 之 medium;5、6 給予含 15 %FBS + probucol (10μg / 1cc)之 medium;7、8 給予含 15%FBS + probucol (1μg / 1cc)之 medium;9、10 給予含 15%FBS + DR(0.002g 53.
(54) / 1cc)之 medium;11、12 為給予含 15%FBS + DR(0.0002g / 1cc) 之 medium。 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. A. 1.227 1.155 1.236 1.156 1.478 1.557 1.593 1.342 0.019 0.086 0.807 0.764. B. 1.104 0.564 1.076 2.157 1.894 1.463 1.816 1.782 0.010 0.053 0.910 0.903. C. 1.444 1.482 1.792 1.990 1.634 1.715 1.538 2.022 0.023 0.098 0.971 0.954. D. 0.908 0.814 1.718 1.875 1.274 1.592 1.410 1.377 0.020 0.079 1.177 0.817. E. 1.636 1.278 1.899 2.159 1.834 1.972 1.408 1.511 0.022 0.109 1.148 1.057. F. 1.055 1.076 0.625 0.782 0.980 1.231 1.761 1.606 0.052 0.132 1.194 0.743. G. 1.465 1.113 0.940 0.921 1.521 2.091 1.612 1.543 0.089 0.140 1.065 0.770. H. 0.984 1.027 1.545 1.221 1.427 1.467 1.337 1.535 0.121 0.145 1.049 0.837. 以 control 為分母,實驗組為分子,計算結果若>1,表示增 生情形越明顯,若越小則表示增生受到抑制,計算結果:15%為 1.252;probucol (10μg / 1cc) 為 1.3;probucol (1μg / 1cc) 計算結 果為 1.14;DR(0.002g / 1cc) 計算結果為 0.05;DR(0.0002g / 1cc) 結 果為 0.74。. 第九節、DNA 電泳之結果 DNA 電泳方面,只有在膽固醇組中可以明顯看到有 apoptosis ladder 情形,其餘組別則較不明顯。. 第十節、Sudan IV 染色之結果 Fig. 25、26 在 Sudan IV 染色方面,主要是觀察粥狀動脈斑 塊堆積之情形。飼養 12 週後,normal diet 組,其主動脈血管之粥 54.
(55) 狀動脈斑塊形成情形幾乎沒有。在給予 probucol 治療後的組別, 其粥狀動脈斑塊堆積之百分比大約為 10-15 %;而給予 2 %山藥 治療組,其堆積百分比約為 40 %;而在餵食 0.5 % cholesterol 之兔子中,其粥狀動脈斑塊堆積比例約為總面積的 90 % ,因此 給予山藥治療後其可減低粥狀動脈斑塊堆積比例約為 38 %。在 Fig. 29 中# 表與正常組相比 P < 0.05,+ 表與 0.5% cholesterol 組 相比 P < 0.05,在統計學上具有顯著差異。. 55.
(56) 討論 兔子血清生化值 在肝功能方面:. 1、. 在 0、2 週其血液中 GOT、GPT 並無明顯差異,表示兔子 在還未餵食膽固醇前,其肝臟功能是正常的,當餵食兩週後, 肝臟功能還屬正常範圍,可能因為高膽固醇血症剛形成,肝 臟仍有能力應付高血脂的情形。但到了最後時,除了 normal 組其他之 GOT、GPT 都有上升情形,表示山藥及 probucol 無 法完全恢復肝臟之功能。 Cholesterol 方面:. 2、. 利用兔子引發高脂血症的動物模式以非常普遍,在本實 驗第 0 週時,其血液膽固醇含量約為 50-100 mg/dl,當餵食膽 固醇之後,probucol 及 2%山藥組其膽固醇含量上升比例約為 6-8 倍,而給予膽固醇組之兔子,血中膽固醇濃度高達 1700 mg/dl,表示經過餵食後兔子以成功誘發高血脂情形。 為了正確起見,我們將 cholesterol 之標準品稀釋 1 、2 及 3 倍後,得到 Fig.之圖形,其所得值為線性關係,曲線之 R2 = 0.9997,表示其稀釋後呈現性關係。另外,我們也將 normal 組做稀釋,所測得值約為 14.9 mg/dl ,推算後得到膽固醇濃 度為 44.7 mg/dl。若以上述數值加以統計後則發現,經過 probucol 或山藥治療後則可使血中膽固醇濃度降低到 500-900 mg/dl 左右,因此可降低血中但膽固醇含量約 2-3 倍。 56.
(57) 因為我們所測出之 data 皆大於標準品的 200 mg/dl,因 此我們再次檢定,將 sample 稀釋 10 倍後再做計算,發現其結 果與稀釋三倍時相似。另外,我們也取 abnormal control做試 驗,所得到結果也與其值相似,因此可證明,稀釋後測得到 的數據經推算是可相信的。. 200 ml/dl. 150 y = 63x + 0.5 R2 = 0.9997. 100 50 0 0. 3、. 1. 2. 3. 4. LDL、HDL: 之前有文獻指出 LDL 及 HDL 比值越高,其得到冠狀動 脈比例越低,而在膽固醇組中,其 HDL/LDL 比值為 0.06,給 予山藥比值為 0.2,中藥山藥組較膽固醇高,表示山藥可以提 高 TG 轉換成 HDL 之能力。就目前實驗結果中可發現,山藥 可降低粥狀動脈硬化形成, 2000 年有文獻指出 67,LDL 為血 管內皮膽固醇之堆積的必要條件,在 1994也有學者提 5 出 LDL 或脂質的氧化產物在導致粥狀動脈瘤之啟始作用過程中,扮 演著一個重要的角色。因此山藥組血液中 LDL 含量較膽固醇 組低,故粥狀動脈硬化產生情形有較改善之現象。 1998 年文獻指出 68,probucol 降低之譏轉可能經由抑制 57.
(58) 肝臟中的膽固醇 ester,probucol 在臨床上為一種降血脂藥 物,其不但可降低血中膽固醇,對於預防粥狀動脈硬化也 具效果。在 1986 年指出 69 probucol 可增強 LDL 分解率,在 本實驗中,所測到 LDL 含量與膽固醇組相比有顯著下降, 與先前研究報告相吻合。. 兔子血液中超氧自由基 血液中的 free radical 其存在時間非常短暫,當血液取 出後,自由基可能已消失,另外取出之血液佔動物全身血液 之極小部分,因此可能不易觀察出其差異性。. 兔子肝臟超氧自由基 在肝臟自由基方面,可由 Fig. 16 中觀察到,經過山藥 或 probucol 治療之組別,其組織自由基皆有下降之情形產生, 表示藥物具有清除自由基之能力,其路徑可能是經由增加抗 氧化酵素之活性,進而代謝體內過多有害之物質。. 兔子血液中紅血球抗氧化 在紅血球抗氧化方面,其並無顯著差異,因為在血液 中,抗氧化酵素以紅血球佔最多,而血液在體內流動,另外 抽血時取出之血液佔動物全身血液之極小部分,且抗氧化酵. 58.
(59) 素在體內仍然以肝臟最多,因此血液中可能不易觀察出差異 性。. 兔子肝臟中抗氧化酵素 SOD:山藥及 probucol 治療之 SOD 含量皆有上升情形, 而餵食膽固醇組含量則非常低;Subrahmanyam et al.(1996). 59. 指出,給予高膽固醇飲食後,再給予 probucol 治療其 SOD 含 量有顯著上升之情形。表示當餵食膽固醇後體內自由基有上 升趨勢,而經山藥及 probucol 治療後可增加體內抗氧化酵素, 主要則為了代謝因高膽固醇所引起的自由基。 GSH:在實驗的第 12 週後,其膽固醇組肝臟組織中的 GSH 活性為 2.5µmoles /min /mg protein,山藥組含量較低,其 原因可能為當山藥中的 SOD 上升,其將超氧自由基轉變為 H2O2,在將 H2O2 分解的路徑有二,一為經由 GSH,另一條路 徑為經由 catalase;在山藥其抗氧化路徑可能並非經由 GSH 代 謝體內自由基。 catalase:膽固醇組的 catalase 含量約為膽固醇組 0.01 U/ mg protein,在經山藥治療後,其含量含增加約 3 倍,表示山 藥具有增加抗氧化酵素之能力,且山藥的抗氧化路徑,其可 能經由 catalase 將過多的 H2O2 分解成 H2O 及 O2。. 兔子肝臟中 apoptosis 基因表現 59.
(60) 在 Schneider DB et al. (2000) 39 指出,內皮中過度的 FasL 表現會增加粥狀動脈硬化的傷害,但在肝臟部分尚未有相關 paper 發表。肝臟中的 Fas 表現為 normal 組表現最顯著,膽固 醇組的表現幾乎沒有;FasL 表現也與 Fas 相似。在 apoptosis 途徑中以 Fas 及 FasL 來說,當 Fas 與 FasL 結合後,會進行 apoptosis 之情形。因此在粥狀動脈硬化明顯之膽固醇組中, 因為細胞增生較多,相對的 apoptosis 之細胞則較少,表示膽 固醇組細胞增生情形較顯著。 在 caspase-3 的表現上,當 Fas 與 FasL 結合後會活化 caspase-8,進而刺激 pro-caspase-3 變成 caspase-3,在肝臟 Western blot 之結果中發現,在膽固醇組中,caspase-3 之表現 為下降之情形,表示其現象較其他組別少,對照前面 Fas 及 FasL 之結果,與 apoptosis 路徑表現相符合。 Ira et al. (2001) 42 指出 P53 為粥狀動脈硬化形成過程中 一個重要因數。P53 為腫瘤抑制因數,其主要是抑制細胞增生 作用。而在本實驗結果中發現,在 normal 組中其表現為增加 之現象,而膽固醇組之 P53 表現是下降之情形,其代表意義 為膽固醇組增生情形增加,而前面敘述中提到,粥狀動脈硬 化之 apoptosis 情形減少,因此相對的其增生情形可能增加, 經實驗證明後證實,粥狀動脈硬化之膽固醇組增生情形為增 加。. 60.
(61) Sudan IV 染色 餵食高膽固醇飲食的主動脈及胸主動脈其堆積的比例 可高達 90%,從 Fig. 及 Fig.25 可看到,經過山藥及 probucol 治療後期血管內皮脂質堆積的比例有明顯下降趨勢,參考結 果之生化值,給予山藥及 probucol 治療後其血中膽固醇含量 及 LDL 含量都有明顯下降情形;在抗氧化酵素方面給予藥物 治療後,其抗氧化酵素有上升情形,Holvet et al. (1995) 71, Heinecke (1998). 70. 指出 , Ox-LDL 會增加粥狀動脈硬化產生,. 推論至前面抗氧化酵素及血液生化 LDL 測量結果,山藥組不 但抗氧化酵素較膽固醇組上升,其血液中 LDL 含量也有較低 之情形。抗氧化酵素增加清除體內多於自由基,因此 LDL 受 到自由基氧化情形也相對較低,加上 LDL 含量又較少,因此 粥狀動脈斑塊堆積情形可獲得改善。. 平滑肌細胞培養 細胞培養所用的 15% medium 為促進增生,給予 probucol 不論劑量多少,並不會抑制平滑肌細胞增生,因為 Steinberg et al.. 69. 指出 probucol 對於粥狀動脈硬化之改善原因為:抑制. ox-LDL 產生,因此在增生抑制方面並無顯著差異。 一般中藥若用到細胞上,其濃度為口服劑量之 1/10,因 此在山藥面我們可以觀察到,給予 1/10 細胞存活數約 50%, 就單純看來似乎有抑制細胞增生效果,但因為山藥粉末內含 61.
(62) 許多澱粉、糖類,在溶解過程中並不容易,因此加入細胞後, 會有許多白色粉末之沈澱,因此死亡原因也可能是因為粉末 導致細胞無法吸收到養分。又因為山藥及 probucol 是利用 DMSO 溶解,因此又另外做一組只有給予高濃度 DMSO 做對 照,此組細胞生長情形良好,因此排除山藥組會受到之影響。 從 MTT assys 之結果中利用 0.5%為 control,可得知含 15%FBS 確實促進細胞增生,而給予 probucol 不論是 1/10 或 1/100,細胞增生情形仍不受抑制,1986 年學者提出,probucol 是經由降低 LDL 及增加抗氧化有關 69。在 DR 組別中,可明 顯得知不論給予 1/10 或 1/100 之組別,結果均<1,則其細胞 增生皆受到抑制作用。. DNA 電泳 DNA apoptosis ladder 中,只有膽固醇組有明顯 apoptosis 情形,但在肝臟 western 從 Fas、FasL 中並無觀察到其 apoptosis 之路徑產生,則可能原因為,膽固醇組之 apoptosis 並不經由 Fas 這條路徑,2000 年有學者指出 39,具有粥狀動脈硬化之病 患血管中會有大量 FasL 之表現,但就目前為止,對於肝臟及 粥狀動脈硬化之相關性並無相關文獻。 在山藥或 probucol組中雖然 apoptosis ladder 並不如膽固 醇組清楚,但一般來說,若無 apoptosis 情形產生其 DNA ladder 位於 Gel 起始處,但山藥或 probucol 其 DNA ladder 為於 Gel 62.
(63) 之下方,因此我們認為 apoptosis 之情形應該也是存在。. 63.
(64) 參考文獻 1. Daniel Steinberg, Sampath Parthasarathy, Thomas E. Carew, John C. Khoo, and Joseph L. Wiztum. Beyond cholesterol modifications of Low-Density Lipoprotein That Increase it’s Atherogenicity. The New England Journal of Medicine 1989; 320(14): 915-924. 2. Moghadasian MH, Mcmanus BM, Godin DV, Rodrigues B, Frohlic JJ. Proatherogenic and antiatherogenic effects of probucol phytosterols in apoliprotein E-deficient mice. Circulation 1999; 99: 1733-1739. 3. Witztum JL. The oxidation hypothesis of atherosclerosis. Lancet 1994; 344(8925): 793-795. 4. Edward M, Boyle Jr, Sean TL, Eric A, Alexander W, Clowes, Edward DV. Atherosclerosis. Ann Thorac Surg 1997; 64: S47-57. 5. Regnstrom J, Nilsson J. Lipid oxidation and inflammation-induced intimal fibrosis in Coronary heart disease. Journal of Laboratory & Clinical Medicine 1994; 124(2): 162-8. 6. Schwenke DC, Carew TE. Initiation of atherosclerotic lesions in cholesterolfed rabbits: I. Focal increases in arterial LDL concentrations precede development of fatty streak lesions. Arteriosclerosis 1989; 9:895-907. 7. Robert A. The pathogenesis of atherosclerosis. Clinica Chimica Acta 1996; 246: 21-38. 8. Witztum JL, Steinberg D. Role of oxidized low-density lipoprotein in atherogenesis. The Journal of Clinical Investigation 1991;. 64.
(65) 88:1785-1792. 9. Berliner JA, Navab M, Fogelman AM, Frank JS, Demer LL, Edwards PA, Watson AD, Lusis AJ. Atherosclerosis: basic mechanisms, oxidation, inflammation, and genetics. Circulation 1995; 91:2248-2496. 10. Navab M, Fogelman AM, Berliner JA, Territo MC, Demer LL, Frank JS, Watson, Andrew D; Edwards PA, Lusis AJ. Pathogenesis of Atherosclerosis. The American Journal of Cardiology 1995; 76(9): 18C-23C. 11. Charlotte L, Mark EA, Ann MM, Magdi Y, Marlene LR. Effects of cross-linking ICAM-1 on the surface of human vascular smooth muscle cells-induction of VCAM-1 but no proliferation. Cardiovascular Research 2001; 50: 547-555. 12. Esterbauer H, Waeg G, Puhl H, Dieber-Rotheneder M, Tatzber F. Inhibition of LDL oxidation by antioxidants. EXS. 1992; 62:145-57. 13. Loscalzo J. The oxidant stress of hyperhomocyst (e) inemia. The Journal of Clinical Investigation 1996; 98:5-7. 14. Nunes GL, Robinson K, Kalynych A et al. Vitamins C and E inhibit O2- production in pig coronary arteries. Circulation 1997; 96: 3593–3601. 15. Simon M, Goran H, Goran B, Olov W. Comparison of antioxidant activity in lipoprtein fractions from insulin-dependent diabetics and healthy controls. Atherosclerosis 1997; 129:89-96. 16. Aldons J. Atherosclerosis. Nature 2000; 407(14): 233-241. 17. John F, Keaney J. Atherosclerosis-from lesion formation to plaque 65.
(66) activation and endothelial dysfunction. Molecular Aspects of Medicine 2000; 21: 99-166. 18. Chesseman KH, Slater TF. An introduction to free radical biochemistry. British Medical Bulletin 1999; 49: 481-493. 19. Marui, N.; Offermann, N. K.; Swerlick, R.; Kunsch, C.; Rosen, A.; Ahmad, M.; Alexander, R. W.; Medford, R. M. Vascular cell adhesion molecule-1 (VCAM-1) gene transcription and expres-sion are regulated through an antioxidant-sensitive mechanism in human vascular endothelial cells. The Journal of Clinical Investigation 1993; 92: 1866–1874. 20. Scandalios JG. Oxygen stress and superoxide dismutase. Plant Physiol 1993; 101:7-12. 21. Scoott MG. The role of cholesterol management in coronary disease risk reduction in elderly patients. Endocrinology and Metabolism Clincs of North America 1998; 23(3): 655-675. 22. Stehbens WE. The oxidative stree hypothesis of atherosclerosis: cause or product? Medical Hypotheses 1999; 53(6): 507-515. 23. Susuki YJ, Forman HJ, Sevanian A. Oxidants as stimulators of signal transduction. Free Radical Biol Med 1997; 22:269–285. 24. Bowler C, Van MM, Inze D. Superoxide Dismutase abd stree tolerance. Annu Rev Plant Physiol Plant Mol Biol 1992; 43: 83-116. 25. Francisco BM, Alicia S, Manuel DL, Francisco R. Lipid peroxidation products in human subretinal fluid. Free Radic Biol Med 1996; 20: 899-903. 26. Steller H. Mechanisms and genes of cellular suicide. Science 1995; 66.
(67) 267: 1445-1448. 27. Fridovich I.Superoxide dismutase. Annu Rev Bolchem 1975; 44: 147-159. 28. Fridovich The biology of oxygen radicals. Science 1978; 201: 875-880. 29. Walling C. In oxidase and realated redox systems. Pergamon Press, Oxford 1982; 85-97. 30. Chakraborti T, Mandal A, Mandal M, Das S, Chakraborti S. Complement activation in heart diseases. Role of oxidants. Cell Signal 2000; 12(9-10): 607-17. 31. Fukai T, Galis ZS, Meng XP, Parthasaraathy S, Harrison DG. Vascular expression of extracellar superoxide dismutase in atherosclerosis. The Journal of Clinical Investigation 1998; 101:2101-2111. 32. Steinbrecher UP, Zhang H, Lougheed, M. role of oxidatively modified LDL in atherosclerosis. Free Rad Biol Med 1990; 9: 155-168. 33. Jessup W, Rankin SM, De Whalley CV, Hoult JRS, Scott J, Leake DS. Alpha-tocopherol consumption during low-density lipoprotein oxidation. Biochem Journal 1990; 265: 399-405. 34. Rosenfeld ME, Palinski W, Yla-Herttuala S, Butler S, Witztum JL. Distribution of oxidation specific lipid-protein adducts and apolipoprotein b in atherosclerotic lesions of varying severity from WHHL rabbits. Arteriosclerosis 1990; 10: 336-349. 35. Stanley L, Hazen. Forum:Role of oxidation in atherosclerosis: 67.
(68) oxidation and atherosclerosis. Free radical & Medicine 2000:28(12):1683-1684. 36. Schwartz SM, Heimark RL, Majesky MW. Developmental mechanisms underlying pathology of arteries. Physioogical Research 1990; 70:177-209. 37. Colles SM, Maxson JM, Carlson SG, Chisolm GM. Oxidized LDL-induced injury and apoptosis in atherosclerosis. Potential roles for oxysterols. Trends Cardiovasc Med 2001; (113-4): 131-138. 38. Li PF, Dietz R, von H. Differential Effect of Hydrogen Peroxide and Superoxide Anion on Apoptosis and Proliferation of Vascular Smooth Muscle Cells. Circulation 1997; 96(10): 3602-3609. 39. Schneider D B, Vassalli GWen S, Driscoll RM., Sassani AB, DeYoung MB, Linnemann R, Virmani R, Dichek D A. Expression of Fas Ligand in arteries of hypercholesterolemic rabbits accelerates atherosclerotic lesion formation. Arteriosclerosis, Thrombosis, and Vascular Biology 2000; 20(2): 298-308. 40. Bennett MR, Evan GI, Schwartz SM. Apoptosis of human vascular smooth muscle cells derived from normal vessels and coronary atherosclerotic plaques. The Journal of Clinical Investigation 1995; 95:2266–2274. 41. Bennett MR, Boyle JJ. Apoptosis of vascular smooth muscle cells in atherosclerosis. Atherosclerosis. 1998; 138:3–9. 42. Ira Tabas. P53 and Atherosclerosis. Circulation Researc. 2001; 88: 747-749. 43. Nagata S, Golstein P. The Fas death factor. Science 1995; 68.
(69) 267:1449–1456. 44. Guevara NV, Kim HS, Antonova EI, Chan L. The absence of p53 accelerates atherosclerosis by increasing cell proliferation in vivo. Nature medicine 1999; 5(3): 335-339. 45. Ross R. The pathogenesis of atherosclerosis: a perspective for the 1990s. Nature 1993; 362:801–809. 46. Schwartz SM, deBlois D, O’Brien ERM. The intima: soil for atherosclerosis and restenosis. Circ Res 1995; 77:445–465. 47. Han DKM, Haudenschild CC, Hong MK, Tinkle BT, Leon MB, Liau G. Evidence for apoptosis in human atherogenesis and in a rat vascular injury model. Am J Pathol 1995; 147: 267– 277. 48. Chaohong Li, Qingbo Xu. Mechanical stress-initiated signal transductions in vascular smooth muscle cells. Cellular Signaling 2000; 12: 435-445. 49. Ashkenazi A, Dixit VM. Death receptors: signaling and modulation. Science 1998; 281:1305–1308. 50. Brandes RP, Behra A, Lebherz C, Borer RH, Bode-Boger SM, Mugge A. Lovastatin maintains nitric oxide-but not EDHF-mediated endothelium-dependent relaxation in the hypercholesterolemic rabbit carotid artery. Atherosclerosis 1999; 142: 97-104. 51. Motoomi N, Shimako AB, Nokao K. Causal relationship between occlusive lesions of the coronary artery and myocardial fibrosis in arteriosclerotic rabbits --differences between cholesterol-fed and heritable hyperlipidemic rabbits. Atherosclerosis 1996; 124: 37-47. 52. Takashi Ito, Masashi Shiomi. Cerebral atherosclerosis occurs 69.
數據

相關文件
You are given the wavelength and total energy of a light pulse and asked to find the number of photons it
好了既然 Z[x] 中的 ideal 不一定是 principle ideal 那麼我們就不能學 Proposition 7.2.11 的方法得到 Z[x] 中的 irreducible element 就是 prime element 了..
The A-Level Biology Curriculum aims to provide learning experiences through which students will acquire or develop the necessary biological knowledge and
Wang, Solving pseudomonotone variational inequalities and pseudocon- vex optimization problems using the projection neural network, IEEE Transactions on Neural Networks 17
volume suppressed mass: (TeV) 2 /M P ∼ 10 −4 eV → mm range can be experimentally tested for any number of extra dimensions - Light U(1) gauge bosons: no derivative couplings. =>
For pedagogical purposes, let us start consideration from a simple one-dimensional (1D) system, where electrons are confined to a chain parallel to the x axis. As it is well known
The observed small neutrino masses strongly suggest the presence of super heavy Majorana neutrinos N. Out-of-thermal equilibrium processes may be easily realized around the
Define instead the imaginary.. potential, magnetic field, lattice…) Dirac-BdG Hamiltonian:. with small, and matrix