蛇床子素衍生物合成及其細胞毒性之研究
127
0
0
全文
(2) 蛇床子素衍生物合成及其細胞毒性之研究. Study on the Synthesis and Cytotoxic Activity of the Derivatives of Osthol. 研 究 生:廖立民. Student:Li-Min Liao. 指導教授:莊祚敏. Advisor:Dr. Tzuoh-Miin Juang 國 立 交 通 大 學 應用化學系 碩 士 論 文. A Thesis Submitted to Department of Applied Chemistry College of Science National Chiao Tung University in partial Fulfillment of the Requirements for the Degree of Master of Science In Applied Chemistry July 2005 Hsinchu, Taiwan, Republic of China. 中華民國九十四年七月.
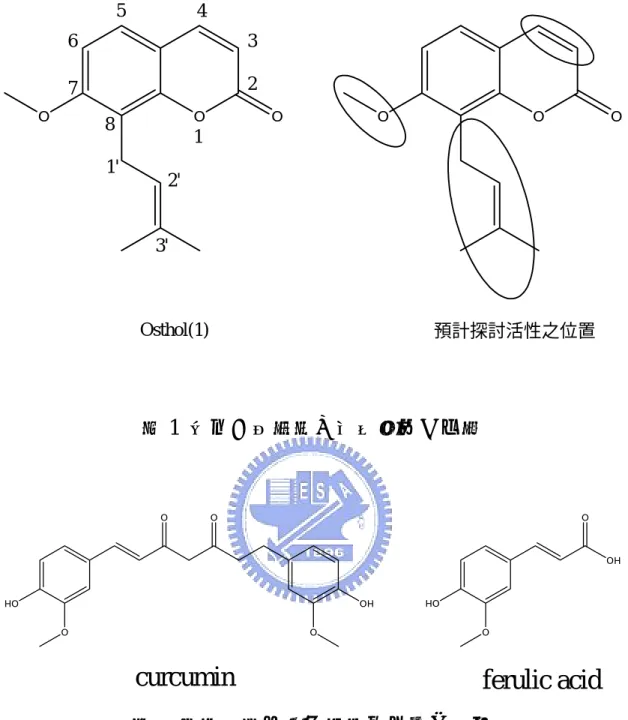
(3) 蛇床子素衍生物合成及其細胞毒性之研究 學生:廖立民. 指導教授:莊祚敏 博士 國立交通大學應用化學所 摘要. 蛇床子為繖形科蛇床屬植物蛇床(Cnidium monnieri(L.)CUSS)之 乾燥成熟果實,屬於補益藥。在近代藥理研究方面,發現蛇床子中的 香豆素類化合物蛇床子素(osthol)能誘導血癌細胞(HL-60)走向細 胞凋亡. 2、3. 。所以我們選擇蛇床子素進行結構上的修飾並與薑黃素. (curcumin)的部分結構形成的化合物 ferulic acid 結合合成出一系列 的衍生物,進行抗癌細胞毒殺活性測試來探討其結構與活性的關係, 發現 osthol 上的 isoprenyl group 對於抗癌活性有重要的影響,且 isoprenyl group 位於 C8 的位置對於抗癌活性有較好的表現。而 3,4-olefinic bond 對抗癌活性有影響,但作用機制不明。當化合物 osthenol 與 demethylsuberosin 接上 ferulic acid 形成衍生物(26)與 (35),發現抗癌活性與 IC50 表現比蛇床子素要來的優異,可將其做 為先導藥物發展出新的抗癌藥物。此外,因為薑黃素不僅在抗癌方面 表現優異,對於抗發炎亦有不錯的表現,因此我們相信取薑黃素部分 結構形成的化合物 ferulic acid 做為取代基所合成出來的一系列衍生 物對於抗發炎也會有不錯的結果。. i.
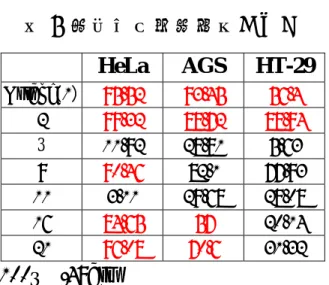
(4) 5. 4. 6. 3. 7. 2. O. O. 8. O. O. O. O. 1. 1'. 2'. 3'. 預計探討活性之位置. Osthol(1). 圖 1 蛇床子素結構及探討活性之位置. O. O. O. OH. HO. OH O. O. curcumin. HO O. ferulic acid. 圖 2 薑黃素與其部分結構形成的化合物. ii.
(5) Study on the Synthesis and Cytotoxic Activity of the Derivatives of Osthol. Student:Li-Min Liao. Advisor:Dr. T. M. Juang. Instituted of Applied Chemistry National Chiao Tung Univeris Abstract Cnidii fructus, the dried mature fruits of Cnidium monnieri (L.) Cusson (Umbelliferae), is used as a tonic agent in traditional Chinese medicine. In modern medical study,osthol could induce apoptosis in HL-60 cells 2, 3. So we choose osthol and feurlic acid to develop a series of derivatives. We used the derivatives to do the MTT assay test and to discuss the SAR, the result teld us the isoprenyl group and the 3,4-olefinic bond of osthol is essential for its activity,and the isoprenyl group at position 8 had the better cytotoxicity. When osthol and demethylsuberosin reacted with ferulic acid to form the derivatives of (26) and (35) have the better effect of anti-cancer and IC50 value than osthol. So the derivatives of (26) and (35) can be the lead compounds to develop the anticancer drug. Therefore, because curcumin not only had the good effect to anticancer,. iii.
(6) but also to anti- inflammation. So we believe the derivatives has the good effect to anti-inflammation.. iv.
(7) 謝誌 時光飛逝,兩年的碩士生涯即將告一段落,回首其中,真覺五味 雜陳,難以言喻。但不論是好或壞,畢竟都已走過這一段人生旅途中 難忘的路程。 首先,本論文承蒙指導教授莊教授的指導,並感謝工研院生醫中 心的李連滋組長與黃崇雄經理提供了完善的實驗場所及在實驗和論 文方向上的細心指導。也要感謝王靜瓊教授對於本論文提供了寶貴的 意見。接著要謝謝所有在生醫中心的所有同仁:岩芳學姐、美華學姐、 志宏大哥、阿邦大哥、孟昀大姊及秘書舒蓉在實驗及事情上的諸多指 導及幫忙。也多謝實驗室的兩位同學:小潔及建邦的幫忙與鼓勵,讓 兩年來的日子不至於枯燥乏味。特別感謝台北醫學大學的簡廷易學長 於最後關頭時在生物活性測試上全力的配合與幫忙才能如期完成本 論文。還有其他實驗室的同學:周小棟、哈比人、大餅、俊竹、月杏、 俊宏以及學弟妹:吳大、阿川、阿嚕咪、智祥、JC、淑媺還有學姐 淑慧,很高興能認識你們讓這兩年的生活增添不少色彩。 最後,要感謝我的家人在精神及物質上無限的支持,才得以讓我 無後顧之憂的過完這段碩士生涯,謝謝小田及奕誠每每在我不如意時 幫我打氣加油。再次謝謝大家,沒有你們,本論文是無法這麼順利完 成的。. v.
(8) 英文縮寫對照表 AGS. Gastric epithelial cells 胃癌細胞株. HeLa. Human cervical epithelial carcinoma 人類子宮頸(上皮)癌. 細胞 HL-60. Human leukemia cells 血癌細胞. HT-29. Human colon cancer cells 結腸癌細胞. IC50. The concentration of 50% inhibition. MTT. 3-[4, 5-dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide. NF-κB nuclear factors-κB P-388. Mouse lymphocytic leukaemia 老鼠淋巴癌細胞. RAW 264.7cells 老鼠巨噬細胞 SAR. Structure and Activity Relationship. V-79. Chinese hamster. vi.
(9) 目錄 中文摘要................................................................................................... i 英文摘要................................................................................................. iii 謝誌........................................................................................................... v 英文縮寫對照表 ...................................................................................... vi 目錄......................................................................................................... vii 表目錄....................................................................................................... ix 圖目錄....................................................................................................... x 第一章、序論........................................................................................... 1 1-1 蛇床子素 ....................................................................................... 1 1-2 蛇床子素之文獻回顧 ................................................................... 3 1-2-1 蛇床子素之藥理活性............................................................ 3 1-2-2 蛇床子素之合成研究............................................................ 5 第二章、研究動機與合成策略 .............................................................. 8 2-1 研究動機 ....................................................................................... 8 2-2 合成策略 ..................................................................................... 10 第三章、實驗......................................................................................... 16 3-1 藥品器材 ..................................................................................... 16 3-1-1 實驗試劑.............................................................................. 16. vii.
(10) 3-1-2 實驗儀器.............................................................................. 17 3-2 實驗步驟 ..................................................................................... 18 第四章、細胞毒性活性測試結果 ........................................................ 50 4-1 細胞毒性實驗 ............................................................................. 50 4-1-1 實驗材料.............................................................................. 50 4-1-2 實驗方法.............................................................................. 52 4-2 細胞毒性實驗結果 ..................................................................... 56 第五章、結果與討論 ............................................................................ 62 第六章、結論......................................................................................... 67 參考文獻................................................................................................. 68. viii.
(11) 表目錄 表 1 細胞毒性測試結果(一) ............................................................ 58 表 2 細胞毒性測試結果(二) ............................................................ 59 表 3 細胞毒性測試結果(三) ............................................................ 60 表 4 細胞毒性測試結果(四) ............................................................ 61 表 5 細胞毒性測試結果(五) ............................................................ 62 表 6 細胞毒性測試結果(六) ............................................................ 64 表 7 細胞毒性測試結果(七) ............................................................ 64 表 8 細胞毒性測試結果(八) ............................................................ 65 表 9 IC50 .................................................................................................. 66. ix.
(12) 圖目錄 圖 1 蛇床子素結構及探討活性之位置 ................................................. i 圖 2 薑黃素與其部分結構形成的化合物 ............................................. ii 圖 3 蛇床的果實 ..................................................................................... 2 圖 4........................................................................................................... 5 圖 5........................................................................................................... 5 圖 6........................................................................................................... 6 圖 7........................................................................................................... 6 圖 8........................................................................................................... 7 圖 9 Osthenol(2)之結構 ..................................................................... 8 圖 10 薑黃素(curcumin)之結構 ........................................................ 9 圖 11....................................................................................................... 10 圖 12....................................................................................................... 11 圖 13....................................................................................................... 12 圖 14....................................................................................................... 12 圖 15....................................................................................................... 14 圖 16 MTT 被活細胞粒線體內的去氫酶間接還原成 Formazan 之原 理。 ........................................................................................... 54 圖 17 結構(一) ................................................................................. 57. x.
(13) 圖 18 測試結果(一) ......................................................................... 58 圖 19 測試結果(二) ......................................................................... 59 圖 20 測試結果(三) ......................................................................... 60 圖 21 測試結果(四) ......................................................................... 61 圖 22 結構(二) ................................................................................. 62 圖 23 結構(三) ................................................................................. 63 圖 24 結構(四) ................................................................................. 64 圖 25 結構(五) ................................................................................. 65 圖 26 結構(六) ................................................................................. 66 圖 27 化合物(2)之 1H NMR 光譜圖 ................................................... 71 圖 28 化合物(4)之 1H NMR 光譜圖 ................................................... 72 圖 29 化合物(5)之 1H NMR 光譜圖 ................................................... 73 圖 30 化合物(7)之 1H NMR 光譜圖 ................................................... 74 圖 31 化合物(8)之 1H NMR 光譜圖 ................................................... 75 圖 32 化合物(9)之 1H NMR 光譜圖 ................................................... 76 圖 33 化合物(10)之 1H NMR 光譜圖 ................................................. 77 圖 34 化合物(11)之 1H NMR 光譜圖 ................................................. 78 圖 35 化合物(12)之 1H NMR 光譜圖 ................................................. 79 圖 36 化合物(13)之 1H NMR 光譜圖 ................................................. 80. xi.
(14) 圖 37 化合物(14)之 1H NMR 光譜圖 ................................................. 81 圖 38 化合物(15)之 1H NMR 光譜圖 ................................................. 82 圖 39 化合物(16)之 1H NMR 光譜圖 ................................................. 83 圖 40 化合物(18)之 1H NMR 光譜圖 ................................................. 84 圖 41 化合物(19)之 1H NMR 光譜圖 ................................................. 85 圖 42 化合物(20)之 1H NMR 光譜圖 ................................................. 86 圖 43 化合物(21)之 1H NMR 光譜圖 ................................................. 87 圖 44 化合物(22)之 1H NMR 光譜圖 ................................................. 88 圖 45 化合物(26)之 1H NMR 光譜圖 ................................................. 89 圖 46 化合物(27)之 1H NMR 光譜圖 ................................................. 90 圖 47 化合物(28)之 1H NMR 光譜圖 ................................................. 91 圖 48 化合物(29)之 1H NMR 光譜圖 ................................................. 92 圖 49 化合物(30)之 1H NMR 光譜圖 ................................................. 93 圖 50 化合物(31)之 1H NMR 光譜圖 ................................................. 94 圖 51 化合物(32)之 1H NMR 光譜圖 ................................................. 95 圖 52 化合物(33)之 1H NMR 光譜圖 ................................................. 96 圖 53 化合物(34)之 1H NMR 光譜圖 ................................................. 97 圖 54 化合物(35)之 1H NMR 光譜圖 ................................................. 98 圖 55 化合物(37)之 1H NMR 光譜圖 ................................................. 99. xii.
(15) 圖 56 化合物(38)之 1H NMR 光譜圖 ............................................... 100 圖 57 化合物(39)之 1H NMR 光譜圖 ............................................... 101 圖 58 化合物(40)之 1H NMR 光譜圖 ............................................... 102 圖 59 化合物(26)之 13C NMR 光譜圖 .............................................. 103 圖 60 化合物(27)之 13C NMR 光譜圖 .............................................. 104 圖 61 化合物(28)之 13C NMR 光譜圖 .............................................. 105 圖 62 化合物(29)之 13C NMR 光譜圖 .............................................. 106 圖 63 化合物(31)之 13C NMR 光譜圖 .............................................. 107 圖 64 化合物(32)之 13C NMR 光譜圖 .............................................. 108 圖 65 化合物(35)之 13C NMR 光譜圖 .............................................. 109 圖 66 化合物(38)之 13C NMR 光譜圖 .............................................. 110 圖 67 化合物(39)之 13C NMR 光譜圖 .............................................. 111 圖 68 化合物(40)之 13C NMR 光譜圖 .............................................. 112. xiii.
(16) 第一章 序論 1-1 蛇床子素 蛇床子為繖形科蛇床屬植物蛇床(Cnidium monnieri(L.)CUSS)之乾 燥成熟果實,始著錄於神農本草經上品,有溫腎壯陽,祛風燥濕、 殺蟲等功效。近代藥理研究證實其在心血管系統、抗骨質疏鬆、 抗氧化及抗癌細胞等方面均有作用,並證實其有效成份是香豆素 1. 類化合物 。在抗癌細胞方面,發現蛇床子的乙醇萃取物對於血癌 (HL-60)細胞具有明顯的抑制效果,更進一步的實驗証明其中的成 份蛇床子素(osthol)能誘導HL-60 cells走向細胞凋亡(apoptosis) 3. 2、. 。蛇床子素(osthol)的化學名7-methoxy-8-[3-methylpent-2-enyl]. coumarin,分子式:C15H16O3、分子量:244.29、熔點:83-84℃。在 1972 年日本學者Hata 等從其果實中分離得到蛇床子素,顏焜熒教 授亦從台灣北部海濱採集濱當歸(Angelica hirsutiflora LIU, CHAO et 4. CHUANG) 之根部亦分離得到蛇床子素(osthol) 。在1996年Itokawa 5. 探討蛇床子素的結構及藥理活性 ,2001年Furukawa取了33種香豆素 6. 類化合物研究對於抗癌細胞的功效 ,發現含有isopentenyl 或 1,1-dimethylallyl group的化合物對於抑制癌細胞的生長具有不錯的效 2、3、6、7. 果。由於蛇床子素在抗癌細胞方面有效果. ,所以我們將蛇床子. 素(osthol)視為不錯的抗癌先導藥物做更深入的研究與探討。. 1.
(17) 圖 3 蛇床的果實. 2.
(18) 1-2 蛇床子素之文獻回顧 1-2-1 蛇床子素之藥理活性 抑制B 型肝炎作用. 8~10. 用MS-G2 及HuH7 細胞培養B 型肝炎表面抗原(HBsAg),並使用 osthol(1)做體外試驗,發現具有抑制B 型肝炎病毒分泌的現象,其 作用機制與增加B 型肝炎表面抗原之糖化作用(glycostlation)有關。. 抗癌. 2、3、6、7. Osthol(1)對 HeLa cells(S3 cultured)的生長具有明顯的抑制作用。 2003 年發現 osthol(1)對於 HL-60 cells 和 P-388 cells 有著強烈的細 胞毒性(IC50=14.9 & 9.3µg/ml)。更進一步的實驗發現 osthol(1)能 誘導 HL-60 cells 走向細胞凋亡(apoptosis) 。. 抗血小板凝聚. 11. 2001 年發現 osthol(1)對於兔子的血小板具有抗凝聚的功能。. 抗骨質疏鬆. 12. Osthol(1)對於 OVX(ovariectomized)老鼠具有預防骨質疏鬆的效 果。. 3.
(19) 13. 抗 NO. 1999 年 Ohigashi 教授發現含有 isoprenyl group 的香豆素類化合物對 於 RAW 264.7 cells 的 NO 分泌具有良好的抑制效果。. Osthol(1)活性探討. 5. 1996 年 Itokawa 教授合成 osthol(1)的衍生物並利用 V-79 cells 做抗 癌細胞的測試。. 4.
(20) 1-2-2 蛇床子素之合成研究 Synthesis of Osthenol(2) 14~18. (1)CLAISEN REARRANGEMENT. 1971 年 Murray 利用 CLAISEN REARRANGEMENT 合成 osthol(1) 15. 的中間體 osthenol(2) 。 3-methyl-3-chlorobut-1-yne HO. O. H2, Pd/BaSO4. K2CO3, KI, DMF. O. O. O. 3. O. EA, quinoline. O. 4. HO. O. O. O. O. 5. +. DEA. O. +. O. HO. O. O. HO. 16 14%. 3 5%. 2 74%. 圖4 1987 年 Salva 亦利用 CLAISEN REARRANGEMENT 合成出 osthenol 19. (2) 。. DEA O. O. O. + HO. O. O. HO. O. I. 16 70%. 2 25%. 圖5. 5. O.
(21) (2)C-Prenylation of Phenols Promoted by Aluminum Oxide Surfaces 20. 1986 年 Buchi 利用 Aluminum Oxide 催化合成 osthenol(2) 。. Al2O3, Prenyl bromide HO. O. O. THF. 3. + HO. O. HO. O. O. O. very minor. 29%. 16 major. 2. 圖6. (3)Demethylation of osthol(1) 2000 年 Gopalakrishnan 用 AlCl3/DMS 對 osthol(1)做 Demethylation 21. 生成 osthenol(2) 。 AlCl3/ DMS O. O. O. DCM. osthol(1). HO. O. 2 圖7. 6. O.
(22) Osthol(1)衍生物. O. O. 22、23. O O. O. 圖8. 7. O. HO. O. O.
(23) 第二章. 研究動機與合成策略. 2-1 研究動機 在近代藥理研究發現蛇床子素對於抑制癌細胞. 2、3、6、7. 具有不錯的. 效果,但是討論其結構與活性關係(SAR)的文獻卻很少,我們希望能 更進一步的討論其 SAR。根據文獻記載,在 umbeliferone (3) 的 benzene 6. ring 上接上 isoprenyl group 能夠增進其抗癌活性 ,所以我們選擇幾 種 isoprenyl group 接在 umbeliferone (3)不同位置上的化合物 (osthenol (2) 、demethylsuberosin(16))來發展新的衍生物。另一方面,文獻 5. 指出在 3,4-olefinic bond 對於毒殺癌細胞活性效果是必須的 ,所以我 們在 osthenol(2) C4 的位置上接上甲基,希望能更進一步的探討其 毒殺癌細胞的運作機制。此外,在 osthenol(2)的 7-hydroxy 位置接 5. 上 prenyl group 也能提高抗癌活性 ,所以我們分別在化合物(2)、 (3) 、(9)、(11) 、(16)的 7-hydroxy 位置上接上其他取代基,希望 能進一步探討 SAR 並找到有發展潛力的抗癌前驅藥物。 5. HO. 4. 6. 3. 7. 2 O. 8. O. 1. 1'. 2'. 3' Osthenol(2). 圖 9 Osthenol(2)之結構 8.
(24) 至於要接上何種取代基,我們選擇了薑黃素(curucmin)部分結 構所形成的化合物ferulic aicd(23)來和osthenol(2) 、demethylsuberosin (16)……等化合物反應合成出新的衍生物。至於為甚麼會挑選薑黃 素來做為取代基的基礎結構,主要是因為薑黃素具有抗發炎、抗氧化 24. 和抗癌作用。在抗癌作用方面 ,薑黃素會引起人類大腸腫瘤細胞株 (lovo)細胞凋亡及細胞週期停滯於 S,G2/M 期 胞如HL-60、HT-29的細胞凋亡(apoptosis). 25. ,也會引起腫瘤細. 26、27. 。薑黃素也被發現對. 於人類大腸上皮細胞之NF-κB活性起抑制作用,並進而降低 28. Cyclo-oxygenase 2 (COX2)的過度表現來達到防止癌化的作用 。所以 我們選取薑黃素做為取代基的基礎架構來發展衍生物。. O. O. OH. HO O. curcumin. 圖 10 薑黃素(curcumin)之結構. 9. O.
(25) 2-2 合成策略 由於我們希望能在 osthenol(2)的 7-hydroxy 上接上其他取代基 形成新的衍生物,因此我們先拿台北醫學大學王靜瓊副教授實驗室所 21. 提供的 osthol(1)做 demethylation ,希望能得到 osthenol(2) ,但 是所得到的產物卻是環化後的 pyranocoumarin。另一方面,雖然經由 15、. CLAISEN REARRANGEMENT 合成的方法可以獲得 osthenol(2) 19、20. ,卻無可避免的會同時得到 isomer(16)的產物增加純化分離上. 的困難,但我們還是選擇用合成的方法來得到 osthenol(2) 。 首先,我們先由 umbeliferone(3)做為起始物,接上 3-methyl-3-chlorobut-1-yne 後做氫化,進行CLAISEN REARRANGEMENT 後得到主產物 osthenol(2) 、副產物 demethylsuberosin(16)以及 15. umbeliferone(3) 。 3-methyl-3-chlorobut-1-yne HO. O. O. H2, Pd/BaSO4. K2CO3, KI, DMF. O. O. 3. O. EA, quinoline. O. 4. HO. O. O. O. O. 5. +. DEA. O. +. O. HO. O. 16 14% 2 74%. 圖 11. 10. O. HO. 3 5%.
(26) 再來,為了探討 3,4-olefinic bond 接上不同的官能基對於毒殺癌細胞 15. 活性效果有何影響,我們利用相同的方法 ,選擇 4-methyl-ubeliferone (6)作為起始物合成出 4-methyl-osthenol(9) ,亦同時得到 4-methyl-7-demethylsuberosin 及 4-methyl umbeliferone。. 3-methyl-3-chlorobut-1-yne HO. O. O. K2CO3, KI,DMF. H2, Pd/BaSO4 O. O. 6. EA, quinoline. O. O. + HO. O. O. 8. 7. DEA. O. +. O. HO. O. O. HO. 10%. O. O. 3%. 9 60%. 圖 12. 此外,為了探討對於不同位置與不同數量的 isoprenyl 接在 umbeliferone(3)上、以及將 osthenol(2)上的 isoprenyl group 替換 成 ally group 對於癌細胞的細胞活性究竟有何影響,因此我們分別合 成出 demethylsuberosin(16). 29、30. 30. 、化合物(12) 、以及. 31. 8-allyl-7-hydroxycoumarin(11) 來和 osthenol(2)來做一系列比較 與探討。. 11.
(27) O. BnBr HO. O. CH3ONa/MeOH. K2CO3, acetone. O. BnO. O. 3. OCH3. BnO. O. OH. 16. 13. O. Prenyl Bromide. DEA. OCH3. K2CO3, acetone. BnO. BnO. O. O. O. 15. 14. BCl3 HO. DCM. O. O. Demethylsuberosin(16). 圖 13. O. CH3ONa/MeOH BnO. O. OCH3. BnO. O. Prenyl Bromide K2CO3, acetone. OH. 17. 15. O. OCH3. BnO. DEA BnO. O. DEA. Allyl Bromide O. 3. O. 19. 18. HO. O. O. K2CO3, acetone. O. O. O. HO. O. O. 10 8-allyl-7-hydroxycoumarin(11). 圖 14. 12.
(28) 再者,由於在 7-hydroxy 的位置接上 prenyl 後可增進毒殺癌細胞活性 5. 的效果 ,因此我們便在 7-hydroxy 的位置上接上 ferulic acid(23)等 取代基,希望能增進其抗癌活性。. 13.
(29) 23:R1 = OCH3, R2 = OH, R3 = H; (feulic acid) 24:R1 = OCH3, R2 = OH, R3 = OCH3;(sinapic acid) 25:R1 = OCH3, R2 = OCH3, R3 = H;(3,4-Dimethoxycinnamic acid) O R3 OH. O. R2 R3. R1 HO. O. O. O. O. O. EDC, DMAP, DCM R2 R1. 26~28. 2. O R3 OH. R2. O R1. HO. O. R3. O. O. O. O. EDC, DMAP, DCM R2 R1. 9. 29~31 O R3 OH. O. R2 R3. R1 HO. O. O. O. O. O. EDC, DMAP, DCM R2 R1. 11. 32~34 O R3 OH. R2 O. O. R1 HO. O. 16. O O. EDC, DMAP, DCM. 35~37. R1. R2 R3. 14. O.
(30) O R3 OH. R2. O R1. HO. O. 3. R3 O. O. O. EDC, DMAP, DCM. 38~40. R2 R1. 圖 15. 15. O.
(31) 第三章 實驗 3-1 藥品材料 3-1-1 實驗試劑 acetone Merck allyl bromide Lancaster Benzyl bromide(BnBr) Merck Fluka Boron trichloride(BCl3)(1M solution in DCM) Celite SHOWA Dichloromethane(DCM) Acros 4-Dimethylaminopyridine(DMAP) Lancaster Dimethyl sulfide(DMS) Lancaster 3,4-Dimethoxycinnamic acid Acros 3,3-Dimethyl acryloyl chloride Acros N,N-Dimethylformamide(DMF) Acros N,N-Diethylaniline(DEA) Acros Ethyl acetate(EA) Merck 1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride(EDC) Lancaster Ethyl ether Merck Ferulic acid MP Biomedical Inc. n-Hexane Merck 3-methyl-3-chlorobut-1-yne Aldrich Methanol(MeOH) Merck 4-methyl umbeliferone MP Biomedical Inc. Lancaster Palladium on barium sulfate(Pd/BaSO4) Palladium on carbon(Pd/C) Laccaster SHOWA Potassium carbonate(K2CO3) Potassium iodide(KI) SHOWA Prenyl bromide Aldrich Quinoline Acros Sinapic acid SIGMA Umbeliferone Lancaster 。 感謝台北醫學大學王靜瓊副教授實驗室提供 osthol(1). 16.
(32) 3-1-2 實驗儀器 (1) FT-IR 紅外線光譜儀(FT-730) (2) LC 液相層析儀(HP 4890A) (3) GC-MASS 氣象層析質譜儀(PERKIN ELMER/Turbo Mass) (4) NMR 核磁共振光譜儀(Varian Unity Inova-500) (5) HRMS 高解析度質譜儀(清大貴儀中心). 17.
(33) 3-2 實驗步驟 7-O-(1,1-Dimethylpropargyl)umbelliferone(4)15 3-methyl-3-chlorobut-1-yne HO. O. O. K2CO3, KI, DMF. O. O. O. 3 4. 將28mg(0.1728mmole) Umbelliferone(3)及35.3mg (0.2108mmole)KI 溶 於acetone,加入0.0833g (0.6036mmole)K2CO3 於室溫下攪拌30 分鐘,加入 0.1ml (0.8901mmole)3-methyl-3-chlorobut-1-yne 後氮氣下迴流24 小時。將溫度回到 室溫,過濾溶液,濃縮後的固體用EA 溶解,用飽和K2CO3 水溶液及飽和食鹽水 洗有機層,用無水硫酸鎂乾燥,濃縮後得到淡黃色固體。經管柱層析純化,得到 21.7mg 白色固體(4) ,產率55 %。. 化合物4 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.70(6H, s), 2.64(1H, s), 6.26(1H, d, J = 9Hz), 7.03(1H,. dd, J = 8.75, 2Hz), 7.30(1H, s), 7.34(1H, d, J = 9Hz), 7.62(1H, d, J = 9Hz);. 18.
(34) 7-O-(1,1-Dimethylallyl)umbelliferone(5)15 H2, Pd/BaSO4 O. O. O. EA, quinoline. 4. O. O. O. 5. 將8mg(0.0351mmole)化合物(4)及2.4mg(30wt%) Pd/BaSO4 溶於EA 中, 加入0.05ml quinoline,在氫氣下室溫攪拌30 分鐘,用Celite 過濾溶液,用1M HCl 及飽和食鹽水洗有機層,用無水硫酸鎂乾燥,濃縮後得到淡黃色固體。經管柱層 析純化,得到7.8mg 白色固體(5) ,產率99%。. 化合物5 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.51(6H, s), 5.19~5.24(2H, m), 6.11(1H, dd, J = 20,. 11Hz), 6.21(1H, d, J = 9.5Hz), 6.85(1H, dd, J = 10, 2.5Hz), 6.91~6.956(1H, m), 7.28(1H, d, J = 8.5Hz), 7.59( 1H, d, J = 9.5Hz);. 19.
(35) osthenol(2)15. DEA O. O. HO. O. O. O. 5. osthenol(2) 取 9.3mg(0.0404mmole)化合物(5)溶於 DEA 中,氮氣下加熱至 150℃攪拌2 小時。將溫度回到室溫,用3N H2SO4 及飽和食鹽水洗有機層,用 無水硫酸鎂乾燥,濃縮後得到褐色油狀物。經管柱層析純化,得到4.7mg 白色油 狀物(2) ,產率50%。. 化合物2 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.75(3H, s), 1.84(3H, s), 3.61(2H, d, J = 7Hz),. 5.24~5.27(1H, m), 5.95(1H, s), 6.22(1H, d, J = 9.5Hz), 6.76(1H, d, J = 8.5Hz), 7.21(1H, d, J = 8.5Hz), 7.60( 1H, d, J = 10Hz);. 20.
(36) 7-(2-methylbut-3-yn-2-yloxy)-2H-chromen-2-one(7). 3-methyl-3-chlorobut-1-yne HO. O. O. K2CO3, KI, DMF. O. O. O. 6 7. 將0.6g 4-Methyl Umbelliferone(0.3409mmole) (6)及0.1132g(0.0682mmole)KI 溶於DMF 中,加入0.64g (0.4631mmole)K2CO3 於室溫下攪拌30 分鐘,加入 0.8ml(0.7121mmole) 3-methyl-3-chlorobut-1-yne 後氮氣下迴流24 小時。將溫度 回到室溫,過濾溶液,濃縮後的固體用EA 溶解,用飽和K2CO3 水溶液及飽和食 鹽水洗有機層,用無水硫酸鎂乾燥,濃縮後得到褐色油狀物。經管柱層析純化, 得到0.4926g 白色固體(7) ,產率60%。. 化合物7 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.69(6H, s), 2.38(3H, s), 2.63(1H, s), 6.13(1H, d, J =. 1Hz), 7.05(1H, dd, J = 9, 2Hz), 7.28(1H, d, J = 2Hz), 7.46(1H, d, J = 8.5Hz);. 21.
(37) 7-(2-methylbut-3-en-2-yloxy)-4-methyl-2H-chromen-2-one(8). H2, Pd/BaSO4 O. O. O. EA, quinoline. O. 7. O. O. 8. 取17.2mg(0.0711mmole)化合物(7)及8.5mg (50wt%)Pd/BaSO4 溶於EA 中,加入0.05ml quinoline,在氫氣下室溫攪拌30 分鐘,用Celite 過濾溶液,用 1M HCl 及飽和食鹽水洗有機層,用無水硫酸鎂乾燥,濃縮後得到淡黃色固體。 經管柱層析純化,得到16.8mg 白色固體(8) ,產率97%。. 化合物8 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.69(6H, s), 2.38(3H, s), 5.19(1H, d, J = 10.5Hz),. 5.22(1H, d, J = 16.5Hz), 6.07~6.13(2H, m), 6.87(1H, dd, J = 11, 2Hz), 6.95(1H, d, J = 2.5Hz), 7.41( 1H, d, J = 8.5Hz);. 22.
(38) 7-hydroxy-4-methyl-8-(3-methylbut-2-enyl)-2H-chromen-2-one(9). DEA O. O. O. HO. O. O. 8. 9. 取 8.2mg(0.0336mmole)化合物(8)溶於 DEA 中,氮氣下加熱至 150℃攪拌2 小時。將溫度回到室溫,用3N H2SO4 及飽和食鹽水洗有機層,用 無水硫酸鎂乾燥,濃縮後得到褐色油狀物。經管柱層析純化,得到3.5mg 白色油 狀物(9) ,產率42%。. 化合物9 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.74(3H, s), 1.84(3H, s), 3.61(1H, d, J = 7Hz),. 5.239~5.267(1H, m), 6.00(1H, s), 6.11(1H, s), 6.79(1H, d, J = 8.5Hz), 7.35( 1H, d, J = 9Hz);. 23.
(39) 7-allyloxycoumarin(10)31. Allyl Bromide HO. O. O. K2CO3, acetone. 3. O. O. O. 10. 取0.1021g(0.6302mmole) Umbelliferone(3)溶於acetone,加入0.4976g (3.6003mmole)K2CO3 於室溫下攪拌30 分鐘,加入0.1ml(1.1556mmole)Allyl Bromide 後氮氣下迴流5 小時。將溫度回到室溫,過濾溶液,濃縮後的固體用 EA 溶解,用飽和K2CO3 水溶液及飽和食鹽水洗有機層,用無水硫酸鎂乾燥,濃 縮後得到淡黃色固體。經管柱層析純化,得到0.0829g 白色固體(10) ,產率65%。. 化合物10 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ4.58(2H, d, J = 5Hz), 5.32(1H, d, J = 10.5Hz), 5.42(1H,. d, J = 16.5Hz), 5.99~6.05(1H, m ), 6.23(1H, d, J = 9.5Hz), 6.81(1H, s), 6.84(1H, d, J = 8.5Hz), 7.35( 1H, d, J = 8.5Hz), 7.61(1H, d, J = 9.5Hz);. 24.
(40) 8-allyl-7-hydroxycoumarin(11)31. DEA O. O. HO. O. 10. O. O. 11. 取 20mg(0.0990mmole)化合物(10)溶於 DEA 中,氮氣下迴流 2 小時。將溫度回到室溫,用3N H2SO4 及飽和食鹽水洗有機層,用無水硫酸鎂乾 燥,濃縮後得到褐色油狀物。經管柱層析純化,得到7.6mg 白色油狀物(11) , 產率38%。. 化合物11 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ3.65(2H, d, J = 5.5Hz), 5.13~5.20(2H, m,), 5.90(1H, s, ),. 5.95~6.01(1H, m ), 6.23(1H, d, J = 9.5Hz), 6.80(1H, d, J = 9.5Hz), 7.25(1H, m), 7.61( 1H, d, J = 9.5Hz),;. 25.
(41) 7-benzyloxycoumarin(12)29,30. BnBr HO. O. O. K2CO3, acetone. BnO. 3. O. O. 12. 將 1g(6.1728mmole)Umbelliferone (3) 溶於acetone 中,加入2.6g (0.0188mloe) K2CO3 於室溫下攪拌30 分鐘,加入1.2ml(0.0100mole) Benzyl bromide 通氮氣 迴流2 小時,將溫度回到室溫,過濾溶液,濃縮後的固體用EA 溶解,用飽和 K2CO3 水溶液及飽和食鹽水洗有機層,用無水硫酸鎂乾燥,濃縮後得到淡黃色固 體。用EA 做再結晶,得到1.48g 白色固體(12) ,產率95 %。. 化合物12 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ5.11(2H, s, ), 6.23(1H, d, J = 9Hz ), 6.87~6.91(2H, m),. 7.33~7.42(6H, m), 7.61(1H, d, J = 9.5Hz);. IR (KBr):1727, 1612, 1280, 1222, 1002 cm-1;. 26.
(42) Methyl 4’-benzyloxy-2’-hydroxycinnamate(13)29,30 O. CH3ONa/MeOH BnO. O. OCH3. BnO. O. 12. OH. 13. 將1.5g (0.0278mmole)NaOCH3 溶於MeOH 中,再把0.7459g(2.960mmole) 的化合物(12)溶於MeOH 並注入上述溶液中,氮氣下迴流4 小時,將溫度降 至0 ℃,用2N HCl 中和溶液至中性,將溶劑抽乾,用EA 溶解固體,用飽和食 鹽水洗有機層,無水硫酸鎂乾燥濃縮後得到白色固體。用EA 做再結晶得到1.18g 白色固體(13) ,產率70%。. 化合物13 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.77(3H, s), 5.05(2H,s ), 5.46(1H, s, ), 6.40~6.45(2H,. m ), 6.57(1H, d, J = 8.5Hz), 7.32~7.38(6H, m), 7.86(1H, d, J = 16Hz);. 27.
(43) Methyl 4’-Benzyloxy-2’-(3-methylbut-2-enyloxy)cinnamate(14)29,30 O. O. OCH3. BnO. OH. Prenyl Bromide K2CO3, acetone. OCH3. BnO. O. 13. 14. 取0.1g(0.0352mmole)化合物 (13) 溶於acetone 中,加入0.2812g(2.0346mmole) K2CO3 於室溫下攪拌30 分鐘,加入0.08ml(0.0682mmole) Prenyl bromide ,氮 氣下迴流4 小時,將溫度回到室溫,過濾溶液,濃縮後的固體用EA 溶解,用飽 和K2CO3 水溶液及飽和食鹽水洗有機層,用無水硫酸鎂乾燥,經管柱層析純化, 得到0.118g 淡黃色油狀物(14) ,產率95%。. 化合物14 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.71(3H, s), 1.77(3H,s ), 3.76(3H, s, ), 4.52(2H, d, J =. 6.5Hz ), 5.06(1H, s), 5.46~5.48(1H, m), 7.30~7.42(6H, m), 7.91( 2H, d, J = 16Hz),;. 28.
(44) 7-benzyloxy-3-(3-methylbut-2-enyl)coumarin(15)29,30 O. OCH3. BnO. DEA. O. BnO. O. O. 15. 14. 取 1.19g(3.3807mmole)化合物(14)溶於 DEA 中,氮氣下迴流 3 小時。將溫度回到室溫,用3N H2SO4 及飽和食鹽水洗有機層,用無水硫酸鎂乾 燥,濃縮後得到褐色油狀物。經管柱層析純化,得到0.6275g 白色固體(15) , 產率58%。. 化合物15 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.64(3H, s), 1.74(3H, s), 3.35(2H, d, J = 7.5Hz), 5.13. (2H, s ), 5.26~5.29(1H, m), 6.20(1H, d, J = 9.5Hz), 6.81(1H, s), 7.18(1H, s), 7.23(1H, s), 7.32~7.58(6H, m), 7.59(1H, d, J = 9Hz);. 29.
(45) demethylsuberosin(16)29,30. BCl3 BnO. O. O. DCM. HO. O. O. 16. 15. 取 0.64g(2.7826mmole)化合物(15)溶於 50ml DCM 中,0 ℃通氮 氣下緩緩滴入4ml(4mmole) 1M BCl3 溶液,攪拌3 小時,加入35ml MeOH , 將溶液倒入冰水中,用EA 萃取水層,用飽和K2CO3 水溶液及飽和食鹽水溶液洗 有機層,無水硫酸鎂乾燥,濃縮後得到褐色油狀物,經管柱層析純化,得到0.373g 白色油狀物(16) ,產率79%。. 化合物16 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.76(3H, s), 1.78(3H,s ), 3.36(2H, d, J = 7.5Hz),. 5.27~5.31(1H, m ), 5.31(1H, s), 6.10(2H, d, J = 10.5Hz), 6.81(1H, s), 7.17( 1H, s), 7.59(1H, d, J = 9.5Hz);. 30.
(46) Methyl 4’-Benzyloxy-2’-hydroxy-5’-(3-methylbut-2-enyl)cinnamate(17)29,30 O. CH3ONa/MeOH BnO. O. OCH3. BnO. O. 15. OH. 17. 將3.02g (0.0559mole)NaOCH3 溶於MeOH 中,再把1.5216g(6.6157mmole) 的化合物(15)溶於MeOH 並滴入上述溶液中,氮氣下迴流4 小時,將溫度降 至0 ℃,用2N HCl 中和溶液至中性,將溶劑抽乾,用EA 溶解固體,用飽和食 鹽水洗有機層,無水硫酸鎂乾燥、濃縮後得到白色固體。用EA 做再結晶得到 0.7845g 白色固體(17) ,產率70%。. 化合物17 的光譜資料如下:. 31.
(47) Methyl 4’-Benzyloxy-5’-(3-methylbut-2enyl) (3-methylbut-2-enyloxy)cinnamate (18)29,30 O. O. OCH3. BnO. OH. Prenyl Bromide K2CO3, acetone. OCH3. BnO. O. 17. 18. 取8.84g(0.0251mole) 化合物(17)溶於acetone 中,加入15.7g (0.1136mole) K2CO3 於室溫下攪拌30 分鐘,加入3ml(0.0256mole) Prenyl bromide ,氮氣下 迴流4 小時,將溫度回到室溫,過濾溶液,濃縮後的固體用EA 溶解,用飽和 K2CO3 水溶液及飽和食鹽水洗有機層,用無水硫酸鎂乾燥,經管柱層析純化,得 到9.3557g 淡黃色油狀物(18) ,產率89%。. 化合物18 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.71(3H, s), 1.77(3H,s ), 1.79(3H, s), 1.83(3H, s),. 3.34(2H, d, J = 7Hz), 3.83(3H, s ), 4.57(1H, d, J = 6.5Hz), 5.16(2H, s), 5.32~5.35(1H, m), 5.49~5.51( 1H, m), 6.45(1H, d, J = 16Hz), 6.52(1H, s), 7.33(1H, s), 7.38~7.48(5H, m), 7.98(1H, d, J = 16Hz);. 32.
(48) 7-benzyloxy-3,6-bis(3-methylbut-2-enyloxy)cinnamate(19)29,30 O. OCH3. BnO. DEA BnO. O. O. O. 19. 18. 取 0.2852g(0.0679mmole) 化合物(18)溶於 DEA 中,氮氣下迴流 3 小時。將溫度回到室溫,用3N H2SO4 及飽和食鹽水洗有機層,用無水硫酸鎂 乾燥,濃縮後得到褐色油狀物。經管柱層析純化,得到0.1180g 白色固體(19) , 產率45%。. 化合物19 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.65(3H, s), 1.67(3H,s ), 1.75(3H, s), 1.78(3H, s),. 3.19(2H, d, J = 7Hz), 3.35(2H, d, J = 7.5Hz ), 5.11(2H, s), 5.27~5.30(2H, m), 6.80(1H, s), 7.15( 1H, s), 7.31~7.41(6H, m);. 33.
(49) 8-isopentyl-7-methoxy-2H-chromen-2-one(20)5. H2, Pd/C O. O. O. O. O. O. EA. 20. Osthol(1). 取25mg (0.0102mmole)Osthol(1)及1mg(4wt%) Pd/C 溶於MeOH 中, 在氫氣下室溫攪拌30 分鐘,用Celite 過濾溶液,用飽和食鹽水洗有機層,用無 水硫酸鎂乾燥,濃縮後得到22.3mg 白色固體(20) ,產率88.5%。. 化合物20 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.00(6H, s), 1.45~1.47(2H, m), 1.63~1.68(1H, m),. 2.86~2.89(2H, m), 3.95(3H, s), 6.27(1H, d, J = 9Hz), 6.86( 1H, d, J = 8.5Hz), 7.31(1H, d, J = 8.5Hz), 7.50(1H, d, J = 9.5Hz);. 34.
(50) 7-(3-methylbut-2-enyloxy)-2H-chromen-2-one(14) Prenyl bromide, K2CO3 acetone HO. O. O. O. 3. O. O. 21. 將0.1231g(0.7599mmole)Umbelliferone(3) 溶於acetone,加入0.6g(4.341mmole) K2CO3 於室溫下攪拌30 分鐘,加入0.14ml(1.1930mmole) Prenyl bromide 後 氮氣下迴流4 小時。將溫度回到室溫,過濾溶液,濃縮後的固體用EA 溶解,用 飽和K2CO3 水溶液及飽和食鹽水洗有機層,用無水硫酸鎂乾燥,濃縮後得到淡 黃色固體。經管柱層析純化,得到0.1678g 白色固體(21) ,產率96%。. 化合物21 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.75(3H, s), 1.79(3H, s), 4.56(2H, d, J = 7Hz),. 5.44~5.47(1H, m), 6.22(1H, d, J = 9.5Hz), 6.80~6.83(2H, m), 7.33(1H, d, J = 8.5Hz), 7.60( 1H, d, J = 9.5Hz);. 35.
(51) 2-oxo-2H-chromen-7-yl 3-methylbut-2-enoate(15) 3,3-Dimethyl acryloyl chloride. O. K2CO3, DMF HO. O. O. O. 3. O. O. 22. 取20mg(0.123mmole) Umbelliferone(3)溶於DMF,加入34mg(0.246mmole) K2CO3 於冰浴下攪拌30 分鐘,緩慢加入0.017ml(0.1520mmole) 3,3-Dimethyl acryloyl chloride 後氮氣下攪拌30 分鐘。將溫度回到室溫,過濾溶液,濃縮後 的固體用EA 溶解,用飽和K2CO3 水溶液及飽和食鹽水洗有機層,用無水硫酸鎂 乾燥,濃縮後得到淡黃色固體。經管柱層析純化,得到20.5mg 白色固體(22) , 產率72%。. 化合物22 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ2.00(3H, s), 2.23(3H, s), 5.90(1H, s), 6.37(1H, d, J =. 9.5Hz), 7.05(1H, d, J = 8.5Hz), 7.11(1H, s), 7.46(1H, d, J = 9.5Hz), 7.67( 1H, d, J = 9.5Hz);. 36.
(52) 26~28: O R3 OH. R2. O R1. HO. O. R3. O. O. O. O. EDC, DMAP, DCM R2 R1. 2. 26~28. 26: 取 6mg(0.0261mmole) 化合物(2) 、10.1mg(0.0521mmole) ferulic acid、0.3mg(10%) DMAP、15mg(0.0782mmole) EDC 置於雙頸 瓶中,加入 10ml DCM,通氮氣下室溫攪拌 30 分鐘,用水及飽和食 鹽水洗有機層,無水硫酸鎂乾、濃縮,得黃色油狀物。經管柱層析純化, 得到4.1mg 白色油狀物(26) ,產率39%。. 27:步驟同26;6mg(0.0261mmole)化合物(2) 、11.7mg(0.0522mmole)Sinapic acid(24) 、0.3mg(10%) DMAP、15.01mg(0.0783mmole) EDC。 28:步驟同Ga;6mg(0.0261mmole)化合物(2) 、10.8mg(0.0522mmole)化 合物(25) 、0.3mg(10%) DMAP、15.01mg(0.0783mmole) EDC。 26 27 28. R1 OCH3 OCH3 OCH3. R2 OH OH OCH3. R3 H OCH3 H. 37. 產率(%) 39 45 52. 產物外觀 白色油狀物 白色油狀物 白色油狀物.
(53) 化合物26 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.64(3H, s), 1.77(3H,s ), 3.51(2H, d, J = 7Hz), 3.94(6H,. s), 5.15~5.17(1H, m), 5.84(1H, bs), 6.37(1H, d, J = 9.5Hz), 6.48(1H, d, J = 16Hz), 6.83(2H, s), 7.06( 1H, d, J = 8Hz), 7.35(1H,d, J = 8.5Hz ), 7.67(1H ,d, J = 10Hz), 7.79(1H, d, J = 15.5Hz);. 13. C NMR(125Mhz, CDCl3) :δ18.0, 23.0, 25.7, 56.0, 109.7, 113.7, 114.9, 115.7, 116.8,. 119.2, 120.3, 123.0, 123.6, 125.7, 126.6, 133.3, 134.4, 146.9, 147.6, 148.7, 151.8, 153.0, 160.5, 165.2. 化合物27 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.60(3H, s), 1.78(3H,s ), 3.51(2H, d, J = 7.5Hz),. 3.95(3H, s), 5.15~5.18(1H, m), 6.??(1H, bs), 6.37(1H, d, J = 10Hz), 6.47(1H, d, J = 16Hz), 6.95(1H, d, J = 8Hz), 7.06~7.10( 2H, m), 7.14(1H,d, J = 8.5Hz ), 7.34(1H ,d, J = 8.5Hz), 7.66(1H, d, J = 9.5Hz), 7.81(1H, d, J = 16Hz);. 13. C NMR(125Mhz, CDCl3) :δ18.1, 23.0, 25.7, 56.4, 105.4, 114.0, 115.7, 116.8, 119.2,. 120.2, 123.0, 125.4, 125.7, 133.3, 137.8, 143.4, 147.3, 147.8, 151.7, 153.0, 160.5, 165.1 HRMS Calcd for C25H24O7: 436.1522, Found: 436.1522;. 38.
(54) 化合物28 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.64(3H, s), 1.76(3H,s ), 3.52(2H, d, J =. 6.5Hz),3.92~3.93(6H, m), 5.168(1H, m), 6.37(1H, d, J = 9.5Hz), 6.49(1H, d, J = 15.5Hz), 6.90(1H, d, J = 8Hz), 7.07(1H, d, J = 8.5Hz), 7.10( 1H, d, J = 3.5Hz), 7.162~7.186(1H, m ), 7.34(1H ,d, J = 8.5Hz), 7.66(1H, d, J = 10.5Hz), 7.83(1H, d, J = 16Hz);. 13. C NMR(125Mhz, CDCl3) :δ18.0, 22.9, 25.7, 55.9, 56.0, 109.9, 111.2, 113.9, 115.7,. 116.8, 119.2, 120.3, 123.0, 123.2, 125.7, 126.9, 133.3, 143.4, 147.4, 149.4, 151.7, 151.8, 152.9, 160.5, 165.2. 39.
(55) 29~31: O R3 OH. R2. O R1. HO. O. R3. O. O. O. O. EDC, DMAP, DCM R2 R1. 29~31. 9. 29: 取 5mg(0.0205mmole) 化合物(9) 、8.5mg(0.041mmole) ferulic acid、0.25mg(10%) DMAP、11.7mg(0.0615mmole) EDC 置於 雙頸瓶中,加入 10ml DCM,通氮氣下室溫攪拌 30 分鐘,用水及飽 和食鹽水洗有機層,無水硫酸鎂乾、濃縮,得黃色油狀物。經管柱層 析純化,得到3.8mg 白色油狀物(29) ,產率43%。. 30:步驟同29;5mg(0.0205mmole)化合物(9) 、9.1mg(0.041mmole) Sinapic acid(24) 、0.25mg(10%) DMAP、11.8mg(0.0615mmole) EDC。 31:步驟同29;5mg(0.0205mmole)化合物(9) 、8.536mg(0.041mmole)化 合物(25) 、0.25mg(10%) DMAP、11.8mg(0.0615mmole) EDC。 29 30 31. R1 OCH3 OCH3 OCH3. R2 OH OH OCH3. R3 H OCH3 H. 40. 產率(%) 43 30 50.8. 產物外觀 白色油狀物 白色油狀物 白色油狀物.
(56) 化合物29 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.63(3H, s), 1.76(3H,s ), 2.41(3H, s), 3.52,(2H, d, J =. 7Hz), 3.95(3H, s), 5.15~5.16(1H, m), 5.91(1H, s), 6.25(1H, s), 6.47(1H, d, J = 16Hz), 6.95( 1H, d, J = 8Hz), 7.08~7.10(2H, m), 7.14(1H ,d, J = 7.5Hz), 7.48(1H, d, J = 8.5Hz), 7.82(1H, d, J = 16Hz);. 13. C NMR(125Mhz, CDCl3) :δ18.0, 18.8, 23.1, 25.7, 56.0, 109.6, 113.7, 114.2, 114.9,. 117.9, 118.8, 120.5, 122.4, 123.0 123.6, 126.6, 133.1, 146.9, 147.5, 148.7, 151.6, 152.2, 152.5, 160.6, 165.2. 化合物30 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.63(3H, s), 1.77(3H,s ), 2.42(3H, s), 3.52,(2H, d, J =. 7Hz), 3.45(6H, s), 5.15~5.16(1H, m), 5.82(1H, s), 6.26(1H, s), 6.49(1H, d, J = 16Hz), 6.83( 1H, s), 7.08(1H, d, J = 8.5Hz), 7.48(1H ,d, J = 8.5Hz), 7.48(1H, d, J = 8.5Hz), 7.80(1H, d, J = 15.5Hz);. 化合物31 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.63(3H, s), 1.77(3H,s ), 2.42(3H, s), 3.52,(2H, d, J =. 6.5Hz), 3.93(6H, s), 5.17(1H, m), 5.26(1H, s), 6.50(1H, d, J = 16Hz), 6.90(1H, d, J = 8Hz), 7.08~7.16( 2H, m), 7.17(1H, d, J = 8Hz), 7.48(1H ,d, J = 8.5Hz), 7.83(1H, d, J =. 41.
(57) 15.5Hz);. 13. C NMR(125Mhz, CDCl3) :δ18.0, 18.6, 23.2, 25.7, 55.9, 56.0, 109.9, 111.2, 114.0,. 114.3, 117.9, 118.8, 1205, 122.4, 123.0, 123.2, 126.9, 133.1, 147.4, 149.4, 151.6, 151.8, 152.2, 152.5, 160.6, 165.2. 42.
(58) 32~34: O R3 OH. R2. O R1. HO. O. R3. O. O. O. O. EDC, DMAP, DCM R2 R1. 11. 32~34. 32: 取 4mg(0.0198mmole) 化合物(11) 、6.7mg(0.0396mmole) ferulic acid、0.21mg(10%) DMAP、10mg(0.0594mmole) EDC 置於雙 頸瓶中,加入 10ml DCM,通氮氣下室溫攪拌 30 分鐘,用水及飽和 食鹽水洗有機層,無水硫酸鎂乾、濃縮,得黃色油狀物。經管柱層析 純化,得到3.8mg 白色油狀物(32) ,產率53%。. 33:步驟同32;4mg(0.0198mmole)化合物(11) 、8.9mg(0.0396mmole)Sinapic acid(24) 、0.21mg(10%) DMAP、10mg(0.0594mmole) EDC。 33:步驟同32;4mg(0.0198mmole)化合物(11) 、8.2mg(0.0396mmole)化 合物(25) 、0.21mg(10%) DMAP、10mg(0.0594mmole) EDC。 32 33 34. R1 OCH3 OCH3 OCH3. R2 OH OH OCH3. R3 H OCH3 H. 43. 產率(%) 53 26 22. 產物外觀 白色油狀物 白色油狀物 白色油狀物.
(59) 化合物32 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ3.58(2H, d, J = 6.5Hz), 3.94(6H,s ), 5.00~5.08(2H, m),. 5.83,(1H, s), 5.89~5.94(1H, m), 6.38(1H, d, J = 9.5Hz), 6.48(1H, d, J = 16Hz), 6.83(1H, s), 7.09(1H, d, J = 8.5Hz), 7.38(1H, d, J = 9Hz), 7.68(1H ,d, J = 9.5Hz), 7.79(1H, d, J = 16Hz);. 13. C NMR(125Mhz, d-DMSO) :δ27.3, 55.8, 111.5, 112.6, 115.2, 115.6, 116.2, 116.6,. 119.5, 119.8, 124.0, 125.3, 127.0, 134.3, 144.3, 147.8, 148.0, 150.0, 151.4, 152.3, 159.7, 164.9. 化合物34 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ3.58(2H, d, J = 6Hz), 3.93(6H,s ), 5.00~5.08(2H, m),. 5.87~5.95(1H, m), 6.38(1H, d, J = 9.5Hz), 6.49(1H, d, J =16Hz), 6.89(1H, d, J = 8Hz ), 7.103~7.107(2H, m), 7.17(1H, d, J =8Hz), 7.38(1H ,d, J = 8.5Hz), 7.68(1H, d, J = 9.5Hz), 7.83(1H, d, J =16Hz);. 44.
(60) 35~37: O R3 OH. R2 R1 HO. O. O. O. O. O. EDC, DMAP, DCM O. 16. 35~37. R1. R2 R3. 35: 取 12mg(0.0523mmole) 化合物(16) 、20.2mg(0.104mmole) ferulic acid、0.6mg(10%) DMAP、30mg(0.1569mmole) EDC 置於雙頸 瓶中,加入 10ml DCM,通氮氣下室溫攪拌 30 分鐘,用水及飽和食 鹽水洗有機層,無水硫酸鎂乾、濃縮,得黃色油狀物。經管柱層析純化, 得到8.9mg 白色油狀物(35) ,產率42%。. 36:步驟同35;12mg(0.0523mmole)化合物(16) 、23.4mg(0.104mmole)Sinapic acid(24) 、0.6mg(10%) DMAP、30mg(0.1569mmole) EDC。 37:步驟同35;12mg(0.0523mmole)化合物(16) 、21.6mg(0.104mmole)化 合物(25) 、0.6mg(10%) DMAP、30mg(0.1569mmole) EDC。. 35 36 37. R1 OCH3 OCH3 OCH3. R2 OH OH OCH3. R3 H OCH3 H. 45. 產率(%) 42 40 47. 產物外觀 白色油狀物 白色油狀物 白色油狀物.
(61) 化合物35 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.66(3H, s), 1.74(3H,s ), 3.29,(2H, d, J = 7Hz), 3.9(3H,. s), 5.21~5.23(1H, m), 5.95(1H, s), 6.35(1H, d, J = 9Hz), 6.46(1H, d, J = 16Hz), 6.94( 1H, d, J = 8Hz), 7.07~7.13(3H, m), 7.31(1H , s), 7.64(1H, d, J = 9Hz), 7.81(1H, d, J = 16Hz);. 13. C NMR(125Mhz, CDCl3) :δ17.9, 25.7, 28.2, 56.0, 109.7, 111.1, 113.5, 114.9, 115.9,. 116.8, 120.8, 123.6, 126.5, 128.4, 130.9, 134.3, 143.0, 146.9, 147.7, 148.7, 151.7, 152.9, 160.6, 164.9. 化合物37 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ1.66(3H, s), 1.73(3H,s ), 3.29,(2H, d, J = 7Hz),. 3.92~3.93(6H, m), 5.22~5.25(1H, m), 6.36(1H, d, J = 9.5Hz), 6.48(1H, d, J = 15.5Hz), 6.89(1H, d, J = 8Hz), 7.10~7.12( 2H, m), 7.17(1H, d, J = 8Hz), 7.31(1H , s), 7.65(1H, d, J = 9.5Hz), 7.83(1H, d, J = 16Hz);. 46.
(62) 38~40: O R3 OH. R2. O R1. HO. O. R3. O. O. O. O. EDC, DMAP, DCM R2. 3. 38~40. R1. 38: 取 5mg(0.0309mmole) Umbelliferone(3) 、12mg(0.0617mmole) ferulic acid、0.4mg(10%) DMAP、17.8mg(0.0926mmole) EDC 置於雙頸瓶中,加入 10ml DCM,通氮氣下室溫攪拌 30 分鐘,用水 及飽和食鹽水洗有機層,無水硫酸鎂乾、濃縮,得黃色油狀物。經管 柱層析純化,得到3.9mg 白色油狀物(38) ,產率37%。. 39:步驟同38;5mg(0.0309mmole)化合物(3) 、13.9mg(0.0617mmole)Sinapic acid(24) 、0.4mg(10%) DMAP、17.8mg(0.0926mmole) EDC。 40:步驟同38;5mg(0.0309mmole)化合物(3) 、12.8mg(0.0617mmole)化 合物(25) 、0.4mg(10%) DMAP、17.8mg(0.0926mmole) EDC。. 38 39 40. R1 OCH3 OCH3 OCH3. R2 OH OH OCH3. R3 H OCH3 H. 47. 產率(%) 37 41 67. 產物外觀 白色粉末 白色粉末 白色粉末.
(63) 化合物38 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ3.94(6H, s), 5.92(1H, s), 6.38(1H, d, J = 9.5Hz),. 6.45(1H, d, J = 16Hz), 6.94(1H, d, J = 8.5Hz), 7.08~7.18( 4H, m), 7.49(1H, d, J = 8.5Hz ), 7.68(1H , d, J = 10Hz), 7.81(1H, d, J = 16Hz);. 13. C NMR(125Mhz, CDCl3) :δ56.0, 109.7, 110.5, 113.7, 114.9, 115.9, 116.5, 118.5,. 123.7, 126.5, 128.5, 142.9, 146.9, 147.8, 148.7, 153.6, 154.8, 160.4, 164.9 HRMS Calcd for C19H14O6: 338.079, Found: 338.0789;. 化合物39 的光譜資料如下: 1. H NMR(500MHz, d-DMSO) :δ3.82(6H, s), 6.47(1H, d, J = 9.5Hz), 6.78(1H, d, J =. 16Hz), 7.14(2H, s), 7.23(1H, d, J =8.5Hz), 7.34(1H ,s), 7.78(1H, s), 7.80(1H, d, J = 7.5Hz), 8.08(1H, d, J =9.5Hz), 9.03(1H, s);. 13. C NMR(125Mhz, d-DMSO) :δ56.11, 56.13, 106.8, 110.0, 113.2, 115.4, 116.5, 118.6,. 124.1, 129.3, 139.0, 143.8, 148.5, 148.08, 153.1, 154.1, 159.7, 164.8. 化合物40 的光譜資料如下: 1. H NMR(500MHz, CDCl3) :δ3.92(6H, s), 6.38(1H, d, J = 9.5Hz), 6.47(1H, d, J =. 16Hz), 6.89(1H, d, J = 8.5Hz), 7.10~7.18(4H, m), 7.49(1H ,d, J = 8Hz), 7.68(1H, d, J = 9.5Hz), 7.83(1H, d, J = 16Hz); 48.
(64) 13. C NMR(125Mhz, CDCl3) :δ55.9, 56.0, 109.9, 110.5, 111.2, 113.9, 115.9, 116.5,. 118.5, 123.3, 126.9, 128.5, 142.8, 147.6, 149.4, 151.9, 153.5, 154.8, 160.4, 164.8. 49.
(65) 第四章 細胞毒性活性測試結果 4-1 細胞毒性實驗 Ⅰ.實驗材料 1.實驗細胞株及培養液 1-1. 細胞株 (1) 人類腸腺癌細胞 (HT-29 cell line, ATCC HTB-38) (2) 人類胃癌細胞 (AGS cell line, ATCC CRL-1739) (3) 人類子宮頸癌細胞 (HeLa cell line, ATCC CCL-2) (4) 人類正常肝細胞 (Chang liver cell line, ATCC CCL-13) 上述細胞來源為食品工業發展研究所菌種中心. 2.實驗藥品與試劑 2-1. 一般化學試劑 (1) NaCl, Na2HPO4, KCl, KH2PO4,HCl, KOH, NaHCO3 (Merck, Germany) (2) Dimethyl sulfoxide (DMSO) (Merck, Germany) (3) Methanol (Merck, Germany) (4) Isopropanol (Merck, Germany) 2-2. 染色劑 (1) Trypan blue (Sigma, USA) (2) MTT(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium 50.
(66) bromide) (Sigma, USA). 3.實驗儀器 (1). 微量天平 (Shimadzu; Libror AEL-40SM, Japan). (2). 低溫離心機 (Centrifuge tube, Kubota 5700, Japan). (3). 低溫離心機 (Eppendrof, 5415C, Germany). (4). 倒立顯微鏡 (Olympus Ut50A, Japan). (5). 正向顯微鏡 (Olympus BH2, Japan). (6). 無菌操作台 (造鑫, Taiwan). (7). 振搖水浴機 (Yamato, Japan). (8). 血球計數器 (Hemocytometer; Bright-line, USA). (9). 組織培養皿 (Falcon, USA). (10) 96-well 組織培養盤 (Falcon, USA) (11) 24-well 組織培養盤 (Falcon, USA) (12) 純水製造機 (Millipore, Milli-RO 10, Milli-QRG, USA) (13) MicroELISA- spectrophotometer 分 光 光 度 計 (Dyn-EX MRX, USA) (14) 自動血球計數器 (Symex;F-800, Japan) (15) 二氧化碳培養箱 (Espec BNA-211, Japan) (16) 高溫滅菌器 (廣水, Taiwan) 51.
(67) II.實驗方法 1. 細胞株之繼代培養 (1) 試液配製: A. 培養液 RPMI 1640 粉末 10.4 克加 2.2 克碳酸氫鈉溶於 1 公升二次蒸餾水中,攪拌均勻後,調整酸鹼值至 7.2-7.3, 加入 10 mM Hepers,以 0.22 µm 濾膜過濾分裝。使用前 加入 FBS 10%、L-glutamine 1%、P/S 1%。 B. 培養液 DMEM 粉末 13.54 g 加 3.7 g 碳酸氫鈉溶於 1 公升 二次蒸餾水中,攪拌均勻後,調整酸鹼值至 7.2-7.3,以 0.22 µm 濾膜過濾分裝。使用前加入 FBS 10%、L-glutamine 1%、P/S 1%。 C. 磷酸緩衝液 Phosphate buffer saline,(PBS) KCl. 0.20. g. NaCl. 8.00. g. Na2HPO4. 1.14. g. KH2PO4. 0.20. g. 用二次蒸餾水配製成 1 公升 10 倍的 PBS 儲備溶液,使用 前以二次蒸餾水稀釋十倍,高壓滅菌後使用。. 52.
(68) (2) 培養方法: A. 細胞之解凍 將冷凍之細胞由-80℃冰箱中取出,於 37℃水浴下解凍, 取出細胞液混合 5 ml 之培養液於 15 ml 離心管中,以 1200 rpm 離心 5 分鐘,吸去上清液,加 10 ml 培養液,將細胞移至 10 公分培養皿中,於 37℃,含 5﹪CO2 的培養箱中培養。 B. a. 細胞之培養 以培養皿中的舊培養液將細胞沖下呈懸浮態,吸取懸 浮液 1-2 ml 至新的 10 公分培養皿,加入新培養液調整細 胞至適當濃度,再放回培養箱於 37℃、5﹪CO2 中培養。 C. 細胞數目的計算: 混合均勻之懸浮液後,取出 0.5 ml 置於微量離心管中, 取出 15 µl 與等量的 Trypan blue 混合均勻,再吸出 15 µl 放入 血球計數器上。用血球計數器記錄井字之四角各 25 小格之活 細胞數。反覆三次,求平均值。 總細胞數 = (平均值 / 4 ) × 2×104 個/ ml。. 53.
(69) 2. 細胞存活性試驗 (1) MTT 分析之原理 : 利用黃色 MTT 溶液被活細胞粒線體內的去氫酶間接還原成 formazan 呈紫黑色結晶(如圖 1),以含 0.04 N 鹽酸之異丙醇將結 晶溶解,在 600 nm 波長下測吸光度,計算細胞存活率。. N N. N Br. N+. Dehydrogenase. N S. HN N N. N+. CH3. N S. CH3. CH3 CH3. MTT. Formazan. 圖 16 MTT 被活細胞粒線體內的去氫酶間接還原成 Formazan 之原理。. (2) MTT 溶液的配製: 精秤 50 mg MTT,加入 10 ml 1﹪PBS 溶解後,以 0.22 µm 濾 膜過濾,避光儲存於 4℃冰箱備用。 (3) 分析步驟: 將脾細胞種至 24-well plate,細胞數 2×106 cells/well,加入 10 µg/ml LPS 及不同濃度之待測藥物,置於 37℃、5﹪CO2 培養箱中 44 小時後,轉至 1.5 ml 小離心管,1200 rpm 離心 10 分鐘,去上 清液,以 200 µl PBS 清洗細胞,1200 rpm 離心 10 分鐘,倒掉上 54.
(70) 清液,加入 180 µl 培養液和 20 µl MTT (5 mg/ml),在 37℃、5% 二氧化碳培養箱下,培養 4 小時,使形成紫色結晶;離心後吸掉 上清液 150 µl,再加入 150 µl 含 0.04 N 鹽酸之異丙醇將結晶溶 解,離心後吸取上清液 150 µl,以 microELISA- spectrophotometer 在波長 600 nm 下測其吸光度 (O.D.值)。. 55.
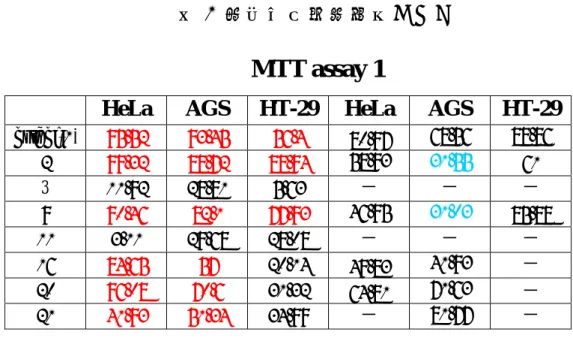
(71) 4-2 細胞毒性實驗結果. O. O. O. O. osthol(1). O. O. O. O. O. 20. O. O. O. 21. 10. O. O. O. O. 22. HO. O. O. HO. O. 2. O. HO. O. 11. 9. HO. O. HO. O. O. 3. 16. 56. O. O.
(72) 26: R1=OCH3, R2=OH, R3=H 27: R1=OCH3, R2=OH, R3=OCH3 28: R1=OCH3, R2=OCH3, R3=H. O R3 O. O. O. R2 R1. 26~28. 29: R1=OCH3, R2=OH, R3=H 30: R1=OCH3, R2=OH, R3=OCH3 31: R1=OCH3, R2=OCH3, R3=H. O R3 O. O. O. R2 R1. 29~31. 32: R1=OCH3, R2=OH, R3=H 33: R1=OCH3, R2=OH, R3=OCH3 34: R1=OCH3, R2=OCH3, R3=H. O R3 O. O. O. R2 R1. 32~34. O. O. 35: R1=OCH3, R2=OH, R3=H 36: R1=OCH3, R2=OH, R3=OCH3 37: R1=OCH3, R2=OCH3, R3=H. O. O R1. R2 R3. 35~37. 38: R1=OCH3, R2=OH, R3=H 39: R1=OCH3, R2=OH, R3=OCH3 40: R1=OCH3, R2=OCH3, R3=H. O R3 O. O. O. R2 R1. 38~40. 圖 17 結構(一). 57.
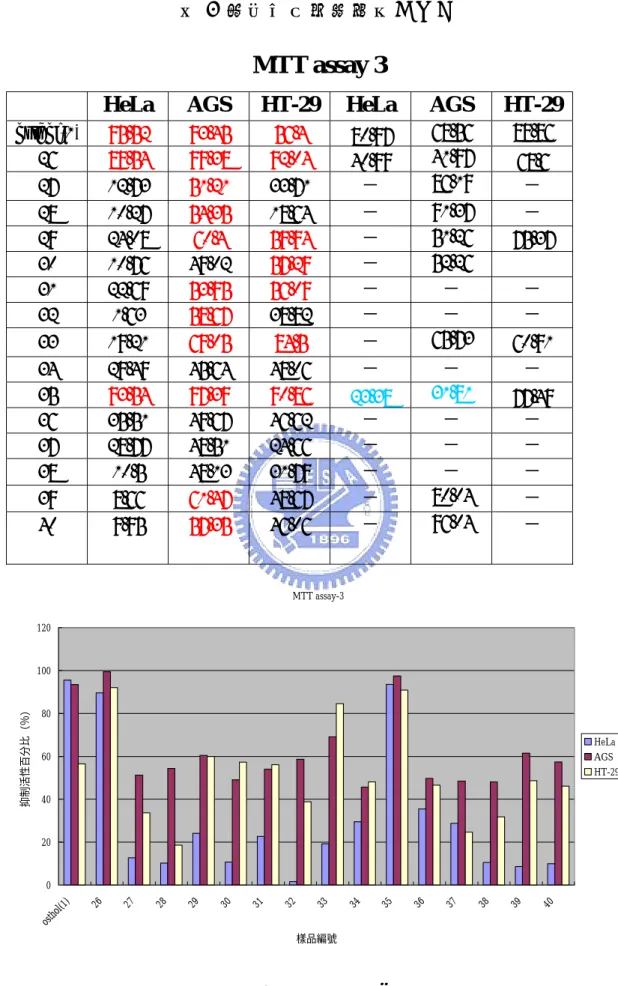
(73) 表 1 細胞毒性測試結果(一). MTT assay 1 osthol(1) 2 3 9 11 16 20 21. HeLa. AGS. HT-29. HeLa. AGS. HT-29. 95.52 99.32 11.92 90.46 3.11 84.65 96.08 41.93. 93.45 88.72 28.81 82.1 29.68 57 70.6 51.34. 56.4 88.94 5.63 77.93 28.08 20.14 31.32 34.99. 80.97 58.93 - 46.95 -. 68.56 31.55 - 31.03 - 41.93 71.63 81.77. 88.86. 49.83 64.81 -. 61 - 85.88 - - - -. MTT assay-1 120. 100. 抑制活性百分比. 80 HeLa AGS HT-29. 60. 40. 20. 0 osthol(1). 2. 3. 9. 11. 16. 樣品編號. 圖 18 測試結果(一). 58. 20. 21.
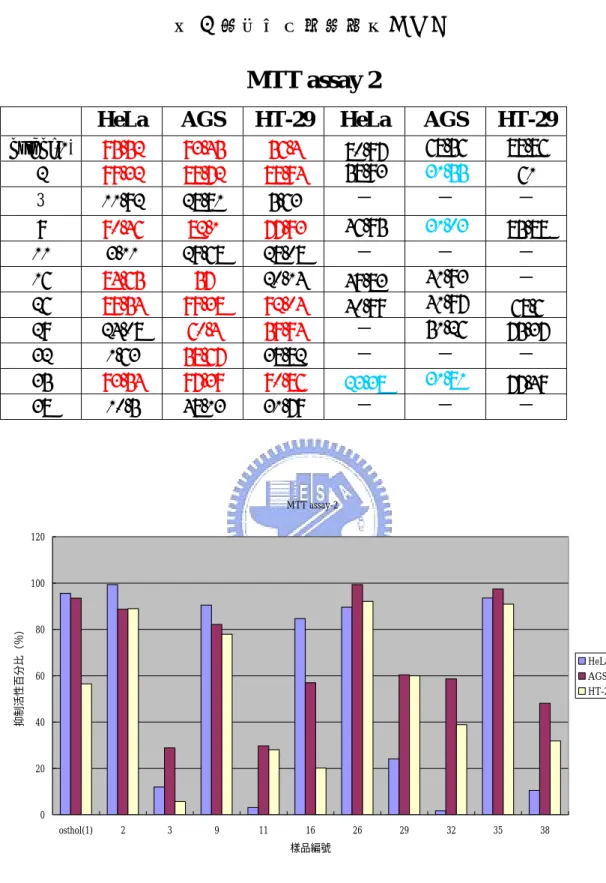
(74) 表 2 細胞毒性測試結果(二). MTT assay 2 HeLa. AGS. HT-29. HeLa. AGS. HT-29. osthol(1) 2 3. 95.52 99.32. 93.45 88.72. 56.4 88.94. 28.81. 5.63. 68.56 31.55 -. 88.86. 11.92. 80.97 58.93 -. 9 11 16 26 29 32 35 38. 90.46 3.11 84.65 89.54 24.08 1.63 93.54 10.5. 82.1 29.68 57 99.38 60.4 58.67 97.39 48.13. 77.93 28.08 20.14 92.04 59.94 38.82 90.86 31.79. 46.95 -. 31.03 - 41.93 41.97 51.26 - 31.81 -. 85.88 - -. 49.83 40.99 - - 23.38 -. 61 -. 68.6 75.37 - 77.49 -. MTT assay-2 120. 抑制活性百分比(%). 100. 80 HeLa AGS HT-29. 60. 40. 20. 0 osthol(1). 2. 3. 9. 11. 16. 26. 29. 樣品編號. 圖 19 測試結果(二). 59. 32. 35. 38.
(75) 表 3 細胞毒性測試結果(三). MTT assay 3 HeLa. AGS. HT-29. HeLa. AGS. HT-29. osthol(1) 26. 95.52 89.54. 93.45 99.38. 56.4 92.04. 12.73. 51.21. 33.71. 68.56 41.97 86.19. 88.86. 27. 80.97 40.99 -. 28 29 30 31 32. 10.27 24.08 10.76 22.69 1.63. 54.35 60.4 49.02 53.95 58.67. 18.64 59.94 57.29 56.09 38.82. - - - - -. - 75.37. 33. 19.21. 69.05. 84.5. -. 91.37 51.26 52.26 - - 65.73. 34 35 36 37 38 39 40. 29.49 93.54 35.51 28.77 10.5 8.66 9.95. 45.64 97.39 49.67 48.51 48.13 61.47 57.35. 48.06 90.86 46.62 24.66 31.79 48.67 46.06. -. 68.6 -. - - 60.91 -. - 31.81 - - - 80.04 96.04. 23.38 - - - - -. 77.49 - - - - -. MTT assay-3 120. 80 HeLa AGS HT-29. 60. 40. 20. 樣品編號. 圖 20 測試結果(三) 60. 40. 39. 38. 37. 36. 35. 34. 33. 32. 31. 30. 29. 28. 27. 26. (1 ). 0 os th ol. 抑制活性百分比(%). 100.
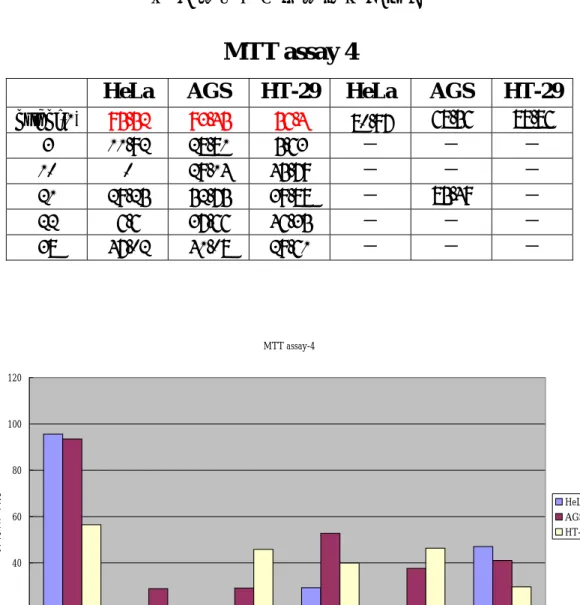
(76) 表 4 細胞毒性測試結果(四). MTT assay 4 osthol(1) 3 10 21 22 38. HeLa. AGS. HT-29. HeLa. AGS. HT-29. 95.52 11.92 0 29.25 6.6 47.02. 93.45 28.81 29.14 52.75 37.66 41.08. 56.4 5.63 45.79 39.88 46.35 29.61. 80.97 - - - - -. 68.56 - - 85.49 - -. 88.86 - - - - -. MTT assay-4 120. 100. 抑制活性百分比. 80 HeLa AGS HT-29. 60. 40. 20. 0 osthol(1). 3. 10. 21 樣品編號. 圖 21 測試結果(四). 61. 22. 38.
(77) 第五章 結果與討論 首先,我們針對 Osthenol(2)上的 isoprenyl 來進行討論,分別 合成出化合物(2) 、(3)、 (9)、 (11) 、(16)及(21)來探討 SAR。 可以發現當 osthenol(2)上 C8 位置的 isoprenyl 分別被 H group(3) 或是 allyl group(11)取代之後活性有非常明顯的下降。另外,將 osthol (1) C8 位置上的 isoprenyl 氫化之後得到化合物(20) ,亦觀察到對 於 AGS cells 及 HT-29 cells 的活性有明顯的下降趨勢,由此可得知 osthol(1) C8 位置上的 isoprenyl group 對於細胞毒性具有相當重要 的影響。. O. O. O. HO. osthol(1). HO. O. 16. O. O. HO. HO. O. O. O. O. O. 3 21. 圖 22 結構(二). 62. HO. O. 11. 9. 2. O. O. O. O.
(78) 表 5 細胞毒性測試結果(五) Osthol(1) 2 3 9 11 16 21. HeLa. AGS. HT-29. 95.52 99.32 11.92 90.46 3.11 84.65 96.08. 93.45 88.72 28.81 82.1 29.68 57 70.6. 56.4 88.94 5.63 77.93 28.08 20.14 31.32. 100µM/48hrs 此外,我們合成出 isoprenyl group 位於 C6 位置的化合物 demethylsuberosin(16),與 osthenol(2)比較後發現活性下降,尤 其對於 HT-29 cells 的活性明顯降低,可知 isoprenyl group 位於 C8 的 位置上具有較好的抗癌活性。 再來,我們利用化合物(2) 、 (3) 、 (9) 、 (11) 、 (16)C7 位置上 的 OH 基接上 ferulic acid(23)來形成新的衍生物(26) 、 (29) 、 (32) 、 (35)、 (38) 。經觀察發現除了化合物(29)之外,其餘的衍生物均 明顯的增進癌細胞毒殺效果,所以我們可以往這個方向繼續更深入的 探討。而相較於化合物(2)而言,化合物(9)僅在 C4 的位置上多 了一個甲基,但是為甚麼形成衍生物(29)之後卻造成活性下降?必 須經由更多的討論之後才有辦法作更進一步的解釋。. 63.
(79) O. O. O. O. O. O. HO. O. O. HO O. O. 29. 26. 圖 23 結構(三). 表 6 細胞毒性測試結果(六) 2 9 26 29. HeLa. AGS. HT-29. 99.32 90.46 89.54 24.08. 88.72 82.1 93.72 60.4. 88.94 77.93 73.46 59.94. 100µM/48hrs 接著我們分別合成新的衍生物 27~40 來和化合物(26) 、(29) 、 (32) 、 (35) 、 (38)做活性上的比較。可得知當 ferulic ester 中 benzene ring 上的 OH 基被保護起來時(形成 OCH3) ,其活性趨勢是下降的, 由此可了解 OH 基對於癌細胞毒殺具有相當重要的作用,而當 benzene group 上多出一個 OCH3 時,其活性趨勢亦是下降的。推論其原因或 許當衍生物的疏水性上升時,對於癌細胞的毒殺效果會造成下降的趨 勢。 O. O. O. O O. HO. O. O. O. O. O. HO O. O. 26. O. O O. 27. 圖 24 結構(四) 64. 28. O. O.
(80) 表 7 細胞毒性測試結果(七) 26 27 28. HeLa. AGS. HT-29. 89.54 12.73 10.27. 99.38 51.21 54.35. 92.04 33.71 18.64. 100µM/48hrs 另外,化合物(33)及化合物(34)對於化合物(32)的活性測試結 果卻是上升的趨勢,這是唯一與其他系列衍生物的活性趨勢相反的系 列,但是無法解釋為何有這樣的結果。 O. O. O. O O. O. O. HO. O. O. HO O. O. O. O. O. O O. O. 33. 32. 34. 圖 25 結構(五) 表 8 細胞毒性測試結果(八) 32 33 34. HeLa. AGS. HT-29. 1.63 19.21 29.49. 58.67 69.05 45.64. 38.82 84.5 48.06. 100µM/48hrs 最後我們根據細胞毒性測試有不錯表現的化合物更進一步的做 IC50 的細胞活性測試,發現到雖然從 MTT assay 的數據來看,化合物 (26)與化合物(35)和 osthol(1)比較起來雖然表現都很不錯, 但是從 IC50 來看,化合物(26)與化合物(35)的數據要比 osthol(1) 低上許多,所以我們可以利用化合物(26)與(35)做為先導藥物更 進一步發展出新的抗癌藥物。 65.
(81) O. O. O. O. O. O. O. HO. O. HO O. osthol(1). O. O. 26. 16. O. O. O. O. O HO. O. 20. 35. 圖 26 結構(六). 表 9 IC50. IC50 (µM) osthol(1) 16 20 21 26 35. HeLa. AGS. HT-29. 80.97 49.83 64.81 >100 40.99 23.38. 68.56 41.93 71.63 >100 41.97 31.81. 88.86 - - - 68.60 77.49. 66. O.
(82) 第六章 結論 本實驗合成出一系列的 osthol(1)衍生物經由細胞毒性測試實 驗後探討其結構與活性間的關係(SAR)。有以下幾點發現: 1.osthol(1)上的 isoprenyl group 對於抗癌活性有重要的影響。 2.Isoprenyl group 位於 osthol(1)C8 上的位置比位於 C6 的位置具有 更好的活性表現。 3.osthol(1)上的 3,4-olefinic bond 對抗癌活性有影響,但作用機制 不明,可更進一步研究探討。 4.衍生物上的 OH 基對於毒殺癌細胞具有相當重要的作用。 5.當化合物 osthenol(2) 、demethylsuberosin(9)接上 freulic acid(23) 形成衍生物(26) 、 (35)後,抗癌活性上升,且 IC50 的值明顯的下 降。 最後,因為薑黃素(curcumin)不僅在抗癌方面表現優異,對於 抗發炎亦有不錯的表現,因此我們相信取其部分結構形成的化合物 ferulic acid(23)做為取代基所合成出來的一系列衍生物(26~40)對 於抗發炎也會有不錯的結果。. 67.
(83) 參考文獻 1. 蔡金娜,張亮,王崢濤,徐珞珊,杜芳,徐國鈞;藥學學報(Acta Pharmaceutica Sinica),1999, 34, 767-771. 2. 王明傑,私立台北醫學大學,碩士論文,2002 3. L. L. Yang, M. C. Wang, L.G. Chen, and C. C. Wang. Plant Med, 2003, 69, 1091-1095. 4. 謝佳玲,中國醫藥學院,博士論文,2003 5. Y. Hitotsuyanagi, H. Kojima, H. Ikuta, K. Takeya, and Itokawa. Bioorganic & Medicinal chemistry Letters, 1996, 6, 1791-1794. 6. S. Kawaii, Y. Tomono, K. Ogawa, M. Sugiura, M. Yano, Y. Yashizawa, C. Ito, and H. Furukawa. Anticancer Research, 2001, 21, 1905. 7. A. Gawron, and K. Gtowniak. Planta Medica, 1987, 48, 526. 8. R. L. Huang, C. C. Chen, Y. L. Huang, D. J. Hsien, C. P. Hu, C. F. Chen, and C. M. Chang. Hepatology,1996, 24, 508. 9. T. Okamoto, S. Yoshidda, T. Kobayashi, and S. Okabe. Jpn. J. Pharmacol, 2001, 85, 95. 10. T. Okamoto, T. Kawasaki, and O. Hino. Biochemical Pharmacology, 2003, 65, 677. 11. I. S. Chen, H. F. Chen, M. J. Cheng, Y. L. Chang, C. M. Teng, I.. 68.
(84) Tsutomu, J. J. Chen, and I. L. Tsai. J. Nat. Prod. 2001, 64, 1143. 12. X. X. Li, I. Hara, and T. Matsumiya. Biol. Pharm. Bull. 2002, 25, 738. 13. A. Murakami, G. Gao, O. K. Kim, M. Omura, M. Yano, C. Ito, H. Furukawa, S. Jiwajinda,K. Koshimizu, and H. Ohigashi. J. Agric. Food Chem. 1999, 47, 333. 14. M. M. Ballantyne, P. H. Mccabe, and R. D. H. Murry. Tetrahedron, 1971, 27, 871. 15. R. D. H. Murray, M.M.Ballantyne, and K.P. Mathai. Tetrahedron, 1971, 27, 1247. 16. R. D. H. Murrcy, M. Sutcliffe, and P. H. Mccabe. Tetrahedron, 1971, 27, 4901. 17. R. D. H. Murray, M. M. Ballantyne, T. C. Hogg, and P. H. Mccabe. Tetrahedron, 1975, 31, 2960. 18. D. S. Karanewsky, and Y. Kishi. J. Org. Chem. 1976, 41, 3026. 19. G. M. Massanet, E. Pando, F. R. Luis, aand J. Salva. Heterocycles, 1987, 26, 1541. 20. K. H. Glusenkamp, and G. Buchi. J. Org. Chem. 1986, 51, 4481. 21. G. Gopalakrishnan, V. Kasinath, N. D. P. Sing, R. Thirumurugan, S. S. S. Raj, and G. Shanmugam. Molecules, 2000, 5, 880.. 69.
(85) 22. R. H. Galan, G. M. Massanet, E. Pando, F. R. Luis, and J. Salva. Heterocycles, 1989, 29, 297. 23. J. Salva, F. R. Luis, E. Pando, G. M. Massanet, and R. H. Galan. Heterocycles, 1990, 31, 255. 24. 黃俊銘,私立中國醫藥大學,碩士論文,2002 25. MC Jinag, YHF Yang, JI Yen, and IK Lin. Nutr Cancer, 1996, 26, 111. 26. H Chen, ZS Zhang, YL Zhang, and DY Zhou. Anticancer Research, 1999, 19, 3675. 27. ML Kuo, TS Huang, JK Lin. Biochim Biohys Acta. 1996, 1317, 95. 28. SM Plummer, KA Holloway, MM Manson, RJ Munks, A Kaptein, S Farrow, and L Howells. Oncogene, 1999, 18, 6013. 29. P. W. Austin, and T. R. Seshadri. Indian Journal of Chemistry, 1968, 6, 412. 30. N. Cairns, L. M. Harwood, and D. P. Astles. J. Chem. Soc. Perkin. Trans. 1, 1994, 21, 3101. 31. N. Cairns, L. M. Harwood, D. P. Astles, and A. Orr. J. Chem. Soc., Chem. Commun. 1986, 182-183.. 70.
(86) 71.
(87) 72.
(88) 73.
(89) 74.
(90) 75.
(91) 76.
(92) 77.
(93) 78.
(94) 79.
(95) 80.
(96) 81.
(97) 82.
(98) 83.
(99) 84.
(100) 85.
(101) 86.
(102) 87.
(103) 88.
(104) 89.
(105) 90.
(106) 91.
(107) 92.
(108) 93.
(109) 94.
(110) 95.
(111) 96.
(112) 97.
(113) 98.
(114) 99.
(115) 100.
(116) 101.
(117) 102.
(118) 103.
(119) 104.
(120) 105.
(121) 106.
(122) 107.
(123) 108.
(124) 109.
(125) 110.
(126) 111.
(127) 112.
(128)
數據

+5
相關文件
塑合板並配合五金配件製成建築用之門、窗、框及 1 至 3 階之樓梯 或其相關結合體等。試題分別由 2 至 3
(1)針對具有中子研究專長者,具備下列要件之 一:①物理、化學、核工系所博士畢業,具 二年以上中子研究經驗;執行中子散射、繞
為降低藥品安全性與有效性試驗的成本與其耗費的時間,
該試驗偏離第四次通報,通報 1 位受試者,1 件 試驗偏離,原因為受試者用藥順從性低於 protocol 閾值(80%), study nurse
病歷號 主診斷 藥品5碼 BLOOD WBC執行日 就醫流水號 次診斷1 藥品成份名 BLOOD WBC檢驗值 性別 次診斷2 藥品商品名 HGB執行日. 出生日期 次診斷3 藥品開立日期時間
13.違反本契約第 8 條第 17 款第 1 目、第 2 目、第 3 目第 1 子目、第 18 款第 3 目第 1 子目(適用勾選本子目選項者)至第 3 子目及第 14 條第
2-1 化學實驗操作程序的認識 探究能力-問題解決 計劃與執行 2-2 化學實驗數據的解釋 探究能力-問題解決 分析與發現 2-3 化學實驗結果的推論與分析
oBike 標榜「騎到哪、停到哪」,大量放置可 租借的單車,但隨後各地開始出現棄置、違規