柚籽黏質物的純化與應用之研究
76
0
0
全文
(2) 目錄 目錄. i. 表目錄. iv. 圖目錄. v. 縮寫表. vi. 摘要. 1. ABSTRACT. 3. 第一章. 4. 前言. 1.1 種籽黏質之簡介. 4. 1.2 黏質多醣體之組成. 5. 1.3 果膠的應用. 6. 1.4 皮膚的構造與老化之簡介. 7. 1.5 自由基之簡介. 9. 1.6 抗氧化機制之簡介. 10. 1.7 研究動機與目的. 11. 第二章. 材料與方法. 13. 2.1 實驗材料. 13. 2.2 實驗方法. 13. 2.2.1. 柚籽表面黏質物的製備. 13. 2.2.2. 陰離子交換層析法 (anion exchange chromatography)純化. 13. 2.2.3. 多醣體組成分析. 15. 2.2.3.1. 總醣含量測定. 15. 2.2.3.2. 醣醛酸含量測定. 16. 2.2.3.3. 蛋白質含量測定. 17. 2.2.3.4. 醣類成份分析. 17. 2.2.3.4.1. 中性單醣組成. 17. 2.2.3.4.2. 酸醛酸組成. 20. 2.2.3.5. 甲基化程度(degree of methylation). 24. 2.2.4. 分子量分析. 25. 2.2.5. 特性分析. 27. 2.2.5.1. 水合能力 (water hydration capacity)測定. 27. 2.2.5.2. 黏度(viscosity)測定. 28. 2.2.5.3. 抗氧化性質分析. 29 i.
(3) 2.2.5.3.1 清除 1,1-diphenyl-2-picryl hydrazyl (DPPH)自由基能力測定. 29. 2.2.5.3.2 Superoxide dismutase (SOD)活性測定. 30. 2.2.5.3.3. 螯合亞鐵離子能力測定. 31. 2.2.6. 細胞培養條件與方法. 32. 2.2.7. 細胞計數. 34. 2.2.8. 細胞存活率測試. 35. 2.2.9. 細胞型態觀察變化. 36. 2.2.10 第三章. 統計方法. 36. 結果. 37. 3.1 萃取柚籽表面黏質物所得產率. 37. 3.2 陰離子交換層析純化多醣體. 37. 3.3 多醣體組成分析. 37. 3.3.1. 總醣、醣醛酸及蛋白質含量. 37. 3.3.2. 醣類成份. 38. 3.3.3. 甲基化程度. 38. 3.4 純化多醣體的分子量分析. 38. 3.5 多醣體特性分析. 39. 3.5.1. 水合能力. 39. 3.5.2. 黏度. 39. 3.5.3. 抗氧化分析. 39. 3.5.3.1 清除 DPPH 自由基能力. 39. 3.5.3.2. SOD活性測定. 39. 3.5.3.3. 螯合亞鐵離子能力. 40. 3.5.4. 細胞毒性分析. 40. 3.5.5. 細胞型態. 40. 討論. 41. 第四章. 4.1. 柚籽多醣體的產率. 41. 4.2. 柚籽多醣體的組成. 42. 4.3. 柚籽多醣體的分子量. 43. 4.4. 柚籽多醣體的特性. 44. 4.4.1. 柚籽多醣體的水合能力. 44. 4.4.2. 柚籽多醣體的黏度. 44. 4.4.3. 柚籽多醣體的的抗氧化能力. 45. 4.4.4. 柚籽多醣體對 NIH-3T3 細胞的毒性分析. 47. ii.
(4) 第五章. 未來研究方向. 49. 第六章. 參考文獻. 62. iii.
(5) 表目錄 表 3-1. 室溫水萃柚籽表面黏質物 (WE)的產率. 50. 表 3-2. 以 DE-52 樹脂分離 WE 得到兩 fraction的回收率. 50. 表 3-3. WE 與 Fraction B 的總醣、醣醛酸及蛋白質含量比率. 50. 表 3-4. Fraction B 內中性單醣的相對比例. 51. 表 3-5. Fraction B 的甲基化程度. 51. 表 3-6. WE、Fraction B 與 Gluten 的水合能力. 52. 表 3-7. WE 與 Fraction B 的 Superoxide dismutase 活性. 52. iv.
(6) 圖目錄 圖 1-1. 以 0.2% (w/v) ruthenium red 染色膨潤後的柚籽黏質. 11. 圖 1-2. 實驗架構圖. 12. 圖 3-1. 以陰離子交換樹脂 (DE-52)樹脂分離 WE 的層析圖. 53. 圖 3-2. 以液相層析系統分析 Fraction B 的醣類成份層析圖. 54. ®. 圖 3-3. 標準品 (A)與 Fraction B (B)在 Sephacryl S-400 的分子篩層析圖. 55. 圖 3-4. 決定 Fraction B 的分子量. 56. 圖 3-5. 不同濃度的 WE 與阿拉伯膠水溶液的黏度變化. 57. 圖 3-6. 不同濃度的 WE、Fraction B 及 ascorbic acid 對清除 DPPH 自由基活 性之影響. 58. 圖 3-7. 不同濃度的 WE、Fraction B 及 EDTA 對螯合亞鐵離子活性之影響. 59. 圖 3-8. 以不同濃度的 WE 與 Fraction B 處理 24 小時後,對小鼠纖維母細胞 的存活率之影響. 圖 3-9. 60. 以倒立式相位差顯微鏡觀察小鼠纖維母細胞經 WE 與 Fraction B 處理 24 小時後之細胞型態變化. 61. v.
(7) 縮寫表 ADI. acceptable daily intake. CMS. chromatography management system. cP. centipoise. DDS. drug delivery system. DE-52. diethylaminoethyl cellulose-52. DMEM. Dulbecco,s modified Eagle Medium. DMSO. dimethyl sulfoxide. DPPH. 1,1-diphenyl-2-picryl hydrazyl. EDTA. (ethylendinitrilo) tetraacetic acid disodium salt. EGCG. epigallocatechin gallate. FBS. fetal bovine serum. GSH-Px. glutathione peroxidase. HGA. homogalacturonan. H2O2. hydrogen peroxide. IC50. 50% inhibiting concentration. LDL. low-density-lipoprotein. NIH-3T3 cell. NIH-3T3 mouse embryonic fibroblasts. MTT. methylthiazoletetrazolium. O2‧-. superoxide radical. ‧OH. hydroxyl radical. PBS. phosphate buffered saline vi.
(8) RG I. rhamnogalacturonan I. RG II. rhamnogalacturonan II. ROS. reactive oxygen species. SOD. superoxide dismutase. TEWL. transepidermal water loss meter. TFA. trifluoroacetic acid. WE. water extract. XGA. xylogalacturonan. vii.
(9) 柚籽黏質物的純化與應用之研究 指導教授:王恆隆 博士 國立高雄大學生命科學系 研究生:蔡佩蓉 國立高雄大學生物科技研究所 摘要 一些植物種子種皮的最外層含有黏質,此黏質具有吸取水分、黏附土壤或動物 及確保種子萌芽等多項生理功能。由於白柚 (Citrus grandis Osbeck)種子浸潤水 後表層呈現透明的黏質物,而且經 ruthenium red 染色後呈紅紫色,確認該黏質 物的主要成份是酸性多醣。本論文期望藉由組成與特性分析,評估柚籽表面的酸 性多醣是否具有應用於食品及化妝品的潛力。以室溫的水萃取柚籽表面黏質物 (water extract,WE),產率約 3%。WE 具有高黏度特性,1% (w/v)水溶液可達 6000 cP 以上。WE 經由陰離子交換層析 (DE-52)分離為主要的兩個 fraction,分別為 於二次水流洗出的 Fraction A,以及於 0.100.18 M NaCl 濃度梯度流洗出的 Fraction B。Fraction B 是 WE 的主要組成,具有高含量的醣醛酸,分子量為 73– 242 kDa,而且其醣類成份包含 rhamnose、arabinose、galactose、glucose、mannose 或 xylose、galacturonic acid 及 glucuronic acid 等。WE 與 Fraction B 皆無顯著清 除 DPPH 自由基能力,且螯合亞鐵離子明能力顯低於 EDTA;然而 WE 與 Fraction B 具有高 SOD 活性,以及良好的水合能力,分別為 9.4 與 15.2 mL/g dry weight。 此外,WE 與 Fraction B 對小鼠纖維母 (NIH-3T3)細胞皆無毒性。 關鍵字:黏質、多醣體、組成、分子量、醣類成份、黏度、水合能力、抗氧化 能力、細胞毒性。 1.
(10) Purification and Application Studies of Mucilage Extracted from Shaddock Seed Advisors: Dr. Heng-Long Wang Institute of Biotechnology, National University of Kaohsiung Student: Pei-Jung Tsai Institute of Biotechnology, National University of Kaohsiung. ABSTRACT. The outer layer of the seed coat in some plant seeds contains large quantities of mucilage. Mucilage in these seeds is thought to perform a variety of physiological functions, including the absorption of water, attachment to soil substrates and animal vectors, protection the seed and its germination. Following the imbibitions of water, the outer layer of shaddock seed (Citrus grandis Osbeck) produces a transparent mucilaginous gel, which appears purplish red after stained with ruthenium red, identifying the gel as an acid polysaccharide. The purpose of this thesis was to analysis the components and properties of shaddock acid polysaccharide, and estimate its potential applicability in food and cosmetics. Mucilage was extracted using deionized water at room temperature (water extract, WE), yielding approximately 3% (w/w). WE displayed high viscosity of 1% (w/v) exceeding 6000 cP. WE was separated into two major fractions by anionic exchange chromatography on DE52-cellulose, namely, Fraction A and Fraction B, collected during elution with water and 0.10–0.18 M NaCl gradient, respectively. Fraction B 2.
(11) was the major component of WE, with a high content of uronic acid, and the molecular weight ranging from 73 to 242 kDa. The major monosaccharides identified in Fraction B were rhamnose, arabinose, galactose, glucose, mannose or xylose, galacturonic acid and glucuronic acid. Neither WE nor Fraction B displayed significant scavenging effects on DPPH radicals, and the Fe+2 chelating abilities were considerably weaker than that of EDTA. Nonetheless, both WE and Fraction B demonstrated high superoxide dismutase activity, and high hydration capacity of 9.4 and 15.2 mL/g dry weight, respectively. Neither WE nor Fraction B demonstrated cytotoxic effects on NIH-3T3 cells. Key. words:. mucilage,. polysaccharides,. composition,. molecular. size,. monosaccharide composition, viscosity, hydration capacity, antioxidant activity, cytotoxic, cell cytotoxicity.. 3.
(12) 第一章. 前言. 1.1 種子黏質之簡介 被子植物的種皮 (seed coat)由數層特殊組織所構成,是受精後的珠 被 發 育 而 成 。 一 些 植 物 , 例 如 十 字 花 科 (Brassicaceae) 、 茄 科 (Solanaceae)、亞麻科 (Linaceae)、車前草科 (Plantaginaceae)等種子的 種皮最外層含有黏質 (mucilage),此類外層含有黏質的種子又稱為黏 液繁殖體 (myxospermy) (Grubert, 1981)。黏質是在高爾基體內製造, 累積於分泌小泡,再經由胞外分泌成為細胞外基質 (extracellular matrix) (Western et al., 2000)。黏質為透明果膠狀多醣體 (pectinaceous polysaccharides)的物質,乾燥時緊貼於種皮外圍,遇水則會在短時間 內吸取水份並膨潤,包覆種子形成一圈黏液 (Bradford and Nonogaki, 2007)。 種子外層的黏質被認為在保持種子活力及確保種子萌芽上扮演重 要角色,可藉由:(1)幫助種子對抗乾燥。當黏質遇水可立即吸取水 分,並且降低水分喪失;(2)幫助種子吸收及補充營養物。黏質一旦 澎潤後增加種子與土壤接觸面積,因此可促進種子保持營養物;(3) 保護種子。黏質可與土壤黏著,避免種子遭受螞蟻或種子採集者的掠 食。(4)調節種子萌芽。溼度過高時,黏質使種皮的透氣性及透水性 變差,引起種子進入休眠,同時抑制種子發芽以保護胚 (embryo)免 於損害,保持種子完整且確保在合適的條件下再行萌芽; (5)幫助固 著。黏質黏附土壤後,防止種子被風雨散播,利於種子在母株附近固 著。(6)幫助散播。黏質也可黏附於鳥類與哺乳類,幫助種子擴展至 4.
(13) 新棲地,或是藉由流水散播至較遠的距離並保持種子完整 (Gutterman, 1993; Zaady et al., 1997; Arsovski et al., 2009; Yang et al., 2010)。除此 之外,黏質吸附露水或少量雨水後可幫助胚修復 DNA,並且維持種 子在惡劣沙漠環境中的活力 (Huang et al., 2008)。. 1.2 黏質多醣體之組成 黏質多醣體的主要成份為果膠 (pectin) (Western et al., 2000)。果膠 是由大量酸性多醣所構成的膠狀物,存在於植物細胞壁的細胞外間 質,具有很高的親水性。依組成的不同分為四類,分別為 homogalacturonan. (HGA). 、. xylogalacturonan. (XGA). 、. rhamnogalacturonan I (RG I) 及 rhamnogalacturonan II (RG II)。HGA 是以 α-1,4 醣苷鍵連接的 D-galacturonic acid 直鏈結構;XGA 是 α-1,4-D-galacturonic acid 的直鏈,側鏈為 β-1,3-D-xylose;RG I 是以 α-1,4-D-galacturonic acid 與 α-1,2-L-rhamnose 組合的雙醣構成主鏈, 側鏈主要為 α-1,3-L-arabinose 和 β-1,4-D-galactose 形成較長的寡聚 醣;RG II 是以 α-1,4- D-galacturonic acid 為主鏈,側鏈較短且多,可 能連接的單醣有十二種,也是唯一含有硼 (borate)的果膠 (Willats et al., 2001; Harholt et al., 2010)。 果 膠 的 結 構 可 以 被 修飾 , 在 galacturonic acid 之 羧 基 (carboxyl group)可被甲基酯化 (methyl esterified)或是在第二個碳上的氫氧根 (hydroxyl)被乙醯酯化 (acetyl esterified)。果膠根據甲基酯化的程度可 分 為 兩 類 , 其 中 甲 基 酯 化 程 度 低 於 50% 為 低 甲 基 酯 化 果 膠 (low-methoxyl pectins),高於50%則為高甲基酯化果膠 (high-methoxyl 5.
(14) pectins)。依據果膠的修飾程度具有不同的凝膠機制,高甲基酯化果 膠需在高酸 (pH 24)且高糖濃度之環境下方可凝膠,是以氫鍵結合 形成網狀構造的凝膠 (Gigli et al., 2009);而低甲基化酯果膠凝膠時不 需糖,且pH值範圍較廣 (pH 2.56.5),是雙價金屬陽離子 (例如Ca2+、 Mg2+等)與galacturonic acid 之羧基以離子鍵鍵結形成的凝膠 (Thakur et al., 1997)。. 1.3 果膠的應用 長久以來,果膠普遍做為天然的食品添加劑。果膠常做為食品中的 膠凝劑 (gelling agent)、增稠劑 (thickener)、調質劑 (texturizer)、乳 化劑 (emulsifier)及安定劑 (stabilizer)等,是一項純天然植物原料。 經由聯合國糧食及農業組織和世界衛生組織 (FAO ∕ WHO)聯合專家 委員會共同確認,果膠是無毒性,並且是無每日允許攝取量 (acceptable daily intake, ADI) 限 制 的 食 品 添 加 劑 (Thakur et al., 1997)。 除了應用於食品工業的特性之外,攝取含有果膠的食物有益健康。 已知食用果膠具有以下保健功能:(1)刺激腸胃蠕動,軟化糞便並促 進排便;(2)具抗菌功效,緩和幼兒常見的細菌性腹瀉;(3)降低血液 中總膽固醇與低密度脂蛋白 (low-density-lipoprotein, LDL)濃度,預防 心血管疾病;(4)與鉛等重金屬結合,並排出體外。現代文明疾病與 高熱量飲食習慣相當有關,果膠產品不但促進健康,可取代高糖高脂 肪原料製成低卡洛里產品,並在腸道與其它食物混合,阻止消化液與 食物接觸,降低食物吸收率;又因果膠能結合大量水分,延緩胃排空 6.
(15) 時間與提升飽足感,達到節食效果 (Thakur et al., 1997; Sriamornsak, 2003)。 近年來關於果膠在藥物上的應用已有許多進展。藥物釋放系統 (drug delivery system, DDS)目的為控制藥物進入人體的釋放速率,防 止藥物輸送過量及抑制藥物副作用,且維持長時間的藥效。藥物釋放 系統將藥物外表包覆親水性載體,使輸送過程中不受破壞,到達目標 後因載體逐漸水解而擴散釋放藥物。藥物釋放系統常用高分子材料做 為藥物的載體。由於果膠具有良好的生物相容性及親水性,已有許多 實 驗 進 一 步 評 估 做 為 藥 物 釋 放 系 統 的 載 體 (Thakur et al., 1997; Sriamornsak, 2003; Liu et al., 2007)。 除此之外,果膠廣泛應用於許多其它產業。例如化粧品產業中,果 膠可做為調整化妝品流動性的增稠劑,及均勻混合油水兩相的乳化穩 定劑;另外紡織業與造紙業也使用果膠做為漿料。在生態應用方面, 果膠可吸附廢水中的重金屬,如鉛、銅、鋅等金屬離子。由上述等多 項應用,可證實果膠是一項天然、安全且相當具有發展價值的原料 (Thakur et al., 1997; Leroux et al., 2003; Li et al., 2007). 1.4 皮膚的構造與老化之簡介 皮膚是人體最大的器官,總表面積約1.52.0 平方公尺,具有調節 體溫、防止乾燥及抵抗外來物質入侵的功能。皮膚由上而下可大致分 為表皮 (epidermis)、真皮 (dermis)和皮下組織 (subcutaneous tissue) 三層,另外還有一些附屬結構,如毛髮、指甲、皮膚腺體 (汗腺、皮 脂腺)等。 7.
(16) 表皮平均厚度約 0.10.3 mm,由內而外分為五層,即:基底層、有 棘層、顆粒層、透明層、角質層,但只有手掌及腳掌的部位具有透明 層。表皮是由細胞密密地推積起來的,由以三種型態的細胞:角質細 胞 (keratinocyte)、 麥拉 寧 色 素 細胞 (melanocyte)及 蘭 格 罕 氏細 胞 (langerhans cell) 所組成。角質細胞是表皮層裡主要行擴散代謝的細 胞,其功能為角質化以產生角質蛋白,表皮層內之各層是由角質細胞 由其基底層分裂代謝而形成。麥拉寧色素細胞生成麥拉寧色素,是造 成膚色的主因之一。蘭格罕氏細胞是皮膚之免疫反應中呈現抗原給淋 巴球的細胞。 真皮以基底膜與表皮連繫,平均厚度約 0.32 mm,區分為乳頭層 及網狀層,是由結締纖維、基質及細胞所組成。真皮內含三類細胞: 纖 維 母 細 胞 (fibrobla st) 、 肥 大 細 胞. (mast cell) 及 巨 噬 細 胞. (macrophage)。纖維母細胞可合成膠原蛋白纖維與彈力蛋白纖維,其 中膠原蛋白纖維其功用是保持組織的形狀,而彈力蛋白纖維可使皮膚 組織有彈性。肥大細胞和巨噬細胞則是與皮膚免疫反應有關。真皮內 基質功能為保持大量的水分,組成為醣蛋白和粘多醣,真皮內水分可 將養分從血管擴散到細胞中,同時使組織柔軟。 位於真皮下層的皮下組織是由海綿狀的結締組織與脂肪細胞所構 成,其中脂肪細胞會合成脂肪貯存於內,而脂肪的功能是保持體溫和 貯存能量。 皮膚老化會有許多徵象,在外觀上會使皮膚紋理粗糙、皮膚鬆弛, 並產生皺紋及褐斑等。在皮膚生理機能上,則有角質層的水分含量減 少、表皮細胞增殖能力降低、真皮纖維母細胞增殖能力降低及皮下組 8.
(17) 織脂肪減少的現象。此外,對於皮膚老化有許多理論,目前最被接受 的是自由基老化理論 (free radical theory)。自由基是具有不成對電子 的化學物質,會攻擊細胞組織,促成癌症及老化產生 (光井武夫, 2005;陳與洪,2001)。. 1.5 自由基之簡介 自由基定義為外層軌域具有不成對電子 (unpaired electron)的原子 或基團,因外層軌遇的不穩定,而具有極高的化學反應性 (high chemical reactivity),易與其它物質反應並奪取電子,穩定自由基本身 但造成其它物質的不穩定,引發一連串的反應,即為自由基的連鎖反 應 (free radical chain reaction) (Halliwell, 1994)。 自由基的來源分為外生性 (exogenous)與內生性 (endogenous)兩 類,外生性為受到環境汙染、輻射、紫外線或吸菸等因素而誘導;內 生性為人體進行正常代謝時所產生。人體內進行氧化代謝 (oxidative metabolism)時,會產生活性氧 (reactive oxygen species, ROS),活性氧 是以氧為中心的高反應分子。當活性氧與抗氧化防禦系統失衡時,過 量的活性氧攻擊細胞組織,造成氧化逆境 (oxidative stress)而促進老 化或疾病。常見的活性氧有超氧陰離子自由基 (superoxide radical, O2‧-) 、 過 氧 化 氧 (hydrogen peroxide, H2O2) 及 氫 氧 離 子 自 由 基 (hydroxyl radical, ‧OH) (Lykkesfeldt, 1995)。 超氧陰離子自由基為最先產生、數量也最多的活性氧,半衰期短, 很少直接對人體造成傷害,卻會形成其它的活性氧。過氧化氧雖然不 是自由基,但可穿透細胞膜到達人體各處,且易受過渡金屬離子催化 9.
(18) 轉變為氫氧離子自由基。氫氧離子自由基的毒性最強,會使細胞膜上 的脂質過氧化及氧化修飾 DNA,將 DNA 上的鳥糞嘌呤 (guanine)突 變為 8-hydroxyguanine 而造成細胞凋亡。另外,氫氧離子自由基也可 能氧化蛋白質,使蛋白質結構改變而失去活性 (Zhu et al., 2004)。. 1.6 抗氧化機制之簡介 人體內本身即有酵素與非酵素的抗氧化防禦系統。包括超氧歧化酶 (superoxide dismutase , SOD) 、 麩 胱 甘 肽 過 氧 化 酶 (glutathione peroxidase,GSH-Px)、及過氧化氫酶 (catalase)等,相互間的反應式 如下:. 非酵素系統則包含維他命 E (α-tocopherol)、維他命 C (ascorbic acid)、類黃酮 (flavonoid)及多元酚 (polyphenol)等,作用機制為終止 自由基連鎖反應、提供氫原子或螯合過渡金屬離子,達到抑制氧化反 應 (Zhu et al., 2004)。. 10.
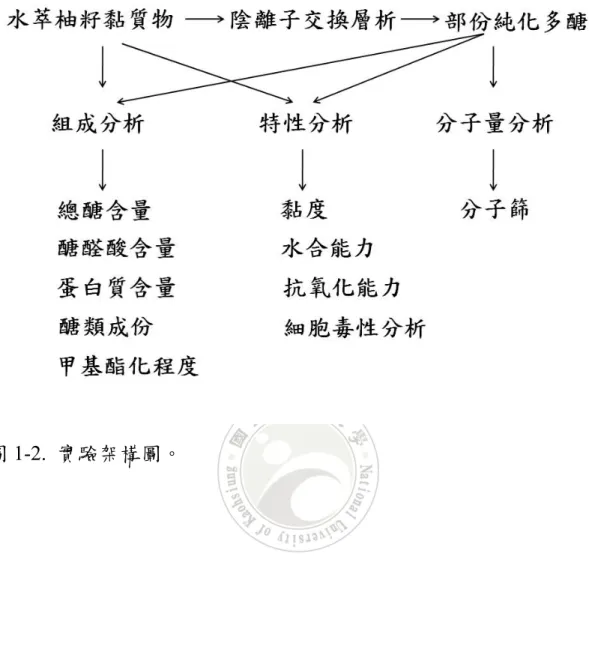
(19) 1.7 研究動機與目的 柚籽是食用柚肉後剩下的廢棄物,表面含有黏質。將柚籽浸潤水 1015 分鐘後,柚籽周圍即有一層透明的黏質物 (圖 1-1A),然後再 利用一種染酸性多醣的染劑ruthenium red (0.2%,w/v),染柚籽後呈 現明顯紅紫色 (圖 1-1B),確認柚籽外層的主要成份是酸性多醣 (Naran et al., 2008)。根據種子的生理理論,推測此黏質物應該具有良 好的吸水特性。因此擬以水萃取存在柚籽外層的多醣體,進行特性分 析,包括黏度、水合能力、抗氧化能力及細胞毒性;組成分析,包括 總醣含量、醣醛酸含量、蛋白質含量、醣類成份及甲基酯化程度。並 且將粗萃的多醣經過陰離子交換層析得到部份純化的多醣體,除了除 了重複上述的特性分析與組成分析外,並利用分子篩估算部份純化多 醣的分子量,實驗架構如圖 1-2。 期望藉由上述的組成與特性分析,評估柚籽表面粘質物是否具有做 為食品、化妝品及藥物添加劑的應用潛力。. 圖 1-1. (A)柚籽吸水後,黏質膨潤為果 膠狀的物質。(B)以 0.2% (w/v) ruthenium red 染色膨潤後的柚籽黏質,黏質可結 合 ruthenium red,使黏質呈現紅紫色。. 11.
(20) 圖 1-2. 實驗架構圖。. 12.
(21) 第二章. 材料與方法. 2.1 實驗材料 本論文使用材料為白柚 (Citrus grandis Osbeck)種子,白柚為芸香 科 (Rutaceae)柑橘屬 (Citrus)。白柚購自市場,並取出種子在室溫陰 乾後,移入乾燥箱保存。. 2.2 實驗方法 2.2.1 柚籽表面黏質物的製備 方法: 取40粒柚籽,秤取乾重。每8粒柚籽 (約1.38 g)放入一50 mL之離心 管,加入10 mL室溫的二次水,於室溫下振盪10分鐘後,取出溶液並 重複萃取至柚籽表層不含黏質物。收集的萃取液混合均勻,以glass microfiber filter (Whatman® No.1820090)抽氣過濾,將濾液經冷凍乾燥 後,計算所得的萃取物粉末萃取回收率,並保存於-20℃。 計算公式: 產率 (%) = (萃取物乾重/柚籽乾重) × 100%. 2.2.2 陰離子交換層析法(anion exchange chromatography) 純化 原理: 利用交換介質表面帶正電荷的特性,可吸附樣品內帶負電之物質, 而將不帶電荷及帶正電之物質直接流出,爾後使用與交換介質結合力 13.
(22) 更強的高鹽離子溶液將帶負電物質洗提出,收集流出物進行分析並冷 凍乾燥後可得部份純化多醣。 方法: 1. 層 析 管 柱 : Econo-Column Chromatography Column #737-5011, BIO-RAD, USA (Max capacity:196 mL) 2. 交換介質:DE (diethylaminoethyl cellulose)-52 陰離子交換樹脂 (Whatman®) 3. 梯度生成器:Gradient Mixer #GM-1, Pharmacia, Sweden 4. 幫浦:Pulse-Free Flow Peristaltic Pump #MINIPULS® 3, Gilson, France 5. 自動收集器:Fraction Collector #FC 203, Gilson, USA 6. 流速:1.96 mL/min 7. 收集單位:7.9 mL/tube 8. NaCl 濃度梯度:280 mL 1 M NaCl (MERCK, 1.06404)與 280 mL 二次水 9. 樣品:25 mL (1.5 mg/mL) 柚籽表面黏質萃取物 10. 步驟:取 95 g 樹脂放入燒杯,加入二次水混合均勻,待樹脂沉降 後除去上清液,重複清洗數次。回溶至 190 mL 混合均勻後緩緩 注入管柱,並以二次水流洗膠體約 30 分鐘,並靜置膠體至隔日。 待膠體完全沉降緊密後,注入樣品,打開蠕動幫浦,以分劃收集 器收集流出物。首先流洗 170 mL 二次水,將不吸附之物質完全 流 出 後 , 開 始 流 洗 連 續 的 NaCl 濃 度 梯 度 (continuous NaCl gradient)。 14.
(23) 11. 檢測:以酚-硫酸呈色法 (Dubois et al, 1956)檢測所收集的各 fraction 總醣含量;以 Blumenkrantz 與 Asboe-Hansen (1973)的方 法檢測各 fraction 醣醛酸含量。 12. 回收:將含多醣之流出物經過透析並冷凍乾燥後可計算回收率。 計算公式: 回收率 (%) = (純化多醣的乾重/柚籽表面黏質萃取物的乾重) × 100%. 2.2.3 多醣體組成分析 2.2.3.1 總醣含量測定 原理: 以酚-硫酸呈色法 (phenol-sulfuric acid)測定樣品總醣含量。硫酸使 醣鏈的醣苷鍵水解,水解產生的單醣脫水並與酚結合而產生橙黃色的 產物,此產物於 490 nm 有最大吸光值,並以商品化的 glucose 製作標 準曲線進行比對 (Dubois et al., 1956)。 試劑: 1. 濃硫酸 (J. T. Baker, 9681-03) 2. 5% (w/v)酚 (MERCK, 100206)溶於二次水 3. 2.5 μg/μL D-glucose (MERCK, 8337)溶於二次水 方法: 取 100 μL 樣品,加入 100 μL 酚溶液混合,於冰上緩慢加入 700 μL 冰浴的濃硫酸後,移於室溫反應 30 分鐘。取 200 μL 混合液以 ELISA reader 測定 490 nm 吸光值,並以 D-glucose 製作標準曲線,將樣品吸 光值代入標準曲線可計算得出樣品的總醣含量。 15.
(24) 2.2.3.2 醣醛酸含量測定 原理: 參考 Blumenkrantz 與 Asboe-Hansen (1973)的方法,將 H2SO4/sodium tetraborate 加入樣品中,樣品中所含的 uronic acid 與 tetraborate 於 100℃作用後,再加入 meta-hydroxydiphenyl 生成一紅色產物,此產物 於 520 nm 的吸光值與 uronic acid 的濃度成正比,並以 D-glucouronic acid 標準品製作標準曲線進行比對。 試劑: 1. 0.0125 M sodium tetraborate (Nacalai Tesque, 1303-96-4) 溶 於 H2SO4 (J. T. Baker, 9681-03) 2. 0.15% (w/v) meta-hydroxybiphenyl (Fluka, 54895)溶於 0.5% (w/v) NaOH 3. 2.5 μg/μL D-glucouronic acid (SIGMA, G-5269)溶於二次水 方法: 取 200 μL 樣品,於冰上緩慢加入 1.2 mL 冰浴的 H2SO4/sodium tetraborate,混合均勻後以 100℃水浴加熱作用 5 分鐘後,迅速移至冰 浴冷卻。再加入 20 μL meta-hydroxydiphenyl 呈色,而空白組則加入 20 μL 0.5% NaOH 取代 meta-hydroxydiphenyl,混合均勻後以 ELISA reader 測定 520 nm 吸光值並以 D-glucouronic acid 製作對數標準曲 線,將樣品吸光值減去空白組吸光值,並代入標準曲線可得樣品的總 醣含量。. 16.
(25) 2.2.3.3 蛋白質含量測定 原理: 使用 Bradford 染色法,依據 Coomassie brilliant blue G-250 在不同 蛋白質濃度下的顏色變化來測定。此種染劑主要與鹼性與芳香性胺基 酸殘基結合,於 595 nm 有最大吸光值,並以 Albumin 標準品製作標 準曲線進行比對 (Bradford, 1976)。 試劑: 1. 1.67 mg/mL Coomassie brilliant blue G-250 (SIGMA, B-1131)溶於 5% perchloric acid (MERCK, 1.00519) 2. 1 mg/mL bovine albumin (SIGMA, A2153)溶於二次水 方法: 取樣品 200 μL,加入 200 μL Coomassie brilliant blue G-250,混合均 勻後取 200 μL 溶液以 ELISA reader 測定 595 nm 吸光值,並以 Albumin 製作對數標準曲線,將樣品吸光值代入標準曲線可計算得出樣品的蛋 白質含量。. 2.2.3.4 醣類成份分析 2.2.3.4.1 中性單醣組成 樣品前處理: 將 50 μL 樣品置入水解管內,加入 50 μL trifluoroacetic acid (TFA, Alfa Aesar, L06374)使最終濃度成為 2 M,抽去空氣至真空,並將水 解管密封,於 110℃作用 2 小時。水解後的樣品利用氮氣吹乾 TFA, 吹乾後的樣品以 700 μL 二次水回溶,混合均勻後以 0.2 μm 針筒尼 17.
(26) 龍過濾膜 (Millex-GN®, SLGNR04NL, Millipore)過濾。 原理: 參考廠商技術手冊資料 【Dionex carboPA10 Analytical (2×250 mm) Product NO.057180 】,濾液通過高鹼陰離子交換層析系統 (high pH anion-exchange chromatography, CarboPA10 2×250 mm column, Dionex, USA),使用 18 mM NaOH 流洗液,利用電化學 (Electrochemical Detection;Pulsed amperometry, Gold electrodes) 方式分析樣品內中性 單醣。 方法: 1. 將導電度為 18 MΩ 的超純水以抽氣過濾器 (GAST) 經 0.2 μm 過濾膜 (Supor®-200, GelmanSciences) 過濾後,裝入塑膠瓶中, 再予超音波震盪 (Ultrasonic cleaner, Delta®) 以去除氣泡。 2. 使 用 除 氣 的 超 純 水 , 以 50 % (w/w) NaOH 溶 液 (Fisher ChemAlert®) 新鮮配製 18 mM NaOH 與 200 mM NaOH 的流洗 液。 3. 裝置工作電極與參考電極。 4. 使用液相層析系統 (liquid chromatography, Dionex, USA),打開 除氣閥,將流洗液的氣體流量表調至 5 psi,利用氦氣 100 psi 藉由 GS50 Gradient pump (DIONEX, USA) 將流洗液管路排氣 (PRIME) 約 5 分鐘至無氣泡為止。待排氣完將除氣閥鎖緊。 5. 開啟 Autosampling 系統 (SPECTRA SYSTEM AS3500, Thermo, Finnigan) 與 Detector 系 統 (ED50 electrochemical Detector, Dionex, USA)。 18.
(27) 6. 啟動 chromatography management system (CMS, Chromeleon®, Dionex, USA) 軟體,設定流洗液的流速為 0.25 mLmin-1,開啟 GS50 Gradient pump (DIONEX, USA) 待壓力至 2400 psi 左右設 定 cell on,使用 18 mM NaOH 流洗 Analytical column CarboPA10 2×250 mm column 至 base line 呈水平的平衡狀態。 7. 利用 Autosampling 系統 (SPECTRA SYSTEM AS3500, Thermo, Finnigan)注射針頭自動抽取超純水樣品 25 μL,使用 18 mM NaOH 流 洗 液 注 入 分 析 管 (CarboPA10 2×250 mm column, Dionex, USA),得知有無雜質 peak,設定分析流洗條件如下: 流洗液: ‧E1: 200 mM NaOH;E2: 18 mM NaOH Gradient Conditions %E1. %E2. Comments. 0.00. 100. 0. Regenerate. 20.00. 100. 0. 20.10. 0. 100. 50.00. 0. 100. 50.10. 0. 100. 75.00. 0. 100. TIME(min). Re-equilibrate. Inject. 8. 依上述步驟 7 相同方式,先後分析中性單醣的標準品與萃取樣 品的中性單醣。 9. 分析完畢後,使用 200 mM NaOH 清洗管柱約 1 小時,再以 Storage Solution 18 mM NaOH 流洗管柱約 10 分鐘。管柱如長 19.
(28) 久不使用時必須使用實心塞塞住,避免管柱乾掉。 10. 定性中性單醣主要依據中性單醣標準 品所出現的滯留時間 (Retention Time) 比對樣品的中性單醣滯留時間。 11. 定量中性單醣的計算公式: ․ 中性單醣標準品係 25 μL 中含有 0.25 μg,chromatography management system (CMS, Chromeleon®, Dionex, USA) 軟體可 積分出 peak 的面積。 ․ 樣品依照中性單醣標準品面積推算出樣品內中性單醣的含量 (χ μg)。. 2.2.3.4.2 醣醛酸組成 樣品前處理: 將 1 mg 樣品溶於 250 μL 12 M H2SO4 (J. T. Baker, 9681-03),以 37℃處理一小時;再加入二次水稀釋至 1M H2SO4 水溶液,置於 100℃水浴三小時,並且每隔 20 分鐘劇烈混合一次。靜置回溫,加 入相近當量的 Ba(OH)2 (Alfa Aesar, 14341)中和,劇烈混合 30 分鐘, 11000 g 離心 5 分 鐘, 取出 上清液 且加入 適量 BaCO3 (Wako, 024-00245),劇烈混合 30 分鐘,最後離心 10 分鐘。利用廣用試紙 測試上清液是否已達中性,偏酸則重複中和步驟。水解後的樣品利 用氮氣吹乾 TFA,吹乾後的樣品以 700 μL 二次水回溶,混合均勻 後以 0.2 μm 針筒尼龍過濾膜 (Millex-GN®, SLGNR04NL, Millipore) 過濾。 原理: 20.
(29) 參考廠商技術手冊資料 (Dionex IonPac® AS11 Manual 5.7 Gradient Separation of krebs Cycle Acids),以超純水萃取的濾液通過離子液 相層析系統 (ion liquid chromatography, IonPac® AS11 2×250 mm column, Dionex, USA),使用 5–100 mM NaOH 梯度流洗液分離醣醛 酸,最後用導電度 (Conductivity) 分析樣品內不同醣醛酸的含量。 方法: 1. 將導電度為 18 MΩ 的超純水以抽氣過濾器 (GAST) 經 0.2 μm 過濾膜 (Supor®-200, GelmanSciences) 過濾後,裝入塑膠瓶中, 再予超音波震盪 (Ultrasonic cleaner, Delta®) 以去除氣泡。 2. 使 用 除 氣 的 超 純 水 , 以 50 % (w/w) NaOH 溶 液 (Fisher ChemAlert®) 新鮮配製 5 mM NaOH 與 100 mM NaOH 的流洗 液。此外需準備 100﹪Methanol (J. T. Baker) 有機溶劑流洗液。 3. 裝置 IonPac® ATC-3 9×24 mm column,可吸附陰離子而降低背 景值。 4. 使用離 子液相 層析 系統 (ion liquid chromatography, Dionex, USA),打開除氣閥,將流洗液的氣體流量表調至 5 psi,利用 100 psi 氦氣藉由 GS50 Gradient pump (DIONEX, USA) 將流洗 液管路排氣 (PRIME) 約 5 分鐘至無氣泡為止。待排氣完將除 氣閥鎖緊。 5. 將 調 量 表 調 至 10 psi , 提 供 氦 氣 使 超 純 水 經 過 anion self-regenerating suppressor 2-mm (ASRS, Dionex, USA) 再生通 道,可以降低 Detector noise,故在此是使用 SRS Suppressor: Auto Suppression External Water Mode。 21.
(30) 6. 開啟 Autosampling 系統 (SPECTRA SYSTEM AS3500, Thermo, Finnigan) 與 Detector 系 統 (ED50 electrochemical Detector, Dionex, USA)。 7. 啟動 chromatography management system (CMS, Chromeleon®, Dionex, USA) 軟 體 , 設 定 流 洗 液 的 流 速 為 0.5 mL/min , temperature-compensation 1.7%/℃,開啟 GS50 Gradient pump (DIONEX, USA),待壓力至 2300 psi 左右設定流洗平衡電流 ECD suppressor current 4 mA,流洗 Analytical column IonPac® AS11 2×250 mm column 至 base line 呈水平的平衡狀態。流洗液 的平衡條件如下: Gradient Conditions %. % 5 mM. % 100 mM. % 100%. 超純水. NaOH. NaOH. Methanol. 32. 50. 0. 18. Equilibration. 8. 利用 Autosampling 系統(SPECTRA SYSTEM AS3500, Thermo, Finnigan),注射針頭自動抽取超純水樣品 10 μl,使用 5–100 mM NaOH 梯 度 流 洗 液 注 入 分 析 管 (IonPac® AS11 2×250 mm column, Dionex, USA),得知有無雜質 peak,設定分析流洗條件 如下: 流洗液: E1: 超純水;E2: 5 mM NaOH;E3: 100 mM NaOH;E4: 100﹪ Methanol Gradient Conditions 22.
(31) Equilibration. Time(min). %E1. %E2. %E3. %E4. Comments. 0. 32. 50. 0. 18. 2.5 mM NaOH/18%CH3OH. Analysis. 7. 32. 50. 0. 18. for 7 min. 0. 32. 5. 0. 18. 2.5 mM NaOH/18 ﹪CH3OH, inject. 0.1. 32. 50. 0. 18. Inject Valve to Load Position. 1.1. 32. 50. 0. 18. 2.5 mM NaOH/18 ﹪CH3OH. 14. 37. 0. 45. 18. to 45 mM NaOH/18﹪ CH3OH in 13 min. ECD suppressor current:100 mA Background Conductivity: 1.5 mM NaOH ≦ 1μS 45 mM NaOH/18﹪CH3OH ≦ 3 Μs 9. 依上述相同方式,先以醣醛酸的標準品定出相對位置後,在分 析萃取樣品中的醣醛酸。 10. 分析完畢後,以 Storage Solution 12 mM NaOH 流洗管柱約 10 分鐘。管柱若長久不使用時必須使用實心塞塞住,避免管柱乾 掉。 11. 定 性 醣 醛 酸 主 要 依 據 醣 醛 酸 標 準 品 所 出 現 的 滯 留 時 間 23.
(32) (Retention Time) 比對樣品的醣醛酸滯留時間。 12. 定量醣醛酸的計算公式: ․ 有 機 酸 標 準 品 係 10 μL 中 含 有 0.1 μg , chromatography management system (CMS, Chromeleon®, Dionex, USA) 軟體可 積分出 peak 的面積。 ․ 醣醛酸萃取樣品依照醣醛酸標準品面積推算出樣品內醣醛酸 的含量 (χ μg)。. 2.2.3.5 甲基化程度(degree of methylation) 原理: 利用 NaOH 對多醣體上的甲基進行移除反應 (elimination)生成甲 醇 (methanol),再以過錳酸鉀將甲醇轉變為甲醛 (formaldehyde)。多 餘的過錳酸鉀則以亞砷酸鈉還原,甲醛經過 acetylacetone 與 ammonia 的作用生成黃色產物 3,5-diacetyl-1,4-dihydro-2,6-methylpyridine,此產 物於 412 nm 有最大吸光值,並以 methanol 標準品製作標準曲線比對 之。 試劑: 1. 1.5 N NaOH (MERCK, 106498) 2. 5.5 N H2SO4 (J. T. Baker, 9681-03) 3. 2% 過錳酸鉀 (potassium permanganate, MERCK, Art. 5082) 4. 0.5 M 亞砷酸鈉 (sodium arsenite, J. T. Baker, Art. 6287) 5. 0.02 M acetylacetone 【含 2.0 M ammonium acetate (MERCK, 1116)、0.05 M acetic acid (J. T. Baker, 9508-03)】(Fluka, 00900) 24.
(33) 6. Methanol (J. T. Baker, 3041-68) 方法: 1. 參考 Wood 等人 (1971)的方法,取 0.5 mL 樣品加入 0.25 mL NaOH,空白組則以 0.25 mL 二次水取代 NaOH,皆於室溫下反應 30 分鐘。 2. 加入 0.25 mL H2SO4,置於冰浴中冷卻。 3. 緩慢加入 0.2 mL potassium permanganate,輕晃後冰浴 15 分鐘。 4. 加入 0.2 mL sodium arsenite 及 0.6 mL 二次水,混合均勻後置於室 溫下 1 小時。 5. 加入 2 mL acetylacetone,混合均勻後置於 60℃溫水浴中 15 分鐘。 6. 冷卻後取 0.25 mL 讀取 412 nm 吸光値。 7. 以 methanol 製作對數標準曲線,將樣品吸光值代入標準曲線可計 算得出樣品的甲基含量。 8. 以樣品的甲基含量對醣醛酸含量的百分比可得知樣品的甲基化 程度。. 2.2.4 分子量分析 原理: 利用分子篩層析法 (gel filtration chromotagraphy)檢測樣品的分子 量。介質單體表面含有很多的孔洞,分子量愈小愈容易進入這些孔洞 中,延遲樣品流動的速度,就愈慢流出;相對地,大分子量的分子則 不容易進入孔洞中,則可較快流出管柱。計算標準品的溶離程度 (kav),並與分子量對數製作檢量線;再將樣品的 kav 內插至檢量線, 25.
(34) 可得知樣品的分子量。 方法: 1. 層 析 管 柱 : Chromatography column #XK 16/100, Amersham Biosciences, Sweden (Max capacity:190 mL) 2. 分離介質:Sephacryl® S-400 膠體 (Amersham Biosciences) 3. 幫浦:Pulse-Free Flow Peristaltic Pump #MINIPULS® 3, Gilson, France 4. 自動收集器:Fraction Collector #FC 203, Gilson, USA 5. 緩衝溶液:0.2 M NaCl (MERCK, 1.06404) 6. 膠體保存液:20%酒精溶液 7. 流速:1.8 mL/min 8. 收集單位:2.7 mL/tube 9. 標 準 品 : Blue dextran T2000 (17-0360-01) 、 Dextran T500 (17-0320-01) 、 Dextran. T70. (17-0280-1) 及. Dextran. T40. (17-0270-01),分子量分別為 2000、500、70 及 40 kDa,皆購自 Amersham Biosciences。 10. 樣品:1 mL (2 mg/mL) 部份純化的柚籽多醣 11. 步驟:取 170 mL 膠體放入燒杯,先以二次水洗去保存液,再以 buffer 平衡膠體。平衡後,將膠體與 buffer 以 2:1 體積比例混合的 溶液,沿著管柱緩慢注入,同時注意膠體上方的 buffer 不可乾掉。 膠體裝填完成後,流洗 250 mL buffer 使膠體完全沉降緊密,方可 進行層析。首先將 buffer 降至與膠體面等高,加入 1 mL 標準品 或樣品於膠體面,當標準品或樣品流入膠體時,再加入 0.5 mL 26.
(35) buffer,使 buffer 進入膠體並重複三次,最後加滿 buffer,將 adaptor 下降至與膠體頂端密合,以蠕動幫浦注入 buffer 並以分劃收集器 收集流出物。 12. 檢測:直接以 660 nm 吸光值檢測 Blue dextran T2000 分佈的 fraction;依照總醣含量測定 (Dubois et. al, 1956),以 490 nm 吸光 值 檢 測 其 他 標 準 品 分 佈 的 fraction ; 依 照 醣 醛 酸 含 量 測 定 (Blumenkrantz and Asboe-Hansen, 1973),以 520 nm 吸光值檢測帶 負電的多醣分佈的 fraction。 13. 計算公式: 14. Kav:樣品溶離程度指標 Ve:樣品溶離體積 Vo:流動相體積 Vt:膠體總體積 Kav = ( Ve – Vo)/(Vt - Vo). 2.2.5 特性分析 2.2.5.1 水合能力 (Water hydration capacity)測定 原理: 參考 Quinn 與 Paton (1979) 的方法,將飽和吸水後的樣品重除以樣 品乾重,可得到每克樣品乾重可水合的水毫升數,是為樣品的水合能 力。. 27.
(36) 方法: 以標準品小麥蛋白 (gluten from wheat, SIGMA, G5004 )做為對照 組。取 2 mL eppendorf 秤重得 W0,放入樣品後秤重得 W1。逐次加入 少量去離子水於 eppendorf,以 2000 g 離心 5 分鐘,重複以上步驟至 樣品無法吸附更多水份時為飽和吸水狀態,並秤重得 W2。 計算公式: 水合能力= (W2-W1 )/( W1-W0 ). 2.2.5.2 黏度(viscosity)測定 原理: 本 實 驗 使 用 指 針 式 黏 度 計 (Dial Reading viscometer #LVT, Brookfield, USA) , 是 為 同 心 圓 柱 黏 度 計. (concentric cylinder. viscometer),原理為紡錘 (spindle)與槽室 (chamber)各為兩個同心圓 柱,將樣品溶液注入兩個同心圓柱之間,測定使紡錘轉動所需的力可 得一力矩 (torque),又將紡錘編號與轉速對應廠商技術手冊所附的關 係表可得一常數,將此常數乘以力矩是為樣品黏度,黏度單位為 centipoise (cP)。 方法: 以阿拉伯膠 (Acaica gum, Alfa Aesar, 36499)做為對照組。將樣品以 27℃的二次水回溶為 0.1、0.3、0.6、0.8、1 % (w/v),注入槽室並以 黏度計測定,可得力矩的讀值。依據廠商技術手冊 (Brookfield),對 照紡錘與轉速相對之常數,並乘以力矩讀值後為樣品水溶液的 cP 值。. 28.
(37) 2.2.5.3 抗氧化性質分析 2.2.5.3.1 清除 1,1-diphenyl-2-picryl hydrazyl (DPPH)自由 基能力測定 原理: DPPH 自由基是一相對安定的自由基,其乙醇溶液於 517 nm 為最 大吸光值。當 DPPH 自由基被抗氧化劑還原時,吸光值會降低,故可 利用此一特性來測試樣品提供氫質子以清除自由基之能力。因此當吸 光值愈低,則表示樣品對 DPPH 自由基之清除能力愈強,即具有良好 的提供氫質子能力。 反應式: DPPH‧ (violet) + AH → DPPH-H + A‧ 試劑: 1. 100 mM Tris-HCl buffer (pH 7.4) 2. 0.25 mM DPPH (SIGMA, D9132)溶於乙醇,需新鮮配置 3. Ascorbic acid (SIGMA, A-0278)溶於二次水 方法: 以標準品抗壞血酸 (ascorbic acid)做為對照組。參考 Yamaguchi 等 人 (1998)之方法,先將樣品以二次水配置不同濃度,取 20 μL 不同濃 度的樣品,加入 80 μL Tris-HCl buffer,再加入現配的 100 μL DPPH 溶液;空白組以 100 μL 乙醇取代 DPPH 溶液;而控制組則以 20 μL 二次水取代樣品。以上皆於暗反應 20 分鐘後,以 ELISA reader 測定 517 nm 吸光值。. 29.
(38) 計算公式: 清除率 (scavenging %) =〔1-(樣品於517 nm之吸光值-空白組於517 nm之吸光值) /控制組於517 nm之吸光值-空白組於517 nm之吸光 值〕× 100%. 2.2.5.3.2. Superoxide dismutase (SOD)活性測定. 原理: 利用 β-mercaptoethanol 與 MnCl2 將 O2 反應產生 superoxide ( O2- ), SOD 可將 O2-轉化成 H2O2,並抑制 O2-將 NADH 氧化成 NAD+,而減 緩 NADH 於 340 nm 吸光值的下降速率 (Paoletti and Mocali, 1990)。 試劑: 1. 50 mM potassium phosphate buffer 【 pH 7.4 , 含 0.1 mM (ethylendinitrilo) tetraacetic acid disodium salt (EDTA)】 2. 7.5 mM NADH (SIGMA, N8129) 3. 100 mM EDTA【含 50 mM MnCl2 (MERCK, 1.05927)】 4. 10 mM β- mercaptoethanol (MERCK, 8.05740) 5. 40 ng/L SOD (SIGMA, S7571)溶於二次水 6. 2 mg/mL Epigallocatechin gallate (EGCG, SIGMA, E4268)溶於二次 水 方法: 1. 取 25 μL 樣品 (2 mg/mL)加入 200 μL 緩衝液、15 μL 7.5 mM NADH 、 13 μL 100 mM EDTA 及 25 μL 10 mM βmercaptoethanol,空白組以 25 μL 緩衝液代替。 30.
(39) 2. β-mercaptoethanol 加入後即開始反應,以 ELISA reader 每隔 30 秒測 340 nm 吸光值,至 20 分鐘。 3. 標準曲線:將 SOD 稀釋成 40 ng/μL、20 ng/μL、10 ng/μL、5 ng/μL、 2.5 ng/μL,並依上述步驟反應。 4. 以標準品 EGCG 作為對照組。 計算: 1. 計算從第 8 分鐘到 20 分鐘每分鐘 340 nm 吸光值的變化量。 2. 計算抑制 NADH 吸光值下降百分比 (公式一),並做成抑制 NADH 吸光值百分比對 SOD (ng)的標準曲線。 3. 以標準曲線計算出相對下降率 50% 及樣品 SOD 的濃度並計算樣 品的 units (公式二)。 4. 1 unit 定義為抑制 50% NADH 吸光值的 SOD (ng)。 公式: (一) 抑制 NADH 吸光值下降百分比 (%) = (樣品吸光值下降率/空白組 吸光值下降率) × 100% (二) Units = 樣品 SOD 濃度(ng)/抑制下降百分比 50%的 SOD 濃度(ng). 2.2.5.3.3 螯合亞鐵離子能力測定 原理: 利用硫酸亞鐵胺. (ammonium ferrous sulphate) 溶 於 醋 酸 銨. (ammonium acetate)中解離出Fe2+,並與Ferrozine形成一複合物,此複 合物於562 nm為最大吸光值。藉由此一特性可測定樣品對Fe2+的螯合 能力。因此當樣品於562 nm的吸光值愈低,則表示樣品螯合Fe2+能力 31.
(40) 愈強。 反應式: Fe2+ + Ferrozine → Ferrozine–Fe2+ complex (violet) 試劑: 1. 2 mM Ammonium iron (II) sulfate hexahydrate (ACROS, 201370250) 溶於5% (w/v) ammonium acetate (MERCK, 1116),需新鮮配製 2. 5 mM Ferrozine (Alfa Aesar, L10607)溶於二次水,需新鮮配製 3. EDTA (Boehringer Mannheim, 808270) 方法: 以標準品EDTA做為對照組。參考Dinis (1994)等人之方法,先將樣 品以二次水配製不同濃度,取樣品100 μL,加入10 μL ammonium ferrous sulphate,再加入20 μL Ferrozine。控制組加入100 μL二次水及 兩種試劑,空白組則為100 μL樣品加10 μL ammonium acetate及20 μL 二次水。以上皆於暗反應10分鐘後以ELISA reader測定562 nm吸光值。 計算公式: 螯合亞鐵離子的能力百分比 (chelating effects %) =〔1-(樣品於562 nm之吸光值-空白組於562 nm之吸光值/控制組於562 nm之吸光值- 空白組於562 nm之吸光值)〕× 100%. 2.2.6 細胞培養條件與方法 試劑: 1. Dulbecco,s modified Eagle Medium (DMEM 培 養 基 , Thermo, SH30022.02) 32.
(41) 2. Fetal bovine serum (FBS, Thermo, SH30071.03 ) 3. 無菌PBS緩衝溶液 (pH 7.4, phosphate buffered saline,0.8 g NaCl + 1.54 g Na2HPO4.12 H2O + 0.2 g KH2PO4 + 0.2 g KCl,補二次水至 1 L並滅菌) 4. 0.05% (w/v) Trypsin-EDTA (Thermo, SH30236.01) 5. Dimethyl sulfoxide (DMSO, MERCK, 1.02952) 細胞株: 小鼠纖維母細胞NIH-3T3 mouse embryonic fibroblasts (NIH-3T3 cell, BCRC 60071),來自國立高雄大學生物科技研究所楊文仁老師實驗 室。 培養條件: 培養在含10% FBS的DMEM培養基。培養環境為37℃、5% CO2及 95%空氣之培養箱。 冷凍細胞活化: 取出在液態氮桶內保存的細胞,以37℃水浴解凍,將細胞懸浮液加 入含適當培養基的離心管,以750 g離心5分鐘,去除上清液,加入適 當培養基將細胞打散後移至培養盤。 細胞繼代培養: 將舊培養基移去,加入無菌PBS清洗細胞,去除殘留的培養基後加 入trypsin-EDTA溶液,並使溶液皆覆蓋細胞,將細胞置於37℃培養箱 作用2分鐘。顯微鏡下觀察細胞已脫落後,加入適當培養基使 trypsin-EDTA溶液中止作用,並均勻打散細胞後移至新的培養盤。 細胞冷凍保存: 33.
(42) 將 舊 培 養 基 移 去 , 加 入 無 菌 PBS 去 除 殘 留 的 培 養 基 , 使 用 trypsin-EDTA溶液將細胞脫落後,加入適當培養基中止trypsin-EDTA 溶液作用,以750 g離心5分鐘。除去上清液,加入適當FBS使細胞數 目為1×106/mL,取0.9 mL細胞溶液裝入冷凍小管,緩慢加入0.1 mL DMSO,並混合均勻,置於冰上4℃ 30分鐘,再移至-80℃,隔夜將冷 凍小管放入液態氮桶。. 2.2.7 細胞計數 原理: Trypan blue染色法可用於檢測活細胞,使用trypan blue染色細胞懸 浮液,注入血球記數板可計算細胞懸浮液中的活細胞數目。 試劑: 1. DMEM培養基 (Thermo, SH30022.02) 2. FBS (Thermo, SH30071.03 ) 3. 無菌PBS緩衝溶液 4. 0.05% Trypsin-EDTA (Thermo, SH30236.01) 5. 0.4% Trypan blue solution (SIGMA, T8154) 方法: 將 舊 培 養 基 移 去 , 加 入 無 菌 PBS 去 除 殘 留 的 培 養 基 , 使 用 trypsin-EDTA溶液將細胞脫落後,加入適當培養基中止trypsin-EDTA 溶液作用,均勻打散細胞後取10 μL細胞懸浮液並加入10 μL trypan blue ,混合後取10 μL混和液注入血球計數盤計算活細胞數目。細胞 計數盤有二個chamber,每個chamber中細刻 9 個 1 mm2之大正方形, 34.
(43) 其中位於4個角落之正方形再細刻16個小格,深度均為0.1 mm。當 chamber上方蓋上蓋玻片後,每個大正方形之體積為1 mm2×0.1 mm = 1.0×10-4 mL 。使用時,計數4個大正方形內之細胞數目,平均後乘以 稀釋倍數,再乘以104,即為每 mL中之細胞數目。. 2.2.8 細胞存活率測試 原理: Methylthiazoletetrazolium (MTT)溶解在不含酚紅的培養液或鹽溶液 呈黃色;而活細胞粒線體中琥珀酸脫氫酶 (succinate dehydrogenase) 能將 MTT 黃色溶液還原為紫色的不可溶性 formazan 結晶,並沉積於 細胞中。以 DMSO 溶解 formazan 結晶,測定於 570 nm 的吸光值, 所測得的吸光值與活細胞數成正比。 試劑: 1. DMEM培養基 (Thermo, SH30022.02) 2. FBS (Thermo, SH30071.03 ) 3. 無菌PBS緩衝溶液 4. 0.05% Trypsin-EDTA (Thermo, SH30236.01) 5. 0.25 g/mL MTT溶液 (溶於50 mL 無菌PBS) (SIGMA, M5655) 6. DMSO (MERCK, 1.02952) 方法: 1. 將 舊 培 養 基 移 去 ,加 入 無 菌 PBS 去 除 殘 留 的 培 養 基 ,使 用 trypsin-EDTA 溶 液 將 細 胞 脫 落 後 , 加 入 適 當 培 養 基 中 止 trypsin-EDTA 溶液作用,均勻打散細胞後取適量細胞懸液以細胞 35.
(44) 記數盤計算細胞數目。 2. 得知細胞數目後,加入培養基調整細胞濃度,使 200 μL 3T3 細胞 懸液內含 4×103 細胞數,並注入 96 孔盤培養 24 小時。 3. 加入 20 μL 樣品,使培養液內所含樣品最終濃度為 0、0.001、0.01、 0.1、1、10 μg/mL,同時以 0 μg/mL 做為控制組,繼續培養 24 小 時。 4. 培養 24 小時後,加入 20 μL MTT 溶液繼續培養 3 小時,3 小時 後移去培養液,加入 100 μL DMSO 振盪,使 formazan 結晶充分 溶解,以 ELISA reader 於 570 nm 測定吸光值。 5. 細胞存活率 (cell viability) = 試驗組吸光值/控制組吸光值 × 100%. 2.2.9 細胞型態觀察變化 將 200 μL 3T3 細胞懸液注入 96 孔盤 (內含 4×103 細胞數),置於 37℃、5% CO2 及 95%空氣的培養箱培養 24 小時。加入 20 μL 樣品, 並繼續培養 24 小時後,以倒立式相位差顯微鏡 (Eclipse TE2000-5, Nikon, Japan)照相分析。. 2.2.10 統計方法 試驗結果以鄧肯氏多變域分析法 (Duncan's mutiple range test), 進行平均值的差異比較。. 36.
(45) 第三章. 結果. 3.1 萃取柚籽表面黏質物所得的產率 以水做為溶媒,萃取柚籽表面黏質物,將所得水萃物命名為 water extract (WE)。相對於柚籽乾重,WE 的產率約為 3% (表 3-1)。. 3.2 陰離子交換層析純化多醣體 使用 DE-52 做為陰離子交換介質,注入 25 mL (1.5 mg/mL) WE, 並以二次水及 0.00.5 M NaCl 濃度梯度流洗。利用酚-硫酸呈色法分 析各 fraction 的總醣含量,發現流洗二次水可分離出一類未被 DE-52 吸附的 fraction,命名為 Fraction A (圖 3-1A),收集範圍為第 7 管至 第 17 管。另一方面,以 Blumenkrantz 與 Asboe-Hansen (1973)的方法 分析各 fraction 的醣醛酸含量,於 0.100.18 M NaCl 濃度梯度流洗出 一類可被 DE-52 吸附的 fraction,命名為 Fraction B (圖 3-1B),收集 範圍為第 40 管至第 50 管。相對於注入的 WE 乾重,Fraction A 與 Fraction B 的回收率分別為 8.3%與 59.7% (表 3-2)。因 Fraction A 回收 率較低,本論文並未對此 fraction 進行分析。. 3.3 多醣體組成分析 3.3.1 總醣、醣醛酸及蛋白質含量 表 3-3 顯示,WE 之總醣、醣醛酸以及蛋白質的含量分別為 42.6%、38.7%與 0.1%;而 Fraction B 則為 16.3%、53.4%與 0.2%。 不論 WE 或 Fraction B,蛋白質含量皆相當低。經過陰離子交換 37.
(46) 層析後,Fraction B 的醣醛酸含量比率是較 WE 提升 1.4 倍;而 總醣的比率較 WE 減少 2.6 倍。. 3.3.2 醣類成份 Fraction B 以 TFA 水解後,利用液相層析系統 (CarboPA10, Dionex)分 析 中 性 醣 的 成 份 為 rhamnose 、 arabinose 、 galactose 、 glucose、mannose 或 xylose (圖 3-2A),且各組成的相對比例依序 為 5:5:3:2:4 (表 3-4)。Fraction B 以 H2SO4 水解後,利用液相 層析系統 (IonPac AS11, Dionex)分析醣醛酸組成,其中 peak 2 為 galacturonic acid,peak 3 為 glucuronic acid ,peak 1、4、5 則為未 知成份 (圖 3-2B)。. 3.3.3. 甲基化程度. 表 3-5 顯示 Fraction B 的甲基化程度為 5.7± 1.3%。. 3.4 純化多醣體的分子量分析 圖 3-3A顯示,標準品Blue dextran T2000、Dextran T500、Dextran T70及Dextran T40經過Sephacryl S-400膠體後,分別於74、95、116及 127 mL被流洗出。Fraction B的溶離體積為98108 mL (圖 3-3B)。將 標準品的分子量以底數為10的對數對應標準品的溶離程度 (Kav)製 作Kav檢量線 (圖 3-4),再以Fraction B的流洗體積計算Kav並內插 Kav檢量線,可得知 Fraction B的分子量範圍約為73242 kDa。. 38.
(47) 3.5 多醣體特性分析 3.5.1 水合能力 表 3-6 顯示,WE 及 Fraction B 的水合能力分別為 9.4 與 15.2 mL/g DW,而一般做為水合能力測試的標準品小麥蛋白則僅為 1.3 mL/g DW。因此,WE 與 Fraction B 皆具有良好的水合能力,並且部份純 化的 Fraction B 比 WE 的水合能力提升 1.6 倍。. 3.5.2 黏度 圖 3-5 顯示,WE 水溶液的黏度曲線隨著濃度的增加而升高,並且 1% (w/v)的 WE 水溶液之黏度可達 6000 cP 以上。相較於對照組-阿 拉伯膠,1%的水溶液黏度則近乎 0 (11.5 cP)。. 3.5.3 抗氧化分析 3.5.3.1 清除 DPPH 自由基能力 添加不同濃度 (0.25、0.5、1、2、4 mg/mL)的WE及Fraction B皆 無顯著清 除DPPH自由 基之能 力;但 WE的清 除能力 略佳,在 2 mg/mL達最大清除能力為14% (圖 3-6)。而抗壞血酸的IC50約為0.05 mg/mL ( 清 除 50% 的 DPPH 自 由 基 效 力 之 濃 度 , 50% inhibiting concentration),最大清除能力則可達80%,明顯優於柚籽的WE與 Fraction B。. 3.5.3.2. SOD活性測定. 每克WE含有7300的SOD單位活性,而每克Fraction B含有3600的 39.
(48) SOD單位活性,顯示WE的SOD單位活性約為Fraction B的2倍。每 克的 EGCG 的SOD單 位活 性則 為73300 ,明 顯高 於柚 籽 的WE及 Fraction B (表 3-7)。. 3.5.3.3 螯合亞鐵離子能力 WE的螯合亞鐵離子能力與添加濃度具有正比關係,且IC50 為2.48 mg/mL (螯合50%的亞鐵離子效力之濃度),但Fraction B則無顯著螯合 亞鐵離子能力 (圖 3-7)。而EDTA的IC50約為0.1 mg/mL,而最大螯合 能力則可達100%,明顯優於柚籽的WE及Fraction B。. 3.5.4 細胞毒性分析 添加不同濃度的 WE 及 Fraction B 於小鼠纖維母細胞 (NIH-3T3 cell)培養 24 小時後觀察細胞的存活率。以控制組的細胞存活率為 100%,含 0.001、0.01、0.1、1、10 μg/mL 的 WE 及 Fraction B 實 驗組的細胞存活率分別為 112、90、95、98、101%與 94、106、106、 98、95%。結果顯示,兩者對細胞存活率在生物統計上皆無顯著差 異 (圖 3-8)。. 3.5.5 細胞型態 使用倒立式相位差顯微鏡觀察細胞是否有受損狀況。圖 3-9 顯 示,添加 10 μg/mL 的 WE 與 Fraction B 並培養 24 小時,皆不影響 小鼠纖維母細胞的細胞型態。. 40.
(49) 第四章. 4.1.. 討論. 柚籽多醣體的產率. 本論文以室溫的水萃取柚籽表面黏質物得到一多醣體 (WE),經過 抽氣過濾及冷凍乾燥後,產率約為柚籽乾重的3% (表 3-1)。Oomah 等人 (1995)以85℃的熱水萃取109種亞麻籽 (flaxseed)的表層黏質,產 率達3.68.0%範圍,顯示不同品系的亞麻籽在黏質物的含量有很大差 異。Fedeniuk與Biliaderis (1994)分別以4℃、25℃、80℃、100℃四種 不同溫度的水萃取亞麻籽黏質,並以冷凍乾燥或酒精沉降提取多醣 體,其中4℃冷水萃取並以冷凍乾燥的產率為最低 (3.6%),8.4%的最 高產率則是以80℃熱水萃取及酒精沉降的方法,因此,不同溫度萃取 及沉澱方法皆會影響種子多醣體的產率。Fekri等人 (2008)以85℃熱 水萃取拉雷草 (dragon head)、甜羅勒 (sweet basil)、亞麻籽及溫桲 (quince)的種子表層黏質,產率分別為1.9、2.1、8.6及11.0%。由以上 結果,物種、品系及萃取條件皆會影響多醣體的產率,並且室溫萃取 的柚籽多醣體產率可能偏低。 天然的黏質物可能為單一多醣或複合多醣的混合物 (Erskine and Jones, 1956)。本論文以ruthenium red染色法證實柚籽表面黏質富含酸 性多醣 (圖 1-1B);進一步將WE以DE-52樹脂分離出未被DE-52吸附 的Fraction A與可被吸附的Fraction B,回收率分別約為8%及60% (表 3-2)。 Warrand 等 人 (2003) 以 40℃ 的 溫 水 萃 取 亞 麻 籽 黏 質 , 並 以 Q-Sepharose樹脂分離為一類中性多醣與一類酸性多醣,回收率各為 75%及25%。上述結果說明,柚籽黏質內主要組成為酸性多醣,與亞 41.
(50) 麻籽黏質以中性多醣為主的特性明顯不同。. 4.2.. 柚籽多醣體的組成. Cui 與 Mazza (1996)以 85℃的熱水萃取亞麻籽黏質,醣醛酸含量為 21.0%。Guo 等人 (2008)以 80℃的熱水萃取洋車前子黏質,醣醛酸含 量為 15.9%。一般商業化果膠的醣醛酸含量,阿拉伯膠 (arabic gum) 為 15.0% (Anderson and Morrison, 1990),刺梧桐膠 (karaya gum)為 31.0% (Anderson et al., 1982),皆低於 WE 的 38.7%,及 Fraction B 的 53.4% (表 3-3)。Changa 等人 (2010)以 90℃熱水萃取紅棗多醣體,醣 醛酸含量為 78.0%,明顯高於 WE 及 Fraction B。Chen 等人 (2006) 指出,亞麻籽黏質內分子間的羧基 (carboxyl group)產生靜電排斥力 (electrostatic repulsion),使分子鏈完全展開並且相互貫穿彼此分子 間,導致分子間相互交聯 (intermolecular cross-linking),形成三維網 狀 結 構 (three-dimensional networks) 的 膠 體 , 並 且 凝 膠 強 度 (gel strength)與羧基含量為正相關。因此,柚籽黏質的凝膠機制可能與亞 麻籽黏質相同,而且由於 WE 與 Fraction B 的醣醛酸含量皆高於亞麻 籽黏質,推測柚籽黏質的凝膠強度較亞麻籽黏質為佳。 Zhang 等人 (2009)以 70℃的熱水萃取亞麻籽黏質,蛋白質含量為 8.5%。Garden (1993)指出,亞麻籽黏質內的蛋白質含量與乳化能力有 關。由於 WE 與 Fraction B 的蛋白質含量皆相當低 (表 3-3),因此柚 籽黏質可能不具有乳化能力。 Naran 等人 (2008)以室溫的水萃取亞麻籽黏質,並以 Sephadex A-25 樹脂與 0.01.2 M ammonium acetate 濃度梯度流洗後可分離為三類多 42.
(51) 醣體,分別命名為 Arabinoxylan、Arabinoxylan-RG I 及 RG I,而且三 者的主要醣組成有 fucose、rhamnose、arabinose、xylose、galactose 及 galacturonic acid 。 Usadel 等 人 (2004)以 30°C 的 0.2% (w/v) ammonium oxalate 萃取阿拉伯芥籽 (arabidopsis seed)黏質,主要醣組 成與亞麻籽的黏質相似,並同樣含有 fucose。由於柚籽的多醣體並未 存有 fucose,因此不同於兩者。雖然在先前的許多文獻中,證實種子 表層黏質普遍含有 RG I 類型的果膠,例如亞麻籽、阿拉伯芥籽及薏 苡 (coix lacryma-jobi)等(Smith and Montgomery, 1959; Yamada et al., 1987; Gutterman and Shemtov, 1996; Western et al., 2000; Naran et al., 2008),而柚籽的 Fraction B 是否為 RG I 類型的果膠,尚待進一步的 研究。. 4.3.. 柚籽多醣體的分子量. 本論文結果中 Fraction B 的分子量範圍約為 73242 kDa (圖 3-5)。 Warrand 等 人 (2003) 以 40℃ 的 溫 水 萃 取 亞 麻 籽 黏 質 , 並 以 Q-Sepharose 樹脂及 Sephacryl S-400 膠體分離為一類中性多醣及兩類 酸性多醣,並進一步利用高壓粒徑排除層析/多角雷射散射 (high pressure size exclusion chromatography/multi-angle laser light scattering) 確認中性多醣的分子量為 1160 kDa,兩類酸性多醣則分別為 172 kDa 與 652 kDa。許多文獻指出,黏質的分子量大小與黏度呈正向關係 (Cui et al.,1994; Fedeniuk and Biliaderis, 1994; Janaki and Sashidhar, 1998)。因此由柚籽黏質的高黏度特性,推測可能存在於 Fraction A。. 43.
(52) 4.4.. 柚籽多醣體的特性. 4.4.1 柚籽多醣體的水合能力 表 3-6顯示,每克乾重的WE及Fraction B分別可水合9.4及15.2毫升 的水。Oakenfull (1980)指出,植物纖維 (plant fiber)的水合能力與木 質 素 (lignin) 及 纖 維 素 (cellulose) 的 含 量 呈 正 向 關 係 , 並 以 羥 基 OH)、乙醯胺基 (NHCOCH3)、氧雙鍵 (O)、羧基 (COOH)以及 硫 酸 基 (OSO3 等 親 水 性 的 官 能 基 與 水 分 子 鍵 結 。 馬 鈴 薯 (potato)、小麥麩 (wheat bran)、蠶豆 (broad beans)、梨 (pear)、春甘 藍 (spring cabbage)、蘋果 (apple)、芹菜 (celary)及萵苣 (lettuce)等纖 維的水合能力分別為2.0、3.0、4.1、7.4、11.3、12.1、19.2及23.7毫升 /克乾重。Bourquin等人 (1996)指出,玉米麩皮 (corn bran)、燕麥麩 皮纖維 (oat bran fiber)、大豆纖維 (soy fiber)、關華豆膠 (guar gum)、 阿拉伯膠 (arabic gum)、刺梧桐膠 (karaya gum)、三仙膠 (xanthan gum) 及仙人掌果膠 (citrus pectin)的水合能力分別為2.6、3.5、5.9、4.8、 10.5、11.7、12.2及16.6 毫升/克乾重,並且與醣醛酸含量呈顯著正相 關 (r2 =0.87)。本實驗結果證明,柚籽黏質具有良好的水合能力, 而且Fraction B的水合能力高於WE係因具有較高的醣醛酸含量。. 4.4.2 柚籽多醣體的黏度 圖 3-5 顯示,WE 水溶液於室溫下的黏度曲線隨著濃度的增加而升 高,並且 1% (w/v) WE 水溶液的黏度可達 6000 cP 以上。Wannerbergera 等人 (1991)測定 23 種亞麻籽膠水溶液的黏度曲線,發現 1% (w/v)亞 麻籽膠水溶液於室溫下的黏度範圍為 20280 cP。Paula 等人 (2001) 44.
(53) 指 出 , 1% 的 大 葉 合 歡 膠 (Albizia lebbeck gum) 水 溶 液 及 腰 果 膠 (cashew gum)於 25℃的黏度分別為 1.2 cP 及 1.0 cP。綜合上述,1% (w/v) 柚籽多醣體水溶液的黏度遠高於以上;因此,柚籽多醣體可期望做為 食品或化妝品中一項優良的增稠劑。許多文獻指出,膠體的黏度明顯 受到溫度、pH 值及陽離子濃度的影響。膠體黏度隨著陽離子濃度或 pH 值的增加而上升,溫度增加則黏度下降 (Medina-Torres et al., 2000; Paula et al., 2001; Mueller et al., 2010)。本論文中 Fraction B 溶於二次 水不具有黏度特性,推測於陰離子交換層析過程使陽離子流失,亦是 可能原因之一 。. 4.4.3 柚籽多醣體的抗氧化能力 本論文以清除 DPPH 自由基能力、SOD 活性測定及螯合亞鐵離子 能力試驗柚籽多醣體的抗氧化能力。自由基為具有不成對電子之化合 物,性質活潑不穩定,會攻擊體內細胞組織造成損傷。DPPH 自由基 是一相對安定的自由基,結構上有一個不成對電子,用來測試樣品提 供氫質子 (H+)以清除自由基之效力;短時間內可測試大量樣品,為 一 普 遍 試 驗 樣 品 提 供 氫 質 子 能 力 之 方 法 (Brand-Williams et al., 1995)。圖 3-6 顯示,雖然 WE 的清除 DPPH 自由基能力略高於 Fraction B,但兩者皆無明顯效果。Guendez 等人 (2005)以乙酸乙酯 (ethyl acetate)萃取 9 個品種的葡萄種子,發現其多元酚 (polyphenol)含量與 清除 DPPH 自由基能力呈顯著正相關 (r2 =0.6499)。Jiménez-Escrig 等 人. (2001) 分 別 以 50% 甲 醇. (methanol/water) 及 70% 丙 酮. (acetone/water)萃取藻類,其中甲醇萃取液含有高量的多元酚與清除 45.
(54) DPPH 自由基能力,並且多元酚含量與清除 DPPH 自由基能力同樣呈 顯著正相關 (r2 =0.73)。由以上可推測,以水萃取的柚籽多醣體可能 不含多元酚,因此不具有提供氫質子以解除 DPPH 自由基之能力。 人體內進行氧化代謝時會產生超氧陰離子自由基 (O2 -),正常情況 ‧. 下與體內的防禦機制維持動態平衡;若因老化或環境等因素造成 O2. ‧-. 自由基過剩時,將會導致脂質過氧化的連鎖反應。SOD 可催化 O2. ‧-. 自由基轉為過氧化氫與氧,進而抑制脂質過氧化反應。因此樣品若具 有類超氧歧化酶活性 (SOD-like),則可認為樣品具有抑制脂質過氧化 的能力。表 3-7 顯示,WE 與 Fraction B 分別具有 7300 及 3600 的 SOD 單位活性/克,皆遠低於 EGCG 的 SOD 活性。Hu 等人 (2009)以 50℃、 70℃及 80℃熱水萃取之白樺茸 (inonotus obliquus)多醣體,SOD 活性 依序為 1100、1700 及 2200 單位活性/克,認為多醣體的 SOD 活性與 蛋白質含量具有正向關係。WE 與 Fraction B 的蛋白質含量皆相當低 (表 3-3),SOD 活性卻較白樺茸多醣體為高 (表 3-7),因此推論柚籽 多醣體的 SOD 活性可能與蛋白質含量無關,目前尚未瞭解是何種成 份。 過渡金屬離子可催化 H2O2 產生氫氧離子自由基 (OH‧-),OH‧-自由 基也是造成脂質過氧化連鎖反應的原因之一。而過渡金屬離子中, Fe2+是最具影響力的助氧化劑。因此若是樣品有螯合亞鐵離子能力, 可認為具有抗脂質過氧化能力。圖 3-7 顯示,Fraction B 無顯著螯合 亞鐵離子能力,但 WE 的螯合亞鐵離子能力與添加濃度為正比關係, 具 有 劑 量 - 效 應 關 係 (dose-response relationship) , 且 IC50 為 2.5 mg/mL。 許 多 文 獻 指 出 , 螯 合 能 力 的 強 度 與 羥 基 (OH) 及 羧 基 46.
(55) (COOH)的含量具有明顯之相關性 (Gluske, 1980; Wilson et al., 1980; Wilson et al., 1986)。Changa 等人 (2010)以 90℃熱水萃取紅棗多醣 體,並以 DEAE-cellucose 樹脂分離為一類中性多醣與三類酸性多醣。 三類 2.5 mg/mL 的紅棗酸性多醣之螯合亞鐵離子能力皆為 95%以上, 而相同濃度的水萃紅棗多醣體為 43%,紅棗中性多醣則相當低; Changa 等人 (2010)認為,螯合亞鐵離子能力與醣醛酸含量呈正向關 係。但在本論文結果中,Fraction B 的醣醛酸含量較 WE 為高 (表 3-3),卻無顯著螯合亞鐵離子能力 (圖 3-7);推測可能原因為本論文 分析螯合亞鐵離子能力的方法中,5%的 ammonium acetate 試劑使反 應溶液呈酸性,造成 Fraction B 的羧基 (COOH)無法解離為羧酸根 離子 (COO),並抑制 Fraction B 的螯合亞鐵離子能力。許多文獻指 出,類黃酮 (flavonoid)含量與螯合亞鐵離子能力呈正向關係 (Acker et al., 1998; Heim et al., 2002; Ebrahimzadeh et al., 2009),推測以水萃 取的柚籽多醣體可能不含類黃酮,因此螯合亞鐵離子能力較弱。. 4.4.4 柚籽多醣體對 NIH-3T3 細胞的毒性分析 細胞死亡主要為細胞壞死 (necrosis)及細胞凋亡 (apoptosis)兩種途 徑。細胞壞死是細胞受到外在因子 (例如輻射、紫外線等)或毒素所 引起,在光學顯微鏡下可觀察到細胞腫大、破裂,且胞內物質流出 (Majno and Joris, 1995; Broker et al., 2005 )。由活細胞數目及細胞外觀 型態,可判定樣品對細胞的毒性。圖 3-8 顯示,於細胞培養液添加不 同濃度的 WE 與 Fraction B,對小鼠纖維母細胞的細胞存活率皆無影 響。圖 3-9 顯示,添加 WE 與 Fraction B 培養 24 小時後的細胞型態, 47.
(56) 添加前後皆無改變。綜合上述結果,WE 與 Fraction B 對小鼠纖維母 細胞不具細胞毒性。纖維母細胞 (fibroblasts)是真皮層 (dermis)的主 要細胞 (光井武夫,2005),因此可初步認為柚籽黏質用於化妝原料 對皮膚沒有刺激性。. 48.
(57) 第五章. 未來研究方向. 根據以上試驗結果,未來將有以下幾項發展方向: 1. 柚籽可做為一萃取多醣體的理想原料。但由於柚籽於室溫的萃取 率偏低,將繼續試驗最適萃取條件。 2. 利用氣相層析質譜與核磁共振儀解析Fraction B的未知醣醛酸及 醣苷鍵結,以確認Fraction B的果膠類型。 3. 分析Fraction A的單醣組成、醣苷鍵結及分子量,有助於了解柚籽 黏質的高黏度特性及凝膠機制。 4. 試驗溫度、pH值及陽離子濃度等條件對柚籽黏質的黏度之影響。 5. 分析水萃及有機溶劑萃取的柚籽黏質內,是否具有多元酚含量。 6. 解析柚籽黏質內的SOD活性來源物質。 7. 改良螯合亞鐵離子能力的試驗方法。可加入緩衝溶液使反應液為 中性,降低對實驗結果的影響。 8. 試驗柚籽黏質是否具有抗發炎作用。 9. 試驗柚籽黏質是否具有抗腫瘤活性。 10. 柚籽黏質有良好的水合能力。可利用角質含水測定儀(corneometer) 及穿皮水份流失儀(transepidermal water loss meter, TEWL)檢測柚 籽黏質對皮膚含水量的影響。 11. 初步認為柚籽黏質對於皮膚沒有刺激性。可利用皮膚測試貼布 (skin patch test),進行柚籽黏質對人體皮膚的過敏性評估。 12. 將柚籽黏質實際應用於食品、化妝品及藥物的添加劑。. 49.
(58) 表 3-1. 室溫水萃柚籽表面黏質物 (WE)的產率 Extract weight/seed dry weight (%). WE. 2.9. ± 0.0. WE 的產率是 WE 乾重相對於柚籽乾重之比率,數據為平均值± SEM (n=3)。. 表 3-2. 以 DE-52 樹脂分離 WE 得到兩 fraction 的回收率 Fraction weight/WE weight (%) Fraction A. 8.3. ± 2.1. Fraction B. 59.7. ± 0.6. 各 fraction 的回收率是回收的重量相對於所注入的 WE 乾重,Fraction A 是未吸 附的多醣,Fraction B 是 0.100.18 M NaCl 流洗出的多醣。數據為平均值± SEM (n=3)。. 表 3-3. WE 與 Fraction B 的總醣、醣醛酸及蛋白質含量比率 Composition (%). WE. Fraction B. Total sugar (as glucose equivalent). 42.6 ± 10.6. 16.3 ± 3.7. Uronic acid (as galacturonic acid equivalent). 38.7 ± 3.6. 53.4 ± 3.8. 0.1 ± 0.0. 0.2 ± 0.1. Protein (as albumin equivalent) 數據為平均值± SEM (n=3)。 50.
(59) 表 3-4. Fraction B 內中性單醣的相對比例 Relative proportions of neutral monosaccharides in Fraction B Rhamnose. 5. Arabinose. 5. Galactose. 3. Glucose. 2. Mannose or Xylose. 4. Fraction B 以 TFA 水解後,利用離子液相層析系統分析 Fraction B 的中性單醣之 相對比例。數據為三批的平均值。. 表 3-5. Fraction B 的甲基化程度 Degree of methylation (%). Fraction B. 5.7. 樣品的甲基含量對醣醛酸含量之比率,數據為平均值± SEM (n=3)。. 51. ± 1.3.
(60) 表 3-6. WE、Fraction B 與 Gluten 的水合能力 Water hydration capacity (mL/g DW) WE Fraction B Gluten from wheat. 9.4. ± 0.3. 15.2. ± 1.5. 1.3. ± 0.0. 每克樣品乾重可水合的毫升數。數據為平均值± SEM (n=3)。. 表 3-7. WE與Fraction B的Superoxide dismutase活性 SOD (units / g DW) WE. 7300. ±. 700. Fraction B. 3600. ±. 300. EGCG. 73300. 每克樣品乾重所含的SOD活性單位。數據為平均值± SEM (n=3)。. 52. ± 2500.
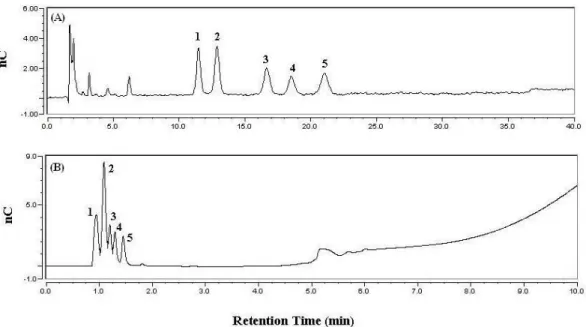
(61) 0.5. 0.2. 0.25. Fraction B. 0.0. 0.0. (B). Fraction B. 0.50. 0.5. 0.25. 0.25 Fraction A. 0.00. 0.0 1. Concentraion of NaCl (M). Fraction A. 0.4. 9. 17 25. 33 41 49 57 65 73. Concentraion of NaCl (M). Concentration of Total Sugar (g/ul) Concentration of Uronic Acid (g/ul). (A). 81 89. Fraction Number 圖 3-1. 以陰離子交換樹脂 (DE-52)樹脂分離 WE 的層析圖 以 DE-52 樹脂分離 WE,並沖提二次水及 0.0–0.5 M NaCl 濃度梯度,檢測所收集 的各 fraction 總醣及醣醛酸含量。(A) 以二次水流洗於第 7 管至第 17 管出現一高 總醣含量的 fraction,命名為 Fraction A;(B) 以 0.100.18 M NaCl 流洗於第 40 管至第 50 管出現一高醣醛酸含量的 fraction,命名為 Fraction B。. 53.
(62) 圖 3-2. 以液相層析系統分析 Fraction B 的醣類成份層析圖 Fraction B 以 TFA 水解後,以液相層析系統 (Carbo PA10, Dionex)分析中性單醣 成份,圖中 y 軸為移動相中導電度的變化,x 軸則為分離物質的滯留時間。(A) peak 1 為 rhamnose,peak 2 為 arabinose,peak 3 為 galactose,peak 4 為 glucose,peak 5 為 mannose 或 xylose。(B) Fraction B 以 H2SO4 水解後,以液相層析系統 (IonPac AS11, Dionex)分析醣醛酸成份,peak 2 為 Galacturonic acid,peak 3 為 Glucuronic acid,peak 1、4、5 則為未知物。. 54.
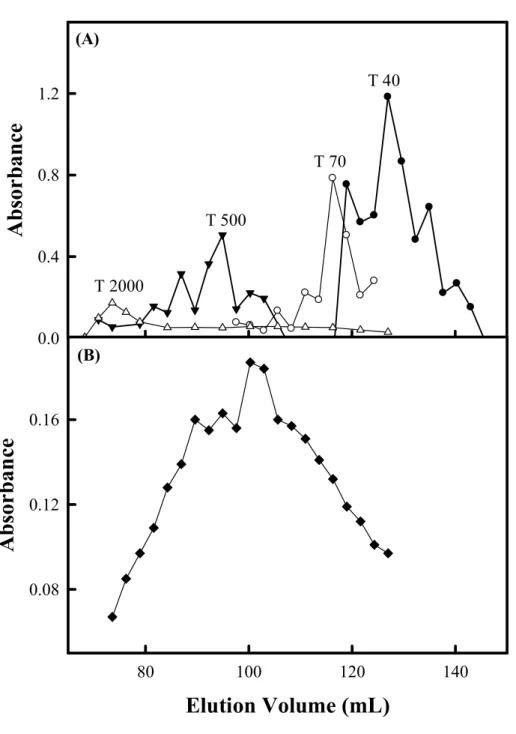
(63) (A) T 40. Absorbance. 1.2. T 70. 0.8 T 500 0.4 T 2000 0.0 (B). Absorbance. 0.16. 0.12. 0.08. 80. 100. 120. 140. Elution Volume (mL) 圖 3-3. 標準品 (A)與 Fraction B (B)在 Sephacryl® S-400 的分子篩層析圖 在 Sephacryl® S-400 以 0.2 M NaCl buffer 流洗標準品Blue dextran T2000、Dextran T500、Dextran T500、Dextran T40 與 Fraction B。(A) 以 660 nm 吸光值檢測 Blue dextran T2000 的溶離體積;依照總醣含量測定,以 490 nm 吸光值檢測其他標準 品的溶離體積。(B) 依照醣醛酸含量測定,以 520 nm 吸光值檢測 Fraction B 的 溶離體積。. 55.
(64) T 40. 0.50. T 70. Kav. Fraction B Fraction B. 0.25. T 500. T 2000. 0.00 100. 1000. Molecular Weight (kDa). 圖 3-4. 決定 Fraction B 的分子量 以標準品Blue dextran T2000、Dextran T500、Dextran T70 及 Dextran T40 在 Sephacryl® S-400 的 Kav 對應底數為 10 的對數分子量,製作 Kav 檢量線,並內 插計算 Fraction B 的 Kav,得知 Fraction B 的分子量。. 56.
(65) Viscosity (cP). 6000. WE Acacia gum. 4000. 2000. 0 0.00. 0.25. 0.50. 0.75. 1.00. Concentration (%, w/v) 圖 3-5. 不同濃度的 WE 與阿拉伯膠水溶液於 27℃的黏度變化 數據為平均值± SEM (n=3)。. 57.
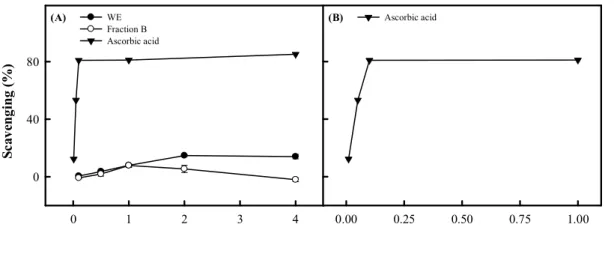
(66) Scavenging (%). (A). (B). WE Fraction B Ascorbic acid. Ascorbic acid. 80. 40. 0 0. 1. 2. 3. 4. 0.00. 0.25. 0.50. 0.75. 1.00. Concentration (mg/mL). 圖 3-6. 不同濃度的 WE、Fraction B 及 ascorbic acid 對清除 DPPH 自由基活性 之影響 (A) WE、Fraction B 以及 ascorbic acid 對 DPPH 自由基的清除能力。(B) 低 ascorbic acid 濃度對 DPPH 自由基的清除能力。數據為平均值± SEM (n=3)。. 58.
(67) Chelating Effects (%). (A). 100. (B) WE Fraction B EDTA. EDTA. 50. 0 0. 1. 2. 3. 4. 0.00. 0.25. 0.50. 0.75. 1.00. Concentration (mg/mL). 圖 3-7. 不同濃度的 WE、Fraction B 及 EDTA 對螯合亞鐵離子活性之影響 (A) WE、Fraction B 以及 EDTA 對亞鐵離子的螯合能力。(B) 低 EDTA 濃度對亞 鐵離子的螯合能力。數據為平均值± SEM (n=3)。. 59.
(68) Cell Viability (% of control). a. (A). a 100. a. a. a. a. 50. Cell Viability (% of control). 0 (B). a. a. a a. 100. a. a. 1. 10. 50. 0 0. 0.001. 0.01. 0.1. Concentration (g/mL) 圖 3-8. 以不同濃度的 WE 與 Fraction B 處理 24 小時後,對小鼠纖維母細胞的 存活率之影響 (A) 添加 WE 的細胞存活率。(B) 添加 Fraction B 的細胞存活率。數據為平均值± SEM (n=3)。以鄧肯氏多變域分析法,比較各處理差異,相同字母表示未達鄧肯 式多變域差異顯著水準。. 60.
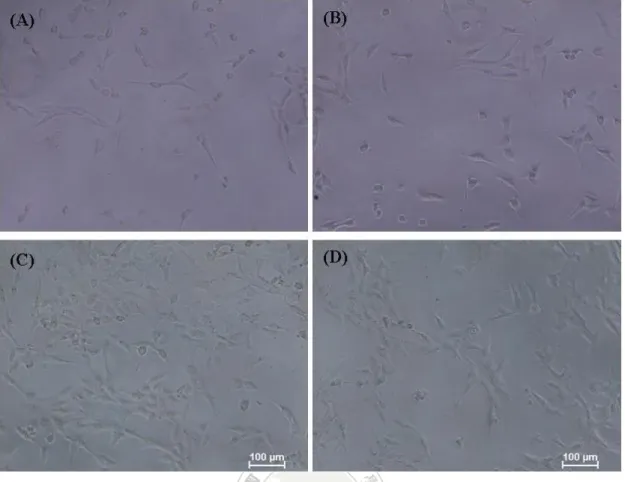
(69) 圖 3-9. 以倒立式相位差顯微鏡觀察小鼠纖維母細胞經 WE 與 Fraction B 處理 24 小時後之細胞型態變化 (A) 未添加 WE 的細胞外觀。(B) 未添加 Fraction B 的細胞外觀。(C) 含 10 μg/mL WE 的細胞外觀。(D) 含 10 μg/mL Fraction B 的細胞外觀。. 61.
數據



+5
Outline
相關文件
為此,國立中正大學防制藥物濫用教育中心與台灣藥物濫用防治研究學會,在教育部學生事 務及特殊教育司之支持下,將於 2019 年 10 月
威夷大學社會心理學博士。曾任 國家科學委員會特約研究員。榮 獲國家科學委員會優良研究獎、美國東
國立高雄師範大學數學教育研究所碩士論文。全國博碩士論文資訊網 全國博碩士論文資訊網 全國博碩士論文資訊網,
巴斯德研究院(法語:Institut Pasteur)總部位於巴黎,是法國的一個私立的非營利研究 中心,致力於生物學、微生物學、疾病和疫苗的相關研究,其創建者巴斯德於
港大學中文系哲學碩士、博士,現 任香港中文大學人間佛教研究中心
電機工程學系暨研究所( EE ) 光電工程學研究所(GIPO) 電信工程學研究所(GICE) 電子工程學研究所(GIEE) 資訊工程學系暨研究所(CS IE )
學博士,現為上海大學文學院教 授,兼任佛光山人間佛教研究院
中華大學應用數學研究所 研 究 生:黃仁性 敬啟 指導教授:楊錦章 教授 中華民國九十六年..