國立宜蘭大學食品科學系(所)
Department of Food Science National Ilan University
碩士論文 Master Thesis
以酵素法產製之幾丁聚醣水解物特性及 其抗菌活性之研究
The study of antibacterial activity and characterization of enzymatically-prepared
chitosan hydrolysates
指導教授:林世斌 博士 Adviser:Shih-Bin Lin , Ph. D.
研究生:林怡君 撰
Graduate Student:Yi-Chun Lin
中華民國九十六年十月
I
誌謝
從青少年年時期到現在,我在宜蘭生活了十個年頭。從專科濛濛 懂懂的時候就跟著林世斌老師做蜂蜜酒蜂蜜醋的研究,到進入研究 所,進行幾丁聚醣水解物之抗菌的研究,完成研究論文,也即將踏入 社會。
感謝林世斌老師在研究上讓我擁有許多自由發揮的機會,並適時 給予我幫助,使研究能順利完成。感謝陳莉臻老師在實驗及生活上支 持。感謝陳輝煌老師及陳威戎老師在論文及研究上的指導及建議,使 論文更加完善。
另外,感謝已畢業的山禾學長、阿德、鳳儀,及同學們(小曼、
仕達、怡萱、欣湉、毓謙、繁敏)和實驗室的學弟妹們(紹凱、嘉玟、
容安、貞伶、懿慧、育翔)及海大的正昇學長,給予我實驗上相當多 的幫助,另外感謝室友及球隊的學弟妹們給予我精神上及生活上的幫 助,使我於課業之餘能夠放鬆的生活,非常感謝大家。
最後,感謝我的爸爸媽媽及姊姊哥哥,使我能安心的完成學業。
這本論文獻給所有的人,感謝大家的包容及鼓勵,並適時的給予我刺 激和鞭策,再次感謝!
怡君 2007/10/15
摘要
幾丁聚醣水解物已被證實具有抗菌之效果,而目前產製幾丁質水 解物的方法主要為化學酸水解及酵素水解。由於酵素水解較溫和且具 有較高的專一性及對環境的污染較小,故成為目前產製幾丁質水解物 的主要方法。幾丁質水解酵素分為專一性酵素及非專一性酵素兩種,
其水解切點有所差異。本研究以 DNS(dinitro-salcylic acid)還原糖 測定法確認木黴菌(Trichoderma viride)幾丁質酵素誘發高峰為第四 天。取第四天之誘發粗幾丁質水解酵素(crude chitinase)與市售纖維 素水解酵素(cellulase)及市售溶菌酶(lysozyme)水解幾丁聚醣,
發現水解三小時,去乙醯度 80%之幾丁聚醣(DD80)黏度會由 403.8 cp 下降至 40 cp 以下,而去乙醯度 92%之幾丁聚醣(DD92)其黏度 則由 367.2 cp 下降至 55 cp 以下,而 DD92-CHlys及 DD80-CHlys DNS 變化很少,DD92-CHcel及 DD80-CHcel在四至五天時 DNS 趨於平緩,
六天之後 DNS 又有上升之情形。DD92-CHtri及 DD80-CHtri之 DNS 則是隨著水解天數而有逐漸上升之趨勢。
幾丁聚醣水解物會因其分子量及去乙醯度而具有不同的抗菌效 果。DD80 及 DD92 未水解時,於中性溶液下溶解度差且分子量較大,
對於抑制金黃色葡萄球菌(S. aureus)之效果(MIC 400~800 ppm)
大於水解物(MIC>800 ppm)。而對於大腸桿菌(E. coli)則是部分
III
水解產物之抑菌效果(MIC 50 ppm)略高於未水解者(MIC 100 ppm)。目前發現對於 S. aureus 有抑制但不會致死,而對於 E. coli 則 具有良好的殺菌效果。而不同酵素的水解產物也因水解機制有所差 異,產物分子量較小的 DD92-CHcel-1day 及 DD80-CHcel-1day 產物需 200 ppm 才具有抑制 E. coli 的效果,但適度水解的 DD92-CHtri 及 DD80-CHtri產物則只需 50 ppm 即可抑制 E. coli。而 lysozyme 水解之 產物,其抑菌情形則以 DD80-CHlys較佳,只需 50 ppm 即可抑菌,但 DD92-CHlys與未水解的差異不大。
關鍵字:幾丁聚醣、抗菌活性、幾丁質水解酵素、黏度、分子量、溶 解度、去乙醯度、溶菌酶、纖維酵素
Abstract
Chitosan hydrolysates was demonstrated to have antimicrobial activity. The acid and enzymatic hydrolysis are two common methods for producing chitosan hydrolysates. Because enzymatic hydrolysis method is milder, more specific, and with lower contamination, it has become a more favorable method than chemical hydrolysis method. In this study, the chitosan hydrolysates were prepared by using crude chitinase (induced from Trichoderma viride), commercial cellulase and commercial lysozyme. Chitosans with degree of deacetylation(DD)of 80% and 92%
were hydrolyzed for 3 hours and their viscosities were reduced from 403.8 cp to 40 cp and from 367.2 cp to 55 cp, respectively. The production rate of reducing sugar was lowest in CHlys but highest in CHcel. Original form chitosan was insoluble in the neutral environment and having a MIC of 400~800 ppm against S. aureus; however, the chitosan hydrolysate was higher than 800 ppm. Contrarily, the MIC of original form chitosan and CHtri against E. coli were 100 ppm and 50 ppm, respectively. Among the hydrolysates, CHcel had the smallest molecular size and required 200 ppm to inhibit E. coli. Besides, DD92-CHtri and DD80-CHtri had similar MIC of 50 ppm against E. coli.
Keyword : Chitosan ; Chitinase ; Lysozyme ; Cellulase ; Degree of deacetylation ( DD ); Antibacterial activity ; Minimal inhibitory concentrations(MIC)
V
目錄
誌謝………..…Ⅰ 中文摘要………..Ⅱ 英文摘要………. Ⅳ 目錄………..…Ⅴ 表目錄………..Ⅸ 圖目錄………..…Ⅹ
壹、前言………..1
一、研究緣起………..1
二、實驗目的………..2
貳、文獻回顧..………3
一、幾丁質及其衍生物簡介………..3
(一)幾丁質………..3
(二)幾丁聚醣..………8
二、幾丁質水解物製備………..14
(一)降解方法………..14
(二)幾丁質降解酵素介紹………..16
1.幾丁質酶………...20
2.纖維酵素………...22
(1)內切型纖維素纖維分解酵素……….22
(2)外切型纖維素纖維分解酵素………..22
(3)β-葡萄醣苷酵素……….………....23
3.溶菌酶………...23
三、幾丁聚醣及其水解物之抑菌作用………..26
(一)幾丁聚醣及其水解物的抗菌影響因子………..27
(二)幾丁聚醣及其水解物的抗菌影響物理因子之測定方 法………..28
1.幾丁聚醣分子量測定方法………...28
2.幾丁聚醣去乙醯度測定方法………...29
(三)菌株介紹………..30
1.大腸桿菌(Escherichia coli)……….32
2.金黃色葡萄球菌(Staphylococcus aureus)………..32
(四)幾丁聚糖及其水解物的抗菌機制………..33
參、材料與實驗方法…..………...………….36
一、研究動機及架構………..36
二、實驗器材………..37
三、實驗藥品………..37
(一)幾丁質(chitin)、幾丁聚醣(chitosan)、葡萄醣胺
VII
(D-(+)-Glucosamine)及 N-乙醯葡萄醣胺寡聚物
(chitosan oligomers;NACOS)……….…...37
(二)培養基………..37
(三)一般藥品………..38
(四)特殊藥品………..38
(五)實驗菌種………..38
(六)酵素………..39
1、商用酵素………39
2、幾丁質酶粗酵素液………39
(1)膠體幾丁質製備………39
(2)Trichoderma viride 菌株培養及誘發幾丁質 酶………39
(3)粗酵素液保存………40
(4)酵素活性測定………40
四、幾丁聚醣水解物製備………42
五、物理特性分析………42
(一)聚合度測定………42
1.黏度計算分子量………...42
2.超效能液相層析儀 HPLC………44
(1)水解產物之大分子量分子分佈……….44
(2)水解產物之小分子量分子分佈……….44
(二)溶解度測試………44
六、抗菌特性分析………44
(一)菌株培養………44
(二)96 well micro-plate 抗菌活性濁度測試………..45
肆、結果與討論………..……….47
一、不同時程之粗酵素誘發活性測定………47
二、酵素水解幾丁聚醣之變化………47
(一)不同水解時程之 DNS 還原糖測定……….47
(二)不同水解時程之黏度測定………48
(三)不同水解時程之分子量變化………48
三、水解產物物理性質………50
(一)水解產物溶解度測定………50
四、水解產物抗菌活性測試:96 well micro-plate 濁度測試最低抑 制濃度(MIC)及平板計數最低殺菌濃度(MBC)………51
伍、結論………..……….57
陸、參考文獻………..……….58
柒、表………..……….81
IX
捌、圖………..……….87 玖、附錄………..……….92
表目錄
表一、幾丁質及幾丁聚醣之機能及其在食品工業上之利用…………11
表二、幾丁質及幾丁聚醣在化妝品的應用………12
表三、幾丁質生物醫學產品開發現況………13
表四、常見降解幾丁質酵素………17
表五、誘發幾丁質降解酵素(專一性酵素)菌體整理………18
表六、幾丁質降解酵素(非專一性酵素)整理………19
表七、以黏度計偵測幾丁聚醣經酵素水解之黏度及分子量變化……81
表八、幾丁聚醣未水解及經酵素於不同時程水解之後之溶解度……82
表九、三種酵素水解幾丁聚醣(DD80及DD92)之產物其對三株 S. aureus最低抑制濃度(MIC)………83
表十、三種酵素水解幾丁聚醣(DD80及DD92)之產物其對三株 S. aureus最低殺菌濃度(MBC)………..84
表十一、三種酵素水解幾丁聚醣(DD80 及 DD92)之產物其對兩株 E. coli 最低抑制濃度(MIC)………85
表十二、三種酵素水解幾丁聚醣(DD80 及 DD92)之產物其對兩株 E. coli 最低殺菌濃度(MBC)………86
XI
圖目錄
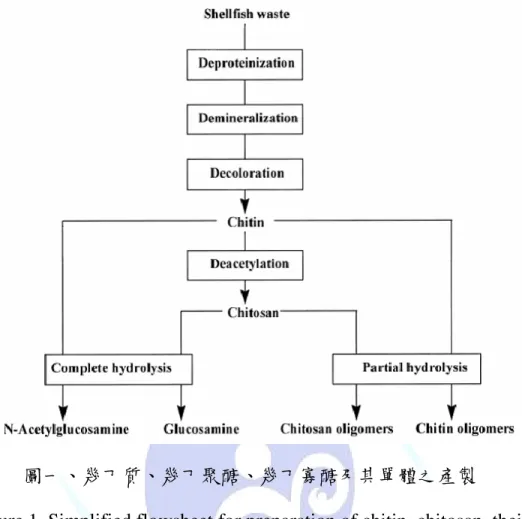
圖一、利用水產廢棄物製備幾丁質(chitin)、幾丁聚醣(chitosan)、
寡聚物及單體之簡單流程………..4
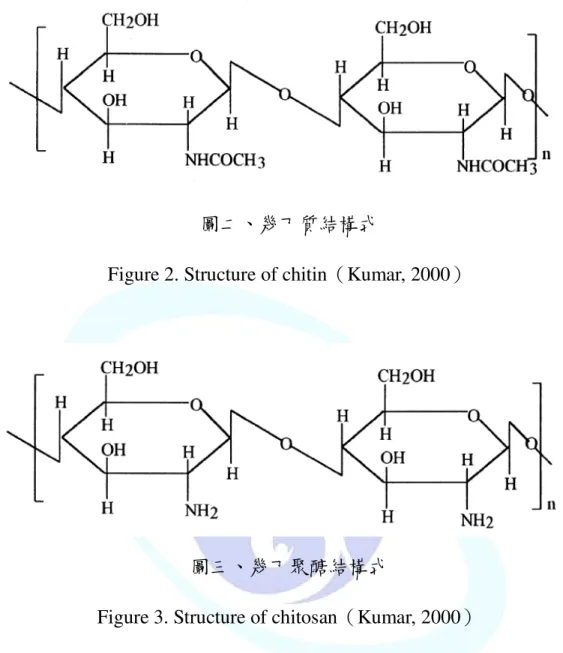
圖二、chitin 結構式………5
圖三、chitosan 結構式………5
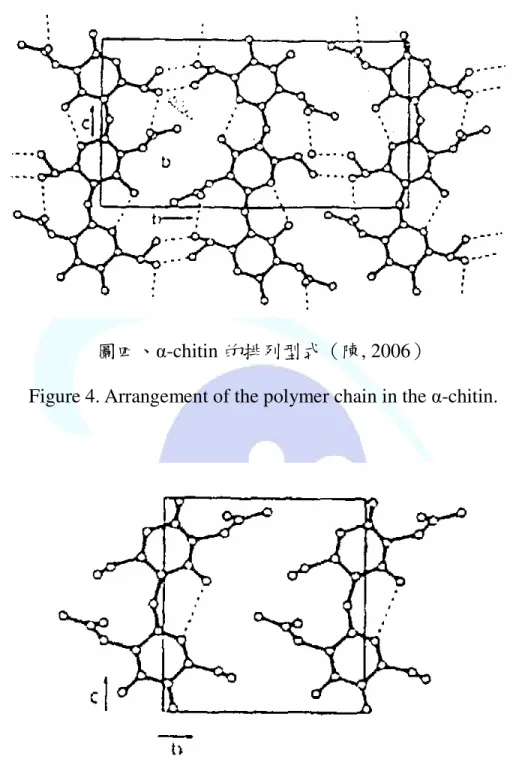
圖四、α-chitin 聚合鏈排列形式……….7
圖五、β-chitin 聚合鏈排列形式……….7
圖六、幾丁質酶對幾丁聚醣之作用原理………21
圖七、溶菌酶(lysozyme)複合結構圖………25
圖八、溶菌酶水解作用於兩種型態的幾丁聚糖………25
圖九、革蘭氏陽性菌及陰性菌細胞表面結構………..31
圖十、幾丁寡糖-單體混合物對 B.cereus 和 E. coli 的殺菌反應模擬 機制……….35
圖十一、DNS反應試劑與還原醣作用原理………41
圖十二、黏度計 Brookfield HADV-Ⅱ+設備………43
圖十三、以 Trichoderma viride 誘發產生 chitinase 之活性曲線……..87
圖十四、以酵素水解幾丁聚醣其 DNS 還原糖量之變化……….88
圖十五、以酵素水解幾丁聚醣其黏度推算幾丁聚醣水解物分子量之變 化………...89
圖十六、以 HPLC 分析 chitinase 之幾丁聚醣水解物(DD92-CHtri)...90 圖十七、幾丁聚醣經過酵素水解後之產物其溶解度之變化…………91
1
壹、前言 一、研究緣起
廢棄物再利用是近年來共通的目標,而水產品加工廢棄物幾丁質 已被研究、利用了許久。醫學上應用已相當久遠,在中國”本草綱目”
中就將蟹殼粉列為藥材。然而,將幾丁質萃取分離則是在 1811-1894 年間由法國科學家發展出來並命名。
1811 年,法國植物學家 Braconnot 以稀氫氧化鈉加熱處理洋菇 時,發現有不溶於水的物質,命名為 fungine。1823 年,Odier 於昆蟲 表面堅硬部位發現類似物質,命名為 chitin,原意為包裹物。1859 年,
Rouget 將幾丁質放在濃氫氧化鈉溶液中加熱後,發現可溶於有機酸。
1894 年,Hoppe-Seyler 將此物質命名為脫乙醯殼多醣(幾丁聚醣:
Chitosan)。1950 年,蘇聯開始將幾丁質應用於軍事用途,日本人將 其用於水處理,將水質淨化。1982 年,幾丁質作為新素材及應用於 生物醫學。
從最初的水質改善,到後來的醫學及健康食品上的發展(表一、
表二及表三)。幾丁質、幾丁聚醣的抑菌特性使其目前已用在防制植
物病原菌,主要是用在栽種方面。但對於人每日的飲食,還是在使用 化學防腐劑,來防止病原菌生長和延長保存期限。因此幾丁質、幾丁 聚醣的抑菌特性值得被關注及利用。由於幾丁聚醣可溶於偏酸的溶劑
中,但是狀態呈現膠狀不利使用。一般認為去乙醯度及分子量影響溶 解之狀態,除此之外也影響其利用性,故目前已有研究使用酵素法及 化學法使其分解成小分子。化學法雖然成本低但對環境影響大,而酵 素法雖然成本高,但是具有水解的專一性。目前已有學者使用不同的 酵 素 來 水 解 幾 丁 質 及 幾 丁 聚 醣 , 如 商 業 濃 縮 酵 素 ( cellulase 、 lysozyme、pectinase、lipase、hemicellulase、protease)及不同菌種誘 發酵素(Trichoderma viride、Trichoderma reesei、Aspergillus niger、
Aspergillus oryzae、Bacillus subtilis 等…)。 二、實驗目的
本研究以幾丁質酶(chitinase是以Trichoderma viride誘發之粗酵 素萃取液)及商業酵素纖維素酵素(cellulase)及溶菌酶(lysozyme)
水解不同去乙醯度的幾丁聚醣(chitosan)。藉以比較不同酵素製備幾 丁質水解物對抗菌之影響,探討抗菌幾丁質之物理特性對抗菌之影 響,並尋找具有抗菌活性產物之產製條件。
3
貳、文獻回顧
一、幾丁質及其衍生物簡介
(一)幾丁質(Chitin):
幾 丁 質 為 自 然 界 中 第 二 多 的 生 物 聚 合 物 , 僅 次 於 纖 維 素
(Deshpande, 1986)。蝦蟹殼廢棄物經過去蛋白、去礦物質及脫色後,
形成白色至淡黃色的幾丁質(圖一)(Cosio et al., 1982;Shahidi et al., 1999;Aye et al., 2006;He et al., 2006)。幾丁質是 N-乙醯葡萄糖胺
(N-acetyl-D-glucosamine)(圖二)(Salmon et al., 1997; Kumar, 2000)
以 β-(1-4)鍵結形成天然的直鏈聚合物,估計每年生產 100 億噸。
而幾丁聚醣(Chitosan)(圖三)(Kumar, 2000.)則是幾丁質經過去乙 醯,即葡萄糖胺(D-glucosamine)以 β-(1-4)結合而成,結構與纖 維素相似。
圖一、幾丁質、幾丁聚醣、幾丁寡醣及其單體之產製
Figure 1. Simplified flowsheet for preparation of chitin, chitosan, their oligomers and monomers from shellfish waste.
(Shahidi et al., 1999)
5
圖二、幾丁質結構式
Figure 2. Structure of chitin(Kumar, 2000)
圖三、幾丁聚醣結構式
Figure 3. Structure of chitosan(Kumar, 2000)
幾丁質的來源為節肢動物(甲殼類、昆蟲外殼)、真菌、藻類及 細胞壁(Tsigo and Bouriotis, 1995;Muzzarelli, 1996;Salmon et al., 1997;Wang and Chang, 1997;Kurita, 1998;Kumar, 2000;Patil et al., 2000;Qin et al., 2004),其乙醯化程度(DA;drgee of acetylation)隨 著來源的不同而有所差異。且其依鏈的排列方式分為 α- Chitin、β- Chitin 和 γ- Chitin。
α- Chitin(圖四)的鏈排列方向↑↓↑,斜方晶系,其兩股雙螺旋呈 反向平行排列,構形最緻密,質地較為堅硬。此類型為自然界中幾丁 質最普遍的構形,大部分的昆蟲或蝦、蟹等甲殼類的幾丁質即屬此 類。β- Chitin(圖五)的鏈排列方向↑↑,單斜晶系,其兩股雙螺旋呈 同向平行排列,此類幾丁質的組織較為鬆散,易被幾丁質酵素所分 解,如烏賊的軟骨即屬此類。至於 γ- Chitin 則為 α 型和 β 型的混合體,
存於藻類和真菌類(Wood, 1988)所含的幾丁質即屬此類。
菇類中幾丁質含量為 7%、螃蟹則為 30%,經過去蛋白及去礦物 質所抽出的幾丁質粉末,帶有些許的粘度,不溶於水、油、強酸和稀 酸,且不被腸內消化液分解。但經過去乙醯處理後,且因分子變小,
易溶於稀酸及腸胃消化液,且腸壁較易吸收。
7
圖四、α-chitin 的排列型式(陳, 2006)
Figure 4. Arrangement of the polymer chain in the α-chitin.
圖五、β-chitin 的排列型式(陳, 2006)
Figure 5. Arrangement of the polymer chain in the β-chitin
(二)幾丁聚醣(Chitosan):
幾丁質利用酵素或是鹼處理來達到去乙醯基(deacetylation)的 目的,而形成幾丁聚醣,在此過程中其聚合度也會有部分降低的情 形,使得產生胺基且對溶解度有提高之效果(Chen and Tsaih, 1998)。
幾丁聚醣的分子量分佈受許多因素影響,例如時間、溫度、試劑 的濃度和乙醯基反應的條件(Tolaimate et al., 2000)。圖三(Kumar, 2000)為幾丁聚糖的結構,其為 β-1,4-D-glucosamine 的直鏈聚合物,
其去乙醯基程度由 65%至 99%不等,一般以 70~90%最常見,其鏈 上的胺基(-NH2),在酸中會呈現(-NH3+),使其成為帶有正電的 聚電解質,因此幾丁聚醣可以溶於酸性或弱酸性的有機酸及無機酸 中,所以幾丁聚醣的溶解度較幾丁質為佳,大部分以 5%的醋酸(acetic acid)當溶劑。
幾丁聚醣具有生物相容性、生物降解性、低毒性、吸附之特性
(Hirano et al., 1990;Kumar, 2000;Li et al., 2007),可應用於工業、
農業、醫藥、環境、化妝品、生醫、生技及食品上(Muzzarelli, 1996;
Shahidi et al., 1999;Tsai et al., 1999;Majeti and Kumar, 2000;Tsai et al., 2000;Chung et al., 2003;Yuli et al., 2004;Qin et al., 2004;Kim and Rajapakse, 2005;Fujimoto et al., 2006;Li et al., 2007)(表一~表三
為幾丁聚醣於食品、化妝品、醫學產品上的應用)。幾丁聚醣對於植
9
物病蟲害防禦具有提高的效果(Hadwiger et al., 1984;Domard and Cartier, 1989;Allan and Peyron, 1995a,b;Tsai et al., 2000),並可抑制 許多的微生物或病原菌之生長(Fajardo et al., 1995;Chen et al., 1998;Tsai and Su, 1999;Helander et al., 2001;Taha and Swailam, 2002;Chung et al., 2003;Fujimoto et al., 2006;Li et al., 2007),此外 具 有 抑 制 抗 真 菌 的 能 力 ( Reddy et al., 1998 ; Sathiyabama and Balasubramanian, 1998;El Ghaouth et al., 2000;Plascencia Jatomea et al, 2003;Terry and Joyce, 2004),可改善農作物栽種(Qin et al., 2002b;
Qin et al., 2004;Liu et al., 2007),並取代化學綜合型殺真菌劑,對蔬 果採收後耗損的問題(Holmes and Eckert, 1999;Janisiewicz and Korsten, 2002;Bautista-Ba˜nos et al., 2006)有所幫助(Reddy et al., 2000;Romanazzi et al., 2003;Chien et al., 2007;Liu et al., 2007)。幾 丁聚醣之功能除了與化學結構有關,另外也與分子大小有關(Babiker, 2002;Qin et al., 2002a;Qin et al., 2004)。低分子量之幾丁聚醣具有 較佳之滲透性(Chen and Hwa, 1996),而研究指出幾丁聚醣的聚合度 大於六個才具有較強的生物活性(Tsai et al., 2000;Jeno et al., 2001;
Muzzarelli and Muzzarelli, 2002;Kim and Rajapakse, 2005),但大分子 的 幾 丁 聚 醣 溶 解 度 低 , 故 不 適 合 應 用 於 醫 藥 及 食 品 工 業 上
(Mattioli-Belmonte et al., 1997;Ilyina et al., 2000)。在醫藥上的用途
包含了抗病毒(Kim and Rajapakse, 2005)、抗腫瘤(Tokoro et al., 1989;Seo et al., 2000;Qin et al., 2004)、提高免疫力(Tokoro et al., 1988a,b;Tokoro,1989;Kobayashi, 1990;Qin et al., 2004)、控制關節 炎(Lee et al., 2003)、脂質代謝、抗凝血活性(Sugano et al., 1992;
Xie et al., 2001;Fujimoto et al., 2006)、降低膽固醇及抗高血壓
(Giustina and Ventura, 1995;Muzzarelli, 1996;Patil et al., 2000;Kim and Rajapakse, 2005)。由於幾丁聚醣具有抗菌活性且殺菌效果佳,另 外對哺乳類細胞毒性低,故適合作食品上之保存(El Ghaouth et al., 1992a,b;Roller and Covill, 1999;Li et al., 2007)。目前常見是用於食 品中用作為澄清劑,於水果汁中作為防止酵素型褐變的抗化劑和香腸 抗氧化劑,另外幾丁聚醣也可用於披覆於新鮮水果和蔬菜表面(Du et al., 1997;Zhang and Quantick, 1997;Ippolito et al., 2000;Jiang and Li, 2001;Devlieghere et al., 2004)。
11
表一、幾丁質及幾丁聚醣之機能及其在食品工業上之利用
Table 1. Chitin and chitosan function and application of food industry
機能 利用
電解複合體之形成 食品加工廠排放廢水中蛋白質之回收、飲用水之淨化,
果汁、啤酒及清酒等之澄清作用。
降低膽固醇 高膽固醇及動脈硬化症的防治用藥劑。
抗細菌、黴菌 食品防腐用,增加食品之保存性;測量農產原料之污染。
促進腸內細菌增殖 乳製品(如牛奶)之添加,病人用食品之添加。
錯合物之形成 幾丁聚醣和重要營養性金屬元素形成錯合物作為食品添
加、硬水之軟化,重金屬之去除。
控制釋放 控制特定食品中香味、營養素、抗氧化物和抗菌物質之
釋放。
抗酸 加工水果及飲料時之脫酸。
吸著 改善食品色素的吸著性,食品加工之脫色,過濾、促進
脫水,單寧酸及咖啡因之去除。
保濕 保濕劑。
分子探針 食品中特異蛋白質之回收和去除。
膠化 低熱量食品飲料,營養素、酵素及有用微生物之固定化
擔體,食品成形劑。
乳化 乳化劑。
膜化 食品加工作為逆滲透及超過濾之材料。
細胞加強性 增強抗體產生,促進代謝,食品用佐劑,消化吸收促進
劑。
熱分解 食品用香味成份之製造。
(網路資料:生醫中心醫藥技術組賴惠敏博士、仿生材料工程技術部 葉明熙博士整理)
表二、幾丁質及幾丁聚醣在化妝品的應用
Table 2. chitin and chitosan application of cosmetics
特性 用途說明
增黏性 此特性可用於洗髮精、潤絲精等洗髮用品或沐浴乳、入浴
劑、牙膏等與水相關產品。
保護膠質生成 添加幾丁質的電解高分子,會促進乳膠安定,具有保護膠質
的作用。
金屬封鎖性 混入化妝品中的不純金屬,會使化妝品的品質劣化,幾丁質
具有游離的氨基酸,會形成金屬錯合物,使金屬安定。
保濕性 頭髮本身具有百分之十的水份,因溫度緣故必須從外界吸收
水份,依水份高低決定頭髮的彈性和柔軟性。幾丁質因構造 以及電荷特性,密度很大,所以具有優異的保濕性。它本身 又是陽性高分子,所以吸附性,持續性高。
防止帶電 幾丁質是陽性高分子,吸附、持續性很好,又有保水性,所
以可以抑制靜電荷蓄電,將負電荷予以中和去除,這種防止 帶電的效果可以預防頭髮乾燥。
減少摩擦性 幾丁質會在毛髮上形成具有潤滑作用的披覆膜,減少摩擦,
因此,用梳子梳頭髮時就不致傷到頭髮。
增加柔軟性 這是幾丁質的特徵,保濕性、防止帶電、降低摩擦等特性互
相結合,就產生輕柔的觸感。
(網路資料:生醫中心醫藥技術組賴惠敏博士、仿生材料工程技術部 葉明熙博士整理)
13
表三、幾丁質生物醫學產品開發現況
Table 3. chitin and chitosan development of biomedicine
種類 用途
Wound dressings 1、Woven fibrous sheet:用幾丁質紡成纖維狀布,可加速傷 口癒合降低傷痛及長疤並且不溶於體液中,和其他的人 工皮膚不同處在於可直接應用於傷口上不用事先浸在 鹽水中,這類產品已在日本開發。
2、Film/hydrocolloid dressing:以幾丁聚醣醋酸溶液作成的 薄膜敷料,優點是不會導致傷口疼痛並且可以減輕疼 痛,將傷口降溫,可吸收 50%的滲出液,可被 lysozyme 分解。
3、Sponge dressing:用於較深的傷口,功能類似 2。
4、通常 chitosan wound dressing 可以作為藥物的載體,可 建立 control-release model。
Wound healing ointments
1、利用幾丁質促進傷口癒合的特性做到藥膏中處理傷口。
2、這類藥品已在動物用藥中使用預期未來可在人體使用。
Surgical sutures 手術縫線的特性必須要在組織中維持長時間足夠使傷口癒 合,再緩慢溶解不需再手術移除,幾丁質在微鹼的環境中 也很穩定,通常是將其作絲狀或表面塗佈在其他縫線上。
Hemostatic agents 止血棉或止血劑 Anticholesterol
products
脂肪清潔劑。用於肥胖及高膽固醇處理。
Ophthalmology 1、用於隱形眼鏡..等,可具有高透氧性、保濕、非過敏性 及高機械強度。
2、可用於受傷的眼睛傷口,促進傷口癒合。
Dentisty 做為牙周病治療,義大利有相當多的研究。
Orthopedics 人工韌帶或 coating 在人工臟器上增加生物相容性。
Drug delivery Control-release 控制藥物吸收代謝。
(網路資料:生醫中心醫藥技術組賴惠敏博士、仿生材料工程技術部 葉明熙博士整理)
二、幾丁質水解物製備
(一)降解方法
一 般 為 降 低 幾 丁 質 及 幾 丁 聚 醣 的 分 子 量 的 方 法 有 酵 素 法
(Kuroiwa et al., 2002;Zhang et al., 1999)、化學酸水解法(Il’ina and Varlamov, 2004)、化學酵素法(Akiyama et al., 1995)、氧化降解法
(Shirui et al., 2004)、超音波降解法(Chen and Chen, 2000)、超音 波與剪力降解法及高速微射流降解法等(吳, 2002;Kim and Rajapakse, 2005)。
其中以酵素法及化學酸水解法較為常用。化學法有用鹽酸(Kral et al., 1982;Kendra and Hadwiger, 1984;Domard and Cartier, 1989)
及硝酸(Allan and Peyron, 1995a,b)來水解chitosan,此外,亦有人用 磷酸來製備幾丁寡糖(Hasegawa, 1993)。然而酸處理雖然反應快(Qin et al., 2002a;Qin et al., 2004),成本也低,但會產生許多問題,除 了酸腐蝕的問題,所產生的水解物聚合度大多為monomer~trimer,
且因中和反應產生大量的鹽類,反應條件不易控制,再現性很差。而 酵素法成本高(Qin et al., 2004),但是毒性低(Mattioli- Belmonte et al., 1997;Ilyina et al., 2000)且具有強烈的專一性,能以少量的酵素就可 以得到較高的產能,且沒有鹽類殘留問題,對環境傷害也較低,故目 前大多尋求低價且方便的酵素法來生產幾丁質水解物(Sakai, 1995;
15
Sashiwa et al., 2001a,b;Kim & Rajapakse, 2005;陳, 2006)。
目前主要是利用幾丁質酶(chitinanse)、幾丁聚醣酶(chitosanase)
及商 用酵素( cellulase, lysozyme, papain, pectin lyase, glucanases, lipases, hemicellulase… ) ( Pantaleome et al., 1992 ; Yalpani and Pantalenone., 1994)之酵素來水解幾丁質或幾丁聚醣。但以chitinase 及chitosanase水解之產物聚合度較小;而利用純的chitinase(from Streptomyces griseus及Bacillus sp.),水解不同乙醯化程度的chitosan,
所水解出來的產物主要為trimer~pentamer(Aiba, 1994a)。但因使用 純的幾丁質酶使的成本大為提高,亦不適合大量生產。Pantalenone
(1992)與Yalpani and Pantalenone等人(1994),發現有多種已經商 業 化 、 較便 宜 的酵 素 , 表四 為 一些 較 常 見的 酵 素分 類 。 木瓜 酶
(Muzzarelli et al., 1994)麥芽脂酶(Muzzarelli et al., 1995),無花果 酶(Yalpani and Pantaleone, 1994)及鳳梨莖蛋白酶(Hung et al., 2002)
等可於酸性溶液中快速降解幾丁聚醣使還原糖含量上升,但其產物多 為 低 分 子 量 幾 丁 聚 醣 及 幾 丁 寡 醣 。 有 學 者 用 lipase 、 cellulase 及 hemicellulase的粗萃取液,來水解不同乙醯化程度的幾丁聚醣,結果 發現hemicellulase、cellulase及lipase都具有高的hexaose、heptaose等較 高聚合度的GlcNAc的產率,而其中利用hemicellulase水解乙醯度達 22%的幾丁聚醣更有著18%的hexamer產率(Aiba, 1998),有學者利用
cellulase水解chitosan,所水解出的產物聚合度為1~8,其中聚合度6~8 的重量比為44.3%,但是在hexamer的比例上卻沒有那麼高(Tsai et al., 2000)。
(二)幾丁質降解酵素介紹
幾丁質降解酵素(Chitinolytic Enzymes)主要分為專一性酵素及 非專一性酵素。專一性酵素為幾丁質酶(Chitinase)及幾丁聚醣酶
(Chitosanase)(Ilyina et al., 2000),多利用細菌及真菌菌體來作酵素 之誘發,其中包含了Burkholderia cepacia, Penicillium digitatum Sacc., Penicillium expansum Link, Rhizoctonia solani, Streptomyces cnereoruber, Streptomyces kurssanovii, Serratia marcescens(Young et al., 1985a,b ; Tagawa and Okazaki, 1991 ; Ilyina et al., 2000 ; Pichyangkura et al., 2002;Chien et al., 2007)等,詳見表五。誘發所 得到的酵素液其水解切點為 N-acetyl-D-glucosamine及D-glucosamine 的β-1,4糖苷鍵。而非專一性酵素為目前市售可購得之商業酵素(表 六),其水解切點並不會針對N-acetyl-D-glucosamine及D-glucosamine 的β-1,4糖苷鍵,只單純針對β-1,4糖苷鍵來水解。
17
表四、常見降解幾丁質酵素 Table 4. Chitinolytic enzymes
Glycanases
Cellulase TV Thichoderma viride Cellulase 300P Thichoderma reesei Cellulase AP Aspergillus niger Hemicellulase Aspergillus oryzae Bioxylanase Thichoderma reesei Dextranase 50L Penicillium lilacinum Pectinase G Aspergillus niger Carbohydrases
Lactozyme Kluyveromyces fragilis Proteases
Papain Carica papya Fungal protease 31,000 Aspergillus oryzae Acid-stable protease Rhizopus sp.
Protease Becillus subtilis Lipases
Lipase AIE Aspergillus niger PPLipase Porcine pancreas Microbial lipase Aspergillus niger Other
Tannase SP292 Aspergillus oryzae
(Pantalenone et al., 1992;Yalpani and Pantalenone et al., 1994.)
表五、誘發幾丁質降解酵素(專一性酵素)菌體整理
Table 5. Including microorganism with chitinolytic enzyme producing ability
Microorganism References
Penicillium islandium Fenton and Eveleigh, 1981
Nocardia orientails Usui et al., 1984
Streptomyces griseus Ohtakara, 1988;Ohtakara et al., 1990;Aiba, 1994a
Bacillus circulans Yabuki et al., 1988
Myrothceium verucaria Vyas and Deshpande, 1989
Bacillus megaterium Pelletier and Sygush, 1990
Aeromonas hydrophila Mitsutomi et al., 1990;Sashiwa et al., 2002 Bacillus licheniformis Takayanga et al., 1991;Pichyangkura et al., 2002
Bacillus sp. Izume et al., 1992;Seino et al., 1994
Bacillus pabuli Frandberg and Schnurer, 1994
Stachybotrys elengans Tweddell et al., 1994
Vibrio alginolyticus Ohishi et al., 1996
Pseudomonas aeruginosa Wang and Chang, 1997;Wang et al., 1999a,b
Streptomyces lydicuis Mahadevan and Crawford, 1997
Trichoderma viride Rogalski et al., 1997
Verticillium lecanii Fenice et al., 1998
Altermaria alternate (Fr.) Keissler Reddy et al., 1998
Puccinia arachidis Speg. Sathiyabama and Balasubramanina, 1998
Trichoderma harzianum Felse and Panda, 1999;Nampoothiri et al., 2004
Rhizoctonia solani Soglio et al., 1998
Bacillus thuringiensis Thamthiankul et al., 2001
B. cepacia TU09 Pichyangkura et al., 2002
Aeromonas hydrophila H-2330 Sashiwa et al., 2002 Botrytis cinerea, Penicillium expansum Romanazzi et al., 2003
Aspergillus niger V. Tiegh. Plascencia-Jatomea et al., 2003 Trichoderma atroviride, Serratia marcescens,
Streptomyces albidoflavus
Giuliano Garisto Donzelli et al., 2003
Penicillium aculeatum NRRL 2129 Binod et al., 2005
Lecanicillium fungicola Ramírez-Coutiño et al., 2006
Bacillus cereus Chang et al., 2007
Penicillium digitatum Sacc., Penicillium expansum Link
Chien et al., 2007
19
表六、幾丁質降解酵素(非專一性酵素)整理 Table 6. Chitinolytic enzyme(non-specific enzyme)
Non-Specific enzyme References
Lysozyme Aiba, 1992 & 1994b;Kurita et al., 2000 Cellulase,α-amylase, Proteinase Zhang et al., 1999
β-glucosidase Zhang and Neau, 2001 Cellulase An, Ac & Tv, Hemicellulase
An
Sukwattanasinitt et al., 2002
Lipase An, Pectinase An Sashiwa et al., 2003 Pectinase, Chitinase Kittur et al., 2003a,b.
Pepsin, Papain, Pronase Vishu Kumar and Tharanathan, 2004 Protease Li et al., 2005
Cellulase A & T, Hemicellulase, Lipase, Pectinase.
Kittur et al., 2005
Papain, Pronase Vishu Kumar et al., 2005 Pepsin, Papain, Lysozyme, Cellulase
Tr & Tv, Lipase An
Ilankoven et al., 2006
Pronase Vishu Kumar et al., 2005, 2007
1.幾丁質酶(Chitinase)
在最近幾年,能製造 chitinase 的微生物就被認為對真菌和線蟲所 引 起 的 農作 物 疾病 有 很 好的 生 物防 治 的 作用, 在植 物 中 存在 的 chitinase 通常被認為是抵抗外來病原體的一種自我防禦的機制(Liu et al., 2003.),植物的 chitinase 表現和外界環境刺激有關,如:真菌的 入侵、滲透壓的改變,或是和成長的階段有關,如:果實的成熟(鐘, 2004)。
這類的酵素屬於 glycosidases(EC 3.2.1.14),用在切斷 β-1,4 糖 苷鍵(Berkely, 1979. Liu et al., 2003),chitinase 依其催化功能區
(catalytic domain)被歸類於 family 18 和 19 中。若根據其特性以及 作 用 方 式 的 不 同 則 可 以 分 為 二 大 類 : 一 為 endochitinase ( EC 3.2.1.14),可以隨機將大分子的 chitin 由中間切開,水解成較小片段 的 N-Acetyl-D- glucosamine(NACOS);另一類為 exochitinase,可分 為兩種:chitobiosidases(EC 3.2.1.29),其會從小分子的 chitin 之非 還 原 端 水 解 , 釋 放 出 dimer , 及 N-acetyl-glucosaminidases ( EC 3.2.1.30),可由經過 endochitinase 水解所得到的 NACOS 之非還原端 水解,進而得到 monomer(Patil, 2000)。
圖六(Aiba, 1994a.)為幾丁質酶降解幾丁質之水解機制。(a)為 去乙醯度 90%、(b)為去乙醯度 70%、(c)為去乙醯度 50%,白圈
21
所代表的為 glucosamine,黑圈代表的為 N-acetyl-D-glucosamine,由 於 chitinase 能 將 具 有 N-acetyl-D- glucosamine 那 端 切 除 , 而 在 glucosamine 那一片段,因 chitinase 無法去水解,是故可以保留下來。
圖六、幾丁質酶作用不同去乙醯度幾丁聚醣之機制。
(●)N-乙醯-D-葡萄糖胺, (○)D-葡萄糖胺(Aiba, 1994a)
Figure 6. Speculative representation of the action of chitinase on the various types of chitosans.
(●)N-acetyl-D-glucosamine, (○)D-glucosamine
2.纖維酵素(Cellulase)
纖維分解酵素為一群酵素,可將不具溶解性的纖維酵素分解成單 糖(Wood, 1985),於蝸牛的消化液、吃木質部的昆蟲類、微生物等 含有此酵素,而反芻動物則是腸道內的微生物會產生纖維酵素故可分 解纖維素(賴滋漢及賴業超, 1994)。這群水解酵素主要可分為以下三 類:
(1)內切型纖維素纖維分解酵素(Endo-β-1,4-D-glucanase,E.C.
3.2.1.4):
內切型纖維素纖維分解酵素又稱為 Cx、CMCase、carboxymethyl- cellulase、endoglucanase、β-1,4-D-glucanhydrolase、β-1,4-D-glucan-4- glucanhydrolase,為一種 glycoprotein,分子量約為 53 kDa~145 kDa。
作用於纖維素的非結晶區,可將纖維素的 β-1,4 鍵,以非特異性的方 式予以水解,將纖維素水解成分解成葡萄糖、纖維二糖、纖維糊精,
也可分解羧甲基化甲基纖維素(CMC)(吳, 2005)。
( 2 ) 外 切 型 纖 維 素 纖 維 分 解 酵 素 ( exo-β-1,4-D-glucanase , E.C.
3.2.1.91):
外 切 型 纖 維 素 纖 維 分 解 酵 素 又 成 C1、 avicelase 、 cellobio- hydrolase、exocellobiohydrolase、β-1,4-D-glucancellobiohydrolase 或 cellulose-β-1,4-glucancellobiohydrolase,也是為一種 glycoprotein,分
23
子量約為 42 kDa~65 kDa(吳, 2005)。此酵素可分解結晶型纖維素,
亦可自末端水解成纖維二糖,與內切酶共同作用時,對分解結晶型纖 維素具有良好的效果。
(3)β-葡萄醣苷酵素(β-1,4-D-glucosidase, E.C. 3.2.1.21.):
β-葡萄醣苷酵素,亦稱為 β-glucosidase、cellobiase 或 β-1,4-gluco- hydrolase,同樣是一種 glycoprotein,分子量約為 50 kDa~410 kDa。
其作用是將纖維雙醣或纖維寡醣自非還原端起,以葡萄糖為一個單位 水解(尤, 2003;吳, 2005)。
3.溶菌酶(Lysozyme)
溶菌酶(EC 3.2.1.17)是醣苷水解酶,分子量為 14-15kDa,等電 點為 11 左右,圖七為其複合結構圖,分佈廣泛且在卵白全固形物中 佔 2.5%(賴滋漢及賴業超, 1994.)。溶菌酶以溶解革蘭氏陰性細菌的 細胞壁,使其崩壞而產生溶菌作用。原因在於它能水解 N-乙醯葡萄 糖胺與 N-乙醯壁酸之間的 ß-1.4 醣苷鍵。這是溶菌酶應用的基礎,也 是它得名的原因。
溶菌酶發揮溶菌作用的最適 pH 值在 8~9 左右(Davies et al.,
1969),其最佳反應溫度和進行溶菌作用的溫度是一致的,都要求在
50℃範圍內。溶菌酶在 pH 1.2~11.3 的廣泛範圍內劇烈變化的,都 沒有發現溶菌酶活性任何改變,因此溶菌酶對酸鹼度的變化不敏感。
在鹼性範圍時,穩定性較差。溶菌酶的熱變性是可逆的,其變性溫度 一般不高於 70ºC,總之,溶菌酶是相當穩定的。
目前已證實溶菌酶必須有三至六個 N-乙醯葡萄糖胺才具有水解 切點,當僅有以一個 N-乙醯葡萄糖胺時不具有水解切點(圖八)(Aiba, 1992)。而以 Lysozyme 作為水解酵素時,最佳的水解樣品其去乙醯 度為 56%,當樣品去乙醯度為 11%或是 97%時均無法水解(Kurita et al., 2000)。
25
圖七、溶菌酶複合結構圖 Figure 7. Structure of lysozyme
圖八、溶菌酶水解作用於兩種型態的幾丁聚糖。(●)N-乙醯-D-葡萄糖 胺,(○)D-葡萄糖胺,(E)溶菌酶(Aiba, 1992)
Figure 8. Speculative representation of the action of lysozyme on the various types of chitosans.
(●)N-acetyl-D-glucosamine, (○)D-glucosamine, (E)Lysozyme
三、幾丁聚醣及其水解物之抑菌作用
Rege 等學者發現,總括具有抗菌活性的幾丁聚醣其去乙醯度介 於 70%至 95%,而其分子量介於 50 至 2000 kDa(Rege et al., 2003)。
而去乙醯度 70%之幾丁聚醣可抑制革蘭氏陽性菌 10~20%及革蘭氏 陰性菌 20-40%,當幾丁聚醣之去乙醯度提高至 90%可抑制革蘭氏陽 性菌 15~35%及革蘭氏陰性菌 40~60%(Chen et al., 2002)。大分子 的 chitosan(28~1671 kDa)對革蘭氏陰性菌可降低 2~3 log CFU/ml,
對革蘭氏陽性菌可降低 4~6 log CFU/ml(NO et al., 2002)。對革蘭氏 陽性菌而言,未水解的幾丁聚醣可抑制量達 95%以上,高分子幾丁 寡醣的抑制量為 50~90%,而低分子量幾丁寡醣的抑制量降為 20~
50%。對革蘭氏陰性菌而言,未水解的幾丁聚醣可抑制 70~99%,
高分子幾丁寡醣的抑制量為 50~90%,而低分子量幾丁寡醣的抑制 量降為 20~50%(Jeon et al., 2001)。
而利用 cellulase 水解 chitosan,所水解出來的產物的聚合度為 1
~8,其中大於 hexamer 的重量比為 44.3%,這個 chitooligosaccharides 的 混 合 液 具 有 很 強 抗 菌 效 果 , 對 於 常 見 的 病 原 菌 如 Aeromonas hydrophila、E. coli、Listeria monocytogenes、Pseudomonas aeruginosa、
Salmonella typhimurium、Shigella dysenteriae、Staphylococcus aureus、
Vibrio cholerae 及 V. parahaemolyticus 之 MIC 為 5~29 ppm,若用
27
chitosan 則需要的濃度則為 50~1000 ppm,若添加 0.24%到牛奶中,
可有效抑制牛奶中腐敗菌及病原菌生長,藉以延長其保存期限(Seo et al., 1992. Tsai et al, 2000)。
(一)幾丁聚醣及其水解物的抗菌影響因子
影響幾丁聚醣的抗菌能力因素很多,主要包括以下三大部分
(Sekiguchi et al., 1994;Shibasaki et al., 1994;Tsai and Su, 1999;Tsai et al, 2000;Choi et al., 2001):第一為環境影響因子:包含了溶劑(有 機酸或無機酸)、pH值、離子強度(NaCl濃度)、金屬離子、界面 活性劑等。第二為幾丁聚醣本身之因子:包含了去乙醯度、分子量及 濃度。目前以證實去乙醯度越高,具有越強的抗菌活性,但分子量與 抗菌效果之關係卻受到抑制對象有所差異。第三為,抑制對象:包含 了微生物品系及菌株之菌齡。
幾丁聚醣的去乙醯度、分子量、環境中pH值及離子強度均會影 響其溶解度,而溶解度的提高有助於幾丁聚醣的利用(Wang et al., 1991a,b;Anthonsen et al., 1993;Chen et al., 1994a,b;Tsaih et al., 1995)。另外幾丁聚醣的去乙醯度、乙醯基分佈情形、黏度及分子量 均會導致產生不同片段大小的幾丁聚醣水解物(Berger et al., 2005;
Chen and Hwa, 1996)。
根據Seo,Mitsuhashi和Tanibe等人的研究,發現幾丁聚醣對有些
菌種有抑制作用,如:Corinebacterium michiganence,Micrococcus fluorescens,Staphylococcus aureus,Escherichia coli等;而幾丁聚醣 對有些菌種則抑制作用並無顯著的效果,如:Bacillus cereus,Erwinia sp.,Erwinia carotovora sub sp.等菌種(Seo et al., 1992)。
而另外幾丁聚醣及其衍生物的抗菌研究還包含了以下之菌株,導 致退伍軍人病的Legionella pneumophila(Fujimoto et al., 2006)、植 物 病 原 菌 Fusarium oxysporum, Fusarium solani, Pythium ultimum
(Chang et al., 2007)、柑橘類水果病原菌Pencillium digitatum(Porat et al., 2000)及Pencillium italicum, Botrydiplodia lecanidion, Botrytis cinerea(Chien et al., 2007)、口腔致病菌Streptococcus mutans及心內 膜炎Actinobacillius actinomycetemcomitans(Choi et al., 2001)等。
幾丁聚醣的抗菌能力主要來自於胺基官能基的作用,因此當去乙 醯度愈高時,其抗菌的效果則愈高。而針對相同的去乙醯度但不同分 子量進行抗菌實驗,發現幾丁聚醣的分子量對抗菌的效果並沒有一定 的規則,但有一最適的分子量,大約為 1800 時抗菌效果最佳(Shin, 1999)。
(二)幾丁聚醣及其水解物的抗菌影響物理因子之測定方法 1.幾丁聚醣分子量測定方法
29
幾丁聚醣分子量之測定方法以下列幾種為主:膠凝滲透色譜法
(Gel Permeation Chromatography, GPC)(Aiba, 1992, 1994a,b;
Sashiwa et al., 2002;Vishu Kumar et al., 2004;Qin et al., 2004;Li et al., 2005)、光散射(Light Scattering, LS)(Jumaa et al., 2002;Methacanon et al., 2003)、黏度法(Aiba, 1992, 1994a,b;Rinaudo et al., 1993;Zhang and Neau, 2001;NO et al., 2002;Chen et al., 2002;Zheng et al., 2003;
Vishu Kumar et al., 2004;Liu et al., 2006;Ramírez-Coutiño et al., 2006;Li et al., 2007)、薄層層析(Thin-Layer Chromatography, TLC)
(Donzelli et al., 2003)、高效能液相層析(HPLC)(Aiba, 1994b;
Tsai et al., 2000;Sukwattanasinitt et al., 2002;Sashiwa et al., 2002;
Sashiwa et al., 2003;Vishu Kumar et al., 2004)、飛行時間質譜儀(Time of Flight Mass Spectrometer, TOF-MS)(Zhang et al., 1999)。
2.幾丁聚醣去乙醯度測定方法
幾丁聚醣去乙醯度之測定方法以下列幾種為主:紫外光/可見光 分光光度法(UV-VIS spectrometer)(Kurita et al., 2000)、傅立葉變換 紅外光譜分析(FT-IR)(Vishu Kumar et al., 2004;Qin et al., 2004;
Li et al., 2005;Ilankovan et al., 2006;Liu et al., 2006;Ramírez-Coutiño et al., 2006;Li et al., 2007)、酸鹼滴定法(Acid-base titration)(Chen and Tsaih, 1998;Tolaimate et al., 2000;Tsai et al., 2000;Qin et al.,
2004;Liu et al., 2006;Li et al., 2007)、圓二色性光譜(circular dichroism, CD)(Domard, 1987;Zhang and Neau, 2001)、核磁共振(NMR)(Kenne and Lindberg. 1980;Rinaudo et al.,1992;Tolaimate et al., 2000;Qin et al., 2004)。
(三)菌株介紹
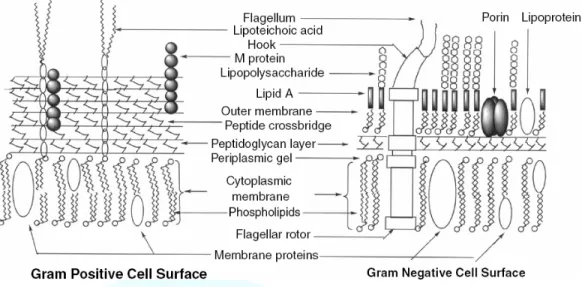
根據染色,細菌的細胞可分為兩種類型(圖九)︰革蘭氏陽性
(Gram-positive)菌和革蘭氏陰性(Gram-negative)菌。染色的差 異反映了結構和化學組成的不同,因而這兩種細菌的細胞壁的結構 是不相同的。另外,革蘭氏陽性菌只有一層膜結構,而革蘭氏陰性 具有兩層膜結構。革蘭氏陽性菌的壁厚達 15~35 nm,組成成分中 的胞壁酸(murein)、磷壁酸(teichoic acis)及肽聚糖(peptidoglycan)
為陽性菌特有。革蘭氏陰性菌的壁較薄(10~15 nm),成份比陽性 菌複雜。不含磷壁酸,但含有脂蛋白、脂多糖、球蛋白及肽聚糖等。
革蘭氏陽性菌的細胞壁較厚,含有較多的胞壁酸,或稱為肽聚糖。胞 壁質的多糖組成主要是由 N-乙醯葡萄糖胺和 N-乙醯胞壁酸交替連接 起來的。這些多糖鏈通過 N-乙醯胞壁酸與短的肽橋結合,不僅如此,
革蘭氏陽性菌細胞壁中胞壁質還具有骨架作用決定細胞的形態。除了 胞壁質外,還有其他的一些成份,較多的是磷壁酸,它是由甘油或核 糖醇(ribitol)衍生物連接在一起形成的長的、負電性的聚合體。
31
圖九、革蘭氏陽性菌及陰性菌細胞表面結構
Figure 9. Composition of the cell surfaces of gram-positive and gram- negative bacteria.(Moat et al., 2002)
與胞壁質骨架共價結合在一起時具有穩定質膜和調節某些酶的活性 之功能。
革蘭氏陰性菌的胞壁質比較薄,並且擴展交聯程度較低,這樣 革蘭氏陰性菌細胞壁的硬度較差,並且使得這兩類菌在染色反應上 有所不同,由於革蘭氏陰性菌胞壁酸含量少,染色後很容易被乙醇 除去。另外,革蘭氏陰性菌具有雙層細胞質膜,一層位於胞壁質的 外側。外膜在化學組成上比較特別,它的內脂層是典型的磷脂層,
但是外脂層幾乎都是脂多糖,使得外膜的滲透性很高。在外膜的內 側,有一層或幾層肽聚糖構成的細胞壁。兩層膜之間具有周質間隙 蛋白,起物質運輸作用(網路資料)。
1.大腸桿菌(Escherichia coli)
革蘭氏陰性桿菌,兼性厭氧,能夠分解葡萄糖、乳糖、麥芽糖與 其他糖類,產酸並產氣,內無胞子。主要存在於人體及動物的腸道中,
為食品檢驗中重要的指標菌,亦為重要的腐敗菌(王, 1999),也是 臨床中重要的病原菌,與許多的疾病有關,其致病原因子主要為黏附 素(adhesin)與外毒素,會引起敗血症、新生兒腦膜炎、腸胃炎及尿 道感染等(王等, 2004)。
2.金黃色葡萄球菌(Staphylococcus aureus)
為革蘭氏陽性球菌,常存在於人類的皮膚、呼吸道、消化道、大
33
氣與周圍所接觸的物品中,為我們人體中的正常菌落,是一種potential pathogen 。所引起的疾病有: 組織蜂巢炎(cellulites)、皮膚汀
(carbuncle)、丘疹(pustules)、癤(boil)、手術後傷口感染等。
若食物中含有的腸毒素(enterotoxin)則會引起最常見的食物中毒。
如果菌體進入血液當中可能引起最嚴重的敗血症(septicemia)此外, 尚可以引起心內膜炎(endocarditis)、肺炎(pneumonia)、骨髓炎
(osteomyelitis)及中毒性休克症候群(TSS)(蔡, 2000;王等, 2004)。
(四)幾丁聚糖及其水解物的抗菌機制
以陰離子交換樹脂測試菌體表面細胞膜及細胞壁所帶的負電荷 量,發現革蘭氏陰性菌帶的負電荷量大於革蘭氏陽性菌帶的負電荷 量,特別是 G(-)Pseudominas aeruginosa>Samonella typhimurium
>Escherichia coli>G(+)Staphylococcus aureus>Staphylococcus faecalis。另外也發現去乙醯度愈高的幾丁聚醣越容易吸附於帶負電越 多的菌體表面,且吸附量與抑制效果成正比(Chung et al., 2004)。
幾丁聚醣真正的抗菌機構並不是很清楚,但原因大致有二,一為 當幾丁聚醣溶於pH值小於6的溶液時,幾丁聚醣會釋放出正電,而所 釋放出的正電分子會和細菌細胞膜所漏出的蛋白質或其他負電分子 形成交鏈,而且幾丁聚醣會選擇性的與金屬離子結合,因此可將幾丁 聚醣視為一種螯合劑,可能會以吸附或穿孔的兩種狀態造成細胞膜之
瓦解(Tsai et al., 2000;Helander et al., 2001;Liu et al., 2004;Li et al., 2007);二是幾丁聚醣進入菌體後,會結合DNA而阻止mRNA的生成 及降低細胞活性。因此幾丁聚醣可用來保護表皮、水的清潔劑及抑制 不同酵素等作用(Hadwiger et al., 1986;Shaihdi et al., 1999)。
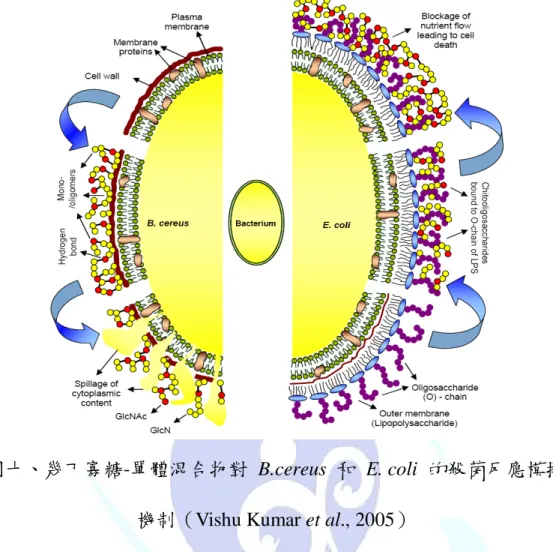
根據學者的研究,幾丁聚醣其單體及寡聚物對革蘭氏陽性菌及革 蘭氏陰性菌的抗菌機制有所差異。圖九中顯示,對於革蘭氏陽性菌 G
(+)B. cereus 主要是以單體或寡聚物與細胞膜壁表面形成氫鍵,造 成細胞膜壁的扭曲變形,內部物質流出而菌體死亡。對革蘭氏陰性菌 G(-)E. coli 則是幾丁寡醣會與脂多醣體(LPS)作用,形成吸附 於細胞膜壁表面的情形,造成營養、代謝及通透的障礙(Tsai et al, 2000;Helander et al., 2001;Vishu Kumar et al., 2005)。
35
圖十、幾丁寡糖-單體混合物對 B.cereus 和 E. coli 的殺菌反應模擬 機制(Vishu Kumar et al., 2005)
Figure 10. Mechanism of bactericidal action of chitooligomeric- monomeric mixtute towards B. cereus and E. coli –
a hypothetical model
參、材料與實驗方法 一、研究動機及架構
利用不同酵素(粗酵素chitinase、市售酵素cellulase及lysozyme)
具有不同的水解機制,來水解幾丁聚醣(DD80及DD92),產生不同 的水解產物(DD80-CHtri、DD92-CHtri、DD80-CHcel、DD92-CHcel、 DD80-CHlys及DD92-CHlys),再加以探討其抗菌活性(MIC、MBC及 IT)及抗菌影響因子(溶解度及分子量)之間的相互影響,進而瞭解 抗菌幾丁聚醣水解物產製條件。
(T. viride之chitinase誘發)
(誘發粗酵素及市售濃縮酵素cellulase、lysozyme)
(水解物CHtri、CHcel、CHlys)
抗菌特性試驗 最低抑制濃度(MIC)
最低殺菌濃度(MBC)
抑制時間(IT)
(去乙醯度80%及92%)
幾丁質酵素製備
幾丁聚醣酵素水解物 幾丁聚醣
分子量(黏度法及 HPLC)
溶解度(%)
37
二、實驗器材
無菌操作台(Chering huei)、恆溫培養箱(Incubactor:Sanyo)、
BioLog Microstation ELISA reader、離心機(Hermle Z323)、水浴槽
(Firstek scientific)、pH meter(Suntex SP-701 pH/mV/Temp meter)、
震盪器(Firstek scientific shaker S 102)、黏度計 Brookfield HADV-Ⅱ
+(Programmable DV-Ⅱ+viscometer)。
三、實驗藥品
( 一 ) 幾 丁 質 ( chitin )、 幾 丁 聚 醣 ( chitosan )、 葡 萄 醣 胺
(D-(+)-Glucosamine)及 N-乙醯葡萄醣胺寡聚物(chitosan oligomers;
NACOS):
幾丁質及幾丁聚醣購自應化企業有限公司。幾丁聚醣為去乙醯度 80%、92%,分子量約 300 kDa,聚合度約為 1850 DP。
葡萄醣胺(D-(+)-Glucosamine hydrochloride, minimum 99%)購 自於 Sigma (G4875,美國)。N-乙醯葡萄醣胺其寡聚物(chitosan oligomers),N-乙醯葡萄醣胺三聚物(chitosan trimer,購自於 Seikagaku corporation,Code NO. 400433)及 N-乙醯葡萄醣胺六聚物(chitosan hexamer,購自於 Seikagaku corporation,Code NO.400436)
(二)培養基:
Nutrient broth(NB):Himedia M002;soyabean casein digest
medium, trytone soya broth(TSB):Himedia M011;soyabean casein digest agar, trytone soya agar(TSA):Himedia M290;potato dextrose broth(PDA):Himedia M403;agar bacteriological, agar No.1(agar):
Oxoid LP0011。(Himedia,印度;Oxoid,英國)。
(三)一般藥品:
Glucose、sucrose、NaNO3、MgSO4‧7H2O、KCl、FeSO4‧7H2O
(購自於 Yakuri,日本);K2HPO4、NaHPO4‧H2O、Na2HPO4(購自 於 Merck,美國);CH3COOH(購自於 Fluka,瑞士);CH3COONa
(購自於 RDH,德國)。
(四)特殊藥品:
Poly vinyl sulfate, potassium salt(PVSK)(購自於 Aldrich 271969,
美國);Hexadecylpyridinium chloride monohydrate(購自於 Sigma C9002,美國);Toluidine blue O(購自於 Sigma T3260,美國);Dextran
(購自於 Sigma D9260,美國)。
(五)實驗菌種:
木黴菌(Trichoderma viride):購自於食品工業研究所,生物資 源保存及研究中心 BCRC 32054。
大腸桿菌(Escherichia coli):購自於食品工業研究所,生物資源 保存及研究中心 BCRC 10675 及 BCRC 10314。
39
金黃色葡萄球菌(Staphylococcus aureus):購自於食品工業研究 所,生物資源保存及研究中心 BCRC 10780、BCRC 10781 及 BCRC 10451。
(六)酵素:
1、商用酵素:
Cellulase(EC 3.2.1.4):cellulase from Trichoderma reesei ATCC 2621,購自於 Sigma C2730(美國)。
Lysozyme(EC 3.2.1.17):lyophilized powder,購自於 Sigma L7651
(美國)。
2、幾丁質酶粗酵素液
(1)膠體幾丁質(colloidal chitin)製備
取幾丁質粉末10 g,加入鹽酸200 ml(1:20),於抽氣櫃中,冰 浴(4℃)下均勻攪拌2小時後,加入2 L的RO水(1:9~10水)中和,
使其產生白色膠體幾丁質沈澱,過程中不斷攪拌,將沈澱物離心保留 後,以水洗使其達中性狀態後,保存於少量的RO水中備用(Roberts and Selitrenkoff, 1985)。
(2)Trichoderma viride 菌株培養及誘發幾丁質酶(chitinase)
由冷凍管中取出 Trichoderma viride BCRC 32054 100 µl 凍管保存 液,置於 PDA 培養基中央,室溫下培養 7 天(活化一代),七天後以
接種環取孢子置於 PDA 培養基中央,培養於室溫下,7 天(活化二 代)。用 2 ml RO 洗下孢子,置入一培培養基,於室溫下震盪培養 5 天。以紗布過濾,取得菌絲體。用 RO 將菌絲體表面糖分洗去後,置 入二培培養基,於室溫下震盪培養 7 天。分別在培養 12 小時、24 小 時、2 天、3 天、4 天、5 天、6 天及 7 天後取樣,將粗酵素保存及酵 素進行活性測定(Chen and Lin, 2004)。
Trichoderma viride 幾丁質酶誘發一培培養基(菌絲體放大培養 基):glucose 40 g,sucrose 12 g,NaNO3 1.2 g,MgSO4‧7H2O 0.2 g,
KCl 0.2 g,FeSO4‧7H2O 0.004 g,K2HPO4 0.4 g,ddH2O 定量至 400 ml,pH 調至 7.2。
Trichoderma viride 幾丁質酶誘發二培培養基(酵素誘發培養 基):Colloidal chitin 6 g(final 1.5 %),NaNO3 1.2 g,MgSO4‧7H2O 0.2 g,KCl 0.2 g,FeSO4‧7H2O 0.004 g,K2HPO4 0.4 g,ddH2O 定量至 400 ml,pH 調至 7.2。
(3)粗酵素液保存
誘發酵素液經過抽氣過濾(濾膜孔徑 0.45 µm),在過 0.22 µm 濾 膜。分裝成小量,置於 15 ml 離心管中,保存於-20℃冰箱(Whirlpool,
東穎惠而浦)冷凍。
(4)酵素活性測定:
41
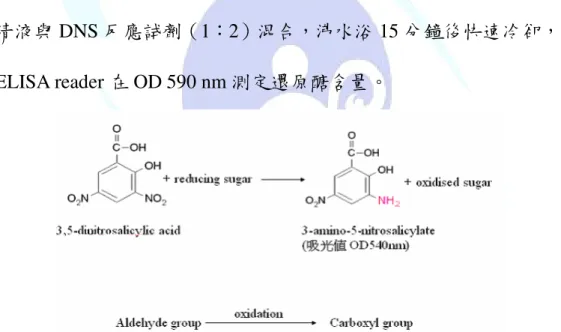
利用DNS試劑作為水解產物的還原醣分析(Ilyina et al., 2000;
Sengupta et al., 2000),測試水解酵素活性最佳的時間點。圖十為DNS 試 劑 作 用 原 理 , 幾 丁 聚 醣 經 過 酵 素 作 用 , 會 水 解 出 小 分 子 D-glucosamine 及 N-acetyl-D- glucosamine,而DNS試劑會與其還原 端作用,並呈色(Ulhoa and Peberdy, 1991;Massimiliano, 1998)。
1 ml 粗酵素液加上 9 ml 的膠體幾丁質基質溶液(含 1 %幾丁質 固形物,50 mM phosphate buffer pH 7.0),於 42 ℃水浴槽(Firstek Scientific B 201)反應 1 小時後,離心 10 分鐘(10000 ×g),取其上 清液與 DNS 反應試劑(1:2)混合,沸水浴 15 分鐘後快速冷卻,以 ELISA reader 在 OD 590 nm 測定還原醣含量。
圖十一、DNS 試劑與還原醣作用原理(陳, 2006)
Figure 11. Speculative representation of the DNS reagent on the reducing sugar.
四、幾丁聚醣水解物製備
1%幾丁聚醣(去乙醯度 80%、92%)溶於 100 mM acetic buffer
(pH 4.0)中後,加入粗酵素液 10%(濃縮酵素液用量 1%),在 42℃
下震盪反應,並取水解時間點 1~12 天之樣品。取出後用沸水浴 15 分鐘使酵素失活(陳, 2006),冷卻至室溫後再沸水浴煮 30 分鐘(重 複冷卻及水浴三次,使水解樣品達無菌狀態,亦可避免 121℃下樣品 的褐變反應)。
五、物理特性分析
(一)聚合度測定 1.黏度計算分子量
使 用 黏 度 計 Brookfield HADV-Ⅱ +( programmable DV-Ⅱ + viscometer),探頭為 H1 探頭,設定轉速為 100 rpm。於水解過程中,
每 3、6、9、24、48、72、96、120、144、168 小時,取 400 ml 至燒 杯中,測其黏度(cp)變化,並以 Mark Houwink 方程式推估分子量
(Ramírez-Coutiño et al., 2006;Li et al., 2007)。Mark Houwink 方程 式:〔η〕= KMa
K = 1.64 × 10-30 × DD14 a = -1.02 × 10-2 × DD + 1.82
43
(A)
(B)
圖十二、黏度計 Brookfield HADV-Ⅱ+(a)裝置(b)探頭 Figure 12. Viscometer brookfield HADV-Ⅱ+(a)device(b)detector
2.超效能液相層析儀 HPLC
(1)水解產物之大分子量分子分佈
使用TSKgel G3000PW(7.5 mm × 300 mm;TOSOH Co.)(gel filtration column)做為HPLC分析用管柱,流速1.0 ml / min,沖提液 為100 mM acetic buffer, pH 4.0,利用RI detector偵測之,以NACOS 1、
3、6 糖及dextran做為標準品(Qin et al., 2004)。
(2)水解產物之小分子量分子分佈
使用Lichrospher 100 NH2(250 × 4 mm;Merck)管柱,及其沖提 液為60% acetonitrile,其他條件皆與大分子量測定條件相似,另外標 準品為NACOS 1、3、6 糖。
(二)溶解度測試
酵素水解產物經過 200 mM phosphate buffer 以 1:1 的比例中和 後,6000 rpm 離心 20 分鐘,將上清液與沈澱物分離,取其沈澱物水 洗三次,以去除溶劑,於 60℃的烘箱中烘乾後秤重,計算其溶解度
(烘箱:Firstek OV150)。
溶解度(%)=(樣品重-烘乾後重)/ 樣品重 × 100 六、抗菌特性分析:
(一)菌株培養
S. aureus(BCRC 10780, BCRC 10781, BCRC 10451)培養於
45
TSA;E. coli(BCRC 10675, BCRC 10314)培養於NA,由-80℃冰箱
(Sanyo MOF-U2086S)取出凍管保存液,取50 ul置於培養基中活化 兩 代 , 兩 種 菌 種 皆 在 37℃ 中 培 養 ( 培 養 箱 : Low-temp incubator LT1601)。
(二)96 well micro-plate 抗菌活性測試
水解物以 20 mM acetic buffer(pH 4)作連續對半稀釋,取 50 µl 置入 96 well micro-plate(2 重複),再加入 50 µl 之 40 mM phosphate buffer(pH 7),最後加入 100 µl 之菌液(取活化之菌液 20 ul 加入 10 ml 兩倍濃度的培養基中),培養於 37 ℃下,以 ELISA reader OD 590 nm 每 12 小時測其濁度變化,繪出生長曲線,判斷 MIC 及 IT 及計算 抑制百分比,再進行作 MBC 測試(陳, 2006)。
最小抑菌濃度(minimum inhibitory concentration, MIC)定義為 菌株在與樣品培養 48 小時後,還維持在遲滯期(lag phase)時的濃 度。
抑制時間(inhibitory time, IT)定義為菌株生長在遲滯期(lag phase)狀態所延長之時間。抑制時間=實驗組菌株生長於 lag phase 之時間-對照組菌株生長於 lag phase 之時間。
最低殺菌濃度(minimum bactericidal concentration, MBC)定義 為菌株被致死菌量達 99.99%。原菌量為 106 / ml,致死 99.99%即菌
量為 102 / ml。取出為 MIC 濃度及高一個濃度中 well 之菌液中 well 之菌液,連續稀釋(101-106)後,取 1 ml 塗抹於平板上,於 37 ℃下 培養 24 小時,計算菌落數。
47
肆、結果與討論
一、不同時程之粗酵素誘發活性測定
圖十二為 Trichoderma viride 於不同誘發時間下之 chitinase 生成 曲線圖。以 DNS 法來測定酵素活性發現,其於三天可達到高峰,四 天之後活性趨於平緩,故取第四天的酵素來作為 chitinase 的粗酵素液 進行後續之幾丁聚醣水解實驗。
二、酵素水解幾丁聚醣之變化
(一)不同水解時程之 DNS 還原糖測定
研究中所使用的三種酵素具有不同的水解機制,而產生不同的水 解產物,可由還原醣量的產生,及水解產物的黏度變化,進而推測分 子量之變化情形。圖十三中可見,lysozyme 水解產物其 DNS 變化很 少,可能是由於 lysozyme 可水解之切點過少,必須同時有三至六個 N-乙醯葡萄糖胺才可水解。而 cellulase 水解過程可分兩階段:第一階 段在二天即達到第一個高峰後有些許下降,五天後則進入第二階段,
還原醣有繼續上升之情形。推測第一階段為 cellulase 將幾丁聚醣液 化,使其黏度下降,水解四天時的分子量,可能會產生聚集的現象,
而第二階段則為糖化現象,將幾丁聚醣結晶區之部分做侵入性的水 解。不同於前兩個酵素,chitinase 水解產物之 DNS 還原醣量則是隨 著水解時間而持續上升之趨勢,其中去乙醯度 80%的幾丁聚醣產生
較去乙醯度 92%高量的還原醣量,主要是因為 chitinase 水解切點為 N-乙醯葡萄醣胺,而去乙醯度 80%的幾丁聚醣含有比 92%者多的 N- 乙醯葡萄醣胺,故具有較多酵素的切點。
(二)不同水解時程之黏度測定
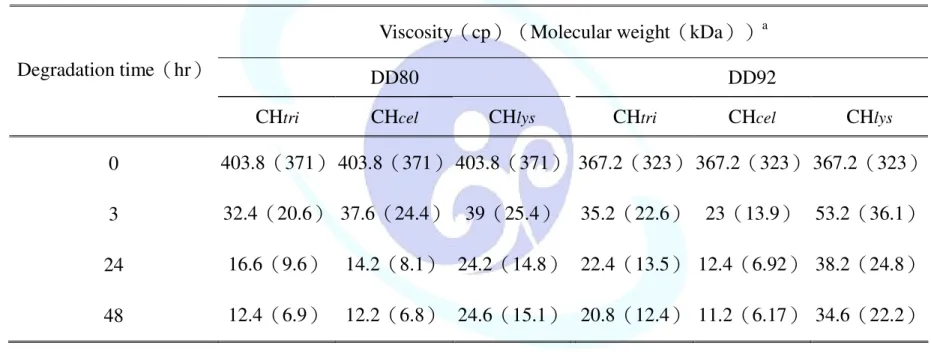
隨著酵素水解幾丁聚醣會使其黏度降低,進而推算出分子量之變 化。研究中以三種酵素水解兩種去乙醯度的幾丁聚醣,發現在三小時 內去乙醯度 80%之幾丁聚醣(DD80)黏度會由 403.8 cp 下降至 40 cp 以下,而去乙醯度 92%之幾丁聚醣(DD92)其黏度則由 367.2 cp 下 降至 55 cp 以下,而於三小時之後起黏度變化不大,由表七可見,水 解一天的黏度大小順序如下:DD92-CHlys(38.2 cp)>DD80-CHlys
(24.2 cp)>DD92-CHtri(22.4 cp)>DD80-CHtri(16.6 cp)>
DD80-CHcel(14.2 cp)>DD92-CHcel(12.4 cp)。Lysozyme 的水解產 物黏度均較大,特別是去乙醯度 92%的幾丁聚醣;chitinase 的水解產 物其黏度以去乙醯度為 92%者較去乙醯度為 80%者來得高。以上這 些結果與上節水解產物之 DNS 還原醣研究之趨勢一致,都可歸因於 酵素水解行為與去乙醯度之關係。其中 cellulase 的水解產物黏度最 低,其不受 N-乙醯葡萄糖胺量的多寡影響,而是受到溶解度的影響,
由於去乙醯度 92%的幾丁聚醣溶解度較佳,故酵素水解較完全。
(三)不同水解時程之分子量變化