國立宜蘭大學環境工程學系(所) 碩士論文
Department of Environmental Engineering National Ilan University
Master Thesis
利用中孔洞觸媒進行甲烷完全氧化與部分氧化之研究
Study on the Direct Complete and Partial Oxidation of Methane by Mesoporous Catalysts
研究生:林振超
Graduate student:Chen-Chao Lin
指導教授:張章堂 博士
Advisor:Chang, Chang-Tang, Ph D
中華民國九十九年六月 June, 2010
摘要
人類直接或間接使用燃料,造成溫室氣體大量排放的情況下,全球暖 化的危機日趨嚴重,造成氣候變的更加極端,甲烷為溫室效應氣體之ㄧ,
其溫室效應潛勢為 CO2的 21 倍。國內外許多研究將甲烷轉化成具有經濟 效益的化學品,而目前處理甲烷大致歸類為甲烷部分氧化反應、直接氧化 反應及氧化偶合反應。而甲烷藉由水蒸氣重組程序以兩階段方式轉化成甲 醇此類技術多需高溫高壓繁雜製程,而本研究以自行製備金屬 MCM-41 中孔洞觸媒進行甲烷完全礦化成二氧化碳及部分氧化為甲醇之研究。當甲 烷進流濃度為 1000 ppm 、空間流速 1200 hr-1且操作溫度為 500℃時,以 Pt-MCM-41 觸媒將甲烷礦化成二氧化碳為最佳;每克的削減量約 0.1 mg/g,其餘觸媒每克的削減量約 0.01 mg/g,相差約 10 倍。當操作溫度提 昇至 550℃時,以 Pt-MCM-41 礦化效率最佳,而每克觸媒溫室效應潛勢削 減量為 0.15 mg/g,各觸媒每克二氧化碳削減量依序為:Pt-MCM-41>
Fe-MCM-41> Mn-MCM-41> Ni-MCM-41> MCM-41;經計算 MCM-41、
Fe-MCM-41、Mn-MCM-41、Ni-MCM-41 及 Pt-MCM-41 觸媒材料成本,
得知各觸媒每克成本分別約為 126.5、143.3、143.2、143.2 及 282.6 元/g,
以經濟效益考量下可選擇 Fe-MCM-41 觸媒。至於部分氧化甲烷為甲醇,
則以 O3結合觸媒於常溫下最具經濟效益,當結合 MCM-41 觸媒可得到最 高甲烷轉化為甲醇之轉化率 83.7%,其次結合 Fe-MCM-41,轉化率約為
62.6%。研究結果得知,O3結合 MCM-41 與 Fe-MCM-41 觸媒產生濃度 1 ppm 的甲醇所需金額分別為 4.3 與 6.5 元。本研究中將各觸媒實驗結果代 入 Power-rate Law 及 Mars and Van Krevelen 模式中,以 Power-rate Law 模式之相關係數較大,皆在 0.97 以上,顯示出 Power-rate Law 可描述觸媒 氧化甲烷之動力學反應,反應階數為 0.3 ~ 1.1;而 MCM-41、Fe-MCM-41、
Mn-MCM-41、Ni-MCM-41 及 Pt-MCM-41 碰撞因子(A)分別為 9.94 × 1011、 9.29 × 1066、4.3 × 1055、3.07 × 1030及 1.2 × 106sec-1;活化能分別為 160、
1086、877、514 及 54 KJ/mol。
關鍵字:溫室氣體、中孔洞觸媒、二氧化碳、甲烷、甲醇
Abstract
A large of greenhouse gases is emitted since people directly or indirectly use fuels. The crisis of global warming increases seriously and results in more extreme climate change. The potential greenhouse gas effect of methane is about 21 times than that of CO2. In current research, people used to transforming methane into chemicals due to cost-effective with partial oxidation, direct oxidation and coupling reaction techniques. Tranditionally, the steam reforming with two-stage procedure can be used to convert methane into methanol under high temperature and pressure. This technology is very complicated process and high cost. Therefore, the MCM-41 mesoporous metal catalyst was prepared to transform methane into methanol with economic consideration in this study. First, the methane was completely mineralized into carbon dioxide. Then, partial oxidation of methane into methanol was also studied. The results showed that the optimum operation conditions of complete oxidation was inlet concentration of methane 1000 ppm, space velocity 1200 hr-1 and the operating temperature of 500 ℃ with Pt-MCM-41 catalyst. The best methane reduction is about 0.10 and 0.15 mg/g under operating temperature of 500 and 550 ℃, respectively, with Pt-MCM-41 catalyst. Carbon dioxide reduction per gram of catalyst ranked in the order as Pt-MCM-41 > Fe-MCM-41 > Mn-MCM-41 > Ni-MCM-41 >
MCM-41.
The cost for preparing MCM-41, Fe-MCM-41, Mn-MCM-41, Ni-MCM- 41 and Pt-MCM-41 was about 127, 143, 143, 143 and the 283 NT/g.
O3 combined with MCM-41at room temperature was the most cost-effective.
The conversion of methane into methanol was 83.7 and 62.6 % with MCM-41 and Fe-MCM-41, respectively. The cost was 4.3 and 6.5 NT dollars per ppm methanol, respectively, under O3 combined with MCM-41 and Fe-MCM-41 catalyst. This study also got the result that the Power-rate Law with correlation coefficiency of 0.97could fit the kinetic equation better than that of Mars and Van Krevelen model.
The kinetics of methane reaction order was ranged from 0.3 to 1.1.
Furthermore, collision factor (A) was 9.94 × 1011, 9.29 × 1066, 4.3 × 1055, 3.07
× 1030 and 1.2 × 106 sec-1, respectively, with MCM-41, Fe-MCM-41, Mn-MCM-41, Ni-MCM-41 and Pt-MCM-41. In addition, activation energy was about 160, 1086, 877, 514 and 54 KJ / mol, respectively, with the previous catalysts.
Keyword:Greenhouse Gas, Mesoporous Catalyst, Carbon Dioxide, Methane, Methanol
誌謝
研究所兩年的生活,轉眼間一下子就過去了,研究所的學業即將結 束。研究期間非常感謝恩師張章堂教授,這兩年來的耐心及細心指導與建 議,讓我對組裝設備、實驗技巧及專業知識、觀念與邏輯思考,有很好的 學習,並給予學生非常充分的實驗資源與空間。也感謝邱求三、馬志明、
張嘉驥、洪桂彬教授在論文的指正,給予寶貴意見與指導。同時也感謝光 暉、則劭、允安,教導我研究上合成觸媒的方法及實驗技巧,小珍、立民、
夢歆在研究及課業上的協助與幫忙、鼓勵與關心,讓我渡過一切的瓶頸。
感謝林永順經理以及大學同學溫茂森對我的實驗設備與儀器操作 上,特別於百忙之中撥空為我細心的指導及校正;大學同學黃稚荃常幫忙 中病毒之電腦進行修護,以及中央貴儀中心的翁淑珍小姐、Jeff 給予儀器 使用上的協助;創迅公司計畫經理曉嵐於合作計畫上耐心的指導,讓我學 習到更多專業知識與職場上的經驗。另外,也感謝空污實驗室與各實驗室 的同學,謝謝大家的互相幫忙與包容,研究期間因為有你們的幫助,讓我 學到很多寶貴的經驗,因為有你們的陪伴讓我快樂的渡過每一天。最後感 謝我最重要的家人,多年來辛苦拉拔我長大,並栽培我讀完研究所的母 親,不管在生活上或求學階段中,給我最多的溫暖與支持。由於你們的鼓 勵、支持與關懷,使我能夠無後顧之憂的完成學業,願將我論文成果的喜 悅和榮耀與你們一同分享。
目錄
摘要 ...I Abstract... III 目錄 ...VI 圖目錄 ... X 表目錄 ... XVII 符號對照表 ...XIX
第一章 前言 ... 1
1-1 研究緣起... 1
1-2 研究目的... 4
第二章 文獻回顧 ... 7
2-1 溫室效應之影響... 7
2-1-1 溫室效應... 7
2-1-2 溫室氣體相關國際公約 ...13
2-1-3 能源危機...19
2-2 甲烷特性及轉化機制...21
2-2-1 甲烷基本特性...22
2-2-2 甲烷轉化機制...23
2-3 臭氧基本特性及各種高級氧化程序...31
2-4 多孔性材料之發展...33
2-5 MCM-41 製備方法... 40
2-5-1 界面活性劑之簡介...45
2-5-2 微胞與矽酸鹽之簡介 ...47
2-5-3 MCM-41 合成機制 ... 54
2-6 觸媒特性分析方法及原理...56
2-6-1 X-ray 粉末繞射儀 ... 56
2-6-2 氮氣等溫吸附/脫附儀 ...60
2-6-3 掃描式電子顯微鏡及能量散佈光譜儀 ...66
2-6-4 穿透式電子顯微鏡...67
2-6-5 熱重分析儀...69
2-6-6 傅立葉紅外線吸收光譜儀 ...70
2-6-7 紫外光-可見光光譜儀 ...72
2-7 性能評估方法...73
2-8 反應動力學...78
2-8-1 Power-rate Law 模式 ... 81
2-8-2 Mars and Van Krevelen 模式... 83
2-8-3 Arrhenius 方程式... 85
第三章 實驗方法 ...87
3-1 實驗藥品及研究設備...87
3-1-1 實驗藥品...87
3-1-2 研究設備...88
3-1-3 分析儀器...89
3-2 研究流程...90
3-3 觸媒製備...92
3-4 操作參數...95
3-5 中孔洞觸媒特性分析...99
3-6 反應動力學參數研求方式...102
第四章 結果與討論 ...104
4-1 MCM-41 特性分析結果... 104
4-1-1 X-ray 粉末繞射儀分析結果 ... 104
4-1-2 氮氣等溫吸附/脫附儀分析結果 ... 113
4-1-3 掃描式電子顯微鏡分析結果 ... 115
4-1-4 穿透式電子顯微鏡分析結果 ...123
4-1-5 熱重分析儀分析結果 ...128
4-1-6 傅立葉紅外線吸收光譜儀分析結果 ...133
4-1-7 紫外光-可見光光譜儀 ...135
4-2 甲烷礦化與成效分析結果...136
4-2-1 空白測試...136
4-2-2 溫度對礦化之影響...139
4-2-3 進流濃度對礦化之影響 ...144
4-2-4 空間流速對礦化效率之影響 ...146
4-2-5 溫室效應潛勢減量評析結果 ...151
4-2-6 成本效益分析...154
4-3 甲烷轉化為甲醇轉化率分析與效益評估結果...155
4-3-1 甲烷轉化成甲醇分析結果 ...156
4-3-2 甲烷轉成甲醇之效益評估結果 ...165
4-4 動力方程式之探討...166
第五章 結論與建議 ...177
5-1 結論...177
5-2 建議...179
參考文獻 ...181
附錄一 物質安全資料表-甲烷...195
附錄二 物質安全資料表-甲醇...200
附錄三 物質安全資料表-臭氧...205
附錄四 甲烷及甲醇檢量線 ...210
附錄五 甲烷及甲醇經濟效益計算... 211
圖目錄
圖 2-1-1 溫室效應示意圖 ... 8
圖 2-1-2 溫室氣體排放來源示意圖 ...11
圖 2-1-3 全球溫室氣體濃度趨勢圖 ...12
圖 2-1-4 全球平均溫度趨勢圖 ...13
圖 2-2-1 甲烷之化學結構圖 ...22
圖 2-2-2 甲烷氧化偶合反應之示意圖 ...30
圖 2-3-1 臭氧之結構圖 ...31
圖 2-4-1 多孔性材料 M41S 家族結構圖 ...36
圖 2-4-2 多孔性材料 M41S 家族 X-ray 特性峰示意圖...37
圖 2-4-3 中孔洞二氧化矽歷年研究文獻數量 ...38
圖 2-4-4 歷年多孔性材料發展過程 ...39
圖 2-5-1 界面活性劑分子結構示意圖 ...45
圖 2-5-2 微胞與反微胞之結構圖 ...48
圖 2-5-3 界面活性劑分子幾何堆積模型示意圖 ...50
圖 2-5-4 各種微胞型態結構圖 ...50
圖 2-5-5 不同 pH 值與矽酸鹽縮合速率及表面電荷之對照圖 ...52
圖 2-5-6 Beck 之 MCM-41 合成機制...55
圖 2-5-7 Firouzi 之 MCM-41 合成機制 ...56
圖 2-6-1 X-ray 繞射圖 ...57
圖 2-6-2 MCM-41 結構中之晶面距離與晶格常數 ...59
圖 2-6-3 氮氣等溫吸附脫附曲線圖 ...63
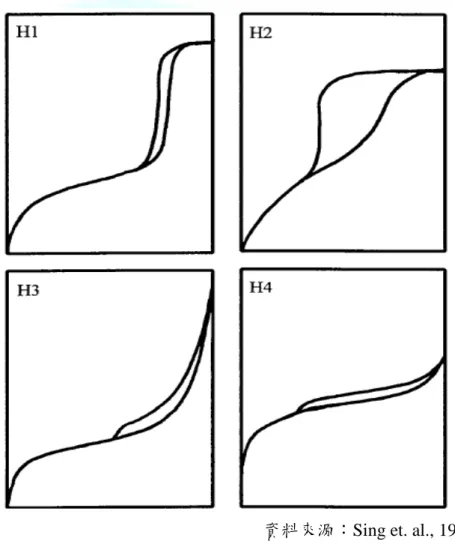
圖 2-6-4 IUPAC 定義遲滯環之圖型 ...65
圖 2-6-5 TEM 概略圖...68
圖 2-6-6 明、暗視野之示意圖 ...69
圖 2-7-1 觸媒焚化反應速率與反應關係圖 ...76
圖 2-8-1 柱流式反應器 ...79
圖 3-2-1 研究流程圖 ...91
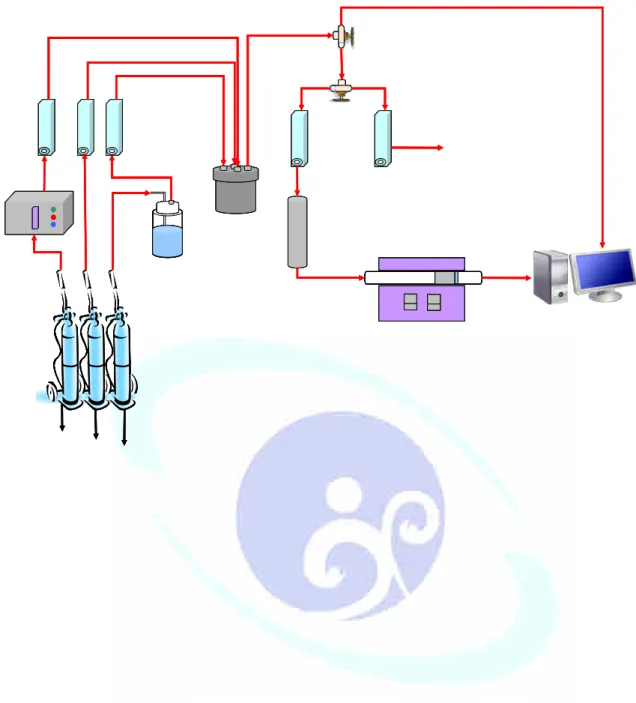
圖 3-4-1 反應系統設備圖 ...98
圖 4-1-1 各種觸媒之 X-ray 粉末繞射光譜圖...107
圖 4-1-2 Fe-MCM-41 之廣角 XRD 圖譜 ...109
圖 4-1-3 Mn-MCM-41 之廣角 XRD 圖譜...110
圖 4-1-4 Derylo-Marczewska 等人研製 Mn-MCM-41 之廣角 XRD 圖譜.110 圖 4-1-5 Ni-MCM-41 之廣角 XRD 圖譜 ...111
圖 4-1-6 Park 等人研製 Ni-MCM-41 之廣角 XRD 圖譜...112
圖 4-1-7 Pt-MCM-41 之廣角 XRD 圖譜 ...112
圖 4-1-8 Liu 等人研製 Pt-MCM-41 之廣角 XRD 圖譜 ...113
圖 4-1-9 各種金屬觸媒之氮氣等溫吸附/脫附曲線圖 ...114
圖 4-1-10 各種金屬觸媒之孔洞大小分佈曲線圖 ...115
圖 4-1-11 as-MCM-41 之 SEM 圖 ...116
圖 4-1-12 MCM-41 之 SEM 圖 ...117
圖 4-1-13 Fe-MCM-41 之 SEM 圖...117
圖 4-1-14 Mn-MCM-41 之 SEM 圖 ...118
圖 4-1-15 Ni-MCM-41 之 SEM 圖...118
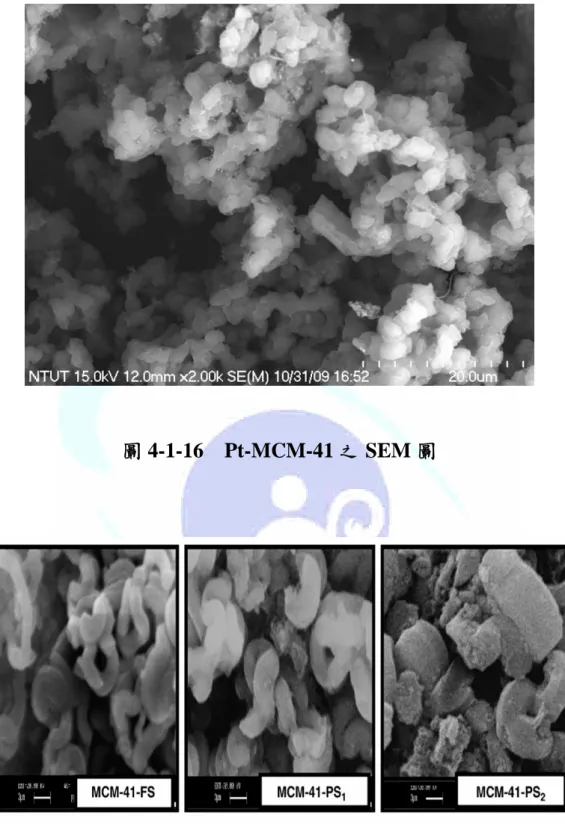
圖 4-1-16 Pt-MCM-41 之 SEM 圖 ...119
圖 4-1-17 Gaydhankar 等人研製中孔洞材料之 SEM 圖 ...119
圖 4-1-18 Das 等人研製中孔洞材料之 SEM 圖...120
圖 4-1-19 Fe-MCM-41 SEM-EDS...121
圖 4-1-20 Mn-MCM-41 SEM-EDS ...121
圖 4-1-21 Ni-MCM-41 SEM-EDS...122
圖 4-1-22 Pt-MCM-41 SEM-EDS ...122
圖 4-1-23 Park 等人 Ni-MCM-41 SEM-EDS 之結果 ...123
圖 4-1-24 as-MCM-41 之 HR-TEM 圖 ...124
圖 4-1-25 MCM-41 之 HR-TEM 圖...125
圖 4-1-26 Fe-MCM-41 之 HR-TEM 圖 ...125
圖 4-1-27 Mn-MCM-41 之 HR-TEM 圖...126
圖 4-1-28 Ni-MCM-41 之 HR-TEM 圖 ...126
圖 4-1-29 Pt-MCM-41 之 HR-TEM 圖 ...127
圖 4-1-30 Parvulescu 等人研製 Ni-MCM-41 之 TEM 圖...127
圖 4-1-31 Liu 等人研製 Pt-MCM-41 之 TEM 圖 ...128
圖 4-1-32 各觸媒之 TGA 圖 ...131
圖 4-1-33 各金屬觸媒之 DTA 圖 ...132
圖 4-1-34 Parid 等人研製中孔洞材料之之 DTA 圖 ...132
圖 4-1-35 MCM-41 披覆各種金屬之 FT-IR 圖譜 ...134
圖 4-1-36 各觸媒之 UV-vis 吸收光譜圖 ...136
圖 4-2-1 各種停留時間對甲烷礦化效率影響之空白測試 ...137
圖 4-2-2 各種操作溫度對甲烷礦化效率影響之空白測試 ...138
圖 4-2-3 各種甲烷進流濃度對甲烷礦化效率影響之空白測試 ...139
圖 4-2-4 使用 MCM-41 觸媒溫度對礦化效率之影響 ...141
圖 4-2-5 使用 Fe-MCM-41 觸媒溫度對礦化效率之影響...141
圖 4-2-6 使用 Mn-MCM-41 觸媒溫度對礦化效率之影響 ...142
圖 4-2-7 使用 Ni-MCM-41 觸媒溫度對礦化效率之影響...142
圖 4-2-8 使用 Pt-MCM-41 觸媒溫度對礦化效率之影響 ...143
圖 4-2-9 使用各種觸媒操作溫度之礦化效率 ...143
圖 4-2-10 使用 Fe-MCM-41 觸媒進流濃度對礦化效率之影響...145
圖 4-2-11 使用不同觸媒進流濃度對礦化效率之影響 ...145
圖 4-2-12 使用 MCM-41 空間流速與溫度對礦化效率之影響...147
圖 4-2-13 使用 Ni-MCM-41 空間流速與溫度對礦化效率之影響 ...147
圖 4-2-14 使用 MCM-41 空間流速與濃度對礦化效率之影響...148
圖 4-2-15 使用 Ni-MCM-41 空間流速與濃度對礦化效率之影響 ...148
圖 4-2-16 溫度為 400℃時各種觸媒於不同空間流速之礦化效率 ...150
圖 4-2-17 溫度為 550℃各種觸媒於不同空間流速之礦化效率 ...150
圖 4-2-18 不同溫度下每克觸媒溫室氣體潛勢削減量 ...152
圖 4-2-19 於不同空間流速下每克觸媒溫室氣體潛勢削減量 ...153
圖 4-2-20 於不同甲烷進流濃度下每克觸媒溫室氣體潛勢削減量 ...154
圖 4-2-21 於不同溫度下單位成本溫室氣體潛勢削減量 ...155
圖 4-3-1 使用 MCM-41 空間流速對轉化成甲醇效率之影響 ...157
圖 4-3-2 使用 Fe-MCM-41 空間流速對轉化成甲醇效率之影響...158
圖 4-3-3 使用 Mn-MCM-41 空間流速對轉化成甲醇效率之影響 ...158
圖 4-3-4 使用 Ni-MCM-41 空間流速對轉化成甲醇效率之影響...159
圖 4-3-5 使用 Pt-MCM-41 空間流速對轉化成甲醇效率之影響 ...159
圖 4-3-6 各觸媒不同空間流速對轉化成甲醇效率之影響 ...160
圖 4-3-7 Teng 等人於不同空間速下甲醇選擇性之研究...160
圖 4-3-8 使用 MCM-41 溫度對轉化成甲醇效率之影響 ...162
圖 4-3-9 使用 Fe-MCM-41 溫度對轉化成甲醇效率之影響...162
圖 4-3-10 使用 Mn-MCM-41 溫度對轉化成甲醇效率之影響 ...163
圖 4-3-11 使用 Ni-MCM-41 溫度對轉化成甲醇效率之影響...163
圖 4-3-12 使用 Pt-MCM-41 溫度對轉化成甲醇效率之影響 ...164
圖 4-3-13 各觸媒不同溫度對甲醇轉化效率之影響 ...164
圖 4-3-14 使用各觸媒將甲烷轉化成甲醇之成本分析圖 ...166
圖 4-4-1 MCM-41 之 Power-rate Law 模式圖 ...168
圖 4-4-2 MCM-41 之 Mars Van Krevelen 模式圖 ...169
圖 4-4-3 Fe-MCM-41 之 Power-rate Law 模式圖 ...169
圖 4-4-4 Fe-MCM-41 之 Mars Van Krevelen 模式圖 ...170
圖 4-4-5 Mn-MCM-41 之 Power-rate Law 模式圖 ...170
圖 4-4-6 Mn-MCM-41 之 Mars Van Krevelen 模式圖...171
圖 4-4-7 Ni-MCM-41 之 Power-rate Law 模式圖 ...171
圖 4-4-8 Ni-MCM-41 之 Mars Van Krevelen 模式圖 ...172
圖 4-4-9 Pt-MCM-41 之 Power-rate Law 模式圖...172
圖 4-4-10 Pt-MCM-41 之 Mars Van Krevelen 模式圖...173
圖 4-4-11 MCM-41 之 lnk’對 1/T 之關係圖 ...173
圖 4-4-12 Fe-MCM-41 之 lnk’對 1/T 之關係圖...174
圖 4-4-13 Mn-MCM-41 之 lnk’對 1/T 之關係圖 ...174
圖 4-4-14 Ni-MCM-41 之 lnk’對 1/T 之關係圖...175
圖 4-4-15 Pt-MCM-41 之 lnk’對 1/T 之關係圖 ...175
表目錄
表 2-1-1 人類活動產生溫室氣體 ... 9
表 2-1-2 溫室氣體潛勢表 ...10
表 2-1-3 京都議定書各國減量目標表 ...16
表 2-1-4 台灣使用能源種類比例 ...21
表 2-4-1 IUPAC 孔洞材料分類 ...34
表 2-4-2 沸石種類及性質 ...35
表 2-4-3 中孔洞多孔性材合成條件 ...39
表 2-5-1 不同製備中孔洞觸媒方法之優缺點 ...43
表 2-5-2 常見界面活性劑種類 ...46
表 2-5-3 界面活性劑堆積參數與微胞形狀對照表 ...51
表 2-5-4 界面活性劑堆積參數與微胞形狀對照表 ...52
表 2-6-1 不同材質之靶材 X-ray 波長...58
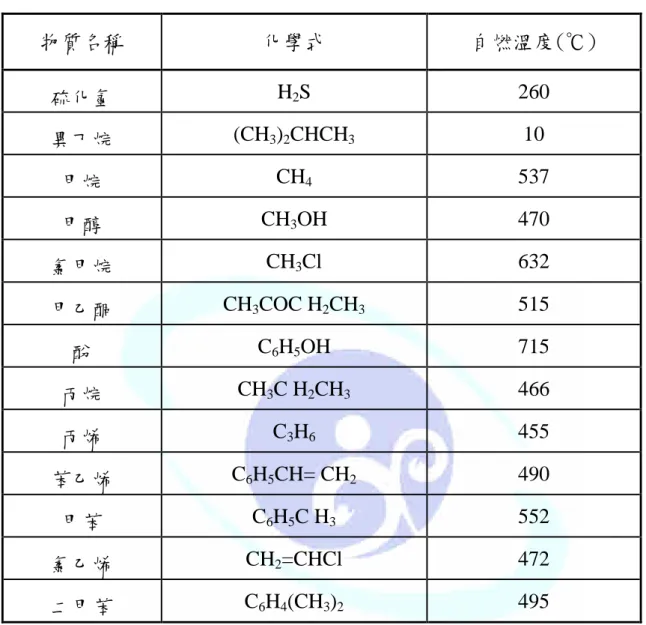
表 2-7-1 物質之自燃溫度 ...74
表 3-4-1 實驗參數 ...99
表 4-1-1 X-ray 粉末繞射、BET 與孔洞特性數據彙整表 ...108
表 4-1-2 各觸媒於各階段重量損失變化彙整表 ...131
表 4-4-1 各觸媒活化能及碰撞因子 ...176
附表 5-1 研製中孔洞金屬觸媒之材料藥品價格 ...211
附表 5-2 研製中孔洞金屬觸媒之成本...212
符號對照表
A:碰撞頻率因子 (1/sec)
A0:界面活性劑親水頭端之有效面積 (cm2)
CH4
AN :反應後甲烷之二氧化碳排放當量 ( kg of CO2e) a0:晶格參數
CH4
BN :反應前甲烷之二氧化碳排放當量 ( kg of CO2e) C:反應物之濃度 (mole/cm3)
Ci :反應物之濃度 (mole/cm3) Cin:反應物入口濃度 (ppm)
CH4
Cin :甲烷進流濃度 (ppm)
C
O:O2之濃度 (mole/cm3) Cout:反應物出口濃度 (ppm) c:常數d:晶面距離 (nm) dhkl:晶格間距
Ea:反應之活化能 (kcal/mole 或 KJ/mole)
F
A:A 成份莫耳流率 (mole/sec)0
F
A :A 成份於反應器入口的莫耳流率(mole/sec)GWP :甲烷溫室潛勢 (通常為 21-23,以甲烷 2008 溫室效應為二氧化
碳的 21 倍)
g:界面活性劑堆積參數
K:24.5 (L) (25℃,1 大氣壓下 1 莫耳氣體體積) k:反應速率常數 (1/sec)
k
i:觸媒表面之還原反應速率常數 (1/sec)k
Oi:觸媒表面之氧化反應速率常數 (1/sec) l:界面活性劑碳氫尾鏈長度 (cm)M:中孔洞觸媒克數 (g)
CH4
Mw :甲烷分子量 (g/mol)
Mη:每克觸媒溫室氣體潛勢削減量 (mg/g) m :反應次數 (order of reaction)
CH4
N
:甲烷之二氧化碳排放當量 ( kg of CO2e)NCO
2e:二氧化碳排放當量 ( kg of CO2e) n:常數n:反應次數 (order of reaction) O2 :氧量濃度 (%)
P:實驗溫度下之壓力 (Pa)
P0:實驗溫度下所吸附氣體之飽和蒸汽壓 (Pa) p:孔洞大小 (nm)
CH4
Qin :甲烷進流流量 (mL/min) Qη:去除量效益 (mg/min)
R:理想氣體常數 (1.987×10-3 kcal/ K.mole)
Rκ:曲率半徑,或稱 Kelvin 半徑 (對凸形表面為正值;對凹形表面為正 值)
T:絕對溫度 (K);攝氏溫度(℃) t:反應時間 (sec)
V:吸附氣體之總體積 (cm3) VL:被吸附物的液體莫耳體積 Vm:單層吸附之氣體體積 (cm3) VR:反應器(或觸媒床)體積 (cm3)
ν:界面活性劑碳氫尾鏈所佔之區域面積 (cm3) Wt:孔洞壁厚 (nm)
X
A:A 成份之轉化率 (%)α:氧化每莫耳 CH4所需理論 O2(mole/mole) γ:被吸附物的液體表面張力
i
:反應物之氧化速率 (mole/sec.cm3) :OOi 2之消耗速率(mole/sec.cm3)
r
A
:A 成份在反應器中的反應濃度 (mole/sec.cm3)
-
i :反應物之反應速率 (mole/sec.cm3) η:減量效益 (%)θ:特徵峰所在位置之角度 λ:X-ray 波長 (nm)
第一章 前言
1-1 研究緣起
自從十八世紀中葉工業革命後,隨著工業科技的發達與經濟迅速的成 長,為人類帶來生活上舒適與便利,因人類直接或間接使用燃料,造成溫 室氣體大量排放的情況下,全球暖化的危機日趨嚴重,造成氣候變的更加 極端,如同「明天過後」、「2012」電影般的情節在現實生活中上演,對人 類的生命財產帶來莫大的威脅。隨著「京都議定書」於 2012 年時效屆滿,
2009 年底召開的哥本哈根會議,全球暖化與國內外溫室效應議題備受關 注;而相關重大環境議題之訊息更是日益繁多,且散見於各資訊媒體、網 頁、電子報、期刊之中。經過許多科學家長期觀察與研究,逐漸證實人類 所造成的溫室氣體對地球的氣候變遷產生很大的影響。
近年來,對於甲烷所造成氣候的負面影響及潛勢,已逐漸受到重視,
成為溫室效應中必需特別注意的物種。氣候變化綱要公約及「京都議定書」
附件 A 中明白的指出所要管制的溫室氣體包含了二氧化碳(CO2)、甲烷 (CH4)、氧化亞氮(N2O)、氫氟碳化物(HFCs)、全氟化碳(PFCs)、六氟化硫 (SF6)等六類。工業革命前大氣中 CO2濃度為 280 ppm,目前大氣中 CO2 濃度已達 385 ppm,由於至今能源使用類型仍以化石燃料及燃煤為主,CO2 濃度仍會持續上升【劉毅弘等人,2009】。而甲烷對於全球暖化的影響,
大約占全部的四分之一到五分之一(溫室氣體約 18%),其中有四成來自 畜牧業,豬、牛等動物所排放的甲烷,比汽車、機車、飛機加起來(14%)
還要多。根據統計從工業革命至今,甲烷濃度暴增,大氣中甲烷的濃度已 經增為三倍以上【凱普勒等人,2007】。若地球持續暖化,在地球北極圈 的永凍土中,埋藏著遠古時代由腐爛植物所產生的數十億噸甲烷,這些甲 烷因氣候變暖會被釋放到大氣層中,更進一步加劇氣候變暖。甲烷為溫室 效應氣體之ㄧ,其溫室效應潛勢為 CO2的 21 倍【IPCC,2008】。甲烷等 溫室效應氣體並非空氣污染物,但是卻會影響全球的環境及氣候,而間接 影響人類的生存環境。若能將甲烷進一步的轉化成具有經濟效益的化學 品、合成氣或甲醇,進而提供清潔能源性,對溫室氣體減量將有顯著的貢 獻。若以 2007 年台灣飼養禽畜數,依動物的溫室氣體排放係數與每隻動 物在生命週期中每年所排放的氣體數估計,豬隻每年排放近 17,000 公噸 的甲烷,雞隻排泄物每年排放近 16,000 公噸的甲烷,牛隻每年排放近 12,000 公噸的甲烷【費亞拉等人,2009】。台灣畜牧大多屬於飼養及定居 圈牧,為降低所排放甲烷之溫室效應與再利用,亦將甲烷轉化之技術應用 於畜牧場等地方與工業界所產生的甲烷。因畜牧場所排放 CH4濃度不高約 數百 ppm 左右,而目前國內外許多研究學者,亦嘗試利用各種處理技術 來處理溫室氣體,如利用熱電漿(Thermal plasma)與非熱電漿(Non-Thermal Plasmas, NTPs)。熱電漿如電漿火炬(plasma torch)【鄭為允,2007】;非熱
電漿法包括為電子束法(Electron Beam)、電暈放電法(Corona Discharge)、
介電質放電法(Dielectric Barrier Discharge, DBD) 【游生任,2000】【鄭立 群,2005】、微波法(Microwave)、高週波電漿法(Radio Frequency, RF)等。
這些電漿技術亦會結合觸媒、奈米碳管等材料,進行溫室氣體處理【張敬 嚴,2008】【陳義昌,2008】。但這些處理方法皆伴隨頗多缺點,如微波法 及高週波電漿的操作較適用在低壓之條件,應用上受到很大的限制,也有 耗能高、二次污染產生等問題。而傳統的甲烷減量技術則有甲烷轉化成合 成氣、甲烷部分氧化反應(POM)、甲烷直接氧化反應(DOM)及甲烷偶合反 應(OCM),但上述的處理方法皆需要較高的反應壓力與反應溫度,因此本 研究乃探討常壓下,使用觸媒直接將低濃度甲烷部份氧化為甲醇之可行 性。
多孔性材料具有高比表面積與高孔隙率,受到許多研究學者的關注,
早期活性碳和沸石廣泛應用於空氣污染防制、光學材料、石化工業或其他 各領域中,扮演著重要的角色,但活性碳孔隙易受阻塞,而沸石孔徑小限 制大分子參與反應,1992 年美孚石油(Mobil oil)公司的研究人員,利用帶 負電荷的矽酸鹽作為矽源與陽離子型界面活性劑作為模板,成功研發出中 孔多孔性材料,稱為 Mobil composite of matter (MCM),此系列多孔材料 家族總稱 M41S。其中又以六角型結構的 MCM-41,具有高比表面積(>1000 m2/g)、高熱穩定性、高孔隙率、可調整孔洞大小( 2-50 nm )且孔徑具有一
致的規則性等優點。
由於傳統甲烷減量技術有其應用之限制,故甲烷轉化成甲醇之技術研 究,各界都在積極尋找最佳的處理方法及操作條件。為提升甲烷部份氧化 為甲醇之轉化率及最佳的操作條件,本研究乃利用高級氧化程序結合此材 料的特性,使甲烷在中孔洞材料具有較佳的質傳速率,進而提升吸脫附程 序之效率,將中孔洞觸媒進行改質(如添加各種金屬),並進行中孔洞觸媒 改質前後之特性分析。中孔洞觸媒含不同金屬時,藉由金屬之活性,降低 反應所需之能量,應用於甲烷礦化成二氧化碳,進而探討中孔洞觸媒將甲 烷礦化成二氧化碳的最佳操作條件。本研究乃探討甲烷礦化成二氧化碳之 最佳減量效益,另為實際應用設計參考,亦需建立中孔洞金屬觸媒對於甲 烷轉化成甲醇的模式。
1-2 研究目的
甲烷儲量大多位於交通不便之地理位置,若藉船隻或管路傳輸需要高 壓與冷藏,增加生產成本,若能將甲烷轉化為甲醇,可減少運輸及增加便 利性。由於甲醇是一種清潔可再生燃料,大部分是有用的能源,且需求量 大,可作為中間能源來源,特別在汽車、燃料電池、供暖、發電、化學製 品等等。本研究嘗試利用自行製備之中孔洞金屬觸媒 MCM-41 結合高級 氧化程序,降低反應所需之能量,並於甲烷轉化反應系統中,藉由中孔洞
觸媒具有高表面積、高孔隙率及其吸附等特性,並披覆不同金屬如:Fe、
Mn、Ni、Pt 等進行改質,可有效增加甲烷與觸媒接觸的機會,且結合臭 氧具有的強氧化特性,利用氫氧自由基降低破壞 C-H 鍵之鍵結所需之能 量,有效提升甲烷轉化成甲醇之轉化率及其選擇性,並對自行製備之中孔 洞金屬觸媒以 X-ray 粉末繞射儀、氮氣等溫吸附/脫附測量儀、掃描式電 子顯微鏡配備能量散佈光譜儀、穿透式電子顯微鏡、紫外-可見光光譜儀、
熱重分析儀等儀器,探討分析觸媒本身之物理及化學變化。
本研究亦探討在各種溫度、濃度、觸媒種類、空間流速及甲烷/臭氧 比率等條件下之轉化率及選擇性,尋求最佳的操作條件、最佳的轉化率及 選擇性、反應機制及其經濟效益之可行性,並建立最佳的動力模式,以 FID 分析儀 (Company thermo Environmental Instruments lnc., TVA-1000) 與氣相層析儀-火焰離子偵測器 (Gas Chromatography-Flame Ionization Detector, GC-FID) ,分析反應後甲烷濃度變化及反應後之氣體產物,如:
CH3OH 等,探討操作參數對甲烷轉化為甲醇轉化率之影響。本研究同時 評估溫室氣體排放潛勢降低之最佳操作條件與效益分析,同時進行甲烷部 份氧化成甲醇成本效益分析。
本研究主要目的如下:
1.探討各種中孔洞金屬觸媒特性對甲烷礦化成二氧化碳及轉化成甲醇之 影響。
2.研析各種中孔洞觸媒對甲烷礦化成二氧化碳之最佳操作條件及礦化效 率。
3.探求中孔洞金屬觸媒對於甲烷部分氧化成甲醇最佳操作條件及成本效 益之分析。
4.評估中孔洞金屬觸媒對於溫室氣體減量效益及成本效益。
第二章 文獻回顧
2-1 溫室效應之影響
2-1-1 溫室效應
地球表面的熱能主要來自太陽的短波輻射(約 0.2 –4μm),輻射波經大 氣吸收、反射,地表吸收剩餘的輻射。經地表土壤、水體、植物等吸收後 的能量,再以長波輻射(約 4 –100μm)釋出,因二氧化碳在波長大於15μm 以上的輻射波有絕佳的吸收率,而甲烷、氧化亞氮、氟氯碳化物等亦有類 似的特性。其中一部分被大氣對流層中的水氣及二氧化碳吸收,另一部分 在平流層被甲烷、氧化亞氮、氟氯碳化物等吸收,其餘則反射回太空。【黃 啟峰,2007】空氣中的溫室氣體會讓向外釋出的紅外線反射回到地球表 面,具有調節地球表面輻射冷卻的功能,使地球表面的溫度不會急劇變 動,同時使得全球全年平均大氣輻射能量的收支保持平衡,此現象稱「溫 室效應」,如圖 2-1-1 所示。然而工業革命後,人類活動製造出大量的溫室 氣體如表 2-1-1 所示【蔡伂俊,2006】,造成溫室氣體急遽增加,更多紅外 線輻射波被折返到地面上,加強「溫室效應」的作用,太陽的熱持續累積 在地球表面,造成大氣溫度逐漸上升。
資料來源: Agence France-Presse, http://www.afp.com//afpcom/fr, 2009
圖 2-1-1 溫室效應示意圖
表 2-1-1 人類活動產生溫室氣體
產生氣體 人類活動
二氧化碳(CO2) 石油、煤等石化燃料燃燒 甲烷(CH4)、氮氧化物(N2O) 農業活動
全氟碳化物(PFCs) 半導體及光電產業
六氟化硫(SF6) 半導體製程、高壓輸配電系統
氫氟碳化物(HFCs) 工業製程品
根 據 聯 合 國 政 府 間 氣 候 變 遷 委 員 會 (Intergovernmental Panel on Climate Change, IPCC)長期研究觀察,全球每年排放至少 224 億公噸的二 氧化碳進入大氣,而森林、海洋所能吸收的二氧化碳量約 35%,所以至少 有 45%左右的二氧化碳持續累積在大氣中,並以每年 0.5%持續增加當中。
氣候變化綱要公約及「京都議定書」附件 A 中明白的指出所要管制的溫 室氣體包含了二氧化碳(CO2)、甲烷(CH4)、氧化亞氮(N2O)、氫氟碳化物 (HFCs)、全氟化碳(PFCs)、六氟化硫(SF6)等六類,其溫室效應潛勢詳如表 2-1-2 所示【IPCC,2008】。而二氧化碳和甲烷排放量分別占總溫室氣體排 放量約 72%與 18%,如圖 2-1-2 所示【ESRL,2010】。
表 2-1-2 溫室氣體潛勢表
資料來源: IPCC, http://www.ipcc.ch/, 2008
資料來源:ESRL, http://www.esrl.noaa.gov/gmd/, 2010
圖 2-1-2 溫室氣體排放來源示意圖
自工業革命以來人類活動大量使用化石燃料,造成溫室氣體逐年增 加,從圖 2-1-3 可以發現大氣中二氧化碳濃度,由 340 ppm 上升至 385 ppm,甲烷濃度從 1600 ppb 上升至 1800 ppb,二氧化碳成長幅度尤其驚人,
在過去 100 多年來全球增溫日益明顯,全球地表平均溫度上升約 0.6℃,
如圖 2-1-4 所示,海平面將上升 10 至 25 公分【ESRL,2010】。但所有自
然的擾動因素,如:火山、太陽週期性變化等,都無法解釋目前快速的氣 候變化趨勢。1996 年 IPCC 報告指出,集合現有資料顯示,人為活動的確 已對全球氣候造成影響是不容置疑的。溫室氣體如何具體減量且有效控制 並妥善利用二氧化碳、甲烷等溫室效應氣體的排放,已成為各國急需努力 達成之目標。
資料來源: ESRL, http://www.esrl.noaa.gov/gmd/, 2010
圖 2-1-3 全球溫室氣體濃度趨勢圖
資料來源: ESRL, http://www.esrl.noaa.gov/gmd/, 2010
圖 2-1-4 全球平均溫度趨勢圖
2-1-2 溫室氣體相關國際公約
根據 IPCC 評估資料顯示,若將大氣中二氧化碳穩定在 450ppm,則 必需在 40 年內將人為的二氧化碳總排放量控制在 1990 年的排放水準。假 設大氣中二氧化碳含量增至工業革命前兩倍,全球平均溫度會上升約攝氏 2 ℃,海平面因此升高約 50 公分。但氣溫改變並非均勻分布,暴雨、旱 災、颱風等極端氣候可能更頻繁;而森林大火、病蟲害的流行及傳染性疾 病、農業生產周期破壞、海水上升改變動植物棲地、生態環境,甚至整個 社會結構都可能因而改變。因此,我們必須要立即採取行動,減少溫室效
應 氣 體 的 排 放 。「 氣 候 變 化 綱 要 公 約 」( United Nations Framework Convention on Climate Change, UNFCCC ) 的 締 約 國 召 開 許 多 次 大 會 (Conferences of the Parties, COP),會議均在討論如何將目前地球上之溫室 效應能做有效之管制。近年來,國際上相繼訂定溫室氣體減量之環保公約 大致如下所述:
一、保護地球氣候 43 屆聯合國大會決議
於 1988 年 3 月,會議內容為呼籲 IPCC 對防止溫室效應的對策 進行評估。
二、索非亞協定
於 1988 年 11 月由 16 個國家批准後共 25 國連署,主要內容在管 制氮氧化合物。
三、海牙宣言
1989 年 3 月,共 24 個參加國,主要是採取強硬手段來推行地球 溫室效應的防止對策,於會議中決定需成立具有決策力的國際性質權 威機構。
四、赫爾辛基宣言
1989 年 5 月,擬定防止地球溫室效應惡化的必要措施。
五、那德威克宣言
1989 年 9 月,共 68 個參加國,對於造成溫室效應氣體中二氧化 碳等濃度予以穩定化的觀念終得到共識,以及立即停止濫伐熱帶雨 林,並且在 IPCC 討論其具體目標。
六、里約宣言(The Framework Convention on Climate Change,FCCC) 1992 年 6 月在地球高峰會議中發展出「氣候變化綱要公約」,強 調因應氣候變遷是世界各國應負之責任,抑制溫室氣體之排放。
七、京都議定書(Kyoto Protocol)
於 1997 年 12 月日本京都舉辦的「氣候變化綱要公約」第三次締 約國大會中,簽署了一項具有法律約束力的「京都議定書」,以規範 工業國家未來溫室氣體減量目標及時程。該項協定包括:二氧化碳
(CO2)、甲烷(CH4)、氧化亞氮(N2O)、氫氟碳化物(HFCs)、全 氟碳化物(PFCs)、六氟化硫(SF6)為削減對象。前三種氣體以 1990 年作為基準年;後三種氣體以 1995 年作為排放基準年。目標年為 2008 年~2012 年間五年的平均值。減量目標如下表 2-1-3 所示【蔡伂俊,
2006】,所有被要求減量的國家平均削減 5.2 % ,但因國情不同而有 差別。
表 2-1-3 京都議定書各國減量目標表
國家 消減率(%)
歐盟 14 國與東歐
(保加利亞、捷克、羅馬尼亞、拉脫維亞等國)
8%
美國 7%
日本、加拿大、匈牙利、波蘭 6%
克羅埃西亞 5%
紐西蘭、俄羅斯、烏克蘭 0%
挪威 -1%
澳洲 -8%
冰島 -10%
平均 5.2%
發展中的國家 自動參加
八、聯合國氣候變遷綱要公約 13 屆締約國會議(UNFCCC-COP13)
2007 年 12 月 3 日至 13 日於峇里島召開 UNFCCC 第 13 次締約國大 會暨京都議定書第 3 次締約國會議(The 3rd Conference of Parties, CMP3) (COP13/CMP3),主要結論有:
1.各國同意成立由全球環境基金(GEF)管理的「調適基金」(Adaptation
Fund)。
2.是關注到森林與碳排放的關聯,致力「降低森林消退所導致的碳排放」
(REDD,Reducing Emissions from Deforestation and Degradation)。並提 出「峇里島藍圖」(Bali Roadmap)。而峇里島路線圖即:
(1) 森林:與會各國允諾以政治方法和實質誘因來保護森林。保存樹林 的計劃將是有具體目標的保護所有的樹種,避免樹木可能的 天生的傳染病害。
(2) 適應力:與會各國願意加強合作支持執行緊急措施以保護窮國免受 氣候變化衝擊。
(3) 技術轉讓:與會各國將考慮如何促使無污染技術從工業化國家快速 移轉到發展中國家。
八、哥本哈根協定(Copenhagen Accord)
2009 年 12 月 7 日至 18 日於丹麥哥本哈根召開 UNFCCC 第 15 次締 約國大會暨京都議定書第 5 次締約國會議(The 5th Conference of Parties, CMP5) (COP15/CMP5),受到全世界的關注,會議中主要討論「京都議定 書」屆滿後,全球對於未來溫室氣體減量目標及期程,但與 COP3 達成的 京都議定書不同的是,哥本哈根協議並無法律約束力之協議,會議中較有 共識的議題如下:
年全球排碳量必須比 1990 年減少 40%,但各國因其地理位置、未來溫 室氣體減量目標、時程及管制方式衝擊各國經濟發展利益等關係,缺乏 對減碳比例與時程的強制性及明確之具體共識,但須在 2010 年 1 月 31 日前各締約國應依會議結論中附表項目向公約秘書處提出具體作為包 括:
(1) 附 件 一 國 家 於 2020 年 之 量 化 減 量 目 標 (Qualified economy-wide emissions targets for 2020),同時基於「可量測、可報告與可查證 (Measurable, Reportable and Verifiable, MRV)」精神提供開發中國家協 助,以確保減量目標及財務協助須嚴格、健全及透明化。
(2) 非附件一國家「國家適當減緩行動(Nationally Appropriate Mitigation Actions, NAMAs)」,並無具體減量期程規範,如接受附件一國家支持 者,亦應符合締約國會議所決定之 MRV 要求。
2.成立「哥本哈根綠色氣候基金會」(Copenhagen Green Climate Fund),從 2010 年至 2012 年,每年提供 100 億元的基金,援助對象為減少伐林、
調適、清潔技術之專案,但協議中未訂出各國援助分攤的比例。
3.會議中未定 2013 年後工業化國家具體減量的目標,或明確定出 2020、
2050 年全球應執行之減量目標,最終達成「哥本哈根協定(Copenhagen Accord)」,協定各國自工業革命前算起,必須將全球升溫控制在攝氏 2℃
以內。
全球環境氣候異常相關議題,近年來逐漸受到世界各國的重視,但各 國在全球暖化的立場還是以本身的生存利益為主要考量,往往造成各國無 法達成共識,不過無法避免未來國際間仍會朝著綠色能源、節能減碳以及 抗全球暖化之方向前進。
2-1-3 能源危機
石油仍然是全球需求最多之能源,2006 年能源消耗中石油占總消耗 量 的 41.3% , 而 對 經 濟 合 作 暨 發 展 組 織 (Organization for Economic Cooperation and Development, OECD)國家而言,2006 年更達到 51.8%,加 上天然氣的 18.7%,OECD 國家有 7 成以上的最終能源消費仍來自於油 氣,現階段石油仍具有其難以替代性【陳芃,2009】。歷史上重要的能源 危機事件均與石油有關,且大多發生在中東地區的產油大國如【高景宜,
2007】:
一、以阿戰爭(1973-1974 年)
阿拉伯石油輸出國組織,為了報復支持以色列的西方國家,實施石油 禁運措施,並削減石油產量,此事件為第一次能源危機。
二、伊朗回教政變(1979-1980 年)
此事件並非石油禁運,而是產油大國伊朗政變導致中東情勢動盪,減 少原油產出,為第二次能源危機。
三、波灣戰爭(1990-1991 年)
伊拉克入侵科威特引爆波斯灣戰爭,造成中東地區政治情勢動盪不 安,對伊拉克實施禁運措施,國際原油供需受到影響。
四、烏俄天然氣之爭(2009 年)
俄國要出口至歐洲的天然氣於烏克蘭過境時出現爭端,引爆「斷氣」
事件,歐洲 17 國頓時陷入能源安全威脅。
因此石油的重要性可見一般,由於我國地理位置及環境的影響,我國 能源主要以煤炭及石油為主,大多仰賴進口占整體比例的 98.1%,自給能 源占 1.9%,其中包含煤炭所占比例,如下表 2-1-4 所示。石油的需求與日 俱增,大量使用石油終將會有用盡的一天,而高漲的油價卻深深的影響大 眾生活,能源如何有效地利用及新能源開發變得迫切重要,故需研擬邁向 永續發展及綠色、再生性能源之途。
表 2-1-4 台灣使用能源種類比例
能源種類 比例(%)
石油 51.3%
煤炭 31.9%
液化天然氣 7.6%
核能發電 7.3%
水力發電 1.5%
天然氣 0.4%
資料來源:楊顯整(2008)
2-2 甲烷特性及轉化機制
近年來,在全球暖化問題及石油即將耗盡的情況下,各國的研究學 者,為因應能源的需求不斷增加,致力於各種傳統和非傳統能源改善及尋 找替代能源來取代石化燃料。由於 CH4分子較石油或煤炭具有較低的 C:
H 比,可提供更大的能量作為分子釋放,故將 CH4轉換成有價值的中間產 物或產品,如 H2、合成氣(H2+CO)、C2H2、CH3OH 和 CH2O,以提高能 源轉換效率【Gondal et al., 2003】。一直以來受到各界廣泛地研究,由相關 文獻得到甲烷氧化完整的反應路徑大致如下【Verma, 2002】:
CH4→.CH3→CH3OH→.CH2OH →CH2O→.CHO→CO2+H2O
並利用此反應機制來模擬甲烷氧化反應探討操作參數之影響結果,並 提供未來研究方向。
2-2-1 甲烷基本特性
甲烷(Methane, CH4)為最簡易之碳氫化合物,化學性極為穩定,其化 學結構如圖 2-2-1 所示。無色、無臭、無味之氣體,比空氣輕,與硝酸、
硫酸、鹼及鹽類不起作用。沸點-162℃,凝固點-182.5℃,自燃溫度 537℃,
溶於酒精、乙醚、微溶於水。甲烷為溫室效應氣體之一,溫室效應潛勢為 二氧化碳的 21 倍,其物理化學特性詳細資料,如附件一為甲烷之物質安 全資料表【勞工安全衛生研究所,2008】。
C H
H
H
H
C H
H
H
H
圖 2-2-1 甲烷之化學結構圖
2-2-2 甲烷轉化機制
目前甲烷轉化成甲醇可以大致歸類為甲烷部分氧化反應、甲烷直接氧 化反應及甲烷氧化偶合反應三種方式:
一、甲烷部份氧化反應(partial oxidation of methane):
將甲烷轉化為甲醇常見的技術為兩階段的反應,第一階段是將甲烷以 水蒸氣重組(steam reforming of methane, SRM)或部分氧化的方式,而得合 成氣(synthesis gas),如(2-1)至(2-4)反應式。第二階段當 H2/CO=2 時,再利 用金屬觸媒如 Zn、Cu、Ni、Pt、Rh 等,將合成氣轉化成甲醇,如(2-4)反 應式,其操作條件因製程的不同而有所差異,其操作溫度範圍為 240℃至 500℃,操作壓力範圍為 50 atm 至 300 atm,且合成氣純度要高,必需不 含硫、氯等物質。
CH4(g)+H2O(g) CO(g)+3H2(g) -△H○298 = -206 kJ/mol (2-1) CH4(g)+1/2O2 (g) CO(g)+2H2(g) -△H○298 = 36 kJ/mol (2-2)
CH4(g)+CO2 (g) 2CO(g)+2H2(g) △H○298 = 247 kJ/mol (2-3)
CO(g)+2H2 (g) CH3OH(l) (2-4)
1.無觸媒
Zhang 等人(2007)以氣相共沈澱法製備 Mo-V-Cr-Bi-P 觸媒結合特殊設 計的石英反應器,研究在溫度 380-500℃及壓力 1.0-5.0MPa 操作條件下,
氣相部分氧化甲烷成甲醇實驗結果,得到甲烷氧化成甲醇之效率,在操作 溫度 430-470℃時,壓力 5.0 MPa 及 CH4/O2/N2 = 100 / 10 / 10 (mL/min),
得到甲烷最佳之轉化率為 13%,甲醇最佳的選擇性則達到 60%。
2.ZSM-5 觸媒
Kudo 等人(1997)使用 ZSM-5 觸媒在低壓下藉由氧氣氧化甲烷,呈現 出 H-ZSM-5 觸媒 (SiO2/A12O3= 283)較其他商業二氧化矽,具有較高的活 性;但其甲烷與甲醇最佳的轉化率及選擇性,分別不超過 7%與 15%。Ono 等人(2000)以 H-ZSM-5 和 Na-ZSM-5 觸媒於低壓下藉由晶格氧18O 部分氧 化甲烷與乙烷,實驗結果以 Na-ZSM-5 觸媒具有較高的選擇性成為甲醇,
而過量的 Na 反而沒有或很少選擇性成為甲醇,且氧的濃度及觸媒表面的 酸點決定氧化的速率。
3.金屬觸媒
Sokolovskii 等人(1998)以硝酸鈷、硝酸錳、硝酸鋁以共沈澱法合成,
xCoO.(1-x)MgO.Al2O3觸媒分別進行甲烷氧化成合成氣之研究,甲烷氧 化成合成氣中分別以不同觸媒成分及使用甲烷氧氣混合氣與甲烷空氣混 合氣,在相同操作條件下,溫度 850℃觸媒填充量 1.0 g 、氧氣流量 90 mL/min 與甲烷流量 180mL/min,呈現出鈷錳鋁觸媒有顯著地將甲烷轉化 成合成氣,甲烷轉化率及一氧化碳的選擇性都在 95%及 99%,H2/CO 比分
別為 2.1 及 2.0,若能藉由特殊吸附劑或水來萃取甲醇,則可以提升較高 的甲醇產率。Teng 等人(2000)於常壓下以 CH4-O2-NO 進料氣體藉由石英 反應器填充觸媒將甲烷氧化成甲醇,探討有無 NO 的情況下其反應特性,
研究結果呈現出在 693℃無 NO 的情況下,甲烷轉化率僅僅只有 1%,添 加 NO 氣體在 CH4-O2-NO 氣體中的 NOx 形成.CH3和.CH3O,呈現出甲 烷轉化率及選擇性成 C1 含氧化物顯著地增加,溫度 535℃與 NO 濃度 0.5%
的條件下,甲烷轉化率達 10%選擇性成為甲醇和甲醛分別為 22%與 24%,
0.35-0.55%的低濃度 NO 有利於甲醇的形成,而低 CH4/O2比約 2-3 有利於 甲醇的高選擇性。
Michalkiecz (2004)利用披覆不同 Si/Fe 比的 Fe-ZSM-5 觸媒以及 Fe-Na-ZSM-5 觸媒填充在內徑 11 mm 的石英反應器,以分子氧作為氧化 劑部分氧化甲烷,反應在 1 大氣壓、溫度 350-360℃,反應時間從 0.5 至 2.5 秒,實驗結果發現 Fe-ZSM-5 觸媒 Si/Fe 比為 22 時,得到最高的甲烷 轉化率約 31.51%,而 Fe-Na-ZSM-5 觸媒 Si/Fe 比為 45 時,得到最高的甲 醇選擇性約 74%,且溫度增加及反應時間長時,則甲烷轉化成甲醇增加,
同時也降低甲烷氧化成甲醇的選擇性。Ono 等人(2008)利用含鋁的二氧化 矽觸媒填充於石英反應器內,藉由分子氧在常壓溫度 650℃流量 28 mL/min 反應時間 5.5 秒的操作條件下,甲醇的選擇性 3.5%。
4.非熱電漿
Nozaki 等人(2004)使用微型非熱電漿反應器,利用內部介質的絕緣電 極,產生大量絲狀的微放電,在 O2/CH4比為 0.5、反應時間 0.28 秒、流量 10 mL/min 及常溫下,得到最佳的甲烷轉化率及甲醇產率分別為 45%及 17%。Indarto 等人(2006)以 Sol-gel 法製備 Fe/Hf/YSZ 觸媒結合介質放電電 漿(DBD),在總流量 30mL/min、CH4:O2=4:1、功率 80W 的相同操作條件 下,使用 Fe/Hf/YSZ 觸媒較未放置觸媒的情況下,甲烷轉化率及甲醇產率 分別從 25.8%提升到 30.8%,4.5%提升到 6.6%,顯示出觸媒具有活化的作 用。
Chen 等人(2009)以含浸法製備 Pt、Fe2O3、CeO2觸媒結合介質放電反 應器所組裝的電漿系統,探討不同觸媒、放電功率、放電間距、總流量及 CH4/Air 進料比對甲烷轉化與甲醇選擇性的影響,得到輸入功率減少有利 於甲烷轉化及甲醇的生產能源效益;而較高的放電頻率約 8kHz,可以造 成大量的微放電,產生更多的氫氧自由基,進而提升甲烷轉化率和甲醇選 擇性分別達到 29%及 2.4%;放電間距增加降低了電場強度導致甲烷轉化 率及甲醇產率呈現減少趨勢。由於流量少、停留時間長,導致過度氧化,
而流量大於 300 mL/min 甲醇產率減少,故最符合效益的流量為 300 mL/min。另外,當 CH4/Air 進料比較低,會造成甲醇進一步氧化成 CO 和 CO2,而高 CH4/Air 進料比則沒有足夠的氧原子與 C-H 鍵反應,因此實驗 結果最佳的進料比為 0.5。
二、甲烷直接氧化反應(partial oxidation of methane):
甲烷在含有氧氣的操作條件下,以一階段的方式直接將甲烷轉化,如 (2-5)反應式。Lodeng 等人(1995)針對過去研究 CH4部分氧化生成 CH3OH 之實驗及理論做探討,發現壓力介於 40×105- 60×105 Pa,溫度介於 723 - 823K,CH4中 O2的濃度約為 2.6 - 4.4%,但 CH4得於較低的轉化率時(低 於 10%),才能得到較高的 CH3OH 產率,約 50 - 65%。
CH4(g) + 1/2O2(g) CH3OH2(l) -△H○298 = 126 kJ/mol (2-5)
Robert 等人(1997)使用 CuCl16Pc 與 FeCl16Pc 複合物合成的沸石於 Parr 反應器中,利用分子氧作為氧化劑,於常溫下使用 CuCl16Pc 與 FeCl16Pc 觸媒,其最佳的甲烷轉化率分別為 3.9%及 4.9%,而甲醇的選擇性分別為 53.5%及 52.6%。
Taylor 等人(2000) 研究利用可見光、水和氧化鎢半導體光觸媒於溫和 的條件下,藉由一個電子轉移分子產生氫氧自由基的一連串的反應機制,
以氫氧自由基與甲烷反應產生甲基自由基,將甲烷轉化為甲醇。實驗結果 顯示光催化反應下,每克觸媒每小時在穩定的模式下產生 1.7g 的甲醇,
而每克觸媒每小時加入雙氧水時產生 43g 的甲醇。
Gang 等人(2000)於高壓釜反應器內填充硫酸汞觸媒,操作溫度 150 - 200℃及壓力 40 - 100 bar,藉由硫酸汞催化,將中間產物甲基雙硫酸
(CH3OSO3H),水解成甲醇,其反應式如(2-6)。當反應壓力達到平衡時,
壓力損失與觸媒用量無關;在較高的反應溫度與壓力下,導致更高的反應 速度,硫酸汞溶解度在反應達到平衡時,硫酸汞增加停止,可非常有效地 將甲烷轉化成甲醇。
CH4+ 2H2SO4 CH3OSO3H + 2H2O + SO2
CH3OSO3H + H2O CH3OH + H2SO4
(2-6)
Takemoto 等人(2002)製備不同重量百分比的 Cu-ZnO/SiO2 觸媒於 CH4-O2-NO 中,分別探討不同溫度(150-350℃)、空間流速(10000-60000 SV/h-1),以及 NO 濃度(0-2%),可以發現到甲醇選擇性不超過 30%。
Okazaki 等人(2002)研究藉由非平衡電漿化學反應於常壓下,利用新 研發出的超短脈衝介質阻擋放電內的一層極薄的玻璃管反應器及結合以 高效率能源再生系統,將甲烷直接轉化成甲醇與水蒸氣混合物。研究結果 得到甲醇產率達到 1%,水氣含量在 50%,而當 CH4:H2O = 3:1 的情況下,
輸入能量的增加超過 20 J/cm3,甲醇產量顯示出飽和的趨勢與,飽和值約 為 0.4%。在最佳水汽含量約 50%,甲醇產量和選擇性分別高達 0.8%和 7.5%。若能添加稀有氣體如氬或氪,可提高甲醇等產物的產量。
Gondal 等人(2003)使用 WO3 光觸媒與石英反應器將甲烷轉化成甲 醇,以不同的實驗參數,如觸媒濃度(0.05 - 0.5 g)、激光功率(0.5 - 3.5W)、
激光照射時間(20 - 140 min),紫外光 185 nm 及可見光 514 nm、H2O2濃度
(0 - 2 mL)得到最佳的操作條件為,反應時間 80min、觸媒量 0.3 克、激光 功率 1.0W、H2O2濃度 2 mL,可以得到較好的甲烷轉化率及甲醇選擇性。
隔年 Gondal 等人(2004) 亦使用 WO3、TiO2 和 NiO 半導體光觸媒,
光催化活性將甲烷轉化成甲醇,研究於常溫下以 UV 光波長 355 nm 照射 下,不同觸媒克數及激光功率的情況下,研究發現 WO3、TiO2 和 NiO 光 觸媒,轉化率最高分別 29%,21%和 20%。
Fajardo 等人(2008)以 Sol-gel 法製備 Fe 觸媒,將甲烷轉成甲醛之研究 中,亦有探討操作溫度分別在 400-750℃,實驗結果得知以 0.5%的 Fe 觸 媒在溫度 400℃,甲烷轉化率為 0.2%,甲醇選擇性高達 92.8%。
Benlounes 等人(2008)利用 PMo11V、PMO11Fe、SiMo11Fe 觸媒在常壓 下藉由 O2與 N2O 作為氧化劑及操作溫度在 700 - 750℃之間發現,利用 N2O 作為氧化劑,SiMo11Fe 觸媒甲烷轉化率最高達 13%,甲醇的選擇性為 21.08%,PMO11Fe 觸媒甲烷轉化率最高達 2%,甲醇的選擇性為 31.34%;
而以 O2作為氧化劑,SiMo11Fe 觸媒甲烷轉化率最高達 32%,甲醇的選擇 性為 7.85%,PMO11Fe 觸媒甲烷轉化率最高達 4%,甲醇的選擇性為 23.68%。
Khokhar 等人(2009)藉由分子氧與釕複合物觸媒,研究總壓力在 10-15 atm 與 30℃的溫度下,進行甲烷直接轉化成甲醇之測試,研究結果得知總 壓力在 15 atm (甲烷分壓 12.5 atm 與氧氣分壓 2.5atm)、溫度 30℃與 CH4/O2
比為 5 的情況下,甲醇的選擇性高達 100%。
三、甲烷氧化偶合反應(oxidation coupling of methane):
將甲烷與氧氣藉由觸媒氧化反應形成較長碳數的烴類,如:乙烷 (C2H6)、乙烯(C2H4) 反應如圖 2-2-2 所示。Keller 和 Bhasin 等人(1982)研 究指出,大量的文獻顯示出過去 20 多年間。主要的問題為氧化耦合的活 性點在耦合催化亦活化 C2H6和 C2H4中 C-H 鍵,形成 CO 或 CO2。C2產物 單一產率通常限制在 25 %左右,選擇性約在 80 %。
圖 2-2-2 甲烷氧化偶合反應之示意圖
汽油-醇類的合成品已被許多國家所應用,故將甲烷轉換成甲醇為一 值得研究的主題。
2-3 臭氧基本特性及各種高級氧化程序
臭氧主要存在於地球的臭氧層中,西元 1785 年 Van Marum,利用高 壓放電設備通入空氣,意外產生特殊味道的氣體,直至西元 1840 年 Schonbein 將此氣體,以希臘字的“Ozein”,其涵義為“新鮮空氣”之意命名 為臭氧(Ozone) 【溫添進,1994】。其臭氧產生原理即為利用氧氣通過高 壓電管,使氧分子激發形成氧原子,氧原子再與氧分子結合形成臭氧分 子,臭氧為氧氣的同素異形體,分子量為 48,分子鍵長 1.278 Ǻ ,鍵腳 116.49,偶極矩為 0.49 ~ 0.58debye ,如圖 2-3-1 臭氧結構圖,25℃具有 34.4kcal/mol 的熱能。臭氧具有很強的氧化能力並具有強烈的腐蝕特性,
濃度增加顏色轉為淡藍色且具有爆炸性之氣體【林永璋,2003】。其物理 化學特性詳細資料,如附件 1-甲烷物質安全資料表。
O
O O
O
O O
圖 2-3-1 臭氧之結構圖
高級氧化程序(Advanced oxidation processes, 簡稱 AOPs)之定義為進 行氧化反應過程中,其能直接或間接產生自由基等活性中間物,由於氫氧 自由基(·OH 或羥基自由基)之標準還原電位為 2.33V,因其具有非常高 之氧化力,藉以氧化污染物或中間產物的程序;而常見的高級氧化程序包 含 H2O2/ O3、UV/ H2O2、UV/O3/ H2O2、Fe2+/ H2O2(Fenton 法)及 UV/TiO2, 並簡述如下:
一、H2O2/ O3
以臭氧與過氧化氫相互結合產生的化學反應,如(2-7)反應式:
H2O2+ 2O3 2·OH + 3O2 (2-7)
藉由上述反應生成高活性的氫氧自由基,H2O2/ O3程序中,H2O2/ O3
的比率影響氧化反應之速率。
二、UV/ H2O2
過氧化氫為強氧化劑,於常溫下為無色之液體,安定程度隨外在環境 如:溫度、壓力、濃度等而改變。在紫外光照射下激發,產生氫氧自由基,
其反應式,如(2-8)反應式:
H2O2
hν
2·OH (2-8)三、UV/O3/ H2O2
臭氧可吸收 260 nm 之紫外光,催化臭氧產生更多的氫氧自由基,並
能激發水中物形成激發態,藉由強氧化力與非選擇性來加速氧化反應速率
【吳致誠,2001】。
四、Fe2+/ H2O2
以亞鐵離子作為催化劑及過氧化氫作為氧化劑,使兩者之間產生劇烈 反應,進而產生大量的氫氧自由基,氧化難以分解之有機物,由大分子分 解成小分子,且破壞發色團之離子鍵結。反應後,亞鐵離子被氧化成三價 鐵離子,產生混凝沈澱來達到去除有機物之效果。
五、UV/TiO2
利用二氧化鈦(TiO2)於紫外光的照射下,吸收大於或等於能帶隙(Band gap)能量的光子後,形成電子/電洞對,進而參予氧化還原反應,產生氫氧 自由基【吳致誠,2001】。
2-4 多孔性材料之發展
孔洞材料分類,主要依據國際純粹與應用化學聯合會 (International Union Pure and Applied Chemistry;簡稱 IUPAC)所定義的標準,將孔洞材 料 依 其 孔 洞 大 小 分 為 三 類 : 孔 洞 直 徑 小 於 2 nm 的 孔 洞 稱 為 微 孔 洞 (micropore);孔洞直徑介於 2-50nm 的孔洞稱為中孔洞(mesoporous);孔洞 直徑大於 50 nm 的孔洞稱為巨孔洞(macropore),如表 2-4-1 所示:
表 2-4-1 IUPAC 孔洞材料分類
孔洞類型 孔洞直徑 範例
巨孔洞 (macroporous) >50 nm zeolite 中孔洞 (mesoporous) 2-50 nm M41S 微孔洞 (microporous) <2 nm glasses
最早 1932 年 McBain 提出「分子篩」一詞,主要能在分子大小的程 度去篩選物質的多孔性材料。到 1960 年矽鋁酸鹽的合成材料-沸石,大量 地應用於石化工業上的催化反應,如異構化、加氫、脫氫、裂解等催化反 應,吸引各領域的研究學者大量投入研究,在合成沸石的過程中,對合成 條件加以控制,沸石組成結構更加多樣化。工業上常用的沸石,依其矽、
鋁含量可分成三類:低矽含量(即 Si/Al 原子數比在 1~1.5 之間),如 A 型 及 X 型沸石,多用於離子交換;中等矽含量(即 Si/Al 比在 1.5~5.0 之間),
如 Y 型沸石,用於石油煉製及石化工業的觸媒作用。高矽含量(即 Si/Al 比大於 5),如 ZSM-5 沸石,用於煉油工業,彙整如表 2-4-2 所示。一般而 言,沸石的熱穩定性及酸性強度因矽含量增加而增高,但是離子交換能力 及酸性則隨矽含量增加而減少【黃玄昇,2003】。
表 2-4-2 沸石種類及性質
沸石種類 孔洞大小(Å) 矽鋁比 沸石中之陽離子
A 4.0 1.0 Ca、Na、K
X 7.4 1-1.5 Na
Y 7.4 1.5-3 Na
Ferrierite 5.5x4.8 5-10 H Mordenite 6.0x7.0 5-10 Na、H
Silicalite 5.5 ∞ H
ZSM-5 5.5 10-500 H
但沸石平均孔徑小,在較大分子結構上,應用處理往往受到限制,直 到近期 1992 年美孚石油(Mobil oil)公司的研究人員,利用帶正電荷四級銨 鹽界面活性劑作為模板與帶負電荷的矽酸鹽作為矽源結合,成功研發出中 孔多孔性材料,稱為 Mobil composite of matter (MCM),依孔洞結構的不 同 分 為 六 角 形 結 構 (hexagonal) 、 立 方 體 結 構 (cubic) 結 構 及 層 狀 結 構 (lamellar),此系列多孔材料家族總稱 M41S,如圖 2-4-1 所示【鄭森源,
2005】。
(a) 六角形結構:MCM-41 (b) 立方體結構:MCM-48 (C) 層狀結構:MCM-50 (a) 六角形結構:MCM-41 (b) 立方體結構:MCM-48 (C) 層狀結構:MCM-50
圖 2-4-1 多孔性材料 M41S 家族結構圖
而 Dapurkar 等人(2001) 亦利用 XRD 呈現出該家族材料之繞射峰之 分佈,如圖 2-4-2 所示。層狀結構(MCM-50)則因結構較不穩定,實際應用 上較無利用價值,也因此六角形結構(MCM-41)廣泛地應用於催化反應、
化學分離、氣體儲存及生物醫學方面等領域【羅佐財,2008】【吳思翰,
2008】,關於中孔洞二氧化矽的研究文獻過去 10 年之間也大幅的增加,如 圖 2-4-3 所示【Berggren et al., 2005】。
Octamer
MCM-50
MCM-48
MCM-41
Disordered MCM-41
Octamer
MCM-50
MCM-48
MCM-41
Disordered MCM-41
資料來源:Dapurkar et al, (2001)
圖 2-4-2 多孔性材料 M41S 家族 X-ray 特性峰示意圖
資 料來源:Berggren et al., 2005
圖 2-4-3 中孔洞二氧化矽歷年研究文獻數量
1992 年以後仍有許多研究者,嘗試改變不同合成條件,如界面活性 劑濃度、種類、碳氫尾鏈長度、合成期間 pH 值、鍛燒溫度與合成方法,
又發展出更多中孔洞多孔性材料,如 HMS、MSU、SBA 等,如表 2-4-4 及圖 2-4-4 所示分別概略彙整歷年發展過程、孔徑大小與合成條件【王書 駿,2005】、【洪錦德,2009】。
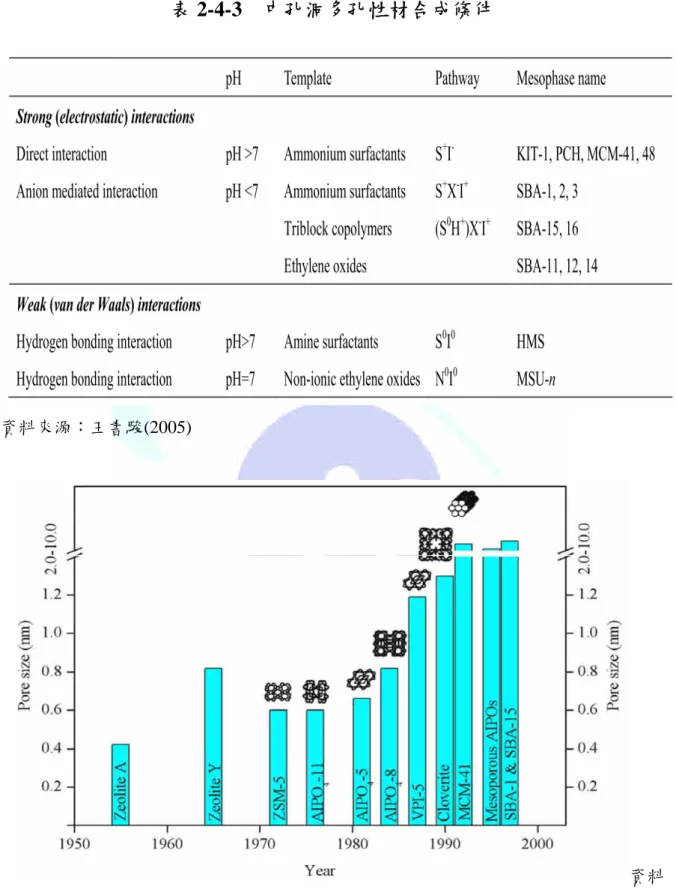
表 2-4-3 中孔洞多孔性材合成條件
資料來源:王書駿(2005)
資料 來源:洪錦德(2009)
圖 2-4-4 歷年多孔性材料發展過程
2-5 MCM-41 製備方法
在過去的研究中,其合成中孔洞材料 MCM-41 製備的方法主要有水 熱合成法與溶膠-凝膠法(亦稱 Sol-gel 法),隨著材料廣泛地應用及科技的 進步,研究人員陸陸續續地發展出更新穎的合成製備方法,其他的合成方 法如含浸法、室溫合成法、後合成法、微波合成法、氣膠法等,並將一些 常見之製備合成方法彙整如表 2-5-1,並概略分述如下:
一、溶膠-凝膠法(亦稱 Sol-gel 法)
溶膠(sol)係指粒徑在 1~100 nm 間之膠體顆粒,粒子之間的作用力來 自 於 凡 得 瓦 耳 力 (Van der Waals force) 及 粒 子 表 面 電 荷 作 用 (Surface charges),並以布朗運動(Brownian motion)的形式均勻分散於液體中;而 凝膠(gel)則為一網狀交鏈結構物,其平均分子鏈長度超過數 nm,而孔洞 大小平均約在數微米左右。將分散之膠體顆粒加以交鏈化或金屬前驅物經 水解(hydrolysis)、聚縮合(polycondensation)而得網狀結構物。亦即將碳氫 烷鏈的界面活性劑作為有機模版與矽氧化物作為矽源,適當比例的混合溶 液,於特定的溫度下攪拌、陳化反應數小時,在大於臨界微胞濃度的條件 下,形成結晶結構,最後將產生凝膠狀的沈澱物,再經由過濾、清洗、烘 乾、鍛燒等程序。Indarto 等人(2006)利用 Sol-gel 法合成 Fe/Hf/YSZ 觸媒 結合介質放電電漿處理甲烷,甲烷轉化率及甲醇產率分別從 25.8%提升到 30.8%,4.5%提升到 6.6%,顯示出觸媒具有活化的作用。
二、水熱法
其原理與溶膠-凝膠法大致相同,而水熱法則是須在壓力釜進行合成 反應。Choi et al., (2006)以不同二氧化矽作為矽源,製備 Fe-MCM-41,以 水熱法在 150℃加熱 7 天,再藉由去離子水洗滌、鍛燒去除有機模板,並 將材料運用於處理污染物酚,而 Vilas et al, (2009)以水熱法成功地合成含 有鉑族金屬的 MCM-41,並將合成的材料藉由 X-ray 繞射儀、穿透式電子 顯微鏡進行特性分析,證明水熱合成法具有良好的結構及純度,成功應用 於還原 NO 氣體。
三、室溫合成法
將烷基類有機模板與矽氧化物以適當比例混合攪拌,於室溫下陳化反 應數小時形成結晶結構,並將產物經由過濾、清洗、乾燥、鍛燒等程序。
Voegtlin et al., (1997)曾以 CTMABr 溶解在 NaOH 溶液中,產生的溶液再 添加入到矽酸鈉溶液中,莫耳組成為 SiO2: Na2O: CTMABr: H2O = 1: 0.5:
0.215: 125,混合攪拌後,調整 pH 為 11。緩慢攪拌 1 小時後,形成沈澱物,
藉由布氏漏斗過濾,以洗滌及在 37℃溫度下乾燥整夜。Kamal (2007) 於 室溫下利用非水熱法直接合成改質 Ce-MCM-41,且所有的製備過程控制 在 22℃±1℃。
四、初濕含浸法
將製備完成的觸媒擔體以適當的溶劑,緩慢滴入粉末擔體,使溶劑進 入孔洞中,直至粉末擔體成黏土狀,即達初濕點。再將金屬加入已達初濕 點溶劑後,緩緩滴入黏土狀的粉末擔體,並將產物經由乾燥、鍛燒程序,
以研製金屬改質 MCM-41。Vetrivel et al., (2005)即利用含浸法將氧化鈷及 氧化錳含浸在 MCM-41 及 Al-MCM-41 應用於氧化氣相異丙苯。
五、後合成法
將其他已合成中孔洞沸石作為矽源,經由二次水熱法合成,使其結構 形態轉變成 MCM-41。Chen et al., (1999)利用後合成法合成 Al-MCM-41,
實驗結果較水熱法所研製材料,具有較好的材料熱穩定性、酸度與結構。
六、微波法
傳統的觸媒製備方式通常是利用化學還原金屬前驅物,金屬還原的程 序需要花費數個小時,且不易控制觸媒顆粒大小,而顆粒大小亦影響金屬 前驅物的還原速率,故在製備程序中以微波輻射加熱法,避免觸媒顆粒於 高溫產生聚集,均勻加熱促進金屬前驅物的還原與加速合成,使結晶時間 縮短。Jiang et. al., (2008)利用當時最新穎的微波法,使用十六烷基三甲基 溴化銨作為模板,製備不同比例的 Co(Ni 或 Cu)-MCM-41 觸媒,成功地 製備出比表面積超過 1100 m2/g,且具有規則性的 Co(Ni 或 Cu)-MCM-41
觸媒。
七、氣膠法
利用氣膠噴霧方式將反應前驅物溶液形成氣膠狀霧滴,因溶液中有揮 發性有機物乙醇,亦使霧滴中水份揮發,霧滴中界面活性劑超過臨界微胞 濃度,產生界面自發性之聚合,透過非共價交互作用之材料自發性組織化 過程,如弱引力的氫鍵作用力、強引力的庫倫靜電力或 π-π 交互作用 等方式,不需要透過任何外力即可進行反應之程序,短時間即可完成晶體 結構之成長,再藉由鍛燒的方式移除有機模板【洪錦德,2009】。而洪錦 德(2009)亦利用氣膠合成法製備之中孔洞材料處理揮發性有機物,並應用 於其他空氣污染防制方面。
表 2-5-1 不同製備中孔洞觸媒方法之優缺點
製備方法 優點 缺點
溶膠凝膠法
1.常溫下製備。
2.所需成本較低。
3.粉末純度高,粒徑組成 均勻。
4.孔隙分布較窄。
1.前驅物成本較高。
2.前驅物易與空氣中的水氣 反應。
表 2-5-1 不同製備中孔洞觸媒方法之優缺點(續)
製備方法 優點 缺點
水熱合成法
1.團聚少,純度高。
2.粒徑分佈窄,易於商 業化。
3.晶化時間長、高結晶 溫度
1. 需 裝 高 壓 裝 置 危 險 性 高。
室溫合成法 1.常溫下製備。 1.結晶時間長。
初濕含浸法
1.易製備。 1. 無 法 控 制 金 屬 均 勻 分 佈。
2.易使金屬集結在一起形 成大顆粒。
後合成法 1.材料均勻性高 1.過程複雜。
微波法
1.加熱系統具均勻溫 度。
2.選擇性加熱且無滯 留效應。
3.結晶化時間短。
1.成本較高。
氣膠法
1.合成時間短。 1. 新 穎 技 術 尚 未 發 展 成 熟,其製備條件參數、
表面孔洞樣式變化相關 等尚待研究。