國立臺東大學 生命科學系 Department of Life Science National Taitung University
碩士論文 Master Thesis
指導教授:林志輝 博士 Advisor:Chih-Hui Lin Ph.D.
綠島朝日溫泉潮間帶微生物群落調查
Investigation of intertidal microbial communities of JhaoRih hot-spring in Green Island
研究生:戴才芸 撰
Graduate student:Tsai-Yun Tai
中華民國 104 年 7 月
July 2015
謝誌
i
中文摘要
潮間帶溫泉具有高溫、高鹽與環境快速變化等特性,了解在此環境下所形成 的細菌群落菌相與組成差異有助於進一步闡釋微生物在生態中的重要性。綠島朝 日溫泉為地球上少有的潮間帶溫泉環境,本研究針對綠島朝日溫泉潮間帶細菌群 落進行研究,以了解細菌群落在快速環境變化下的動態。本研究進行一年度的四 季樣區探勘、水溫、水位、鹽度與 pH 值記錄、溫度循環細菌篩選分析、變性梯 度膠體電泳 (
denaturing gradient gel electrophoresis,
DGGE) 及總體基因體學 (metagenomic) 分析。DGGE 分析的結果顯示,春季水溫最低時細菌多樣性最高,而在秋季水溫恆定高溫時多樣性最低。同時夏季的變性梯度膠體電泳圖譜多樣性 指數與稀釋性曲線也顯示,恆定的高溫環境會使得少數物種累積生長優勢,使得 細菌群落的多樣性下降。總體基因體學分析結果發現本研究中的E、K 與 C 三個 樣區皆以 Proteobacteria、Cyanobacteria、Chloroflexi 及 Bacteroidetes 的菌種為 主,其中以 Cyanobacteria 最多,分別佔 81.1%、99.3% 與 97.5%。多樣性指數 分析的結果顯示高溫或溫泉存在會降低微生物群落的多樣性 (有潮汐無溫泉 (溫 度較低) > 有潮汐有溫泉 > 無潮汐有溫泉 (溫度較高),和 DGGE 分析結果符 合。典型相關分析 (canonical correlation analysis, CCA) 顯示在環境因素中,最高 溫與最低溫明顯影響優勢菌群的分布。根據環境因素、細菌篩選、變性梯度膠體 電泳圖譜分析與總體基因體學分析結果得知,綠島朝日溫泉潮間帶區域的細菌群 落 結 構 與 主 要 和 溫 度 ( 溫 泉 ) 有 相 關 , 溫 泉 所 帶 有 的 礦 物 質 不 但 可 以 促 進 Cyanobacteria 的 生 長 , 當 環 境 因 子 劇 烈 變 動 時 , 具 有 高 度 適 應 逆 境 能 力 的 Cyanobacteria 族群更成為潮間帶溫泉微生物群落中的最重要物種。由於本研究中 溫度循環培養僅培養異營微生物,真正的多數族群 Cyanobacteria 無法生長,以 致於無法反映出主要的耐溫度逆境族群。因此在未來的研究中,建議將培養分離 Cyanobacteria 或是其他的光合作用微生物列為必須的研究方向。
關鍵字:綠島、溫泉、變性梯度膠體電泳、總體基因體學
ii
英文摘要
Intertidal hot springs with high-temperature, high salt and rapidly changing environment and other characteristics, understand the bacterial communities of bacteria formed by the phase difference helps to further explain the composition of microorganisms in environmental and ecological importance in this environment. In this study JhaoRih hot-spring is among the uncommon earth intertidal hot springs environment, was conducted studies on investigation of intertidal microbial communities of JhaoRih hot-spring in Green island, in order to the bacterial community dynamics in a rapidly changing environment. The study conducted a year sample area available, water temperature, water level, salinity and pH value recorded temperature cycling bacterial screening analysis, denaturing gradient gel electrophoresis (DGGE) and metagenomic analysis. It was found that the summer for the biggest changes between JhaoRih hot spring temperature intertidal areas, and different seasonal hot spring environment impact on the intertidal sample area, but also for its bacterial phase have different effects. Genome analysis of the results of the overall findings of this study in the E, K and C are three sample areas begin Proteobacteria, Cyanobacteria, Chloroflexi and Bacteroidetes bacteria-based, which Cyanobacteria most, accounting for 81.1%, 99.3% and 97.5% . The results show that the diversity index analysis will reduce the presence of heat or hot springs diversity of microbial communities (there are no tidal Terme (low temperature)> tidal spa> there is no tidal Terme (high temperature), and DGGE analysis was consistent. Canonical Correlation Analysis (CCA) is displayed in the environmental factors, the most obvious effect of high temperature and the minimum temperature distribution advantages flora. According to the environmental factors, bacteria filter, denaturing gradient gel electrophoresis profiles colloid analysis and overall genomics analysis that, Green Island Community Structure spa area with bacteria and primary and temperature (hot spring) relevant, spa brought some minerals can not only promote the growth of Cyanobacteria, a drastic change when environmental factors, with high capacity to adapt to stress Cyanobacteria populations become intertidal spa microbial communities in the most important species. Since this study temperature cycling culture cultures only heterotrophic microorganisms,
iii
real-majority Cyanobacteria can not grow, so that does not reflect the major ethnic groups resistant to temperature stress. Therefore, in future studies It recommended that Cyanobacteria were isolated photosynthesis or other microbes as essential research.
Key words:Green Island, hot spring, denaturing gradient gel electrophoresis,
metagenomiciv
縮寫表
DGGE (
denaturing gradient gel electrophoresis
):變性梯度膠體電泳 RFLP (restriction fragment length polymorphism):限制性片段長度多態性ARDRA (amplified ribosomal DNA restriction analysis):擴增核糖體 DNA 限制性分 析
SSCP (single strand conformation polymorphism):單鏈構象多態性 RISA (ribosomal intergenic spacer analysis):核糖體基因間隔分析
T-RFLP (terminal restriction fragment length polymorphism):末端限制性片段長度多 態性
FISH (fluorescence in situ hybridization):螢光原位雜交 CCA (canonical correlation analysis):典型相關分析
v
目錄
中文摘要 ...i
英文摘要 ... ii
縮寫表 ... iv
目錄 ... v
圖目錄 ... vii
表目錄 ... ix
一. 文獻回顧 ... 1
(一) 微生物與環境 ... 1
(二) 極端環境 (extreme environment) 與嗜極生物 (extremophile) ... 7
1. 極端環境 (extreme environment) ... 7
2. 嗜極生物 (extremophile) ... 7
2.1 嗜冷/熱性細菌 ... 10
2.2 嗜鹽性細菌 ... 13
2.3 嗜酸/鹼性細菌 ... 14
2.4 嗜壓性細菌 ... 14
(三) 微生物群落 ... 15
1. 潮間帶微生物膜氈 ... 15
2. 高鹽微生物膜氈 ... 16
3. 溫泉微生物膜氈 ... 16
(四) 溫泉環境與潮間帶環境 ... 18
1. 溫泉環境 ... 18
2. 溫度、地質、物理與化學條件 ... 19
3. 潮間帶環境 ... 19
3.1 沙岸生態系 ... 19
3.2 礁岩生態系 ... 24
3.3 珊瑚礁生態系 ... 24
(五) 綠島朝日溫泉 ... 25
(六) 環境微生物的研究方法 ... 25
1. 454 定序技術 ... 32
2. Illumina 定序技術 ... 32
二. 研究動機目的及架構 ... 36
三. 材料與方法 ... 38
(一) 實驗儀器 ... 38
(二) 藥品試劑 ... 39
(三) 試驗方法 ... 40
1. 樣點與樣本採集 ... 40
vi
2. 水溫、水位、鹽度與 pH 值紀錄 ... 40
3. 高低溫循環菌株篩選 ... 42
4. DNA 萃取與純化 ... 42
5. 菌種鑑定 ... 42
6. DGGE 分析 ... 44
6.1 PCR 放大 ... 44
6.2 DGGE 電泳 ... 44
7. Illumina Miseq 序列分析 ... 45
8. 微生物多樣性分析 ... 45
8.1 稀釋性曲線 (rarefaction curve) ... 45
8.2 豐富度 (richness) ... 45
8.3 生物多樣性 (biodiversity) 指數 ... 46
8.4 覆蓋率 (coverage) ... 47
8.5 典型相關分析 (canonical correlation analysis, CCA) ... 47
9. 空照圖 ... 47
四. 結果與討論 ... 49
(一) 樣點探索與樣區設定 ... 49
(二) 各季採樣點特性 ... 49
(三) 樣點水溫變化特性 ... 62
(四) 樣點溫差 ... 68
(五) 季節溫差與各樣區溫差統整 ... 68
(六) 高溫與低溫循環培養分離菌株 ... 72
(七) DGGE 分析 ... 79
(八) 總體基因體學分析 ... 85
五. 結論 ... 94
六. 參考文獻 ... 95
vii
圖目錄
圖一、碳循環………3
圖二、氮循環………4
圖三、磷循環………5
圖四、硫循環………6
圖五、生物的三域分型樹………11
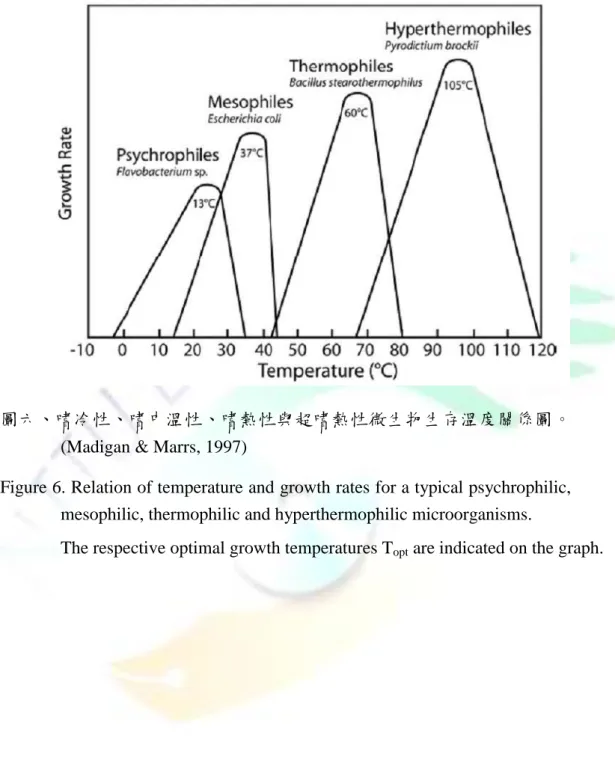
圖六、嗜冷性、嗜中溫性、嗜熱性與超嗜熱性微生物生存溫度關係圖…………12
圖七、典型具有分層結構的生物膜氈………16
圖八、台灣地區溫泉地質圖………21
圖九、綠島地圖………26
圖十、綠島朝日溫泉潮間帶與潮間帶生物膜氈………27
圖十一、微生物的監測方法和步驟………28
圖十二、DGGE 原理………30
圖十三、總體基因組學分析原理………33
圖十四、Roche/454 定序儀原理………34
圖十五、Illumina Genome Analyzer 原理………35
圖十六、本研究之研究架構………37
圖十七、綠島空照圖………49
圖十八、樣點分布………51
圖十九、樣點分布………52
圖二十、樣點分布………53
圖二十一、採樣區………54
圖二十二、採樣區外觀………55
圖二十三、採樣區外觀………56
圖二十四、冬季樣區………57
圖二十五、第一年夏季水溫………65
圖二十六、秋季水溫………66
圖二十七、冬季水溫………67
圖二十八、春季水溫………68
圖二十九、第二年夏季水溫………69
viii
圖目錄
圖三十、溫度變化較低的各樣區季節水溫變化………70
圖三十一、溫度變化較高的各樣區季節水溫變化………71
圖三十二、各季節樣區水溫變化比較………72
圖三十三、各樣區水溫變化量………73
圖三十四、由溫度循環培養所分離出的菌株………79
圖三十五、由溫度循環培養所分離出的菌株分離株中各物種的數量………80
圖三十六、潮間帶細菌群落 DGGE 的分析結果………82
圖三十七、各季節樣點 16S rRNA DGGE 圖譜的稀釋性曲線………83
圖三十八、各季節樣點 16S rRNA DGGE 圖譜的 Shannon 多樣性指數分析……84
圖三十九、各季節樣點 16S rRNA DGGE 圖譜的 Simpson 多樣性指數分析……85
圖四十、各季節樣點 16S rRNA DGGE 圖譜的 CCA 分析結果………86
圖四十一、在樣區 E、K 與 C 的定序覆蓋率………87
圖四十二、在樣區 E、K 與 C 的細菌綱層次群落組成………88
圖四十三、在樣區 E、K 與 C 的物種豐度曲線………89
圖四十四、在樣區 E、K 與 C 的 Chao 1 豐富度估計………90
圖四十五、在樣區 E、K 與 C 的 Shannon 多樣性指數曲線………91
圖四十六、樣區 E、K 與 C 的微生物菌相 CCA 分析………93
ix
表目錄
表一、已知對各種極端環因子耐受度最高的極端生物………8
表二、生活於複數極端環境的嗜複極端因子性微生物………9
表三、根據溫度的溫泉分類………20
表四、根據物理性質的溫泉分類………22
表五、根據化學性質的溫泉分類………23
表六、分析方法之原理與優缺點………29
表七、本研究樣區………41
表八、本研究中所使用之引子………43
表九、第一年夏季採樣點特性………58
表十、秋季採樣點特性………59
表十一、冬季採樣點特性………60
表十二、春季採樣點特性………61
表十三、第二年夏季採樣點特性………62
表十四、高溫循環 (H) 培養分離菌株的 16S rRNA 基因序列比對結果…………76
表十五、低溫循環 (L) 培養分離菌株之 16S rRNA 基因序列比對結果…………78
1
一. 文獻回顧
(一) 微生物與環境
地球上微生物分布於整個生物圈中。除了具有極高的生長與繁衍速度之 外,體積小、表面積大、變異快且代謝快都是微生物面對環境壓力時,相較 於其他生物所具有的優勢。在自然環境中,細菌是密度最大且種類最多的生 物族群,甚至可能是地球上數量和歧異度最大的一類生物 (Torsvik et al., 2002)。
生物必須依賴環境中的各種資源生長與繁衍後代。環境提供生物的資源 包括日光、空氣、水及各種有機或無機的養分。在環境中不同的地理、氣候 因子或者是生物之間的相互關係皆會大大影響生物族群變化,這些影響因子 包括溫度、濕度、酸鹼值、含氧量、有機質、無機質和生物性壓力等 (張,1997)。每一個微生物細胞必須應對不同環境壓力,包含溫度的大幅變 化、可利用的營養物質和宿主的防禦等 (Buckley, 2004)。微生物面對逆境已 經發展出不斷監控環境變化的系統 (Jose, 2012) 以對抗溫度變化、化學性壓 力或氧化損傷等。細胞甚至會通過調控機制合成特殊分子以消除有害的環境 損傷。部分微生物在逆境解除時可以回到原來的狀態,但有些會促使遺傳分 子改變而推動演化 (Buckley, 2004)。
地球可視為密閉生態系統。植物與許多微生物以簡單之無機化合物為營 養,動物則需更複雜之有機化合物。地球上生命與必須元素由無機化合物,
而後轉變為有機化合物,並返回其元素狀態所進行的循環息息相關。微生物 主導此類化學轉變,包含碳、氮、磷與硫循環,並從中獲得能量。
碳是構成各種生物體最基本的元素,碳循環包括 CO
2
的固定和 CO2
的再生。植物、藻類以及光合微生物,通過光合作用固定自然界中的 CO
2
,合成有機碳化合物,進而轉化成各種有機碳化合物。動物以植物為食物,經 過生物氧化釋放出 CO
2
,畜牧業如牛等反芻動物物消化 (甲烷),動植物的 屍體經微生物完全降解 (即礦化作用) 後,最終主要產物之一也是 CO2
。地 下埋藏的煤炭或石油等 (二氧化碳跟甲烷),經過人類的開發利用,如作為 燃料在燃燒後產生 CO2
之後重新加入碳循環。通過這些生物和非生物過程2
產生的 CO
2
,隨後又被植物和光合微生物利用,開始新的碳循環 (圖一)。氮是構成生物體的另一種必需元素,自然界中的氮循環包括許多轉化作 用。空氣中的氮氣被固氮微生物及植物與微生物固定成氨,並經過硝化微生 物的作用轉化成硝酸鹽,後者被植物或微生物同化成有機氮化物。動物食用 含氮的植物,又轉變成動物體內的蛋白質。動物、植物和微生物的遺體及排 泄物被微生物分解後,又以氨的形式釋放出來,這種過程叫做氨化作用。由 硝化菌產生的硝酸鹽在無氧條件下被一些微生物還原成為氮氣,重新回到大 氣中,開始新的氮循環。微生物在氮循環中的幾種作用歸納為:固氮作用、
硝化作用、同化作用、脫氮作用、氨化作用和反硝化作用 (圖二)。
磷是包括微生物在內的所有生命體中不可缺少的元素。在生物大分子核 酸、三磷酸腺苷 (adenosine triphosphate, ATP)、以及生物體內糖代謝的某些 中間體中,都有磷的存在。在自然界中,磷的循環包括可溶性無機磷的同化、
有機磷的礦化以及不溶性磷的溶解等。可溶性的無機磷化物被微生物吸收後 合成有機磷化物,成為生命物質結構組分 (同化作用)。在土壤中許多的細 菌、放線菌和黴菌能產生植酸酶和磷酸酶,能夠將含磷的有機物分解 (異化 作用),產生的無機磷化物可被植物吸收利用。土壤中的磷酸或可溶性的磷 酸鹽與土壤中的一些鹼結合,形成不溶性的磷酸鹽。在天然水體中大部分的 磷存在於水下的沉積物中。不過生活在土壤和水體中的一些微生物,通過代 謝產生的硝酸、硫酸和有機酸又可將不溶性的磷酸鹽溶解,從而使自然界中 的磷循環周而復始的不斷進行 (圖三)。
自然界中的硫和硫化氫被微生物氧化成為硫酸鹽,硫酸鹽被植物和微生 物同化成為有機硫化物。動物食用植物和微生物,將其轉化成為動物有機硫 化物,當動植物的遺體被微生物分解時,含硫的有機質主要是蛋白質降解成 為硫化氫進入到環境中。此外環境中的硫酸鹽在缺氧條件下,能被微生物還 原成為硫化氫。微生物在自然界的硫循環中,參與了各個過程:脫硫作用、
硫化作用、硫同化作用和反硫化作用 (硫酸鹽還原作用) (圖四)。
3
圖一、碳循環。(Bruxelles, 2009) Figure 1. Carbon cycle.
4
圖二、氮循環。(Lenntech, 1998) Figure 2. Nitrogen cycle.
5
圖三、磷循環。(Lenntech, 1998) Figure 3. Phosphorus cycle.
6
圖四、硫循環。(Lenntech, 1998) Figure 4. Sulfur cycle.
7
(二) 極端環境 (extreme environment) 與嗜極生物 (extremophile)
1. 極端環境 (extreme environment)
從生態觀點,整個地球系統包括眾多的生態棲位與獨特的環境背景,
不同的環境條件使的生物群落組成不同。生物為了生長和繁殖,絕大多數 的生物選擇相對較少壓力的適度環境。適當的物理和化學性質包含: pH 值 偏中性、溫度為 20℃- 40℃、空氣壓力約 1 個大氣壓、有足夠的水活性 (最 好大於 0.7) 和營養源、適當的鹽濃度 (介於淡水和海水之間) 、沒有過度 暴露於輻射 (與地球表面上接收到的平均量相比) 和低重金屬或有毒化合 物 (如有機溶劑)。與此相反,惡劣環境如高酸度和鹼度、極端溫度、高壓 力或真空狀態、低水活性、養分不足、高鹽度、密集輻射、高濃度的重金 屬或有毒物質的地方,則被定義為極端環境 (extreme environment)。
2. 嗜極生物 (extremophile)
嗜極生物是指生活在一般生物不能正常生存、繁衍環境中的生物 (Rothschild & Mancinelli, 2001)。自 1960 年代首次發現可於 60°C 以上生 存的生物後 (Brock & Freeze, 1969),許多生存於特殊環境的生物被逐漸分 離出來,嗜極生物的概念開始被建立 (MacElroy, 1974),生命生存的極限條 件也一再被更新 (表一)。嗜極生物通常是以其所生存的極端環境因子為描 述依據,如嗜熱性生物 (thermophile)、嗜冷性生物 (psychrophile)、嗜酸性 生 物 (acidophile) 、 嗜 鹼 性 生 物 (alkaliphile) 、 嗜 壓 性 生 物 (barophile/piezophile)、嗜鹽性生物 (halophile) 以及由其他特殊環境分離出 的生物。然而這樣的區分方式並不完全,因許多極端環境往往存在複數的 限制因子,如表二所示。因此由這些環境分離出來的生物,往往對多個極 端 環 境 具 有 抗 性 , 對 此 Rothschild & Mancinelli (2001) 提 出 了
「polyextremophilic organism」的概念。Canganella & Wiegel (2011) 也對嗜 極端性生物的分類提出 true (obligate) 與 facultative extremophile 的概念。
前者為只能生存於特殊環境,後者可生存於一般環境,但對於特殊環境亦 有耐受性。研究嗜極生物也使生物分類學出現重大的變革,
8
表一、已知對各種極端環因子耐受度最高的極端生物 (Rothschild & Mancinelli, 2001) Table 1. “Record-holding” extremophiles and their environmental limits
Environmental factor Organism Habitat Phylogenetic
affiliation Tolerance to stress
Temperature
High Pyrolobus fumarii Hot undersea
hydrothermal vents Crenarchaeota
Maximum 113°C, Optimum 106°C, Minimum 90°C
Low Polaromonas
vacuolata Sea-ice Bacteria
Minimum 0°C, Optimum 4°C, Maximum 12°C
pH
Low Picrophilus oshimae Acidic hot springs Euryarchaeota
Minimum pH -0.06, Optimum pH 0.7, Maximum pH 4 (is also thermophilic)
High Natronobacterium
gregoryi Soda lakes Euryarchaeota
Maximum pH 12, Optimum pH 10, Minimum pH 8.5 (is also halophilic)
Hydrostatic pressure Strain MT41 Mariana Trench Bacteria
Maximum >100 MPa, Optimum 70 MPa, Minimum 50 Mpa
Salt concentration Halobacterium salinarum
Salt lakes, salted
hides, salted fish Euryarchaeota
Maximum NaCl saturation, Optimum 250 g /L salt,
Minimum 150 g/L salt
Ultraviolet and ionizing radiation
Deinococcus radiodurans
Isolated from ground meat, radioactive waste, nasal secretion of elephant; true habitats unknown
Bacteria
Resistant to 1.5 kGy
gamma radiation and
to 1500 J/m 2 of
ultraviolet radiation
9
表二、生活於複數極端環境的嗜複極端因子性微生物 (Rothschild & Mancinelli, 2001)
Table 2. Some examples of "polyextremophilic" microorganisms, adapted to life at a combination of several environmental extremes
Environmental
factors Organism Habitat Phylogenetic
affiliation Tolerance to stress
Low pH, high temperature
Picrophilus
oshimae Acidic hot springs Euryarchaeota
Minimum pH -0.06;
Maximum temperature 65°C
Sulfurisphaera Acidic hot spring Crenarchaeota Maximum temperature 92°C; Minimum pH 1
Cyanidium
caldarium Acidic hot springs Eukarya Maximum temperature 57°C; Minimum pH 0.2
High pH, high salt concentration
Natronobacterium
gregoryi Soda lakes Archaea -Euryarchaeota
Maximum pH 12; NaCl saturation
High temperature, high pH
Thermococcus alcaliphilus
Shallow marine hydrothermal
springs
Archaea -Euryarchaeota
Maximum temperature 90°C; Maximum pH 10.5
High temperature, high pressure
Thermococcus barophilus
Thermal vent, Mid-Atlantic
Ridge
Archaea -Euryarchaeota
Maximum temperature 100°C; Requires 15-17.5 MPa pressure at the highest
temperatures
High temperature, high radiation
Deinococcus
geothermalis Thermal springs Bacteria
Maximum temperature 50°C. Resistant to at least 10 kGy gamma radiation
Low temperature,
high pressure Deep-sea bacteria Deep sea
environments Bacteria
Live at 2-4°C and pressures of 50-110 Mpa
10
基於 16S rRNA 基因序列分型的真核 (Eukarya)、細菌 (Bacteria) 與古菌 (Archaea) 三域 (three domain 或 three superkingdom) 分類學說也因此被建 立 (Woese & Fox, 1977; Woese et al., 1990) (圖五)。因為 16S rRNA 分型法 的建立與使用,突破生物分離培養技術的限制,使得更多無法培養的物種 得以被發現。近年來,嗜極生物的研究包含 (1) 嗜極端性生物的起源-是 屬於較古老的族群,或是經過二次演化適應的結果。(2) 於工業製程的利用 性。(3) 地球生命起源的研究。(4) 對特殊環境的適應性與抗性 (Canganella
& Wiegel, 2011)。
2.1 嗜冷/熱性細菌
在各種不同的特異環境中,溫度對微生物而言,是一個相當重要的因 子,傳統上微生物學家將微生物以其適合生存的溫度區分為嗜冷性微生物 (psychrophiles)、嗜中溫微生物 (mesophiles)、嗜熱性微生物 (thermophiles) 及超嗜熱性微生物 (hyperthermophiles) 等幾類 (圖六)。其中在 40℃ 以 上可快速生長的高溫微生物被稱為嗜熱性微生物 (thermophiles)。嗜熱性 微 生 物 存 在 於 自 然 界 及 人 為 的 某 些 環 境 中 , 如 地 熱 區 的 溫 泉 (hot springs)、太陽直射的土壤、火山的硫氣孔 (continental solfataras)、海底熱 泉 (hydrothermal vents)、堆肥、熱水器及其冷卻水等 (Brock 1978, 1986;
Kristjansson, 1992)。同時嗜熱性微生物並非單一物種,而是廣泛的分佈於 不同的生物界中,如原生動物、真菌、藻類、細菌及古菌等。大多數的嗜 熱微生物的最適生長溫度在 50-70℃ 這個區間,且在 25-40℃ 依舊可以 緩慢的生長 (Kristjansson, 1992)。
在各種不同的嗜熱性微生物中,細菌是分佈最為廣泛且種類最多的一 群。嗜熱性的細菌早在 80 年前已被微生物學家所發現,但近代的研究則 是源起於 1969 年 Brock 和 Freeze 兩位科學家,由美國黃石公園溫泉 中,分離出一株可生長於 60-80℃ 高溫的細菌 Thermus aquaticus 後 (Brock & Freeze, 1969),加上研究與培養的設備不斷的改進,這類微生物 在世界各地之 50-90℃ 中性或鹼性水域中陸續分離得到 (Ramaley &
Hixson, 1970; Oshima & Imahori, 1971; Saiki et al., 1972; Brock & Boylen, 1973; Loginova & Erorgova, 1975; Pask-Hughes & Williams, 1975;
Demharter et al., 1989; Williams et al., 1995; Stainthorpe & Williams, 1988;
11
圖五、生物的三域分型樹。(Woese et al., 1990)
Figure 5. Universal phylogenetic tree of the three domains.
12
圖六、嗜冷性、嗜中溫性、嗜熱性與超嗜熱性微生物生存溫度關係圖。
(Madigan & Marrs, 1997)
Figure 6. Relation of temperature and growth rates for a typical psychrophilic, mesophilic, thermophilic and hyperthermophilic microorganisms.
The respective optimal growth temperatures T
opt
are indicated on the graph.13
Sharp & Williams, 1995; Tenreiro et al., 1995; Ferreira et al., 1997;
Albuquerque et al, 2000; Chung et al., 2000),而開始成為研究的重點。
常見的陸地高溫生物區域有火山和地熱,例如硫磺溫泉、中度熱泉和 海底含鹽的熱火山口。海底高溫生物區域由溫度約在 400℃ 以上的熱的 噴氣口、熱泉、沉積物和深海火山組成。
硫磺溫泉地區土壤由不同的兩層組成,上面的酸性層含有大量的氧,
由於三價鐵離子的存在,它是呈赭色。從上層中,分離到許多好氧的超嗜 熱嗜酸菌,如硫化葉菌屬 (Sulfolobus) 和酸雙面菌屬 (Acidianus) 的細 菌。下層中由於亞鐵離子的存在,表現為淡黑藍色,pH 值為中性,氧化 還原狀態明顯降低。從這一層中,可以分離到熱變形目 (Thermoproteales) 和甲烷嗜熱菌屬 (Methanothermus) 的細菌。
淺海高溫生物區域分佈在意大利、葡萄牙亞速爾群島、非洲等地。深 海高溫生物區域位於深約 120~3700 公尺處。在淺海和深海的高溫體生 物區域中棲息的種類有 Igneococcales、熱球菌目 (Thermococcales)、甲烷 球菌目 (Methanococcales)、古生球菌目 (Archaeoglobales) 和棲熱袍菌目 (Thermotogales) 。 至 今 僅 在 比 較 深 的 深 海 區 找 到 甲 烷 嗜 高 熱 菌 屬 (Methanopyrus) 的細菌,而在淺海高溫生物區域廣泛分離到的是產液菌屬 (Aquifex) 的細菌。另有研究發現,在冷的海水中有超嗜熱微生物存在,
儘管它們不能生長,但能以一種休眠狀態存活許多年 (Stetter, 1998)。
2.2 嗜鹽性細菌
嗜鹽菌通常分佈在曬鹽場、鹽湖、醃漬品中以及自然環境中 (如死 海)。一般嗜鹽菌能夠在鹽濃度為 15-20% 的環境中生長 (Juez et al., 1990),有的甚至能在 32% 的鹽水中生長。嗜鹽菌依照可生長溫度範圍 在 30~55℃ 之間,最適生長溫度為 37℃。其可生長之 pH 範圍為 5-8,
最適生長 pH 為 7。當培養溫度上升且在高鹽溶液的培養環下,氧氣的 供給量會影響其生長。
極端嗜鹽菌有鹽桿菌 (Halobacterium) 和鹽球菌 (Halococcus),屬於 古菌。鹽桿菌細胞含有紅色素,所以在鹽湖和死海中大量生長時,該環境 呈現紅色。一些嗜鹽細菌的細胞中含有紫膜,膜中有一種蛋白質,稱為細 菌視紫質 (bacteriorhodopsin),能吸收太陽光的能量而當嗜鹽菌處在氧氣 濃度過低或是有光線的照射下,無法藉由氧化磷酸化作用產生足夠能量,
14
則 轉由紫膜的光合磷酸化來提供 ,此時才能促使紫膜的合成 (Oren, 2002)。
2.3 嗜酸/鹼性細菌
大多數嗜酸微生物生長在特殊的酸性環境中,酸性是由硫或它的化合 物產生的。這些環境大多數是地熱區或採礦區及其伴生的廢棄物質。許多 富含硫磺的熱泉和經由氧化礦石或礦尾流過的水體 pH 值僅為 2~3。近 年發現的嗜酸微生物種類大量增加,對已經命名的菌種特性研究也有長足 的進展,自從早期有關嗜酸菌混合培養現象的爭論以來,有更多的菌種之 間相互作用被報導 (Norris et al.,1982; Harrison, 1984)。嗜酸菌根據其生長 溫度範圍,分成了三個類群,即嗜溫嗜酸菌 (mesophilic acidophile)、中度 嗜 熱 嗜 酸 菌 (moderately thermophilic acidophile) 和 嗜 熱 嗜 酸 菌 (thermophilic acidophile) 。
地球上鹼性最強的自然環境是碳酸鹽湖及碳酸鹽荒漠,極端鹼性的湖 如肯尼亞的 Magadi 湖和埃及的 Wady Natrun 湖都是地球上最穩定的鹼 性環境。這些地區的 pH 值高達 10.5~11.0,碳酸鹽是鹼性物質的主要來 源。人為產生的鹼性環境如石灰水和鹼性污水等,也是嗜鹼微生物的主要 棲地。嗜鹼微生物有兩個主要的生理類群:嗜鹽嗜鹼微生物和非嗜鹽的嗜 鹼微生物,前者的生長需要鹼性和高濃度鹽 (達 33% NaCl + Na
2
CO3
) (沈, 2000)。1923 年學者 Johnson 發現幾種能夠耐鹽鹼的黴菌,1928 年 Downie 等學者發現第一種嗜鹼菌糞鏈球菌 (Streptococcus faecalis)之後,大量不同 類型的嗜鹼微生物已經從土壤、鹼湖、鹼性泉水甚至海洋中分離,包括細 菌、真菌和古菌 (Horikoshi, 1998)。但在中性或酸性環境中也有嗜鹼微生 物的分佈。已分離到的嗜鹼微生物包含芽孢桿菌屬 (Bacillus)、無色桿菌 屬 (Achromobacter) 、 鏈 黴 菌 屬 (Streptomyces) 、 假 單 胞 菌 屬 (Pseudomonas)、黃桿菌屬 (Flavobacterium) 和微球菌屬 (Micrococcus) 等。
2.4 嗜壓性細菌
所謂嗜壓微生物 (piezothiles 或 barophiles) 的定義是指那些達到最
15
大生長速度時所需壓力大於 0.1 MPa 的微生物。Certes 等人 (1886) 已經 發現在深海熱泉地區的生物在高溫下是會生長的。嗜壓微生物有兩個主要 的生理類群:嗜壓嗜熱微生物和嗜壓嗜冷微生物。典型的深海溫度是在 1
~3℃,但在海底熱泉出口的高溫高壓環境中發現有生物存在。現在已知 在溫度範圍 0.5~350℃,壓力 0.1~110 MPa 的深海中,棲息相當多的生 命 (Abe et al., 2001)。目前對生命生長的上限溫度還不清楚 (Brock, 1985;
1986; Stetter, 1986),可能比所推測的 250℃ 的值來的低 (Bernhardt et al., 1984; Karl et al., 1988; Trent et al., 1984;White, 1984)。
(三) 微生物群落
微生物是一群無法用肉眼看見的微小生物,其中人類最熟悉的是細菌,
細菌遍佈在空氣、水和土壤,是微生物世界中數量和種類最多的族群。微生 物在環境中扮演著分解者的角色,它們能循環生物圈中被固定的養份,使養 份可以在不同生物中流動。同時它也幫助我們分解環境中的毒性物質,使被 污染的環境能再度被我們利用。自然環境中的微生物皆以群落共存,以利於 個體間進行基因物質、養分及生化訊號的互換 (Buckley, 2004)。在極端環境 中的微生物群落,尤其是由多種微生物所構成的微生物膜氈 (microbial mats) (圖七) 是潮間帶生態中最主要的微生物群落 (Stal & Caumette, 1994;
Seckbach & Oren, 2010;Bolhuis et al, 2014)。
1. 潮間帶微生物膜氈
潮間帶的微生物膜氈在斜度較低的海灘斜坡以細沙沉積物為主體形成 (Stal, 2012)。潮間帶為極端的環境,不定期的海水淹沒,產生週期性強烈的 鹽度波動 (從雨後淡水到經長期乾燥下高鹽環境) 和大幅度的溫度變化。這 些短時間內的環境變化和波動,可能使潮間帶的微生物膜氈具有高多樣性 特徵 (Bolhuis & Stal, 2011)。Armitage 等學者曾針對美國 Sippewisset 鹽 沼,使用 PCR 擴增 16S rRNA 序列並以高通量定序 (high-throughput sequencing, HTS) 和總體基因組學 (metagenomics) 分析潮間帶微生物膜氈 (Armitage et al., 2012)。整體而言 Sippewisset 鹽沼微生物膜氈呈現高度多 樣性,隨著時間潮間帶微生物群落呈現出不同的發展階段和菌相。其豐富 度和均勻度隨著覆蓋量增加所造成的特性差異而減小。在頂層的微生物膜
16
氈中,多樣性與各種逆境環境有關,如 UV 照射、溫度、乾燥、風蝕和潮 汐。Bolhuis 與 Stal 學者在不同的空間和時間使用 V6 區 16S rRNA 基因 序列分析研究沿海微生物膜氈的微生物多樣性 (包括古菌和細菌),在三個 季節中分析鹽度梯度的三種不同類型的微生物膜氈 (淡水或微鹹的淡水、
潮間帶與海洋)。不同類型的微生物膜氈之間的差異遠比在同一個位置不同 的 季 節 之 間 的 變 化 更 為 顯 著 。 在 後 續 研 究中 使 用 DGGE (
denaturing gradient gel electrophoresis
) 進一步證實三種不同類型的微生物膜氈間有 不同的保守物種群集 (conserved clustering) 的存在 (包括真核生物),同時 也能看出群落之間異質性的高低 (Bolhuis et al., 2013)。2. 高鹽微生物膜氈
高鹽微生物膜氈是微生物膜氈體系之中最有趣的研究目標。這些微生 物膜氈從天然的鹽湖到人為鹽場遍布全世界。高鹽微生物膜氈暴露於飽和 滷水當中 (Jørgensen, 1994; Des Marais, 1995),且常伴隨高溫和高量的太陽 輻射。這些因素影響了微生物膜氈生物群落的組成和代謝的表現,但依舊 無法抑制一個高度多樣化和複雜的微生物生態系統的形成。在沿海發現的 高鹽微生物膜氈生長較少受季節中斷,並持續增長好幾年形成多層結構。
過去研究在 Guerrero Negro 微生物膜氈發現細菌、古菌和真菌的比例分別 為 90%、9% 和 1%,確認細菌在微生物膜氈中的主導地位,但古菌在代 謝方面仍有顯著的貢獻 (Robertson et al., 2009)。古菌 (如 Haloquadratum walsbyi) 常出現在高鹽度水體中 (Bolhuis et al., 2004; Legault et al., 2006),
而高鹽微生物膜氈亦常有古菌群落出現 (Ley et al., 2006; Robertson et al., 2009; Armitage et al., 2012; Harris et al., 2013)。此外,在高鹽微生物膜氈中,
藍 菌 為 佔 主 導 地 位 的 初 級 生 產 者 , 負 責 生 產 厚 厚 的 胞 外 聚 合 物 (extracellular polymers, EPS) 以預防乾燥 (Bolhuis et al., 2014)。
3. 溫泉微生物膜氈
人類自 19 世紀開始進行溫泉及地質和物理化學特性的研究。對溫泉 中的微生物興趣始於 1950 年代嗜熱菌的分離 (Marsh & Larsen, 1953)。目 前對溫泉環境研究的興趣很大一部份是來自於可能具有生物技術應用潛在 價值的酵素選殖。此外溫泉微生物膜氈的極端條件被認為可以用來研究早
17
圖七、典型具有分層結構的生物膜氈。(Armitage et al., 2012 ) Figure 7. The typical multilayered structure of microbial mats.
18
期地球的生態環境 (Ward et al., 1998)。溫泉環境常結合高溫 (50-91℃)、pH 偏酸和高濃度的硫化物,這些環境條件會限制生物的多樣性,並限制細菌 的生長。相較於其他類型的微生物膜氈,溫泉環境往往缺乏季節性變動,
僅經歷不規則變化的光強度 (除了晝夜循環)、溫度、pH 和硫化物的濃度 波動。微生物群落的複雜性與溫度高低有關,而微生物膜氈的組成似乎主 要由溫度決定 (Miller et al., 2009)。在較高溫度下的一級代謝產物主要是硫 的氧化物,形成微生物膜氈群落的多樣性來源 (Everroad et al., 2012)。
溫泉在地理上是隔離的,因此導致微生物遺傳訊息的障礙 (Miller et al., 2007; Takacs-Vesbach et al., 2008; Lau et al., 2009) 。在黃石國家公園 (Yellowstone National Park, WY) 的 Mushroom 與 Octopus 溫泉中的微生 物膜氈,已被用來作為研究微生物群落生活在這些高溫棲息地的結構和功 能的模型系統超過三十年 (Brock, 1978; Ward et al., 1998, 2006; Ward &
Castenholz, 2002; Klatt et al., 2011, 2013a, 2013b)。Klatt 等學者使用總體基 因體與焦磷酸定序對 16S rRNA 基因 V3 / V5 區域定序分析 Mushroom 與 Octopus 溫泉的微生物膜氈的多樣性 (Klatt et al., 2011)。微生物群落組 成包含不同的生態類型,而微生物膜氈的功能與組織隨光線的梯度及化學 條件而改變 (Ramsing et al., 2000; Ward et al., 2006)。值得注意的是這些作 者沒有觀察到微生物沿著物理化學梯度遷移 (單細胞)。
(四) 溫泉環境與潮間帶環境
1. 溫泉環境
泉水是地下水集中排出在地表上的逕流水 (Todd, 1980)。迄今對於溫泉 沒有單一的定義。通常當泉水滿足三個描述之一的條件就可以稱為溫泉 (Todd, 1980; LaMoreaux & Tanner, 2001): (1) 溫度比當地地下水較高的泉 水。(2) 泉水的溫度比當地全年空氣平均溫度高 5℃。(3) 泉水溫度高於體 溫。不同國家對於溫泉的定義稍有不同,根據台灣溫泉法第一章第三條,
溫泉定義是符合溫泉基準之溫泉水及水蒸氣,包含溶於溫泉水中之氣體。
溫泉水包括自然湧出或人為抽取之溫水、冷水及水蒸氣 (含溶於溫泉水中 之氣體),在地表量測之溫度高於或等於 30℃ 者。若溫度低於 30℃ 之泉 水,其水質符合溫泉水質成分標準:(1) 溶解固體量 (Total dissolved solids, TDS):在 500 mg/L 以上。 (2) 主要含量陰離子:碳酸氫根離子 (HCO
3 -
) 含19
量 250 mg/L 以上、硫酸根離子 (SO
4 -
) 含量 250 mg/L 以上或氯離子 (含 其他鹵族離子)(Cl-
,including other halide) 含量 250 mg/L 以上。(3) 特殊 成分:游離二氧化碳 (CO2
) 含量 250 mg/L 以上、總硫化物 (total sulfide) 含量大於 1 mg/L、總鐵離子 (Fe2+
+Fe3+
) 含量大於 10 mg/L 或鐳 (Ra) 含 量大於 1x10-8
curie/L ,亦視為溫泉。2. 溫度、地質、物理與化學條件
溫泉的分類方式有許多種,常見的分類方法是根據不同用途進行分 類:依據不同的溫度範圍可分為低溫溫泉 (49℃以下)、中溫泉 (50-74℃)、
高溫泉 (75-96℃) 及沸騰溫泉 (97℃以上) 等四種 (表三)、依地質性質可 分為變質岩區、沉積岩區與火成岩區三類;變質岩區是構成台灣島孤的核 心主要分布於中央山脈兩側;沉積岩區主要分布於台灣西部、南部,少數 分布於東北部;火成岩區主要分布於台灣北部 (圖八)、物理特性可依流體 的狀態,活動模式和地貌外觀區分 (表四) 或依不同化學性質如 pH 值和 在溫泉水中溶解的離子作為分類 (表五)。
3. 潮間帶環境
潮間帶位於陸地到海洋之間的過渡區域,它的範圍是從海水漲潮的最 高點,一直到退潮的最低點,會曝露在空氣中的海岸部分。潮間帶的各項 環境因子隨著時間快速變化 (水位、鹽分、水溫與光照),並且與土壤相較 之下岩岸或沙灘本身能提供的養分不多,因此一般來說缺乏大型植物生長 (Bolhuis et al., 2013)。Hobel 等學者對冰島潮間帶溫泉的研究顯示,隨著潮 汐的改變在 12 小時內溫度變化可超過 70℃,是地球上少數高低溫差大的 環境 (Hobel et al., 2005)。Bolhuis 等學者對汶萊婆羅洲河口潮間帶的研究 顯示,在一天的時間中鹽度變化可超過 18 PSU,對於該地的細菌菌相組成 有顯著的影響 (Bolhuis et al., 2014)常見的海濱潮間帶,根據構成物質分成 三種:沙岸生態系、礁岩生態系與珊瑚礁生態系,不同的構成物質會決定 生物的分布,形成具有不同生物多樣性的潮間帶環境。
3.1 沙岸生態系
較鬆軟的岩石被海風侵蝕後,變成了較細的沙粒,再加上各河川 從上游匯集到下游,所搬運的泥沙堆積到海邊,造成沙岸生態系海岸
20
表三、根據溫度的溫泉分類 (Brock, 1971)
Table 3. Hot spring classification based on temperature
Types Temperature Range
Low-Temperature Hot Spring Lower than 49°C Medium-Temperature Hot Spring 50-74°C
High-Temperature Hot Spring 75-96°C
Boiling Spring Higher than 97°C
21
圖八、台灣地區溫泉地質圖。(工業技術研究院, 2002) Figure 8. Hot spring distribution of geology in Taiwan.
22
表四、根據物理性質的溫泉分類 (Brock, 1971)
Table 4. Hot spring classification based on physical properties Types Physical Properties
Ordinary Hot Spring With temperatures below boiling point, and in most cases spring water is constantly welling. One of the most widely distributed types of terrestrial hot springs.
Geyser Characterized by intermittent discharge of water. Pause time and water temperatures vary, some are above boiling point.
Boiling Spring With temperatures from 93 to 100°C (depends on altitude).
Fumaroles or Solfataras Underground water was heated and vaporized (the source temperature is usually higher than 100°C), and then migrated upwards to surface. If the emitting gas is mainly water vapor, then the degassing structure is called fumarole; if H
2
S is dominant, then it is called solfatara.Hot Mud Spring The discharged hot water is with large amount of mud.
The major constituents in mud are clay minerals, which are derived from the long term interaction between hot water and surrounding rocks.
23
表五、根據化學性質的溫泉分類 (Brock, 1971)
Table 5. Hot spring classification based on chemical properties
Category: subcategory Major Ions pH
1. Chloride Spring Cl -
Carbonate-chloride spring
Na + , Cl - > HCO 3 -
8-9 Acidic sulfate-chloride spring
H + > Na + , Cl - > SO 4
2- 1-4
Neutral sulfate-chloride spring Na + > Ca 2+ , Cl - > SO 4 2-
8-9
2. Hydrocarbonate Spring HCO 3
-
Sodium hydrocarbonate spring
H + > Na + , HCO 3 - 7-10 Sodium/Calciumhydrocarbonate spring
Na + > Ca 2+ , HCO 3
- 7-8
Sulfate-sodium hydrocarbonate spring
Na + , HCO 3 - > SO 4 2- 7-8 Chloride-hydrocarbonate spring
Na + , HCO 3
- > Cl - 6-7
3. Sulfate Spring
SO 4 2-
Acidic sulfate spring H + > Na + , Ca 2+ , SO 4
2- 1-3
Neutral sulfate spring
Ca 2+ > Na + , SO 4 2- > HCO 3 - 6-7
4. Others
NaHCO 3 (Baking Soda)
Ca(HCO 3 )2 or Mg(HCO 3 ) 2
NaCl (Salt)
CaCl 2 or MgCl 2
Na 2 SO 4 (Glauber’s Salt)
CaSO 4 (Gypsum)
MgSO 4 (Epsom Salts)
24
海岸線單調平直。為了適應潮水的漲退,還有海浪的拍打侵蝕,沙岸生 態系的生物們大部分都有掘洞、潛沙的本領,以適應在退潮時,不會缺 水致死。此外有些動物的生理週期,會受到月球引力和日夜變化影響,
產生垂直遷徙活動,在夜晚退潮時才出來活動或覓食,平常都躲在沙 中。(國立海洋生物博物館, 2011)
3.2 礁岩生態系
礁岩海岸通常是指陸地跟海水相互交界的地方,由於地殼板塊的 擠壓作用與火山爆發所噴出的熔岩,造成多由玄武岩與火成岩等堅硬 底質所構成的海岸。因為處於陸地與海洋之間,所以海岸的地形經由 長期的陸地風化與侵蝕作用,與海浪及潮汐作用而產生了海蝕崖、海 蝕洞、海蝕平台、海蝕岩柱和潮池等各種不同面貌的海岸地形。受到 乾燥及溫度兩個決定岩岸生物分佈的限制因子,其相互交乘作用的效 果會比單獨因子影響更大,同時再加上陽光所產生強烈的紫外線所造 成傷害,使得生活在此區的生物大多會潛藏在石縫或岩石下。(國立海 洋生物博物館, 2011)
3.3 珊瑚礁生態系
珊瑚礁海岸是由許多死亡的造礁珊瑚為主體,與其他石灰質藻 類、貝殼等膠結堆積,形成大塊具有孔隙的鈣質礁岩體,像礁石一樣 堅硬,因此稱為珊瑚礁海岸。由於珊瑚的生長會受到水溫與光線的影 響,最適宜珊瑚生長的海水水溫需在 20℃ 以上,而水深亦不能超過 40-60 米,否則珊瑚上的共生藻會無法型光合作用,因此珊瑚礁海岸多 分布於南北緯 28 度間的海域,例如恆春半島和綠島等地即為珊瑚礁 海岸。珊瑚礁可分為珊瑚礁灰岩和珊瑚碎屑岩兩種。前者是巨大的珊 瑚礁群體未經搬運而在它的原生地堆積成礁石。後者是原生礁或造礁 珊瑚骨骼經破壞后,其碎塊碎屑被搬運至其他地方后沉積下來而固結 成礁者。在珊瑚碎屑的形成過程中,有一些完整的貝殼及碎片,石灰 質海藻,甚至還有一些岩性不同,大小不同的礫石夾雜其中,因而珊 瑚碎屑岩的成分是比較復雜的,不像珊瑚礁灰岩那樣單一。
珊瑚礁生態系為生物多樣性最高的地點之一,珊瑚上的共生藻提
25
供了高生產力。此外,珊瑚礁提供不同大小的空間縫隙,讓不同種類 的生物得以在珊瑚礁上生長繁衍。(國立海洋生物博物館, 2011)
(五) 綠島朝日溫泉
綠島位於台東縣東南沿海上,此島上東南方海岸有一熱泉區,由於溫泉 面向太平洋,朝東方可觀日出之緣故,在日治時期便有「旭溫泉」的美稱,
後來更名為「朝日溫泉」(圖九)。該區有數口熱泉分別散佈於岸上及潮間帶,
出水點是在潮間帶珊瑚礁旁 (圖十),泉水來源是附近海域的海水,滲入地底 後經由火山岩漿加熱,再因壓力作用而湧出。泉質屬於硫磺泉,但硫磺含量 極低。水質透明,湧出口的水溫介於 40-90℃,pH 值為 7.5 ,地質為變質 岩。(宋聖榮,2003;Shien & Jean, 1998 )
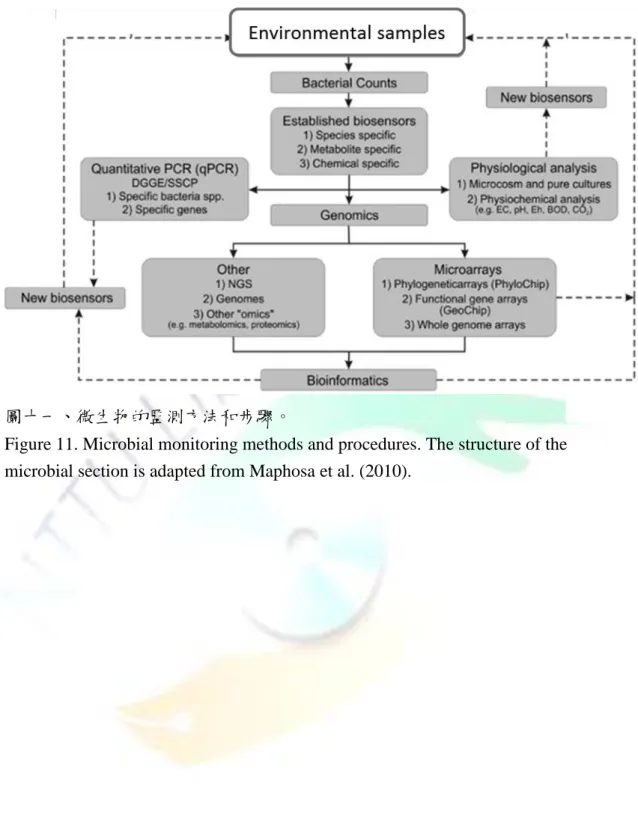
(六) 環境微生物的研究方法
目前環境微生物的研究方法以活菌培養以及分子生物學分析為主 (圖十 一)。由於多數環境中的微生物仍然無法人工培養,因此以微生物培養計數的 方法進行環境微生物菌相評估被認為可能存在相當大的偏差 (Widmer, 2007)。以分子為基礎的微生物分析方法由於不需要培養出目標微生物,因此 被認為可以提供偏差較小且更為詳細的資訊 (James et al, 2006)。目前有多種 分析方法用於微生物菌相的評估,其中包含 DGGE、限制性片段長度多態性 (restriction fragment length polymorphism , RFLP)、擴增核糖體DNA限制性分 析 (amplified ribosomal DNA restriction analysis, ARDRA)、單鏈構象多態性 (single strand conformation polymorphism, SSCP) 、 核 糖 體 基 因 間 隔 分 析 (ribosomal intergenic spacer analysis, RISA)、末端限制性片段長度多態性 T-RFLP (terminal restriction fragment length polymorphism, T-RFLP)、螢光原 位 雜 交 (fluorescence in situ hybridization, FISH) 和 總 體 基 因 組 學 (metagenomics) 等技術 (表六)。在這些分子分析工具當中,DGGE 因為具 有操作步驟簡單、成本相對低廉、可提供可靠的微生物菌相資訊以及可藉由 定序進一步分析特定 DNA 片段等優點,是過去二十年相當受歡迎的微生物
26
圖九、綠島地圖。(臺東縣政府, 2014) Figure 9. Green Island map.
27
圖十、綠島朝日溫泉潮間帶與潮間帶生物膜氈。
Figure 10. Intertidal zone and intertidal microbial mats of JhaoRih hot spring in Green island. Red circle : sampling erea.
28
菌相分析方法 (Nakatsu, 2006)。
DGGE 最早由 Fischer 和 Lerman 於 1983 年提出,利用尿素 (Urea) 和甲醯胺 (Formamide) 等變性劑配製不同濃度梯度的凝膠,不同的 DNA 在不同的變性劑條件下部分解鏈,導致分子發生改變,進而影響其電泳移動 速度,最後形成位置不同的條帶 (圖十二)。主要應用主要在兩個領域:(1) 突 變分析 (mutation analysis) 因爲突變有時候能明顯改變分子變性所需的變性 劑 濃 度 , 因 此 可 用 於 點 突 變 的 偵 測 。 (2) 複 雜 細 菌 樣 品 的 多 樣 性 分 析 (diversity analysis of complex bacterial samples)。
隨著分子生物技術的進步,對於微生物菌相分析的要求也愈來愈高,雖 然 DGGE 是依可靠的分析方法,但受限於 DGGE 放大片段太短 (一般約 200~700 bp) 與電泳本身的解析度,無法取得較為完整精確的物種組成資 訊,尤其容易忽略數量較少的物種。近年由於次世代定序 (next-generation sequencing, NGS) 技術的普及,使得總體基因體學分析突飛猛進,成為微生 物菌相分析的新潮流。利用總體基因組學分析,可以取得精確的微生物群落 組成資訊,對於數量較少的物種有更好的偵測能力。其中 rRNA 序列 (尤其 是 SSU rRNA) 成爲分析總體基因組學最常用的依據 (Armitage et al., 2012;Bruns et al., 1991 )。
總體基因組學是指一門直接取得環境中所有遺傳物質的研究方法 (圖 十三)。早期以總體基因組學研究微生物基因體須先將環境中基因 DNA 或 RNA 選殖進入大腸桿菌 (Escherichia coli) 細胞內,再進行特定序列的定 序,以分析在自然環境中複製選殖特定基因的多樣性。但是利用傳統選殖的 方式進行總體基因組學分析的效率和覆蓋率都存在進步的空間 (Hugenholtz et al., 1998)。總體基因體學提供一個更客觀的微生物菌相,近年許多相關研 究已完全的改變過去我們對微生物世界的認知 (Marco, 2010; Marco, 2011)。
29
圖十一、微生物的監測方法和步驟。
Figure 11. Microbial monitoring methods and procedures. The structure of the microbial section is adapted from Maphosa et al. (2010).
30
表六、環境微生物分子分析方法之原理與優缺點
Table 6. Principle, advantage and shortcoming of molecular methods applied for envinomental microbial community analysis
Method Principle Advantage
ShortcomingDGGE
不同的變性劑濃度,解鏈之後 電泳速度下降
樣本製備容 易,價格低
分辨率低,分析片段 不能大於 500 bp
RFLP
序列差異引起限制性內切酶,
切位點的差異 重複性高,高通量 耗時,操作繁瑣
ARDRA
限制性核酸內切酶酶切後將得
到長度數量不同的 DNA 片段 高解析 對圖譜進行定量與群
落間比較較難分析
SSCP
長度相同但序列不同的單鏈 DNA 具有空間構象上的差異
操作簡便,價格低
靈敏度和再現性差,
分析片段約 150~300 bp 最佳
RISA 核醣體區間序列多態性 操作簡便,序
列多態性豐富
核醣體 copy 數不同 會產生假陽性
T-RFLP
PCR 所使用的一端或兩端帶 有螢光標記
操作簡便,分辨率 高,靈敏度高
低估複雜群落的多樣 性,無法對微生物定
性分析
FISH
人工合成螢光或放射性標記與 微生物基因組雜交
操作簡便,檢 測靈敏度高
只能對特定類群的微 生物進行研究
Metagenomics 直接取得環境中所有遺傳物質 高解析,高通量,
樣品製備容易 單次定序成本高
31
圖十二、DGGE 原理。 (Temmerman, 2003) Figure 12. Principle of DGGE.
32
(七) 次世代定序 (next-generation sequence, NGS)
1. 454 定序技術
454 定序技術是 2005 年由美國 Roche 公司推出的 DNA 定序儀 器。 其 運作原 理 (Fan et al.,2006) 為 將欲 定序的 DNA 片 段打 成約 300~800 bp 的小片段,並於兩端接上 adaptor 序列,再加入大小約 28 µm 表面帶有 adaptor 互補序列的微磁珠,並利用聚合酶連鎖反應進行增幅,
每一個片段將被增幅約一百萬倍。再將此表面帶有 DNA 增幅產物的微 磁珠,放入具有可感光偵測的微孔盤中,使的每孔帶有單一磁珠 (圖十 四)。最後再進行焦磷酸定序法 (Ahmadian et al.,2006) 進行反覆的試劑置 換與偵測,快速地讀取大量之定序結果。並以軟體系統組裝配對完整核酸 序列。近十年研究學者開始利用焦磷酸定序 (pyrosequencing) 的方式進行 環境中樣本基因序列定序,使得微觀下的生物多樣性分析有突破性的進展 (Eisen, 2007)。(Mardis, 2008)
2. Illumina 定序技術
2007 年 Illumina 公司併購 Solexa 公司,並整合其 DNA 定序平台 推出 DNA 定序儀器 (Illumina Genome Analyzer)。其運作原理 (圖十五) 為先將待測 DNA 打斷成 200-500 bp 的小片段,並於兩端接上 adaptor 序列。將已接上 adaptor 序列的待定序基因小片段,置入表面帶有互補 adaptor 序列的晶片,透過橋式聚合酶鏈鎖反應進行增幅,接著加入依不 同鹼基而標記特定且可移除螢光分子的去氧核苷酸材料與反應試劑,如此 反覆進行螢光標記移除、試劑置換與偵測,以快速讀取大量之定序結果,
最後輔以資訊軟體系統,即可組裝配對完整 DNA 序列。(Mardis, 2008)
33
圖十三、總體基因組學分析原理。(Wooley, 2010)
Figure 13. Principle of metagenomics analysis.(A) Sampling from habitat; (B) filtering particles, typically by size; (C) DNA extraction and lysis; (D) cloning and library; (E) sequence the clones; (F) sequence assembly.
34
圖十四、Roche/454 定序儀原理。(Mardis, 2008) Figure 14. Principle of the Roche/454 sequencer
.
35
圖十五、Illumina Genome Analyzer 原理。(Mardis, 2008) Figure 15. Principle of Illumina Genome analyzer.
36
二. 研究動機目的及架構
綠島朝日溫泉是少見的海濱溫泉,為全世界僅三座的海濱溫泉之一 (另兩座 分別在日本九州和義大利西西里島)。泉水來源為海水滲入地底後經由火山岩漿 加熱,再因壓力作用而湧出。綠島朝日溫泉地形為珊瑚礁海岸,潮間帶與溫泉共 同形成的環境變化包含溫度變化、鹽度變化、pH 值的改變以及日照等環境因 子,使得潮間帶溫泉的可以說是地球上環境變化最快速且持續的地點。Hobel 等 學者對冰島潮間帶溫泉的研究顯示,隨著潮汐的改變在 12 小時內溫度變化可超 過 70℃,是地球上少數高低溫差大的環境 (Hobel et al., 2005)。Bolhuis 等學者 對汶萊婆羅洲河口潮間帶的研究顯示,在一天的時間中鹽度變化可超過 18 PSU (practical salinity unit),對於該地的細菌菌相組成有顯著的影響 (Bolhuis et al., 2014)。
溫泉環境常結合高溫 (50-91℃)、pH 偏酸和高濃度的硫化物,這些環境條 件會限制生物的多樣性,並限制細菌的生長。但本研究室於先前的研究中發現綠 島朝日溫泉擁有豐富多樣的嗜熱性細菌,其多樣性遠高於其他溫泉。在這樣溫度 變化極端的環境中,微生物群落的動態以及主要的優勢菌種,是一項值得研究的 課題 (Ramsing et al., 2000; Ward et al., 2006)。本研究進行綠島朝日溫泉潮間帶微 生物群落的研究,分離耐溫度變化的細菌,並藉由 DGGE 分析初步評估樣點的 微生物菌相變化與多樣性,再進一步選擇樣點以總體基因體學進行深入的分析,
探討在此種特殊環境下的細菌群落變化及可能的優勢物種,希望透過朝日溫泉潮 間帶微生物菌相的分析能進一步了解細菌群落在快速環境變化下的菌相特徵。
37
圖十六、本研究之研究架構。
Figure 16. Framework of this study.
38
三. 材料與方法
(一) 實驗儀器
1. 滅菌釜 (Speedy Autoclave)
Model TM-328, Tomin Medical Equipment Co., Ltd, Taipei, Taiwan 2. 熱風循環烘箱 (Forced Convection Oven)
Model DK600D,Yihder Co., Ltd, Taipei, Taiwan 3. 真空烘箱 (Vacuum Drying Oven)
Model VO 30L, Channel Business Co,. Ltd, Taipei, Taiwan 4. 電磁攪拌器 (Magnetic stirrers)
Model MGS-1001, LMS, Taipei, Taiwan 5. 紫外光燈箱 (UV light box)
Model UV2020-2, Top Bio Co., Taipei, Taiwan 6. 照相系統 (Digital Gel Image System)
Model DGIS-8, Top Bio Co., Taipei, Taiwan 7. 無菌操作台 (Laminar flow)
Model JW-5N, Lian Shen Enterprise Co., Ltd, Taichung, Taiwan 8. 迴轉式振盪恆溫培養箱 (Orbital Shaking Incubator)
Model S300R, Firstek Scientific Co., Ltd, Taipei, Taiwan 9. 迴轉式振盪恆溫培養箱 (Orbital Shaking Incubator)
Model LM-570, Yihder Co., Ltd, Taipei, Taiwan 10. 振盪器 (Vortex-Genie 2)
Model G560, Scientific Industries Inc, Bohemia, New York, USA 11. PCR 反應器 (PCR Machine)
Model RoboCycler
®
Gradient 96, Stratagene, Santa Clara, CA, USA 12. PCR 反應器 (PCR Machine)Model 2720 Thermal Cycler, Applied Biosystems, Waltham, MA, USA 13. 精密天平 (Precision Balance)
Model ML203, Mettler-Toledo International Inc, Leicester, UK 14. 離心機 (Centrifuge)
Model Refrigerated table top centrifuge Z326 K, Hermle Labortechnik
39
GmbH, Wehingen, Germany 15. 電泳槽 (Electrophoresis)
Model Mupid-2, Cosmo Bio Co., Ltd, Tokyo, Japan 16. 螢光定量儀 (Qubit fluorometer)
Model Qubit 2.0, Life Technologies Co., Carlsbad, CA, USA 17. 手提式酸鹼值/氧化還原電位測定儀 (Digital pH/MV meter)
Model TS-1, Suntex, Taipei, Taiwan
18. 不銹鋼溫度記錄器 (Stainless temp logger)
Model U12-015, Onset Computer Corporation, Cape Cod, MA, USA 19. 水位/水溫記錄器 (Water level/ Temp Logger)
Model U-20, Onset Computer Corporation, Cape Cod, MA, USA 20. 水溫記錄器 (Water Temp Pro v2 Logger)
Model U-22, Onset Computer Corporation, Cape Cod, MA, USA 21. 海水鹽度儀 (Seawater Refractometer)
Model HI 96822, Hanna Instruments, Woonsocket, RI, USA 22. 充電式抽水馬達 (Aquacharge pump)
Model AQ500 Series, ITT Flow Control, Beverly, MA, USA
23. DGGE 電泳系統 (Universal Mutation Detection System for DGGE) Model DCod System, BIO-RAD Laboratories, Inc., Hercules, CA, USA 24. 雙耳浮球 (
Spherical With Double Knobs
)Model 4M-15, Marine Delta International Co., Ltd, Kaohsiung , Taiwan
(二)
藥品試劑
1. 以下藥品購自 Sigma-Aldrich Co. (Saint Louis, MO, USA):
Ammonium persulfate (APS)、 tetramethylethylenediamine (TEMED) 和 Viscozyme。
2. 以下產品購自 BIONOVAS biotechnology Co. Ltd. (Ontario, Canada):
40% Acrylamide/Bis (37.5:1) 和 formamide。
3. Ethanol 購自 OneStar Biotechnology Co., Ltd. (Taipei, Taiwan) 4. 以下藥品購自 Invitrogen® (Grand Island, NY, USA):
UltraPure
TM
Formamide, Redistilled、SYBR®
gold nucleic acid gel stain、40
UltraPure
TM
Urea 和 Qubit®
dsDNA BR assay kit。5. 以下藥品購自 Roche (Mannheim, Germany):
Deoxynucleotide triphosphates (dNTP)、Super-Therm Gold polymerase (JMR-851)。
6. 以下藥品購自 Focus Bio-Inova, Inc. (Herndon, VA, USA):
Agarose Low EEO 和 Agar。
7. Tris-Acetate-EDTA buffer 購 自 Gene Star Biotechnology Co., Ltd (Shanghai, China)
8. REPLI-g
®
Midi Kit 購自 QIAGEN® (Duesseldorf, Germany)9. Ultra Clean
®
Soil DNA Isolation Kit 購自 MO-BIO Laboratories, Inc.(Carlsbad, CA, USA)
10. Genomic DNA Purification Kit 購自 Biokit (Barcelona, Spain) 11. Nutrient Broth 購自 HiMedia Laboratories Pvt. Ltd. (Mumbai, India) 12. Dimethyl sulfoxide (DMSO) 購 自 Kanto Chemical Co., Inc (Tokyo,
Japan)
13. EasyPure PCR cleanup/Gel extraction Kit 購自 Bioman scientific Co., Ltd (Taipei, Taiwan)
(三)
試驗方法
1. 樣點與樣本採集
樣點位置、樣點描述與採樣時間如表七。樣品採集自水面下礁石表面 的附著物,進行高低溫循環菌株篩選的樣品在採集後立刻置入液態培養基 (Nutrient Broth, NB) 中保存,進行 DGGE 以及 16S rRNA 總體基因體學分 析的樣品在採集後立刻浸入 95% 酒精保存。
2. 水溫、水位、鹽度與 pH 值紀錄
每季採取樣品前於樣點放置水溫與水位記錄器,記錄 48 小時。水溫 接高於 50
o
C 的樣點以 HOBO U-12 高溫記錄器記錄水溫。水溫低於 50o
C 的樣點以 HOBO U-20 水位/水溫記錄器或是 HOBO U-22 水溫記錄器記41
表七、本研究樣區
Table 7. Sample sites of this study
Sampling Location Feature Available sampling season
A 溫泉井邊緣 不受潮汐影響,溫度較為恆定 春、夏、秋、冬
B 溫泉煮蛋區 不受潮汐影響,溫度可達 90 ℃
*
春、夏、秋、冬C 溫泉煮蛋區外側 不受潮汐影響,溫度相對恆定 春、夏、秋、冬
D 溫泉水湧出池 溫度除了秋冬季海水湧入,均屬於高溫 春、夏、秋、冬
E 外側無溫泉水池 溫度僅受潮汐和日照影響,為原本設定的對照樣區 夏
F 接近外側有溫泉滲流的溝渠 夏
G 較為接近內側的溫泉滲出水池 溫度不高 春、夏、秋、冬
H 由 C 點流出的溫泉水流向海岸
的中間點
春、夏、秋、冬
I H 點的下游樣區 水深較深,有少許溫泉滲出 春
J 無溫泉水池 溫度僅受潮汐和日照影響,繼 E 之後的對照樣區
**
夏、冬K 樣區 C、H 與 I 的下游通往海岸 的溝渠,本身有溫泉水湧出
靠近海岸,受潮汐影響溫差較大 夏
L 獨立通往海岸的溝渠,本身有溫
泉水湧出
靠近海岸,受潮汐影響溫差較大 夏
*本樣區由於受到遊客影響大且溫泉管理人員會調節水量因此夏季之後放棄採樣
**本樣區由於春季採樣時發現被礁石填塞,無法取樣,因此放棄
42
錄水溫以及水位變化。鹽度以海水鹽度儀 (Model HI 96822) 進行測定。pH 值 以手提式酸鹼值/氧化還原電位測定儀 (Model TS-1) 紀錄。
3. 高低溫循環菌株篩選
樣品分為 H (高溫篩選) 組與 L (低溫篩選) 組。H 組以 NB 培養 2 天 (55℃),再以 45 ℃- 35℃- 25℃- 4℃- 25℃- 35℃- 45℃- 55℃ 進行循環繼代 培養。L 組先以 NB 培養基培養 5 天 (4℃),再以 25℃- 35℃- 45℃- 55℃- 45℃- 35℃- 25℃- 4℃ 進行循環繼代培養。完成溫度循環的液態培養基以四 區劃線在固態培養基 (nutrient agar, NA) 上分離單一菌落,並繼代 5 次完成 純化。
4. DNA 萃取與純化
分離菌株的 DNA 抽取以 Genomic DNA Purification Kit (Biokit) 進行。
Illumina Miseq 的序列分析樣品則依據 Couradeau 等人的研究 (Couradeau et al., 2011) 進行 DNA 的抽取。取約 1 g 的溫泉潮間帶樣品磨碎之後,以 12,000 xg 離心取沉澱,並以真空烘箱抽乾後加入 2
L Viscozyme 於 37 o
C 反應 1 小時,每 15 分鐘均勻混合一次以加速分解細胞外基質,再以 MoBio Power Soil DNA kit 進行 DNA 抽取。DNA 濃度則以 Qubit®
dsDNA BR Assay Kit 進行定量。5. 菌種鑑定
分離菌株以 Genomic DNA Purification Kit 萃取 DNA 後以引子對 B27F/ U1492R (DeLong, 1992) (表八) 進行 16S rRNA 基因序列的 PCR 擴 增與分析。PCR 反應的總體積為 25 μL,其中包含 1X PCR 緩衝液 (S-T Exsel buffer with 20 mM MgSO
4
)、1 U Exsel high fidelity DNA polymerase、0.1 mM deoxynucleoside triphosphates (dNTPs)、0.12 μM primer 以及 50 ng 溫泉 菌株 DNA。PCR 反應條件為起始變性反應 (denaturation) 95°C,5 分鐘。接 著以 95°C 30 秒;57°C 45 秒;72°C 1 分鐘為一循環,進行 35 循環,最後 進行 72°C 10 分鐘後保存於 4℃。產物經由電泳確認後交由明欣生物科技有43
表八、本研究中所使用之引子 Table 8. Primers used in this study.
Primer Amplicon Sequence (5′→3′) References Target genes
B27F
1379 bp
5′-AGAGTTTGATCCTGGCTCAG-3′
DeLong, 1992
Eubacterial 16S rRNA U1492R 5′-GGTTACCTTGTTACGACTT-3′
341FGC
194 bp
5′-CCTACGGGAGGCAGCAG-3′
Muyzer et al., 1993
Eubacterial 16S rRNA V3 region
534R 5′-ATTACCGCGGCTGCTGG-3′
ARC344F-mod
624 bp 5′-ACGGGGYGCASSAGKCGVGA-3′
Pires et al., 2012
Archean 16S rRNA Arch958R-mod 5′-YCCGGCGTTGAVTCCAATT-3′
524F-10-ext
425 bp 5′-TGYCAGCCGCCGCGGTAA-3′
Pires et al., 2012
Archean 16S rRNA Arch958R-mod-GC 5′-CCGGCGTTGAVTCCAATT-3′
GC clamp : CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGG Y=C, T;V=A, C, G;S=G, C;K=G, T