KLK1 基因啟動子-130G
N多型性與帕金森氏症感受性的分析
黃淑宜
1莊蕙瑄
1陳瓊美
2吳逸如
2* 李桂楨
1*
1 國立臺灣師範大學生命科學系 2 長庚紀念醫院神經內科 (收稿日期:2005.4.19,接受日期:2005.5.6) 摘 要 帕金森氏症為一常見的神經退化性疾病,和遺傳及環境因素相關。KLK1 為一serine protease,在人體包括大腦皮質、海馬迴等多處部位皆有表現。本研究的目的在探討KLK1 基因 啟動子-130GN多型性與國人帕金森氏症感受性的相關性。-130GN多型性基因型的分析方法包括 螢光PCR產物的長度分析、單股核酸構形多型性/異雙股分析及DNA定序等。所研究樣品群包括 208 位帕金森氏症患者及 95 位正常人。結果共觀察到五種對偶基因:I (G9)、A (G10)、B (G2CG7)、 H (G11)、K (G12)。多型性對偶基因的啟動子轉錄活性分析顯示,在人類胚胎腎細胞HEK-293 及 人類腦癌細胞IMR-32 中,A、B、H對偶基因的轉錄活性並無顯著差異,但三者的轉錄活性均較 K對偶基因顯著的好。進一步的依據含或不含K對偶基因的基因型,或K對偶基因頻率,進行X2統 計分析,結果顯示在正常人族群與帕金森氏症患者群間,並未呈現顯著差異。故推論KLK1 基因 啟動子多型性,雖然會影響其在人類胚胎腎細胞及腦癌細胞中的表現量,但其變異和國人帕金 森氏症的感受性並沒有太大關連性。 關鍵詞:KLK1,-130GN多型性,帕金森氏症,疾病感受性緒 言
帕金森氏症 (Parkinson's disease) 為一常 見的神經退化性疾病,患者在臨床上會出現運 動遲緩、靜止性顫抖、僵硬等症狀,病理特徵 包含中腦黑質區緻密部 (pars compacta of the substantia nigra) 的多巴胺神經細胞數目大量減 少,及在神經元細胞質中出現 Lewy bodies 的包 涵體 (Lang and Lozano, 1998)。帕金森氏症的病 因至今未明,目前最被廣為接受的為基因與環 境交互作用的多因子理論。目前已知的遺傳基 因缺陷,包括α-SYN (Polymeropoulos et al., 1997; Kruger et al., 1998)、parkin (Kitada et al., 1998) 、 UCHL1 (Leroy et al., 1998) 、 DJ-1 (Bonifati et al., 2003)、PINK1 (Valente et al., 2004)、dardarin (Paisan-Ruiz et al., 2004)等。然而大多數的帕金森氏症患者,並不具上述這些 基因的變異。故應進一步利用候選基因策略, 來探討可能參與的其他遺傳因子。
Kallikrein 為 serine proteases 的一個亞群, 和一些蛋白質的轉譯後修飾作用有關,藉此將 前軀蛋白轉變為有生物活性的分子,如轉變 kininogen 成血管擴張素 kinin (Carbarni et al., 1993; Clements, 1994)。人體內的 kallikrein 可以 分為兩群:plasma kallikrein 和 tissue kallikrein, 前 者 為 單 一 基 因 的 產 物 , 在 肝 臟 中 以 prekallikrein 的方式合成,分泌至血液中,再轉 變 為 plasma kallikrein (Chung et al., 1986; Beaubien et al., 1991),後者則包含多個成員, 如 KLK1 (pancreatic/renal kallikrein) 、 KLK2 (glandular kallikrein) 、 KLK3 (prostate-specific kallikrein) 等 , 表 現 於 人 體 多 處 器 官 及 腺 體
(Clements, 1994)。目前已知的 KLK1 ~ KLK15 等 15 個相關基因,皆位於染色體 19q13.3-q13.4 上 (Evans et al., 1988; Riegman et al., 1992)。
和本研究相關的KLK1 基因,約長 4.5 kb, 有 5 個exon,其 5'端上游區-202 bp長的啟動子 片段已具組織專一性表現 (Xiong et al., 1997; Yousef et al., 2000)。在KLK1 啟動子的-130 ~ -121 間有多型性區域 (-130GN),在白種人、非 裔美國人、亞洲人的族群分析中共發現了 10~15 種對偶基因 (allele) (Song et al., 1997; Yu et al., 2002)。在非裔美國人的族群分析中,此啟動子 多 型 性 和 高 血 壓 及 末 期 腎 病 相 關 (Yu et al., 2002)。此啟動子多型性亦和國人的腎病進程相 關 (Lee-Chen et al., 2004)。由於serine proteases 參與生理活性大分子的後修飾作用、細胞外基 質 蛋 白 的 分 解 、 synapse 相 關 蛋 白 的 切 割 等 (Shiosaka and Yoshida, 2000),且利用reverse transcriptase-polymerase chain reaction (RT-PCR) 的方法,在大腦皮質及海馬迴部位亦可檢測到 KLK1 的表現 (Shimizu-Okabe et al., 2001),因 此本實驗分析了正常人及帕金森氏症患者之 KLK1 基因 5'端上游區的-130GN啟動子多型 性,並檢測各多型性啟動子的轉錄活性,以了 解此多型性是否和國人帕金森氏症的發生相 關。
材料與方法
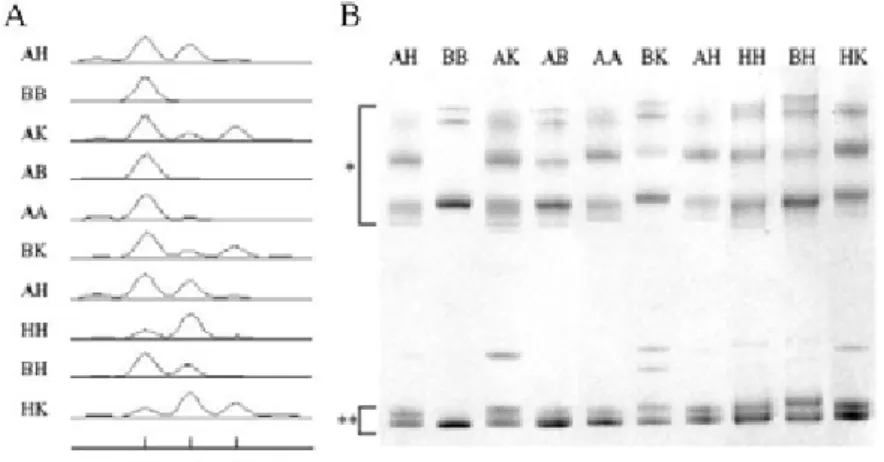
研究樣品 正常人 (95 位) 及帕金森氏症 (208 位) 患 者的血液樣品,由林口長庚紀念醫院吳逸如醫 師及陳瓊美醫師提供。由各血液樣品的白血球 中分離出 DNA。 KLK1 基因啟動子-130GN多型性的檢視 以PCR放大正常人及帕金森氏症患者之 KLK1 基因 5'端上游區啟動子序列,反應所使用 之引子對為hKPM6: GAATGCGTCCAGCGTG ATCC 、 hKPM7: fam-AGCCCTTATCCCCTC AGAGC。在一 25 µl的反應中,反應溶液包含 100 ng的DNA、50 ng的引子對、1.0 mM MgCl2、 200 µM dNTP及 0.5 U的 Taq DNA聚合酵素 (Promega)。PCR反應的煉合溫度為 60℃,所放 大的 178 ~ 181 bp片段包含啟動子上-210 ~ -32 區域(核苷酸序列+1 表示mRNA轉錄的起始 點)。反應完畢後的產物,經稀釋 8 倍後,以聚 丙 醯 胺 膠 體 進 行 長 度 分 析 (MegaBACE Analyzer 定 序 儀 及 分 析 軟 體 , Molecular Dynamics),由不同長度推算出各樣品的基因 型,如對偶基因I (178 bp)、A或B (179 bp)、H (180 bp)、K (181 bp) 等。對偶基因A或B可進一 步藉單股核酸構形多型性 (SSCP) 及異雙股 (heteroduplex) 分析區分。上述五種多型性對偶 基因,亦經選殖、定序,來確認各對偶基因的 序列。 圖一、KLK1 基因啟動子多型性的檢視。(A)螢光 PCR 產物之聚丙醯胺膠體長度分析結果。(B)上述 PCR 產物變性後之 SSCP/heteroduplex 分析結果,*及**分別表示變異的單股構形及異雙股構造。各樣品的基因型標示於左方(A)或上方(B)。Figure 1. Genotype analysis of KLK1 promoter polymorphism. (A) Electrophoresis of fluorescenced PCR products in linear
polyacrylamide gels on an automated sequencer. (B) Electrophoresis of danatured PCR products for SSCP and heteroduplex analyses. The template genotypes in (A) and (B) are indicated on the left (A) and top (B).
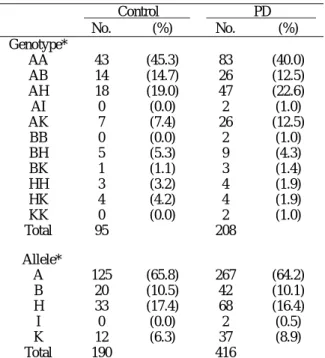
表一、KLK1 多型性基因型分佈及對偶基因頻率
Table 1. KLK1 genotype distribution and allele frequency
Control PD No. (%) No. (%) Genotype* AA 43 (45.3) 83 (40.0) AB 14 (14.7) 26 (12.5) AH 18 (19.0) 47 (22.6) AI 0 (0.0) 2 (1.0) AK 7 (7.4) 26 (12.5) BB 0 (0.0) 2 (1.0) BH 5 (5.3) 9 (4.3) BK 1 (1.1) 3 (1.4) HH 3 (3.2) 4 (1.9) HK 4 (4.2) 4 (1.9) KK 0 (0.0) 2 (1.0) Total 95 208 Allele* A 125 (65.8) 267 (64.2) B 20 (10.5) 42 (10.1) H 33 (17.4) 68 (16.4) I 0 (0.0) 2 (0.5) K 12 (6.3) 37 (8.9) Total 190 416 *A: G10, B: G2CG7, H: G11, I: G9, K: G12. 多型性啟動子片段的轉錄活性分析 取含頻率較高的對偶基因A、B、H、K的 DNA 樣 品 , 以 引 子 對 hKPM1: CTGCAGGAATCTAGTTC 、 huKATG: CAGAACCAGGAACCACAT 放 大 999 bp 長 (-945 ~ + 54) 的多型性啟動子片段,經選殖、 定序後,以EcoRI切出,置入已引入限制酶EcoRI 切位的pGL3-Basic載體 (Promega) (Wu et al., 2004)的螢火蟲luciferase報導基因前。培養人類 胚胎腎細胞HEK-293 及人類腦癌細胞IMR-32 於 37℃含 5 % CO2且溼度良好的培養箱中。培 養液為含 10 %胎牛血清、100 U/ml青黴素與 100 U/ml 鏈 黴 素 之 Dulbecco's Modified Eagle Medium (DMEM)。接種 4×105個細胞在 12-well 培養盤上,隔天取 1.5 µg啟動子重組質體DNA 及 0.05 µg含有水母 (Renilla) luciferase之質體 DNA (phRL-TK , 作 為 internal control) , 以 liposome轉移入細胞中。兩天後收取細胞,製備 細胞液,以冷光測定儀 (Luminometer) 測定螢 火蟲及水母luciferase的相對活性比值。 統計分析 以基因計算方法分析正常人族群及帕金森 氏症樣品群的多型性對偶基因頻率及異型合子 率,並以χ2 檢測是否具有顯著差異。上述各對 偶基因轉錄活性的差異以雙尾Student's t-test檢 測之。
結 果
KLK1 基因啟動子多型性分析 KLK1 基因上游區-130GN多型性,以引子對 hKMP6、hKMP7 放大的片段,經螢光定序儀分 析後,長度範圍為 178~181 bp,即對偶基因I 的長度為 178 bp,對偶基因A、B的長度為 179 bp,對偶基因H的長度為 180 bp,對偶基因K的 長度為 181 bp等 (圖一A)。進一步的SSCP/ heteroduplex分析,可分辨出含對偶基因A、B 的基因型 (圖一B)。各對偶基因亦經選殖、定 序確認其序列變異:I (G9)、A (G10)、B (G2CG7)、 H (G11)、K (G12)等(data not shown)。正常人(95 位)及帕金森氏症(208 位)患者的 多型性基因型分析結果列於表一。在正常人及 帕金森氏症病患族群中,共觀察到的十一種基 因型,其中以 AA 為最常見(45.3%、40.0%), 其 次 為 AH (19.0% 、 22.6%) 、 AB (14.7% 、 12.5%)、AK (7.4%、12.5%)、HK (4.2%、1.9%)、 BH (5.3%、4.3%)、HH (3.2%、1.9%)、BK (1.1%、 1.4%)、AI、BB、KK (皆為 0.0%、1.0%)等。這 十一種基因型由五種對偶基因組成,其中對偶 基因 A 最為常見,在兩族群中分別佔 65.8%、 64.2%,其次為 H (17.4%、16.4%)、B (10.5%、 10.1%)、K (6.3%、8.9%)、I (0.0%、0.5%)等。 多型性啟動子的轉錄活性分析 將包含上述頻率較高的 A、B、H、K 對偶 基因的啟動子,置於螢火蟲 luciferase 報導基因 前,如此構築的重組質體,和由 TK 基因啟動 子驅動水母 luciferase 之內在控制組質體,共同 轉入 HEK-293 及 IMR-32 細胞後,經冷光測定 儀測定,計算出表現的兩種 luciferase 的活性比 值。如圖二所示,在 HEK-293 及 IMR-32 細胞 中,若將對偶基因 A 的活性比值定為 100%,B、 H 對偶基因的轉錄活性與 A 對偶基因相較,並 無顯著差異 (96% ~ 107%,P > 0.05)。相反的, K 對偶基因的轉錄活性遠較 A 對偶基因為低 (18% ~ 20%),且此差異呈顯著性 (P < 0.001)。
圖 二 、 KLK1 基因啟動子多型性對偶基因A (G10) 、 B (G2CG7)、H (G11)、K (G12)於HEK-293 與IMR-32 細胞的轉 錄活性分析。縱座標的相對比值,係以對偶基因A之螢火 蟲luciferase與水母luciferase的活性比值作為 100%,比較 其他多型性啟動子重組質體的相對活性的結果。各長方形 柱子的數值表三次實驗之平均值±標準誤差值。
Figure 2. Transient expression of luciferase enzymatic
activity driven by the KLK1 5'-flanking 999-bp fragment containing the A (G10), B (G2CG7), H (G11), and K (G12) alleles in HEK-293 and IMR-32 cells. The levels of luciferase activities are expressed as percentages of the activity of the A allele. Each value is the mean ± SD of three independent experiments, each performed in duplicate.
K 對偶基因和帕金森氏症感受性的相關性 上述啟動子的轉錄活性分析結果顯示, KLK1 基因的啟動子多型性可能影響其在細胞 中的表現量。故進一步分析正常人族群及帕金 森氏症患者群,含或不含 K 對偶基因的基因型 或 K 對偶基因頻率。結果顯示在此兩樣品群 間,並未呈現顯著差異 (P > 0.05,表二)。
討 論
本研究以台灣地區的帕金森氏症患者與正 常人為對象,探討KLK1 基因-130GN多型性與國 人帕金森氏症發生的相關性,並利用報導基因 系統進行人類胚胎腎細胞HEK-293 及腦癌細胞 IMR-32 體 外 實 驗 , 檢 測 KLK1 基 因 啟 動 子 -130GN多型性對轉錄活性的影響。 在基因型的分析方面,先前 Song 等人於 1997 年的報導中,分析了 18 位亞裔樣品,其所 觀察到的四種對偶基因 A (61.1%)、H (25.0%)、 B (11.1%)、K (2.8%)的結果,與我們的結果相 似 (表一)。由於我們的樣品群較大(95 位正常人 及 208 位帕金森氏症患者),故有機會觀察到 I 這個罕見的 (< 0.1%) 對偶基因。此對偶基因 I 在 美 裔 黑 人 中 頗 常 見 (18.2%) (Yu et al., 2002),可能源自於較高 I 對偶基因頻率的創始 族群及族群間 gene flow 很慢。 在KLK1 啟動子活性分析中,A、B、H、K 對偶基因在HEK-293 及IMR-32 細胞中表現的 啟動子活性相近 (圖二)。與A對偶基因相較, B、H對偶基因啟動子活性約為 96% ~ 107%, 而K對偶基因的啟動子活性顯著的較A對偶基 因為低 (18% ~ 20%,P < 0.001)。A、B、H、K 對偶基因其多型性變異分別為G10、G2CG7、 G11、G12,其中B對偶基因序列中含GGCGG, 類似轉錄因子SP1 的辨識序列 (Brown et al., 1992),其他對偶基因則為連續G序列的長度變 化(G10~ G12)。-130GN多型性位點鄰近上游區域 尚 有 CRE (cAMP response element) 、 GRE (glucocorticoid response element),下游區域有 CAAT Box序列。此多型性位點較長的K對偶基 因,可能因影響鄰近轉錄因子的結合或其交互 作 用 , 而 導 致 低 轉 錄 活 性 。 人 類 的 漸 進 性 myoclonus癲癇症 (EPM1) (Lalioti et al., 1999)及 第 十 二 型 脊 髓 小 腦 共 濟 失 調 症 (SCA12) (Holmes et al., 2003),即因啟動子上的長度差異 影響啟動子活性所引起。表二、包含或不包含 K 對偶基因的基因型及對偶基因頻率
Table 2. Analysis of genotype and allele frequencies with or without K allele
Control PD No. (%) No. (%) Genotype* without K allele (AA, AB, AH, AI, BB, BH, HH) 83 (87.4) 173 (83.2) Genotype with K allele (AK, BK, HK, KK) 12 (12.6) 35 (16.8)
P (1 df) 0.2744
Allele* A, B, H, I 178 (93.7) 379 (91.1)
Allele K 12 (6.3) 37 (8.9)
P (1 df) 0.2118
先前本實驗室及 Yu 等人曾分析正常人族 群與腎病患者群此 KLK1 啟動子多型性的分 佈,結果發現 K 對偶基因與腎病進程有關 (Yu
et al., 2002; Lee-Chen et al., 2004)。KLK1 可活
化 kinin、促使血管擴張、降低血壓,來拮抗腎 素 - 血 管 收 縮 素 系 統 (Scicli and Carretero, 1986)。當 KLK1 活性偏低時(如 K 對偶基因攜 帶者),相對的腎素-血管收縮素系統的表現量可 能會較高,導致腎病的惡化。本研究中,K 對 偶基因活性顯著低於 A、B、H 對偶基因的結 果,與上述腎病進程的研究相符。Song 等人於 1997 年報導此 KLK1 啟動子多型性時,也曾於 HEK-293 細胞中分析過啟動子功能,此實驗將 啟動子片段-940 ~ +10 的 B 對偶基因的活性設 為 100%,A、K、I 對偶基因與 B 相較,無顯著 差異,但 H 對偶基因的轉錄活性顯著較低,僅 為 B 對偶基因的 15.6%,此結果與本研究的啟 動子片段-945 ~ + 54 分析結果相異。推測或許 Song 等人和本研究所使用的啟動子片段上,可 能有其他未報導過的多型性變異,而導致不同 的研究結果。 KLK1 是 serine proteases 的一種,除活化 kinin 來拮抗血管收縮素的功能外,在神經系統 多處部位亦表現 (Shimizu-Okabe et al., 2001), 參與大分子的轉譯後修飾作用、細胞外基質蛋 白 的 分 解 , 和 synapse 相 關 蛋 白 的 切 割 等 (Shiosaka and Yoshida, 2000)。由於帕金森氏症 源自於蛋白質不當的儲積,故推測其表現量變 異可能和國人帕金森氏症發生相關。但本研究 結果顯示,雖然 K 對偶基因的活性顯著較低, 但此 K 對偶基因和國人帕金森氏症的發生並沒 有太大關連性。
誌 謝
本研究感謝同意參與研究的帕金森氏症病 患及正常人。研究經費來源係由國科會計畫 NSC-93-2314-B-182A-175 所補助,於此一併致 謝。參考文獻
Beaubien G, Rosinski-Chupin I, Mattei MG, Mbikay M, Chretien M and Seidah NG. 1991.
Gene structure and chromosomal localization of plasma kallikrein. Biochemistry 30:1628-1635.
Bonifati V, Rizzu P, van Baren MJ, Schaap O, Breedveld GJ, Krieger E, Dekker MCJ, Squitieri F, Ibanez P, Joosse M, van Dongen JW, Vanacore N, van Swieten JC, Brice A, Meco G, van Duijn CM, Oostra BA and Heutink P. 2003. Mutations in the DJ-1 gene associated with autosomal recessive early-onset parkinsonism. Science 299: 256-259.
Brown CJ, Baltz KA and Edenberg HJ. 1992. Expression of the human ADH2 gene: an unusual Sp1-binding site in the promoter of a gene expressed at high levels in liver. Gene 121:313-320.
Carbarni LA, Scicli AG and Carretero OA. 1993. The molecular biology of the kallikrein-kinin system, III: the human kallikrein gene family and kallikrein substrate. J. Hypertens. 11:893-898.
Chung DW, Fujikawa K, McMullen BA and Davie EW. 1986. Human plasma prekallikrein, a zymogen to a serine protease that contains four tandem repeats. Biochemistry 25:2410-2417.
Clements JA. 1994. The human kallikrein gene family: a diversity of expression and function. Mol. Cell. Endocrinol. 99:C1-C6.
Evans BA, Yun ZX, Close JA, Tregear GW, Kitamura N, Nakanishi S, Callen DF, Baker E, Hyland VJ, Sutherland GR, et al. 1988. Structure and chromosomal localization of the human renal kallikrein gene. Biochemistry 27:3124-3129.
Holmes SE, O'Hearn E, Margolis RL. 2003. Why is SCA12 different from other SCAs? Cytogenet. Genome Res. 100:189-197.
Kitada T, Asakawa S, Hattori N, Matsumine H, Yamamura Y, Minoshima S, Yokochi M, Mizuno Y and Shimizu N. 1998. Mutations in the parkin gene cause autosomal recessive juvenile parkinsonism. Nature 392:605-608. Kruger R, Kuhn W, Muller T, Woitalla D, Graeber
M, Kosel S, Przuntek H, Epplen JT, Schols L and Riess O. 1998. Ala30Pro mutation in the gene encoding α-synuclein in Parkinson's disease. Nat. Genet. 18:106-108.
Lalioti MD, Scott HS, Antonarakis SE. 1999. Altered spacing of promoter elements due to
the dodecamer repeat expansion contributes to reduced expression of the cystatin B gene in EPM1. Hum. Mol. Genet. 8:1791-1798. Lang AE and Lozano AM. 1998. Parkinson's
disease. First of two parts. N. Engl. J. Med. 339:1044-1053.
Lee-Chen GJ, Liu KP, Lai YC, Juang HS, Huang SY and Lin CY. 2004. Significance of the tissue kallikrein promoter and transforming growth factor-β1 polymorphisms with renal progression in children with vesicoureteral reflux. Kidney Int. 65:1467-1472.
Leroy E, Boyer R, Auburger G, Leube B, Ulm G, Mezey E, Harta G, Brownstein MJ, Jonnalagada S, Chernova T, Dehejia A, Lavedan C, Gasser T, Steinbach PJ, Wilkinson KD and Polymeropoulos MH. 1998. The ubiquitin pathway in Parkinson's disease. Nature 395:451-452.
Paisan-Ruiz C, Jain S, Evans EW, Gilks WP, Simon J, van der Brug M, de Munain AL, Aparicio S, Gil AM, Khan N, Johnson J, Martinez JR, Nicholl D, Carrera IM, Pena AS, de Silva R, Lees A, Marti-Masso JF, Perez-Tur J, Wood NW and Singleton AB. 2004. Cloning of the gene containing mutations that cause PARK8-linked Parkinson's disease. Neuron 44:595-600.
Polymeropoulos MH, Lavedan C, Leroy E, Ide SE, Dehejia A, Dutra A, Pike B, Root H, Rubenstein J, Boyer R, Stenroos ES, Chandrasekharappa S, Athanassiadou A, Papapetropoulos T, Johnson WG, Lazzarini AM, Duvoisin RC, Di Iorio G, Golbe LI and Nussbaum RL. 1997. Mutation in the α-synuclein gene identified in families with Parkinson's disease. Science 276:2045-2047. Riegman PHJ, Vlietstra RJ, Suurmeijer L,
Cleutjens CBJM and Trapman J. 1992. Characterization of the human kallikrein locus. Genomics 14:6-11.
Scicli AG and Carretero OA. 1986. Renal kallikrein-kinin system. Kidney Int. 29:120-130.
Shimizu-Okabe C, Yousef GM, Diamandis EP, Yoshida S, Shiosaka S and Fahnestock M. 2001. Expression of the kallikrein gene family in normal and brain. Mol. Neurosci. 12:2747-2751.
Shiosaka S and Yoshida S. 2000. Synaptic microenvironments--structural plasticity,
adhesion molecules, proteases and their inhibitors. Neurosci. Res. 37:85-89.
Song Q, Chao J and Chao L. 1997. DNA polymorphisms in the 5'-flanking region of the human tissue kallikrein gene. Hum. Genet. 99:727-734.
Valente EM, Abou-Sleiman PM, Caputo V, Muqit MM, Harvey K, Gispert S, Ali Z, Del Turco D, Bentivoglio AR, Healy DG, Albanese A, Nussbaum R, Gonzalez-Maldonado R, Deller T, Salvi S, Cortelli P, Gilks WP, Latchman DS, Harvey RJ, Dallapiccola B, Auburger G and Wood NW. 2004. Hereditary early-onset Parkinson's disease caused by mutations in PINK1. Science 304:1158-1160.
Wu YR, Wang CK, Chen CM, Hsu Y, Lin SJ, Lin YY, Fung HC, Chang KH and Lee-Chen GJ. 2004. Analysis of Heat shock protein 70 gene polymorphisms and the risk of Parkinson's disease. Hum. Genet. 114:236-241.
Xiong W, Wang J, Chao L and Chao J. 1997. Tissue-specific expression and promoter analyses of the human tissue kallikrein gene in transgenic mice. Biochem. J. 325:111-116. Yousef GM, Chang A, Scorilas A and Diamandis
EP. 2000. Genomic organization of the human kallikrein gene family on chromosome 19q13.3-q13.4. Biochem. Biophys. Res. Commun. 276:125-133.
Yu H, Song Q, Freedman BI, Chao J, Chao L, Rich SS and Bowden DW. 2002. Association of the tissue kallikrein gene promoter with ESRD and hypertension. Kidney. Int. 61:1030-1039.
Analysis of KLK1 Gene -130G
NPolymorphism with the Risk of
Parkinson's Disease
Shu-Yi Huang
1, Huei-Shiuan Juang
1, Chiung-Mei Chen
2, Yih-Ru Wu
2*, Guey-Jen Lee-Chen
1*
1
Department of Life Science, National Taiwan Normal University Taipei, Taiwan
2
Department of Neurology, Chang Gung Memorial Hospital Taipei, Taiwan
(Received: 19 April 2005, accepted: 6 May 2005)
ABSTRACT
Parkinson's disease (PD) is a common neurodegenerative disorder involving several genetic and environmental components. Human tissue kallikrein (KLK1) is a serine protease expressed in both the cerebral cortex and hippocampus. In this study we investigated the association of KLK1 gene -130GN polymorphism with the risk of Parkinson's disease. The -130 GN polymorphism was analyzed by electrophoresis of fluorescenced PCR products in sequencing gels, single-strand conformation polymorphism (SSCP)/heteroduplex analysis and DNA sequencing. Two hundred and eight patients with PD and 95 normal controls were examined. Five alleles were identified in the KLK1 promoter: I (G9), A (G10), B (G2CG7), H (G11), and K (G12). A reporter construct containing the K allele cloned into a luciferase reporter plasmid drove significantly lower transcriptional activity of KLK1 as compared with the A, B, and H alleles in both HEK-293 and IMR-32 cells. However, when the genotype and allele frequencies with or without K allele were analyzed, no statistically significant difference was observed between PD patients and controls. Therefore, the results indicate that although associated with lower transcriptional activity, KLK1 -130 GN K allele was not associated with the risk of Taiwanese PD.
Key words: KLK1, -130GN polymorphism, Parkinson's disease, disease susceptibility