唐杜鵑組織培養芽體延緩生長貯存培養技術
廖宇賡1,2) 葉佩雯1)
摘 要
杜鵑花屬(Rhododendron L.)植物為著名庭園景觀樹種,有極大之商業價值,組織培養繁殖能滿 足其大規模生產之需求,也是復育瀕危種杜鵑的手段之一。惟進行組織培養操作時,長期且重複性的 繼代培養有體細胞變異及污染之顧慮。本研究藉由延緩生長貯存以減緩培殖體之生長,達到延長繼 代週期之效果。以唐杜鵑(Rhododendron simsii Planch.)之增殖培養基為基礎,組合不同濃度之蔗糖 (sucrose)、甘露糖醇(mannitol)及山梨糖醇(sorbitol)為滲調劑,取代增殖培養基中之蔗糖,另結合三種 貯存溫度(4、10及22℃)於黑暗中貯存唐杜鵑芽體。依存活率及貯存期結束後芽體活力恢復情形,選擇 最佳貯存條件,並接續嘗試移除貯存培養基中的細胞分裂素及調整光照條件。綜合本研究結果顯示,
以22℃搭配添加3% (w v-1)蔗糖及33.6 µM 6-(γ-γ-dimethylallylamino) purine (2iP)的貯存培養基,並 施予光照,可在不繼代的情形下延續貯存芽體達8個月,且其恢復生長後之芽體生長情形良好,發根及 馴化成小植株之能力均不受影響。
關鍵詞:杜鵑花、微體繁殖、滲調劑、糖醇。
廖宇賡、葉佩雯。2020。唐杜鵑組織培養芽體延緩生長貯存培養技術。台灣林業科學35(1):81-96。
1) 國立嘉義大學森林暨自然資源學系,60004 嘉義市學府路300號 Department of Forestry and Natural Resources, National Chiayi Univ., 300 Xuefu Rd., Chiayi 60004, Taiwan.
2) 通訊作者 Corresponding author, e-mail:ykliao@mail.ncyu.edu.tw
2019年8月送審 2020年3月通過 Received August 2019, Accepted March 2020.
Research paper
In Vitro Culture Method for the Slow-Growth Storage of Rhododendron simsii Planch. Shoots
Yue-Ken Liao,1,2) Pei-Wen Yeh1)
【Summary】
The genus Rhododendron L. includes many popular gardening species of azalea widely used in landscaping, which illustrates their great commercial value. Their large-scale produc- tion can be achieved by in vitro propagation, and such techniques can also be used as a protocol to recover certain endangered Rhododendron species. However, frequent subculturing for long- term maintenance of tissue-cultured materials may lead to a risk of somaclonal variations and contamination. Therefore, the present study was conducted to develop a slow-growth storage method to reduce the growth of explants, thus prolonging the interval between subcultures.
Based on a proliferation medium for the micropropagation of R. simsii Planch., sucrose was replaced by mannitol and sorbitol or in combination with sucrose in different concentrations as the osmoticum. Three storage temperatures (4, 10, and 22℃) were synchronously investigated to conserve the in vitro shoots of R. simsii in the dark. An optimal storage protocol was thus determined based on the shoot survival rate and recovery growth from storage. The removal of cytokinin from the storage medium and manipulating the illumination condition were further investigated. After 8 mo of storage in a medium containing 3%(w v
-1) sucrose, 33.6 µM 6-(γ-γ- dimethylallylamino) purine (2iP) at 22℃/illumination, the shoots of R. simsii still maintained their recovery growth with no subculturing. The explant rooting capability and subsequent accli- matization were both unaffected.
Key words: azalea, micropropagation, osmoticum, sugar alcohol.
Liao YK, Yeh PW. 2020. In vitro culture method for the slow-growth storage of Rhododendron simsii Planch. shoots. Taiwan J For Sci 35(1):81-96.
緒 言
杜鵑花科(Ericacea)杜鵑花屬(Rhododendron L.)植物為著名的庭園景觀樹種,有大量且密集 炫目的花朵,花色繁多且花期長,成為廣泛栽 植的觀花植物,創造極大之商業產值。比利時 為全球主要盆栽杜鵑花的出口國,有資料顯示 其年產量曾達3,000萬株,產值高達4,820萬歐元 (Christiaens 2014),可見杜鵑花栽培市場之規 模。除了園藝的觀賞價值之外,亦有學者提取 杜鵑花所含之毒性物質或特殊化學成分之衍生
物,研究產製殺蟲劑及抗病毒藥物(Klocke et al.
1991, Prakash et al. 2007)。因此為因應市場需求 而大量繁殖時,為確保杜鵑花之觀賞性狀或萃 取成分之穩定,使用無性繁殖為較佳的手段。
目前多數栽培的杜鵑花是以營養系扦插的 方式繁殖,取其保有與母本相同性狀的優點。
但可能會遭遇採穗枝條難以取得、插穗不易發 根且繁殖速度緩慢等困擾,難以滿足市場需求 (Mao and Zhou 2003)。因此另闢以組織培養繁
殖來克服前述困難,其中又以德國之花卉市場 為一明顯案例(Winkelmann et al. 2006)。此外,
為因應觀賞花卉瞬變的流行趨勢,育成大量新 品種需藉用雜交育種法才得以實現。而杜鵑花 種間雜交育種時,常需輔以組織培養中的胚救 援(embryo rescue)技術才能協助雜交胚在敗育前 存活下來,以突破不同亞屬間雜交時常發生合 子形成後出現屏障(postzygotic barriers)之困擾 (Eeckhaut et al. 2007)。近年多倍體(polyploid) 育種法的盛行亦需配合組織培養技術方能執行 (Eeckhaut et al. 2006)。因此組織培養在杜鵑 花 商 業 性 的 繁 殖 上 , 具 有 相 當 貢 獻 。 除 此 之 外,某些特定的杜鵑花屬植物,因棲地特殊、
族 群 稀 少 且 遭 受 干 擾 , 因 而 列 入 瀕 危 須 受 保 育,亦有學者利用組織培養方法增殖其族群之 案例(Mao et al. 2011)。然而在組織培養操作過 程中,大量的培殖體需進行週期性的繼代培養 (subculture),相當耗費時間、人力及材料成本 並有提高污染的風險(Leifert et al. 1994),且重 複多次的繼代培養及受到植物生長調節劑的長 期刺激,有體細胞變異(somaclonal variation)的 顧慮(Rodrigues et al. 1998, Bairu et al. 2011),甚 至降低培殖體的增殖能力(Vujovic et al. 2012)。
為了去除這些不利其品質及性狀維持之影響,
可暫緩培殖體的生長速率並配合成本考量及商 業市場需求,發展能使之進行貯存的策略。
延緩生長貯存(slow-growth storage)是藉 調整組織培養環境條件以減緩培殖體之生長,
並延長其繼代週期,以達成中、短期貯存的目 標。此法透過減少繼代培養的次數能降低培養 的 成 本 , 並 能 穩 定 維 持 培 殖 體 優 良 之 商 業 性 狀,能保有品種育成後之價值,除此之外本法 亦能運用在植物種質資源保存的工作。在過去 二十年間,延緩生長貯存法已經成功應用在經 濟作物如馬鈴薯(Solanum tuberosum L.)及甘蔗 (Saccharum officinarum L.) (Withers et al. 1990, Watt et al. 2009)、果樹如蘋果(Malus pumila Mill.)及歐洲梨(Pyrus communis L.) (Hao and Deng 2003, Lukoseviciute et al. 2012)、藥用 植物(Rajasekharan et al., 2005)以及林木如白 楊(Populus tremula L.)與赤楊(Alnus glutinosa
L.) (Hausman et al. 1994, San Jose et al. 2015) 等。其優勢在於操作簡便、節約人力及設施的 支 出 , 且 貯 存 體 在 結 束 貯 存 期 後 , 大 多 可 立 即 進 入 增 殖 週 期 , 能 迅 速 配 合 商 業 市 場 淡 旺 季的需求以調整產量(Akdemir et al. 2010)。
惟目前在杜鵑屬植物中,僅有Verleysen et al.
(2005)曾以種原保存為目的進行過超低溫貯 存 法(cryopreservation)之操作,而延緩生長 貯 存 法 的 應 用 尚 未 見 探 討 。 本 研 究 以 唐 杜 鵑 (Rhododendron simsii Planch.)為例,進行延 緩生長貯存之試驗,測試不同培養條件之貯存 效果,以期提供杜鵑花屬植物實行該法時之參 考,作為杜鵑花植物延緩生長貯存之基礎。
材 料 與 方 法
一、唐杜鵑無菌材料之維持
本研究所使用之唐杜鵑芽體,係根據Liao and Chuang (2015)描述之方法誘導而來,並以微 體繁殖方式繼代維持之。繼代時以添加3%(w v-1) sucrose、33.6 µM 6-(γ-γ-dimethylallylamino) purine (2iP)及1% (w v-1) Difco Bacto agar,pH 5.2之Anderson培養基(Anderson 1984)為增殖 培 養 基 進 行 培 養 。 增 殖 培 養 環 境 則 設 定 溫 度 為22±1℃,光週期為16/8 h,以冷白螢光燈 (FL40D/38,東亞,台灣)提供30~50 μmol m-2 s-1 之光子通量,每4 wk 繼代一次。
二、延緩生長貯存處理
(一)不同滲調劑、貯存溫度及時間之影響 從繼代數次後唐杜鵑的多芽體中,取1.5 cm 長之單一芽體垂直植入內含貯存培養基之無菌培 養皿中(直徑90×高20 mm),每皿植入6個芽體。
以添加3% (87.64 mM)蔗糖之增殖培養基為對照 組(3Su),並使用不同滲調劑組合:2% (109.78 mM) mannitol (2Ma)、2% (109.77 mM) sorbitol (2So)、3% sucrose+2% mannitol (2Ma+3Su)及 3% sucrose+2% sorbitol (2So+3Su)取代增殖培 養基中之sucrose作為貯存培養基之碳源以進行 試驗。貯存期間的三種溫度條件分別由商用冰箱
的冷藏室(4℃)、生長箱(Incubator LM-570R, 利 政科技,新北市)(10℃)及原有組織培養生長室 (22℃)提供,芽體貯存2、4、6 及8個月,培養皿 以鋁箔紙包裝保持全程黑暗。
(二)貯存培養基中生長調節劑添加與否之影響 在上述試驗結束後,選擇其中兩個較佳的 貯存培養基,並於其中是否添加2iP為此階段試 驗之變因,使用與前一試驗相同的操作方式,
貯存8個月,全程黑暗。
(三)貯存期間光照之影響
以前述貯存試驗最佳之處理,測試貯存期 間施予光照(30~50 µmol m-2 s-1,16/8 h)或連續 黑暗之差異,貯存期為8個月。該光照條件與維 持唐杜鵑無菌材料所用者相同。
三、恢復培養之增殖活力試驗
上述三個貯存試驗於結束後,將處理後之 培殖體,直接移回至增殖培養基中進行增殖,
並於增殖培養環境下每4 wk繼代一次,使其恢 復正常的生長活力以誘導側芽發生。於恢復培 養8 wk後,紀錄唐杜鵑芽培殖體枯萎或褐化者 為死亡,無此現象者即為存活,並計算各處理 中存活個體數轉換為存活率。並將增殖之側芽 定義為:「於解剖顯微鏡下觀察培殖體側芽長 度大於0.1 cm者」,列為側芽計算之個體再進 一步量測其長度,以長度達1.5 cm者界定為大 芽,未達標準者為小芽,統計側芽中大芽百分 比做為增殖活力恢復之指標之一。
四、比較延緩生長貯存是否影響芽體發根及馴化 取50個單一芽體以最佳的貯存處理組合 (22℃、3% sucrose、不移除2iP且施予光照)貯存 8個月,對照組則為使用增殖培養基及增殖環境 持續繼代之芽體。經貯存8個月之芽體,需移至 對照組之培養條件中繼代培養兩次以恢復生長,
每次維持4 wk。誘導發根之方法依照Ho and Liao (2018)建議之流程,將此兩種處理後並增殖所得 之多芽體直接移至含有1.0 µM indole-3-butyric acid (IBA) 的1/2 Anderson培養基(發根培養基)
中,並以95 (直徑)×105 (高) mm之蘭花育苗培 養盒(Type CK-B, 清科企業,台灣)裝填100 ml的 發根培養基進行發根,試驗進行10 wk。此試驗 重複兩次,發根以芽體至少出現一不定根長度 超過0.2 cm為成功發根,記錄發根數量(roots per explant)、發根百分比及最長根之長度(cm)。
在1 0 wk 誘 導 發 根 結 束 後 將 已 發 根 之 單 株 芽 體 , 以10 (株)×10 (株)的密度移植入59 (長)×47.5B (寬)×16 (高) cm具孔洞的方型塑 膠籃中,填充純椰纖(coconut coir, Sanda, Sri Lanka)為馴化介質,並將此塑膠籃置於稍大 (47(長)×37.7(寬)×13 (高) cm)的無蓋無孔洞方 型外籃中,底部需使用4個塑膠培養皿(高度2.0 cm)將之墊高,外籃內注入1 L硫酸銅溶液(2.5 g/
L),外籃上方以透明壓克力板覆蓋保持籃內相對 濕度,隨馴化期的延續將壓克力板的覆蓋面積逐 漸縮小而露出縫隙,待4 wk之馴化期結束後,紀 錄小植株馴化的存活率。二種處理各100株,試 驗重複兩次,並評定小植株無枯萎或褐化者為馴 化成活之個體。
五、統計分析
測試不同滲調劑、貯存溫度及時間效應的 試驗,採裂區設計(split-plot design),將溫度處 理設為主區,並同時檢測滲調劑與時間之影響。
生長調節劑添加與否之試驗為完全逢機複因子試 驗(completely randomized factorial experiment)。
各次試驗中每個處理組合有6個樣本,試驗皆進 行兩次,共有12個樣本。記錄芽體增殖數量時,
將增殖側芽之大芽百分比經角度值轉換(arcsine transformation)後,進行統計分析。在前兩個貯 存試驗中分析延緩生長的處理條件對培殖體活 力的影響,同時包含各處理因子間的交感效應 (interaction)。資料以SPSS 12.0軟體進行變方分 析(ANOVA),若處理組合間有顯著差異,則以 (least significance difference (LSD) test)進行比較 各處理均值間差異之顯著性(p < 0.05)。第三個 貯存試驗與發根及馴化試驗則是以獨立樣本t檢 定,依查表t值進行分析比較,分別檢測光照與 否的貯存效果以及唐杜鵑芽體的發根與馴化是否 受到貯存處理之影響。
結 果
一、不同滲調劑、貯存溫度及時間之影響
(一) 貯存期間的觀察
觀 察 貯 存 期 間 培 殖 體 外 觀 , 降 低 貯 存 溫 度會使芽體生長受抑制,芽體在此環境下無任 何抽長及增殖的情形。而以22℃進行貯存,且 培養基中又含有蔗糖之三個處理,均出現黃化 (etiolation)及徒長的狀況(Fig. 1),表示該處理
於貯存期間無法抑制生長,惟經2So+3Su處理 者此徵狀較輕,顯示其受抑制生長效果較其他 兩者稍強一些。然這些徵狀於恢復培養2個月後 會逐漸消失且不影響培殖體恢復活力。其他單 獨使用非代謝性糖醇之處理者有褐化的情況發 生,經觀察2Ma的嚴重褐化並非受到貯存溫度 所影響,因三種貯存溫度皆會出現,可推測是 因滲調劑本身所導致。而2So僅有組合22℃時才 會產生褐化(Fig. 1)。
Fig. 1. Growth performance of Rhododendron simsii shoot explants stored for 6 mo in
culture conditions with a combination of osmoticum (Y axis) and temperature (X axis); see
text for osmoticum codes, bar = 0.5 cm.
(二) 貯存後芽體恢復生長時存活率比較 當貯存階段結束後,芽體於恢復培養時之 存活率皆隨貯存期的延長而下降,顯著受到時 間的影響。貯存期達6個月者,22℃的培養還 能使所有滲調劑處理尚能保持50%以上的芽體 存活,僅有經2Ma貯存者芽體全數死亡,而貯 存 培 養 基 為3Su者完全沒有死亡的芽體(Table 1)。但是當貯存期延長至8個月時,則是3Su及 2Ma+3Su仍有存活之芽體,其中又以3Su搭配 22℃之存活率(91.6%)最為優異,其餘者皆少 於50%,而由2Ma及2So貯存者,芽體全數死亡 (Table 1)。
(三) 貯存後芽體於恢復生長期之活力比較 在結束恢復培養後比較經不同貯存處理後 培殖體的活力,貯存溫度(為試驗設計之主區) 的改變,不影響芽體活力,不論是芽體再恢復 增殖的數目以及大芽比例都未呈顯著差異(Table 2)。不同貯存時間雖不影響芽體增殖,但大芽 率則因貯存期之延長逐漸降低,在比較滲調劑 處理之效應時,有添加蔗糖者芽體增殖能力的 恢復狀況均較優異(Table 2)。此外,由於貯存
溫度與時間有交感效應,芽體活力是以22℃貯 存6 mo為佳(Table 3),而溫度及滲調劑間的交 感效應使22℃與2So+3Su的處理組合能增殖最 多的芽體,但該組合產生之大芽比例卻非最高 (Table 4)。反而是22℃分別與3Su及2Ma+3Su 組合時,芽體數雖次於2So+3Su,但兩者的大 芽率表現則優於22℃及2So+3Su之搭配,又以 僅添加蔗糖(3Su)有最佳的大芽率(48.5%, Table 4)。若將增殖側芽數與大芽率相乘的結果進行 比較,22℃分別組合3Su及2Ma+3Su滲調劑,
能於恢復培養後獲得約2.8 (5.87×48.5%)及2.0 (6.06×32.4%)個大芽,而22℃組合2So+3Su時 則產生1.7 (9×19.6%)個大芽,明顯少於前述兩 者(Table 4)。
(四) 芽體貯存8個月之表現
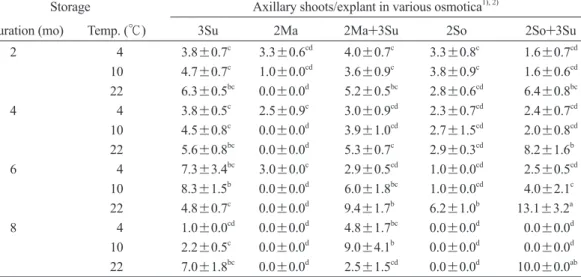
另本試驗中三個處理因子間亦出現交感效 應,經比較後在22℃及2So+3Su培養基中貯存 6個月的培殖體能產生13.1個芽體為最佳(Table 5)。大致上貯存的時間越短,溫度越高則越有 利 培 殖 體 增 殖 能 力 的 恢 復 , 但 若 考 量 貯 存 最 久(8個月)這個要件,最能維持芽體增殖能力
Table 1. Survival rate of Rhododendron simsii shoot explants, that previously underwent slow-growth storage in combination with osmoticum, temperature, and culture duration, and then incubated for 2 mo more to recover normal growth
Storage Survival (%) in various osmotica1) Duration Temp.
3Su 2Ma 2Ma+3Su 2So 2So+3Su
(mo) (℃)
2 4 83.3±11.2 33.3±14.2 50.0±15.0 100±0.0 33.3±14.2 10 100±0.0 8.3±8.3 83.3±11.2 50.0±15.0 83.3±11.2 22 10±0.0 0.0±0.0 83.3±11.2 83.3±11.2 83.3±11.2 4 4 91.6±8.3 33.3±14.2 33.3±14.2 75.0±13.0 41.6±14.8 10 100±0.0 0.0±0.0 58.3±14.8 41.6±14.8 58.3±14.8 22 91.6±8.3 0.0±0.0 83.3±11.2 75.0±13.0 83.3±11.2 6 4 33.3±14.2 8.3±8.3 66.6±14.2 16.6±11.2 16.6±11.2 10 75.0±13.0 0.0±0.0 41.6±14.8 16.6±11.2 25.0±13.0 22 100±0.0 0.0±0.0 75.0±13.0 50.0±15.0 66.6±14.2 8 4 16.6±11.2 0.0±0.0 50.0±15.0 0.0±0.0 0.0±0.0 10 41.6±14.8 0.0±0.0 33.3±14.2 0.0±0.0 0.0±0.0 22 91.6±8.3 0.0±0.0 33.3±14.2 0.0±0.0 8.3±8.3
1) See text for osmoticum codes.
Table 2. Split-plot experiment showing effects of storage conditions (source factors) on the follow-up recovery growth in micropropagated shoots of Rhododendron simsii
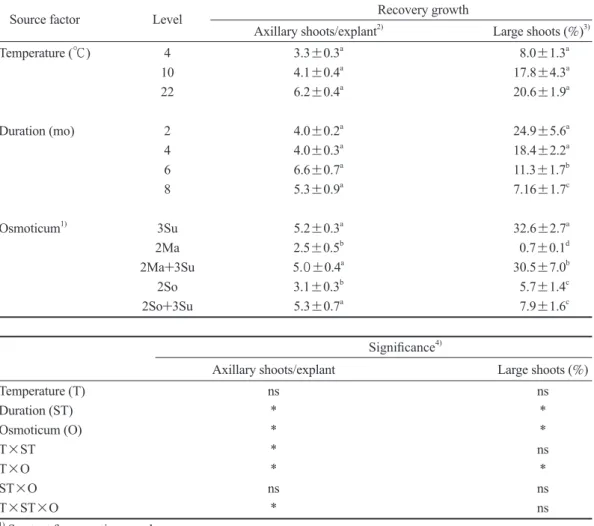
Source factor Level Recovery growth
Axillary shoots/explant2) Large shoots (%)3) Temperature (℃) 4 3.3±0.3a 8.0±1.3a
10 4.1±0.4a 17.8±4.3a
22 6.2±0.4a 20.6±1.9a
Duration (mo) 2 4.0±0.2a 24.9±5.6a
4 4.0±0.3a 18.4±2.2a
6 6.6±0.7a 11.3±1.7b
8 5.3±0.9a 7.16±1.7c
Osmoticum1) 3Su 5.2±0.3a 32.6±2.7a
2Ma 2.5±0.5b 0.7±0.1d
2Ma+3Su 5.0±0.4a 30.5±7.0b
2So 3.1±0.3b 5.7±1.4c
2So+3Su 5.3±0.7a 7.9±1.6c
Significance4)
Axillary shoots/explant Large shoots (%)
Temperature (T) ns ns
Duration (ST) * *
Osmoticum (O) * *
T×ST * ns
T×O * *
ST×O ns ns
T×ST×O * ns
1) See text for osmoticum codes.
2), 3) Axillary shoot production and large shoot formation (mean±standard error) corresponding to different levels
for each source factor where the mean values followed by different superscript letters significantly differ as de- tected by an LSD test at p < 0.05.
4) Source factor and their interactive effects on recovery growth where * represents a significant difference de- tected at p < 0.05; and ns a non-significant difference (p > 0.05).
者,為22℃組合3Su、2So+3Su以及10℃組合 2Ma+3Su這三個處理(Table 5)。而觀察貯存8 個月並經恢復培養2個月之芽體外觀(Fig. 2),
與其活力恢復之數據有一致之結果,仍能保有 增殖活力者包含3Su、2Ma+3Su及2So+3Su (在 22℃),皆能產生鮮綠色的芽體且生長良好,且 其外觀並無異常,但值得注意的是2So+3Su搭 配22℃處理的側芽以小芽居多(Fig. 2)。
二、貯存培養基中生長調節劑添加與否之影響 在 第 一 個 貯 存 試 驗 中 選 定 了 較 佳 的 條 件 (22℃組合3Su或2Ma+3Su滲調劑)後,本試驗 嘗試將原已添加在該二種貯存培養基中的細胞 分裂素2iP移除,並檢視其效果。移除2iP顯著 影響貯存的情形,不論添加何種滲調劑,當貯 存8個月後,移除2iP者芽體全數死亡。其過程 是 先 見 到 芽 體 抽 長 生 長 , 約 於 貯 存1個月後,
培 殖 體 才 因 缺 乏2iP而逐漸褐化死亡。而未移 除2iP者,滲調劑為2Ma+3Su時有58.3%的芽體 存活,而3Su的存活率有91.7%。在檢測培殖體 恢復活力的項目(增殖側芽數、大芽率)時,移 除2iP因芽體全數死亡故不討論(Table 6)。而比 較兩種滲調劑組合時,側芽增殖數雖不受其影 響,但經3Su貯存之芽體,在恢復生長時會增 殖較多大芽(Table 6)。此外,兩因子間對側芽 增殖及大芽之形成會有交感效應出現,使芽體
經添加3Su且未移除2iP的培養基貯存培養後,
於恢復期增殖最多的芽體(1.25個/explant)及形 成最佳大芽率(37.2%)。
三、貯存期間光照之影響
在移除2iP的試驗結果中顯示,貯存培養基 中必須添加細胞分裂素,而2Ma+3Su滲調劑與 3Su相比,並未使貯存效果提升。因此在本試 驗中,僅選擇添加2iP及使用3Su為滲調劑的貯
Fig. 2. Shoot explants of Rhododendron simsii that previously underwent 8 mo of storage in
culture conditions with a combination of osmoticum (Y axis) and temperature (X axis), and
then incubated for 2 mo more for recovery growth showing various extents of axillary shoot
production, bar = 0.5 cm.
存培養基進行光照與否的試驗。黑暗或光照對 於貯存唐杜鵑芽體在存活率、恢復期之芽體增 殖數及大芽率均未達顯著差異(Table 7),惟比 較光照者之均值均略高於黑暗貯存者。就貯後 的芽體外觀而言,未施予光照會使芽體出現黃 化的現象,但在貯存期間仍出現少量增殖的芽 體。此現象顯示要藉黑暗限制或延緩培殖體的 生長其效果微弱。而有光照者於貯存初期芽體 持續生長直至後期則漸緩慢,8個月後大部分被 貯存處理的單一芽體會呈褐色,但進入恢復培 養後仍可繼續恢復活力並增殖(Fig. 3)。
四、延緩生長貯存處理對於唐杜鵑芽體發根 及馴化之影響
為建立唐杜鵑完備的延緩生長貯存系統,
需進一步確認貯存後之芽體除能正常增殖外,
其 再 生 成 小 植 株 之 能 力 可 不 受 貯 存 過 程 所 影 響。經本研究中總結最佳貯存條件組合處理8個 月之芽培殖體,在完成兩次繼代(恢復期)後,進 入發根試驗。由於發根誘導採用低濃度(1 μM) IBA及長時間(10 wk)培養的方式進行,約7 wk 後可觀察到根的發生,而芽體在恢復期時已經 開始有側芽增殖,一旦由此多芽體生根之後開 始迅速增生,產生大量色澤呈鮮綠色的芽叢。
無論是否經過貯存,從其芽叢誘導而出的根系 外觀並無差異,兩者皆能產生白色、細長且呈 鬚狀之完整根系,但在對照組中會出現較多白 色或褐色之短根(< 1.0 cm)。若比較發根的表 現,兩者間在發根率、根數及最長根長的t檢定 值皆大於查表所得之t值,顯示貯存處理會影響
Fig. 3. Morphology of Rhododendron simsii shoot explants that had undergone 8 mo of storage either in (A) an illuminated condition (30~50 µmol m
-2s
-1, 16/8 h) showing normal axillary shoot (ns) proliferation or in (B) darkness exhibiting etiolated and spindling axillary shoot (es) growth, bar = 0.5 cm.
Table 3. Interactive effects exhibited by storage temperature and duration (from Table 2) showing various levels of axillary shoot production in micropropagated shoots of
Rhododendron simsii; with data collected at the end of recovery growthStorage Axillary shoots/explant 1)
temperature (℃) 2 mo 4 mo 6 mo 8 mo 4 3.11±0.70c 2.81±0.32cde 2.03±0.11def 1.51±0.10f
10 3.20±0.43c 3.00±0.50cd 2.98±0.21cd 1.78±0.13ef 22 4.65±0.62c 4.80±0.71b 6.06±0.65a 3.92±0.55c
1)Axillary shoot production (mean±standard error) followed by different superscript letters significantly differ as detected by an LSD test at p < 0.05.
芽體的發根效果,貯存後芽體的發根率及最長 根長都顯著較佳,而發根數量雖也有顯著差異 但差距較小(Table 8)。將已發根的芽叢各自拆 分成單株小植株後再進行馴化,其馴化後之存 活率並未受到貯存處理之影響,皆有超過98%
以上的高存活率(Table 8),且生長狀況良好。
討 論
本 研 究 第 一 個 貯 存 試 驗 中 , 以 滲 調 劑 為 最 主 要 影 響 培 殖 體 恢 復 培 養 之 因 子 , 同 時 在 芽 體 增 殖 及 大 芽 比 例 上 產 生 顯 著 差 異( Ta b l e 2)。在其他延緩生長貯存的研究中,低溫與黑 暗 的 適 當 搭 配 往 往 創 造 良 好 的 延 緩 生 長 效 果 (Negri et al. 2000, Cha-um and Kirdmanee 2007, Lukoseviciute et al. 2012),在本研究中該組 合確實有延緩生長之效,芽體在低溫中呈現綠 色,且無生長跡象(Fig. 1),但是後續芽體卻無 法恢復生長而死亡(Fig. 2, Table 1)。Engelmann (1991)提到原生於熱帶與亞熱帶的植物一般對 於 低 溫 較 為 敏 感 , 易 於 低 溫 時 遭 遇 寒 害 。 而 唐杜鵑屬映山紅亞屬(subgenus Tsutsusi) (de Schepper et al. 2001a),該亞屬被認為是非耐寒 之植物(de Schepper et al. 2001b)。對低溫敏感 (cold-sensitive)之物種面臨低溫逆境時,會發 生無法回復的細胞膜及光合器官之損傷,進而 使細胞死亡(Hodgson et al. 1987, Sharom et al.
1994)。又由於低溫貯存前往往會進行單一芽體 的切離操作,Lambardi and Ozudogru (2013)認 為此種機械逆境會於密閉的培養容器中,讓植 物體產生高濃度CO2及累積乙烯,當隨即又進行 低溫貯存時,驟減的溫度(24降至4℃)會使之無 法忍受低溫逆境之傷害。
除了降低溫度使貯存芽體容易死亡之外,
當檢驗貯存後芽體恢復生長活力時,裂區試驗 中做為主區的溫度變因,對芽體活力沒有顯著 影響(Table 2)。但是純就實務考慮,降低溫度 需要耗費較多能源,若溫度影響不顯著時,應 優先考慮使用耗能較低的貯存溫度(22℃)。除 此之外,當溫度與其他因子發生交感效應時,
檢驗芽體貯存後活力的試驗皆指出,各次組合
優 劣 分 析 中 最 佳 者 , 皆 使 用 到22℃這個貯存 條件(Tables 3-5),因此本研究仍以原本繼代 培養的溫度(22℃)作為最佳選擇。此結果與總 序天冬(Asparagus racemosus Willd.) (Thakur et al. 2015)、兩種胡椒屬植物(Piper aduncum L. and P. hispidinervum C. DC.) (da Silva and Scherwinski-Pereira 2011)及咖啡(Coffea spp.) (Bertrand-Desbrunais et al. 1991)的研究相近,
皆是使用原有之增殖溫度即可進行貯存。Gopal et al. (2002)也認為在高溫地區維持低溫貯存 環境(6-8℃)運作相當耗費能源,為降低貯存成 本,修改了馬鈴薯(Solanum tuberosum L.)的貯 存條件,使用24℃搭配適當的滲調劑組合亦可 成功執行。因此設法在原增殖溫度條件下進行 貯存,可為優先考慮之作法。
在 五 種 不 同 滲 調 劑 組 合 的 選 擇 上 , 單 獨 添 加 糖 醇 無 法 維 持 唐 杜 鵑 的 貯 存 , 其 中 以2%
甘露糖醇的影響最大(Table 1, 2)。甘露糖醇及 山梨糖醇因無法被大部分的植物所代謝利用,
常取之為貯存培養基中滲調劑的選項,以提高 培 養 基 的 滲 透 壓 。 但 在 許 多 案 例 中 添 加2~4%
甘露糖醇造成貯存後芽體生長勢的減弱而死亡 (Lata et al. 2010, da Silva and Scherwinski- Pereira 2011)。在馬鈴薯的研究中更觀察到高 濃 度 甘 露 糖 醇 所 導 致 的 芽 體 生 長 異 常(Lopez- Delgado et al. 1998)。不過以4%甘露糖醇則 可成功貯存圓錐石頭花(Gypsophila paniculate L.)的芽體6個月(Rady and Bekheet 2008)。本 試驗中2%山梨糖醇的貯存延續至6個月時,還 能 保 持50%的存活率且平均能增殖6個芽體,
若至8個月則芽體無存活(Table 1),但在盾葉 鬼臼(Podophyllim petatum L.) 8個月的延緩生 長期中卻能以相同濃度的山梨糖醇滲調劑維持 100%的存活率(Lata et al. 2010)。因此對單一 糖醇類滲調劑的適應,仍依植物而異。唐杜鵑 可能是無法利用此兩種非代謝性糖醇,造成貯 存培養基中持續的高滲透壓,進而導致滲透逆 境發生而使芽體死亡。
唐杜鵑貯存培養基中以蔗糖組合兩種醣醇 的處理,皆能提升其貯存後芽體的存活率(Table 1)。相似的滲調劑貯存條件也有應用在其它物
Table 4. Interactive effects exhibited by two source factors from Table 2 showing various levels of axillary shoot production and large shoot formation in micropropagated shoots of
Rhododendron simsii; with data collected at the end of recovery growthStorage Osmoticum1)
temperature 3Su 2Ma 2Ma+3Su 2So 2So+3Su (℃) Axillary shoots/explant2)
4 4.3±0.5c 3.4±0.3c 3.5±0.5c 2.9±0.5cd 2.1±0.4cd 10 5.2±0.66bc 0.5±0.5d 4.6±0.8bc 2.6±0.7cd 2.1±0.5cd 22 5.9±0.5b 0.0±0.0d 6.1±0.7b 3.5±0.4c 9.0±1.1a
Large shoot (%)2)
4 14.2±3.8b 1.9±1.1c 15.8±3.8b 6.2±2.1bc 2.1±2.1c 10 35.2±4.3a 0.0±0.0d 43.4±19.7a 8.4±3.6bc 2.0±1.3c 22 48.5±4.5a 0.0±0.0d 32.4±4.8ab 2.4±1.2c 19.6±3.5b
1) See text for osmoticum codes.
2) Axillary shoot production and large shoot formation (mean±standard error) followed by different superscript letters significantly differ as detected by an LSD test at p < 0.05.
Table 5. Interactive effects exhibited by three source factors from Table 2 showing various levels of axillary shoot production in micropropagated shoots of Rhododendron simsii; with data collected at the end of recovery growth
Storage Axillary shoots/explant in various osmotica1), 2)
Duration (mo) Temp. (℃) 3Su 2Ma 2Ma+3Su 2So 2So+3Su 2 4 3.8±0.7c 3.3±0.6cd 4.0±0.7c 3.3±0.8c 1.6±0.7cd 10 4.7±0.7c 1.0±0.0cd 3.6±0.9c 3.8±0.9c 1.6±0.6cd 22 6.3±0.5bc 0.0±0.0d 5.2±0.5bc 2.8±0.6cd 6.4±0.8bc 4 4 3.8±0.5c 2.5±0.9c 3.0±0.9cd 2.3±0.7cd 2.4±0.7cd 10 4.5±0.8c 0.0±0.0d 3.9±1.0cd 2.7±1.5cd 2.0±0.8cd 22 5.6±0.8bc 0.0±0.0d 5.3±0.7c 2.9±0.3cd 8.2±1.6b 6 4 7.3±3.4bc 3.0±0.0c 2.9±0.5cd 1.0±0.0cd 2.5±0.5cd
10 8.3±1.5b 0.0±0.0d 6.0±1.8bc 1.0±0.0cd 4.0±2.1c 22 4.8±0.7c 0.0±0.0d 9.4±1.7b 6.2±1.0b 13.1±3.2a 8 4 1.0±0.0cd 0.0±0.0d 4.8±1.7bc 0.0±0.0d 0.0±0.0d 10 2.2±0.5c 0.0±0.0d 9.0±4.1b 0.0±0.0d 0.0±0.0d 22 7.0±1.8bc 0.0±0.0d 2.5±1.5cd 0.0±0.0d 10.0±0.0ab
1) See text for osmoticum codes.
2)Axillary shoot production (mean±standard error) followed by different superscript letters significantly differ as detected by an LSD test at p < 0.05.
種的案例,包含杏樹(Prunus armeniaca L.) (2%
sucrose+1% mannitol) (Marino et al. 2010)、
馬鈴薯(2% sucrose+4% sorbitol) (Gopal and Chauhan 2010)與朝鮮薊(Cynara cardunculus L.) (2% sucrose+2% sorbitol) (Tavazza et al. 2015)
等。蔗糖與糖醇的搭配除了能提升培養基的滲 透壓外,蔗糖亦能於貯存期間做為碳源以維持 培殖體的生長,因此對於貯存後培殖體的恢復 生長較有助益。
通常短貯存期會有較佳的存活率,但若在
可降低存活率(犧牲部分材料)的前提下以盡量 延長貯存時間為考量時,則恢復生長時的生長 指標應同時評估。在滲調劑與溫度的交互作用 下,22℃搭配3%蔗糖(3Su)是此一貯存試驗中的 最適組合之一,雖其並未能有效延緩生長(Fig.
1),但其於所有組合中有最佳的恢復表現(Table 4)。且操作方式最為簡便,無需變動培養環境 條件,即能獲得良好的貯存效果,相當具有效 益。而此種高溫與蔗糖的搭配並非特例,也曾 使樹胡椒(P. aduncum)貯存期達6個月(da Silva and Scherwinski-Pereira 2011)。本研究在芽體 貯存期延長至8個月時,雖然有特定處理(3Su) 在恢復期的存活率仍高(91.6%,Table 1),但 是整體的分析顯示,在此恢復階段經貯存8個月 的芽體再長出有效大芽的能力開始下降(Table 2)。若進行商業生產,這個代表貯存8個月的 材料,可能就需要較長的時間恢復芽體增殖能 力,如此同樣會增加培養成本,因此本研究沒
有再測試更久的時間。但是從原本培養方式每 個 月 要 繼 代 一 次 , 改 進 到 可 以 貯 存8個月不繼 代,即代表有效減少了在組織培養環境中維持 植物材料的費用。
降 低 濃 度 或 不 添 加 植 物 生 長 調 節 劑 的 處 理 能 使 貯 存 體 達 到 延 緩 生 長 的 作 用 , 曾 於 貯 存 梨( P y r u s s p p . ) 的 部 分 品 種 時 獲 得 印 證 (Lukoseviciute et al. 2012)。然而本研究中將唐 杜鵑貯存培養基中的2iP移除是不可行的(Table 6)。同樣的情況在歐洲栗(Castanea sativa M.
cv. Montemarano)的貯存研究中也有相同結果 (Capuana and Lonardo 2013)。造成此結果的 原因可能與內源性的細胞分裂素有關,由於芽 培殖體並無根器官的存在,導致內源性細胞分 裂素的合成降低,若不在培養基中添加,則造 成頂端分生組織的細胞分裂減少、終止且壞死 (Bairu et al. 2009)。此外,貯存初期22℃的培養 環境使其生長速度並未受到延緩,也可能是加
Table 6. Factorial experiment showing effects of storage conditions, adding mannitol, and removing 6-(γ-γ-dimethylallylamino) purine (2iP) on the follow-up recovery growth of micropropagated shoots of Rhododendron simsii
Source factor Level Recovery growth
Axillary shoots/explant2) Large shoots (%)3)
Osmoticum
1)3Su 0.6±0.2
a18.6±6.8
a2Ma+3Su 0.4±0.2
a6.3±3.9
bPlant growth regulator + 2iP 1.3±0.2
a24.9±7.2
a-2iP 0.0±0.0
b0.0±0.0
b
Significance
4)
Axillary shoots/explant Large shoots (%)
Osmoticum (O) ns ns
Plant growth regulator (P) * *
O×P * *
1) See text for osmoticum codes.
2), 3) Axillary shoot production and large shoot formation (mean±standard error) corresponding to different levels
for each source factor where the mean values followed by different superscript letters significantly differ as detected by an LSD test at p < 0.05.
4) Source factor and their interactive effects on recovery growth where * represents a significant difference de- tected at p < 0.05 and ns a non-significant difference (p > 0.05).
速唐杜鵑芽體於貯存期全數死亡的原因之一。
貯存期間是否施加光照,對於唐杜鵑芽體 之存活及後續再生表現並無顯著差異。惟施予 光照者的再生狀況仍略較黑暗貯存者為佳(Table 7)。Ozudogru et al. (2009)認為低光強度或黑 暗的利用,能有效降低培殖體生理作用之速率 以減緩生長。但在其他的貯存案例上,如歐洲 栗(Capuana and Lonardo 2013)、蘋果屬(Malus Mill.) (Reed 1999)及梨屬(Pyrus L.) (Wilkins et al. 1988)等物種之貯存系統,則較偏好使用低光 強度而非完全黑暗的培養環境。Kubota (2005) 認為隨貯存期間的延長,在維持不繼代培養的 前提下,貯存培養基內的養分會逐漸被消耗殆 盡,在無法持續供給養分的情形下,此時若能 持續提供少量的光照,使培殖體維持碳平衡,
可能有助於其後之再生,惟此理論在本研究中 未造成顯著差異。
許 多 延 緩 生 長 的 研 究 顯 示 , 貯 存 處 理 並 不影響之後發根的表現(Romano and Martins- Loucao 1999, Trejgell et al. 2015, Rodrigues et al. 2018)。然而貯存後唐杜鵑芽體的發根結
果,與對照組(持續繼代者)相比呈顯著差異,
且以接受貯存者較佳(Table 8)。Giovannelli and Giannini (2000)的研究中利用成熟歐洲栗為培 殖體材料,在培養48個繼代週期(每一繼代週期 5~6 wk)後,其芽體增殖率、發根率及馴化成功 率皆顯著下降,顯示長期的培養可能會改變培 殖體之生理條件,使其表現不佳,這也是延緩 貯存要讓植物體避免長期接受繼代培養的原因 之一。
結 論
綜合本研究之結果,唐杜鵑芽體的延緩生 長貯存,是以22℃搭配添加3% sucrose及33.6 µM 2iP的貯存培養基並施予光照,能在無繼代 情形下維持8個月,且芽體後續能成功增殖、發 根轉化成完整植株。本研究利用最簡便之貯存 設備即可達成貯存之目的,對於具商業栽培價 值之杜鵑花植物而言,此法為一頗具潛力之培 養策略,可以利用本研究作為建立杜鵑花植物 延緩生長貯存法之先例。
Table 7. Survival rate of Rhododendron simsii micropropagated shoots after storage with (+) or without (-) illumination and their axillary shoot production/large shoot formation in follow-up recovery growth
Illumination Survival (%) Axillary shoots/explant Large shoots (%)
+ 91.7±8.30 7.0±1.5 21.5±4.4
- 83.3±16.7 5.4±0.9 14.8±4.0
t value1) --- 0.937 1.099
1) t values not greater than t(0.05/2, 22) = 2.07 represent a non-significant difference detected in the recovery growth where shoot production and large shoot formation were not affected by light manipulation.
Table 8. Rooting and acclimatization performance of Rhododendron simsii micropropagated shoots that previously underwent storage vs. routine subculturing (control)
Treatment origin Rooting (%) Root no./explant Longest root (cm) Acclimatization survival (%) Control 24.9±1.9 1.35±0.04 0.6±0.02 98.5±0.8
Storage 54.4±1.8 1.56±0.03 1.1±0.02 100.0±0.0
t value 11.201) 4.001) 12.251) 1.962)
1) t values greater than t(0.05/2, ∞) = 1.96 represent detection of a significant difference in analysis indicating an over- all better rooting performance obtained from shoots receiving storage.
2) t values not greater than t(0.05/2,18) = 2.101 represent detection of a non-significant difference in analysis indicat- ing that acclimatization survival was not affected.
引 用 文 獻