國 立 交 通 大 學
環境工程研究所
博
士
論
文
受污染地下水之複合式生物脫硝系統開發
Development of A Hybrid Biological System for the Removal of Nitrate from Polluted Groundwater
研 究 生:李茂松
指導教授:黃志彬 博士
受污染地下水之複合式生物脫硝系統開發
Development of A Hybrid Biological System for the Removalof Nitrate from Polluted Groundwater 研 究 生:李茂松 Student:Mao-Sung Lee 指導教授:黃志彬 Advisor:Chihpin Huang 國 立 交 通 大 學 環 境 工 程 研 究 所 博 士 論 文 A Thesis
Submitted to Institute of Environmental Engineering College of Engineering
National Chiao Tung University in partial Fulfillment of the Requirements
for the Degree of Doctor of Philosophy
in
Environmental Engineering December 2009
受污染
受污染
受污染
受污染地下
地下
地下
地下水之
水之
水之
水之複合式
複合式生物
複合式
複合式
生物
生物
生物脫硝系統開
脫硝系統開
脫硝系統開
脫硝系統開發
發
發
發
研究生:李茂松 指導教授:黃志彬 博士 國立交通大學環境工程研究所摘
摘
摘
摘 要
要
要
要
利用生物異營脫硝技術去除地下水硝酸鹽雖然是一種經濟有效的方 法,但處理水中含有殘餘有機化合物、消毒副產物和微生物,對於飲用水 仍有潛在風險。本研究結合多孔性擔體及薄膜生物處理技術,先利用生物 槽中之多孔性擔體進行生物異營脫硝處理,而多餘碳源、消毒副產物前驅 物和微生物,再利用薄膜生物反應槽(MBR)或生物擔體反應槽(BCR) 進行分解及過濾去除。本研究藉由改變生物脫硝程序之碳氮比及體積負 荷,探討去除硝酸鹽、亞硝酸鹽、溶解性有機碳(DOC)、溶解性微生物產 物(SMPs)、總菌落數、大腸桿菌、濁度及粒徑分佈之效能影響。而微生物 之行為表現,如脫硝菌活性、菌相、菌種鑑定及微生物增殖也都被詳細檢 討。此外比較不同 MBR 薄膜之過濾阻力及處理水消毒後副產物之差異;最 後篩選出 BCR 結合 MBR 之最適組合,設立模型設備於淨水場,進行長期 試驗,評估應用之可行性。除 DOC 之效能,明顯比 MBR 差;而當硝酸鹽氮體積負荷介於 0.25 ~ 0.5 kg/m3 d 之間,MBR 去除 SMP 之效能比 BCR 為佳,但在硝酸鹽氮體積負荷 0.75 kg/m3 d 時,兩者去除 SMP 之效能則相近;MBR 處理水之總菌落數及 大腸桿菌水質指標皆優於 BCR,而 MBR 處理水大腸桿菌及加氯消毒後之 總菌落數皆可符合飲用水管制標準;去除濁度與過濾介質及孔徑相關,優 劣順序為 MBR-G(UF)、MBR-K(MF)及 BCR(多孔性擔體) ;MBR-K 過濾總 阻力小於 MBR-G,而 MBR 過濾總阻力也會隨 MLSS 濃度下降而降低;脫 硝菌經過馴養後,最大氮氣產氣量增加 4 倍;採用 nirS 基因之引子將微生 物進行 DNA 萃取及聚合酶連鎖反應(PCR),顯示使用 nirS 引子可快速檢測 處理槽中脫硝菌之菌群;應用螢光染色技術於好氧生物系統,顯示 MBR 及 BCR 微生物活性具佳,而使用變性梯度凝膠電泳(DGGE),可發現 BCR-N、 MBR 及 BCR-C 有不同之優勢菌種;添加次氯酸鈉在處理水中進行消毒試 驗,其三鹵甲烷濃度低於 80 µg/L 符合飲用水之法規規定。 以薄膜生物脫硝技術進行淨水場模型廠試驗,硬體設置於已停用淨水 場,其硝酸鹽氮平均濃度約 40 mg/L,出水量達 18 ~ 36 CMD,造水率達 99.5%,無氧槽之脫硝效率達 85% 以上。新穎性複合式脫硝除碳系統,當 控制碳氮比為 1.5 及硝酸鹽氮體積負荷低於 0.8 kg NO3-N / m 3 d 時,能夠有
綜上所述,本研究開發處理受污染地下水之複合式生物脫硝系統,藉
由實驗室試驗及模型廠驗證,證實可有效去除硝酸鹽、亞硝酸鹽及分解多
餘碳源,降低消毒副產物之前驅物及微生物含量,進而提昇飲用水安全。
未來可應用於硝酸鹽含量高之表面水及地下水處理,亦可應用於含高硝酸
Development of A Hybrid Biological System for the Removal of Nitrate from Polluted Groundwater
Student: Maosung Lee Advisor: Chihpin Huang
Institute of Environmental Engineering National Chiao Tung University
Abstract
Heterotrophic denitrification is an economical means for removing nitrate from groundwater. However, residual organic compounds, disinfection by-products and microorganism contamination in treated water cause potential risks to drinking water supplies. To overcome these problems, system combines with Bio-Carrier Reactor (BCR) for heterotrophic denitrification and Membrane Bioreactor (MBR) for removal of residual organic compounds, precursor of disinfection by-products and microorganisms was studied. The effect on nitrate, nitrite, dissolved organic carbon (DOC), Soluble microbial products (SMPs), total bacteria count, coliforms, turbidity and particle size distribution were investigated by change of carbon to nitrogen ratio and volumetric loading in denitrification process. The performance of microorganisms, like denitrification bacteria activity, microbial community identification and microorganism growth were also studied. Filtration resistance and disinfection by-products were
The research results showed that the nitrate concentration in effluent was lower by controlling higher C/N ratio; however, the residual DOC concentration was higher too. The nitrate concentration in the MBR effluent was increased when the nitrate volumetric loading in the denitrification tank was increased. MBR showed better performance in DOC removal compared to BCR. Also MBR showed better removal of SMP when nitrate volumetric loading was in the range of 0.25 to 0.5 kg NO3--N/m3 d. However, the removal of SMP showed no
significant difference between MBR and BCR when nitrate volumetric loading was at 0.75 kg NO3
--N/m3 d.
Total bacteria count and coliforms in MBR effluent was lower than those in BCR. Also, Coliforms in MBR effluent and total bacteria count after chlorine addition could comply with drinking water quality standard. The removal of turbidity was related with filter media and its pore size. The performance was decreased in the order of MBR-G(UF), MBR-K(MF) and BCR(porous carrier). The total filtration resistance for MBR-K was lower than that for MBR-G. And, the total filtration resistance for MBR was decreased as the MLSS concentration was decreased.
The maximum nitrogen gas production after 24 hours increased four times after acclimation of denitrification bacteria. Using primer of nirS gene in extraction of Deoxyribonucleic acid (DNA) from microorganism and Polymerase Chain Reaction (PCR) showed that primer of nirS gene could detect denitrification bacteria in reactor rapidly. Application of fluorescence dyeing technology to aerobic biological system showed that MBR microorganism had
µg/L of drinking water standard after addition of sodium hypochlorite for disinfection.
A pilot plant combining BCR and MBR was installed in the field for long-term test. The groundwater used as influent containing 40 mg NO3
--N/L nitrate in average. During the long-term test, the treated water was controlled at 18 to 36 CMD, the water productivity was at 99.5% and the denitrification efficiency in anoxic tank was 85%. It shows that the effluent nitrate and nitrite were both removed effectively by controlling carbon to nitrogen ratio at 1.5 (g/g) and volumetric loading of nitrate nitroge below 0.8 kg NO3-N/m
3
d in the influent. It also showed that amounts of DOC and SMPs in membrane permeate are significantly lower than those in the treated water of denitrification reactor.
Therefore, a hybrid biological system was proposed in this study. Bench and pilot experiment results showed it could remove nitrate, nitrite, residual organic compounds, precursors of disinfection by-products and microbial products effectively to improve drinking water safety. Based on the research results, the process could be applied in the treatment of surface water and groundwater for nitrate removal. It was also highly potential for treatment of industrial wastewater with high nitrate concentration.
誌
誌
誌
誌 謝
謝
謝
謝
回首七年來在職進修博士學習之旅,幸蒙指導教授-黃志彬教授多年來 對於茂松之研究方向、觀念啟迪及架構匡正等指導與教誨,幫助我由原較 熟悉的物化技術擴展到生物處理領域,過程雖然辛苦,但一切值得,於此 獻上最深的敬意與謝意!亦要由衷的感謝袁如馨教授,論文寫作上不厭其 煩的指導及協助,讓論文更臻完備,獲益匪淺。論文口試期間,承蒙口試 委員李篤中教授、康世芳教授與吳志超教授對本論文的疏漏不足及謬誤之 處指正,使得本論文順利完成,在此謹深致謝忱。 工業技術研究院前後提供了碩博士兩次在職進修機會,豐富了我在流 體化床結晶與生物脫硝方面之學識,如此厚愛永銘於心;研究期間感謝環 安中心于樹偉主任及楊致行中心副主任、游惠宋組長、邵信主任、能環所 周珊珊組長、梁德明副組長、超博士、仁陽、誼彰、文源、啟鐘、玉惠、 淑惠、佩姍、玫君、得旭及明玉等同事之協助,以及張王冠經理有形無形 幫忙,洪俊雄教授與同事慧玲和幸德在分子生物技術之開導;同學文彬、 惠玲、育俊及學妹雅茹、于婷在口試期間之幫忙與鼓勵一併感謝。 另外,更應感謝與我結婚恰滿二十週年的妻子-淑芬,女兒亦平及知 芸,在這段時間給我最大的支持與鼓勵,讓我無後顧之憂,順利完成學業。 最後,僅將此論文獻給我的家人、兄弟姊、親戚、同事與朋友、以及在天 堂的父親與母親,因為有您使我有力量面對一切的困難與挑戰,謝謝您們,目
錄
目
錄
目
錄
目
錄
中文摘要 ……….... i 英文摘要 ……….... iv 誌謝 ……….... vii 目錄 ……….... viii 表目錄 ……….... xi 圖目錄 ……….... xii 第一章 導論……….... 1 1.1 緣起……… 1 1.2 研究目的……….... 3 1.3 論文架構……….... 4 第二章 文獻回顧……….... 7 2.1 生物脫硝……….... 8 2.1.1 異營菌及自營菌脫硝………... 8 2.1.2 影響脫硝作用之因素………... 10 2.1.3 水中硝酸鹽脫硝處理………... 13 2.1.4 微生物菌相分析………... 14 2.2 生物擔體反應槽(BCR)之特性與功效………….…..………... 15 2.3 薄膜生物反應槽(MBR)之薄膜功能…... 17 2.4 建構生物擔體與薄膜之複合處理系統……….... 20 2.5 探討飲用水水質安全性….………... 22 第三章 研究方法……….... 24 3.1 材料……… 24 3.2 生物擔體脫硝處理……… 26 3.2.1 生物脫硝處理之實驗裝置……... 27 3.2.2 脫硝菌之活性測試……….. 30 3.2.3 改變操作參數之實驗規劃... 31 3.2.4 脫硝菌性質及生物擔體微生物吸附量……….……... 32 3.3 薄膜生物及生物擔體去除有機碳效能及微生物行為差異之 比較... 33
3.3.5 三鹵甲烷生成潛能(THMFP)檢測評估…... 45 3.4 模型廠含硝酸鹽地下水之複合式生物脫硝處理系統…….... 46 3.4.1 脫硝除碳薄膜生物系統之模型廠裝置………... 46 3.4.2 系統啟動與操作……….……... 50 3.5 實驗分析方法………... 52 3.5.1 分析設備………... 52 3.5.2 水質分析方法………... 54 3.5.3 物理參數之量測………...….... 61 第四章 水中硝酸鹽之生物擔體脫硝處理……… 62 4.1 脫硝菌之活性……….... 62 4.2 改變碳氮比對生物脫硝影響……….... 66 4.3 改變硝酸鹽氮體積負荷對生物脫硝影響……….……... 68 4.4 生物擔體之微生物吸附量………... 74 4.5 生物擔體之微生物菌相觀測…... 76 4.6 小結…... 79 第五章 薄膜生物及生物擔體去除有機碳效能及微生物行為差異之 比較... 80 5.1 除碳槽在不同體積負荷下之處理效能……….... 80 5.1.1 對去除 SMPs 值和 DOC 之影響……… 80 5.1.2 對去除 DOC 和 SUVA 值之影響……….…… 82 5.1.3 對去除總菌落數及大腸桿菌之變化... 83 5.1.4 對去除濁度及粒徑分佈之效果差異... 87 5.1.5 處理水經加氯消毒後之三鹵甲烷生成潛能……….………. 91 5.2 除碳槽在微生物菌相表現上之行為差異……….... 95 5.2.1 菌相觀測……….. 95 5.2.2 螢光染色技術應用於微生物 RNA 及 DNA 之比較………. 98 5.2.3 應用分子生物技術之菌種鑑定……….. 103 5.3 不同 MBR 模組之過濾阻力比較………...………… 111 5.4 小結…... 114 第六章 模型廠含硝酸鹽地下水之複合式生物脫硝處理系統... 116 6.1 地下水水質特性……….... 116
6.6 模型廠處理水經加氯消毒後之三鹵甲烷生成潛能... 127 6.7 小結…... 129 第七章 結論與建議……….... 130 7.1 結論……….…... 130 7.2 建議……….... 131 參考文獻 ……….... 133 簡歷 ……….... 142
表
表
表
表 目
目
目
目 錄
錄
錄
錄
表 2-1 各種薄膜生物型態進行原水脫硝處理……….. 19 表 3-1 實驗室規模原水之試驗操作條件……….. 29 表 3-2 污泥中微生物 PCR 反應之引子與其序列………. 41 表 3-3 污泥中微生物 PCR 之條件………. 41 表 3-4 污泥中脫硝菌 PCR 反應之引子與其序列………. 42 表 3-5 污泥中脫硝菌 PCR 之條件………. 42 表 3-6 DNA 序列長度對應所需之膠體濃度………. 43 表 3-7 南投新街淨水場地下水之模型設備脫硝槽試驗操作條件…….. 51 表 3-8 水質分析方法……….. 54 表 3-9 THMs 氣提補集器之操作條件………... 58 表 3-10 氣相層析儀分析 THMs 之操作條件……….. 58 表 4-1 不同脫硝槽硝酸鹽氮體積負荷之監控條件(固定碳氮比 1.5)….. 71 表 4-2 多孔性生物擔體之微生物吸附量……….. 75 表 5-1 MBR 及 BCR 處理水隨不同硝酸鹽氮體積負荷之總菌落數及 腸桿菌變化………... 84 表 5-2 THM7消毒副產物各物種之面積及對應之濃度….……… 94 表 5-3 水樣 TOC、添加氯濃度、THMinstant、THM7、7 天後餘氯濃度 及 THMFP……… 94表 5-4 DNA 及 RNA 於 Acridine Orange 作用下之變化……….. 98
表 5-5 BCR-N, BCR-C 及 MBR 微生物之 DNA 分析 ……….. 103 表 5-6 BCR-N 程序之優勢菌種鑑定結果………. 108 表 5-7 MBR 程序之優勢菌種鑑定結果………. 109 表 5-8 BCR-C 程序之優勢菌種鑑定結果………. 110 表 6-1 寬口井之地下水水質分析……….. 117 表 6-2 一號深井之地下水水質分析……….. 118 表 6-3 比較 MBR 處理前後之 DOC、蛋白質和多醣類濃度變化…….. 125 表 6-4 模型廠 MBR 處理前後 DOC 與 THMFP 之關係………. 128
圖
圖
圖
圖 目
目
目
目 錄
錄
錄
錄
圖 1-1 研究架構與步驟……….. 6 圖 3-1 PU 材質多孔性生物擔體相片(單位:公分)……….. 25 圖 3-2 兩種不同之 MBR 薄膜型態……… 26 圖 3-3 實驗室規模之水中硝酸鹽生物脫硝處理流程……….. 28 圖 3-4 實驗室規模之薄膜及生物擔體除碳處理流程……….. 34 圖 3-5 實驗室規模之複合式生物脫硝除碳處理流程實體裝置……….. 35 圖 3-6 EPSs 和 SMPs 之區分………. 37 圖 3-7 模型廠之地下水薄膜生物脫硝處理流程……….. 48 圖 3-8 模型廠之地下水生物脫硝實體裝置……….. 49 圖 3-9 模型廠之地下水薄膜生物除碳實體裝置……….. 49 圖 3-10 四種 THMs 物種 (40 µg/L)之氣相層析圖………. 59 圖 4-1 馴養前後污泥隨不同食微比於 24 小時後之氮氣產氣量變化…. 64 圖 4-2 脫硝菌產氣之成分分析……….. 65 圖 4-3 MBR-K 及 MBR-G 處理水隨不同碳氮比之 DOC 及硝酸鹽氮濃 度變化……….. 67 圖 4-4 不同脫硝槽硝酸鹽氮體積負荷對處理水硝酸鹽氮和亞硝酸鹽 氮之影響(C/N=1.5)………. 72 圖 4-5 不同脫硝槽硝酸鹽氮體積負荷對處理水硝酸鹽氮和亞硝酸鹽 氮之影響(C/N=3)……… 72 圖 4-6 不同碳氮比脫硝除碳系統之脫硝槽體積負荷對應於 MBR 除碳 槽體積負荷……….. 73 圖 4-7 體積負荷為 0.25 kg NO3-N / m 3 d 之脫硝槽微生物菌相(400X).. 77 圖 4-8 體積負荷為 0.25 kg NO3-N / m 3 d 之脫硝槽微生物菌相(1000X) 77 圖 4-9 體積負荷為 0.5 kg NO3-N / m3 d 之脫硝槽微生物菌相(400X).... 78 圖 4-10 體積負荷為 0.75 kg NO3-N / m 3 d 之脫硝槽微生物菌相(400X)... 78 圖 5-1 MBR 及 BCR 隨不同體積負荷下之 SMPs 及 DOC 水質差異….. 81圖 5-2 MBR 及 BCR 隨不同 TOC 體積負荷之 SUVA 值及 DOC 濃度 變化... 82 圖 5-3 體積負荷為 0.5 kg NO3-N / m 3 d 之 MBR 及 BCR 處理水總菌 落數及大腸桿菌群……….. 85 圖 5-4 MBR 及 BCR 處理水隨不同 TOC 體積負荷之濁度變化………. 88
圖 5-7 MBR 及 BCR 處理水隨不同體積負荷之三鹵甲烷生成潛能及 總有機碳之濃度差異……….. 92 圖 5-8 (A)MBR-G (B)MBR-K (C)BCR 之三鹵甲烷物種之層析圖….… 93 圖 5-9 好氧槽、MBR-K 及 MBK-G 處理水經加氯消毒後之三鹵甲烷 生成潛能 (碳氮比 1.5 及體積負荷 0.64 kg NO3-N / m3 d)……… 94 圖 5-10 MBR 除碳槽在體積負荷 146 g TOC / m3 d 時之菌相(400X)…… 96 圖 5-11 MBR 除碳槽在體積負荷 266 g TOC / m3 d 時之菌相(400X)... 96 圖 5-12 BCR-C 除碳槽在體積負荷 67 g TOC / m3 d 時之菌相(1000X).... 97 圖 5-13 BCR-C 除碳槽在體積負荷 155 g TOC / m3 d 時之菌相(400X)…. 97 圖 5-14 MBR 槽內微生物(a)位相差相片與(b)螢光相片………... 100 圖 5-15 BCR-C 槽內微生物(a)位相差相片與(b)螢光相片……… 101 圖 5-16 BCR-N 槽內微生物(a)位相差相片與(b)螢光相片……… 102 圖 5-17 BCR-N, BCR-C 及 MBR 微生物採用 968F-GC 和 1392R 引子之 聚合酶連鎖反應……….. 104 圖 5-18 BCR-N, BCR-C 及 MBR 脫硝菌採用 nirS 基因引子之聚合酶連 鎖反應……….. 104 圖 5-19 BCR-N, BCR-C 和 MBR 微生物之 DGGE 結果與 NCBI 資料庫 進行比對後相似度最高之優勢菌種……….. 107 圖 5-20 實驗室規模 MBR-K 及 MBR-G 隨操作時間之薄膜通量變化.... 112 圖 5-21 實驗室規模 MBR-K 及 MBR-G 隨操作時間之薄膜總阻力變化 113 圖 6-1 模型廠 MBR-K 及 MBR-G 處理水於不同碳氮比隨操作時間之 硝酸鹽氮及 DOC 濃度變化……… 119 圖 6-2 模型廠各處理單元在不同操作時間之硝酸鹽氮濃度變化…….. 121 圖 6-3 模型廠進出流水隨不同操作時間之 pH 值及濁度變化………… 122 圖 6-4 位相差顯微鏡觀察微生物菌相(100X)……… 123 圖 6-5 位相差顯微鏡觀察微生物菌相(400X)……… 124 圖 6-6 比較 MBR-K 和 MBR-G 實驗室與模型廠規模之 DOC 與 SMPs 去除率……….. 126 圖 6-7 模型廠 MBR-K 和 MBR-G 處理水之 DOC 及 THMFP 濃度差異 128
第一章
第一章
第一章
第一章 導
導
導
導 論
論
論
論
1.1 緣起緣起緣起緣起 西元 1940 年學者研究發現水中含有過量硝酸鹽時,會使嬰兒產生變性 血色蛋白質血症(Methemoglobinnema)之疾病,通稱為藍嬰症(Blue baby disease),美國公共衛生協會自西元 1962 年起建議給水硝酸鹽氮的濃度不得 超過 10 mg/L,而國內依據行政院環境保護署於西元 2005 年 5 月 30 日修正 通過的飲用水之水質標準,飲用水含硝酸鹽氮之濃度限制為 10 mg NO3-N/ L (44.3 mg NO3- / L),因此若飲用水水源含硝酸鹽水體過量時,必須調整硝 酸鹽濃度在標準值內,以確保飲用水之品質與安全。 由於台灣中南部農業密集,大量氮肥造成飲用水水源含過量硝酸鹽, 由於飲用水中含過量硝酸鹽,直接影響飲用水之品質,甚至於超過行政院 環境保護署之飲用水含硝酸鹽氮濃度限制,故處理飲用水中過量硝酸鹽之 濃度以符合國內飲用水之標準,已為現階段刻不容緩之研究議題。 目前有許多技術可應用於去除水中之硝酸鹽,這些技術原則上可分為 兩大類:物理化學處理程序(如離子交換、逆滲透與電透析)與生物處理程 序,各有其優缺點。物理化學處理程序通常僅將硝酸鹽分離,處理後之飲同時具備去除硝酸鹽及省能源之優點,共分為自營菌脫硝(或稱脫氮)及異營 菌脫硝處理兩種方法,自營菌脫硝處理技術優點為處理水中未產生殘餘碳 源及其他污染物,其缺點為處理速率較低,自然界自營菌種量少取得不易, 且於處理過程中需添加之能量,若為氫氣本身具自燃性會有爆炸疑慮,且 於水中溶解度低、利用率低及耗費能源之問題,而如為元素硫需要相轉換 耗能費藥或直接使用還原性硫化物,不論是元素硫或還原性硫化物於脫硝 過程中,若控制不當皆有產生臭味風險,故於實廠運用時,較難為鄰近居 民所接受;異營菌脫硝處理技術優點為處理速率較高,自然界菌種多取得 較易,缺點為在脫硝處理過程中殘餘碳源、消毒副產物之前驅物及微生物, 需進一步處理與解決,故異營菌生物脫硝處理技術通常運用於一般之廢水 處理,若要運用於水質標準較高之飲用水處理,需結合其他技術進一步開 發設計,方能有效改善飲用水水質,達行政院環境保護署之飲用水標準。 因此本研究提出複合式生物脫硝系統,該系統除能調整水中之硝酸鹽 濃度達飲用水標準外,且在脫硝處理過程中產生之污染物亦能有效分解及 過濾。本研究主要為結合多孔性擔體及薄膜生物處理技術,利用生物槽中 之多孔性擔體進行異營菌生物脫硝處理,而多餘碳源、消毒副產物前驅物 和微生物等污染物,則利用薄膜生物反應槽(Membrane bioreactors, MBR)
有機碳(Dissolved organic carbon, DOC)、溶解性微生物產物(Soluble Microbial Product, SMPs)、總菌落數、大腸桿菌、濁度及粒徑分佈之效能影 響;而微生物之行為表現,如脫硝菌活性、菌相、菌種鑑定、微生物吸附 量也都被詳細檢討;此外比較不同 MBR 薄膜模組之過濾阻力及處理水消毒 後副產物之差異。最後篩選出 BCR 結合 MBR 之最適組合,設置模型設備 於淨水場,進行長期試驗,評估其可行性。 1.2 研究目的研究目的研究目的研究目的 飲用水與廢水脫硝主要差異性為處理水質需要符合標準不同,硝酸鹽 氮濃度限值飲用水是 10 mg/L,而廢水排放限值為 50 mg/L,技術導向亦不 同;由於自營菌生物脫硝速率通常較慢,因此處理水中之硝酸鹽污染物, 採用異營菌生物脫硝之方式進行,但此種方法需要外加有機碳源,產生殘 餘碳源及微生物污染之問題,如何提供一安全有效之處理方式,對系統之 實際應用上相當重要,需要較佳之後處理設計,以確保飲用水水質安全。 本研究先於實驗室進行模擬地下水薄膜生物脫硝可行性之研究,再放 大 至 模 型 廠 驗 證 , 進 行 應 用 性 評 估 , 最 後 依 三 鹵 甲 烷 生 成 潛 能
(Trihalomethane formation potential, THMFP)等指標評估飲用水質安全,主要
試驗,以高活性脫硝菌進行脫硝試驗,改變碳氮比及體積負荷,並討論
生物擔體上微生物吸附量及菌相分析。
(2) 比較 MBR 及 BCR 多餘有機碳之處理效能及微生物行為變化之差異,探
討去除 DOC、SMPs、比 紫 外 線 吸 光 度 (Specific ultraviolet absorbance,
SUVA)、總菌落數、大腸桿菌、濁度及粒徑分佈之對有機碳之處理效能 影響;不同 MBR 模組過濾阻力及處理水加氯消毒後 THMFP 之差異, 以及微生物菌相觀測、螢光染色技術應用、菌相分析及菌種鑑定等。 (3) 以實驗室所建立之操作條件,進行模型廠含硝酸鹽地下水之複合式生物 脫硝處理模型廠驗證,並檢測處理水中硝酸鹽、亞硝酸鹽、DOC、SMPs 及 THMs 之飲用水水質,是否達法規標準。 1.3 論文架構論文架構論文架構 論文架構 本論文之架構與研究步驟如圖 1-1 所示,分為第一章緣起和目的;第二 章相關理論基礎,文獻回顧包括生物脫硝影響因子、水中硝酸鹽脫硝處理、 MBR 及 BCR 之除碳系統、建構生物擔體與薄膜之複合處理系統及飲用水 水質安全;第三章研究方法,探討使用材料、方法、分析及裝置;第四章 研討水中硝酸鹽之生物擔體脫硝處理,測定脫硝菌活性、改變碳氮比及硝
差異,探討 DOC 、SMPs、SUVA、總菌落數、大腸桿菌、濁度、粒徑分佈、
不同 MBR 模組之過濾阻力、THMFP、菌相觀測、螢光染色、菌相分析及
菌種鑑定;第六章為模型廠含硝酸鹽地下水之複合式生物脫硝處理系統,
以實驗室操作條件進行模型廠驗證,探討系統穩定性;最後第七章提供結
文獻蒐集分類整理 建構複合式生物脫硝系統之 理論基礎 第五章薄膜生物及生物擔體去除有機 碳效能及微生物行為差異之比較 ﹡DOC和SMPs ﹡DOC和SUVA ﹡總菌落數及大腸桿菌 ﹡粒徑分佈及濁度 ﹡THMFP ﹡螢光染色、菌相分析及菌種鑑定 ﹡不同MBR模組之過濾阻力 實驗室規模 測試 模型廠 驗證 第四章水中硝酸鹽之生物擔體脫硝處理 ﹡脫硝菌活性測定 ﹡改變碳氮比和硝酸鹽體積負荷之操作參數 對生物脫硝影響 ﹡生物擔體微生物吸附量及菌相分析 第六章模型廠含硝酸鹽地下水之複合式 生物脫硝處理系統 ﹡模型廠環境背景 ﹡實驗室操作條件之模型廠驗 ﹡模型廠長期試驗 脫硝理論發展 與系統建構
第二章
第二章
第二章
第二章 文獻回顧
文獻回顧
文獻回顧
文獻回顧
本研究主要是結合 BCR 及 MBR 系統進行水中硝酸鹽之脫硝除碳,先 於 2.1 章節回顧生物脫硝,有關生物擔體反應槽之特性與功效敘述於 2.2 章 節,接著於 2.3 章節是論述薄膜生物反應槽之薄膜功能,2.4 章節是建構生 物擔體與薄膜之複合處理系統,最後 2.5 章節為探討飲用水水質安全性。 水中硝酸鹽生物脫硝處理系統前半部為多孔性生物擔體之脫硝槽,後 面為 MBR 及多孔性生物擔體之除碳槽;硝酸鹽先經過缺氧脫硝處理,殘餘 之碳源、副產物前驅物和微生物再利用好氧環境薄膜及多孔性擔體做進一 步去除。因此處理受污染硝酸鹽水源生物脫硝需要結合缺氧和好氧兩個階 段,無法直接以 MBR 進行脫硝除碳,而於生物反應槽添加多孔性擔體之目 的為提高表面積供微生物附著和增殖,以累積大量生物膜微生物,有助於 去除各種污染物及提昇有機物降解效能。 多孔性擔體的優點包括(1)多孔性擔體屬開放性孔洞,有助於穩定水流 流況,提高懸浮固體物攔截之機會; (2)多孔性擔體提供較大之表面積供微生 物附著及增殖,可累積大量生物膜微生物,有助於各種污染物之去除; (3) 多孔性擔體上成長大量微生物,讓生物反應槽比傳統活性污泥槽有較高負效防止濾材之壓密現象,可大幅降低上流式生物濾床之水頭損失並節省動 力成本。 MBR 槽內曝氣之功能是提供掃流作用,以減少薄膜阻塞及提供喜氣污 泥分解有機物所需的氧氣量,同時考量出水水質與安全性,故採用 MF 或 UF 商業化薄膜進行試驗。 2.1 生物生物生物脫硝生物脫硝脫硝 脫硝 2.1.1 異營菌及自營菌脫硝異營菌及自營菌脫硝異營菌及自營菌脫硝異營菌及自營菌脫硝 脫硝技術(硝化脫硝)是廢水高級處理技術之一,Rogalla et al. (1992)指出
1964 年英國人 Downing & Painter 利用活性污泥處理將氨氮轉化成為硝酸
鹽,爾後經過 10 年之研究發展,藉由生化反應在缺氧環境進行脫硝作用。 脫 硝 菌 依 其 能 量 獲 得 不 同 , 可 分 為 異 營 菌 (Heterotrophs) 和 自 營 菌 (Autotrophs)兩類,其中異營菌以有機物如甲醇、乙醇及醋酸等為能量來源, 而自營菌則以無機物如氫氣和元素硫為能量來源及以二氧化碳為碳源。異 營性脫硝菌多適合於缺氧環境下進行代謝,以硝酸鹽或亞硝酸鹽為電子接 受者,而將硝酸鹽或亞硝酸鹽還原成氣態氮。例如使用醋酸當碳源(Drtil et
5 CH3COOH + 8 NO3 + 3 H+ → 10 HCO3 + 4 N2(g) + 4 H2O (2) 每去除 1 kg 硝酸鹽氮理論量需要 1.32 kg 碳,若加上細胞內呼吸作用所 需要的碳量,推估碳氮比約 1.5。
自營菌如 Micrococcus 及 Thiobacillus 分別以氫氣(Kurt et al., 1987)及 元素硫(Mateju et al., 1992)為能源,其如反應方程式(3)和(4) 2 NO3 + 5 H2 → 4 H2O + 2 OH + N2 (3) 理論上每去除 1 kg 硝酸鹽氮需要 0.357 kg 氫氣,實際上的需要量會略 高於理論值,約為 0.38 ~ 0.4 kg。 10 NO3 + 11 S0 + 4.1 HCO3 + 0.5 CO2 + 1.71 NH4 + + 2.54 H2O → 0.92 C5H7NO2 + 11 SO42- + 5.4 N2 + 9.62 H+ (4) 理論上每去除 1 kg 硝酸鹽氮需 2.55 kg 之元素硫(Mateju, et al., 1992)。
2.1.2 影響脫硝作用之因素影響脫硝作用之因素影響脫硝作用之因素影響脫硝作用之因素
脫硝反應受到許多環境因素影響,常見的影響因子如下:
(1) pH 值
脫硝作用速率和 pH 值相關,最適合 pH 值範圍為 6.5 ~ 7.5,且以 pH 7
時最佳(Metcalf & Eddy, 1991),當 pH 小於 6 或大於 8 時,脫硝速率將會受
到抑制。脫硝反應過程,由 Drtil et al. (1995)和 van Rijn et al. (2006)之式(1)
和式(2)得知反應物將會產生鹼度,而使得 pH 值上升。
(2)溫度
溫度對脫硝作用亦有影響,其影響關係式如下(Metcalf & Eddy, 1991):
U’DN = UDN × 1.09 (T-20) × (1- DO) (5) 其中 U’DN:總脫硝速率 UDN:比脫硝速率(lb NO3-N / lb MLVSS day) T:廢水溫度(℃) DO:廢水中之溶氧濃度(mg/L) 脫硝菌對溫度的適應範圍為 0 ~ 60℃,最適溫度則為 24 ~ 40℃,若於 低溫(5 ~ 10℃)下亦可進行,但速率較慢。 (3)溶氧
作用時將受到抑制,當溶氧濃度達 0.2 % 飽和溶液時,抑制作用最大。溫
度對脫硝作用之影響關係式,式(5)顯示當溶氧濃度接近 1 mg/L 時,脫硝速
率線性下降至零。但若將氧移除,脫硝菌既使在沒有氮氧化物存在之環境
下,亦能在 40 分鐘到 3 小時恢復其還原酵素系統(Payne et al., 1971)。
(4)氧化還原電位(Oxidation reduction potential, ORP)
溶氧濃度當低於偵測極限時,應改用量測敏感度較強的 ORP 當控制參
數,進行脫硝反應(Zhao et al., 1999; Fuerhacker et al., 2000)。脫硝反應(NO3 - → NO2 → NO → N2O → N2)每一個步驟皆屬於氧化還原反應,故藉由 量測 ORP 之變化,即可判斷脫硝作用是否發生。氧化還原電位與去除碳氮 化合物間的關係,當 ORP 電位為零 mv 時,表示硝酸鹽進行脫硝作用 (Charpentier et al., 1987)。 (5)碳氮比 因脫硝菌屬於異營菌,故將硝酸鹽還原成氮氣時需要有機碳存在,而 有機碳為脫硝菌主要之能量來源,因此有機碳的分解難易將影響脫硝速 率。脫硝速率受碳源種類影響,在缺氧反應階段,使用醋酸鈉比使用甲醇 或葡萄醣之脫硝速率較快,其他依序為甲醇和葡萄醣(Tam et al., 1992)。通 常 COD/NO3-N (w/w) 比值為 3 ~ 6 時,才能有效將硝酸鹽還原成氣態氮
探討脫硝反應之影響因子及最適條件為 pH 6.5 ~ 7.5、溫度 24 ~ 40
℃、溶氧濃度小於 0.13 mg/L 及碳氮比(BOD / NOx – N)通常大於等於 2.3
(Orhon & Artan, 1994)。Walter et al. (2005)論述影響硝化和脫硝因素,包括
水力(雷諾數)、pH 值、基質濃度和生物膜之污泥齡。Wang et al. (2009)探討 脫硝最適操作條件,當進流水硝酸鹽氮濃度約 100 mg/L,控制 pH 為 7 ~ 7.5、以甲醇為碳源、碳氮比是 1.25,以及 HRT 為 8 hrs 之情形下,硝酸鹽 氮濃度去除率大於 99 %。由本章節文獻歸納,脫硝反應之影響因子 pH 值、 碳氮比、溫度、溶氧、氧化還原電位、體積負荷、水力及污泥齡等,僅 pH 值及碳氮比皆被提及,顯示兩者為脫硝反應之重要影響因子。
2.1.3 水水水水中中中中硝酸鹽脫硝處理硝酸鹽脫硝處理硝酸鹽脫硝處理硝酸鹽脫硝處理 許多技術可應用於去除水中硝酸鹽,如離子交換、生物脫硝、逆滲透 與電透析等。這些技術可分為兩大類:物理化學處理程序(如離子交換、逆 滲透與電透析)與生物處理程序,各種技術各有其優劣點。物理化學處理程 序通常僅將硝酸鹽進行分離濃縮,因此產生高濃度廢液,需考量後續之處 理問題。例如,離子交換技術使用陰離子樹脂中之氯離子或碳酸氫根與水 中硝酸根離子進行取代反應,以達到去除硝酸鹽的目的。然而樹脂飽和後 需以過量鹽類進行再生,因而產生含高濃度硝酸鹽、硫酸鹽與氯鹽之廢液, 需進一步處理。生物脫硝程序具備去除硝酸鹽及省能源之優點,利用脫硝 菌將水中之硝酸鹽轉化成氮氣,但微生物與碳源通常需要外加至原水中, 因此需較佳之後處理設計,以確保飲用水水質。此外,脫硝過程中,亞硝
酸鹽中間產物之產生,亦為應用此技術之一大疑慮(Gayle et al., 1989; Mateju
et al., 1992)。脫硝過程中添加適量基質,可提高處理效率;使用薄膜分離,
可將生物處理程序隔離進行,並得到穩定之出流水(Chang et al., 1993;
2.1.4 微生物菌相分析微生物菌相分析微生物菌相分析微生物菌相分析
傳統微生物菌群分析,主要以顯微鏡觀察或菌種分離培養等方法,因
細菌的外型差異小,菌群相似性高、多樣性的環境樣本,顯微鏡觀察無法
有效地進行區別;而於菌種分離培養時,因培養基具有選擇性,無法反應
實際環境狀況下菌群之組成結構,活性污泥系統中之菌種太多無法順利培
養且分析時間長。Amann et al. (1990)利用 16S rRNA 定序結果顯示自然環境
中的微生物種類遠超過利用傳統培養所知的範圍,因此傳統分離培養方法
較不適於菌群變化分析。
面對微生物學的挑戰,近年來許多分析方法被嘗試用來提高微生物分
析的效率、速度和選擇性,目前較常應用於環工之分子生物技術中,本研
究運用螢光分析(Fluorescence assays) (Raymond et al., 1994)、聚合酶連鎖反
應 (Polymerase Chain Reaction, PCR)及 變 性 梯 度 凝 膠 電 泳 法 (Denaturing
2.2 生物擔體反應槽生物擔體反應槽生物擔體反應槽(BCR)之生物擔體反應槽 之之之特性與功效特性與功效特性與功效特性與功效
由於開孔性泡綿具有大表面積,可提供微生物附著增殖;對於採用泡
綿作為微生物附著擔體之研究,Breitenbucher et al. (1990) 曾進行高效率開
孔性載體相關研究,指出高效率載體需要具備下列特性:(1)對微生物而言,
快速菌落生長速度(High colonization velocity)、提供大面積附著、表面粗糙、
適當大小、大孔洞體積、開孔(阻止擴散限制)、生物與化學穩定性及緩和表 面;(2)對程序工程而言,則含清晰幾何外型、良好的逆洗特性、不易堵塞 及機械強度適中等。致病菌在多孔性介質的滯留和去除之影響因子有物理 張力及吸附(Stevik, et al., 2004),而改變多孔性介質大小、表面構造及負荷 對於吸附影響大(Huysman, 1993),小顆粒擁有大表面積,有利於多點吸附 (Tan, et al., 1992),表面粗造將增加吸附能力及低剪力具備較低脫附速率 (Characklis, 1984)。 Wartchow et al. (1990) 以實驗室和模型廠填充率都以 25% 泡綿反應 槽進行批式及連續試驗,探討污泥齡對懸浮和固定膜混合系統硝化、脫硝 之影響;實驗結果發現混合系統之污泥停留時間比無泡綿之傳統方法增加 30 %,泡綿中微生物之硝化能力比懸浮微生物增加 20 ~ 30 %,且於溶氧濃 度 2 ~ 4 mg/L 環境下,硝化與脫氮作用亦可同時發生;該研究提供微生物附
除能力(2)適當之碳氮量可同時提昇去除 COD 能力及硝化脫氮作用(Morper
& Wildmoser, 1990)。Deguchi & Kashiwaya (1994) 利用 27 ppi,長寬高各為
15 mm × 12 mm × 12 mm 之泡綿,探討泡綿生物處理系統之硝化脫硝功能;
以填充率 10%組裝 A、B 兩組實驗設備,A 設備以單槽輪流交替操作 Anoxic
或 Oxic 條件,B 設備以兩槽分別操作 Anoxic 與 Oxic 條件,其結果顯示 A
組 設 備 中 污 泥 之 硝 化 與 脫 硝 速 率 常 數 分 別 為 50.16 和 33.6 mg
NO3-N/g-VSS-d,此數值是懸浮系統之 1.5 到 1.6 倍,而 B 組設備中污泥之
2.3 薄膜生物反應槽薄膜生物反應槽薄膜生物反應槽(MBR)之薄膜生物反應槽 之之薄膜之薄膜薄膜功能薄膜功能功能功能
生物除碳系統至少包括有 MBR 及 BCR 兩種,依照薄膜傳送物質種類
及微生物在反應槽之應用方式,演變出數種不同型式之薄膜生物槽,以薄
膜傳送物質種類而言,有處理水傳輸、離子溶質傳輸與分子溶質傳輸等三
種 , 第 一 種 是 處 理 水 傳 輸 亦 即 固 液 薄 膜 分 離 生 物 處 理 槽 (Solid-Liquid
Membrane Separation Bioreactor, SLMSB),利用 UF 或 MF 薄膜分離濃縮生
物污泥,並迴流至生物處理槽,主要是以壓力為驅動力進行過濾操作(Chang
et al., 1993; Delanghe et al., 1994; Barreiros et al., 1998; Wasik et al., 2001)。第
二種是離子溶質傳輸,傳輸硝酸鹽之薄膜通常為透析(Dialysis)薄膜,利用
硝酸鹽在薄膜兩端之濃度差,產生濃度梯度以進行硝酸鹽傳輸,而處理水
因與生物反應區域分開,故可避免微生物污染處理水問題( Fuchs et al., 1997;
Mansell et al., 1999)。另有學者使用離子交換膜,選擇性通過硝酸離子,以
提昇硝酸鹽氮之傳輸速率(Fonseca et al., 2000)。離子交換薄膜生物處理槽
(Ion Exchange Membrane Bioreactor, IEMB),利用薄膜將水、廢水或廢氣中
特定有機物進行傳輸,送至生物處理槽進行生物分解,此技術不受被處理
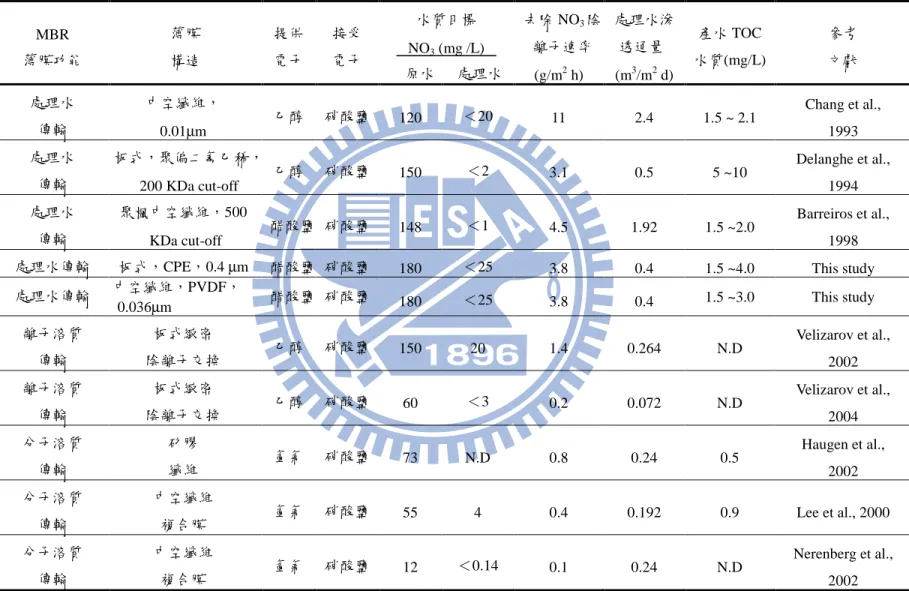
水中有機碳濃度(Lee et al., 2000; Haugen et al., 2002; Nerenberg et al., 2002)。Lee et al. (2006) 先前研究顯示添加擔體能截留懸浮生物污泥及減低 薄膜上生物膜生長;萃取式薄膜生物處理技術,提昇滲透通量的反應決定 步驟為第一階段酚通過薄膜,而非第二階段微生物對有機物的分解效率。 本論文係考量薄膜通量及硝酸鹽處理水質之成效,而採用薄膜處理水 傳輸方式,綜合 MBR 各種薄膜功能研究結果,如表 2-1 所示,應用 MBR 進行原水生物脫硝處理,以壓力為趨動力時,去除硝酸根陰離子速率為最 大,可達到 3.1 ~ 11 g/m2 h。兩件離子溶質傳輸案例 TOC 濃度皆低於 0.5 mg/L 偵測極限,可證明運用離子溶質傳輸方式之處理水 TOC 濃度最低。至於分 子溶質傳輸研究案例與處理水及離子溶質傳輸方式比較,不論去除硝酸根 陰離子速率為 0.1 ~ 0.8 g/m2 h 或 TOC 水質 N.D. ~ 0.9 mg/L 都是效果居於中 等(Crespo et al., 2004)。本研究結果,顯示進流水硝酸鹽濃度 180 mg/L, 處理水小於 25 mg/L 時,換算硝酸根陰離子去除速率為 3.8 g/m2 h,其表現 都比離子溶質傳輸及分子溶質傳輸優,而在處理水傳輸之 TOC 濃度 1.5 ~ 4 mg/L 表現則較離子溶質傳輸及分子溶質傳輸差,經納入表 2-1 比較,本研 究之結果與第一種處理水傳輸之文獻趨勢相似。
表 2-1 各種薄膜生物型態進行原水脫硝處理 MBR 薄膜功能 薄膜 構造 提供 電子 接受 電子 水質目標 NO3 (mg /L) 原水 處理水 去除 NO3陰 離子速率 (g/m2 h) 處理水滲 透通量 (m3/m2 d) 產水 TOC 水質(mg/L) 參考 文獻 處理水 傳輸 中空纖維, 0.01µm 乙醇 硝酸鹽 120 <20 11 2.4 1.5 ~ 2.1 Chang et al., 1993 處理水 傳輸 板式,聚偏二氟乙稀, 200 KDa cut-off 乙醇 硝酸鹽 150 <2 3.1 0.5 5 ~10 Delanghe et al., 1994 處理水 傳輸 聚楓中空纖維,500 KDa cut-off 醋酸鹽 硝酸鹽 148 <1 4.5 1.92 1.5 ~2.0 Barreiros et al., 1998
處理水傳輸 板式,CPE,0.4 µm 醋酸鹽 硝酸鹽 180 <25 3.8 0.4 1.5 ~4.0 This study
處理水傳輸 中空纖維,PVDF, 0.036µm 醋酸鹽 硝酸鹽 180 <25 3.8 0.4 1.5 ~3.0 This study 離子溶質 傳輸 板式緻密 陰離子交換 乙醇 硝酸鹽 150 20 1.4 0.264 N.D Velizarov et al., 2002 離子溶質 傳輸 板式緻密 陰離子交換 乙醇 硝酸鹽 60 <3 0.2 0.072 N.D Velizarov et al., 2004 分子溶質 傳輸 矽膠 纖維 氫氣 硝酸鹽 73 N.D 0.8 0.24 0.5 Haugen et al., 2002 分子溶質 中空纖維
2.4 建構建構建構生物建構生物生物擔體生物擔體擔體擔體與薄膜與薄膜之複合與薄膜與薄膜之複合之複合之複合式脫硝式脫硝式脫硝式脫硝處理系統處理系統處理系統處理系統
結 合 兩 種 不 同 處 理 技 術 簡 稱 複 合 系 統 , 此 複 合 系 統 分 別 說 明
如 下,Basu & Huck (2004, 2005) 將 生 物 濾 床 單 元 放 置 於 薄 膜 前 後
位 置 , 並 分 析 其 對 腐 植 酸 處 理 之 影 響 , 結 果 發 現 生 物 過 濾 單 元 放
置 於 薄 膜 之 前 , 對 於 處 理 TOC 和 有 機 酸 效 果 較 大 , 而 SUVA 值 效
能 減 少 主 要 來 自 於 薄 膜 過 濾 , 薄 膜 置 於 生 物 濾 床 之 後 , 比 薄 膜 置
於 生 物 濾 床 前,其 積 垢 速 率 較 慢。Ivanovic et al.(2006)分 析 顆 粒 大
小 分 佈 (Particle size distribution, PSD)得 知 次 微 米 顆 粒 數 目 相 對 較
多 , 其 污 泥 性 質 不 利 於 沈 降 和 過 濾 , 若 操 作 條 件 控 制 在 低 有 機 負
荷 , 其 產 生 之 污 泥 粒 徑 較 大 , 有 利 於 脫 水 、 過 濾 、 較 低 薄 膜 積 垢
和 較 低 清 洗 頻 率 ; 其 移 動 床 生 物 膜 反 應 槽 (Moving bed biofilm
reactor, MBBR),擔 體 材 質 採 用 高 密 度 聚 氯 乙 稀 (密 度 0.95 g/cm3),
外 觀 為 小 圓 柱 型,內 外 邊 線 交 錯,長 7 ~ 15 mm,直 徑 10 ~ 15 mm,
填 充 率 60 ~ 70%。
Guo et al.(2007)比 較 生 物 漂 浮 擔 體 過 濾 -沈 浸 式 薄 膜 生 物 反 應
去 除 率 高 於 20 %;FMR-SMBR 系 統 在 次 臨 界 通 量 下 操 作,以 FMR 當 SMBR 之 前 處 理 單 元 , 可 有 效 降 低 薄 膜 積 垢 。 BF-MBR 系 統 之 體 積 負 荷 為 2 ~ 8 kg COD / m3 d 、HRT 4 hrs 及 薄 膜 通 量 約 50 L/m2 h, 實 驗 結 果 優 於 AS-MBR 系 統 體 積 負 荷 1 ~ 3 kg COD / m3 d 、 HRT 4 ~ 10 hrs , 以 及 薄 膜 通 量 約 15 ~ 25 L/m2 h (Leiknes &
Odegaard, 2007)。 Ivanovic & Leiknes (2008) 研 究 指 出 生 物 膜 薄 膜
生 物 反 應 槽 (Biofilm membrane bioreactor, BF-MBR)及 所 有 MBR
系 統 操 作 時 , 為 維 持 掃 流 條 件 , 充 分 曝 氣 是 必 要 的 , BF-MBR 系
統 對 於 污 泥 顆 粒 分 離 比 MBR 更 容 易,曝 氣 產 生 之 剪 應 力 能 防 止 膠
2.5 探討探討探討飲用水水質安全探討飲用水水質安全飲用水水質安全性飲用水水質安全性性性
(1) 三鹵甲烷生成潛勢三鹵甲烷生成潛勢三鹵甲烷生成潛勢三鹵甲烷生成潛勢(THMFP)
水中殘餘有機碳加氯消毒後,會產生揮發性有機物,而當進流水
THMFP 濃度為 450 µg/L 時,應用管狀薄膜模組在水處理時,約有 60%去除
率(Ravindran et al., 2009),而分析自來水三鹵甲烷(THMs)濃度,以氯仿濃度
為 0.03 ~ 98.4 µg/L 最高(Baytak et al., 2008),趨勢與本論文結果相同。Wang et al. (2007)利用三種組合藥劑研究 THMs 之致癌風險,藥劑分別為兩段加 氯、氯加上氯胺及臭氧加上後加氯,其結果顯示生命期望值高低順序為兩 段加氯、氯加上氯胺及臭氧加上後加氯。 (2) 溶解性微生物產物溶解性微生物產物溶解性微生物產物溶解性微生物產物(SMPs) SMPs 於活性污泥系統具抑制硝化作用,但在高濃度狀況下,對於活 性污泥之混凝膠羽及污泥沈降性有負面影響 (Chudoba, 1985a, 1985b)。 Ichihashi et al. (2006) 研究 SMPs 對活性污泥中氮磷去除影響,操作兩組 厭氧加上喜氣的整合系統,HRT 分別為 48 和 6.4 小時,結果顯示 SMP 會抑制厭氧醋酸鹽代謝及降低硝化脫氮能力,造成處理水硝酸鹽及亞硝
(3) 大腸桿菌大腸桿菌大腸桿菌大腸桿菌群群群群及總菌落數及總菌落數及總菌落數及總菌落數
飲用水水質細菌性標準之分析項目有大腸桿菌群及總菌落數,使用
UV、TiO2及 UV/TiO2光觸媒都能去除大腸桿菌群(Rizzo, 2009),多層濾料
(Devi et al., 2008)及土壤(Nemade et al., 2009)亦可去除。另一項飲用水水質
是否符合標準之指標為總菌落數(Edberg et al., 1996),水樣於 34 ~ 36℃以
HPC (Heterototrophic Plate Count) 培養基培養 48 小時後,利用肉眼計算異
營 菌 數 目 (APHA, 2005) 。 能 夠 傳 染 產 生 病 變 之 異 營 菌 種 類 如 下 :
Acinetobacter, Aeromonas, Flavobacterium, Klebsiella, Legionella, Moraxella, Mycobacterium, Serratia, Pseudomonas 和 Xanthomonas (Rusin et al., 1997;
第三章
第三章
第三章
第三章 研究方法
研究方法
研究方法
研究方法
3.1 材料材料材料材料 (1) 模擬原水之製備模擬原水之製備模擬原水之製備模擬原水之製備 南投縣名間鄉新街淨水場地下水硝酸鹽氮平均濃度約為 41 mg/L,本研 究以此濃度為模擬對象,實驗室試驗是自來水中添加硝酸鈉,配置硝酸鹽 氮濃度約 30 ~ 40 mg/L,選用醋酸當碳源,營養源則為 KH2PO4與 FeSO4 7H2O,控制碳、磷、鐵三者重量比為 100:1:0.5,而模型廠則置於新街淨 水場,以該廠之寬口井(淺井)及一號深井的地下水為處理對象,碳源亦選用 醋酸,營養源由於現場地下水已含有微量鐵,且為方便調配故僅添加液態 磷酸,控制碳及磷兩者重量比為 100:1。 (2) 多孔性擔體多孔性擔體多孔性擔體多孔性擔體 本實驗多孔性擔體材質選用聚氨基甲酸酯(Polyurethane, PU)泡綿,PU 泡綿比重為 28 kg/m3,泡綿外觀為扇形狀,如圖 3-1 所示,每顆泡綿直徑為 2.2 公分,厚度為 2 公分,體積為 4.5 立方公分,平均單顆重量 116.6 mg, 脫硝槽填充泡綿量為槽體約 80%,加上扣除上下隔版有效區為 70 %,孔隙
泡綿將充滿於整個槽內。 圖 3-1 PU 材質多孔性生物擔體相片(單位:公分) (3) 薄膜薄膜薄膜薄膜 本研究使用兩種薄膜,如圖 3-2 所示,MBR-G 為加拿大 Zenon 公 司開發之薄膜,生產之薄膜為一沈浸式超過濾膜,材質為聚偏二氟乙 烯(Polyvinylidene difluoride, PVDF),平均孔徑約 0.036 µm,薄膜本身 為中空纖維膜管,內徑 0.9 mm,外徑 1.9 mm,此薄膜可耐強酸鹼(pH 3 ~ 12)與氧化劑( 2,000 mg/L as NaOCl )之腐蝕。MBR-K 為日本 Kubota 公司所開發之薄膜,其生產之薄膜為平板式微過濾膜,材質為氯化聚 2.0 2.2
Styrene, ABS)塑膠,此薄膜可耐強酸鹼(pH 3 ~ 11)及氧化劑( 0.5% as NaOCl )之腐蝕。 MBR-K (Kubota) MBR-G (GE-Zenon) 圖 3-2 兩種不同之 MBR 薄膜型態 3.2 生物擔體生物擔體生物擔體脫硝處理生物擔體脫硝處理脫硝處理 脫硝處理 地下水利用外加碳源之生物脫硝技術去除硝酸鹽雖然較經濟,但處理 水中含有殘餘有機化合物、消毒副產物和微生物污染物,對於飲用水之安 全,仍有潛在風險。本論文研究生物膜脫硝及經過薄膜生物反應槽或生物 擔體反應槽去除殘餘有機化合物和微生物之組合程序,與傳統生物程序比 較,新的組合程序期望較能達到品質較高之飲用水標準。
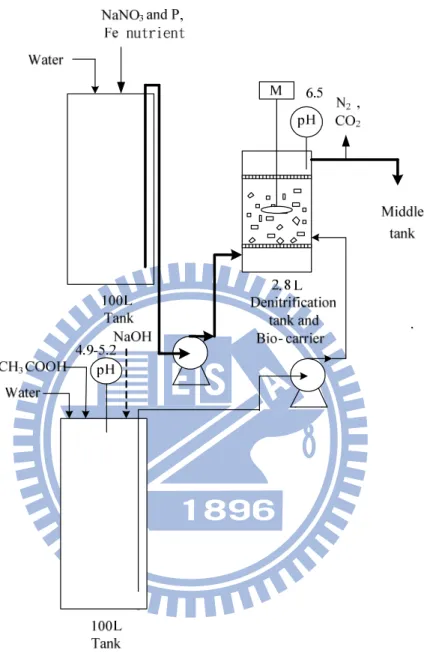
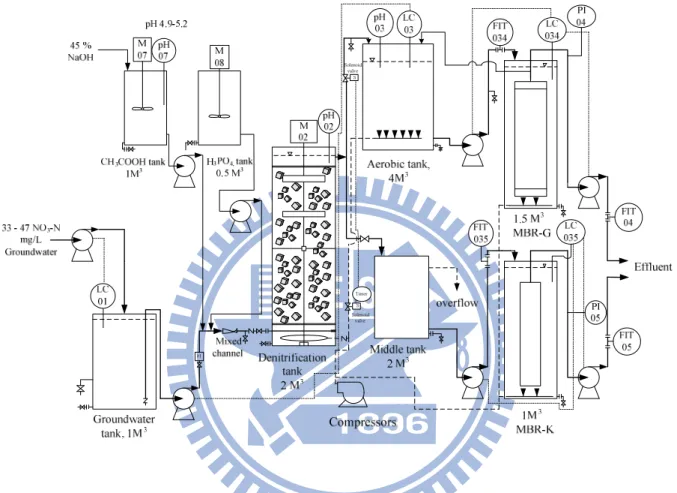
3.2.1 生物擔體脫硝處理之生物擔體脫硝處理之生物擔體脫硝處理之生物擔體脫硝處理之實驗裝置實驗裝置實驗裝置 實驗裝置 BCR 與 MBR 之複合技術,如圖 3-3 所示,主要是應用生物膜技術之生 物脫硝能力及薄膜之固體物截留能力,獲得符合飲用水標準之出流水。實 驗室添加硝酸鈉以配製模擬原水,碳源選用醋酸,同時補充 KH2PO4 與 FeSO4‧7H2O 為營養源。原水槽、脫硝槽、中續槽、MBR 除碳槽及 BCR 除碳槽,容積分別為 100 公升、5 公升、20 公升、20 公升及 2.8 公升,其 中脫硝槽、中續槽、MBR 及 BCR 之有效容積為 3.6 公升、18.8 公升、18.8 公升及 1.9 公升;進水流量 20 ~ 120 ml/min,脫硝槽 HRT 為 0.5 ~ 3 小時, 碳氮比分別是 1.5、 3 及 7 ;中續槽設置溢流孔之目的為當進水速率大於 薄膜過濾速率時,多出來的水量將從溢流孔流出,可有效調整水量。 本實驗先利用 BCR 槽中之脫硝菌進行脫硝處理,殘餘之有機物於後段 利用除碳系統去除。脫硝系統監控 pH 值、溫度、溶氧、氧化還原電位及 流量等,以流量及反應槽容積計算脫硝槽體積負荷,檢測馴養前後脫硝菌 之活性,改變碳氮比和體積負荷去探討對生物脫硝影響,同時以位相差觀 測及分子生物技術進行微生物菌相分析,最後探討生物擔體之微生物吸附 量,推估 BCR 槽中微生物濃度及食微比。規劃從實驗試程一到試程三, 改變碳氮比,其他操作條件如表 3-1。
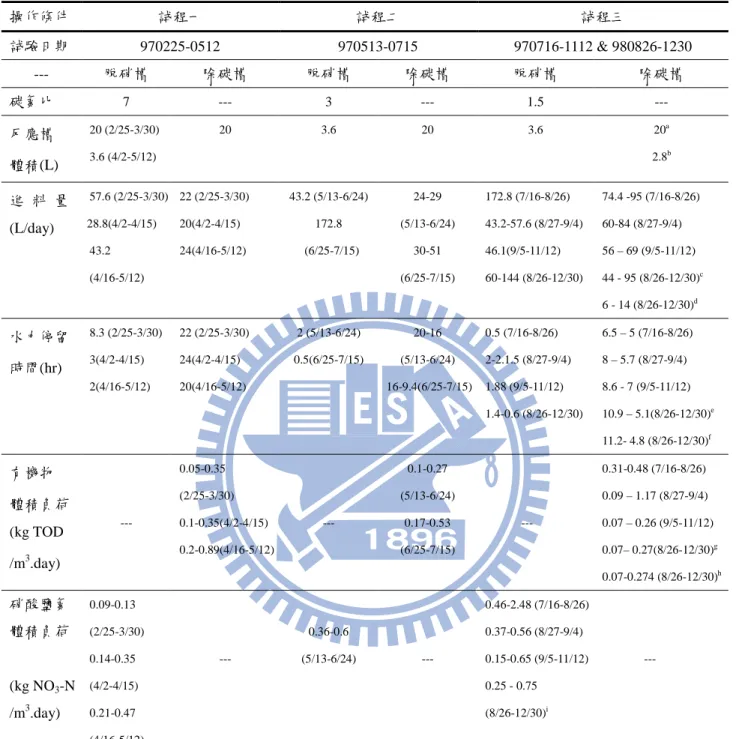
表 3-1 實驗室規模原水之試驗操作條件 操作條件 試程一 試程二 試程三 試驗日期 970225-0512 970513-0715 970716-1112 & 980826-1230 --- 脫硝槽 除碳槽 脫硝槽 除碳槽 脫硝槽 除碳槽 碳氮比 7 --- 3 --- 1.5 --- 反應槽 體積(L) 20 (2/25-3/30) 3.6 (4/2-5/12) 20 3.6 20 3.6 20a 2.8b 進 料 量 (L/day) 57.6 (2/25-3/30) 28.8(4/2-4/15) 43.2 (4/16-5/12) 22 (2/25-3/30) 20(4/2-4/15) 24(4/16-5/12) 43.2 (5/13-6/24) 172.8 (6/25-7/15) 24-29 (5/13-6/24) 30-51 (6/25-7/15) 172.8 (7/16-8/26) 43.2-57.6 (8/27-9/4) 46.1(9/5-11/12) 60-144 (8/26-12/30) 74.4 -95 (7/16-8/26) 60-84 (8/27-9/4) 56 – 69 (9/5-11/12) 44 - 95 (8/26-12/30)c 6 - 14 (8/26-12/30)d 水力停留 時間(hr) 8.3 (2/25-3/30) 3(4/2-4/15) 2(4/16-5/12) 22 (2/25-3/30) 24(4/2-4/15) 20(4/16-5/12) 2 (5/13-6/24) 0.5(6/25-7/15) 20-16 (5/13-6/24) 16-9.4(6/25-7/15) 0.5 (7/16-8/26) 2-2.1.5 (8/27-9/4) 1.88 (9/5-11/12) 1.4-0.6 (8/26-12/30) 6.5 – 5 (7/16-8/26) 8 – 5.7 (8/27-9/4) 8.6 - 7 (9/5-11/12) 10.9 – 5.1(8/26-12/30)e 11.2- 4.8 (8/26-12/30)f 有機物 體積負荷 (kg TOD /m3.day) --- 0.05-0.35 (2/25-3/30) 0.1-0.35(4/2-4/15) 0.2-0.89(4/16-5/12) --- 0.1-0.27 (5/13-6/24) 0.17-0.53 (6/25-7/15) --- 0.31-0.48 (7/16-8/26) 0.09 – 1.17 (8/27-9/4) 0.07 – 0.26 (9/5-11/12) 0.07– 0.27(8/26-12/30)g 0.07-0.274 (8/26-12/30)h 硝酸鹽氮 體積負荷 (kg NO3-N /m3.day) 0.09-0.13 (2/25-3/30) 0.14-0.35 (4/2-4/15) 0.21-0.47 (4/16-5/12) --- 0.36-0.6 (5/13-6/24) --- 0.46-2.48 (7/16-8/26) 0.37-0.56 (8/27-9/4) 0.15-0.65 (9/5-11/12) 0.25 - 0.75 (8/26-12/30)i --- 備註 備註 備註 備註:::: a.MBR 總體積,槽內放置沈浸式 MBR-G 及 MBR-K 模組;b.BCR 體積;c.MBR 出水量;d.BCR 出水量; e.MBR 之 HRT;f.BCR 之 HRT;g.MBR 有機物體積負荷;h.BCR 有機物體積負荷;i.BCR 脫硝槽硝酸鹽氮 之體積負荷。
3.2.2 脫硝菌脫硝菌脫硝菌脫硝菌之活性測試之活性測試之活性測試 之活性測試 脫硝菌之活性測試以醋酸為基質測定脫硝菌之最大氮氣產氣率,比較馴 養前後污泥之活性,步驟為(1)先檢測馴養前植種污泥內脫硝菌之最大氮氣 產氣率(2)植種污泥經過脫硝槽馴養後,從脫硝槽中取出生物擔體進行脫硝 菌之淘洗和擠乾,產生的懸浮污泥再經過離心濃縮處理並測量 VSS 含量(3) 污泥及基質溶液配置:脫硝槽污泥馴養前 F/M 值介於 0 ~ 3.0 間,數值分別 為 0、 0.1、 0.5、 1.0、 2.0 及 3.0 共 6 瓶,污泥馴養後 F/M 值介於 0 ~ 6.0 間,數值分別為 0、 0.1、 0.5、 1.0、 2.0、 3.0 及 6.0 共 7 瓶;添加硝酸 鈉並以醋酸為基質,控制 C/N 比為 1.5,添加營養源,並以 NaOH 調整至 pH 約 6.5 ~ 7.0,每瓶均先取 50 mL 污泥,再加上蒸餾水去稀釋調整至 200 ml, 步驟仿效甲烷菌的活性測定實驗(Qmax),藉由觀察鳥型醱酵管液面之變化, 記錄 24 小時後之氮氣產氣量,比較污泥馴養前後每克 VSS 污泥每天氮氣產 氣量,並換算馴養前後不同的 Qmax。
3.2.3 改變改變改變改變操作參數操作參數操作參數操作參數之實驗規劃之實驗規劃之實驗規劃 之實驗規劃 脫硝反應除了受到 pH 值、溫度、溶氧及氧化還原電位等環境因子影響 外,亦受到操作因子影響,而操作因子包括碳氮比、體積負荷、有機基質 種類。本實驗先監控環境因子在一定範圍內(1)脫硝槽及除碳槽最佳 pH 值皆 為 7.0,故為了兼顧脫硝除碳效果及飲用水安全,需藉由添加不同液鹼量到 醋酸槽,調整酸鹼值去控制脫硝槽 pH 值為 6.5 ± 0.5 及除碳槽 pH 值為 7.5 ± 0.5 (2)脫硝菌適合生長的溫度範圍為 0 ~ 60℃,室內水溫 25 ± 5℃,而模型 廠戶外水溫約 30 ± 5℃,兩個測試場所都合適(3)脫硝槽溶氧是 0.2 ~ 0.4 mg/L,同時監測 ORP 約為 - 100 ~ - 200 mv 是缺氧環境。 改變操作參數(1)實驗室規模時分成碳氮重量比 1.5、3 及 7 三組實驗, 結果重量比為 7 時之出流水總有機碳濃度過高,因此在模型廠試驗時選擇 碳氮重量比 1.5 和 3 兩組試驗而排除重量比 7 (2)實驗室脫硝槽之體積負荷 0.1 ~ 1.4 kg NO3-N / m 3 d,實驗發現為了符合飲用水 10 mg/L 標準,體積負 荷應低於 0.8 kg NO3-N / m 3 d,因此在模型廠試驗時,則調整體積負荷是 0.4 ~ 0.8 kg NO3-N / m 3 d。另為方便記錄實驗操作條件,製作空白記錄表格, 至於有機基質種類,因固定碳源為醋酸,故這項變數可以忽略。
3.2.4 脫硝菌性質及脫硝菌性質及脫硝菌性質及脫硝菌性質及生物擔體生物擔體生物擔體微生物生物擔體微生物微生物吸附量微生物吸附量吸附量 吸附量
生物脫硝作用是利用微生物使硝酸鹽還原為氮氣,即從水或廢水中去
除氮。能夠進行脫硝反應之微生物種類很多,例如:Achromobacter、
Pseudomonas、Thiobacillus、Bacillus、Sprilillum、Minococcus 等。脫硝菌
依 其 獲 得 能 源 方 式 之 不 同 可 區 分 為 自 營 菌 (Autotrophs) 和 異 營 菌 (Heterotrophs)兩類,自營菌之碳源為無機物(二氧化碳),而異營菌則以有機 物為碳源。脫硝菌屬於黏滯性物種,容易造成管線和反應槽堵塞,故利用 自動定時定期攪拌和間歇曝氣,如此可大大降低影響。 為獲得新鮮生物擔體之平均重量,取 10 顆新鮮生物擔體烘乾並稱重; 同時另取 BCR 槽中數顆已馴養的生物擔體去計算單顆生物擔體微生物吸附 量,並推估反應槽中微生物濃度及食微比,由於生物擔體屬多孔開放性, 因此微生物除附著表面外也滲入孔內,需利用夾子擠出生物擔體之微生物 後,方能量測 MLSS 體積及分析 VSS 及 SS 濃度。
3.3 薄膜生物薄膜生物薄膜生物及薄膜生物及及及生物擔體生物擔體生物擔體生物擔體去除有機去除有機去除有機去除有機碳碳效能碳碳效能效能效能及微生物及微生物及微生物及微生物行為差異行為差異行為差異行為差異之比較之比較之比較之比較 MBR 槽中主要為懸浮性微生物,而 BCR 槽內則為生物膜微生物附著 於多孔性擔體上,兩者皆具備去除有機化合物效能,故探討處理水質之功 能性比較及微生物之行為差異。由於本論文是複合式生物脫硝系統開發, 於多孔性擔體生物膜脫硝後進行 MBR 除碳,其結果與單獨以 MBR 去除有 機物不同,故需再深入探討。加上 Kubota 是平版 MF 膜,而 GE-Zenon 是 管狀 UF 膜,故同時也比較不同模組及材質之 Fouling 現象及處理水之濁度、 粒徑、SMP、DOC、消毒副產物等水質。 3.3.1 MBR 及及及及 BCR 之實驗裝置之實驗裝置之實驗裝置之實驗裝置 後段 MBR 及 BCR 兩者並聯,薄膜與生物擔體之除碳處理流程,如圖 3-4 及圖 3-5 實體裝置所示,利用微生物進行有機碳生物降解及加上薄膜 或生物擔體進行固體物截留,以得到較優之出流水水質。除碳系統監控 pH 值、流量、曝氣量、薄膜壓力、槽內微生物量及量測排放水總體積等。計 算體積負荷(或水力停留時間)、 薄膜阻力、薄膜通量;及檢測 DOC、SMPs、 SUVA、 總菌落數、大腸桿菌、濁度、粒徑分佈;同時以位相差觀測菌相、 螢光染色去分辨 RNA 和 DNA 並以分子生物技術進行微生物菌相分析;最
50 L GE-Zenon Membrane Permeate Collection tank 18.8 L Middle tank 18.8 L MBR 50 L Kubota Membrane Permeate Collection tank Over flow Air LC pH pH pH P P pH 20 L BCR Effluent Collection tank pH Air 1.9 L BCR 圖 3-4 實驗室規模之薄膜及生物擔體除碳處理流程
BCR-C 除碳槽 MBR-K 和 MBR-G 除碳槽 BCR-N 脫硝槽
3.3.2 SMPs 之之之組成及分離之組成及分離組成及分離 組成及分離 SMPs 是溶解性微生物產物之簡稱,而 SMPs 組成為多醣類、蛋白質、 腐植酸、核酸、有機酸、抗生素及硫醇等多種物質之混合體,主要成分是 多醣類和蛋白質(Liu et al., 2002),本論文所稱分析 SMPs 即為此兩種濃度之 分析。本篇論文後段使用 MBR 去除殘餘有機碳、消毒副產物之前驅物與微 生物污染,由於 SMPs 濃度若為異常時易造成薄膜堵塞,加上分析薄膜前後 SMPs 數值差異可說明 MBR 去除有機物之效能,故可見 SMPs 在本篇論文 之重要性。
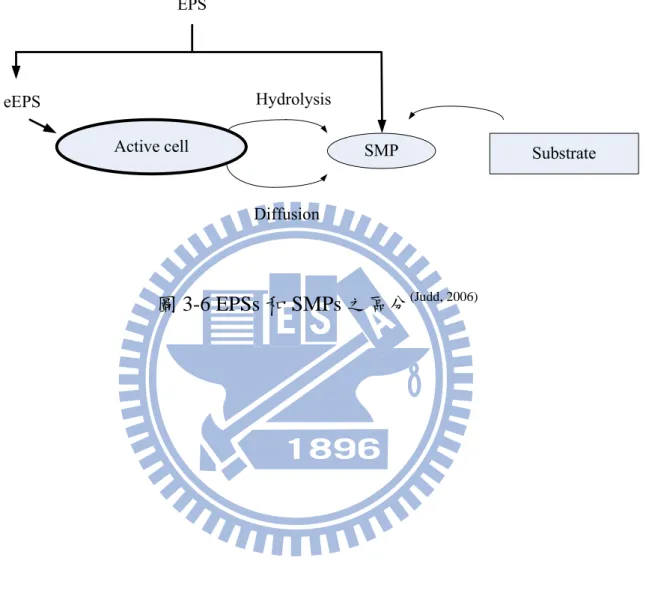
Judd (2006)區分活性污泥中之胞外聚合物(Extracellular Polymeric
Substances, EPSs)及溶解性微生物產物(Soluble Microbial Products, SMPs)
如圖 3-6 所示,EPS 可細分為 (extracted EPS, eEPS) 與 SMP,萃取 EPS
以 eEPS 符號表示,活性污泥細胞膜經由水解和擴散到水相稱為 SMP
(Laspidou & Rittmann, 2002 ; Li et al. 2005),SMP 亦是溶解性的生物質
量,在 MBR 系統研究中,曾被證明 SMP 來自於進流基質。本論文實驗
之 SMPs 分離方法比照 Liu & Fang (2002)描述,先以 4,000 rpm 離心 20 分
鐘 ( 4o
Active cell SMP Substrate
eEPS Hydrolysis
Diffusion EPS
3.3.3 腐植酸腐植酸腐植酸腐植酸之之之 SUVA 值測定之 值測定值測定值測定
相同水樣分別取兩杯以 0.45 µm 濾紙過濾後,一杯分析 DOC 濃度,另
一杯利用分光光度計在波長 254 nm 時測定,紀錄其吸光度,兩者比值即為
SUVA 值。SUVA (L/mg m) = UV254nm × 100 / DOC, UV254是水中含有不飽
和鍵之有機物在波長 254 nm 時所表達之吸光度,是一種評估水中腐植酸多
寡之指標,當 SUVA 值小於 3 時,表示有機物之性質屬親水性,換言之當
水中腐植酸非常少時是可以忽略的(Edzwald et al., 1990),反之若 SUVA
值大於 4.5 時,則表示有機物性質屬疏水性,代表水中存在腐植酸。
若水中或污泥中含有高濃度之腐植酸,於計算 SMPs 或 EPSs 時,除蛋
白質與多醣類之外,也需要加入腐植酸一併計算。另若水中含有高濃度腐
3.3.4 微生物微生物微生物微生物菌相分析菌相分析菌相分析 菌相分析 1.位相差顯微鏡觀察 本研究透過觀察活性污泥之生物相,瞭解污泥中微生物生長、活動及 菌相之演替情況,由位相差顯微鏡觀察BCR-N、MBR及BCR-C三種反應器 上微生物形態之差異,可輔助判別水處理設施運行狀況及處理效果。 2.螢光染色法 利用螢光標定目標 DNA 及 RNA 之寡核苷酸探針,進行原位染色技術 方法,已廣泛運用於微生物領域,如活性污泥之研究,用以克服傳統培養 方法所造成之偏差。而螢光原位染色係依此特性使用染劑,進一步追蹤目 標生物並定量;螢光原位染色技術可分為固定、染色、顯像等步驟。 3.分子生物常用之實驗方法 本研究之樣品為自 BCR-N、MBR 及 BCR-C 三個生物反應槽取出微生 物樣品進行下列實驗。 (1) DNA 萃取 每一樣品取出後,利用套組試劑( UltraCleanTM
Soil DNA Isolation Kit )
IRS,放置於 bead beater 2500 rpm,震盪 1-2 秒,將蓋子稍微懸鬆之後以
13,000 rpm 離心 30 秒,將上清液 450 µL 移至新的離心管中,接著加入 250
µL 的溶液 S2 vortex 數秒後置於 4℃冰上 5 分鐘;再以 13,000 rpm 離心 1
分鐘,取上清液 450 µL 至新的離心管,加 900 µL 溶液 S3 vortex 數秒, 將混合液分批於 spin filter 過濾,以 13,000 rpm 離心後將濾液廢棄,然後
加入 300 µL 溶液 S4於 spin filter 靜置 1 min,13,000 rpm 離心 0.5 分鐘將 濾液廢棄,以完全除去溶液 S4,最後把 spin filter 置於新的離心管並以 50 µL S5 溶液靜置 1-5 mins,將 DNA 溶出,再以 13,000 rpm 離心 0.5 分鐘, 離心後的濾液(即 DNA)於-20℃保存之。DNA 濃度可經由 UV 吸收光測 定法來正確地定量。樣品中 DNA 的量和 UV 吸光度的讀值呈正比。當利 用波長 260 奈米的 UV 射線所測的吸光讀值為 l.0 時,表示每毫升溶液含 有 50 微克的雙股 DNA。 (2) 聚合酶連鎖反應(PCR) PCR 之原理係藉由加入適當引子對後(Primer set),進行 dNTP(即為
ATP、TTP、GTP、CTP 等 DNA 的組成成分)、DNA 等聚合酵素(Polymerase)
之反應物及目標序列(Template),經過一連串循環升溫降溫控制,使目標
A.微生物菌相之檢測
三種生物反應器之污泥中微生物PCR反應之引子及序列如表3-2,
PCR反應條件如表3-3所示,95℃ 3分鐘(1個循環),95℃ 45秒,54℃ 45
秒,72℃ 2分鐘(28個循環) 及 72℃ 3分鐘(1個循環)。
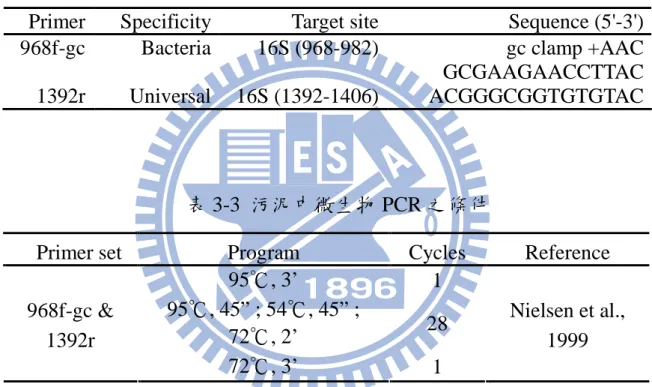
表 3-2 污泥中微生物 PCR 反應之引子與其序列
Primer Specificity Target site Sequence (5'-3')
968f-gc Bacteria 16S (968-982) gc clamp +AAC
GCGAAGAACCTTAC
1392r Universal 16S (1392-1406) ACGGGCGGTGTGTAC
表 3-3 污泥中微生物 PCR 之條件
Primer set Program Cycles Reference
95℃, 3’ 1 95℃, 45” ; 54℃, 45” ; 72℃, 2’ 28 968f-gc & 1392r 72℃, 3’ 1 Nielsen et al., 1999 B.脫硝菌之檢測 生物反應器之微生物族群很複雜,但若以分子生物技術則可分析不 同菌群之相同功能性基因。本研究如表3-4採用nirS基因引子,從BCR-N、
表 3-4 污泥中脫硝菌 PCR 反應之引子與其序列 Primer Specificity Target site Sequence (5'-3')
cd3aF Bacteria 16S (916-935) GTS AAC GTS AAG
GAR ACS GG
R3cd Bacteria 16S (1322-1341) GAS TTC GGR TGS GTC
TTG A
表 3-5 污泥中脫硝菌 PCR 之條件
Primer set Program Cycles Reference
94℃ 2’ , 1 94℃ 30”;57 , , ℃ 1’;72 , ℃ 1’ 30 cd3aF & R3cd 72℃ 10’ , 1 Throback et al., 2004 C.跑膠 PCR反應結束後,利用瓊脂膠糖明膠 (Agarose gel) 進行電泳,以 確定其產物長度並判斷產物是否正確。表3-6依據不同長度之產物配置適 當濃度的膠體,將PCR產物與Loading dye依比例混合後,以100伏特電壓 進行電泳約20分鐘。最後將膠體浸入含0.5 µg/mL之溴乙烯染色10分鐘, 並以紫外光顯像後拍照記錄結果。
表 3-6 DNA 序列長度對應所需之膠體濃度 Gel Concentration (%) DNA Size (kb)
0.5 1 ~ 30 0.75 0.8 ~ 12 1.0 0.5 ~ 10 1.25 0.4 ~ 7 1.5 0.2 ~ 3 2 ~ 5 0.01 ~ 0.5
(3) 變性梯度凝膠電泳(Denaturing gradient gel electrophoresis, DGGE)
變性梯度明膠電泳分析法,主要目標在於分析序列長度相同而鹼 基組成不同的 PCR 產物,其靈敏度最高可區分出一個鹼基差別的 DNA 片段,藉此可判別出屬於不同菌種(species),甚至不同的菌株(strain), 其原理乃在於配製具有變性劑濃度梯度的膠體,藉由不同濃度變性劑 提供能量強弱之不同,打斷構成雙股 DNA 結構能力的氫鍵,即可使 DNA 變性;樣本經 DGGE 分析後,在電泳膠片上所呈現多個不同位置 之亮帶,代表不同的 DNA 序列,藉分析在電泳膠片上之亮帶多寡與位 置的差異,瞭解系統中微生物族群的多樣性。 當配製變性梯度膠時,首先準備變性梯度最高及最低變性劑濃度
(High/Low Denature Density Solution),以 gradient former (Bio-Rad) 配
(4) DNA 純化 利用真細菌之引子對 968f-gc 及 1392r 進行聚合酶連鎖反應以增殖 PCR 產物,利用 DGGE 分析後,再將 DGGE 膠體上相異的亮帶分別切 下後置於無菌水中,經“freeze-and-thaw”過程以獲取目標 DNA 片 段;為檢視切下的亮帶,必須重複進行 PCR-DGGE 與切膠純化的分析, 直至確定為單一亮帶為止。最後,將純化的 DNA 再利用 968f & 1392r 引子對進行 DNA 增殖。 (5)定序-菌種分析 本研究 DNA 序列之定序分析,係委託明欣生物科技有限公司
(Mission Biotech, Taiwan)進行。將取得之序列結果利用 NCBI (National
Center for Biotechnology Information) 網站所提供之 Nucleotide Blast 服
3.3.5 三鹵甲烷生成潛能三鹵甲烷生成潛能三鹵甲烷生成潛能三鹵甲烷生成潛能(THMFP)檢測評估檢測評估檢測評估檢測評估
台灣之淨水場一般採用加氯消毒法,以防止水媒傳染病之發生,惟
原 水 如 受 有 機 污 染 物 污 染 , 經 加 氯 消 毒 後 , 可 能 衍 生 三 鹵 甲 烷
(Trihalomethanes, THMs)、鹵乙酸類(Haloacetic acids, HAAs)、鹵乙睛類
(Haloacetonnitiles, HANs)、鹵化酮類(Haloketones, HKs)、氯化苦味素
(Chloropicrin, CP)等消毒副產物(Disinfection by products, DBP)。而 THMs
是 DBPs 主要成分,不但為最主要之自來水消毒副產物,亦為自來水最
常見之污染物。
THMFP 是三鹵甲烷生成潛能(Trihalomethane formation potential)之
簡稱,而 THMs 是三鹵甲烷(Trihalomethanes)之簡稱。由於 MBR 可去除
消毒副產物之前驅物,故藉由分析 THMFP 預測 THMs 之濃度;飲用水
法規要求是 THMs 濃度為 80 µg /L。三鹵甲烷定義為三氯甲烷(CHCl3,
TCM),二氯一溴甲烷(CHBrCl2, BDCM),一氯二溴甲烷(CHBr2Cl, DBCM)