行政院國家科學委員會專題研究計畫 成果報告
尋找控制昆蟲重要生理作用的新化學因子--蜜蜂腦內對逆
境刺激之生理反應分析(3/3)
研究成果報告(完整版)
計 畫 類 別 : 整合型 計 畫 編 號 : NSC 95-2313-B-002-115- 執 行 期 間 : 95 年 02 月 01 日至 96 年 12 月 31 日 執 行 單 位 : 國立臺灣大學昆蟲學系暨研究所 計 畫 主 持 人 : 楊恩誠 計畫參與人員: 博士班研究生-兼任助理:陳怡伶 報 告 附 件 : 國際合作計畫研究心得報告 處 理 方 式 : 本計畫可公開查詢中 華 民 國 97 年 03 月 17 日
行政院國家科學委員會補助專題研究計畫
■ 成 果 報 告
□期中進度報告
尋找控制昆蟲重要作用的新化學因子-蜜蜂腦內對逆境刺激
之生理反應分析(3/3)
計畫類別:□ 個別型計畫 ■ 整合型計畫
計畫編號:NSC95 – 2313 – B – 002 – 115 -
執行期間:九十五 年 二 月 一 日至 九十六 年 一 月 三十一 日
計畫主持人:楊恩誠 副教授
共同主持人:
計畫參與人員:陳怡伶(博士生兼任研究助理)
成果報告類型(依經費核定清單規定繳交):□精簡報告 ■完整報告
本成果報告包括以下應繳交之附件:
□赴國外出差或研習心得報告一份
□赴大陸地區出差或研習心得報告一份
□出席國際學術會議心得報告及發表之論文各一份
□國際合作研究計畫國外研究報告書一份
處理方式:除產學合作研究計畫、提升產業技術及人才培育研究計畫、
列管計畫及下列情形者外,得立即公開查詢
□涉及專利或其他智慧財產權,□一年■二年後可公開查詢
執行單位:國立台灣大學昆蟲學系
中 華 民 國 九十七 年 三 月 十六 日
摘要
當生物因環境中逆境因子刺激或受到天敵威脅時,生物胺(biogenic amines)於不同物種體內 可以調控某些生理與行為的改變,作為防禦及應變措施。而昆蟲受到驚嚇或於長距離飛行 時,逆境荷爾蒙(stress hormone)-鱆胺(octopamine)會調控生理使血糖濃度上升,滿足能量需 求。由於目前對於昆蟲神經中樞系統如何調控逆境生理反應所之不多,因此本研究初步的 研究重點在於(1)利用低溫、CO2 昏迷與垂直旋轉三組逆境刺激,於外勤蜂覓食行為的改變 來界定是否受到逆境刺激的影響;(2)再根據行為研究的結果,以逆相式高效率液相層析儀 (Reverse-phase HPLC)來測量外勤蜂腦部生物胺-鱆胺、多巴胺(dopamine)與血清素(serotonin) 分泌量的變化情形。結果顯示當外勤蜂受到不同的逆境刺激後,在來回餵食器的時間間隔 上,產生顯著的延遲現象;腦部生物胺量測量的結果發現,不同的逆境刺激引發腦部除了 血清素以外的兩種生物胺在分泌量上的下降。推論外勤蜂受到逆境刺激後,引發腦中不同 物質,包括鱆胺與多巴胺的變動以改變某些生理狀態,並可能導致覓食行為產生延遲的現 象。 關鍵詞:逆境生理、生物胺、鱆胺、覓食行為、外勤蜂Abstract
The mechanisms of stress responses are very important to protect animal’s life, when they confronted with the sudden environmental changes or predators. In this research, we want to understand how these stress treatments (CO2 anesthesia, chilling anesthesia and vertical spin)
affected honeybee workers in their foraging behavior. Furthermore, the HPLC was used to measure the levels of the octopamine, the so called stress hormone, and other biogenic amines such as dopamine and serotonin in these stressed bee brains. The results show that a longer time interval in bee’s foraging behavior were observed and the concentrations of octopamine and dopamine revealed significant reduced in bee brains after stress treatments. Therefore, our results suggested that both octopamine and dopamine are the crucial compounds for stress responses that involved in the delayed foraging behavior of stressed bees.
目錄
摘要... I
Abstract ...II
目錄... III
章節
1. 前言... 1
2. 文獻摘述... 3
3. 研究方法... 7
4. 結果與討論... 9
5. 計畫成果自評...11
參考文獻...12
表...20
圖...24
前言
現今存活且具優良適應環境能力的生物物種,無不是經過嚴厲的自然選汰與長時間的演化 而來。因此各種生物在面臨環境的瞬息萬變與天敵等這些具有威脅性的刺激時,皆已具備 良好的適應與應變機制才得以延續生命與繁衍後代。以哺乳動物為例,當遭受到突發狀況 或緊張的狀態時,位於腦部的下視丘 (hypothalamus)便發出訊號,經由神經與內分泌系統 分別到達腎上腺促使釋放正腎上腺素、腎上腺素與一些固醇類物質,藉以分解肝糖來增加 血液中葡萄糖量以備能量的需求1。在魚類的研究發現,廣鹽性魚類能在不同鹽類濃度的水 中迅速的調節生理機能適應環境2-5。甚至一般認為較原始的線蟲也會因環境改變的刺激而 調整基因的活動,最後調控行為的改變 6,7。這些能夠適應或應付環境與生物因子改變的機 制,在物種演化過程中皆因能夠提供最高的適存值而被保留下來 8。而可能造成威脅的刺 激,包含環境與天敵等因子稱為逆境 (stress)。物種為了應付這些可能危及體內平衡的物理 性或感受性的威脅,會藉由調控神經、內分泌系統與基因表現引發逆境生理 (stressphysiology)或行為上的逆境反應 (stress response)9-11。
逆境生理在脊椎動物特別是哺乳類的研究上有相當深入的探討,但是在脊椎動物上的探討 則相當有限。研究指出哺乳類與昆蟲在嗅覺學習相關的神經系統上具有生理機制與解剖學 上的相似性 12。生物內存在的逆境生理調控機制,是由數千甚至數億年長時間演化而來。 以演化觀點提出的假說認為:脊椎動物逆境生理的調控機制源自於無脊椎動物的神經系統 10 。其證據除了低等無脊椎生物早在地質年代的原生代就已經出現外,可由無脊椎與脊椎動 物的免疫與神經系統利用相似的細胞訊息物質與類似的訊息傳遞過程窺知一二。再者如同 哺 乳 類 動 物 , 無 脊 椎 動 物 在 免 疫 與 神 經 系 統 間 也 具 有 良 好 的 雙 向 溝 通(bi-directional communication) 。因此推測無脊椎動物與脊椎動物的逆境生理調控機制可能共享某些相同 的調控路徑。當內在或外在的逆境刺激出現時,會干擾或影響生物體內的恆定,為了重建 體內恆定生物體內會啟動逆境生理機制;相反的過度逆境反應亦可能帶來負面的影響 11。 在哺乳類動物的逆境生理研究已經相當的詳細與廣泛,特別在醫學上。係因為一方面逆境 刺激啟動了適應機制與增加能力使個體可以應付緊急的狀況,達到促進生理健康與良好生 存的目的;另一方面過度或長期的逆境刺激可能為個體帶來傷害例如疾病的發生 13。然而 目前對於無脊椎動物的逆境生理無論在行為或分子機制方面的研究所知甚少。尤其對於生 存於地球超過兩億五千萬年,且種類的多樣性與適應性為動物界之首的昆蟲而言,對於其 逆境生理的研究至今未有深入的探討。過去許多文獻曾經描述昆蟲為較原始或較低等的物 種,但是在昆蟲的生活史中包含了胚胎期、後胚胎發育期、繁殖、各種生理代謝與不同的 行為模式,這些都是需要非常完美的訊息傳遞機制,並且需要非常精密與協調的神經內分 泌控制系統才能完全掌握。因此在昆蟲的逆境生理調控機制的研究上,我們不禁要問其中 參與的化學物質有哪些種類?其調控的路徑為何又有哪些方式? 過去基因體 (Genomics)時代對於生物基因序列的描述造就了生物及醫藥技術的大革命。目 前已知超過七十多種種生物的完整基因序列已經被定序完成,其中包含了細菌、線蟲、植 物、昆蟲以及脊椎動物甚至是人類 14, 15。基因序列解密完成即宣告了基因體時代的尾聲而 蛋白質體時代的來臨。這些已知生物的基因組序列為未知的分子化學物質的發現與研究上 提供了非常好的機會。因此近幾年來各種蛋白質與胜肽的構造及功能在分子層次的研究中
已經成為主流。在西元2006 年四月蜜蜂 (Apis mellifera)的基因組已完全被科學家解開,並 發表於同年十月號第 443 捲的 nature 雜誌上16。蜜蜂是繼果蠅 (Drosophila melanogaster) 與岡比亞瘧蚊 (Anopheles gambiae)後,第三個序列被完整解開的昆蟲。與前兩者不同的是: 蜜蜂為社會性昆蟲,腦中具有一百多萬個神經元,其數量為果蠅的四倍之多;蜜蜂的工蜂 會學習與記憶蜜源植物的味道、形狀和所在位置,並隨著覓食次數的增加來校正並且提高 覓食的效率;此外蜜蜂為除了靈長類動物以外具有彩色視覺的動物 17。種種優點使得蜜蜂 無論在分子生物、神經生物或動物行為學的研究中,都是首選的研究對象。除了 nature 雜 誌外,science 雜誌也刊登了由比較基因序列到蛋白質體學的方式來探討蜜蜂腦中神經胜肽 相關文章18。昆蟲腦內的逆境生理反應是否與目前所知的脊椎動物逆境生理反應一樣呢?如 是,隨著蜜蜂基因體解序開放之際,蜜蜂的神經系統是否可被應用來作為研究逆境生理或 神經性疾病的模式動物(animal model)呢?這個答案是肯定的。比較因氧化壓力(oxidative stress)造成蜜蜂嗅覺記憶損傷與人類阿茲海默症(Alzheimer's disease, AD)和帕金森氏症 (Parkinson disease, PD)的成因可發現,皆導因於相似的神經細胞可塑性(neuronal plasticity)
的退化過程12。因此以蜜蜂作為模式動物將可有益於了解人類一些疾病的成因。 因此在本研究中,我們想要從昆蟲受逆境刺產生的不正常行為與腦內逆境生理所參與的物 質開始進而探討整個腦內逆境生理的調控機制。我們將以蜜蜂為研究對象,利用其工蜂到 固定蜜源採食花蜜的行為現象(即所謂 flower constancy) 19,20,對其進行逆境刺激,以引發其 逆境生理及行為反應:(1)首先觀察其行為的改變與分析腦內與逆境生理相關的化學物質; (2)在神經胜肽類的研究方面,利用逆向式高效率液相層析儀(Reverse-phase HPLC)進行 蜜蜂腦內肽類物質的分離與萃取,進一步使用質普儀(MALDI-TOF)進行胜肽類的鑑定與分 析;(3)利用 RNAi 技術干擾逆境相關胜肽 mRNA 使之無法發揮正常功能,來確定胜肽的功 能性;或knockout 相關胜肽的基因表現,最後再將已鑑定之胜肽注射回該胜肽變異種(mutant strain)的蜜蜂腦內,雙重確定該逆境相關胜肽之功能;(4)找出逆境相關胜肽的主要表現內 分泌/神經細胞與鑑定接受器種類,近一步探討胜肽與接受器結合後引發的詳細分子路徑。 這樣才能完整的描述蜜蜂的逆境生理與了解逆境反應。
文獻摘述
在脊椎動物中,兒茶酚胺(catecholamine)包括多巴胺(dopamine)、腎上腺素(adrenaline)與正 腎上腺素(noradrenalin) 被認為是當逆境存在時第一個反應的物質,而後啟動隨之而來的逆 境反應11。受到逆境刺激時,脊椎動物體內的腎上腺系統快速的反應並調控增加血液中的正 腎上腺素、腎上腺素與一些神經肽類物質11, 21。其主要的荷爾蒙-腎上腺素由腎上腺隨質部 所釋放;而正腎上腺素則由腎上腺隨質部和交感神經末端所釋放。兩種物質共同調控心臟 與骨骼肌,使生物體進入備戰狀態(fight-or flight response)22。另外,逆境生理在中樞神經系 統 (central nervous system, CNS)扮演極重要的角色。當逆境刺激存在時,兒茶酚胺系統的 啟動會刺激大腦的特定部位,例如、海馬迴、扁桃體與下視丘等區域,甚至包括了知覺中 心-前額皮層部11, 23,最後導致生理或行為上的改變。另外在魚類最近的研究結果發現吳郭 魚由低張溶液置換成高張溶液時,大腦細胞內的訊息傳遞 (signal transduction)在即短的時 間內就產生變化,比任何已知的生理反應都來得迅速2-5。 無論在脊椎或無脊椎動物,生物胺 (biogenic amine)被認為在調控感覺器官、影響中央神經 系統的狀態與起始行為的改變上扮演了相當重要的角色24。在無脊椎動物的研究中,鱆胺 (octopamine)最早於章魚的唾腺中被發現25,為生物所合成的單胺類,其結構與功能類似於脊椎動物的正腎上線素,此外兩者的接受器皆屬於G-protein coupled receptors (GPCRs)24。 鱆鞍分泌細胞與正腎上腺素分泌細胞其神經原訊息輸入端分別存在於觸角葉與嗅球,當與 相對的GPCRs結合後,增加細胞中的cAMP進而活化protein kinase A(PKA),再由PKA去磷 酸 化( 活 化 ) 重 要 的 蛋 白 質 , 例 如 : cAMP response element binding transcription factor(pCREB)26。其生理功能在於可以作神經傳導物質 (neurotransmitter)、神經調控物質 (neuromodulator)及神經激素(neurohormone)24, 27, 28,並能調控體內能量的代謝及參與“打或 跑”的行為反應24, 29-32。例如、當昆蟲受到驚嚇或於長距離飛行時,鱆胺會促進昆蟲的脂肪 體進行醣解作用,使血液中的海藻糖濃度上升,以滿足能量需求以應付緊急的逆境刺激24, 29。因此鱆胺在無脊椎動物的生理上具有“逆境激素”之稱24 。外目前於昆蟲中所發現的生物 胺包括乙醯膽鹼、鱆胺、血清素 (serotonin)、兒茶酚胺類、類腎上腺素(synephrine)與組織 胺幾種33,與昆蟲許多的生理生化反應及行為的調控有密切的關聯30-32, 34-47。許多研究發現 昆蟲在不同的逆境刺激下,體內的生物胺濃度會有顯著的變化。例如,利用熱處理的刺激 下,昆蟲體內的鱆胺濃度顯著的上升48, 49。另外研究中顯示社會性昆蟲-蜜蜂腦中包括鱆 胺、血清素、多巴胺,三種主要的生物胺被認為可以調控工蜂擔任不同任務的轉換與維持 50 。但是在不同環境逆境的影響下,例如季節、日齡、不同的蜂群與夾後足處理下,蜜蜂腦 中生物胺濃度也有不同的變化51。因此生物胺無論在脊椎或無脊椎生物的逆境生理上皆扮演 著極為重要的角色。此外生物胺亦牽涉於昆蟲記憶及學習系統43-46。一般認為蕈狀體 (mushroom body)在昆蟲學習及記憶系統上扮演著重要的角色52。研究發現蜜蜂的蕈狀體上 具有高密度的鱆胺受器53。若將鱆胺注射入蜜蜂蕈狀體後,則可增加記憶的儲存及恢復;反 之注射血清素或多巴胺後,則會降低或抑制記憶儲存及恢復54。而根據Menzel等人研究中發 現,工蜂在搜尋食物的過程中,會記憶蜜源地的位置並建立覓食路徑 (foraging pathway), 其覓食路徑以中長期記憶 (mid/long-term memory)的方式儲存於腦中55。 除了生物胺之外,尚有許多不同層次的化學物質參與逆境生理的,包含胜肽類、蛋白質與
各種基因的活動。在過去對於無脊椎動物相關的荷爾蒙與神經胜肽的研究顯示在部分的神 經內分泌與神經系統中,特別是心泌體 (corpora cardiaca, CC) (功能類似脊椎動物的腦垂體
56)中發現結構相似於脊椎動物的荷爾蒙與神經胜肽 (neuropeptide) 10
。這些所發現的化學物 質 相 當 於 脊 椎 動 物 的 : oxytocin, vasopressin, adrenocorticotropin(ACTH), α-melanocytestimulating hormone (MSH), somatostatin, substance P, neurotensin, hypothalamic growth hormone releasing factor, insulin, glucagons, gastrin/cholecystokinin, vasoactive intestinalpeptide(VIP), pancreatic polypeptide (PP), secretin, luteinizing hormone releasing
factor(LHRF)與數種opioids10, 57。隨著蛋白質體技術的發展,近年來在逆境生理機制的研究
中發現新的胜肽例如:novel corticotropin-releasing factor (CRF) type 2 receptor-selective agonists, stresscopin (SCP)/urocortin III (UcnIII)與 stresscopin-related peptide (SRP)/urocortin II (UcnII)58-60。這些與早期所發現的CRF family被認為參與脊椎動物逆境生理的調控61。而 CRF和urocortin的活化與G protein-coupled receptor的結合有關,其中CRF type 1 與type 2
(CRF1 與CRF2)被發現遍佈於脊椎動物的中央與周圍神經系統62-64。
在無脊椎動物體內的FMRFamides 最早於蚌 (Macrocallista nimbosa)的神經系統中被分離
出來65,至今FMRFamide-related peptides為研究相當廣泛的肽類,具有刺激或抑制神經細胞
與肌肉的功能。例如在蝗蟲的跳躍肌中,FMRFamides的釋放會興奮性的刺激前與後突觸神
經細胞66;FMRFamide會造成海兔 (Aplysia californica)感覺神經突觸的反應降低67;與調控 離子的通道 (K+, Ca2+, Cl– channels)的通透性有關68-70;FMRFamide與G-proteins結合調控二 次訊息物質(cAMP, IP3 與arachidonic acid)的濃度71-75。最近的研究顯示FMRFamides會降低 蟑螂(Periplaneta Americana) dorsal-unpaired median neurons訊號(spike)的頻率與降低細胞內
鈣離子的濃度,並推測可能與其周圍的生物胺-鱆胺的釋放有關76。
在果蠅(Drosophila melanogaster)與岡比亞瘧蚊 (Anopheles gambiae)的研究中發現,昆蟲的 腦部最少有35種神經胜肽基因77-84。隨著質普儀 (mass spectrometry)與層析的技術提升78, 85,近年來Clynen等人更提出了peptidomic的概念86 :就是利用更加精確的分析技術來鑑定 及研究這些比蛋白質更小的物質-胜肽。配合生物基因序列的定序,使得所發現的胜肽能夠 從已知的基因序列去預測胜肽的前驅物質:GPCRs, peptide-processing enzymes和肽類訊息 傳遞有關的蛋白(可以調控細胞表現神經胜肽的transcription factors)14, 15, 79, 83, 87-89。在早期利 用免疫染色化學(immunocytochemistry)與原位雜合技術 (in situ hybridizaiton)了解大部分已
知的昆蟲神經胜肽存在於中間神經元(interneuron)、神經內分泌與分泌細胞中80, 90, 91。但在 神經胜肽所扮演的生理角色上僅止於circulating hormones92, 93,甚至在昆蟲腦部的功能亦眾 說紛紜。一般認為神經胜肽的作用為神經調控物質或者是co-transmitters而非典型的神經傳 導物質80, 90, 94 。其co-transmitters存在的位置與神經傳導物質相同但主要的功能是作用於離 子通道形式的受器 (ion-channel-type of receptor) 95。神經胜肽的大小範圍從數個到一百個胺 基酸序列左右,其源自於較大的蛋白質前驅物,並在細胞質網內經過截切及修飾作用才會 成為具有生物活性的神經胜肽86。在許多研究中發現,一種神經胜肽前驅物包含了數種神經 胜肽的同分異構形式,或者一種前驅物上相關的神經胜肽皆擁有相同的motif。部份前驅物 製造出相似的神經胜肽,但是其他的則是生產出不同活性的肽類96。因此也許不同功能神經 胜肽可能源自於同一個前驅物,所以在一個完整生理機制的研究上找出神經胜肽的共同的 前驅蛋白質是很重要的。
綜合以上,昆蟲對逆境刺激的反應亦有其被保存下來的逆境生理機制。對於逆境刺激所產 生的生理反應是否有一定的規律可循,至今仍未有確切答案。現今昆蟲逆境生理學的研究 發展大多以分子生物技術探討昆蟲的heat shock gene為主體,又稱為stress gene。再者就是 探討生物胺在昆蟲受到逆境刺激後濃度的變化情形再加以推測與逆境生理的相關性。例 如、昆蟲在受到逆境刺激時體內的鱆胺量會立刻上升,使血液中的trihalose利用率提高24, 29, 97-100 ,猶如人體內的腎上腺素與血糖在逆境刺激時升高一樣11, 21。但是在其他方面諸如神經 胜肽類、胺基酸類等等的神經分泌物質在昆蟲受到逆境刺激後產生逆境生理時對中樞神經 系統的調控機制則知之甚少。昆蟲的主要感覺器官主要集中頭部,當逆境刺激存在時會立 即影響頭部的感覺器官並將訊息傳入大腦內。例如前述的吳郭魚由低張溶液置換成高張溶 液時,大腦細胞內的訊息傳遞(signal transduction)在即短的時間內就產生變化,比任何已知 的生理反應都來得迅速2-5。另外再加上昆蟲腦部的血腦屏障的隔絕52,推測昆蟲腦內的逆境 生理的調控機制可能是當逆境刺激存在時首先被啟動的。因此在本研究中,我們想要從昆 蟲受逆境刺產生的不正常行為與腦內逆境生理所參與的物質開始進而探討整個腦內逆境生 理的調控機制。實驗中我們將以蜜蜂為研究對象,利用其工蜂到固定蜜源採食花蜜的行為 現象(即所謂flower constancy) 101, 102,對其進行逆境刺激,以引發其逆境生理反應,再觀察 其行為的改變與分析腦內逆境生理相關的化學物質。初步的研究發現逆境刺激(冰昏、CO2 麻醉或垂直旋轉)會引發蜜蜂的採蜜行為異常,即接受過刺激後的工蜂來回採食蜜源的時 間間隔延遲。除了在覓食行為的改變外,也觀察到經過低溫與CO2處理的外勤蜂由昏迷中 甦醒時,皆會立即清理複眼及觸角。由於發現工蜂來回採食花蜜的時間延遲現象並非肇因 於其飛行能力降低,而是在正常飛行狀況下離開蜜源。因此,我們大膽假設所施予工蜂的 逆境刺激可能對工蜂的中樞神經系統造成了某種影響。為了審慎地檢查蜜蜂大腦內所產生 的變化,我們初步利用衍生反應(derivation)使生物胺類的化合物產生具有螢光特性,以 供HPLC的螢光偵測器分析並比較逆境刺激(處理組)與無逆境刺激(對照組)工蜂腦內其 生物胺類的神經傳導物質(鱆胺、多巴胺及血清素)在於量上的變化。另一方面,我們將探討 逆境生理相關的胜肽化合物種類。同樣的利用逆向式高效率液相層析儀(Reverse-phase HPLC)進行胜肽化合物的分離與純化,而後將分離後收集而來的樣品質進一步使用質普儀 (MALDI-TOF)進行胜肽化合物的定序與分析。在神經胜肽類的分析與鑑定的研究上,我們 與比利時魯汶大學的動物研究所合作進行這項研究。目前世界上專精於研究昆蟲的 neuropeptide的分析與鑑定並有豐富的資料庫的研究群首推比利時魯汶大學動物學研究所 Prof. Arnold De Loof的團隊。由於種種因素,神經胜肽類分析與鑑定的研究尚未完成。但初
步的結果發現,受CO2昏迷處理的樣品中,肽類的總數多於受到受低溫昏迷處理的樣品。
由上述初步試驗結果做成以下的推論:1. 生物胺類的鱆胺、多巴胺及血清素與逆境生理反 應的關係仍待進一步探討;2. 被逆境處理所引出來的novel compounds 可能包含各類的神 經傳導物質(amino acids、biogenic amines、peptides),而這些未知的化合物可能為一般正 常生理狀況下不被表現出來或釋放出來的,相當值得深入研究。對於這些novelcompounds 的出現,除了分析其成分之外,其在生理上所扮演的角色及功用,則為本計劃擬研究的重 點。藉由本計劃的執行,除了對於目前所知有限的幾類昆蟲大腦內的化合物種類在逆境生 理中所扮演的角色可做深入的探討之外,開發未知的化合物與探討其生理功能將有助於我 們進一步了解在地球上演化相當成功的生物-昆蟲,其神經系統如何應付突如其來的逆境
刺激,並如何在短時間內恢復其生理功能以求生存。另一方面,由於工蜂的取食路徑為其 長期記憶(long-term memory)的行為表現結果54,而受到逆境刺激處理的工蜂迷失於其原先 的取食路徑,經過一段時間之後又可恢復如前,因此我們假設因刺激所造成的逆境生理在 大腦內很可能與記憶有關。事實上,前人的研究亦已證實鱆胺及血清素兩者對於蜜蜂記憶 的儲存與恢復有很大的影響:鱆胺會增進蜜蜂的記憶能力,反之血清素則會降低其記憶的 能力53。由我們初步由液相層析儀分析發現,在接受逆境刺激後的工蜂腦內之鱆胺降低,血 清素升高,因此極可能影響工蜂的記憶能力。如前所述,目前尚有許多未知的腦內化合物 仍待探討其生理功能。因此研究初期的重點在於找出與蜜蜂腦部逆境生理相關化學物質。 首先從蜜蜂取食行為是否會受逆境刺激的影響著手,另外再進一步從生理的角度去探討生 物胺與蜜蜂腦中逆境生理的關聯性。
研究方法
實驗動物與取食路徑的建立:
以國立中興大學霧峰鄉北溝農場所飼育的六箱西洋蜂(Apis mellifera, Hymenoptera: Apidae)為實驗對象。利用餵食器內含市售蜂蜜和二號砂糖混合之水溶液誘引外勤蜂到餵 食器上取食,並慢慢將餵食器移往實驗地點,建立由蜂箱到實驗地點大約 70 公尺的取食 路徑。當取食路徑建立完成後,在實驗地點放置一個固定的餵食器,1-2 天固定更換餵食器 中的糖水溶液,供外勤蜂不斷來回覓食。 外勤蜂逆境處理之行為試驗 接著在十隻蜜蜂的胸部或腹部背板上以不同顏色的壓克力顏料做標記以區分,並記錄 被標記蜜蜂連續來回十次的時間間隔,以確保外勤蜂為正常取食。之後分別以低溫麻醉、 CO2 麻醉、垂直旋轉等三逆境種處理使被標記的蜜蜂昏迷或感受到逆境刺激。待被處理的 蜜蜂恢復,將自然飛離餵食器後並再度回到餵食器上的時間間隔紀錄下來,作為該逆境刺 激的處理反應(treatment response)。之後再持續紀錄該蜜蜂隨後連續來回十次的時間間隔。 三種逆境處理分述如下: 一、 低溫麻醉 當外勤蜂在餵食器上取食時,用塑膠試管(直徑16 mm, 長100 mm, 容量15 ml)輕輕 的蓋住蜜蜂並小心地引導進入試管中,並蓋上蓋子後將該試管埋入碎冰中。經過四分鐘後 (包括一分鐘內完全昏迷再持續冰三分鐘)將蜜蜂取出置於餵食器附近的恢復盤上,待蜜 蜂恢復後自然飛離。記錄甦醒自然飛離後再度回到餵食器的時間間隔,作為低溫麻醉的處 理反應。之後再紀錄十次連續來回的時間間隔。並再重複一次前述動作,並記錄冰昏第二 次後飛離及飛回餵食器的間隔時間,及其後十次的來回時間。實驗數據的顯著差異性分析 以t-test 做檢測。 二、CO2 麻醉 抓取外勤蜂的方式如同低溫麻醉,不同處在於將試管中的蜜蜂置入已充滿CO2 的塑膠 袋中。待蜜蜂昏迷後(五秒內),分別經過兩分鐘或四分鐘處理後,將蜜蜂取出置於恢復 盤上,待蜜蜂恢復後自然飛離。記錄方式同低溫麻醉,但與低溫麻醉不同的是無論是兩分 鐘或四分鐘麻醉都只有做一次的處理。實驗數據的顯著差異性分析以t-test 做檢測。 三、 垂直旋轉處理 將裝有蜜蜂的試管置於垂直旋轉式震盪器(Firstek Scientific; T-101; 旋轉半徑150 mm) 上旋轉。此處理包含三種旋轉速度分別為40、50 與60 rpm,而每一種速度各分別處理30、 60 與90 秒。而對照組(spin control)則僅將外勤蜂放置試管內90秒不經過旋轉處理。處 理後將蜜蜂施放餵食器附近,自然飛離。實驗數據的分析係利用two-way ANOVA 及顯著 差異多重比較做檢測。 外勤蜂逆境處理之腦部生物胺分析 外勤蜂腦部生物胺分泌量分析係使用逆向式高效率液相層析儀(Reversed-phase HPLC) 測量並比較外勤蜂受到逆境處理(實驗組)與外勤蜂未受到逆境處理組(對照組),其腦中生物 胺 (鱆胺、血清素與多巴胺)含量的差異性。其蜜蜂腦液萃取的方法與逆向式高效率液相層 析法係分別參考Harris and Wooding (1992)與Wood and Hall (2000)所發表的文章51, 103。詳細
的方式與層析法描述如下: 一、蜜蜂腦液的萃取方式 將外勤蜂頭部剪下固定於含有蜜蜂生理食鹽水的解剖盤中,並將解剖盤置於解剖顯微 鏡下,利用尖銳的聶子將蜜蜂的腦剖出並移除多餘的氣管組織與下食道神經球。將完整的 腦置於含有2% 140μl的EDTA水溶液1.5ml的微量離心管中,一直累積到20顆腦(一個樣 品)。之後利用研磨棒將微量離心管中的腦組織均質化後,利用超音波細胞破膜機 (10-15 分鐘)破壞細胞模,完全將細胞內的微量化學物質釋放出來。最後再利用高速離心機控溫在 4℃下離心10分鐘(轉速為13000 rpm)後,取其上清液後通過孔徑為0.22μm的過濾膜,並將最 後得到的乾淨樣品置換至新的微量離心管中備用。 二、蜜蜂腦內生物胺的偵測 甲、標準品與校正曲線 將三種標準品分別以0.1 M HCl稀釋為1.25 mM作為儲存溶液並冰存於4℃中。在製作 校正曲線之前,將三種儲存液分別梯度稀釋成不同濃度的溶液(OA: 0.05-0.5 μM; DA: 0.05-0.35 μM; 5-HT: 0.05-0.5 )。利用reserve phase HPLC來測量這些稀釋後不同濃度 的標準品溶液,將所得之圖普作面積積分,再做直線回歸曲線之計算便可得不同標 準品分別相對應之校正曲線。 乙、逆相式層析法 在 室 溫 下 利 用 逆 相 式 層 析 設 備 進 行 樣 品 與 標 準 品 之 分 析(HPLC system: SpectraSYSTEMTM P1000 isocratic pumps, solvent degassers, SSI 502 fluorodetector: Scintific systems, inc., USA)。分離管柱則選取規格為5μm Thermo Hypersil-Keystone BDS C18(150 × 4.6 mm I.D.) 的分離管。在逆相式層析法中使用的動相溶液分成A與B
兩種即動相A與動相B。其組成成分如下:
動相A: 0.05% aqueous trifluoroacetic acid(TFA)-Methanl (97.5: 2.5, v/v) 動相B: 0.05% aqueous trifluoroacetic acid(TFA)-Methanl (40: 60, v/v)
這些移動相溶液在使用前必須利用氦氣去除多餘的空氣或氣泡。液相層析儀的流速 設定在1 ml/min,其動相A與動相B的梯度配對時間為:0.00 min, 100% A; 1.00 min, 100% A; 16.00 min, 50% A and 50% B; 16.1 min 100% A~20min.。螢光偵測器的偵 測波長為: excitation at 220 nm, emission at 32- nm。利用標準品出現之時間來對應樣 品中成分峰液出現的時間質來確定實驗中所需的生物胺成分峰。液相層析儀所發出 訊號將由訊號擷取系統(Model NI 345x, National instruments, Austin, TX, USA)(Notch Filter= 60.00 Hz)擷取到電腦中,並利用LabVIEW軟體(ver. 6.0, Nation Instruments, Austin, TX, USA)呈現,其成份峰面積則利用分析軟體-Origin data system software (ver. 7.0, OriginLab Co., Northampton, MA, USA)來進行積分與作顯著差異性分析。
結果與討論
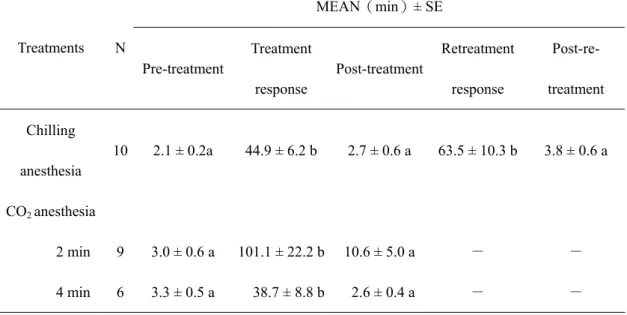
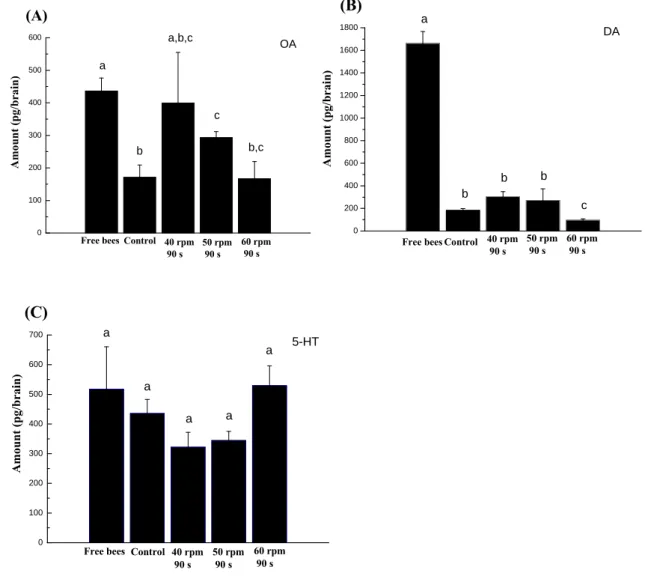
一、 逆境處理對外勤蜂覓食時間間隔的影響 (1) 低溫麻醉 外勤蜂在低溫處理之後,不到一分鐘的時間便開始漸漸甦醒。甦醒中的外勤蜂的會 開始活動觸角與足並在原地清理觸角與複眼。經過十分鐘到一個小時不等的恢復時 間,蜜蜂會開始飛離餵食器。未低溫處理時前,蜜蜂來回餵食器的時間間隔為 2.1 ± 0.2 分鐘;同批蜜蜂在第一次低溫處理後來回的時間間隔(稱為處理反應)為44.9 ± 6.2 分鐘;繼處理反應後來回的平均時間為2.7 ± 0.6分鐘;接著第二次低溫處理後的 處理反應為63.5 ± 10.3分鐘;之後平均來回的時間間隔為3.8 ± 0.6 分鐘。經t-test 統 計分析的結果顯示,低溫處理後的蜜蜂來回的時間間隔(處理反應)皆顯著增加(表 一)。 (2) CO2 麻醉 外勤蜂經過CO2 麻醉的處理後,其甦醒的情形大致與在低溫處理後的情形相同。在CO2 麻 醉處理前和處理反應之後的來回時間間隔大約為3 分鐘;在經過CO2麻醉兩或四分鐘處 理,其處理反應分別為101.1 ± 22.2 分鐘與38.7 ± 8.8 分鐘。經統計分析的結果發現CO2 麻 醉的處理後的反應呈現顯著增加。由數據顯示外勤蜂以低溫與CO2 麻醉處理後,在來回餵 食器覓食的時間間隔皆產生延遲的現象(表一)。 (3) 垂直旋轉處理 較前兩種處理方法不同的處,在垂直旋轉處理下,外勤蜂不會有昏迷的狀況。而經過處理 後將其施放到餵食器的附近,大多數的外勤蜂即立刻飛離。經two-way ANOVA 統計分析 後,結果顯示兩個因子(轉速與持續時間)對於外勤蜂於實驗地點取食行為之時間間隔皆有影 響(表二)。在垂直旋轉處理前的部分,不同轉速(40、50 與60 rpm)持續30 或60 秒處理下反 應皆無呈現顯著差異(表三)。而在40、50 與60 rpm 皆持續90 秒的處理下,其反應分別為 5.5 ± 1.0 分鐘、6.3 ± 1.4 分鐘、與 8.6 ± 1.9 分鐘,與對照組(2.9 ± 0.5 分鐘)比較皆呈現顯 著差異(表四)。顯示在經過垂直旋轉處理後,蜜蜂在來回覓食的時間間隔仍會有顯著延遲的 現象。而此種處理的反應時間間隔遠短於低溫或CO2 麻醉者,由此可知低溫或CO2 麻醉逆 境刺激對於外勤蜂的生理影響較大,故可能需要較長的時間恢復正常的生理功能。根據逆 境行為的觀察結果發現,以低溫、CO2 麻醉與垂直旋轉處理後,顯著的增加外勤蜂來回餵 食器覓食的時間間隔。其中昏迷處理(低溫與CO2 麻醉處理)後的來回時間間隔比較非昏 迷處理(垂直旋轉處理)後的時間間隔多了十倍以上的時間。昏迷後的外勤蜂除了需要較 長的恢復時間之外,另外可觀察到外勤蜂甦醒後,會利用前足不斷的清理觸角與複眼。由 此可反映出,昏迷處理對於外勤蜂造成的影響遠大於非昏迷處理。 外勤蜂甦醒之後不斷清理觸角與複眼的行為與近年來發現田間中毒的外勤蜂行為相同104。 在1994 年法國的蜂農發現大量的蜜蜂有異常的行為並且大量死亡,造成了法國農業極大的 損失。觀察發現這些蜜蜂似乎無法正常的返回蜂巢,而是在蜂巢四周及田間作物上停留, 並且不斷的清理觸角及複眼。雖然這些蜜蜂不會立即死亡,但是卻無法正常的執行工作, 因此造成蜜蜂族群越來越弱,蜂產品的收成大幅降低。而經過一連串的研究發現,殺蟲劑 益達胺為蜜蜂中毒事件的罪魁禍首。益達胺對昆蟲具有高度的神經毒性105,通常施用於向日葵田間毒殺害蟲。因此當蜜蜂到向日葵田中覓食,可能接觸到植物上的殺蟲劑而中毒。 前人研究並且指出益達胺會降低蜜蜂的學習能力106。蜜蜂中毒的行為與本研究逆境行為的 觀察結果相同,此種固定的蜜蜂行為模式,未來可以用於初步環境污染監測的應用。 二、逆境處理對外勤蜂腦內生物胺量變動的影響 根據上述行為實驗的結果,利用能導致外勤蜂覓食時間間隔延遲的逆境刺激處理外勤蜂, 再以高效率液相層析法分析腦中鱆胺、多巴胺與血清素量的變化情形。結果發現在低溫昏 迷處理下外勤蜂腦中的鱆胺及多巴胺與對照組比較後,呈現顯著下降(鱆胺: 270.63 ± 12.88
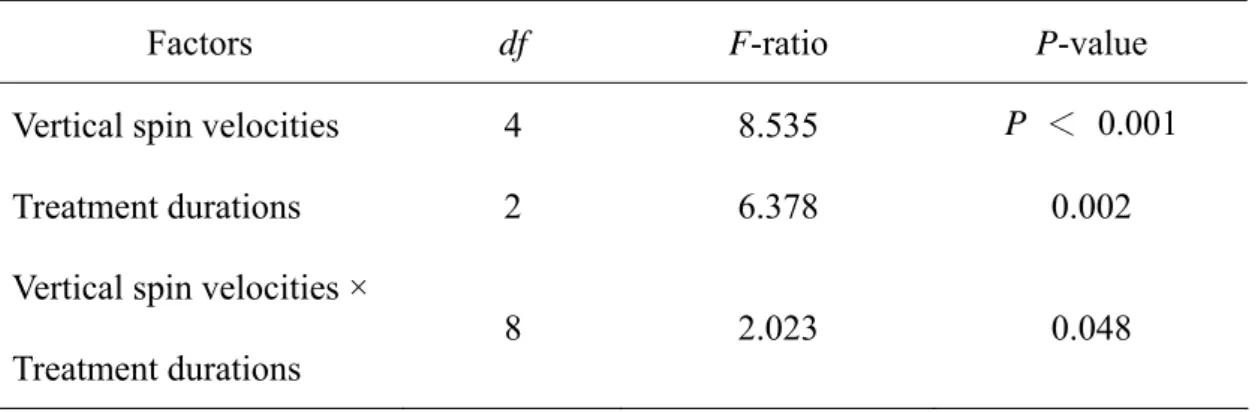
pg/brain, P = 0.02;多巴胺: 329.49 ± 92.66pg/brain, P = 0.00265)(圖一)。以CO2 處理兩或
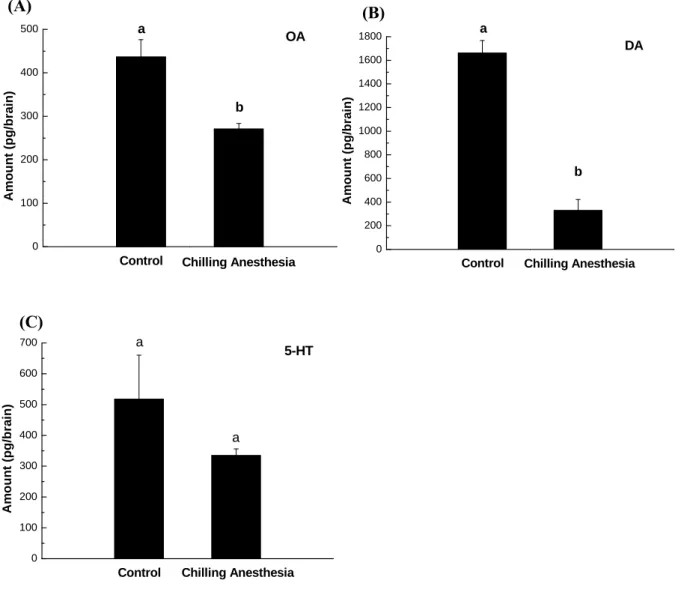
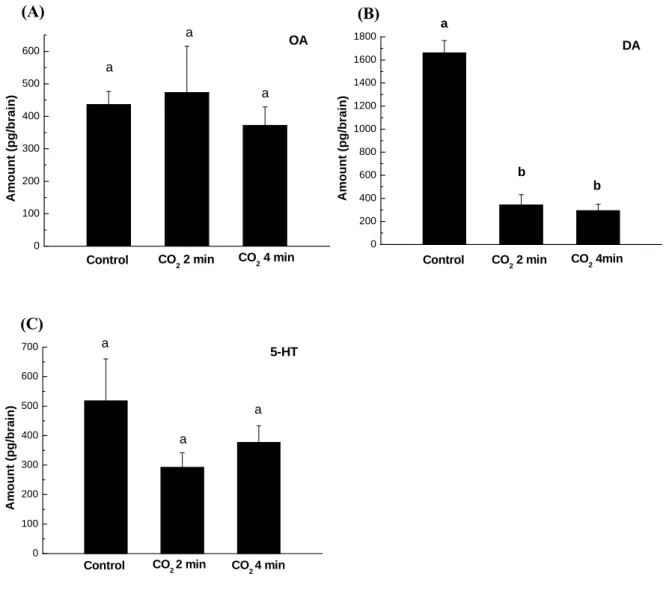
四分鐘後,僅多巴胺有顯著下降(CO2 兩分鐘:343.45 ± 89.22 pg/brain, P = 0.01090;四分 鐘:293.24 ± 55.73 pg/brain, P = 0.00103)(圖二)。因此在昏迷處理的狀況下,無論是CO2 兩 或四分鐘昏迷處理或低溫處理,皆會影響蜜蜂覓食時間間隔的規律性,而外勤蜂腦部鱆胺 或多巴胺也會因此而導致量上的變化。 而在非昏迷的逆境處理部份,以不同垂直旋轉速度(40、50 與60 rpm)持續90 秒的逆境 處理外勤蜂(取20 隻外勤蜂腦為一個樣品);對照組為將外勤蜂關在試管內90 秒的處理。 但對照組對於外勤蜂而言亦是一種逆境處理,所以在這個部分另外隨機取20隻(完全未經逆 境處理)外勤蜂(free bees group)做為整體的比較。實驗結果顯示鱆胺在50 與60 rpm 90 秒 處理及對照組分別與free bees group 比較時皆呈現顯著的降低(P = 0.031; P= 0.015; P< 0.01),而隨著轉速的增加鱆胺在腦中的量則出現減少的趨勢。而多巴胺則在此種處理下 皆呈現極顯著的降低 (P < 0.01);血清素則無顯著的改變(圖三)。在垂直旋轉的逆境刺激 下,覓食時間間隔的延遲與外勤蜂腦中的鱆胺或多巴胺量的變動有密切的關係。前人的研 究發現,在蜜蜂的覓食路徑-蜜蜂由蜂巢出發到達一處蜜源地後,經過一段時間,若選擇 停留原處取食,稱為intra-patch choices;若選擇另一處蜜源地則稱為inter-patch choices。而 整個行程,自離巢後至再度回巢的路徑則稱為interbout。建立intra-patch 的記憶需要數秒鐘 至數分鐘的時間,屬於前短期記憶(early short-term memory);而建立inter-patch 的記憶 則需要數分鐘至數小時的時間,屬於後短期記憶(late short-term memory);最後形成interbout 的時間則需要數小時至數月的時間,屬於中長期記憶(mid/long-term memory)55。另外Erber 等人(1980)的研究中指出,對蜜蜂腦中蕈狀體(mushroom body)的calyx area,做5-10 秒
鐘的低溫處理,則會損害記憶的形成107。而本研究的觀察發現,外勤蜂受到逆境刺激後, 在飛離餵食器時,並無異常的行為產生,亦不會立即返回巢中,因此推測可能是中長期記 憶受到損害,而導致外勤蜂在來回時間間隔上的延遲現象。腦中生物胺在昆蟲的學習與記 憶上亦扮演了重要的角色,若將鱆胺微量注射到蜜蜂的calyces 中,則增加記憶的儲存和恢 復記憶;而注射血清素則會降低記憶,另外注射多巴胺至腦中central complex 附近時,亦 有助於記憶的恢復54, 108。而本研究的結果發現,以低溫及轉速50 與60rpm 持續90 秒的處 理會引起腦中的鱆胺和多巴胺分泌量顯著下降;而經CO2 處理後,僅多巴胺有顯著的下降。 因此結合前人的研究與實驗的結果推測,蜜蜂受到逆境刺激,導致腦中化學物質的濃度改 變(包含鱆胺與多巴胺含量的下降),並調控的生理亦有可能與中長期記憶的暫時中斷有 關,最後導致覓食時間間隔上的延遲。至於這些化學物質調控的機制,就目前的研究顯示, 仍所知有限。
計畫成果自評
本研究計畫在初期的研究成果中發現了逆境刺激不但會造成外勤蜂在取食行為上有延遲的 現象,而且也發現腦部中生物胺在分泌量上有顯著的差異性。研究成果已經投稿於Archives of insect biochemistry and physiology期刊(正在投稿中)。也因為這個部分的研究成果進一步 發現除了生物胺與腦部的逆境生理相關外,亦存在著其他物質例如肽類或蛋白質可能與逆 境生理或逆境反應的調控有關。因此下一階段的研究重點著重於肽類或蛋白質等逆境反應 相關化學物質之鑑定與分析。
另外承蒙國科會國合處的經費補助,我們健全了原本儀器設備上不足的地方,完整的建立 一套效率更好且臨敏度更高的高效率液相層析設備(HP 1100系列),再搭配高臨敏度的庫倫 式電化學偵測器( ESA Coulochem III ),可用於蜜蜂單顆腦內生物胺量的測量。在蜜蜂腦類 逆境生理相關肽類與蛋白質的純化與萃取方面的設備有:高效率液相層析設備搭配二極體 陣列檢測器 (HP 1100系列)與自動分流收集器 (HP 1200系列)。部分的補助經費則是補助博 士班學生至比利時魯汶大學Prof. de Loof 研究室中取經,學習肽類與蛋白質的純化與萃取 方法與如何使用質普儀進行分析。無論在設備或技術上,我們已經有完備的分析工具與分 析方式,因此未來可望能在昆蟲腦部逆境生理的研究上有重要的突破。
參考文獻
1. Campbell, N. A., and J. B. Reece. 2002. Chemical signals in animals. pp. 955-974. In: F. Wong-Staal, ed. Biology. Benjamin Cumming, San Francisco.
2. Weng, C. F., C. C. Chiang, H. Y. Gong, M. H. C. Chen, W. T. Huang, C. Y. Cheng, and
J. L. Wu. 2002. Bioenergstics of adaptation to a salinity transition in a Euryhaline Teleost
(orenochromis mossambicus) brain. Expert. Biology Med. 227: 45-50.
3. Weng, C. F., C.C. Chiang, H.Y. Gong, M.H.C. Chen, C.J.F. Lin, W.T. Huang, C.Y.
Cheng, P.P. Hwang, and J.L. Wu. 2002. Acute changes in gill Na+ - K+ - ATPase and
creatine kinase in response to salinity changes in the Euryhaline Teleost, Tilapia (Oreochromis mossambicus). Physiol. Biochem. Zool. 75: 29-36.
4. Lin, L. Y., C. C. Chiang, H. Y. Gong, C. Y. Cheng, P. P. Hwang, and C. F. Weng. 2003. The cellular distributions of creatine kinase in branchial of Euryhaline Tilapia (Oreochromis
mossambicus). Am. J. Physiol. 284:C233-241.
5. Gong, H. Y., J. L. Wu, W. T. Huang, C. J. F. Lin, and C. F. Weng. 2004. Response to acute changes in salinity of two different muscle type creatine kinase isoforms, from euryhaline teleost (Oreochromis mossambicus) gills. Biochim. Biophys. Acta 1657: 184-191.
6. Sokolowski, M. B. 2002. Social eating for stress. Nature 419: 893-894.
7. Chase, D. L., and M. R. Koelle. 2007. Biogenic amine neurotransmitters in C. elegans. pp. 1-15. In: D. L. Chase, and M. R. Koelle, eds. The C. elegans Research Community, WormBook. (http://www.wormbook.org).
8. Alcock, J. 2001. Adaptation and antipredator behavior. pp. 183-213. In: J. Alcock, ed. Animal Behavior: An Evolutionary Approach. Sinauer Associates, Inc. Sunderland, Massachusetts.
9. Pacak, K., and M. Palkovits. 2001. Stressor specificity of central neuroendocrine responses: implications for stress-related disorders. Endocr. Rev. 22: 502-548.
10. Stefano, G. B., P. Cadet, W. Zhu, C. M. Rialas, K, Mantione, D. Benz, R. Fuentes, F.
Casares, G. L. Fricchione, Z. Fulop, and B. Slingsby. 2002. The blueprint for stress can be
found in invertebrates. Neuro Endocrinol. Lett. 23: 85-93.
11. Sabban, E. L., and R. Kevtňanskỳ. 2001. Stress-triggered activation of gene expression in catecholaminergic systems: dynamics of transcriptional evens. Trends Neurosci. 24: 91-98. 12. Farooqui, T. 2007. Octopamine-mediated neuronal plasticity in honeybees: implications for
olfactory dysfunction in humans. Neuroscientist 13: 304-322.
system. Ann. New York Acad. Sci. 816: 102-118.
14. Adams, M. D., S. E. Celniker, R. A. Holt, and C. A. Evans. 2000. The genome sequence ofDrosophila melanogaster. Science 287: 2185-2195.
15. Bargmann, C. I. 1998. Neurobiology of the Caenorhabditis elegans genome. Science 282:2028-2033.
16. Honey Bee Genome Sequencing Consortium. 2006. Insights into social insects from the genome of the honeybee Apis mellifera.Nature 443: 931-949.
17. Menzel, R., and W. Backhaus. 1989. Color vision honey bees: Phenomena and physiological mechanisms, pp. 281-279. In: D. G. Sttavenga, and R. C. Hai-die, eds. Facets of vision. Springer-Verlag, Berlin, Heidelberg, New York
18. Hummon, A. B., T. A. Richmond, P. Verleyen, G. Baggerman, J. Huybrechts, M. A.
Ewing, E. Vierstraete, S. L. Rodriguez-Zas, L. Schoofs, G. E. Robinson, and J. V. Sweedler. 2006. From the genome to the proteome: uncovering peptides in the Apis brain.
Science 314: 647-649.
19. Free, J. B. 1963. The constancy of honeybees. J. Anim. Ecol. 32: 119-131.
20. Waddington, K. D. 1983. Floral visitation sequences by bees: models and experiments. pp. 461-437. In: C. E. Jones, and R. J. Little, eds. Handbook of Experimental Pollination Biology. Van Nostrand-Reinhold, New York.
21. Randall, D., W. Burggren, and K. French. 2002. Glands and hormones. pp. 301-360. In: D. Randall, W. Burggren, and K. French, eds. Animal Physiology: Mechanisms and adaptations. W. H. Freeman and Company, New York.
22. Cannon, W. B. 1927. Bodily changes in pain, hunger, fear and rage- account of recent researches into the function of emotional excitement. Appleton Ged., New York.
23. Bear, M. F., B. Connors, and M. Paradiso. 2001. Chemical control of the brain and behavior. pp. 496-521. In: M. F. Bear, B. Connors, and M. Paradiso, eds. Neuroscience: exploring thebrain. Lippincott Williams & Wilkins, USA
24. Roeder, T. 1999. Octopamine in invertebrates. Prog. Neurobiol. 59: 533-561.
25. Erspamer, V., and G. Boretti. 1951. Identification and characterization by paper chromatography of enteramine, histamine, and allied substances of Octopoda and in other tissues of vertebrates and invertebrates. Arch. Int. Pharmacodyn. Ther. 88: 296-332.
26. Hildebrandt, H., and U. Müller. 1995. Octopamine mediates rapid stimulation of protein kinase A in the antennal lobe of honeybee. J. Neurobiol. 27: 44-50.
27. Orchard, I. 1986. Octopamine in insect: neurotransmitter, neurohormone, and neuromodulator. Can. J. Zool. 60: 659-667.
28. Roeder, T. 1994. Biogenic amine and their receptors in insects. Comp. Biochem. Physiol. C 107: 1-12.
29. Orchard, I., J. A. Carlisle, B. J. Loughton, J. W. D. Gole, and R. G. H. Downer. 1982. In vitro studies on the effects of octopamine on the locust fat body. Gen. Comp. Endocrinol. 48: 7-13.
30. Adamo, S. A., C. E. Linn, and R. R. Hoy. 1995. The role of neurohormonal octopamine during “fight or flight” behaviors in the field cricket Gyrllus bimaculatus. J. Exp. Biol. 198: 1691-1700.
31. Huber, R., and A. Delago. 1998. Serotonin alter decision to withdraw in fighting crayfish, Astacus astacus: the motivational concept revisited. J. Comp. Physiol. A 182: 573-583. 32. Stevenson, P. A., H. A. Hofmann, K. Schoch, and K. Schildberger. 2000. The fight and
flight responses of crickets depleted of biogenic amines. J. Neurobiol. 43: 107-120.
33. Osborne, R. H. 1996. Insect neurotransmission: Neurotransmitters and their receptors. Pharmacol. Ther. 69(2): 117-142.
34. Leibowitz, S. F., and J. T. Alexander. 1998. Hypothalmic serotonin in control of eating behavior, meal size, and body weight. Biol. Psychiatry 44: 851-865.
35. Dacks, A. M., T. Nickel, and B. K. Mitchell. 2003. An examination of serotonin and feeding in the flesh fly Neobellieria bullata (Sarcophagidae: Diptera). J. Insect Behav. 16: 1-21.
36. Brain, P. F., and M. Haug. 1992. Hormonal and neurochemical correlates of various forms of animal “aggression”. Psychoneuroendocrinol. 17: 537-551.
37. Summers, C. H., and N. Greenberg. 1995. Activation of central biogenic amines following aggressive interactions in male lizards, Anolis carolinensis. Brian Behav. Evol. 45: 339-349. 38. Huber, R., M. Orzeszyna, N. Pokorny, and E. A. Kravitz. 1997. Biogenic amines and
aggression: experimental approaches in crustaceans. Brain Behav. Evol. 1: 60-68.
39. Huber, R., R. Smith, A. Delago, K. Isaksson, and E. A. Krazitz. 1997. Serotonin and aggressive motivation in crustaceans: altering the decision to retreat. Proc. Nat. Acad. Sci. 94: 5939-5942.
40. Kravitz, E. A. 2000. Serotonin and aggression: insights gained from a lobster model system and speculations on the role of amine neurons in a complex behavior. J. Comp. Physiol. A 186: 221-238.
41. Murakami, S., and M. T. Itoh. 2001. Effects of aggression and wing removal on brain serotonin levels in male crickets, Gryllus bimaculatus. J. Insect Physiol. 47: 1309-1312. 42. Murakami, S., and M. T. Itoh. 2003. Removal of both antennae influences the courtship
and aggressive behaviors in male crickets. J. Neurobiol. 57: 110-118.
43. Menzel, R., S. Wittstock, and M. Sugawa. 1989. Chemical codes of learning and memory in honeybee. pp. 335-355. In: L. R. Squire, and L. Lindenlaub, eds. The Biology of Memory. Stuttgart, Schattauer Verlag.
44. Erber, J., P. Kloppenburg, and A. Scheidler. 1993. Neuromdulation by serotonin and octopamine in the honeybee: behaviors, neuroanatomy and electrophysiology. Experientia 49: 1073-1083.
45. Hasselmo, M. E. 1995. Neuromodulation of cortical function: modeling the physiological basis of behavior. Behav. Brain Res. 67: 1-27.
46. Harvey, J. A. 1996. Serotonergic regulation of associative learning. Behav. Brain Res. 73: 47-50.
47. Linn, C. E., and W. L. Roelofs. 1986. Modulatory effects of octopamine and serotonin on male sensitivity and periodicity of response to sex pheromone in the cabbage looper moth,
Trichoplusia ni. Arch. Insect Biochem. Physiol. 3: 161-171.
48. Davenport, A. P., and P. D. Evans. 1984. Stress-induced changes in the octopamine levels of insect haemolymph. Insect Biochem. 14: 135-143.
49. Hirashima, A., M. J. Sukhanova, and I. Y. Rauschenbach. 2000. Biogenic Amines in
Drosophila virilis under stress conditions. Biosci. Biotechnol. Biochem. 64: 2625-2630.
50. Wagener-Hulme, C., J. C. Kuehn, D. J. Schulz, and G. E. Robinson. 1999. Biogenic amines and division of labor in honey bee colonies. J. Com. Physiol. 184: 471-479.
51. Harris, J. W., and J. Wooding. 1992. Effects of stress, age, season, and source colony on levels of octopamine, dopamine and serotonin in the honey bee (Apis mellifera L.) brain. J. Insect. Physiol. 38: 29-35.
52. Chapman, R. F. 1998. Nervous system. pp. 533-569. In: R. F. Chapman, ed. The Insect: structure and function. Cambridge University Press, Cambridgy.
53. Erber, J., P. Kloppenburg, and A. Scheidler. 1993. Neuromodulation by serotonin and octopamine in the honeybee: behaviour, neuroanantomy and electrophysiology. Experientia. 49: 1073-1083.
54. Menzel, R., S. Wittstock, and M. Sugawa. 1983. Chemical codes of learning and memory in honeybee. pp. 335-355. In: L. R. Squire, and L. Lindenlaub, eds. The Biology of Memory. Stuttgart, Schattauer Verlag.
55. Menzel, R. S. 1999. Memory dynamics in the honeybee. J. Comp. Physiol. A. 185: 323-340. 56. Clynen, E., J. Huybrechts, G. Baggerman, J. Van Doorn, D. Van Der Horst, A. De Loof,
and L. Schoofs. 2003. Identification of a glycogenolysis-inhibiting peptide from the corpora
cardiaca of locusts. Endocrinology 144: 3441-3448.
57. Aiello, E., E. Hager, C. Akiwumi, and G. B. Stefano. 1986. An opioid mechanism modulates central and not peripheral dopaminergic control of ciliary activity in the marine mussel Mytilus edulis. Cell Mol. Neruobiol. 6: 17-30.
58. Hsu, S. Y., and A. J. Hsueh. 2001. Human stresscopin and stresscopin-related peptide are selective ligands for the type 2 corticotropin-releasing hormone receptor. Nat. Med. 7:605–11.
59. Lewis, K., C. Li, M. H. Perrin, A. Blount, K. Kunitake, and C. Donaldson. 2001. Identification of urocortin III, an additional member of the corticotropin-releasing factor (CRF) family with high affinity for the CRF2 receptor. Proc. Natl. Acad. Sci. USA 98:7570–5.
60. Reyes, T. M., K. Lewis, M. H. Perrin, K. S. Kunitake, J. Vaughan, and C. A. Arias. 2001. Urocortin II: a member of the corticotropin-releasing factor (CRF) neuropeptide family that is selectively bound by type 2 CRF receptors. Proc. Natl. Acad. Sci. USA 98:2843–8.
61. Chang, C. L., and S. Y. T. Hsu. 2004. Ancient evolution of stress-regulating peptides in vertebrates. Peptides 25: 1681-1688.
62. Vita, N., P. Laurent, S. Lefort, P. Chalon, X. Dumont, and M. Kaghad. 1993. Cloning and expression of a complementary DNA encoding a high affinity human neurotensin receptor. FEBS Lett. 317:139–42.
63. Potter, E., S. Sutton, C. Donaldson, R. Chen, M. Perrin, and K. Lewis K. 1994. Distribution of corticotropin-releasing factor receptor mRNA expression in the rat brain and pituitary. Proc. Natl. Acad. Sci. USA 91:8777–81.
64. Suman-Chauhan, N., P. Carnell, R. Franks, L. Webdale, N. S. Gee, S. Mc- Nulty, C.J.
Rossant, D. Van Leeuwen, R. Mackenzie, and M. D. Hall. 1999. Expression and
characterisation of human and rat CRF2alpha receptors. Eur. J. Pharmacol. 379:219–27. 65. Price, D.A., and M. J. Greenberg. 1977. Structure of a molluscan cardioexcitatory
neuropeptide. Science 197: 670–671.
66. Walther, C., K. E. Zittlau, H. Murck, and R. J. Nachman. 1991. Peptidergic modulation of synaptic transmission in locust skeletal muscle. pp. 175–186. In E. Florey, and G. B. Stefano, eds. Comparative Aspects of Neuropeptide Function. Manchester University Press, Manchester.
67. Piomelli, D., A. Volterra, N. Dale, S. A. Siegelbaum, E. R. Kandel, J. H. Schwartz, and
F. Belardetti. 1987. Lipoxygenase metabolites of arachidonic acid as second messengers
forpresynaptic inhibition of Aplysia sensory cells. Nature 328: 38–43.
68. Walther, C., K. E. Zittlau, H. Murck, and R. J. Nachman. 1991. Peptidergic modulation of synaptic transmission in locust skeletal muscle. pp. 175–186. In E. Florey, and G. B. Stefano, eds. Comparative Aspects of Neuropeptide Function. Manchester University Press, Manchester.
69. Cottrell, G.A. 1997. The first peptide-gated ion channel. J. Exp. Biol. 200: 2377–2386.
70. Buttner, N., and S. A. Siegelbaum. 2003. Antagonistic modulation of a hyperpolarization-activated Cl– current in Aplysia sensory neurons by SCP (B) and FMRFamide. J. Neurophysiol. 90: 586–598.
71. Cazzamali, G., and C. J. Grimmelikhuijzen. 2002. Molecular cloning and functional expression of the .rst insect FMRFamide receptor. Proc. Natl. Acad. Sci. USA 99: 12073–12078.
72. Meeusen, T., I. Mertens, E. Clynen, G. Baggerman, R. Nichols, R. J. Nachman, R.
of the invertebrate G protein-coupled FMRFamide receptor. Proc. Natl. Acad. Sci. USA 99: 15363–15368.
73. Willoughby, D., M. S. Yeoman, and P. R. Benjamin. 1999. Cyclic AMP is involved in cardioregulation by multiple neuropeptides encoded on the FMRFamide gene. J. Exp. Biol. 202: 2595–2607.
74. Willoughby, D., M. S.Yeoman, and P. R. Benjamin. 1999. Inositol-1,4,5- trisphosphate and inositol-1,3,4,5-tetrakisphosphate are second messenger targets for cardioactive neuropeptides encoded on the FMRFamide gene. J. Exp. Biol. 202: 2581–2593.
75. Van Tol-Steye, H., J. C. Lodder, H. D. Mansvelder, R. J. Planta, H. Van Heerikhuizen,
and K. S. Kits. 1999. Roles of G-protein beta gamma, arachidonic acid, and
phosphorylation inconvergent activation of an S-like potassium conductance by dopamine, Ala-Pro-Gly-Trp-NH2, and Phe-Met- Arg-Phe-NH2. J. Neurosci.19: 3739–3751.
76. Predel, R., S. Neupert, D. Wicher, M. Gundel, S. Roth, and C. Derst. 2004. Unique accumulation of neuropeptides in an insect: FMRFamide-related peptides in the cockroach,
Periplaneta americana. Eur. J. Neurosci. 20:1499–1513.
77. Nässel, D. R., and U. Homberg. 2006. Neuropeptides in interneurons of the insect brain. Cell Tissus Res. 326: 1-24.
78. Baggerman, G., A. Cerstiaens, A. De Loof, and L. Schoofs. 2002. Peptidomics of the larval Drosophila melanogaster central nervous system. J. Biol. Chem. 277: 40368-40374. 79. Hewes, R. S., and P. H. Taghert. 2001. Neuropeptides and neruopeptide receptors in the
Drosophila melanogaster genome. Genome Res. 11: 1126-1142.
80. Nässel, D. R. 2002. Neuropeptides in the nervous system of Drosophila and other insect: multiple roles of neuromodulators and neurohormones. Progr. Neurobiol. 68: 1-84.
81. Nässel, D. R., and P. Taghert. 2005. Neuropeptides in invertebrates. Encyalopedia of Life Sciences. Wiley, http://www.els.net
82. Riehle, M. A., S. F. Garczynski, J. W. Crim, C. A. Hill, and M. R. Brown. 2002. Neuropeptides and peptide hormones in Anopheles gambiae. Science 298: 172-175.
83. Taghert, P. H., and J. A. Veenstra. 2003. Drosophila neuropeptides signaling. Adv. Genet. 49: 1-65.
84. Vanden, B. J. 2001. Neuropeptides and their precursors in the fruitfly, Drosophila
melanogaster. Peptides 22:241-254.
85. Baggerman, G., K. Boonen, P, Verleyen, A. De Loof, and L. Schoofs. 2005. Peptidomic analysis of the larval Drosophila melanogaster central nervous system by two-dimensional capillary liquid chromatography quadrupole time-of-flight mass spectrometry. J. Mass Spectrom. 40: 250-260.
86. Clynen, E., J. Huybrechts, P. Verleyne, A. De Loof, and L. Schoofs. 2006. Annotation of novel neuorpeptide precursors in the migratory locust based on transcript screening of a public EST database and mass spectrometry. BMC Genomics. 7: 201-215.
87. Brody, T., and A. Cravchik. 2000. Drosophila melanogaster G-protein-coupled receptors. J. Cell Biol. 150: F83-F88.
Drosophila melanogaster genomes to understand neuropeptide and peptidase function.
Biochem. Soc. Trans. 28: 464-469.
89. Nathoo, A. N., R. A. Moeller. B. A. Westlund, and A. C. Hart. 2001. Identification of neuropeptide-like protein gene families in Caenorhabditis elegans and other species. Proc. Natl. Acad. Sci. USA 98: 14000-14005.
90. Homberg, U. 2002. Neurotransmitters and neuropeptides in the brain of locust. Microsc. Res. Tech. 56: 189-202.
91. Nässel, D. R. 1993. Neuropeptides in the insect brain: a review. Cell Tissue Res. 273:1-29. 92. Claeys, I., J. Poels, G. Simonet, V. Franssens, T. Van Loy, M. B. Van Hiel, B.
Breugelmans, and J. Vanden Broeck. 2005. Insect neuropeptide and peptide hormone
receptors: current knowledge and future directions. Vitam. Horm. 73: 217-282.
93. Ewer, J. 2005. Behavioral actions of neuropeptides in invertebrates: insights from
Drosophila. Horm. Behav. 48: 418-429.
94. Nusbaum, M. P., D. M. Blitz, A. M. Swensen, D. Wood, and E. Marder. 2001. The roles of co-transmission in neural network modulation. Trends Neurosci. 24: 146-154.
95. Burnstock, G. 2004. Cotransmission. Curr. Opin. Pharmacol. 4: 47-52.
96. Zhang, J. V., P. G. Ren, O. Avsian-Kretchmer, C. W. Luo, R. Rauch, C. Klein, and A.
J. Hsueh. 2005. Obestatin, a peptide encoded by the ghrelin gene, opposes ghrelin’s effects
on food intake. Science 310: 996-999.
97. Downer, R. G. H., G. L. Orr, J. W. D. Gole, and I. Orchard. 1984. The role of octopamine and cyclic AMP in regulating hormone release from corpora cardiaca of American cockroach. J. Insect Physiol. 30: 457-462.
98. Orchard, I., J. W. D. Gole, and R. G. H. Downer. 1983. Pharmacology of aminergic recrptors mediating an elevation of cyclic AMP and release of hormone from locust neurosecretory cell. Brain Res. 288: 349-353.
99. Orchard, I., B. J. Loughton, and R. A. Webb. 1981. Octopamine and short-term hyperlipaemia in the locust. Gen. Comp. Endocrinol. 45: 175-180.
100. Pannabecker, T., and I. Orchard. 1986. Octopamine and cyclic AMP mediate release of the adipokinetic hormone I and II from isoland locust neurodocrine tissue. Mol. Cell. Endocr. 48:153-159.
101. Free, J. B. 1963. The constancy of honeybees. J. Anim. Ecol. 32: 119-131.
102. Waddington, K. D. 1983. Floral visitation sequences by bees: models and experiments. pp. 461-437. In: C. E. Jones, and R. J. Little, eds. Handbook of Experimental Pollination Biology. New York. Van Nostrand-Reinhold.
103. Wood, A. T., and M. R. Hall. 2000. Reversed-phase high-performamce liquid chromatography of catecholamines and indoleamines using a simple gradient solvent system and native fluorescence detection. J. Chromatogr. A 744: 221-225.
104. Schmuck, R., R. Schöning, A. Stork, and O. Schramel. 2001. Risk posed to honeybees (Apis mellifera L, Hymenoptera) by an imidacloprid seed dressing of sunflowers. Pest Manag. Sci. 57: 225-238.
106. Déglise, P., B. Grunewald, and M. Gauthier. 2002. The insecticide imidacloprid is a partial agonist of the nicotinic receptor of honeybee Kenyon cells. Neurosci. Lett. 321: 13-16.
107. Erber, J., T. Masuhr, and R. Menzel. 1980. Localization of short-term memory in the brain of the bee, Apis mellifera. Physiol. Entomol. 5: 343-358.
108. Mercer, A. R., and R. Menzel. 1982. The effects of biogenic amines on conditioned and unconditioned responses to olfactory stimuli in the honey bee Apis mellifera. J. Comp. Physiol. 145: 363-368.
表一、低溫與CO2昏迷處理對蜜蜂取食行為的影響
Table 1. Effects of Chilling and anesthesia treatments on honeybees rewarding behaviors (time intervals)(P<0.05) MEAN(min)± SE Treatments N Pre-treatment Treatment response Post-treatment Retreatment response Post-re- treatment Chilling anesthesia 10 2.1 ± 0.2a 44.9 ± 6.2 b 2.7 ± 0.6 a 63.5 ± 10.3 b 3.8 ± 0.6 a CO2 anesthesia 2 min 9 3.0 ± 0.6 a 101.1 ± 22.2 b 10.6 ± 5.0 a - - 4 min 6 3.3 ± 0.5 a 38.7 ± 8.8 b 2.6 ± 0.4 a - -
表二、垂直旋轉轉速與旋轉持續時間兩因子對外勤蜂取食行為的影響分析
Table 2. Two-way ANOVA results for effects of spin velocities and durations on honeybee rewarding behaviors
Factors df F-ratio P-value
Vertical spin velocities 4 8.535 P < 0.001
Treatment durations 2 6.378 0.002
Vertical spin velocities ×
表三、垂直旋轉轉速與旋轉持續時間兩因子間的交互作用對外勤蜂取食行為的影響分析 Table 3. F-ratios and P-values from ANOVA analyzing the effects of spin velocities and treatment durations on honeybee rewarding behaviors
Treatment durations
30 s 60 s 90 s
Factor
F-ratio P-value F-ratio P-value F-ratio P-value
Vertical spin
velocities
表四、多重比較測試不同的垂直旋轉轉速(皆持續 90 秒)對外勤蜂取食行為的影響分析 Table 4. Multiple comparisons from Tukey’s Studentized Range (HSD) Test analyzing the effects of various spin velocities for 90s on honeybee rewarding behavior
Vertical spin (rpm) Treatment duration(s) n Treatment response MEAN(min)± SE Control 90 10 2.9 ± 0.5 a 30 90 10 3.1 ± 0.4 a 40 90 10 5.5 ± 1.0 b 50 90 10 6.3 ± 1.4 b 60 90 10 8.6 ± 1.9 b
圖一、低溫昏迷對外勤蜂腦內三種生物胺分泌量之影響,(A)鱆胺;(B)多巴胺;(C)血清素。 Fig. 1. Effects of chilling anesthesia on octopamine (A), dopamine (B) and serotonin (C) levels in the brain of Apis mellifera L.
0 100 200 300 400 500 Chilling Anesthesia Amou nt ( p g/ brai n) Control b OA a (A) 0 200 400 600 800 1000 1200 1400 1600 1800 a Chilling Anesthesia Am o u n t ( p g/ bra in) Control b DA (B) 0 100 200 300 400 500 600 700 a a 5-HT Chilling Anesthesia Am oun t (p g/bra in ) Control (C)
圖二、CO2持續兩分鐘或四分鐘昏迷對外勤蜂腦內三種生物胺分泌量之影響,(A)鱆胺;(B)
多巴胺;(C)血清素。
Fig. 2. Effects of CO2 anesthesia for 2 and 4 min on octopamine (A), dopamine (B) and serotonin
(C) levels in the brain of Apis mellifera L.
0 100 200 300 400 500 600 a a OA CO2 4 min CO2 2 min Am ount ( pg/brain) Control a (A) 0 200 400 600 800 1000 1200 1400 1600 1800 DA b Amou nt (pg /br ai n ) a b (B)
Control CO2 2 min CO2 4min
0 100 200 300 400 500 600 700 CO2 4 min a a a 5-HT Am oun t ( pg/bra in) (C) Control CO2 2 min
圖三、三種不同的垂直旋轉轉速(皆持續 90 秒)對外勤蜂腦內三種生物胺分泌量之影響,(A) 鱆胺;(B)多巴胺;(C)血清素。
Fig. 3. Effects of different vertical spin velocity for 90 seconds on octopamine (A), dopamine (B) and serotonin (C) levels in the brain of Apis mellifera L.
0 100 200 300 400 500 600 Control 60 rpm 90 s 50 rpm 90 s 40 rpm 90 s A m ou nt (pg/br ai n) Free bees a b a,b,c c b,c OA (A) 0 200 400 600 800 1000 1200 1400 1600 1800 Control b b 60 rpm 90 s 50 rpm 90 s 40 rpm 90 s Free bees Amou nt (p g/b rain ) a b c DA (B) 0 100 200 300 400 500 600 700 a a a a 60 rpm 90 s 50 rpm 90 s 40 rpm 90 s Control Free bees Am ount (pg /brain) 5-HT a (C)
一、 赴國外研究之緣由 當生物體對於週遭環境突然改變的刺激,或對天敵威脅時所產稱的生理反應,是 有益於該生物對抗環境變化或天敵攻擊的能力基礎。這樣的生理變化即稱作逆境 生理(stress physiology),且逆境生理機制在生物的演化過程中扮演極為重要的角 色。逆境生理在脊椎動物上的研究已經有相當的進展。然而,我們對於昆蟲這種 在地球上演化相當成功的動物的逆境生理反應所之甚少。尤其腦部受到因外在逆 境刺激而產生或釋放化學物質的生理反應,則是一個有趣而且極具挑戰性的研究 方向。在本研究中,雖然初步的研究結果證實了受到逆境刺激的外勤蜂其覓食行 為與腦內生物胺的量皆會受到影響。但是在初步分析中亦發現尚有未知的化合物 經由逆境刺激而被釋放到腦中。其中出現大量極性較低且分子量較大的物質,而 根據這些物質極性推測很有可能為肽類的化合物。因此為了進一步鑑定和分析這 些未知的化學物質及了解其生理上的功能,必須具備蛋白質或肽類分離的基本技 術與背景知識。此外,目前用於鑑定分析蛋白質與肽類最佳的方式為質譜儀的使 用,因此我們能利用分子的質量快速的鑑定出一個樣品中的化合物結構。且這項 工具有高靈敏度可以偵測非常少量的分子。 目前世界上專精於研究昆蟲的neuropeptide 的分析與鑑定並有豐富的資料庫的研
究群首推比利時魯汶大學動物學研究所Prof. Arnold De Loof 的團隊,因此要進
行因逆境刺激而釋放的未知化學物質分析與該團隊合作是必要的。基於知識背景 與技術上不足的需求,筆者前往該研究所學習肽類的分離純化與質譜儀的分析技 術,並期望本次赴國外研究對於日後的研究有所助益。 第一年 研究心得 本次赴外研究的重點在於肽類物質的分離與收集及MALDI TOF 使用的技術建 立,其步驟方法整理如下: 1. 實驗動物 考慮在比利時蜜蜂取得不易,另外由台灣所攜帶蜜蜂腦的粹取液因粹取技術不佳 而導致無法使用。最後就地取材利用比利時魯汶大學動物學研究所飼養之蝗蟲 (Locusta migratoria)作為研究動物。 2. 研究方法
(1) 肽類的粹取
將25 隻蝗蟲放置在-20℃的冷凍櫃中持續 15 分鐘(低溫逆境處理),取出後將蝗蟲
放至於冰筒中,以碎冰保持蝗蟲處於低溫狀態直到蝗蟲腦解剖完畢,作為實驗
組,另外取25 隻蝗蟲不經低溫處理作為對照組。並將解剖出的蝗蟲腦置於粹取
液中(90% methanol, 9% water and 1% fromic acid),利用超音波攪拌機將蝗蟲腦打
碎,並用離心機以13,000 rpm 的轉速離心 3-5 分鐘再取出上清液,再利用真空乾 燥離心機將大部分的溶劑抽掉(避免完全乾燥),之後加入 0.1% TFA 稀釋樣品, 再進行樣 品去除脂肪酸的步驟。去除脂肪酸的步驟分為兩部分:首先將樣品與Ethyl acetate 以1:1 的體積混合並靜置 1 分鐘之後移除掉上清液的部分;另一個步驟是樣品 與Hexane 以 1:1 的體積混合並靜置 1 分鐘之後移除掉上清液的部分。最後再利 用真空抽氣離心機將剩餘的溶劑移除,便完成了去除脂肪酸的程序。
下一個步驟係利用Sep-PakR Cartridge(for solid phase extraction)將樣品中的肽類 分離出來。首先用100%ACN 活化 cartridge 再利用 0.1% TFA 移除 ACN,再將 樣品導入cartridge 中留下肽類物質並除去液體,最後用 80%ACN 將 cartridge 上 的肽類物質洗出並收集下來,如此便完成蝗蟲腦中肽類的收集程序。
(2) 肽類的分離
利用逆向式高效率液相層析儀( Reverse-phase HPLC)將由蝗蟲腦所粹取 出的肽類物質分離,其裝置與程序如下:
i. 裝置設備: Gilson pump 305, WaterTM Tunable Absorbance Detector, Gilson Model Fraction Collector, Gilson 712 HPLC-Running program, Symmctry 4.6×250 mm column.
ii. 動態系統溶液及gradient program: mobile phases A: 0.1%TFA, mobile phases B: 80%ACN -TFA;0.00 min, 98% A and 2 % B; 10 min, 98% A and 2 % B; 70min, 100 % B. Flow rate=1 ml/min.
iii. 程序: 將收集所得的肽類樣品注射入管注內,利用 Detector 掃描 214
nm 波長的光譜。之後利用 fraction collector 收集流出的溶液,收集六十管每 分鐘一管。再將收集之六十個樣品利用真空抽器離心機抽乾冰存備用。
(3)質譜儀分析
i. 裝置設備: Maldi-Tof-MS: Rejlex Ⅳ Bwku daltonic
溶上述所得之六十管乾燥樣品,再利用超音波震盪3 min 增加溶解度。再將六 十個樣品吸取1μl 滴在質譜盤上後再加入 matrix 1μl (α-cyano-4-hydroxycinnanic acid)待其乾燥後,將質譜盤置入質譜儀中備用。 iii. 利用質譜儀鑑定每一個肽類,並用分析軟體找出每個肽類核質比並記錄 下來作為實驗組與對照組比對之用。 3. 結果與討論 經逆向式高效率液相層析儀所得到的結果發現,在蝗蟲腦中有非常多的肽類存 在,而且實驗組與對照組所得的圖譜有許多的差異性,證實了蝗蟲受到低溫逆境 刺激之後,腦中的肽類量或種類會因逆境刺激產生變化。但是由於腦中肽類數 量太多因此無法一一比較。另外由質譜儀分析的結果,證實了實驗組與對照組所 產生的肽類仍然呈現差異性。 建議 本人覺得學校或系所應鼓勵研究生多多把握並參加國際會議或赴國外研究的機 會,增加與其他學者交流合作的機會,接收新知並在國際上多多與各國學者互 動,才能促進學術進步。並且能利用赴國外研究的機會,訓練自己的語文應對及 與外籍人士溝通的膽識。 攜回資料名稱及內容 逆向式高效率液相層析儀與質譜儀分析所得到的結果 書籍: Leuven (魯汶大學出版)介紹魯汶大學城建築物及歷史。 第二年 啟程 本次短期研究是由國科會國合處補助的雙邊合作計畫經費前往比利時進行為期 三個星期的研究。由1 月 3 日一大早從台灣出發,經香港轉機飛往蘇黎世,再 轉往布魯塞爾。到達布魯塞爾已經是4 日的早上十點。由於在出發之前已經與 該研究所聯繫,因此他們派了一位技術人員來接機。當我拿了行李步出大廳的那