行政院國家科學委員會專題研究計畫 成果報告
新穎聚乙炔之合成及其在高分子電激發光元件之應用(3/3)
計畫類別: 個別型計畫 計畫編號: NSC94-2216-E-009-001- 執行期間: 94 年 08 月 01 日至 95 年 07 月 31 日 執行單位: 國立交通大學應用化學系(所) 計畫主持人: 許千樹 報告類型: 完整報告 報告附件: 出席國際會議研究心得報告及發表論文 處理方式: 本計畫可公開查詢中 華 民 國 95 年 8 月 22 日
摘 要
有機材料和高分子材料應用在電子元件上,具有發展的淺力和優勢,如具輕 薄化、可大面積化、寬廣的色系和低製造成本。此計劃研究的目的在於開發新穎 聚乙炔材料,以應用於有機發光二極體和有機太陽能電池。 研究內容主要分為三部份。第一部份為雙取代聚乙炔之合成與光電性質研 究,第二部份為雙取代聚乙炔陷域能階的探討,第三部份為雙取代聚乙炔薄膜應 用於太陽能電池。 第一部份研究中,我們已合成含氟苯基及戊烷環己烷基之雙取代聚乙炔,量 測其光學性質並應用於有機電激發光元件上,此外並探討利用摻混電洞傳輸材料 ( TM-TPD )於材料中,或是利用化學共聚合方式將電洞傳輸基團( carbazole )導入聚 乙炔高分子中,其元件有最好的表現,元件結構為 ITO/PEDOT/聚乙炔共聚物( PDPA-2Fcab )/Ca/Al,最大效率達 3.37 cd/A 以及最大亮度可達 4230 cd/m2,此為 目前文獻報導上利用聚乙炔做為發光材料最佳之結果。此外亦合成新穎之含芴基 取代基之聚乙炔衍生物,將其應用於發光元件上。此系列聚乙炔高分子可以達到 紅、綠、藍三色的光色,因此本計畫開發之新型聚乙炔材料在有機電激發光顯示 器上,具有極大之應用潛力。 在第二部分研究中,利用Q-DLTS 和 TSC 技術來研究含二氟苯基之聚乙炔材 料的陷域過程,此材料和元件相關的陷域能階和參數都可以被測量出。 第三部分將所合成之含芴基之聚乙炔材料應用於高分子太陽能電池上,製備 其摻混PCBM 元件,並與高效率的 P3HT:PCBM 太陽能電池進行比較探討。 關鍵字: 聚乙炔, 導電高分子, 發光高分子。
Abstract
The use of organic materials and polymers as active layers in electronic devices has definitively several advantages such as low weight, large surface, wide color range, and low production cost. The objective of thesis is to examine new derivatives of polyacetylene for their potential use in organic light emitting diodes (OLEDs) and organic photovoltaic cells (OPCs).
The goal of this research is to study the synthesis and application of new light-emitting polymers. The first part of this study is focused on the synthesis and electro-optical properties of disubstituted polyacetylenes derivatives. The second part is to study to the trap state of disubstituted polyacetylenes. The third part is to study the photovoltaic properties of our polymers.
The first part of the work is devoted to the description of synthesis technique of disubstituted polyacetylenes with difluorophenyl and pentylcyclohexyl side groups (PDPA-2F). The organic light emitting diodes were fabricated and their performances were measured. A ITO/PEDOT/PDPA-2Fcab/Ca/Al using a copolymer of PDPA-2F and carbazole group, revealed a maximum current efficiency of 3.37 cd/A and a maximum luminescence of 4230 cd/m2. The result described above revealed the best performance of polyacetylene derivatives used as light emitting materials so far.
In the second part of the work, trapping processes in OLEDs were examined by current-voltage characteristic and thermally stimulated current measurements. The trap parameters were determined and correlated to the electrical processes in diodes.
In the third part, OPCs making use of poly[(9,9-dimethylfluoren-2-yl)acetylene] (PFA1), et poly[(1-pentyl-2-(9,9-dimethylfluoren-2-yl)acetylene) (PFA2) blended with PCBM were realized and characterized.
目 錄
中文摘要 ……… 1 英文摘要 ……… 2 目錄 ……… 3 合成目錄 ……… 5 表目錄 ……… 6 圖目錄 ……… 7 第一章 緒論……… 10 1.1 有機電激發光簡介……… 10 1.2 電激發光原理……… 13 1.3 聚乙炔之合成及光電性質……… 17 1.4 聚乙炔衍生物的光電性質……… 20 1.5 研究動機……… 22 第二章 實驗部份……… 24 2.1 試藥……… 24 2.2 儀器……… 24 2.3 單體合成……… 25 2.3.1 化合物1-5 及單體 M1-M5 之合成……… 26 2.3.2 化合物6-8 及單體 PFA1-PFA5 之合成……… 30 2.3.3 聚合物合成……… 33 2.4 元件製作……… 35 第三章 結果與討論……… 393.1 含氟苯基之聚乙炔光電性質研究……… 39 3.1.1 聚合反應之探討……… 39 3.1.2 高分子結構鑑定……… 39 3.1.3 聚合物之光學性質……… 41 3.1.4 聚合物之電化學性質……… 43 3.1.5 聚合物之電激發光性質及元件特性……… 48 3.1.6 PDPA-2F 摻混 TM-TPD 及 PDPA-2Fcab 研究……… 51 3.2 PFA 合成及光電性質……… 53 3.2.1 PFA 聚合反應之探討……… 53 3.2.2 PFA 結構鑑定……… 54 3.2.3 PFA 之光學性質……… 56 3.2.4 PFA 之電化學性質……… 60 3.2.5 PFA 之電激發光性質及元件特性……… 63 第四章 結論……… 67 第五章 參考文獻……… 68
List of Schemes
Scheme 2-1. Synthesis of compound 5 and Monomers M1-M5 ……… 36 Scheme 2-2. Synthesis of monomers M6-M10 and polymers PFA1-PFA5… 37 Scheme 2-3. Synthesis of polymers PDPA-CHC5, PDPA-1F, PDPA-2F,
List of Tables
Table 1-1. Optical properties of disubstituted polyacetylene derivatives: -(R1C=CR2)x-……… 21
Table 3-1. Polymerization of monomers M1-M5 and M2+5……… 40 Table 3-2. Optical properties, quantum yields of fluorine-containing
polyacetylenes ……… 43 Table 3-3. Redox properties of fluorine-containing polymers ……… 45 Table 3-4. The polyacetylenes EL device performances ……… 46 Table 3-5. The EL device performances for polyacetylenes and the blends of
PDPA-2F and TM-TPD……… 51 Table 3-6. Polymerization of fluorene-containing monomers M1- M5……… 54 Table 3-7. Optical properties, quantum yields and redox properties of PFA
polymers……… 57 Table 3-8. The EL device performances for PFA2-PFA5 ……… 66
List of Figures
Fig. 1-1. Small molecular OEL device prepared by Tang et al. ……… 11
Fig. 1-2. Structures of some common small molecules ……… 12
Fig. 1-3. Structures of some common polymer materials……… 13
Fig. 1-4. Structure of a single layer OLED device ……… 14
Fig. 1-5. Electroluminescence mechanism ……… 14
Fig. 1-6. Energy diagram of exciton formation ……… 15
Fig. 1-7. Schematic energy level diagram for an ITO/PPV/Al device……… 16
Fig. 1-8. Structure of a multilayer OLED device……… 16
Fig. 1-9. Theoretical isomers of polyacetylene: (A) trans-transoid, (B) cis-cisoid, (C) cis-transoid and (D) trans-cisoid ……… 17
Fig. 1-10. (A) The two degenerate ground states of trans-(CH)x. (B) A trans-(CH)x chain containing a charged soliton- antisoliton pair. (C) cis-(CH)x, the cis-transoid and trans- cisoid configuration. (D) A cis-(CH)x chain containing a charged soliton-antisoliton pair……… 18
Fig. 1-11. Relative energy diagram of PA……… 19
Fig. 3-1. IR spectra of M3 and PDPA-2F……… 40
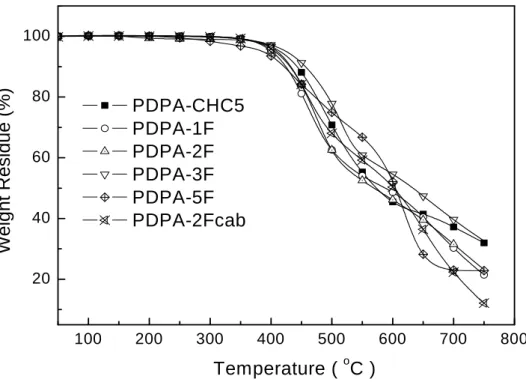
Fig. 3-2. TGA thermograms of PDPA-CHC5 ~ PDPA-2Fcab……… 41
Fig. 3-3. UV-vis absorption spectra of PA-CHC5 (▓), PDPA-1F (○), PDPA-2F (△), PDPA-3F (▽) and PDPA-5F (♁) in thin film state ……… 42
Fig. 3-4. PL spectra of PA-CHC5 (▓), PDPA-1F (○), PDPA-2F (△), PDPA-3F (▽) and PDPA-5F (♁) in thin film state……… 42 Fig. 3-5. Cyclic voltammorgrams of (a) PDPA-CHC5, PDPA-1F and
PDPA-2F (b) PDPA-2Fcab, PDPA-3F and PDPA-5F……… 44 Fig. 3-6. EL spectra of PDPA-CHC5 (▓), PDPA-1F (○), PDPA-2F (△),
PDPA-3F (▽) and PDPA-5F (♁) ……… 46 Fig. 3-7. Current density of versus electrical field for PDPA-CHC5 (▓),
PDPA-1F (○), PDPA-2F (△), PDPA-3F (▽) and PDPA-5F (♁) in electron-only devices……… 47 Fig. 3-8. UV-vis absorption spectrum of PDPA-2F (○) and the PL spectra
of TM-TPD (▲), PDPA-2F (●) and the blend of PDPA-2F and 10 wt% TM-TPD (△) ……… 48 Fig. 3-9. Energy level diagrams of PDPA-2F, TM-TPD, and PDPA-
2Fcab……… 49 Fig. 3-10. (a) Current density, (b) brightness and (c) current efficiency
versus applied voltage of PDPA-2F (○), the blend of PDPA-2F and 5 wt% (●), 10 wt% (▲), 20 wt% (▓) of TM-TPD, and PA-2Fcab (△) in ITO/ PEDOT/polymer/Ca /Al devices………… 51 Fig. 3-11. Current density of versus electrical field for PDPA-2F (○, ●),
the blend of PDPA-2F and TM-TPD (△, ▲), PA-2Fcab (□, ▓) in hole-only (hollow) and electron- only (filled) devices………… 52 Fig. 3-12. Normalized EL spectra of the devices using PDPA-2F (○), the
blend of PDPA-2F and 5 wt% (●), 10 wt% (▲), 20 wt% (▓) of TM-TPD, and PA-2Fcab (△) as active layers……… 53
Fig. 3-13. IR spectra for (A) M6, (B) PFA1, (C) M7, and (D) PFA2 ……… 55
Fig. 3-14. TGA thermograms of PFA1-PFA5 ……… 56
Fig. 3-15. (a) UV-vis absorption spectra of PFA1-PFA5 in chloroform. (b) UV-vis absorption spectra of PFA1- PFA5 in thin film state …… 58
Fig. 3-16. (a) PL spectra of PFA1-PFA5 in chloroform. (b) PL spectra of PFA1-PFA5 in thin film state ……… 59
Fig. 3-17. Cyclic voltammorgrams of PFA1-PFA5 films……… 60
Fig. 3-18. Energy level diagram of PFA1-PFA5 ……… 61
Fig. 3-19. EL spectra of PFA2, PFA3, PFA4 and PFA5 ……… 62
Fig. 3-20. Current density and luminescence intensity vs. bias voltage in ITO/PEDOT/Polymer PFA2 or PFA3/Ca/Al devices ……… 63
Fig. 3-21. Current density and luminescence intensity vs. bias voltage in ITO/PEDOT/Polymer PFA4 or PFA5/Ca/Al devices ……… 64
Fig. 3-22. Current density and Luminescence vs. bias voltage in ITO/PEDOT/PFA2(98wt%)+PFA5(2wt%)/Ca/Al device………… 65
Fig. 3-23. Normalized electroluminescent vs. bias voltage in ITO/ PEDOT/PFA2(98wt%)+PFA5(2wt%)/Ca/Al device……… 65
第一章 緒 論
1.1 有機電激發光簡介
有機電激發光(Organic Electroluminescence, OEL)的研究肇始於 1950 年早 期,1953 年 Bernanose 等人對分佈於高分子中的有機染料(Acridine 或 Quinacrin) 施以交流電壓觀察到了發光現象 [1],當時他們解釋此發光原理應類似於傳統 III-V 或II-VI 族元素所組合的薄膜式電激發光板(Thin film electroluminescence panel), 例如硫化鋅(ZnS)。其後於 1963 年 Pope 等人於 Anthracene 晶體兩端跨接 400 伏 特以上之高電壓,觀察到發光現象,不過其發光強度仍低 [2]。至 1965 年,Helfrich 和Schneider 利用含有 AlCl3-Anthracene(陰極)和 Na-Anthracene(陽極)的電解
質溶液成功的製備出高亮度的發光元件 [3-4],並成為第一篇有機電激發光的專利 文獻。但受限於當時的設備與製作方法,製備出來的單晶層厚度較厚,一般仍需
要超過100 伏特的電壓才能將其驅動發光,無法成為優良的 EL 元件,所以其後十
數年間雖然有人陸續利用 Anthracene 單晶製作元件,並繼續從事相關發光機制、
電荷轉移、注入電流及量子效率(Quantum Efficiency)的研究,但距離實用階段 仍有很大的差距。直到 1979 年 Roberts 等人以 Langmuir- Blodgett 技術製造 Anthracene 衍生物的元件 [5],利用重複多次的單層分子成膜,大幅降低有機發光 層的厚度,連帶地使驅動電壓下降,才使得有機電激發光研究開始步入實用化的 階段。
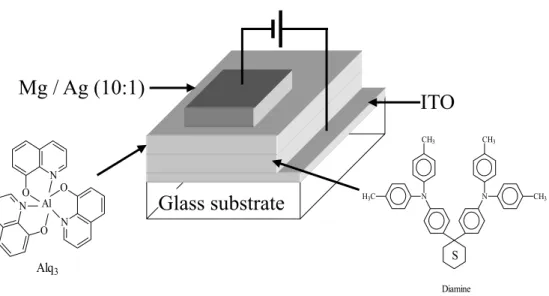
1987 年美國 Eastman Kodak 公司的 C. W. Tang 和 S. A. Vanslyke 利用真空蒸鍍 非晶系(Amorphous)有機薄膜的技術以及創新的異質介面(Hetero-junction)多 層有機薄膜之元件結構 [6] (如 Fig. 1-1 所示),以氧化銦錫(Indium-tin oxide, ITO) 及鎂銀合金(Mg-Ag alloy)分別當作陽極及陰極,芳香烷胺類(Aromatic diamine) 作為電洞傳輸層(Hole transport layer),8-Hydroxyquinoline aluminum(Alq3)當作
發光層(Emission layer),發表了第一個高亮度的有機薄膜發光元件。他們大幅地 改善了有機電激發光元件的特性(操作電壓<10 Volt,量子效率>1%)及穩定性,
成為第一個接近實用的小分子真空蒸鍍OEL 元件,也因此激起了世人對 OEL 的興
趣,並廣泛積極地投入研究。
該元件的特徵是採用具有孤電子對(Lone electron pair)的芳香烷胺類做為電
洞傳輸層,增加電洞的傳輸效果,另採用能吸引電子的鋁錯合物 Alq3做為電子傳
輸層(Electron transport layer)兼發光層,將載子封閉在有機層中,使再結合 (Recombination)效率大幅提昇,而且有機層膜厚只有 1000 Å,才得以實現以 10
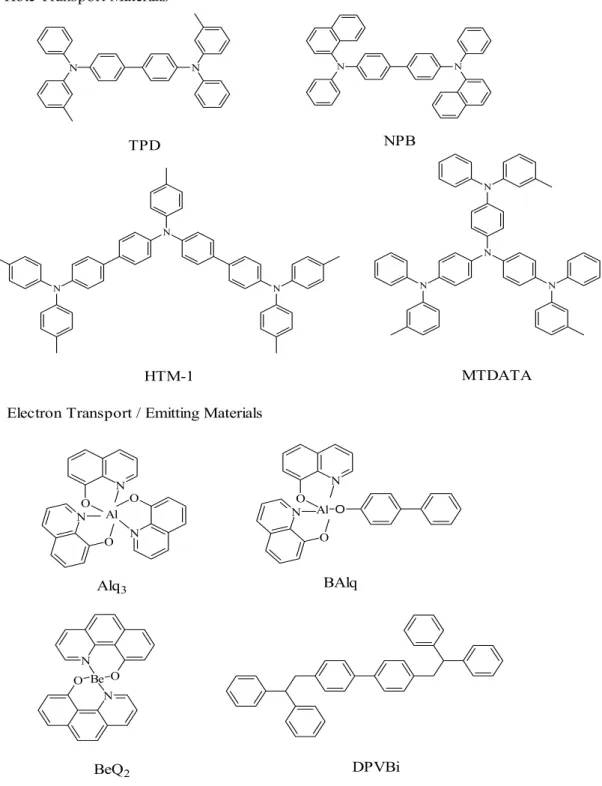
Volt 低電壓驅動,得到 1000 cd/m2以上的劃時代亮度。從Pope 等人至柯達公司所 用的材料以有機小分子為主(見Fig. 1-2)。
Fig. 1-1. Small molecular OEL device prepared by Tang et al.
在有機高分子OEL 元件的發展方面,1982 年 Patridge 等人已利用旋轉塗佈方 式(Spin-coating)製作出第一個高分子的 OEL 元件 [7],當時所利用的材料是 Poly(vinylcarbazole)(PVK)。但真正讓有機高分子用於 OEL 受到重視的則是 1990 年英國劍橋大學卡文迪西實驗室(Calvendish Lab.)所發表,利用 Poly(p-phenylene vinylene)(PPV)所製造的 OEL 元件 [8]。 他們利用前驅物法(Precursor route)將高分子前驅物塗佈於導電玻璃表面, 再經過熱脫去反應製成了共軛聚合物,並鍍上鋁金屬做為陰極,製作出第一個以 共軛高分子為發光材料的OEL 元件,引發了第二波的 OEL 元件的研究熱潮。該元 件之驅動電壓為14 Volt,量子效率為 0.05%。劍橋大學更於 1992 年成立 Cambridge Display Technology(CDT)公司,致力於發展高分子發光材料與元件技術。自此 Kodak 與 CDT 各自成為發展小分子與高分子 OEL 研究的兩大巨擘。常見的 OEL 高分子材料結構如Fig. 1-3 所示。
Glass substrate
Mg / Ag (10:1)
N O N O N O Al Alq3 N N H3C CH3 CH3 CH3 Diamine SITO
Fig. 1-2. Structures of some common small molecules
N N
Hole Transport Materials
TPD
N N
NPB
Electron Transport / Emitting Materials
N O N O N O Al N O Be O N Alq3 BAlq BeQ2 DPVBi N N N N N N N HTM-1 MTDATA N O N O Al O
S R N CH2 CH R R PPP PPV PT PVK PF n n n n n
Fig. 1-3. Structures of some common polymer materials
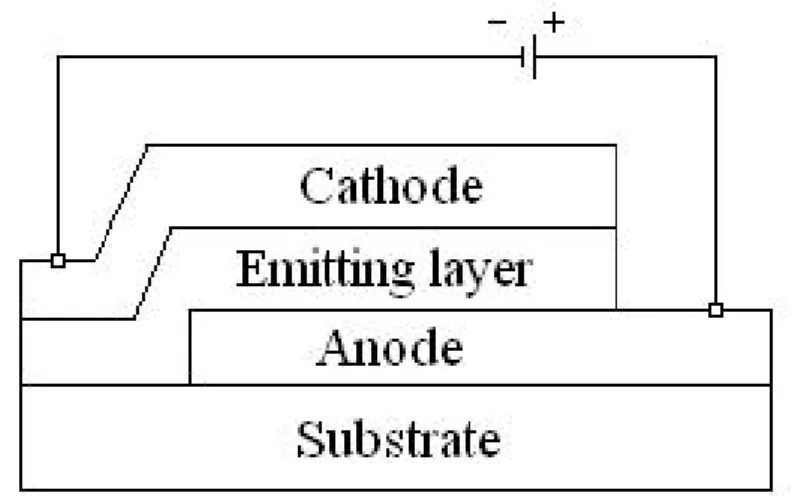
1.2 電激發光原理 OEL 元件本質上為一固態半導體元件,其所使用的材料是有機半導體而非傳 統的無機半導體。傳統的發光二極體是利用無機材料III-V A 族或 II-VI A 族化合物 半導體所製成,以原子為基本單位;而大部分的有機半導體則是由所謂的“共軛 分子"或“共軛高分子"所構成,由於分子間的交互作用遠較原子間之交互作用 為弱,因此有機半導體通常帶著強烈的分子本身的色彩。共軛高分子在聚合物主 鏈上含有大量的π電子,在主鏈中形成不定形位移(Delocalization),此不定形位 移被認為是影響共軛高分子能階差(Band-gap)之主要因素,也進而影響其光電性 質。在共軛高分子中又以PPV(見 Fig. 1-3)系統最常做為有機發光二極體的發光 材料,將PPV 薄膜夾於金屬陰極和陽極之間(見下頁 Fig. 1-4),整個元件製作在 透明基板如玻璃或PET(塑膠基板)上 [9],透明陽極通常是由 ITO(摻雜錫之氧 化銦)所構成,陰極則選用功函數(Work function)較小的金屬如鈣或鋁,當一順 向偏壓加諸於陽極和陰極之間時,電洞和電子分別自陽極和陰極注入有機半導體 之最高填滿分子軌域(Highest occupied molecular orbital,HOMO)與最低未填滿 分子軌域(Lowest un-occupied molecular orbital,LUMO),二者在有機薄膜中傳導 而相遇,經由再結合形成高能態的激子(Excition)。當激子由激發態降回基態時,
伴隨輻射性衰變(Radiative decay)的方式而產生光子(Photon),透過透明基板而 發光(見下頁Fig. 1-5)。
Fig. 1-4. Structure of a single layer OLED device
Fig. 1-5. Electroluminescence mechanism
cathode
anode
e
-e
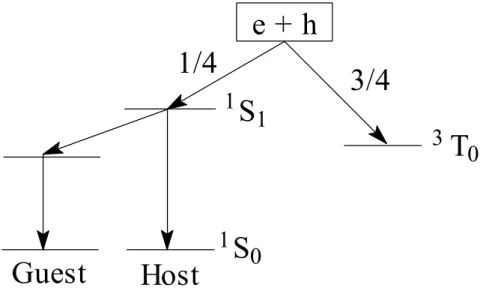
激子緩解(Relaxation)的過程如 Fig. 1-6 所示,單線態激子經輻射性衰變回 到基態而放出螢光,三重態激子則會以磷光或是非輻射方式衰退,不會放出螢光。 然而形成單線態激子的機率為四分之一,形成三重態激子的機率為四分之三,因 此理論上OEL 的內部量子效率(Internal quantum efficiency)最大值為 25%。
e + h
1/4
3/4
T
0
3
1
S
1
1
S
0
Host
Guest
Fig. 1-6. Energy diagram of exciton formation
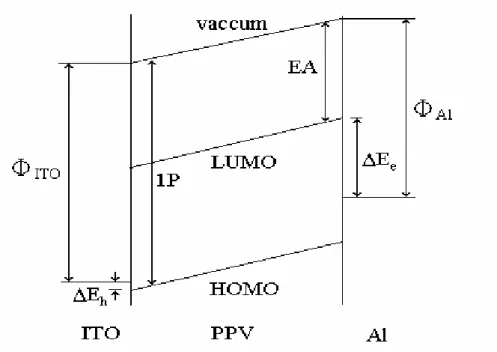
典型單層 ITO/PPV/Al 元件的能階圖如下頁 Fig.1-7 所示。IP(Ionization potential)是 PPV 的游離能,代表由 HOMO 能階移除一個電子到無窮遠處所需 的能量。EA(Electron affinity)為 PPV 的電子親和力,即由無窮遠處加入一個
電子到 LUMO 能階所需的能量。ΦITO與ΦAl分別為 ITO 和鋁的工作函數。△
Ee和△Eh分別為由電極注入電子或電洞的能障。由圖可知,由ITO 注入電洞到 PPV 價帶的能障很小,而由鋁注入電子到傳導帶則有相當大的能障。故選擇功 函數較低的金屬(如鈣、鎂、鋇)有利於電子注入,可提升量子產率 [10]。 為了增加電荷注入與傳輸程度以增進發光效率,亦可以於發光層和陽極間加 入電洞傳輸層,於發光層和陰極間加入電子傳輸層,形成多層結構的有機發光元 件,如Fig. 1-8 所示。
Fig. 1-7. Schematic energy level diagram for an ITO/PPV/Al device
1.3 聚乙炔的合成及光電性質
聚乙炔因其特殊的不飽和共軛主鏈結構而被廣泛的加以研究。最早於1958 年
G. Natta 等人以 Ti(OBu)4/AlEt3 為催化劑系統成功合成出黑色的粉末狀聚乙炔
[11],唯此所合成之黑色粉末不但不穩定,並且不溶於任何有機溶劑中,故無法從 事進一步的性質量測或加工利用。直到1974 年 H. Shirakawa 等人合成出具金屬光 澤且較穩定之聚乙炔薄膜後,對於聚乙炔材料的物性及化性才逐漸被分析與探討 [12]。於 1977 年 A. G. MacDiarmid 與上述 H. Shirakawa 研究群更發現經摻雜後的 聚乙炔具有高達103 ~ 104 S/cm 的導電度 [13],此數值幾乎已與某些金屬之導電度 相當,由此一報導的出現,也徹底的改變了一般所認知的高分子材料必定為絕緣 體的概念。 在一般半導體材料中,當高能量光子注入後會同時發生兩種不同的過程,一 是產生電子電洞而進一步生成電流形成所謂光導性質( photoconductivity ),另一則 是由所生成之電子電洞進行再結合而引發出光激發光( photoluminescence,PL )性 質,然而電子電洞的再結合亦可經由非發光機制來完成,且於常溫下此機制佔較 大比例 [14]。但於聚乙炔材料中光導性質與 PL 性質並無法同時存在,其中光導性 質只發生於具反式共軛主鏈之聚乙炔,但PL 性質卻僅發生於具順式共軛主鏈之聚 乙炔 [15],這個異常的現象則必須由 soliton model 來加以解釋。
所謂soliton model 必須以共軛結構來加以說明,如下一頁之 Fig. 1-9 所示,聚 乙炔的結構可細分為4 種,分別是(i) trans-transoid、(ii) cis-cisoid、(iii) cis-transoid 及(iv) trans-cisoid,其中 cis-cisoid 結構會導致聚合物無法溶解,因而不需對此結構 做進一步的分析。
Fig. 1-9. Theoretical isomers of polyacetylene: (A) trans-transoid, (B) cis-cisoid, (C) cis-transoid and (D) trans-cisoid.
C C C C C C C H H H H H H H C H H C C C H C H C C C H H H H C H H C C C H C H C C C H H H H H H H H H H H H H (A) (B) (C) (D)
首先在聚乙炔之共軛系統中,若將所有鍵長視為相等,則位於 2pz軌域中的π
價電子將因dimerization distortion 而形成不穩定的狀態,導致相鄰 C-H 基團會彼此 互相靠近而形成交錯的長鍵(單鍵)-短鍵(雙鍵)結構,以達到較穩定的最低能量狀 態 [16],如下頁之 Fig. 1-10 (A) 所示,圖中若以對稱的觀點來看,很明顯的,我
們可以在分子內互換單鍵與雙鍵的位置而不需改變其能量,因此,在trans-transoid
結構中會形成2 個最低能量的簡併基態( degenerate ground state )。在簡併態的存在 下,當高能量光子注入此聚乙炔材料後,將先產生電子電洞對,並很快的形成 charged soliton pair,於極短的時間內( 10-3 s )再發展為兩個互相分離的 degenerate region ( Fig. 1-10 (B) ),此時的 charged soliton 在電場下可自由移動,於是便產生了 光導性質 [17]。
Fig. 1-10. (A) The two degenerate ground states of trans-(CH)x. (B) A trans-(CH)x
chain containing a charged soliton-antisoliton pair. (C) cis-(CH)x, the cis-transoid and
trans-cisoid configuration. (D) A cis-(CH)x chain containing a charged
soliton-antisoliton pair. C H H C C C H C H C C C C H H H H C C C H H H H (C) (D) C H H C C C H C H C C C C H H H H C C C H H H H C H H C C C H C H C C C C H H H H C C C H H H H a b a (+) (-) C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C H H H H H H H H H H H H (-) (+) a b a (B) (A)
hv
1 B
u1 A
g2 A
g1
1
1
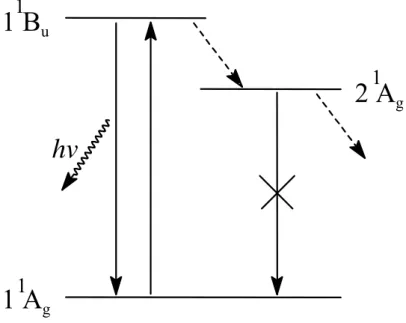
但於cis-transoid 結構中的情況並不相同,如 Fig. 1-10 (C) 所示,當能量較低 的 cis-transoid 結構中之單鍵-雙鍵互換後,形成的卻會是能量較高的 trans-cisoid 結構,由於能量上的差異,此 cis-transoid 結構並無法產生簡併態,因此,在光子 注入此聚乙炔材料後,所生成的charged soliton 若要移動必須消耗更大的能量,所以此soliton 會被侷限於固定的 nondegenerate region ( Fig. 1-10 (D) )中,直到後來有 機會與其他電子或電洞進行再結合( recombination )而產生 PL 效應 [17,18]。 雖然具順式共軛主鏈之聚乙炔可發生PL 效應,但其強度非常微弱,這必須由 其相對能階圖來加以解釋。如 Fig. 1-11,就共軛雙鍵結構之能階圖而言,除位於 HOMO 軌域的基態 11Ag能階外,另分別列出了 2 個最低能量的激發態能階 21Ag 及11Bu。於聚乙炔材料的例子中,由於庫輪引力的影響會使21Ag能階的能量低於 11Bu能階的能量 [19],故電子由 11Ag能階被激發至11Bu能階( singlet )後,激態電 子傾向於以非輻射性衰減( nonradiative decay )的方式轉移至較低能量的另一個激 態21Ag能階( triplet ),若由對稱的觀點來看,此經轉移之激態電子由放射螢光而從 三重態 21Ag能階回到基態 11Ag能階是屬於 forbidden 的,因此抑制了聚乙炔材料 的PL 性質。
1.4 聚乙炔衍生物的光電性質 早期為了改良傳統聚乙炔的不穩定性及溶解度問題,對於此系統聚合物的研 究一般朝向合成具取代之聚乙炔衍生物,此時期各種不同的催化劑類型不斷的被 提出,如 radical、ionic 及 Ziegler-Natta 系統等,然而所得到的產物多為分子量僅 數千的寡聚物 [20]。直到 70 年代中期,tungsten ( W )及 molybdenum ( Mo )催化劑 被發現可有效的對立體障礙較小之單取代乙炔衍生物單體進行聚合反應後,VB、 VIB 族過渡金屬( Nb、Ta、Mo 及 W )、Rhodium ( Rh )化合物及改良過之 Ziegler-Natta 催化劑才逐漸被廣泛而有效的使用於合成具取代之聚乙炔衍生物上。 藉由取代基的不同可使聚乙炔衍生物具有各式各樣的光電性質,而在這裡我 們感興趣的只在於其聚合物之PL 及電激發光( electroluminescence,EL )特性上。 由以往文獻的報導可歸納出一個結論,即聚乙炔系統之PL 及 EL 效應強度依序為: 雙取代聚乙炔衍生物>單取代聚乙炔衍生物>無取代之聚乙炔,其中後兩者因為 PL 效應太弱而幾乎被歸類為不具 PL 性質之材料。 除上一節中所討論的具順式主鏈之聚乙炔在紅外光區可發生極微弱螢光外, 單取代聚乙炔衍生物的研究方面大多也僅止於對其材料的UV-Vis 吸收光譜之量測 (見 Table 1-1 )。而於 2000 年 B. Z. Tang 等人的實驗結果中發現,將具雙苯環之液 晶基導入單取代聚乙炔衍生物側鏈可提高其材料之 PL 效應 [22-24],但除了放射 光強度仍然有待提升外,其放射波長亦位於可見光區域外而有待改良。於本研究 第一部份中已順利合成出具反式環己烷液晶基之單取代聚乙炔衍生物,並成功的 將其 PL 放射波長位移至藍綠光範圍,唯亮度依然偏低而無法偵測到其元件之 EL 放射光。故整體來說,單取代聚乙炔衍生物之PL 效應和具順式主鏈之聚乙炔一樣 十分微弱,其主要原因推測應該與聚乙炔相同,是來自於21Ag能階低於11Bu能階 所致。 在雙取代聚乙炔衍生物方面,從1996 年起 T. Masuda 等人已陸續發表許多相 關材料 [25-30],其詳細結構及 PL、EL 數據已整理於下頁之 Table 1 中。由表中可 發現,聚烷基苯基乙炔( polyalkylphenyl acetylene )系列聚合物之放射波長在 450 nm 左右,屬於藍光材料,若以 naphthyl 基團來增加主鏈的共軛區域,或改變主鏈結 構為聚雙苯基乙炔( polydiphenylacetylene )系列,則放射波長位移至 500-550 nm, 為藍綠光或綠光材料。在雙取代聚乙炔衍生物中,其PL 與 EL 放射波長間通常不 會有太大的差異,但文獻中對於元件亮度的報導並不常見,這是因為其強度太低 之故。相關報導中元件 EL 強度最高者為具有 2 個苯環取代基之聚乙炔衍生物:
poly[1-(p-n-butylphenyl)-2-phenyl acetylene] ( Table 1-1, No. 7 ),但其亮度也僅 2.5 cd/m2 ( 12 V,20 mA/cm2 ) [26]。
Table 1-1. Optical properties of di-substituted polyacetylene derivatives: -(R1C=CR2)x-. No. R1 R2 PL (λ, nm) EL (λ, nm) Cathode Brightness (cd/m2)
1 hexyl Phenyl 450 450 Mg/Al 0.5
2 ethyl Phenyl 460 460 Mg/Al 0.1
3 methyl Phenyl 470 480 Mg/Al 0.1
4 methyl Naphthyl 500 500 Mg/In -
5 Cl Phenyl 500 - - -
6 phenyl -Ph-p-t-Bu 510 510 Mg/In -
7 phenyl -Ph-p-n-Bu 520 520 Mg/Al 2.5
8 phenyl -Ph-p-Si(i-Pr)3 520 - - -
9 phenyl -Ph-p-Si(Me)3 520 520 Mg/In -
10 phenyl -Ph-m-Si(Me)3 520 550 Mg/In -
11 phenyl -Ph-p-Si(Ph)3 530 550 Mg/In -
12 phenyl -Ph-p-adamantyl 530 550 Mg/In -
一般相信雙取代聚乙炔衍生物之 21A g能階已高於 11Bu能階,造成其元件 EL 效率仍然偏低的主要原因是注入的電子及電洞傳輸不平衡所致,此外,諸如分子 鏈間的interchain interaction 及發光層的結晶度等亦皆會影響其材料之發光效率。 近年來,雙取代聚乙炔(disubstituted PA)由於可合成出具發藍、綠、紅三原色 光之材料,所以被廣泛地被研究以及應用在PLED 上。日本 Masuda 先生等人合成 出具carbazole 基團之聚乙炔 [27],這類聚乙炔具有光導電性以及可摻混 Ir 燐光物 具發光性質 [28]。然而,文獻中最好的聚乙炔元件表現是由中國香港 Tang 先生等 人所發表的多層元件,主要是利用 poly[1-phenyl-5-(α-naphthoxy) pentane] 摻混 PVK 當發光層,Bathocupronie 當電洞阻擋層和 Alq3當電子傳輸層 [29]。此外,Tang
等人也發表含 Silole 基團聚乙炔當發光層之藍綠光多層元件,最大亮度達 1118
1.5 研究動機及分子設計 本研究實驗中將以合成雙取代之聚乙炔衍生物為主。由上頁之Table 1-1 中可 以知道,因為炔基上取代基的不同而可造成其材料放射光色的改變,此外,在聚 合物方面的合成,則將採用適當的metathesis 催化劑來進行聚合反應。同時在本部 份實驗中也將對所得聚合物做完整的性質分析及光電量測。 本實驗室在過去數年內,曾經成功的合成出數系列側鏈液晶聚乙炔,這些側 鏈液晶聚乙炔皆具有發光之特性,其發光效率與Prof. Masuda 報導之結果相近, 此結果發表於Macromolecules 雜誌上 [31]。其中我們亦也有合成雙苯環取代之聚 乙炔(PA1-PA4),其中PA2所製備之元件亮度高。 C C C7H18 F
[
]
n C C C5H11 F F[
]
n C C C5H11 F[
]
n C C C4H9[
]
n PA1 PA2 PA3 PA4 但是此系列材料,並非被完整討論其光電性質,因此,我們欲合成在側鏈上 有不同數量氟原子的雙取代聚乙炔,探討其對聚乙炔材料的影響,另外,在研究 中所合成出含氟基雙取代聚乙炔(poly[1-(3,4-difluorophenyl)-2-(4-phenylcyclohexyl phrnyl)acetylene], PDPA-2F 即是 PA2) 材料,雖然具有較佳的元件表現,但是我們 也想更提升其元件的效率,因此利用摻混電洞傳輸材料 ( N,N,N’,N’-tertrakis(4- methylphenylbenzidine, TM-TPD)) 或是嘗試利用化學共聚合含 carbazole 電洞傳輸 基 團 之 聚 乙 炔 材 料 (poly[(1-(3,4-difluorophenyl)-2-(4-pentylcyclo-hexylphenyl) acetylene)]-co-poly[(1-phenyl-2-(N-propylcarbazole)acetylene)], PDPA-2Fcab) 來更加 以提升元件表現,欲所設計的聚乙炔化學以及TM-TPD 結構如下圖所表示。另一方面研究中,改變聚乙炔側鏈可以改變其光色,因此我們將芴基(fluorene) 導入於聚乙炔中並改變側鏈基團,希望利用芴基熱安定性、具發光性、巨大立體 結構來改善影響聚乙炔性質,希望可以增加聚乙炔其熱穩定性及高發光效率,並 對其光電性質進行探討,以應用於高分子發光二極體。 N N C5 F F n C C F F 90 C C N 10 PDPA 2F PDPA 2Fcab TPD TM
第二章 實驗部份
2.1 試藥 所有藥品均採購自 Merck、Aldrich、Lancaster 或東京化成公司,不經純化而 直接使用。所有溶劑係購自 Merck 或 Fisher 公司。無水四氫呋喃(THF)以金屬 鈉乾燥,並加入Benzophenone 為指示劑。 2.2 測試方法 為了鑑定或測試所得的中間產物、前驅物單體和聚合物特性,採用下列測試儀 器:(1) 核磁共振光譜儀(Nuclear Magnetic Resonance Spectrometer;NMR)
係使用Varian 300 MHz 核磁共振光譜儀。使用 CDCl3為溶劑,化學位移單位
為 ppm,隅合常數單位為 Hz,並以四甲基矽烷(TMS)做為內部基準(δ=0.00
ppm)。符號s 表示單峰(singlet),d 表示二重峰(doublet),t 表示三重峰(triplet), q 表示四重峰(quartet),m 表示多重鋒(multiplet)。
(2) 紅外線光譜儀(Infrared Spectrometer;IR)
係使用Nicolet 520 型紅外線光譜儀。固體樣品與溴化鉀粉末混合壓片;液體
樣品使用氯化鈉鹽片夾成薄片。光譜單位為cm-1。
(3) 微差掃描卡計(Differential Scanning Calorimeter;DSC)
係使用SEIKO SSC5200 DSC 以及 Computer/Thermal Analyzer,另使用 Liquid nitrogen cooling accessary 冷卻系統。溫度以 In 做校正, 取樣 5 至 10 毫克,加熱 或冷卻掃描速率為10℃/min。測試樣品之相轉移(phase transition)溫度取其極值, 聚合物取其最大反曲點(infection point)為玻璃轉移溫度(glass transition temperature, Tg)。
(4) 熱重分析儀(Thermogravimetric Analysis;TGA)
係使用SEIKO TG/DTA 200 型,樣品取 5 至 10 毫克,加熱或冷卻掃描速率為 10℃/min。加熱中記錄樣品之重量變化。
係使用Merck 5735 DC Silica gel 60 F-254 型鋁背薄片,並以 UV 燈 (UVGL-25 型)檢定。
(6) 凝膠滲透層析儀(Gel Permeation Chromatography;GPC)
係使用 Series III Pump 型高效能管柱層析幫浦。偵測器為 Viscotek T50A Differential Viscometer 和 Viscotek LR125 Laser Refractometer,管柱係 American Polymer Standards Corporation 所生產。樣品濃度取 1.0 mg/mL,以聚苯乙烯 (polystyrene)當基準,沖提液為 THF,流速為 1.0 mL/min。 (7) 紫外-可見光吸收光譜儀(UV-Vis Spectrophotometer) 係使用SHIMADZU UV-1601 型吸收光譜儀。溶液吸收測量方面,係將樣品溶 於各種不同的溶劑中,配製成稀薄溶液並測量之。薄膜吸收測量方面,係將樣品 溶於氯仿中,配製成0.5% (w/v) 溶液,再以旋轉塗佈方式,將樣品塗佈成膜於石 英玻璃上並測量之,光譜單位為nm。 (8) 螢光光譜儀(Spectrofluorophotometer;PL) 係使用SHIMADZU RF-5301PC 型螢光光譜儀。樣品的配製與處理如上所述。 光譜單位為nm。 (9) 循環伏安計量儀(Cyclic Voltammetry;CV) 係使用Autolab ADC 164 型。將待測高分子成膜於鉑電極上做為工作電極,以 飽合甘汞電極做為參考電極,以另一鉑電極做為對應電極,電解液為 0.1 M 之
TBAPF6 / acetonitrile,掃描速率 50 mV/sec。
(10) 光譜掃描色度計(Spectroscan Colorimeter;PR-650) 係使用PR-650 型。將元件施以電壓驅動發光後,再以此光譜色度計量測發光 強度與光色。元件之製作見2.4 節。 2.3 單體之合成 此部分單體之設計,可以區分為兩部分共10 單體,其中 M1 為具戊烷環己烷 基之雙苯環乙炔,M2 ~ M5 為具氟基及戊烷環己烷基之雙苯環乙炔,M6 ~ M10 為 具芴基團之乙炔衍生物。單體之詳細合成步驟敘述如下,完整的合成流程則列於 Scheme 2-1 和 Scheme 2-2
2.3.1 化合物 1 ~ 5 及 M1 ~ M5 之合成 1-Iodo-4-(4-pentylcyclohexyl)benzene (1).
合成2-iodo-4-(4-pentylcyclohexyl)benzene 主要是 pentylcyclohexyl- benzene 將 碘化的反應,將pentylcyclohexylbenzene ( 25.00 g , 108.50 mmol )、iodine (I2) ( 13.80
g, 54.30 mmol )、iodic acid (HIO3) ( 4.77 g, 27.10 mmol )在 80 % acetic acid 中於氮氣
下在80℃時反應 4 小時。反應結束後冷卻至室溫,並加入大量的水固體析出,抽 器過濾並用甲醇沖洗固體,得到白色固體34.00 g。產率:88 % ; mp 45-47 .℃ 1H NMR (300 MHz, CDCl 3) δ (ppm): 7.44 (d, J= 8.4Hz, 2H), 7.34 (d, J= 8.4, 2H), 2.44 (t, 12.2Hz, 1H), 1.84 (d, J= 9Hz, 4H), 0.95-1.46 (m, 13H), 0.87 (t, J= 7.2Hz, 3H)。 13C NMR (75 MHz, CDCl
3) δ (ppm): 149.13 (1C, Ar), 13.59 (1C, Ar), 132.46 (2C, Ar),
130.02 (2C, Ar), 44.10, 37.32, 37.25, 34.12 (2C), 33.45 (2C), 32.2, 26.65, 22.72, 12.38。MS [M+] calcd. for C17H25I356.29, found 356。Anal. Calcd. For C17H25: C, 57.31;
H, 7.07. Found: C, 57.1; H, 7.05.
1-(3-hydroxy-3-methyl-1-butynyl)-4-pentylcyclohexylbenzene (2).
將1-iodo-4-(pentylcyclohexyl)benzene ( 17.70 g, 50.00 mmol )、PdCl2(PPh3)2
( 0.35 g, 0.50 mmol )、CuI ( 0.48 g, 2.50 mmol )、PPh3 ( 0.98 g, 3.75 mmol ) 都加入
於反應瓶中並加入溶劑triethylamine ( 200 ml ) 後於氮氣下攪拌 30 分鐘,再利用加 液漏斗加入2-methyl-3-butyn-2-ol ( 5.00 g, 60.00 mmol ) 於反應中。在 80℃下反應 12 小時,反應結束後,迴旋蒸餾抽走 triethylamine 後,用 EA 萃取產物,再用水洗 數次後,經過飽和食鹽水和硫酸鎂除水後,迴旋蒸餾濃縮得不純的產物。再利用 當沖提液( EA:Hexane = 1 : 5,其 Rf = 0.4 )進行管柱層析純化後得棕色液體 12.20 g。產率:78 %。 1H NMR (300 MHz, CDCl 3) δ (ppm): 7.41 (d, J= 8.4Hz, 2H), 7.16 (d, J= 8.4, 2H), 2.44 (t, 12.2Hz, 1H), 1.87 (d, J= 9Hz, 4H), 1.65 (s, 6H), 1.48-0.93 (m, 13H), 0.88 (t, J= 7.2Hz, 3H)。13C NMR (75 MHz, CDCl3) δ (ppm): 149.13 (1C, Ar), 140.0 (1C, Ar), 132.54 (2C, Ar), 128.22 (2C, Ar), 90.4 (C≡C), 81.3 (C≡C), 66.7, 46.8, 44.09, 37.34, 37.27, 34.09 (2C), 33.45 (2C), 32.19, 31.24, 26.52, 22.75, 12.39。MS [M+] calcd. for C22H32O312.5, found 312。Anal. Calcd. For C22H32O: C, 84.56; H, 10.32。Found: C,
84.95; H, 10.43.
4-(pentylcyclohexyl)phenylacetylene (3)
將1-(3-hydroxy-3-methyl-1-butynyl)-4-pentylcyclohexylbenzene ( 15. 60 g, 50.00 mmol ) 和 KOH ( 8.44 g, 125.00 mmol ) 加入溶劑 dioxane ( 300 ml )於雙頸瓶中,將
此反應於120℃下反應 4 小時。反應結束後冷卻至室溫, 6N HCl ( 12 ml ) 溶液加 入於反應瓶中 ,並用 EA 來萃取出產物。再用水洗數次後,經過飽和食鹽水和硫 酸鎂除水後,迴旋蒸餾濃縮得不純的產物。再利用Hexane 當沖提液( Rf = 0.55 ) 進行管柱層析純化後得無色液體9.40 g。產率:74 %。 1H NMR (300 MHz, CDCl 3) δ (ppm): 7.39 (d, J= 8.1Hz, 2H), 7.14 (d, J= 8.4, 2H), 3.0 (s, 1H), 2.44 (t, 12.2Hz, 1H), 1.84 (d, J= 9Hz, 4H), 0.95-1.46 (m, 13H), 0.87 (t, J= 7.2Hz, 3H)。13C NMR (75 MHz, CDCl3) δ (ppm): 148.13 (1C, Ar), 140.2 (1C, Ar), 131.64 (2C, Ar), 127.02 (2C, Ar), 84.4 (C≡C), 77.0 (C≡C), 44.09, 37.32, 37.25, 34.09 (2C), 33.45 (2C), 32.19, 26.62, 22.71, 12.38。MS [M+] calcd. for C19H26 254.20, found
254。Anal. Calcd. For C19H26: C, 89.70; H, 10.3. Found: C, 89.5; H, 10.5。
1-(3-hydroxy-3-methyl-1-butynyl)-4-pentylcyclohexylbenzene (4).
將iodobenzene ( 10.0 g, 49.0 mmol )、PdCl2(PPh3)2 ( 0.34 g, 0.49 mmol )、 CuI
( 0.47 g, 2.45 mmol )和 PPh3 ( 0.96 g, 3.68 mmol) 都加入於反應瓶中並加入溶劑 triethylamine ( 100 ml ) 後於氮氣下攪拌 30 分鐘,待催化劑及反應物都溶解後,再 利用加液漏斗加入6-chlorohexyne ( 6.25 g, 54.00 mmol ) 於反應瓶中。在 70℃下反 應12 小時,反應結束後,迴旋蒸餾抽走 triethylamine 後,用 EA 萃取產物,再用 水洗數次後,經過飽和食鹽水和硫酸鎂除水後,迴旋蒸餾濃縮得不純的產物。再 利用當沖提液(EA:Hexane = 1 : 10,其 Rf = 0.5)進行管柱層析純化後得棕色液體 8.78 g。產率:93.8 %。 1H NMR (300 MHz, CDCl 3) δ (ppm): 7.39 (m, 2H), 7.28 (m, 3H), 3.61 (t, 7.2Hz, 2H), 2.45 (t, J= 7.2Hz, 2H), 1.96 (m, 2H), 1.75 (m, 2H)。13C NMR (75 MHz, CDCl3) δ (ppm): 132.54 (2C, Ar), 128.22 (2C, Ar), 90.4 (C≡C), 81.3 (C≡C), 66.7, 46.8, 44.09, 37.34, 37.27, 34.09 (2C), 33.45 (2C), 32.19, 31.24, 26.52, 22.75, 12.39。MS [M+] calcd. for C12H13Cl192.69, found 192。Anal. Calcd. For C12H13Cl: C, 84.56; H, 10.32. Found:
C, 74.8; H, 6.8.
1-(3-hydroxy-3-methyl-1-butynyl)-4-pentylcyclohexylbenzene (5).
將化合物(4) ( 5.00 g, 26.00 mmol )、carbazole ( 5.18 g, 31.2 mmol )、K2CO3
( 28.70 g, 208.00 mmol )和少量的 KI 全部加入在含有 150 mL dimethylformamide ( DMF ) 溶劑的反應瓶中。反應溫度在 110℃持續 24 小時,反應結束後,迴旋蒸
餾抽走DMF 後,用 EA 萃取產物,再用水洗數次後,經過飽和食鹽水和硫酸鎂除
水後,迴旋蒸餾濃縮得不純的產物。再利用當沖提液(EA:Hexane = 1 : 10,其 Rf = 0.4)進行管柱層析純化後得白色固體 5.58 g。產率:71 %。
1H NMR (300 MHz, CDCl 3) δ (ppm): 8.10 (d, J= 8.1Hz, 2H), 7.44 (m, 5H), 7.22 (m, 6H), 4.37 (t, 7.2Hz, 2H), 2.44 (t, J= 7.2Hz, 2H), 2.08 (m, 2H), 1.67 (m, 2H)。13C NMR (75 MHz, CDCl3) δ (ppm): 132.54 (2C, Ar), 128.22 (2C, Ar), 90.4 (C≡C), 81.3 (C≡C), 66.7, 46.8, 44.09, 37.34, 37.27, 34.09 (2C), 33.45 (2C), 32.19, 31.24, 26.52, 22.75, 12.39。IR (KBr), ν(cm-1): 3051, 3020, 2943, 2877, 2231, 1627, 1597, 1573, 1482, 1452, 1348, 1326, 1235, 1152, 1068, 926, 850, 750。MS [M+] calcd. for C24H21N 323.44,
found 323。Anal. Calcd. For C12H13Cl: C, 89.13; H, 6.54。Found: C, 89.0; H, 6.55.
1-Phenyl-2-(4-(pentylcyclohexyl)phenyl)acetylene (M1).
Iodobenzene ( 5.00 g, 24.50 mmol ), PdCl2(PPh3)2 ( 0.17 g, 0.25 mmol ), CuI
( 0.24 g, 1.23 mmol ) 和 PPh3 ( 0.48 g, 1.84 mmol ) 溶於溶劑 triethylamine ( 50 ml )
的雙頸瓶中,並將此反應溶液於氮氣攪拌30 分鐘後,利用加液漏斗加入化合物 (3) ( 6.86 g, 27.00 mmol ) 於反應瓶中,此反應於 70℃下加熱迴流 12 小時。反應結束 後,迴旋蒸餾抽走triethylamine 後,用 EA 萃取產物,再用水洗數次後,經過飽和 食鹽水和硫酸鎂除水後,迴旋蒸餾濃縮得不純的產物。再利用Hexane 當沖提液( Rf = 0.6 )進行管柱層析純化後得白色固體 6.87 g。產率:86 %。mp: 53-55 . ℃ 1H NMR (300 MHz, CDCl 3) δ (ppm): 7.38 (d, J= 7.2Hz, 2H), 7.34 (m, 5H), 7.19 (d, J= 7.2, 2H), 2.40 (t, 12.0Hz, 1H), 1.87 (d, J= 10.5Hz, 4H), 1.47-1.04 (m, 13H), 0.88 (t, 7.2Hz, 3H)。13C NMR (75 MHz, CDCl3) δ (ppm): 148.56 (1C, Ar), 131.64 (2C, Ar),
131.55 (2C, Ar), 128.35 (2C, Ar), 127.02 (2C, Ar), 125.60 (1C, Ar), 119.38 (1C, Ar), 90.40 (C≡C), 89.50 (C≡C), 44.09, 37.32, 37.25, 34.09 (2C), 33.45 (2C), 32.19, 26.63, 22.71, 12.38。IR (KBr), ν(cm-1): 3030, 2954, 2924, 2846, 2221, 1597, 1511, 1467, 1442, 1375, 1214, 1069, 966, 896, 828, 754。MS [M+] calcd. for C25H30 330.51,found 330。
Anal. Calcd. For C25H30: C, 90.85; H, 9.15。Found: C, 90.80; H, 9.20.
1-(4-Florophenyl)-2-(4-(pentylcyclohexyl)phenyl)acetylene (M2). 單體M2 的合成步驟和合成 M1 相似,只是將合成 M1 的起使物 iodobenzene 取代換成 4-fluoroidobenzene。合成物產物單體 M2 為白色固體。產率 82 %。mp: 65-67℃。 1H NMR (300 MHz, CDCl 3) δ (ppm): 7.50 (m, 2H), 7.40 (d, J= 7.2Hz, 2H), 7.18 (d, J= 7.2, 2H), 7.01 (m, 2H), 2.41 (t, 12.0Hz, 1H), 1.86 (d, J= 10.5Hz, 4H), 1.47-1.04 (m, 13H), 0.88 (t, 7.2Hz, 3H)。13C NMR (75 MHz, CDCl3) δ (ppm): 149.16 (1C, Ar), 143.0
(m, 1C, Ar), 141.96 (m, 1C, Ar), 131.64 (2C, Ar), 127.02 (2C, Ar), 119.38 (1C, Ar), 117.20 (2C, Ar), 115.85 (1C, Ar), 115.69 (1C, Ar), 91.21 (C≡C), 85.70 (C≡C), 44.09,
37.32, 37.25, 34.09 (2C), 33.45 (2C), 32.19, 26.63, 22.71, 12.38。IR (KBr), ν(cm-1): 3031, 2953, 2922, 2850, 2229, 2220, 1894, 1652, 1598, 1514, 1467, 1445, 1232, 1220, 1155, 1092, 1012, 966, 896, 834。MS [M+] calcd. for C25H29F1 348.22, found 348。Anal.
Calcd. For C25H29F1: C, 86.16; H, 8.39. Found: C, 86.01; H, 8.25。
1-(3,4-Difloro)phenyl-2-(4-(pentylcyclohexyl)phenyl)acetylene (M3). 單體M3 的合成步驟和合成 M1 相似,只是將合成 M1 的起使物 iodobenzene 取代換成 3,4-difluoroidobenzene。合成物產物單體 M3 為白色固體。產率 80 %。 mp: 78-80℃。 1H NMR (300 MHz, CDCl 3) δ (ppm): 7.41 (d, J= 7.2Hz, 2H), 7.19 (s, 1H), 7.15 (d, J= 7.2, 2H), 7.09 (m, 2H), 2.47 (t, 12.0Hz, 1H), 1.86 (d, J= 10.5Hz, 4H), 1.47-1.04 (m, 13H), 0.87 (t, 7.2Hz, 3H)。13C NMR (75 MHz, CDCl3) δ (ppm): 149.26 (1C, Ar), 143.3
(m, 1C, Ar), 141.96 (m, 1C, Ar), 137.38 (m, 1C, Ar), 131.34 (2C, Ar), 126.82 (2C, Ar), 119.38 (1C, Ar), 116.10 (1C, Ar), 115.85 (1C, Ar), 115.75 (1C, Ar), 91.01 (C≡C), 85.65 (C≡C), 44.09, 37.32, 37.25, 34.12 (2C), 33.24 (2C), 32.19, 26.63, 22.61, 12.38。IR (KBr), ν(cm-1): 3036, 2957, 2923, 2849, 2219, 1890, 1742, 1596, 1518, 1467, 1445, 1417, 1323, 1267, 1227, 1202, 1119, 1102, 951, 867, 829。MS [M+] calcd. for C25H28F2
366.49, found 366。Anal. Calcd. For C25H28F2: C, 81.93; H, 7.70. Found: C, 81.53; H,
7.37。 1-(3,4,5-Trifloro)phenyl-2-(4-(pentylcyclohexyl)phenyl)acetylene (M4). 單體M4 的合成步驟和合成 M1 相似,只是將合成 M1 的起使物 iodobenzene 取代換成 4-fluoroidobenzene。合成物產物單體 M4 為白色固體。產率 83 %。mp: 60-62℃。 1H NMR (300 MHz, CDCl 3) δ (ppm): 7.42 (d, J= 7.2Hz, 2H), 7.12 (d, J= 7.2, 2H), 7.08 (m, 2H), 2.46 (t, 12.0Hz, 1H), 1.86 (d, J= 10.5Hz, 4H), 1.47-1.04 (m, 13H), 0.87 (t, 7.2Hz, 3H)。13C NMR (75 MHz, CDCl3) δ (ppm): 152.3 (m, 1C, Ar), 149.16 (1C, Ar),
143.0 (m, 1C, Ar), 141.96 (m, 1C, Ar), 138.38(m, 1C, Ar), 131.64 (2C, Ar), 127.02 (2C, Ar), 119.38 (1C, Ar), 115.91(1C, Ar), 115.61(1C, Ar), 91.20 (C≡C), 85.61 (C≡C), 44.09, 37.32, 37.25, 34.09 (2C), 33.45 (2C), 32.19, 26.63, 22.71, 12.38。IR (KBr), ν(cm-1): 3030, 2957, 2922, 2852, 2682, 2217, 1909, 1609, 1529, 1447, 1428, 1379, 1255, 1206, 1202, 1070, 1046, 980, 910, 856, 832。MS [M+] calcd. for C25H27F3 384.48, found 384。
1- Pentaflorophenyl-2-(4-(pentylcyclohexyl)phenyl)acetylene (M5). 單體M5 的合成步驟和合成 M1 相似,只是將合成 M1 的起使物 iodobenzene 取代換成 4-fluoroidobenzene。合成物產物單體 M5 為白色固體。產率 84 %。mp: 70-75℃。 1H NMR (300 MHz, CDCl 3) δ (ppm): 7.48 (d, J= 7.2Hz, 2H), 7.18 (d, J= 7.2, 2H), 2.48 (t, 12.0Hz, 1H), 1.86 (d, J= 11.5Hz, 4H), 1.48-1.01 (m, 13H), 0.87 (t, 7.2Hz, 3H). 13C NMR (75 MHz, CDCl 3) δ (ppm): 149.91 (1C, Ar), 148.93 (m, 1C, Ar), 145.17 (m,
1C, Ar), 142.82 (m, 1C, Ar), 139.31 (m, 1C, Ar), 136.1 (m, 1C, Ar), 131.47 (2C, Ar), 126.82 (2C, Ar), 118.80 (1C, Ar), 101.97 (C≡C), 100.0 (1C, Ar), 72.36 (C≡C), 44.68, 37.33, 37.25, 34.45 (2C), 32.21 (2C), 30.87, 26.64, 22.63, 14.09. IR (KBr), ν(cm-1): 3030, 2957, 2920, 2854, 2230, 1917, 1622, 1525, 1496, 1445, 1412, 1365, 1109, 1096, 1029, 984, 967, 835. MS [M+] calcd. for C25H25F5 420.47, found 420. Anal. Calcd. For
C25H25F5: C, 71.41; H, 5.99. Found: C, 71.9; H, 5.82.
2.3.2 化合物 6 ~ 8 及 M6 ~ M10 之合成 2-Iodofluorene (6)
合成2-iodofluorene 是將 fluorene 碘化的反應,將 fluorene ( 30.00 g , 180.00 mmol )、iodine ( 23 g, 91 mmol ) 、iodic acid (HIO3) ( 8.00 g, 45.00 mmol )在 80 %
acetic acid 中於氮氣下在 80℃時反應 4 小時。 反應結束後冷卻至室溫,並加入大 量的水固體析出,抽器過濾並用甲醇沖洗固體,得到白色固體31.60 g。產率:60 % ; mp 130-132 .℃ 1H NMR (300 MHz, CDCl 3) δ (ppm):3.81 (d, J= 15.9Hz, 2H), 7.31 (m, 2H), 7.44 (m, 2H), 7.66 (d, J = 7.2 Hz, 1H), 7.73 (d, J = 7.2 Hz, 1H), 7.85 (s, 1H). 13C NMR (75 MHz, CDCl3) δ (ppm): 36.6, 92.5, 120.2, 121.7, 122.3, 127.1, 127.8, 132.2, 135.9,
138.0, 138.6, 153.2, 154.9. MS [M+] calcd. for C13H9I 292.12, found 292. Anal. Calcd.
For C13H9I: C, 53.45; H, 3.11. Found: C, 53.40; H, 3.18.
9,9-Dimethyl-2-iodofluorene (7).
反應瓶中將2-Iodofluorene ( 25.00 g, 85.60 mmol )溶於 THF 並加入 potassium tert-butoxid ( 21.80 g, 0.19 mol ) 後得到紅色溶液,接著加入 methyliodine ( 28.15 g, 0.19 mol ) 於室溫下反應 3 小時後反應結束。將反應迴旋蒸餾抽去溶劑後,選用環己
烷當沖提液進行管柱層析純化後,抽乾可以得到淡黃色固體25.20 g。產率:92 % ;
mp 63-65 . ℃
7.66 (d, J = 7.2 Hz, 1H), 7.73 (d, J = 7.2 Hz, 1H), 7.85 (s, 1H). 13C NMR (75 MHz, CDCl3) δ (ppm): 26.9, 47.1, 92.5, 120.0, 121.7, 122.5, 127.1, 127.8, 132.0, 135.9, 138.0,
138.6, 153.0, 154.9. MS [M+] calcd. for C15H13I 320.17, found 320. Anal. Calcd. For
C15H13I: C, 56.27; H, 4.09; I, 39.64. Found: C, 56.21; H, 4.12.
9,9-Dimethyl-2-(3hydroxy-3-methyl-1-butynyl)fluorene (8).
9,9-dimethyl-2-iodofluorene ( 25.00 g, 78.10 mmol )、PdCl2(PPh3)2 ( 0.56 g, 0.78
mmol )、CuI ( 1.53 g, 5.86 mmol )、PPh3 ( 0.74 g, 3.90 mmol ) 都加入於反應瓶中並
加入溶劑triethylamine ( 250 ml )後於氮氣下攪拌 30 分鐘,再利用加液漏斗加入 2-methyl-3-butyn-2-ol ( 7.88 g, 93.70 mmol ) 於反應中。在 80℃下反應 12 小時,反 應結束後,迴旋蒸餾抽走triethylamine 後,用 EA 萃取產物,再用水洗數次後,經 過飽和食鹽水和硫酸鎂除水後,迴旋蒸餾濃縮得不純的產物。再利用EA:Hexane (1 : 5)當沖提液進行管柱層析純化後得棕色液體 13.00 g。產率:68 %。 1H NMR (300 MHz, CDCl 3) δ (ppm): 1.47 (s, 6H), 1.65 (s, 6H), 7.31 (m, 2H), 7.41 (m, 2H), 7.48 (s, 1H), 7.66 (m, 2H). 13C NMR (75 MHz, CDCl3) δ (ppm): 26.9, 31.4, 46.8, 66.7, 81.2, 90.4, 119.8, 120.3, 122.5, 122.6, 126.4, 127.0, 127.8, 131.2, 138.2, 140.0, 153.9, 154.0. MS [M+] calcd. for C20H20O 276.38, found 276. Anal. Calcd. For
C20H20O: C, 89.92; H, 7.29; O, 5.79. Found: C, 89.94; H, 7.23.
(9,9-Dimethyl-2-fluorene)acetylene (M6).
將9,9-Dimethyl-2-(3hydroxy-3-methyl-1-butynyl)fluorene ( 10.00 g, 36.00 mmol ) 和KOH ( 4.44 g, 79.2 mmol ) 加入溶劑 dioxane ( 300 ml )於雙頸瓶中,將此反應於 120℃下反應 4 小時。反應結束後冷卻至室溫, 6N HCl ( 12 ml ) 溶液加入於反應 瓶中 ,並用 EA 來萃取出產物。再用水洗數次後,經過飽和食鹽水和硫酸鎂除水 後,迴旋蒸餾濃縮得不純的產物。再利用Hexane 當沖提液進行管柱層析純化後得 無色液體5.80 g。產率:74 %。 1H NMR (300 MHz, CDCl 3) δ (ppm): 1.47 (s, 6H), 3.12 (s, 1H), 7.32 (m, 2H), 7.44 (m, 2H), 7.56 (s, 1H), 7.64 (d, J = 7.2 Hz, 1H), 7.67 (d, J = 7.2 Hz, 1H),. 13C NMR (75 MHz, CDCl3) δ (ppm): 26.9, 46.8, 77.0, 84.4, 119.8, 120.3, 122.5, 122.6, 126.4, 127.0,
127.8, 131.2, 138.2, 140.0, 153.9, 154.0. MS [M+] calcd. for C17H14 218.30, found 218.
Anal. Calcd. For C17H14: C, 93.54; H, 6.46. Found: C, 93.53; H, 6.47.
1-Pentyl-2-(9,9-dimethyl-2-fluorene)acetylene (M7) and 1-decyl-2-(9,9-dimethyl-2- fluorene)acetylene (M8) and 1-phenyl-2-(9,9-dimethyl-2-fluorene)acetylene (M9)
and 1-(3,4-diflorophenyl)-2-(9,9-Dimethyl-2-fluorene)acetylene (M10).
單體M7-M10 合成是相同的合成步驟。在此僅以單體 M7 合成步驟為例,將
9,9-dimethyl-2-iodofluorene ( 10.00 g, 31.20 mmol ), PdCl2(PPh3)2 ( 0.22 g, 0.31
mmol ), CuI ( 0.62 g, 2.37 mmol ) 和 PPh3 ( 0.24 g, 1.26 mmol ) 溶於溶劑
triethylamine ( 100 ml ) 的雙頸瓶中,並將此反應溶液於氮氣攪拌 30 分鐘後,利用 加液漏斗加入1-heptyene ( 3.60 g, 37.5 mmol ) 於反應瓶中,此反應於 70℃下加熱 迴流12 小時。反應結束後,迴旋蒸餾抽走 triethylamine 後,用 EA 萃取產物,再 用水洗數次後,經過飽和食鹽水和硫酸鎂除水後,迴旋蒸餾濃縮得不純的產物。 再利用Hexane 當沖提液進行管柱層析純化後得無色黏稠液體 4.76 g。產率:53 %。 1H NMR (300 MHz, CDCl 3) δ (ppm): 0.93 (t, 3H), 1.48 (m, 10H), 1.62 (m, 2H), 2.43 (t, 2H), 7.32 (m, 2H), 7.40 (m, 2H), 7.46 (s, 1H), 7.61 (d, J = 7.2 Hz, 1H), 7.63 (d, J = 7.2 Hz, 1H). 13C NMR (75 MHz, CDCl3) δ (ppm): 14.0, 19.4, 22.2, 26.9, 28.5, 31.1, 46.7, 81.2, 90.4, 119.7, 120.1, 122.5, 122.6, 125.8, 127.0, 127.3, 130.5, 138.5, 138.6, 153.4, 153.7. MS [M+] calcd. for C22H24 288.43,found 288. Anal. Calcd. For C22H24: C,
91.61; H, 8.39. Found: C, 91.60; H, 8.40. M8: 產率:51 %。 1H NMR (300 MHz, CDCl 3) δ (ppm): 0.9 (t, 3H), 1.27 (m, 13H), 1.46(m, 7H), 1.62 (m, 2H), 2.43 (t, 2H), 7.32 (m, 2H), 7.39 (m, 2H), 7.46 (s, 1H), 7.61 (d, J = 7.2 Hz, 1H), 7.64 (d, J = 7.2 Hz, 1H). 13C NMR (75 MHz, CDCl3) δ (ppm): 14.1, 19.4, 22.6, 26.9, 28.8, 29.0, 29.2, 29.3, 29.5, 29.6, 31.9, 46.7, 81.2, 90.4, 119.7, 120.1, 122.5, 122.6, 125.8, 127.0, 127.3, 130.5, 138.5, 138.6, 153.4, 153.7. MS [M+] calcd. for C27H34
358.57, found 358. Anal. Calcd. For C27H34: C, 90.44; H, 9.56. Found: C, 90.40; H,
9.60. M9: 產率:70 % ; mp 112-114 ℃。 1H NMR (300 MHz, CDCl 3) δ (ppm): 1.50 (s, 6H), 7.34 (m, 4H), 7.43 (m, 2H), 7.51 (m, 3H), 7.60 (s, 1H), 7.70 (d, J = 7.8Hz, 2H). 13C NMR (75 MHz, CDCl3) δ (ppm): 26.9, 46.8, 89.5, 90.4, 119.9, 120.3, 121.9, 122.5, 122.6, 123.0, 126.0, 127.0, 127.1, 127.7, 128.1, 128.3, 130.7, 131.6, 138.2, 139.4, 153.9, 154.0. MS [M+] calcd. for C23H18
294.40, found 294. Anal. Calcd. For C23H18: C, 93.84; H, 6.16. Found: C, 93.74; H,
6.26.
1H NMR (300 MHz, CDCl 3) δ (ppm): 1.50 (s, 6H), 7.14 (quartet, 1H), 7.35 (m, 3H), 7.49 (d, 1.5Hz, 1H), 7.52 (d, 1.5Hz, 1H), 7.58(d, 1.5Hz, 1H), 7.69 (s, 1H), 7.70 (m, 2H). 13C NMR (75 MHz, CDCl3) δ (ppm): 26.9, 46.8, 87.2, 90.3, 117.5(d), 119.9, 120.3, 120.4(d), 121.0, 122.5, 122.6, 126.0, 127.1, 127.8, 128.0(d), 128.1(d), 130.7, 138.2, 139.8, 148.2(d), 148.5(d), 151.9(d), 152.2(d), 153.6, 153.8. MS [M+] calcd. for 330.38, found 330. Anal. Calcd. For C23H16F2: C, 83.62; H, 4.88. Found: C, 83.60; H, 4.91.
2.3.3 聚合物之合成
此研究中所有聚合反應皆在無水的氮氣下進行,聚合步驟參考 Scheme 2-2 及
2-3。藥品的量秤也在無水的手套箱中進行,聚乙炔聚合反應步驟皆相同,以下就
以聚合M1 為例。其聚合步驟如下,取一 25 mL 雙頸瓶於無水手套箱中秤取催化
劑TaCl5 ( 0.158 g, 0.4 mmol ) 和助催化劑 n-Bu4Sn ( 0.28 mg, 0.8 mmol ) 後,取出於
氮氣下加入溶劑甲苯10 mL 於反應瓶中,於 80℃下加熱攪拌 30 min。此外,另取 單體 M1 ( 0.9 g, 4.12 mmol )秤入於另一 25 mL 雙頸瓶中並加入溶劑甲苯 10 mL 溶 解單體後,快速用針筒吸取單體溶液打入含催化劑之反應瓶中,反應24 小時。反 應結束後至冷,將溶液慢慢滴入快速攪拌的甲醇溶液中,此時會有大量固體析出 後,進行抽器過濾可得聚乙炔高分子,並於抽真空乾燥後得 PDPA-CHC5 高分子 0.61 g (產率: 81%)。 1H NMR (300 MHz, CDCl 3) δ (ppm): 7.38 (d, J= 7.2Hz, 2H), 7.34 (m, 5H), 7.19 (d, J= 7.2, 2H), 2.40 (t, 12.0Hz, 1H), 1.87 (d, J= 10.5Hz, 4H), 1.47-1.04 (m, 13H), 0.88 (t, 7.2Hz, 3H). 13C NMR (75 MHz, CDCl3) δ (ppm): 156.02 (2C, C=C), 148.56 (1C,
Ar), 131.64 (2C, Ar), 131.55 (2C, Ar), 128.35 (2C, Ar), 127.02 (2C, Ar), 125.60 (1C, Ar), 119.38 (1C, Ar), 44.09, 37.32, 37.25, 34.09 (2C), 33.45 (2C), 32.19, 26.63, 22.71, 12.38。 Anal. Calcd. For C25H30: C, 90.85; H, 9.15。 Found: C, 89.55; H, 8.89。
PDPA-1F:產率:92.4%。1H NMR (300 MHz, CDCl3) δ (ppm): 7.55 (m, 2H), 7.43 (d,
J= 7.2Hz, 2H), 7.17 (d, J= 7.2, 2H), 7.11 (m, 2H), 2.41 (t, 12.0Hz, 1H), 1.85 (d, J= 10.5Hz, 4H), 1.47-1.04 (m, 13H), 0.88 (t, 7.2Hz, 3H)。13C NMR (75 MHz, CDCl3) δ
(ppm): 154.52 (2C, C=C), 149.16 (1C, Ar), 143.0 (m, 1C, Ar), 141.96 (m, 1C, Ar), 131.64 (2C, Ar), 127.02 (2C, Ar), 119.38 (1C, Ar), 117.20 (2C, Ar), 115.85 (1C, Ar), 115.69 (1C, Ar), 44.09, 37.32, 37.25, 34.09 (2C), 33.45 (2C), 32.19, 26.63, 22.71, 12.38。Anal. Calcd. For C25H29F: C, 86.16; H, 8.39. Found: C, 86.01; H, 8.35。
7.16 (s, 1H), 7.13 (d, J= 7.4, 2H), 7.09 (m, 2H), 2.57 (t, 12.0Hz, 1H), 1.87 (d, J= 10.5Hz, 4H), 1.47-1.08 (m, 13H), 0.87 (t, 7.2Hz, 3H)。13C NMR (75 MHz, CDCl3) δ (ppm):
155.24 (2C, C=C), 149.26 (1C, Ar), 143.3 (m, 1C, Ar), 141.96 (m, 1C, Ar), 137.38 (m, 1C, Ar), 131.34 (2C, Ar), 126.82 (2C, Ar), 119.38 (1C, Ar), 116.10 (1C, Ar), 115.85 (1C, Ar), 115.75 (1C, Ar), 44.09, 37.32, 37.25, 34.12 (2C), 33.24 (2C), 32.19, 26.63, 22.61, 12.38。Anal. Calcd. For C25H28F2: C, 81.93; H, 7.70. Found: C, 81.54; H, 7.40.
PDPA-3F:產率:90%。1H NMR (300 MHz, CDCl3) δ (ppm): 7.46 (d, J= 7.1Hz, 2H),
7.14 (d, J= 7.2, 2H), 7.09 (m, 2H), 2.48 (t, 12.0Hz, 1H), 1.92 (d, J= 10.3Hz, 4H), 1.47-1.04 (m, 13H), 0.87 (t, 7.2Hz, 3H)。13C NMR (75 MHz, CDCl3) δ (ppm): 154.64
(2C, C=C), 152.5 (m, 1C, Ar), 149.20 (1C, Ar), 143.0 (m, 1C, Ar), 141.96 (m, 1C, Ar), 138.78(m, 1C, Ar), 131.64 (2C, Ar), 127.02 (2C, Ar), 119.38 (1C, Ar), 115.90(1C, Ar), 115.61(1C, Ar), 44.09, 37.32, 37.25, 34.09 (2C), 33.45 (2C), 32.19, 26.63, 22.71, 12.38。Anal. Calcd. For C25H27F3: C, 78.10; H, 7.08. Found: C, 77.61 H, 6.83。
PDPA-5F:產率: 31%。 1H NMR (300 MHz, CDCl3) δ (ppm): 7.45 (d, J= 7.2Hz, 2H),
7.16 (d, J= 7.2, 2H), 2.46(t, 12.0Hz, 1H), 1.86 (d, J= 11.5Hz, 4H), 1.48-1.10 (m, 13H), 0.88 (t, 7.2Hz, 3H)。13C NMR (75 MHz, CDCl3) δ (ppm): 149.91 (1C, Ar), 148.93 (m,
1C, Ar), 145.17 (m, 1C, Ar), 142.82 (m, 1C, Ar), 139.31 (m, 1C, Ar), 136.1 (m, 1C, Ar), 131.47 (2C, Ar), 126.82 (2C, Ar), 118.80 (1C, Ar), 100.0 (1C, Ar), 44.68, 37.33, 37.25, 34.45 (2C), 32.21 (2C), 30.87, 26.64, 22.63, 14.09。Anal. Calcd. For C25H25F5: C, 71.41;
H, 5.99. Found: C, 70.94; H, 5.53。
PDPA-2Fcab:產率: 90.3%。1H NMR (300 MHz, CDCl3) δ (ppm): 7.41 (d, J= 7.2Hz,
2H), 7.16 (s, 1H), 7.13 (d, J= 7.4, 2H), 7.09 (m, 2H), 2.57 (t, 12.0Hz, 1H), 1.87 (d, J= 10.5Hz, 4H), 1.47-1.08 (m, 13H), 0.87 (t, 7.2Hz, 3H)。13C NMR (75 MHz, CDCl3) δ
(ppm): 155.24 (2C, C=C), 149.26 (1C, Ar), 143.3 (m, 1C, Ar), 141.96 (m, 1C, Ar), 137.38 (m, 1C, Ar), 131.34 (2C, Ar), 126.82 (2C, Ar), 119.38 (1C, Ar), 116.10 (1C, Ar), 115.85 (1C, Ar), 115.75 (1C, Ar), 44.09, 37.32, 37.25, 34.12 (2C), 33.24 (2C), 32.19, 26.63, 22.61, 12.38。Anal. Calcd. For C249H273F18N: C, 82.53; H, 7.65; N, 0.39. Found:
C, 80.81; H, 7.91; N, 0.78。
PFA1: 產率: 68%。1H NMR (300 MHz, CDCl3) δ (ppm): 1.48 (s, 6H), 7.19 (br, 3H),
120.3, 122.5, 122.6, 126.4, 127.0, 127.8, 131.2, 138.2, 140.0, 153.9, 154.0. 155.0。Anal. Calcd. For C17H14: C, 93.54; H, 6.46. Found: C, 92.64; H, 6.46。
PFA2: 產率: 31%。1H NMR (300 MHz, CDCl3) δ (ppm): 0.93 (t, 3H), 1.47 (br, 12H),
2.18 (t, 2H), 7.17 (br, 5H), 7.62 (br, 2H)。13C NMR (75 MHz, CDCl3) δ (ppm): 14.0,
19.4, 26.9, 28.5, 31.1, 45.7, 119.7, 120.1, 122.5, 122.6, 125.8, 127.0, 127.3, 130.5, 138.5, 138.6, 140.0, 153.4, 153.7。Anal. Calcd. For C22H24: C, 91.64; H, 8.39。Found: C,
89.00; H, 8.10。
PFA3: 產率: 36%。1H NMR (300 MHz, CDCl3) δ (ppm): 0.93 (t, 3H), 1.27-1.55 (br,
22H), 2.20 (t, 2H), 7.32 (br, 5H), 7.6 (br, 2H)。 13C NMR (75 MHz, CDCl3) δ (ppm):
14.1, 19.4, 22.6, 26.9, 28.8, 29.0, 29.2, 29.3, 29.5, 29.6, 31.9, 46.7, 119.7, 120.1, 122.5, 122.6, 125.8, 127.0, 127.3, 130.5, 138.5, 138.6, 146.5, 153.4, 153.7。Anal. Calcd. For C27H34: C, 90.44; H, 9.56. Found: C, 88.54; H, 9.40。
PFA4: 產率: 75%。1H NMR (300 MHz, CDCl3) δ (ppm): 1.58 (s, 6H), 7.40 (br, 6H),
7.55 (br, 4H), 7.70 (br, 2H)。13C NMR (75 MHz, CDCl3) δ (ppm): 26.9, 46.8, 119.9,
120.3, 121.9, 122.5, 122.6, 123.0, 126.0, 127.0, 127.1, 127.7, 128.1, 128.3, 130.7, 131.6, 138.2, 139.4, 153.9, 153.0. 156.4。Anal. Calcd. For C23H18: C, 93.84; H, 6.16。Found: C,
92.20; H, 5.89.
PFA5: 產率: 70%。1H NMR (300 MHz, CDCl3) δ (ppm): 1.58 (s, 6H), 7.15 (br, 1H),
7.35 (br, 3H), 7.50 (br, 3H), 7.68 (br, 3H)。13C NMR (75 MHz, CDCl3) δ (ppm): 26.9,
46.8, 117.5(d), 119.9, 120.3, 120.4(d), 121.0, 122.5, 122.6, 126.0, 127.1, 127.8, 128.0(d), 128.1(d), 130.7, 138.2, 139.8, 148.2(d), 148.5(d), 151.9(d), 152.2(d), 153.6, 153.8. 156.2。Anal. Calcd. For C23H16F2: C, 83.62; H, 4.88。Found: C, 82.66; H, 5.22.
2.4 元件製作
在 預 洗 好 的 ITO 玻 璃 上 以 旋 轉 塗 佈 的 方 式 , 將 Poly(3,4-ethylene dioxythiophene/polystyrene sulfonate) (PEDOT/PSS) 塗佈成膜其上,於 150℃下加熱 一小時。再將所合成的發光材料溶於CHCl3中,配製成0.6% (w/v) 溶液,以旋轉
塗佈方式將高分子塗佈成膜於ITO 玻璃上。轉速及時間設定為:第一段轉速 1000
rpm,時間 10 秒;第二段轉速 2000 rpm,轉速 30 秒。最後再以真空蒸鍍方式,在 高分子薄膜表面鍍上鈣及鋁做為電極。在真空度為6×10-7 torr 下,鍍上的鈣(Ca)及
鋁(Al)電極厚度分別為 350 Å 及 1000 Å。
Scheme 2-1. Synthesis of 5 and Monomers M1-M5.
H11C5 H11C5 I Ar : F F F F F F F F F F F H11C5 C C Ar ArI or ArBr M1-M5 1 2 M1 M2 M3 M4 M5 I C C Cl C C N 3 4 H11C5 C C H 5 H11C5 C C OH I2/HIO3 AcOH PdCl2(PPh3)2 PPh3 CuI / / KOH Dioxane PdCl2(PPh3)2 PPh3 CuI / / PdCl2(PPh3)2 PPh3 CuI / / N K2CO3/KI DMF/ Cl OH
Scheme 2-2. Synthesis of Monomers M6-M10 and Polymers PFA1-PFA5. I I C C H 7 6 7 C C R C C OH 8 I2 / HIO3 AcOH THF CH3I / t BuOK -HC C OH PdCl2(PPh3)2, CuI, PPh3 / Et3N KOH Dioxane Cat. 7 HC C R PdCl2(PPh3)2, CuI, PPh3 / Et3N 7 M : R= F F Cat. n C C n C C n C C H n C C n C C F F 3 PFA 5 PFA 4 PFA PFA1 2 PFA R= M 6 8 M : R= 9 M : R= 10 M :
Scheme 2-3. Synthesis of Polymers PDPA-CHC5, PDPA-1F, PDPA-2F, PDPA-3F, PDPA-5F and PDPA-2Fcab.
C C A r H11C5 n M 1-M 5 C F C C5H11 F 90 10 M 2 + 5 C C N PD PA -2Fcab polym erization TaC l5/n B u- 4Sn polym erization TaC l5/n B u- 4S n R : F F F F F F F F F F F PD PA -C H C 5 PD PA -1F PD PA -2F PD PA -3F PD PA -5F R C C C5H11
第三章 結果與討論
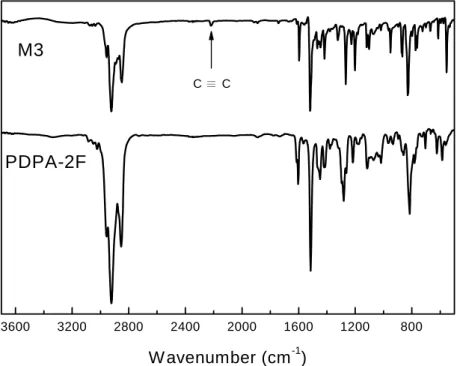
3.1 含氟之聚乙炔光電性質研究 3.1.1 聚合反應之探討 Table 3-1 摘要含戊烷環己烷基和氟苯基之單體乙炔,所使用的 TaCl5當催化 劑以及n-Bu4Su 當助催化劑條件下,以及紀錄所使用的聚合條件。聚合反應主要都 是使用甲苯溶劑並及溫度80 oC 下進行,單體 M1 ~ M5 都屬於雙取代聚乙炔聚合, 在M1~ M4 的聚合結果也和文獻也報導相近 [31],雙苯環乙炔利用 TaCl5/n-Bu4Sn 催化劑聚合可以得到高分子量和高產率的聚乙炔,我們所得到分子量 Mn 約~ 300KDa 至 900KDa 以及產率至少在 ~ 80%以上,再則,即使若在聚合中加入有可 能也是少量10% 的化合物 5 進行共聚反應,對分子量和產率也不會影響多大。另 外,M5 所得的結果較特別,分子量和產率都下降許多,Mn 約~ 42KDa 以及產率 約 30%,最有可能的原因是側鏈的五氟苯基的氟原子靠近三鍵,導致於三鍵在聚 合成雙鍵主鏈的過程中,造成影響而使得聚合產率下降。 3.1.2 高分子結構鑑定 Fig. 3-1 表示高分子 PDPA-2F 的 IR 圖譜,為了比較其單體 M3 的 IR 圖譜顯示 於圖中。單體M3 的三鍵 C≣C stretching 特徵峰之吸收,在波長 2220 cm-1處,然 而在PDPA-2F 圖中上述的吸收全都消失,至於雙鍵 C=C stretching 的吸收在 1650 cm-1處不是很明顯,不過根據GPC 分析,確實已得到聚乙炔高分子。比較 M3 和 PDPA-2F 的圖譜,在指紋區的吸收二者都非常相似,因此很難在 IR 圖譜中分辨出 PDPA-2F 高分子結構中 cis-和 trans-所佔的成分多寡。至於聚乙炔詳細的 IR 圖譜 討論將在後面章節內。利用 TGA 和 DSC 可以測量出所合成聚乙炔的熱性質,並且其資訊都被摘要
在Table 3-1 中。Fig. 3-2 表示聚乙炔高分子的 TGA 圖形,可以發現此材料表現出
很好的穩定性,在重量損失5% 時的熱裂解溫度( Td )範圍約在 400 ℃之間。此系
列聚乙炔的玻璃轉移溫度( Tg )範圍也在 200 至 230 ℃之間,因為此系列高分子都 為雙苯環聚乙炔,高分子鏈的側鏈由兩個苯環所包圍,使得此系列聚乙炔有奇佳
的熱穩定性,具有較高的 Td 和 Tg。再則此系列之高分子對一般溶劑的溶解度都
Table 3-1 Polymerization of Monomers M1-M5a and M2+5
Monomer Yield (%) Mnb PDI Tg (℃) Td (℃)c
M1 80.9 306,500 1.39 201.7 415 M2 92.4 761,600 1.67 219.8 401 M3 95.9 890,900 1.59 232.8 410 M4 90.4 725900 1.70 235.7 425 M5 30.7 42,000 1.78 230.7 400 M2+5 90.3 737,600 1.48 228.5 406
a All polymerization took place under nitrogen for 24hr in toluene solution and used
n-Bu4Sn as cocatalyst. [M] = 0.2M, [TaCl5] = 20 mM, [n-Bu4Sn] = 40 mM. b
Determined by GPC relative to polystyrene. c Temperature of 5% weight loss measured by TGA in nitrogen.
Fig. 3-1. IR spectra of M3 and PDPA-2F.
3600 3200 2800 2400 2000 1600 1200 800
C ≣ C
W avenumber (cm-1)
M3
Fig. 3-2. TGA thermograms of PDPA-CHC5 ~ PDPA-2Fcab. 3.1.3 聚合物之光學性質
Fig. 3-3 表示 PDPA-CHC5 ~ PDPA-5F 在薄膜態的 UV-vis 吸收光譜分別。我們
比較其薄膜態吸收光譜,主要有兩個吸收峰在375 和 430 nm,二者主要為聚乙炔
高分子π-π*主鏈的吸收 [32]。此外,當側鏈苯基上的氟原子的數量增加時,其 UV 吸收值會出現紅位移,如 PDPA-5F 的最大吸收值在 473 nm,比較側鏈苯基沒 有氟原子的PDPA-CHC5,PDPA-5F 紅位移約 40 nm 之多。
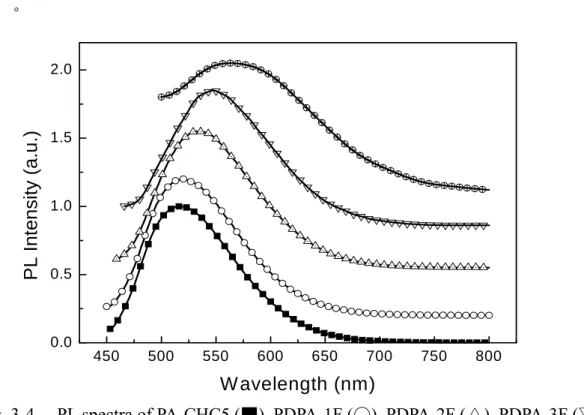
Fig. 3-4 顯示出 PDPA-CHC5 ~ PDPA-5F 的 PL 螢光光譜圖在薄膜態。 PDPA-CHC5 的 PL 螢光光譜放射峰皆在 517 nm 左右為綠光,其 PL 效率(φf) 值為
54.5%。我們也可以明顯地注意到,當側鏈苯基的氟原子的數量增加時,PL 最大 放射波長會出現紅位移,但是PL 效率卻會下降,如 PDPA-1F、PDPA-2F、PDPA-3F 和PDPA-2F 的最大放射波長分別在 519、536、547、568 nm,以及 PL 效率下降後 分別為52.7%、43.7%、30%、4.1%。Table 3-2 摘要 PDPA-CHC5 ~ PDPA-5F 的 UV-vis
吸收光譜和 PL 螢光光譜,由表可以此系列材料在溶液中和薄膜時的 UV-vis 吸收 相似,但PL 值在薄膜時會出現紅位移現象,表示此系列材料即使導入巨大基團的 戊烷環己烷基於側鏈,仍有堆疊現象發生。 100 200 300 400 500 600 700 800 20 40 60 80 100 Weight R e sidue (%) Temperature ( oC ) PDPA-CHC5 PDPA-1F PDPA-2F PDPA-3F PDPA-5F PDPA-2Fcab
Fig. 3-3. UV-vis absorption spectra of PA-CHC5 (▓), PDPA-1F (○), PDPA-2F (△), PDPA-3F (▽) and PDPA-5F (♁) in thin film state.
。
Fig. 3-4. PL spectra of PA-CHC5 (▓), PDPA-1F (○), PDPA-2F (△), PDPA-3F (▽) and PDPA-5F (♁) in thin film state.
450 500 550 600 650 700 750 800 0.0 0.5 1.0 1.5 2.0 PL Intensity (a.u.) W avelength (nm) 300 350 400 450 500 550 600 0.0 0.1 0.2 0.3 0.4 0.5 Abso rba n ce (a.u. ) Wavelength (nm)
Table 3-2. Optical Properties, Quantum Yields of polymers
Solutiona Filmb
Abs PL Abs PL PL efficiencye
Polymer λmax (nm)c λmax (nm)d λmax (nm)c λmax (nm)c,d Film (%)
PDPA-CHC5 430 492 423 517 54.5 PDPA-1F 430 494 429 519 52.7 PDPA-2F 437 500 433 536 43.7 PDPA-3F 438 533 441 547 30.8 PDPA-5F 480 569 473 568 4.1 PDPA-2Fcab 438 500 431 537 45.6
a Measured in THF. b Prepared by spin-coating from toluene solution. c Data in the
parentheses are wavelength of shoulders. d Excited at λmax of abs. e Measured by integral sphere. f The optical band gap takes as the absorption onset of UV-vis spectrum of the polymer film. g HOMO/LUMO values as determined by the onset of CV measurements and optical band gap.
3.1.4 聚合物之電化學性質
為了解聚合物之HOMO 與 LUMO 能帶值,我們進行了循環伏安計量(Cyclic
voltammetry, CV)分析。一般高分子發光材料 HOMO、LUMO 能帶與能階(Energy gap, Eg)的關係可以下列式子表示之:
HOMO = | 4.4 + Eox,onset |
LUMO = | 4.4 + Ered,onset |
Eg = HOMO – LUMO
式中的Eox, onser和Ered, onset分別表示在氧化與還原曲線中的起始電位值。由於高分
子材料在量測還原電位時會因為水或其他物質的存在而變得雜亂,無法得到確切
的還原曲線,故通常利用 UV-vis 吸收光譜中的吸收起始點(λonset)配合下列式子
得到能階Eg 值:
Eg (e.V) = 1240 / λonset (nm)
測量和計算方式如前所述,Fig. 3-5 所表示聚乙炔在氧化方面的 CV 圖,其氧 化的起使吸收電位約在+ 0.9 到+ 1.33 V。然而利用 UV-vis 吸收圖譜可以計算出其 能帶( band gap ),其能帶範圍約從 2.29 到 2.67 eV。因此,我們可以從已知的 HOMO
能階和能帶,計算出高分子個別的LUMO 能階,其詳細能階資訊被列表在上頁 table
3-3 中。
在我們的研究中,側鏈取代基是會影響到聚乙炔的能帶性質,基本上來說, 電子效應( electronic effect )和立體障礙( steric hindrance )是主要兩個因素。由結果 得知,在聚乙炔的側鏈苯環上引入氟原子,是屬於電子效應,因為氟原子為強拉 電子基,根據文獻報導 [33-35],導入拉電子基在共軛高分子主鏈會造成或具有五
氟苯基有機材料,其材料的 LUMO 和 HOMO 會明顯地下降,此現象也發生在我
們例子中,PDPA-CHC5 的 LUMO 和 HOMO 分別為 2.63 和 5.30 eV,側鏈為 1-氟 苯基的PDPA-1F 其 LUMO 和 HOMO 下降,分別為 2.83 和 5.50 eV,隨著氟原子 的增加,側鏈為五氟苯基的PDPA-5F 其 LUMO 和 HOMO 下降更多,分別至 3.44
和2.29 eV。因此,當側鏈苯環上的氟原子增加時,導致 LUMO 和 HOMO 下降,
也使得之間的能帶下降,所以由CV 的測量我們可以更明確瞭解,上述其光學性質
( UV 吸收和 PL 放射 )為何都出現紅位移現象。
Fig. 3-5. Cyclic voltammorgrams of (a) PDPA-CHC5, PDPA-1F and PDPA-2F (b) PDPA-2Fcab, PDPA-3F and PDPA-5F.
0.0 0.5 1.0 1.5 2.0 0.0000 0.0001 0.0002 0.0003 0.0004 PDPA-2F C u rrent (m A) Potential (V) PDPA-CHC5 PDPA-1F (a) 0.0 0.5 1.0 1.5 2.0 0.0000 0.0001 0.0002 0.0003 PDPA-5F PDPA-3F Cu rr en t (mA ) Potential (V) PDPA-2Fcab (b)