國立交通大學
分子醫學與生物工程研究所
碩士論文
Characterization of Fur, RcsB, and the cyclic di-GMP dependent expression of type 3 fimbriae in Klebsiella pneumonia CG43
克雷白氏肺炎桿菌 CG43 Fur、RcsB 及 cyclic di-GMP 對第三型纖毛表現之調控探討
Student: Wei-feng Lin 研究生:林偉豐
Advisor: Hwei-Ling Peng,Ph.D. 指導教授: 彭慧玲 博士
July,2014
i
論文摘要
生物膜是形成微生物感染過程中重要的一環,細菌的二級訊號分 c-di-GMP 已被證實是調控生物膜形成的重要分子,而第三型纖毛是決定克雷白氏肺炎桿菌 生物膜形成的主要因子,其表現受 c-di-GMP 與 PilZ domain 蛋白 MrkH 所正向調 控;另外 Fur 及 RcsB 也會正向調控克雷白氏肺炎桿菌 CG43 中第三型纖毛的表 現。本論文藉著分析特定基因的缺損對於第三型纖毛主要單位蛋白 MrkA 表現的 影響,進一步探討 Fur、RcsB 和 c-di-GMP 間交互作用的可能性。我們發現在限 鐵或低鐵環境中(LB 中添加鐵螯合物 deferoxamine、M9 或 DMEM 培養條件下), fur 和小 RNA ryhB 基因同時缺損下,可以回復 MrkA 的生成量,進一步測試其 啟動子活性和生物膜生成量,結果也顯示 Fur 活化 MrkA 表現的方式可能是透過 抑制小 RNA ryhB;有趣的是,當細菌在靜置培養條件下,fur 基因缺損對於 MrkA 的表現沒有影響,然而,在此培養條件下,fur 和 rcsB 基因同時缺損卻可測得 Fur 對 MrkA 表現的影響。在 LB 或 M9 震盪培養、或 LB 靜置培養下,Fur 的表現量 變化不大,此暗示在微氧環境中,RcsB 負向調控 Fur。此外,進一步藉測試第一 型纖毛的活性及單位蛋白 FimA 的生成量,結果發現 RcsB 負向調控第一型纖毛 活性,而 Fur 可能正向影響第一型纖毛的表現;有趣的是,在 rcsB 基因缺損下, 生物膜生成明顯提高,然而,rcsB 或 fur 基因缺損對纖維素的生成沒有明顯影響, 此顯示除了第三型纖毛和纖維素外,還有其它決定生物膜生成的重要因子。進一 步利用西方墨點法分析 RcsB 對第三型纖毛表現的調控機制,結果發現 RcsB 可 能與 RmpA2 作用而影響第三型纖毛的表現。最後,在 fur 及 rcsB 雙基因缺損的 狀態下,c-di-GMP 依然可以活化 MrkA 表現,只有在 mrkH 基因缺損下才失去 c-di-GMP 的活化功能,此結果顯示 c-di-GMP 與 Fur/RcsB 對第三型纖毛表現的 調控機制是分開獨立的。
ii
Abstract
Biofilm formation is an important stage for many microbial infections. Cyclic di-GMP (c-di-GMP), a bacterial second messenger, has been shown as a key signaling molecule to modulate the biofilm formation. In Klebsiella pneumoniae, type 3 fimbriae is the major determinant for biofilm formation and the expression is dependent on the c-di-GMP levels. It is speculated that MrkH, a PilZ domain protein, is responsible for the c-di-GMP dependent expression. We have previously demonstrated that Fur (Ferric uptake regulator) and RcsB (regulator of capsule synthesis) positively regulates the expression of type 3 fimbriae in K. pneumoniae CG43. Here we analyze further the specific gene deletion effects on the major pilin MrkA production to explore if interacting regulation is present between Fur, RcsB, and c-di-GMP. In low iron conditions which include LB with deferoxamine, M9 or DMEM medium, deletion of fur and ryhB can restore MrkA production. The promoter activity analysis and biofilm formation measurement also revealed that Fur activation of the MrkA production is probably mediated by repression of the small RNA ryhB. Interestingly, deletion of fur had not affected the MrkA
production when the bacteria grown under static condition. However, under the same cultured condition, the fur deletion effect is again observed when the rcsB gene was removed. This implies that RcsB negatively regulates the expression of Fur under microaerobic environment. Meanwhile, type 1 fimbriae activity
assessment and FimA production analysis indicated that RcsB negatively affects the expression of type 1 fimbriae while Fur probably plays a positive role on type 1 fimbriae expression. Interestingly, deletion of rcsB increased biofilm formation, however, fur or rcsB deletion had no effect on the cellulose synthesis. This indicates that, in addition to type 3 fimbriae and cellulose, other important
iii
determinant(s) is present for the biofilm formation. Furthermore, the analysis of the deletion effects of rcsB, rmpA, rmpA2, and fur on MrkA production suggests that RcsB interacts with RmpA2 for the regulation of type 3 fimbriae expression. Finally, increase c-di-GMP levels still can activate MrkA production in the absence of rcsB or fur, while the c-di-GMP dependent MrkA production is no longer
observed when mrkH is deleted. This implies that the regulatory mechanisms of c-di-GMP and Fur/RcsB for the control of type 3 fimbriae expression are independent.
iv
致謝
檢視足跡會發現生命因踏實走過而豐美 -牧羊少年奇幻之旅 時光倉促,從退伍進實驗室到畢業,兩年多的碩士生涯轉眼即過,由於大學 時成績並不出色,所以並沒有推甄而是選擇考試但也備取很後面,所以就直接去 當兵,而在當兵時等待備取時,還想說要不要轉換跑道不走生科了,沒想到一個 禮拜後收到備取通知,還打了好幾次電話確定,之後退伍就進入實驗室,想當初 要進入交通大學就讀時,心中還非常惶恐想說我可以嗎?會有老師想收我嗎?會不 會讀不下去?每一位同學感覺都好厲害,沒想到碩士兩年過去了,期間我還得過 書卷獎及斐陶斐獎,這段期間首先要感謝的人就是我的指導老師 彭慧玲老師, 感謝她願意收我,讓我進入彭家,一開始和老師 meeting 時老師總會仔細的替我 們上課,彌補我們一開始背景上的不足,之後便耐心的和我們討論實驗上的邏輯 及設計,並且訓練我們獨立思考的能力,而開學後見到老師為了上課用心準備講 義及讀 paper 讓我非常的感動,每每和老師對談都使我收穫良多,雖然我的能力 薄弱但是老師正面的鼓勵我幫助我建立信心,最重要的是關心我們生活中的大小 事,讓我知道老師不只是一位研究者更是一位教育家,讓我很敬重老師。 非常感謝清華大學的 張晃猷老師,撥冗參與我的口試,並在論文上給予我 很多的建議,並且直指問題的核心,讓我見識到老師的功力,也更清楚自己不足 的地方,使我的思考更深更廣,幫助我很多。 也非常謝謝 梁美智老師參與我的口試,不只幫助我在論文的研究上,平時 還常常接收到老師送的小蛋糕或小點心,老師的好手藝讓我們更有口福,而平時 遇見老師和老師的聊天及老師的打氣讓人感到親切溫暖,讓我在口試緊張時能稍 稍緩一口氣。v 當然感謝我到交大後遇見的每一個人,一開始進實驗室帶我們做實驗及分享 碩士生活的帥氣子祥、美麗燕曦及學弟兼學長的冠男,因為有你們讓我更快進入 適應碩士的步伐,你們的互動也帶來實驗室的歡樂及看見朋友間的幫助與信任, 而與我一同進入實驗室的夥伴們,珍儀、蕙瑜、及俐君,因為有你們讓我的碩士 生涯有更多的幫助及依靠更有許多的歡樂,和珍儀一起吃素食及運動讓我可以放 鬆身心,蕙瑜的問題讓我更知道還有哪些部份我需要查清楚,和俐君可以一起絞 盡腦力的分析思考調控關係,及最後接近口試時大家可以一起勉勵相互打氣,壓 力大時可以互相聊天,有你們這些夥伴真好。還要感謝實驗室中的靜柔學姊,常 常有問題第一個想到的就是學姊,用她的經驗及智慧來給我們建議及安慰我們, 真的像一位大姊姊,把我們這些學弟妹圈再一起想桶箍一樣,及有問題問學長就 對了的哲充學長,實驗上有遇到任何問題無法解決的問學長,他會從豐富的經驗 及看過超多的文獻中給我們一個錦囊方案,不吝教導我們這些學弟妹。還有實驗 室中的學弟妹,竹銘館雙女神可愛俏皮的瑋芝、人美心更美的子芸及彭家未來的 中流砥柱業務員的最愛偶爾耍點傲嬌的家睿,因為有你們讓實驗室更加歡樂,還 有新來的小碩一們,啟翔、若迪,感謝你們在重要時刻都熱心的幫我們。 還有在我剛來新竹時給我很多幫忙的超厲害柏融,及被我騙來交大陪我的銘 碩、正邦,及來交大後遇見的好朋友們子傑,小楊家的同學,趙家的同學等,族 繁不及備載,以及幫我們處理行政的佳文、淑卿等,還有上課的老師們,太感謝 有你們了。 兩年多的生涯不短,還有當過實驗助教,感謝每一位幫助我的貴人,都讓我 成長及學習很多,也讓我享受這樣的感覺,最後要感謝我的親愛家人,因為有你 們及經濟上的支持讓我可以就讀,我的成長及喜悅都來自你們的無私奉獻。 當你真心渴望某樣東西時 整個宇宙都會聯合起來幫助你完成 沒有一顆心會因為追逐夢想而受傷 -牧羊少年奇幻之旅
vi
目錄
論文摘要... i Abstract ... ii 致謝... iv 目錄... vi 表目錄... viii 圖目錄... ix 一、前言... 1 1.1. 克雷白氏肺炎桿菌... 1 1.2. 第三型纖毛... 21.3. 鐵攝取調控分子(Ferric uptake regulator,Fur) ... 3
1.4. 莢膜合成調控分子 B(regulator of capsule synthesis B,RcsB) ... 4
1.5. Fur-rmpA/rmpA2 ... 6 1.6. 二級訊號分子 cyclic di-GMP ... 6 1.7. 第三型纖毛的表現調控... 7 1.8. 研究目標... 9 二、實驗方法與材料... 10 2.1. 菌株及培養條件... 10 2.2. 生物膜染色... 10 2.3. 生物資訊的分析... 10 2.4. 西方免疫墨點法(Western blot) ... 11 2.5. β-半乳糖苷酶活性評估 ... 11 2.6. 莢膜多醣體低速離心定性分析... 12 2.7. 酵母菌凝集試驗(Yeast agglutination) ... 12 2.8. 剛果紅及鈣螢光表現分析... 12 2.9. 跳躍子突變技術... 12
vii
三、結果... 13
3.1. 在不同培養液之條件下 small RNA RyhB 對第三型纖毛 MrkA 蛋白生成 的影響 13 3.2. 啟動子活性試驗分析 RyhB 的影響 ... 14 3.3. ryhB 基因缺損對生物膜生成的影響 ... 14 3.4. 伴護蛋白 Hfq 對 MrkA 表現的影響... 14 3.5. mrkA 啟動子序列 ... 14 3.6. Fur 及 RcsB 基因缺損時對第三型纖毛 MrkA 生成的影響 ... 15 3.7. 不同氧氣含量下 Fur 及 MrkA 的表現 ... 15 3.8. 啟動子活性分析 Fur 在不同培養液下表現及 SoxRS 基因缺損影響 ... 16 3.9. Fur 啟動子序列分析 ... 16 3.10. RcsB 與 Fur 對第一型纖毛表現的影響 ... 16 3.11. Fur 及 rcsB 基因缺損對胞外纖維素生合成的影響 ... 17 3.12. RcsB 與 RmpA2 基因缺損對第三型纖毛 MrkA 表現的影響 ... 17
3.13. rcsB 基因缺損在提高 cyclic di-GMP 含量後對於 Fur 的表現影響 ... 17
3.14. 在提高 cyclic di-GMP 含量後 rcsB 及 fur 基因缺損對於 MrkA 的表現 18 3.15. mrkH 基因缺損及在提高 cyclic di-GMP 含量後對 MrkA 表現影響 ... 18
3.16. mrkH 啟動子序列分析及 mrkH、mrkI、fur、rcsB 基因缺損對於 mrkH 啟 動子活性之影響 ... 18
3.17. 跳躍子突變技術挑選增加 mrkH 啟動子活性菌株 ... 19
四、討論... 20
viii
表目錄
表 一、本研究所使用的菌株... 32 表 二、本研究所使用和建構的質體... 33
ix
圖目錄
圖 一、在不同培養液之條件下 small RNA RyhB 對第三型纖毛 MrkA 蛋白的生
成影響 ... 35
圖 二、啟動子活性試驗分析 small RNA RyhB 的影響 ... 36
圖 三、ryhB 基因缺損對生物膜生成的影響 ... 37
圖 四、伴護蛋白 Hfq 可能參與 small RNA RyhB 的調控 ... 38
圖 五、mrkA 啟動子序列 ... 39 圖 六、Fur 及 RcsB 基因缺損時對第三型纖毛 MrkA 生成的影響 ... 40 圖 七、不同氧氣含量下 Fur 及 MrkA 的表現 ... 42 圖 八、啟動子活性分析 Fur 在不同培養液下表現及 soxRS 基因缺損影響 ... 43 圖 九、fur 啟動子序列分析 ... 44 圖 十、RcsB 與 Fur 對第一型纖毛表現的影響 ... 46 圖 十一、fur 基因缺損、rcsB 基因缺損及 fur、rcsB 雙基因缺損對克雷白氏肺炎 桿菌胞外纖維素生合成影響... 47 圖 十二、RcsB 與 RmpA2 基因缺損對第三型纖毛 MrkA 表現的影響 ... 48
圖 十三、rcsB 基因缺損在提高 cyclic di-GMP 含量後及對於 Fur 的表現影響 .. 49
圖 十四、提高 cyclic di-GMP 含量後 rcsB 及 fur 基因缺損對於 MrkA 的表現 .. 50
圖 十五、mrkH 基因缺損在提高 cyclic di-GMP 含量後對 MrkA 的表現的影響 51 圖 十六、mrkH 啟動子序列分析及 mrkH、mrkI、fur、rcsB 基因缺損對於 mrkH 啟動子活性之影響... 53
圖 十七、跳躍子突變技術挑選增加 mrkH 啟動子活性菌株 ... 55
x
附圖 一、在克雷白氏肺炎桿菌中 Fur 調控第三型纖毛路徑圖 ... 57 附圖 二、mrkI 基因缺損在提高 cyclic di-GMP 含量後對 MrkA 的表現的影響.. 58
xi
縮寫表
BCIP 5-bromo-4-chloro-3-indolyl phosphate
c-di-GMP Bis-(3'-5')-cyclic dimeric guanosine monophosphate CPS capsular polysaccharide
DGC di-guanylate cyclase
ESBL extended-spectrum β-lactamase Fur ferric uptake regulator
LB Luria-Bertani
g microgram
l microliter
M micromolar ml milliliter
NBT nitroblue tetrazolium chloride
ONPG o-nitrophynyl, β-D-galactopyranoside OD optical density
PDE phosphodiesterase
Rcs regulator of capsular synthesis rpm revolution per minute
SDS-PAGE sodium dodecyl sulfate-polyacrylamidegel electrophoresis TEMED N, N, N’, N’-tetramethylthyl-enediamine
1
一、前言
1.1. 克雷白氏肺炎桿菌 克雷白氏肺炎桿菌(Klebsiella pneumoniae)是一株革蘭氏陰性菌,短桿狀, 不具移動性,其一特色具有厚重的莢膜,歸屬腸桿菌科(Enterobacteriaceae);由 於抗生素的濫用造成抗藥性的產生,最常見的抗藥菌株可以產生廣效性乙内醯胺 酶(Extended-spectrum –lactamase,ESBL)來分解乙内醯胺類抗生素[1],2008 年出現抗碳青黴烯類的克雷白氏肺炎菌株被稱為 KPC[2,3],2009 年後陸續產生 NDM-1(New-Delhi metallo beta-lactamase)類的抗藥菌株[4],近年成為院內感染的 重要伺機性病原,可以感染免疫力不好或有缺失的病人而造成嚴重的症狀,包括 肺炎、敗血症、尿道感染及嚴重的化膿性感染,因處理不當可能致死[5-9],很特 別的是在 2004 年,在台灣有被報導超過 900 病例的肝膿瘍是由於克雷白氏肺炎 桿菌感染所引起,另外在中國、韓國、日本,新加坡、香港、泰國及印度也都有 陸續相關的病例被報導,約有 40-70%的病人都有糖尿病或跟葡萄糖耐受相關的 代謝症候群疾病[10,11]。 而克雷白氏肺炎桿菌可以幫助它克服或逃脫宿主免疫系統進而感染的致病 因子包括:莢膜(capsule polysaccharises,CPS) 、脂多醣(lipopolysaccharides, LPS)、攝鐵系統(iron acquisition systems) 、黏附因子(adhesins)。莢膜可以保護 細菌使多形核白血球(polymorphonuclear granulocyte)的吞噬不易及躲過血清中 殺菌能力[12-15],克雷白氏肺炎桿菌具有 77 種莢膜血清型,其中以 K1 與 K2 對 小鼠毒性最強[16,17],也是造成肝膿瘍最常見的兩種血清型,本實驗中所使用的 菌株具 K2 血清型 CG43,乃從長庚醫院糖尿病病人分離出來[18-22],脂多醣和 莢膜的功能很相似,可以幫助細菌抵抗血清及抗菌胜肽;它更是一內毒素,可能 引起宿主敗血性休克的嚴重反應[23,24],在動物實驗上,攝鐵系統扮演致病重要 的角色[15],將攝鐵系統的一基因 sitA 剔除,可提高小鼠的存活率,因此其 sitA 剔除的菌株,可能成為減毒疫苗的候選者[25],細菌利用表面的黏附蛋白或胞外2 分泌物接合或黏附宿主細胞,進而形成生物膜。而生物膜的形成使得治療不易, 也是細菌致病的重要的因子;克雷白氏肺炎桿菌主要的黏附因子包括第一型及第 三型纖毛,其黏附能力和因導管而引起的泌尿道感染(Catheter-associated urinary tract infections,CAUTI)有關,這兩種纖毛也都認為與生物膜的形成有密切的關 係[26-28]。 1.2. 第三型纖毛 1959 年第三型纖毛在克雷白氏肺炎桿菌表面被 Duguid 所鑑定[29],長 0.5-2 μm,寬 2-4 nm 存在於菌體的表面,可以與紅血球細胞凝集的反應可以檢測其活 性將處理過鞣酸的紅血球與細菌混和後觀察此寧機反應是否不因加入甘露醣而 消失,此反應稱為甘露醣抗性(mannose-resistant)。在其他腸桿菌的第三型纖毛 也有此克雷白氏屬的凝集現象(Klebsiella-like hemagglutination),不同於第一型 纖毛的活性,可因甘露醣而不見[30]。曾有證據顯示第三型纖毛可能是細菌間經 接合作用傳遞抗藥性質體伴隨的水平基因傳遞,因此推測大腸桿菌的第三型纖毛 是由克雷白氏肺炎桿菌水平傳遞而來[31,32]。 第三型纖毛的組成是由 mrk 基因組構成,mrkABCDF 基因組在克雷白肺炎桿 菌屬或腸桿菌屬(Enterobacter)的相似度都很高;第三型纖毛組裝屬與 chaperone-usher pathway,MrkA 是主要的結構單完蛋白,MrkB 及 MrkC 分屬膜 間質中的伴護與鷹架蛋白家族(periplasmic chaperones and scaffolding proteins), MrkA 蛋白經運輸至膜間質時 MrkB 伴護蛋白結合,再傳送至 MrkC 鷹架蛋白後, 由 MrkA 蛋白 C 端的 鏈互相連結組裝成聚合螺旋茅狀的線狀結構掛到外膜上, [33,34],接著 MrkD 就座落纖毛頂端決定纖毛黏附的專一性,有文獻指出因此 mrkD 基因缺損會使原本可凝集紅血球的現象消失,而不同菌株 MrkD 序列也會 有一些變異,而此差異可決定 MrkD 的結合活性。MrkD 可決定細菌黏附尿道及 支氣管細胞基底膜(basement membrane)的能力,但其作用機制不明[35-41],至
3 於 MrkF 的功能還不是很清楚,只知道 MrkF 的突變會影響到纖毛的產生,實驗 證據顯示 MrkF 參與纖毛的組裝,他扮演的角色可能是穩定纖毛以及減少過長的 纖毛產生,在 chaperone-usher pathway 這類的纖毛組裝,需要一個或多個類似定 位的蛋白(adaptor protein)來使纖毛的組裝正確,而 MrkF 它的功能推測應該是類 似這種蛋白[42-46]。
1.3. 鐵攝取調控分子(Ferric uptake regulator,Fur)
Fur 是一種雙單元(dimeric)組成的金屬蛋白(metalloprotein),首次發現在 1978 年於大腸桿菌(E.coli)及沙門氏菌(Salmonella typhi)中[47,48],發現會抑制 與鐵調控有關係的基因,近期更發現 Fur 是一種上游調控分子(global regulator) 並廣泛存於格蘭氏陰性菌中,Fur 會與鐵離子做結合引起構型的改變進而活化 Fur,活化後的 Fur 可以跟特別的 DNA 序列結合,這一段序列稱為 Fur 結合位(Fur box),序列約 19-bp(GATAATGATAATCATTATC)為一迴文序列[49-52],經由現 代的分子生物學科技,生物晶片的分析,淋病奈特氏菌(Neisseria gonorrhoeae)、 腦膜炎雙球菌(Neisseria meningitides)、空腸曲狀桿菌(Campylobacter jejuni)、及 大腸桿菌中,在含鐵的培養條件下,都發現約有 50-100 種基因受到 Fur 的負調 控,而這些基因的功能與金屬離子的平衡、氧化壓力的反應、抗酸反應、及致病 因子的產生有關,事實上除了直接的調控外[53-56],Fur 也可以經由一個約 90 nt 的 small-RNA,2001 年 RyhB 在大腸桿菌中發現,抑制目標基因 mRNA 的轉譯, 過程中 Hfq 可以幫助 RyhB 與目標基因的鹼基配對及與 RNase E 結合,進而降解 mRNA,其調控機制為 RyhB 會以反向結合(antisense pariing)的方式與目標 mRNA 結合,其結合位多為轉譯起始區(translation initiation region ,TIR)而與 核醣體結合位結合進而抑制其目標基因的轉譯,而同樣的 Hfq 及 RNase E 都會參 與活化降解過程目標基因的表現,而在大腸桿菌中有 18 種與鐵離子相關的蛋白 都以此種形式調控,但 RyhB 的過中也有不需 Hfq 及 RNase E 參與的調控但其
4
機制還不清楚,而在大腸感桿菌中 RyhB 也會與 fur 的上游區域做結合影響其轉 譯的過程已調控表現,[57,58],而 Fur 就負調控 RyhB,在霍亂弧菌(Vibrio cholera)、沙門氏菌及鼠疫桿菌(Yersinia)等都有發現此調控機制,但 RyhB 除了 可以負向調控基因的表現也可以正向調控基因的表現在大腸桿菌中,Hfq 在多鐵 離子時會與 shiA 5’-UTR 結合變成抑制結構進而抑制表現但在缺鐵離子時 RyhB 會與shiA 結合使結構改變使其核醣體可以結合進而表現。Hfq 在沙門氏菌中也發 現與壓力的調控分子有 RpoS、RpoE 有關當大的關係,影響其毒性,在 Hfq 基因 缺損株中其毒性因子降低,降低入侵細胞的能力及在吞噬細胞中的存活能力 [59-62]。
1.4. 莢膜合成調控分子 B(regulator of capsule synthesis B,RcsB)
細菌等微生物為了能快速反應外界的各種變化及壓力,因此發展出雙分子調 控系統,它的組成可以分為兩大部分,第一為位在細胞膜上的組胺酸激酶 (Histidine kinase, HK),它可以偵測壓力或環境變化並將訊號傳遞給其對應的反 應調控分子(Response regulator, RR),而存在於細胞質中的反應調控分子接收到 來自組胺酸激酶的訊號後,便會與下游的基因做結合以調控表現[63-67]。
莢膜合成調控系統(regulator of capsule synthesis system, RCS system) 便是 其中一套雙分子調控系統,最早在大腸桿菌中發現跟莢膜生合成基因的轉錄調控 有關[68],除了大腸桿菌外,在沙門氏菌及克雷白氏肺炎桿菌中,其莢膜的生合 成都是由這一套系統所調控,此系統含有 RcsB、RcsC(regulator of capsule synthesis C, RcsC)、RcsD(regulator of capsule synthesis D, RcsD)及 RcsF(regulator of capsule synthesis F, RcsF) ,再經由刺激後產生磷酸根傳遞
(phosphotransferring),依不同菌種有不一樣的傳遞路徑[69-71],最後將磷酸根傳 遞給 RcsB,刺激活化 RcsB,而 RcsB 可以單獨形成複合體或與其他轉錄調控因 子結合進而調控下游基因的表現,目前的研究發現除了可以調控莢膜的生合成
5
外,還與鞭毛生合成(Flagellum synthesis)、細菌細胞分裂(Cell division)、細 菌的移動性(Motility)及許多致病因子有關,RcsB 這一個轉錄因子在不同的菌 種間包括:大腸桿菌、沙門氏菌及克雷白氏肺炎桿菌其序列的保留度也很高 [69,72-80]。 本實驗室先前研究中 RcsB 處於不同條件下,其調控路徑也不太相同,發現 於一般 LB 培養液 37℃搖晃培養時,其在克雷白氏肺炎桿菌 CG43 調控路徑,由 RcsC、RcsF 偵測來自細胞內部或外部的刺激,使得 RcsC 自我磷酸化,並將磷 酸根傳遞予 RcsD,接著 RcsD再將訊號傳遞給下游的反應調控因子 RcsB,而 RcsB 將形成同源複合體或與其他調控分子結合進而影響第三型纖毛及莢膜生合 成的表現。若在微氧或弱酸的環境中,則 RcsB 不用透過 RcsC、RcsD或 RcsF 也可以獲得磷酸化,調控到先前實驗室研究發現的抗酸反應中重要蛋白 Yfdx。 但若在充氧的條件下,則會經由 RcsD將磷酸根傳遞給 RcsB 進而調控 Yfdx 表 現,而當碰到多粘菌素 B (polymyxin B)時,訊號則會透過 RcsF 沒有經過 RcsC 傳給 RcsD最後給 RcsB,影響到莢膜的生合成。RcsC 可能扮演去磷酸化的角色, 此外,RcsB 的磷酸化與否更會決定其調控路徑。 先前研究 RcsC,RcsD將磷酸化 RcsB 第 56 個氨基酸天冬氨酸鹽(Aspartate) 並促進其活化,本實驗室也探討 RcsB 磷酸化對於基因調控的關係,利用建構兩 個定點突變的 RcsB,分別為 RcsB-D56A 和 RcsB-D56E。RcsB-D56A 模擬無法 接受磷酸根的 RcsB;而 RcsB-D56E 則是模擬持續磷酸化狀態的 RcsB,發現無 法磷酸化的 RcsB 則會增加莢膜與細菌抗酸的能力,而持續磷酸化狀態的 RcsB 則可以增加第三型纖毛主要的蛋白 MrkA 的表現。 在不同的條件下會有不同的傳遞路徑將 RcsB 磷酸化或去磷酸化,而 RcsB 的磷酸化與否則會影響它和其他蛋白或 DNA 的結合及影響其下游調控。
6 1.5. Fur-rmpA/rmpA2
2007 於克雷白氏肺炎桿菌 52145 毒性質體約 180 kb 中發現 rmpA (regulator of mucoid phenotype A) 基因,其序列分析,轉譯的蛋白 RmpA 在大腸桿菌 HB101 可以促進胞外多醣體(colonic acid)的生合成[19,81],而高莢膜表現臨床分離菌株 K2 血清型克雷白肺炎桿菌 CG43 中,莢膜多醣表現與一個大型毒性質體PLVPK
(large virulence plasmid in klebsiella)有共同調控的關係,當剔除此質體則在小鼠 的動物實驗上會減低約 1000 倍的毒性[10],而實驗室中也發現此質體PLVPK 帶 有 rmpA 及 rmpA2 並且與莢膜多醣體的生合成有關[18],而 rmpA 與 rmpA2 其相 似性約 71.4 %且在 C 端都具有高保留的 DNA binding motif,除了 rmpA2 在 N 端 多了 15 個胺基酸,並且發現 rmpA 基因缺損時,其莢膜的生合成會受到影響降 低其動物實驗中毒性也降低,並藉由細菌雙雜和實驗及免疫共沉澱分析,顯示 rmpA 與 RcsB 會有交互作用的可能,此外利用 LacZ 報導系統及 DNA 遲滯實驗 及 fur 基因缺損表現型的分析,發現 rmpA 會受到 Fur 的抑制。
1.6. 二級訊號分子 cyclic di-GMP
細菌為了適應多樣的環境變化,因此須透過不同的訊息傳遞系統,進而改變 行為或生理以生存,cyclic di-GMP 為細菌體內的二級訊號分子,在調控過程中 扮演一個重要的角色,它會控制細菌各種狀態,包括細菌的移動性(motility)、 生物膜的形成(biofilm formation)、細胞週期(cell life cycle)、細菌間的溝通 (cell-cell signaling)、纖毛的表現及細菌的致病因子等。[82-86]
研究中也發現 cyclic di-GMP 的濃度高低,會影響某些基因的表現。經由 cyclic di-GMP 與受體(receptors)接合包括轉錄因子、RNA(riboswitch)、PilZ domain、GGDEF、EAL domain,進而改變轉錄的活性(transcription activity),造 成表現型(Phenotype)的改變,而 cyclic di-GMP 含量多寡是藉由 GGDEF、EAL 及 HD-GYP domain 來決定[87]。
7
GGDEF domain 大約是由 170 個胺基酸所構成,在一個蛋白質上具有高度保 留的 GGDEF motif,這是它具有活性的位置也是它名稱的由來[88],若將其中的 氨基酸改變則會使活性降低甚至不見,GGDEF domain 具有雙鳥甘酸環化酶 (diguanylate cyclase, DGC)的活性可以將兩個 GTP 環化形成 cyclic di-GMP,使 cyclic di-GMP 濃度提高。
EAL domain 具有磷酸二酯酶(phosphodiesterase, PDE)的活性可以水解 cyclic di-GMP 使其濃度降低。[89-91]
有些蛋白則同時具有 GGDEF 及 EAL domain,暗示其中一個不具活性或是 其中一個活性可能較低,並在不同時機作調控,或是蛋白上可能有另一個 domain,具有調控的作用或可以當作一個受體跟其他訊號做連結。
cyclic di-GMP 的調控受體,可以跟有 GGDEF 及 EAL domain 的轉錄因子結 合並調控下游基因,還有較多研究的 PilZ domain,在綠膿桿菌(Pseudomonas aeruginosa) PilZ 與 cyclic di-GMP 結合後,會降低抽動運動性(twitching
motility),所以 cyclic di-GMP 扮演著一個中間重要的調控角色,當細菌遇到各種 變化時會刺激 GGDEF、EAL domain 使 cyclic di-GMP 濃度受到影響,而 cyclic di-GMP 在與其他各種轉錄因子結合進而影響基因表現,使細菌在行為或生理因 應改變[92-96]。
1.7. 第三型纖毛的表現調控
第三型纖毛除了組成結構的部分外,還有參與其表現調控的基因包含 mrkH,mrkI 及 mrkJ,mrkJ 含 EAL domain 有磷酸二酯酶的活性,mrkH 是一個 PilZ domain 的蛋白質[97],mrkI 則是具有 LuxR-like DNA binding domain 的轉錄 因子,mrkH,mrkI 共用同一個啟動子一同被轉錄出來,文獻中報導大量表現 mrkJ 時將會顯著降低細菌體內的 cyclic di-GMP 濃度,使得克雷白氏肺炎桿菌第三型 纖毛減少,當 mrkJ 剔除時則可以增加 cyclic di-GMP 濃度並使得第三型纖毛增加
8
[93,98-100],另一篇報導中也發現克雷白氏肺炎桿菌中的一基因 YfiN 具有 GGDEF domain 可以增加 cyclic di-GMP 濃度,而 cyclic di-GMP 會與 MrkH 中的 PilZ domain 結合,並且會結合到 mrkA 的啟動子位置並活化表現,使第三型纖毛 增加,其生物膜的合成也增加[101],利用電泳遷移率實驗(Electrophoretic Mobility Shift Assay, EMSA)和啟動子活性分析(promoter activity assay)也推測出啟動子 的結合序列為 CATCTATCAATG[102],研究中也發現當 mrkI 剔除時,其第三型 纖毛也不會表現,但其機制並不清楚,也有文獻指出在克雷白氏肺炎桿菌中 oxyR 基因的剔除也會降低第一型及第三型的表現[103],而本實驗室先前的研究中也 指出 Fur 也會調控到第三型纖毛,利用電泳遷移率實驗和啟動子活性分析,Fur 扮演正向的調控角色去和 mrkH 啟動子結合,而在 mrkA 的啟動子區域也推測應 有一個未知抑制者(repressor)抑制 mrkA 的表現[104]。
9 1.8. 研究目標 本實驗擬證實 Fur 是經由哪一未知抑制者以調控 mrkA 的表現。而在第三型 纖毛 mrkA 及 mrkH 啟動子都有發現 RcsB 的結合位,根據本實驗室先前的研究 發現 RcsB 剔除時除了莢膜的生合成下降外,也發現第三型纖毛的 MrkA 蛋白下 降,所以想得知 Fur 及 RcsB 是否有上下游的調控關係;進一步探討如何一起調 控第三型纖毛的表現。 同時,想確認 cyclic di-GMP 是否會影響或經由這些轉錄因子進而調控第三 型纖毛的表現,再者實驗室先前利用 transcriptome 分析當處於高 cyclic di-GMP 時 RNA 的表現,發現與第三型纖毛表現相關的基因表現量都明顯增加,所以想 知道 mrkH,mrkI 及 cyclic di-GMP 的關係,由於平時 mrkH 啟動子活性不高,推 論是否有抑制者抑制,因此將利用跳躍子突變(transposon mutagenesis)的方法, 試著挑出此抑制者。最後,將利用西方墨點法、啟動子活性及生物膜測定來推演 出其調控關係。
10
二、實驗方法與材料
2.1. 菌株及培養條件 本研究的克雷白氏肺炎桿菌 CG43 為長庚紀念醫院林口分院的臨床分離 株,而 CG43S3 是由實驗室篩選獲得具有鏈黴素(streptomycin)抗性的突變株; 另外,CG43S3ΔryhB、CG43S3ΔfurΔryhB 由中國醫藥大學林靖婷教授實驗室提 供。本實驗上所使用的菌株及質體詳列於表一及表二。所有菌株於已加入適量抗 生素的 Luria-Bertani (LB)培養液或培養基,經震盪培養於 37°C; 使用的抗 生素及濃度分別為:鏈黴素 、氨比西林(ampicillin) 、卡 那黴素(kanamycin) 、四環黴素(tetracycline) 及氯黴素 (chloramphenicol) 。 2.2. 生物膜染色 細菌在 LB 培養液中培養隔夜後,以 100 倍稀釋至 4 ml LB 培養液中,再 吸取 150 l 菌液到 96 孔盤,於 37°C 靜置培養 24 小時,小心去除菌液後以一 次水清洗兩次,再加入 180 l 1%結晶紫,以每分鐘 60 轉(revolution per minute, rpm)震盪處理五十分鐘後,再以一次水清洗 3 次,最後用 150 l 1% SDS 復溶並以 OD595。ELISA reader 測量。 2.3. 生物資訊的分析 相關基因的比較分析是利用 NCBI 網站;啟動子的預測以Softberry(http://linux1.softberry.com/all.htm)或 Bioinformatics @ MolGen ppp (http://bioinformatics.biol.rug.nl)分析;預測 RNA 雜交區域構型序列經由 RNAhybrid(http://bibiserv2.cebitec.uni-bielefeld.de)軟體分析。
11 2.4. 西方免疫墨點法(Western blot)
將蛋白質以等比例混合蛋白質染劑(0.0626 M Tris-HCl pH 6.8、2% SDS、10% glycerol、0.01% bromophenol blue 以及 100 mM dithiothreitol),並以 95℃加熱 10 分鐘,取適量蛋白質(約 )加入 13.5% SDS-PAGE 電泳分離蛋白(100V、 200 mA、140 分鐘)。蛋白質經過膠電泳分離後,將膠上之蛋白質電泳 100 分鐘 (140V、400 mA、100 分鐘)轉漬於聚篇二氟乙烯模(polyvinylidene difluoride, PVDF; Millipore, Billerica, MA, USA)上,再以 5%的脫脂奶粉 4℃處理隔夜,接 著加一級抗體 anti- 在室溫下 2 小時,再以 5000 被稀釋之二級抗體: 鹼性磷酸酶偶聯的抗兔免疫球蛋白 G(alkaline phosphatase-conjugated anti-rabbit immunoglobulin G)在室溫下處理 1 小時,隨後加入呈色劑 BCIP
(5-bromo-4-chloro-3-indolyl phosphate)、NBT 及鹼性磷酸酶緩衝液(alkaline phosphatase buffer)避光呈色。
2.5. β-半乳糖苷酶活性評估
大致根據 Miller 方法(56),將隔夜培養之菌液以 100 倍稀釋於 LB 培養 液中,待菌液 OD600 約 0.6~0.8 左右,未加或加入稀釋後濃度為 的 PQ
培養 40 分鐘,取 的待測菌液加入含有 (60 mM
Na2HPO4、40 mM NaH2PO4、10 mM KCl、1 mM MgSO4 及 50 mM
β-mercaptoethanol)、 及 三氯甲烷(chloroform)混合液 中,並於 30°C 水浴槽靜置 10 分鐘, 隨即加入 的 4 mg/ml o-nitrophynyl, β-D-galactopyranoside(ONPG)混合均勻靜置於 30°C 水浴槽,並開始計時至混 合液變成黃色,再加入 終止反應後測量波長 420 nm 下的 吸光值;每次獨立實驗以三重覆數據換算出平均值及標準差,呈現的數據為三次 獨立實驗中較具代表性的一次。
12 2.6. 莢膜多醣體低速離心定性分析 菌株在 LB 培養 16 小時,在以 5000 rpm,4 分鐘低速離心,並拍照儲存。 2.7. 酵母菌凝集試驗(Yeast agglutination) 細菌在 LB 37℃培養 16 小時,將 1ml 的菌液以 15000rmp、2 分鐘離心 並除去上清液,分別以 saline(0.85%NaCl)或 5%D-mannose 回溶,再將此對照 組與實驗組混著 1%酵母菌於 24 孔盤,並在室溫下於 100 rmp 的震動儀上, 並觀察其結果。 2.8. 剛果紅及鈣螢光表現分析
剛果紅培養基 20 g/Ml brilliant blue、40 g/Ml congo red 不含鹽 LB 配成培養基,4mg/L glucose、1mM HEPES、20 g/L calcofluor LB 配成培 養基,將培養 16 小時的菌液滴或塗在盤上,37℃培養 16 小時候觀察,鈣螢 光需用黑燈管照射才可觀察。
2.9. 跳躍子突變技術
將隔夜培養的大腸桿菌 S17-1 λpir(pUT mini-Tn5 luxCDABE km2)及克 雷白氏肺炎桿菌 CG43(pLacz-mrkH C),分別以 LB 培養液一比一混和培養 30 分鐘,離心去除上清液,以生理食鹽水清洗將,質體提供者與接受者 1:2 混和並將菌液滴在 LB 培養基上的硝化纖維膜(nitrocellose)靜置 12 小時,將 硝化纖維膜取出到 LB 中懸浮,並塗到含有氯黴素(Chloramphenicol)與卡納 黴素(kanamycin)的馬康基氏瓊脂(macconkey agar)盤上挑選菌落。
13
三、結果
3.1. 在不同培養液之條件下 small RNA RyhB 對第三型纖毛 MrkA 蛋白生成的影 響
本實驗室研究發現 Fur 會活化 mrkH 的啟動子提高 MrkH 表現,MrkH 和 c-di-GMP 結合後再活化 MrkA 的表現。當 fur 基因缺損時,MrkA 幾乎不表現,然而,在 MrkA 啟動子區域發現的 Fur 結合序列位在 MrkA 的轉錄起始點上,因此推論 Fur 經由抑制一個未知的因子進而抑制 MrkA 的表現,當 fur 基因缺損株培養在 LB 中,使此未知因子表現而抑制 MrkA 的表現 (附圖一)。
大腸桿菌 Fur 負向調控小 RNA RyhB,轉而控制許多基因的表現,為了確認 RyhB 是否為此未知抑制因子,首先,建構 fur 、ryhB 雙基因缺損株突變株,再 以西方墨點分析突變株 fur, ryhB, fur ryhB 於 LB 培養下第三型纖毛 單位蛋白 MrkA 的表現,如圖一(A),當 fur 基因缺損時 MrkA 不表現, ryhB 基 因缺損株的 MrkA 表現則和正常株一樣,而 fur、ryhB 雙基因缺損菌株也不見 MrkA 表現;圖一(B)顯示,於 LB 培養液中加入可螯合三價鐵離子的
Deferoxamine 後,fur、ryhB 雙基因缺損菌株的 MrkA 則會表現;此外,加入另 一可與二價鐵離子結合的鐵螯劑 2,. 2-dipyridyl (Dip),發現各菌株在加入 Dip 後 其生長速度會變慢,且 MrkA 表現明顯變差(圖一 C);而以含低濃度鐵離子的 M9 培養,結果發現 fur、ryhB 雙基因缺損菌株會表現 MrkA (圖一 D);最後也以 低鐵高葡萄糖的 DMEM 來模擬生物體內環境,圖一(E)也顯示,相較於 fur,
fur ryhB 菌株的 MrkA 明顯提高,這些結果暗示在低鐵環境下 ryhB 扮演負
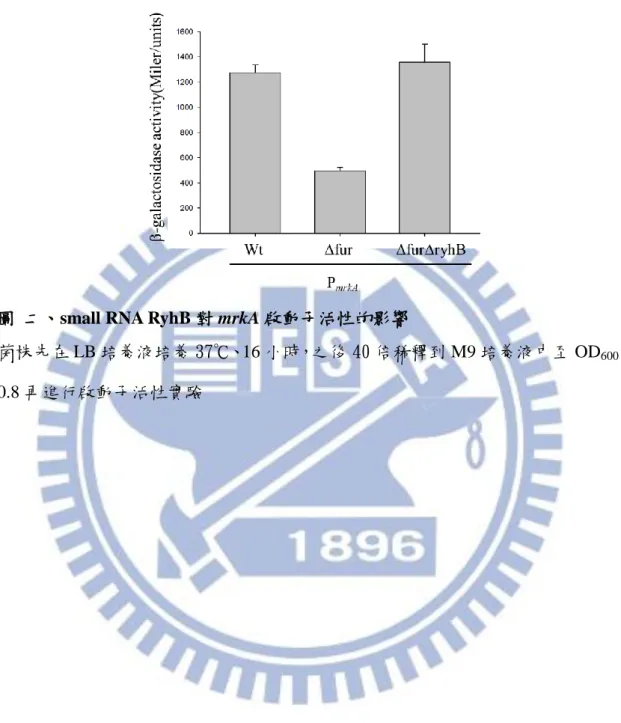
14 3.2. 啟動子活性試驗分析 RyhB 的影響
利用LacZ 報導系統
,在不具啟動子的 lacZ 基因前殖入帶有 mrkA 啟動子,
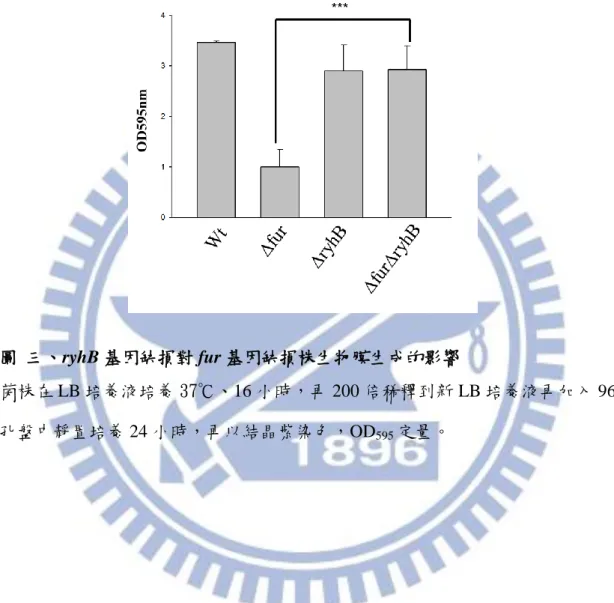
利用量測LacZ -galactosidase 活性來反應 mrkA 啟動子的活性。由圖二所示, 在 M9 培養下,fur 基因缺損會降低 mrkA 啟動子活性,而在 fur、ryhB 雙基因缺 損株中,其 mrkA 啟動子活性上升,結果顯示 Fur 可能經由抑制 ryhB 進而活化 MrkA 表現。 3.3. ryhB 基因缺損對生物膜生成的影響 在克雷白氏肺炎桿菌中第三型纖毛是決定其生物膜形成的重要因子,圖三顯 示 ryhB 基因缺損株和親本株的生物膜形成能力類似,而 fur 基因缺損株的生物 膜的生成明顯降低,當 fur、ryhB 雙基因缺損時,回復親本株一樣的生物膜形成 能力,此結果也顯示 RyhB 只有在 fur 基因缺損時可以抑制其生物膜的形成。 3.4. 伴護蛋白 Hfq 對 MrkA 表現的影響 由 Hfq 伴護蛋白可以幫助 RyhB 與目標基因的鹼基配對,藉 M9 低鐵培養比 較 hfq 基因缺損株和 fur、ryhB 雙基因缺損株的 MrkA 表現,圖四顯示 hfq 基因 缺損和 fur、ryhB 雙基因缺損對 MrkA 表現的影響類似。 3.5. mrkA 啟動子序列 分析 mrkA 上游非轉譯區可能的啟動子區發現 MrkH 及 RcsB 的結合位(圖五 A),經 RNAhybrid (http://bibiserv.techfak.uni-bielefeld.de/rnahybrid/submission.html) 預測 small RNA RyhB 對於 mrkA 的結合構型如圖五 B。
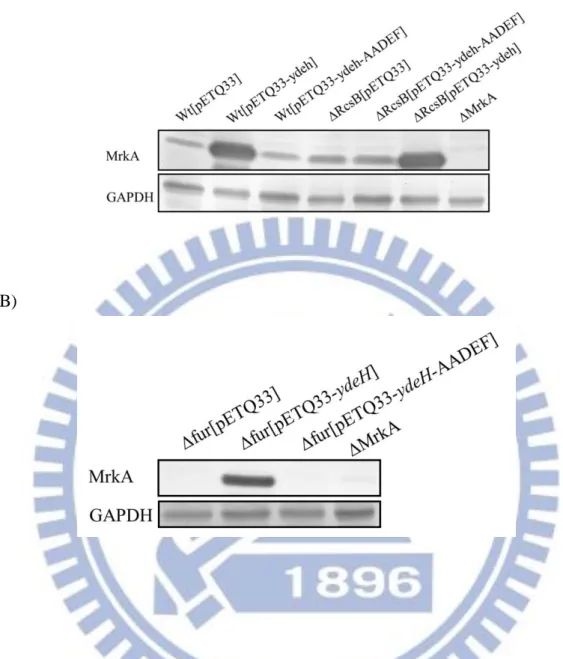
15 3.6. Fur 及 RcsB 基因缺損時對第三型纖毛 MrkA 生成的影響 相較於 CG43S3,rcsB 基因缺損菌株的 MrkA 表現量些微降低,加上在 mrkA 啟動子上的 RcsB 結合序列,暗示 RcsB 可以正向影響第三型纖毛的表現。為了 探討 Fur 及 RcsB 是否有交互作用進而影響 MrkA 表現的可能性,圖六顯示以西 方墨點法分析各菌株在搖晃(A)及靜置培養(B)條件下的 MrkA 表現,結果發現在 靜置培養下,MrkA 表現量不受 fur 基因缺損影響,然而,在 fur、rcsB 雙基因缺 損下,MrkA 表現明顯受到抑制 (圖六 B)。
3.7. 不同氧氣含量下 Fur 及 MrkA 的表現
圖六顯示 Fur 對 MrkA 表現的影響只有在搖晃培養時可見,因此推論 Fur 對 MrkA 表現的調控與氧氣含量有關,如圖七(A)所示,利用西方墨點法檢視 fur 基 因缺損株在搖晃、直立震盪及在培養液上方加礦物油等條件下的 MrkA 表現,結 果發現 fur 基因缺損株在搖晃培養下 MrkA 不表現,隨著含氧量的降低 MrkA 表 現逐漸增加,此顯示 fur 基因缺損對 MrkA 的影響隨著含氧量降低而漸小;為了 確認是否與 Fur 表現量有關,再以西方墨點法偵測 Fur 的表現,如圖七(B)在 LB 搖晃培養下 Fur 表現較靜置好外,而在 M9 搖晃培養下 Fur 表現量最低;由於大 腸桿菌 SoxRS 可活化促進 Fur 表現[105],圖七 B 也分析 SoxRS 基因缺損對 Fur 表現的影響,於 LB,SoxRS 缺損降低 Fur 表現,而在 M9 中 SoxRS 缺損反而增 加 Fur 表現;也有報導在缺鐵時 RyhB 會結合 Fur 的 mRNA 之非轉錄區而降解 Fur,圖七(C)分析在 M9 低鐵培養下 ryhB 基因缺損對 Fur 表現的影響,結果發現 RyhB 基因缺損些微增加 Fur 表現量。
16
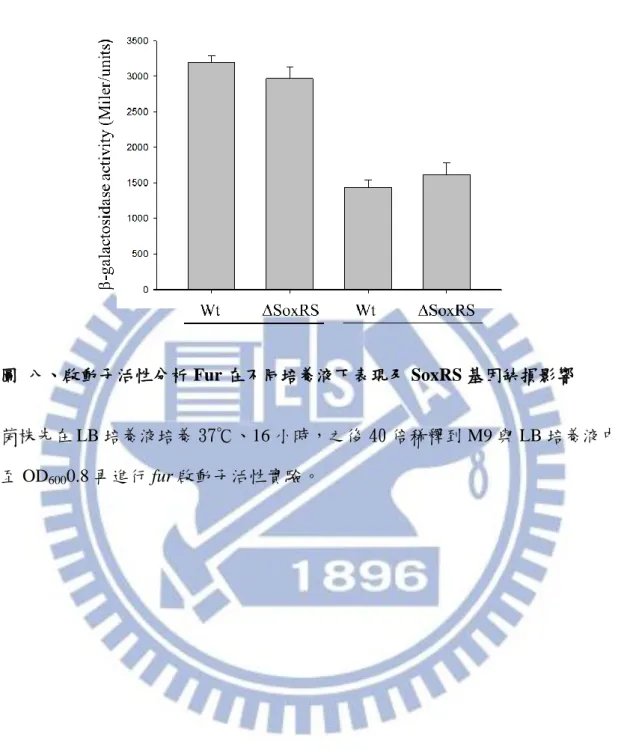
3.8. 啟動子活性分析 Fur 在不同培養液下表現及 SoxRS 基因缺損影響
進一步利用啟動子活性分析 SoxRS 基因缺損對 Fur 的影響,如圖八,在 LB 的培養的 Fur 表現量比在 M9 培養要高,而 soxRS 基因缺損對 Fur 啟動子活性影 響不大。
3.9. Fur 啟動子序列分析
圖九(A)以 Softberry 線上軟體分析 Fur 基因上游非轉譯區序列發現 SoxRS 及 Fur 的結合位,這兩個結合位互相重疊,另外,也發現 OxyR 的結合位,以 RNAhybrid 預測 RyhB 與fur 的結合構型如圖九(B)。
3.10. RcsB 與 Fur 對第一型纖毛表現的影響 在克雷白氏肺炎桿菌中第三型纖毛的表現和第一型纖毛的表現息息相關,所 以進一步以酵母菌凝集試驗來檢測 RcsB 與 Fur 是否也影響第一型纖毛的表現, 如圖十(A),fur 基因缺損對細菌凝集酵母菌的活性沒影明顯影響,然而,rcsB 基 因缺損明顯增加其凝集酵母菌的能力,而此活性會因加入甘露糖而消失,當 fur、 rcsB 雙基因缺損時會降低凝集酵母菌的能力;圖十(B)以西方墨點法證明第一型 纖毛蛋白 FimA 的表現會因 rcsB 基因缺損而表現量明顯增加,此結果暗示 RcsB 可抑制 FimA 的表現,相對的,Fur 可能活化第一型纖毛 FimA 的表現。fur 基因 缺損時生物膜生成降低,而 rcsB 基因缺損反而提高其生物膜形成能力,而當 fur、 rcsB 雙基因缺損時生物膜降低 (圖十 C)。
17
3.11. Fur 及 rcsB 基因缺損對胞外纖維素生合成的影響
細菌生物膜的形成除了纖毛扮演重要角色外,其他胞外黏附因子或多醣分泌 物如纖維素也很重要。可以染纖維素及胞外多醣類的染劑剛果紅及 Calcofluor 觀 察纖維素的生合成,圖十一(A)及(B)顯示除了 CpxRA 基因缺損株外,fur 或 rcsB 基因缺損株,或 fur、rcsB 雙基因缺損株都沒有生成纖維素。
3.12. RcsB 與 RmpA2 基因缺損對第三型纖毛 MrkA 表現的影響
克雷白氏肺炎桿菌 Fur 會經由抑制 ryhB,再經 RyhB 活化莢膜的生合成,此 外,Fur 會抑制 rmpA 及 rmpA2 表現,而 RmpA、RmpA2 會結合 RcsB 一起活化 其莢膜生合成表現,為了探討 RcsB 如何影響第三型纖毛的表現,圖十二 A 以低 速離心觀察 Fur 及 RcsB 基因缺損對莢膜生合成的影響,結果搖晃或靜置培養, 各菌株莢膜的生成都沒有明顯差異;圖十二(B)顯示搖晃培養下,fur 基因缺損抑 制其 MrkA 表現,而靜置培養下 fur、rmpA2 雙基因缺損菌株的 MrkA 表現和搖 晃培養一樣,此暗示 RmpA2 可能參與 RcsB 對第三型纖毛的調控。
3.13. rcsB 基因缺損在提高 cyclic di-GMP 含量後對於 Fur 的表現影響
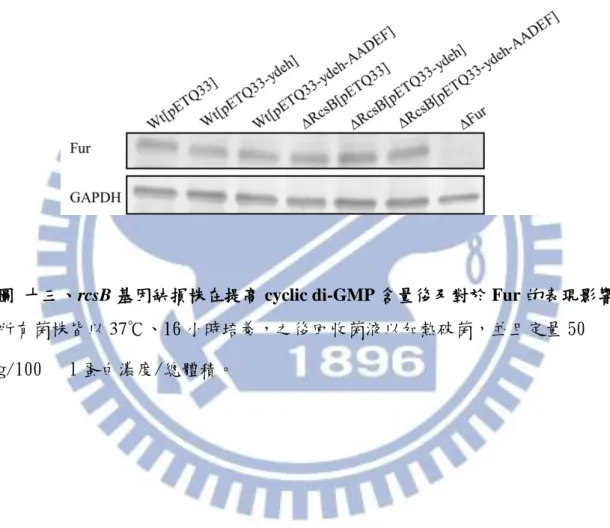
圖十三顯示在提高 c-di-GMP 後,Fur 的表現沒有明顯變化,將 GGDEF domain 突變成 AADEF domain 使其喪失合成 c-di-GMP 的能力,或在 rcsB 基因缺損情形 下,Fur 的表現也沒有明顯改變。
18
3.14. 在提高 cyclic di-GMP 含量後 rcsB 及 fur 基因缺損對於 MrkA 的表現
圖十四(A)顯示提高 c-di-GMP 後明顯增加 MrkA 的表現,而此表現不受 rcsB 基因缺損的影響,顯示 c-di-GMP 影響 MrkA 的表現與經由 RcsB 調控 MrkA 的表現可能是獨立而不相關;圖十四(B)也顯示 fur 基因缺損不影響因 c-di-GMP 增加而提高的 MrkA 表現,此顯示 c-di-GMP 影響 MrkA 的表現與 Fur 調控 MrkA 表現的途徑是獨立的。
3.15. mrkH 基因缺損及在提高 cyclic di-GMP 含量後對 MrkA 表現影響
圖十五顯示 mrkH 基因缺損後 MrkA 表現明顯降低,而提高 c-di-GMP 含 量也無法回補 mrkH 基因缺損對 MrkA 表現的影響,顯示 c-di-GMP 很可能經 由 MrkH 而影響 MrkA 表現,此結果與附圖二中 MrkI 對 MrkA 表現的影響類 似,相反的,rcsB 和 fur 雙基因缺損並不影響 c-di-GMP 所調控的 MrkA 表現。
3.16. mrkH 啟動子序列分析及 mrkH、mrkI、fur、rcsB 基因缺損對於 mrkH 啟動子活性之影響 分析 mrkH 啟動子序列,結果如圖十六(A)所示,mrkH 啟動子序列具有 Fur 及 RcsB 的結合位,圖十六(B)顯示在 LB 搖晃培養下,mrkI、fur 或 rcsB 基因缺 損都會明顯降低 mrkH 啟動子活性,此結果顯示這些調控因子都正向調控 mrkH, 而 mrkH 基因缺損則些微降低其表現;有趣的是,在靜置培養下的 mrkH 啟動子 活性稍微高於搖晃培養(圖十六 C)。
19 3.17. 跳躍子突變技術挑選增加 mrkH 啟動子活性菌株 在圖十六(B)中可以發現 mrkH 啟動子活性並不高,推測可能有其他轉錄因 子抑制其活性,因此企圖利用跳躍子突變技術(圖十七 A)篩選出此抑制因子,首 在 LacZ 基因缺損株放入帶有 mrkH 啟動子的質體,再利用接合作用轉入 Tn5 跳 躍子,藉量測 LacZ 活性來篩選增加 mrkH 啟動子活性的突變株。經篩選約 10000 顆突變株,挑出 LacZ 活性較高的菌落 10 顆,重新培養滴在馬康基氏瓊脂上與 帶有 mrkH 啟動子質體的菌比較,卻沒有發現明顯變紅的菌落(圖十七 B),而利 用 X-gal 篩選也無明顯深藍的菌落(圖十七 C)。
20
四、討論
鐵離子是生物體內重要的一個金屬離子,對而言,鐵離子也扮演許多酵素或 蛋白質的重要輔助因子,多以二價鐵離子來控制許多重要生理反應。環境中鐵離 子多以三價型態存在,細菌以運鐵系統將三價鐵離子運進細胞內再以氧化還原方 應轉成二價鐵離子,同時釋放氧化自由基。所以,在細胞內堆積過多的鐵離子反 而造成氧化壓力,細菌以 Fur 轉錄因子來壓制運鐵系統而達到調節細胞內鐵離子 平衡的目的;不同菌種或不同環境表現的 Fur 可以不同型式來調控下游基因,已 知有四大類調控型式:一、Fur 與二價鐵離子結合使構型改變形成二聚體,進而 抑制下游基因的表現,當鐵離子濃度降低時,沒有鐵離子結合的 Fur 離開其標的 基因的啟動子而使基因表現;二、Fur 與二價鐵離子結合後形成二聚體,進而活 化下游基因的表現;三、Fur 不需鐵離子結合就可形成二聚體,apo-Fur 即可抑 制下游基因的表現;四、apo-Fur 活化下游的基因表現。在大腸桿菌中,有關第 一種方式的調控型式被研究最多;幽門螺旋桿菌的 Fur 則可以四種方式來分別調 控不同的下游基因表現[106];克雷白氏肺炎桿菌與大腸桿菌親緣關係相近,但 是,Fur 以何種方式調控基因的研究不多。圖一實驗顯示在低鐵環境,Fur 可經由 RyhB 調控第三型纖毛 MrkA 蛋白表 現;在低鐵環境下,fur 基因缺損仍影響 MrkA 蛋白表現,圖二的啟動子活性實 驗也可見 Fur 在低鐵時仍有抑制作用,此暗示 apo-Fur 型態在此時仍具調控功 能;Fur 會受到其他二價金屬離子如錳或鋅的影響,因此而保有調控功能。此外, 在低鐵時,RyhB 可能無法完全抑制 Fur 的 mRNA 活性[107],所以還有一部分的 Fur 可執行功能,因此,Fur 以何種調控方式影響第三型纖毛表現仍需更多的研 究探討。
除了低鐵環境,Fur 的表現可能受培養方式的影響,圖六 B 及圖十 A 顯示, 靜置培養下 fur 基因缺損 MrkA 蛋白的影響變小,此暗示靜置培養下的 Fur 不具
21
調控第三型纖毛的功能;然而,靜置培養下,fur、rcsB 雙基因缺損對於 MrkA 蛋白的生成卻有明顯的影響,因此,RcsB 很可能在靜置培養低氧氣含量的環境 下抑制 Fur 調控 MrkA 表現的功能;在克雷白氏肺炎桿菌中,Fur 及 RcsB 對於 其莢膜生成都有調控功能,而由圖八可見 Fur 及 RcsB 對於第一型纖毛活性也有 影響,而 fur、rcsB 雙基因缺損的實驗結果再次顯示 RcsB 負向影響 Fur 調控活性 的可能性。RcsB 會影響小 RNA RprA 表現[108],RcsB 可能透過調控小 RNA 的 表現轉而影響 Fur 活性;另外,Fur 及 RcsB 都可經由分子修飾改變其功能狀態, 如 apo-Fur、磷酸化或非磷酸的 RcsB,都可以影響其調控活性,因此,進一步探 討其調控機制前,必須先釐清它們在不同刺激或環境下以何種狀態運作。而在靜 置培養條件下,MrkA 蛋白表現量增加,Fur 的表現卻沒有明顯變化,這也暗示 Fur 的狀態決定其功能,由啟動子活性分析發現 SoxRS 可影響 Fur 的表現,另外, 克雷白氏肺炎桿菌的第一型、第三型纖毛會受 OxyR 氧化壓力轉錄因子的影響, 因此,氧化壓力可能是決定 Fur 調控功能的外在因子。
已知,c-di-GMP 會與 MrkH 結合後活化 MrkA 表現,由附圖二可知 MrkI 也 是 c-di-GMP 影響 MrkA 表現的重要因子,圖十六可見 mrkI 基因缺損影響 MrkH 啟動子活性,而 mrkH 的基因缺損的影響,我們推論 MrkI 自我調控 mrkHI 表現, MrkH 生成後與 c-di-GMP 結合後,進而活化 MrkA 啟動子活性;但是,MrkI 自 我調控 mrkHI 表現時是否需要 MrkH 及 c-di-GMP 的協同作用,仍需更多研究來 佐證。由於 MrkH 的啟動子活性很低,在靜置培養的活性比搖晃培養高,此暗示 低含氧量可活化 MrkH 啟動子,而在跳躍子突變實驗中,沒有找到可能參與調控 mrkHI 表現的因子,可能是因在含氧量高的狀態,MrkH 啟動子活性太低,無法 因跳躍子突變而篩選出差異明顯的突變株。 最後以圖十八調控路徑為本論文作一結論:在低鐵環境中,Fur 對 RyhB 的 抑制作用降低,RyhB 進而抑制第三型纖毛 MrkA 蛋白的產生,扮護蛋白 Hfq 是 否參與穩定 RyhB 與 MrkA 的鹼基配對,仍待證明;RyhB 在低鐵環境,可能回
22
過頭抑制 Fur 的表現,SoxRS 也可能在低鐵環境扮演抑制 Fur 的角色;在低含氧 量下,RcsB 可能與 RmpA2 結合活化 MrkA 表現,c-di-GMP 是否直接參與活化 mrkH 啟動子,MrkH 及 MrkI 的角色仍待釐清。
23
五、參考文獻
1. Colodner R, Raz R, Chazan B, Sakran W (2004) Susceptibility pattern of
extended-spectrum beta-lactamase producing bacteria isolated from inpatients to five antimicrobial drugs in a community hospital in Northern Israel. Int J Antimicrob Agents 24: 409-410.
2. Hirsch EB, Tam VH (2010) Detection and treatment options for Klebsiella pneumoniae carbapenemases (KPCs): an emerging cause of
multidrug-resistant infection. J Antimicrob Chemother 65: 1119-1125. 3. Nordmann P, Cuzon G, Naas T (2009) The real threat of Klebsiella pneumoniae
carbapenemase-producing bacteria. Lancet Infect Dis 9: 228-236. 4. Kumarasamy KK, Toleman MA, Walsh TR, Bagaria J, Butt F, et al. (2010)
Emergence of a new antibiotic resistance mechanism in India, Pakistan, and the UK: a molecular, biological, and epidemiological study. Lancet Infect Dis 10: 597-602.
5. Chen KY, Hsueh PR, Liaw YS, Yang PC, Luh KT (2000) A 10-year experience with bacteriology of acute thoracic empyema: emphasis on Klebsiella pneumoniae in patients with diabetes mellitus. Chest 117: 1685-1689.
6. Chuang YP, Fang CT, Lai SY, Chang SC, Wang JT (2006) Genetic determinants of capsular serotype K1 of Klebsiella pneumoniae causing primary pyogenic liver abscess. J Infect Dis 193: 645-654.
7. Keynan Y, Rubinstein E (2007) The changing face of Klebsiella pneumoniae infections in the community. Int J Antimicrob Agents 30: 385-389. 8. Tsay RW, Siu LK, Fung CP, Chang FY (2002) Characteristics of bacteremia
between community-acquired and nosocomial Klebsiella pneumoniae infection: risk factor for mortality and the impact of capsular serotypes as a herald for community-acquired infection. Arch Intern Med 162: 1021-1027. 9. Yu WL, Ko WC, Cheng KC, Lee HC, Ke DS, et al. (2006) Association between
rmpA and magA genes and clinical syndromes caused by Klebsiella pneumoniae in Taiwan. Clin Infect Dis 42: 1351-1358.
10. Fang CT, Chuang YP, Shun CT, Chang SC, Wang JT (2004) A novel virulence gene in Klebsiella pneumoniae strains causing primary liver abscess and septic metastatic complications. J Exp Med 199: 697-705.
11. Yu WL, Chan KS, Ko WC, Lee CC, Chuang YC (2007) Lower prevalence of diabetes mellitus in patients with Klebsiella pneumoniae primary liver abscess caused by isolates of K1/K2 than with non-K1/K2 capsular serotypes. Clin
24
Infect Dis 45: 1529-1530; author reply 1532-1523.
12. Amako K, Meno Y, Takade A (1988) Fine structures of the capsules of Klebsiella pneumoniae and Escherichia coli K1. J Bacteriol 170: 4960-4962.
13. Mizuta K, Ohta M, Mori M, Hasegawa T, Nakashima I, et al. (1983) Virulence for mice of Klebsiella strains belonging to the O1 group: relationship to their capsular (K) types. Infect Immun 40: 56-61.
14. Pan YJ, Fang HC, Yang HC, Lin TL, Hsieh PF, et al. (2008) Capsular
polysaccharide synthesis regions in Klebsiella pneumoniae serotype K57 and a new capsular serotype. J Clin Microbiol 46: 2231-2240.
15. Podschun R, Fischer A, Ullmann U (1992) Siderophore production of Klebsiella species isolated from different sources. Zentralbl Bakteriol 276: 481-486. 16. Lin CT, Wu CC, Chen YS, Lai YC, Chi C, et al. (2011) Fur regulation of the
capsular polysaccharide biosynthesis and iron-acquisition systems in Klebsiella pneumoniae CG43. Microbiology 157: 419-429.
17. Williams P, Lambert PA, Brown MR, Jones RJ (1983) The role of the O and K antigens in determining the resistance of Klebsiella aerogenes to serum killing and phagocytosis. J Gen Microbiol 129: 2181-2191.
18. Lai YC, Peng HL, Chang HY (2003) RmpA2, an activator of capsule biosynthesis in Klebsiella pneumoniae CG43, regulates K2 cps gene expression at the transcriptional level. J Bacteriol 185: 788-800.
19. Chang HY, Lee JH, Deng WL, Fu TF, Peng HL (1996) Virulence and outer membrane properties of a galU mutant of Klebsiella pneumoniae CG43. Microb Pathog 20: 255-261.
20. Cerwenka H (2010) Pyogenic liver abscess: differences in etiology and treatment in Southeast Asia and Central Europe. World J Gastroenterol 16: 2458-2462. 21. Lee CH, Hu TH, Liu JW (2005) Splenic abscess caused by Klebsiella pneumoniae
and non-Klebsiella pneumoniae in Taiwan: emphasizing risk factors for acquisition of Klebsiella pneumoniae splenic abscess. Scand J Infect Dis 37: 905-909.
22. Sheu SJ, Kung YH, Wu TT, Chang FP, Horng YH (2011) Risk factors for
endogenous endophthalmitis secondary to klebsiella pneumoniae liver abscess: 20-year experience in Southern Taiwan. Retina 31: 2026-2031.
23. Tomas JM, Camprubi S, Merino S, Davey MR, Williams P (1991) Surface exposure of O1 serotype lipopolysaccharide in Klebsiella pneumoniae strains expressing different K antigens. Infect Immun 59: 2006-2011.
24. Podschun R, Ullmann U (1998) Klebsiella spp. as nosocomial pathogens: epidemiology, taxonomy, typing methods, and pathogenicity factors. Clin Microbiol Rev 11: 589-603.
25
25. Sun WS, Syu WJ, Ho WL, Lin CN, Tsai SF, et al. (2014) SitA contributes to the virulence of Klebsiella pneumoniae in a mouse infection model. Microbes Infect 16: 161-170.
26. Nicolle LE (2005) Catheter-related urinary tract infection. Drugs Aging 22: 627-639.
27. Macleod SM, Stickler DJ (2007) Species interactions in mixed-community crystalline biofilms on urinary catheters. J Med Microbiol 56: 1549-1557. 28. Wang X, Lunsdorf H, Ehren I, Brauner A, Romling U (2010) Characteristics of
biofilms from urinary tract catheters and presence of biofilm-related components in Escherichia coli. Curr Microbiol 60: 446-453.
29. Duguid JP (1959) Fimbriae and adhesive properties in Klebsiella strains. J Gen Microbiol 21: 271-286.
30. Stahlhut SG, Struve C, Krogfelt KA (2012) Klebsiella pneumoniae type 3 fimbriae agglutinate yeast in a mannose-resistant manner. J Med Microbiol 61:
317-322.
31. Sebghati TA, Korhonen TK, Hornick DB, Clegg S (1998) Characterization of the type 3 fimbrial adhesins of Klebsiella strains. Infect Immun 66: 2887-2894. 32. Gerlach GF, Allen BL, Clegg S (1988) Molecular characterization of the type 3
(MR/K) fimbriae of Klebsiella pneumoniae. J Bacteriol 170: 3547-3553. 33. Chan CH, Chen FJ, Huang YJ, Chen SY, Liu KL, et al. (2012) Identification of
protein domains on major pilin MrkA that affects the mechanical properties of Klebsiella pneumoniae type 3 fimbriae. Langmuir 28: 7428-7435.
34. Chen FJ, Chan CH, Huang YJ, Liu KL, Peng HL, et al. (2011) Structural and mechanical properties of Klebsiella pneumoniae type 3 Fimbriae. J Bacteriol 193: 1718-1725.
35. Langstraat J, Bohse M, Clegg S (2001) Type 3 fimbrial shaft (MrkA) of Klebsiella pneumoniae, but not the fimbrial adhesin (MrkD), facilitates biofilm formation. Infect Immun 69: 5805-5812.
36. Jagnow J, Clegg S (2003) Klebsiella pneumoniae MrkD-mediated biofilm
formation on extracellular matrix- and collagen-coated surfaces. Microbiology 149: 2397-2405.
37. Huang YJ, Wu CC, Chen MC, Fung CP, Peng HL (2006) Characterization of the type 3 fimbriae with different MrkD adhesins: possible role of the MrkD containing an RGD motif. Biochem Biophys Res Commun 350: 537-542. 38. Schurtz TA, Hornick DB, Korhonen TK, Clegg S (1994) The type 3 fimbrial
adhesin gene (mrkD) of Klebsiella species is not conserved among all fimbriate strains. Infect Immun 62: 4186-4191.
26
fimbriae of Klebsiella pneumoniae to human endothelial and urinary bladder cells. Infect Immun 65: 1546-1549.
40. Miettinen A, Westerlund B, Tarkkanen AM, Tornroth T, Ljungberg P, et al. (1993) Binding of bacterial adhesins to rat glomerular mesangium in vivo. Kidney Int 43: 592-600.
41. Tarkkanen AM, Allen BL, Westerlund B, Holthofer H, Kuusela P, et al. (1990) Type V collagen as the target for type-3 fimbriae, enterobacterial adherence organelles. Mol Microbiol 4: 1353-1361.
42. Huang YJ, Liao HW, Wu CC, Peng HL (2009) MrkF is a component of type 3 fimbriae in Klebsiella pneumoniae. Res Microbiol 160: 71-79.
43. Russell PW, Orndorff PE (1992) Lesions in two Escherichia coli type 1 pilus genes alter pilus number and length without affecting receptor binding. J Bacteriol 174: 5923-5935.
44. Mobley HL, Jarvis KG, Elwood JP, Whittle DI, Lockatell CV, et al. (1993) Isogenic P-fimbrial deletion mutants of pyelonephritogenic Escherichia coli: the role of alpha Gal(1-4) beta Gal binding in virulence of a wild-type strain. Mol Microbiol 10: 143-155.
45. Lund B, Lindberg F, Marklund BI, Normark S (1987) The PapG protein is the alpha-D-galactopyranosyl-(1----4)-beta-D-galactopyranose-binding adhesin of uropathogenic Escherichia coli. Proc Natl Acad Sci U S A 84: 5898-5902. 46. Gerlach GF, Allen BL, Clegg S (1989) Type 3 fimbriae among enterobacteria and
the ability of spermidine to inhibit MR/K hemagglutination. Infect Immun 57: 219-224.
47. Ernst JF, Bennett RL, Rothfield LI (1978) Constitutive expression of the iron-enterochelin and ferrichrome uptake systems in a mutant strain of Salmonella typhimurium. J Bacteriol 135: 928-934.
48. Hantke K (1981) Regulation of ferric iron transport in Escherichia coli K12: isolation of a constitutive mutant. Mol Gen Genet 182: 288-292.
49. Calderwood SB, Mekalanos JJ (1988) Confirmation of the Fur operator site by insertion of a synthetic oligonucleotide into an operon fusion plasmid. J Bacteriol 170: 1015-1017.
50. Coy M, Neilands JB (1991) Structural dynamics and functional domains of the fur protein. Biochemistry 30: 8201-8210.
51. Delany I, Rappuoli R, Scarlato V (2004) Fur functions as an activator and as a repressor of putative virulence genes in Neisseria meningitidis. Mol Microbiol 52: 1081-1090.
52. De Lorenzo V, Herrero M, Giovannini F, Neilands JB (1988) Fur (ferric uptake regulation) protein and CAP (catabolite-activator protein) modulate
27
transcription of fur gene in Escherichia coli. Eur J Biochem 173: 537-546. 53. Davis BM, Quinones M, Pratt J, Ding Y, Waldor MK (2005) Characterization of
the small untranslated RNA RyhB and its regulon in Vibrio cholerae. J Bacteriol 187: 4005-4014.
54. Battistoni F, Platero R, Duran R, Cervenansky C, Battistoni J, et al. (2002) Identification of an iron-regulated, hemin-binding outer membrane protein in Sinorhizobium meliloti. Appl Environ Microbiol 68: 5877-5881.
55. Masse E, Vanderpool CK, Gottesman S (2005) Effect of RyhB small RNA on global iron use in Escherichia coli. J Bacteriol 187: 6962-6971.
56. McHugh JP, Rodriguez-Quinones F, Abdul-Tehrani H, Svistunenko DA, Poole RK, et al. (2003) Global iron-dependent gene regulation in Escherichia coli. A new mechanism for iron homeostasis. J Biol Chem 278: 29478-29486.
57. Morita T, Maki K, Aiba H (2005) RNase E-based ribonucleoprotein complexes: mechanical basis of mRNA destabilization mediated by bacterial noncoding RNAs. Genes Dev 19: 2176-2186.
58. Morita T, Mochizuki Y, Aiba H (2006) Translational repression is sufficient for gene silencing by bacterial small noncoding RNAs in the absence of mRNA destruction. Proc Natl Acad Sci U S A 103: 4858-4863.
59. Oglesby AG, Murphy ER, Iyer VR, Payne SM (2005) Fur regulates acid resistance in Shigella flexneri via RyhB and ydeP. Mol Microbiol 58: 1354-1367.
60. Palyada K, Threadgill D, Stintzi A (2004) Iron acquisition and regulation in Campylobacter jejuni. J Bacteriol 186: 4714-4729.
61. Vasil ML, Ochsner UA (1999) The response of Pseudomonas aeruginosa to iron: genetics, biochemistry and virulence. Mol Microbiol 34: 399-413.
62. Masse E, Salvail H, Desnoyers G, Arguin M (2007) Small RNAs controlling iron metabolism. Curr Opin Microbiol 10: 140-145.
63. Galperin MY, Higdon R, Kolker E (2010) Interplay of heritage and habitat in the distribution of bacterial signal transduction systems. Mol Biosyst 6: 721-728. 64. Stock AM, Robinson VL, Goudreau PN (2000) Two-component signal
transduction. Annu Rev Biochem 69: 183-215.
65. Mascher T, Helmann JD, Unden G (2006) Stimulus perception in bacterial signal-transducing histidine kinases. Microbiol Mol Biol Rev 70: 910-938. 66. Stock JB, Ninfa AJ, Stock AM (1989) Protein phosphorylation and regulation of
adaptive responses in bacteria. Microbiol Rev 53: 450-490.
67. Alex LA, Simon MI (1994) Protein histidine kinases and signal transduction in prokaryotes and eukaryotes. Trends Genet 10: 133-138.
68. Trisler P, Gottesman S (1984) lon transcriptional regulation of genes necessary for capsular polysaccharide synthesis in Escherichia coli K-12. J Bacteriol 160:
28 184-191.
69. Gottesman S, Trisler P, Torres-Cabassa A (1985) Regulation of capsular
polysaccharide synthesis in Escherichia coli K-12: characterization of three regulatory genes. J Bacteriol 162: 1111-1119.
70. Brill JA, Quinlan-Walshe C, Gottesman S (1988) Fine-structure mapping and identification of two regulators of capsule synthesis in Escherichia coli K-12. J Bacteriol 170: 2599-2611.
71. Stout V, Gottesman S (1990) RcsB and RcsC: a two-component regulator of capsule synthesis in Escherichia coli. J Bacteriol 172: 659-669.
72. Majdalani N, Heck M, Stout V, Gottesman S (2005) Role of RcsF in signaling to the Rcs phosphorelay pathway in Escherichia coli. J Bacteriol 187:
6770-6778.
73. Pruss BM, Besemann C, Denton A, Wolfe AJ (2006) A complex transcription network controls the early stages of biofilm development by Escherichia coli. J Bacteriol 188: 3731-3739.
74. Francez-Charlot A, Laugel B, Van Gemert A, Dubarry N, Wiorowski F, et al. (2003) RcsCDB His-Asp phosphorelay system negatively regulates the flhDC operon in Escherichia coli. Mol Microbiol 49: 823-832.
75. Davalos-Garcia M, Conter A, Toesca I, Gutierrez C, Cam K (2001) Regulation of osmC gene expression by the two-component system rcsB-rcsC in Escherichia coli. J Bacteriol 183: 5870-5876.
76. Schwan WR, Shibata S, Aizawa S, Wolfe AJ (2007) The two-component response regulator RcsB regulates type 1 piliation in Escherichia coli. J Bacteriol 189: 7159-7163.
77. Carballes F, Bertrand C, Bouche JP, Cam K (1999) Regulation of Escherichia coli cell division genes ftsA and ftsZ by the two-component system rcsC-rcsB. Mol Microbiol 34: 442-450.
78. Garcia-Calderon CB, Casadesus J, Ramos-Morales F (2007) Rcs and PhoPQ regulatory overlap in the control of Salmonella enterica virulence. J Bacteriol 189: 6635-6644.
79. Wang Q, Zhao Y, McClelland M, Harshey RM (2007) The RcsCDB signaling system and swarming motility in Salmonella enterica serovar typhimurium: dual regulation of flagellar and SPI-2 virulence genes. J Bacteriol 189: 8447-8457.
80. Virlogeux I, Waxin H, Ecobichon C, Lee JO, Popoff MY (1996) Characterization of the rcsA and rcsB genes from Salmonella typhi: rcsB through tviA is involved in regulation of Vi antigen synthesis. J Bacteriol 178: 1691-1698. 81. Nassif X, Honore N, Vasselon T, Cole ST, Sansonetti PJ (1989) Positive control of
29
colanic acid synthesis in Escherichia coli by rmpA and rmpB, two virulence-plasmid genes of Klebsiella pneumoniae. Mol Microbiol 3: 1349-1359.
82. Romling U, Simm R (2009) Prevailing concepts of c-di-GMP signaling. Contrib Microbiol 16: 161-181.
83. Ross P, Weinhouse H, Aloni Y, Michaeli D, Weinberger-Ohana P, et al. (1987) Regulation of cellulose synthesis in Acetobacter xylinum by cyclic diguanylic acid. Nature 325: 279-281.
84. D'Argenio DA, Miller SI (2004) Cyclic di-GMP as a bacterial second messenger. Microbiology 150: 2497-2502.
85. Romling U, Amikam D (2006) Cyclic di-GMP as a second messenger. Curr Opin Microbiol 9: 218-228.
86. Romling U, Galperin MY, Gomelsky M (2013) Cyclic di-GMP: the first 25 years of a universal bacterial second messenger. Microbiol Mol Biol Rev 77: 1-52. 87. Mendez-Ortiz MM, Hyodo M, Hayakawa Y, Membrillo-Hernandez J (2006)
Genome-wide transcriptional profile of Escherichia coli in response to high levels of the second messenger 3',5'-cyclic diguanylic acid. J Biol Chem 281: 8090-8099.
88. Romling U, Gomelsky M, Galperin MY (2005) C-di-GMP: the dawning of a novel bacterial signalling system. Mol Microbiol 57: 629-639.
89. Chan C, Paul R, Samoray D, Amiot NC, Giese B, et al. (2004) Structural basis of activity and allosteric control of diguanylate cyclase. Proc Natl Acad Sci U S A 101: 17084-17089.
90. Simm R, Morr M, Kader A, Nimtz M, Romling U (2004) GGDEF and EAL domains inversely regulate cyclic di-GMP levels and transition from sessility to motility. Mol Microbiol 53: 1123-1134.
91. Ryan RP, Fouhy Y, Lucey JF, Dow JM (2006) Cyclic di-GMP signaling in bacteria: recent advances and new puzzles. J Bacteriol 188: 8327-8334.
92. Kong IC (2010) Application of stimulating agents on the immobilized bioluminescence strain Pseudomonas putida mt-2 KG1206, preserved by deep-freezing, for the convenient biomonitoring. J Environ Sci (China) 22: 1475-1480.
93. Benach J, Swaminathan SS, Tamayo R, Handelman SK, Folta-Stogniew E, et al. (2007) The structural basis of cyclic diguanylate signal transduction by PilZ domains. EMBO J 26: 5153-5166.
94. Christen M, Christen B, Allan MG, Folcher M, Jeno P, et al. (2007) DgrA is a member of a new family of cyclic diguanosine monophosphate receptors and controls flagellar motor function in Caulobacter crescentus. Proc Natl Acad
30 Sci U S A 104: 4112-4117.
95. Hickman JW, Harwood CS (2008) Identification of FleQ from Pseudomonas aeruginosa as a c-di-GMP-responsive transcription factor. Mol Microbiol 69: 376-389.
96. Lee VT, Matewish JM, Kessler JL, Hyodo M, Hayakawa Y, et al. (2007) A cyclic-di-GMP receptor required for bacterial exopolysaccharide production. Mol Microbiol 65: 1474-1484.
97. Johnson JG, Murphy CN, Sippy J, Johnson TJ, Clegg S (2011) Type 3 fimbriae and biofilm formation are regulated by the transcriptional regulators MrkHI in Klebsiella pneumoniae. J Bacteriol 193: 3453-3460.
98. Tamayo R, Pratt JT, Camilli A (2007) Roles of cyclic diguanylate in the regulation of bacterial pathogenesis. Annu Rev Microbiol 61: 131-148.
99. McDonough KA, Rodriguez A (2012) The myriad roles of cyclic AMP in microbial pathogens: from signal to sword. Nat Rev Microbiol 10: 27-38. 100. Johnson JG, Clegg S (2010) Role of MrkJ, a phosphodiesterase, in type 3
fimbrial expression and biofilm formation in Klebsiella pneumoniae. J Bacteriol 192: 3944-3950.
101. Wilksch JJ, Yang J, Clements A, Gabbe JL, Short KR, et al. (2011) MrkH, a novel c-di-GMP-dependent transcriptional activator, controls Klebsiella pneumoniae biofilm formation by regulating type 3 fimbriae expression. PLoS Pathog 7: e1002204.
102. Yang J, Wilksch JJ, Tan JW, Hocking DM, Webb CT, et al. (2013)
Transcriptional activation of the mrkA promoter of the Klebsiella pneumoniae type 3 fimbrial operon by the c-di-GMP-dependent MrkH protein. PLoS One 8: e79038.
103. Hennequin C, Forestier C (2009) oxyR, a LysR-type regulator involved in Klebsiella pneumoniae mucosal and abiotic colonization. Infect Immun 77: 5449-5457.
104. Wu CC, Lin CT, Cheng WY, Huang CJ, Wang ZC, et al. (2012) Fur-dependent MrkHI regulation of type 3 fimbriae in Klebsiella pneumoniae CG43. Microbiology 158: 1045-1056.
105. Zheng M, Doan B, Schneider TD, Storz G (1999) OxyR and SoxRS regulation of fur. J Bacteriol 181: 4639-4643.
106. Carpenter BM, Whitmire JM, Merrell DS (2009) This is not your mother's repressor: the complex role of fur in pathogenesis. Infect Immun 77: 2590-2601.
107. Vecerek B, Moll I, Blasi U (2007) Control of Fur synthesis by the non-coding RNA RyhB and iron-responsive decoding. EMBO J 26: 965-975.
31
108. Peterson CN, Carabetta VJ, Chowdhury T, Silhavy TJ (2006) LrhA regulates rpoS translation in response to the Rcs phosphorelay system in Escherichia coli. J Bacteriol 188: 3175-3181.