N-acetylcysteine 藉由活化轉錄抑制因子HBP1抑制口腔癌上皮生長因子受體的訊息傳遞; N-acetylcysteine(NAC) inhibits EGFR Signaling through Induction of the Transcriptional Factor HBP1 in Oral Cancers
全文
(2) 目錄 縮寫對照表 ...............................................................................................................................I 摘要 ..........................................................................................................................................III Abstract ................................................................................................................................... IV 第一章、前言................................................................................................................ 1 第二章、文獻探討........................................................................................................ 2 一、口腔癌 (Oral Cancer) ....................................................................................... 2 I. 介紹 .................................................................................................................... 2 II. 病理特徵 .......................................................................................................... 2 III. 口腔癌發生過程 ............................................................................................. 4 IV. 口腔癌之危險因子 ......................................................................................... 4 V. 口腔癌分期 ...................................................................................................... 6 VI. 口腔癌與 EGFR ............................................................................................. 8 二、上皮生長因子受體 (Epidermal Growth Factor Receptor;EGFR) ................ 9 I. 介紹 .................................................................................................................... 9 II. 上皮生長因子受體之訊息傳遞 .................................................................... 10 III. EGFR 磷酸化位點......................................................................................... 12 IV. EGFR 與氧化壓力 ........................................................................................ 14 V. EGFR 與 HBP1 .............................................................................................. 14 三、HBP1 (HMG (High-mobility group)-Box Protein 1)...................................... 16 I. 介紹 .................................................................................................................. 16 i.
(3) II. HBP1 轉錄因子調控細胞生長 ....................................................................... 16 i. HBP1 與 RB............................................................................................... 17 ii. HBP1 與 p38 MAPK ................................................................................ 18 iii. HBP1 抑制 Wnt 訊息傳遞路徑 ............................................................. 19 iv. HBP1 抑制 NADPH 氧化酶之次單位 p47phox 的表現 .......................... 20 III. HBP1 與癌症 ................................................................................................. 21 四、NAC (N-acetyl-L-cysteine) ............................................................................. 22 I. 介紹 .................................................................................................................. 22 II. NAC 與 GSH .................................................................................................. 22 III. NAC 與癌症 .................................................................................................. 23 i. NAC 與抗突變........................................................................................... 23 ii. NAC 與抗氧化 ......................................................................................... 23 iii. NAC 對粒線體的影響 ............................................................................ 23 iv. NAC 與 DNA 的修復 ............................................................................. 23 v. NAC 抑制基因毒性以及細胞的轉型 ...................................................... 23 vi. NAC 調節基因表現以及訊息傳遞路徑................................................. 24 vii. NAC 抑制腫瘤細胞的增生與形成 ....................................................... 24 IV. NAC 與 EGFR............................................................................................... 24 五、RNA 干擾術 (RNA interference;RNAi) ..................................................... 25 I. 介紹 .................................................................................................................. 25 II. 原理 ................................................................................................................ 25 III. 應用 ............................................................................................................... 26 六、實驗目的與動機 ............................................................................................. 27 ii.
(4) 第三章、材料與方法.................................................................................................. 28 一、實驗設計 ......................................................................................................... 28 二、實驗藥品與儀器 ............................................................................................. 29 三、細胞培養 (Cell Culture) ................................................................................. 32 I. 細胞株及細胞培養條件 .................................................................................. 32 II. 試劑配製 ........................................................................................................ 32 III. 繼代培養 ....................................................................................................... 33 IV. 細胞冷凍 ....................................................................................................... 33 四、細胞生長率 (Growth) 與存活率 (Viability) 測定 ........................................ 34 I. 原理 .................................................................................................................. 34 II. 試劑配製 ........................................................................................................ 34 III. 細胞型態觀察 ............................................................................................... 34 IV. 實驗步驟 ....................................................................................................... 34 五、細胞週期 (Cell Cycle) 分析........................................................................... 36 I. 原理 .................................................................................................................. 36 II. 試劑配製 ........................................................................................................ 36 III. 實驗步驟 ....................................................................................................... 37 六、ROS (Reactive Oxygen Species) 測定 ........................................................... 38 I. 原理 .................................................................................................................. 38 II. 試劑配製 ........................................................................................................ 38 III. 實驗步驟 ....................................................................................................... 38 七、蛋白質萃取 ..................................................................................................... 39 iii.
(5) I. 原理 .................................................................................................................. 39 II. 試劑配製 ........................................................................................................ 39 III. 實驗步驟 ....................................................................................................... 39 八、蛋白質定量 ..................................................................................................... 40 I. 原理 .................................................................................................................. 40 II. 標準曲線製備 ................................................................................................ 40 III. 實驗步驟 ....................................................................................................... 40 九、西方點墨法 (Western Bloting) ...................................................................... 42 I. 原理 .................................................................................................................. 42 II. 試劑配製 ........................................................................................................ 42 III. 實驗步驟 ....................................................................................................... 46 十、質體 (Plasmid) 的製備................................................................................... 47 I. 原理 .................................................................................................................. 47 II. 使用的質體 (乾燥) ........................................................................................ 48 III. 實驗步驟 ....................................................................................................... 48 十一、HBP1 knockdown 之 HSC-3 細胞株 – 利用 RNAi 干擾技術................ 50 I. 原理 .................................................................................................................. 50 II. 實驗步驟 ........................................................................................................ 50 十二、萃取 RNA – 使用 RNeasy® Mini Kit (QIAGEN) ..................................... 52 I. 原理 .................................................................................................................. 52 II. 試劑配製 ........................................................................................................ 52 III. 實驗步驟 ....................................................................................................... 52 iv.
(6) 十三、RT-PCR (Reverse Transcription-Polymerase Chain Reaction) – 使用 SuperScriptTMⅢ One-Step RT-PCR System with Platinum® Taq DNA Polymerase Kit (invitrogen) ............................................................................ 54 I. 原理 .................................................................................................................. 54 II. 試劑配製 ........................................................................................................ 54 III. 實驗步驟 ....................................................................................................... 54 十四、冷光酵素報導基因分析法 – Luciferase Gene Reporter Assay ................ 56 I. 原理 .................................................................................................................. 56 II. 實驗步驟 ........................................................................................................ 56 十五、統計分析 ..................................................................................................... 57 第四章、結果.............................................................................................................. 58 一、NAC 抑制 HSC-3 口腔癌細胞生長 ............................................................. 58 I. NAC 抑制 HSC-3 生長 ................................................................................... 58 II. NAC 抑制 cyclinD1 表現使細胞週期停滯於 G1 期 ................................... 58 二、NAC 誘發 HBP1 的表現且抑制 EGFR 訊息傳遞路徑 .............................. 60 I. NAC 增加 HBP1 蛋白質與 mRNA 的表現 .................................................. 60 II. NAC 抑制 EGFR 訊息傳遞路徑 ................................................................... 61 三、NAC 抑制 p47phox 的表現且抑制細胞內 ROS 的產生 ............................... 62 I. NAC 抑制 p47phox 的表現 ................................................................................ 62 II. NAC 抑制細胞內 ROS 的產生 ..................................................................... 62 四、HBP1 調控 EGFR 與下游 Akt 的活化 ........................................................ 63 I. HBP1 knockdown 增強 EGFR、Akt 及 ERK 的活性 ................................... 63 v.
(7) II. HBP1 knockdown 增強 EGF 誘發的 EGFR 訊息傳遞路徑 ........................ 63 五、NAC 藉由調控 HBP1 的表現而抑制 EGFR 訊息傳遞路徑 ...................... 65 I. HBP1 knockdown 減緩 NAC 對 HSC-3 口腔癌細胞的生長抑制 ................ 65 II. HBP1 knockdown 減緩 NAC 對 EGF 誘發之 EGFR 訊息傳遞路徑的抑制 65 第五章、討論.............................................................................................................. 88 第六章、結論.............................................................................................................. 94 參考資料...................................................................................................................... 95. vi.
(8) 圖目錄 圖 2-1 口腔癌的發生過程 ........................................................................................... 4 圖 2-2 上皮生長因子受體結構圖 ............................................................................. 10 圖 2-3 ErbB 接受體與其配體 ................................................................................... 11 圖 2-4 上皮生長因子受體的訊息傳遞 ..................................................................... 12 圖 2-5 標準的 EGFR 訊息傳遞路徑與磷酸化位點 ................................................ 13 圖 2-6 HBP1 結構圖 ................................................................................................. 16 圖 2-7 HBP1 調控細胞週期 ..................................................................................... 17 圖 2-8 HBP1 為 p38 MAPK 路徑之作用目標 ........................................................ 18 圖 2-9 HBP1 標的基因-Wnt ..................................................................................... 19 圖 2-10 p47phox 之啟動子........................................................................................... 20 圖 2-11 HBP1 調控 NADPH 氧化酶 ....................................................................... 20 圖 2-12 正常 HBP1 與突變的 HBP1 結構 .............................................................. 21 圖 2-13 Cysteine 與 NAC 之結構 ............................................................................ 22 圖 2-14 RNAi 之作用原理 ........................................................................................ 26 圖 4-1 HSC-3 細胞 EGFR 過度表現且 HBP1 表現較低 ....................................... 67 圖 4-2 NAC 抑制 HSC-3 口腔癌細胞生長 ............................................................. 68 圖 4-3 NAC 抑制 HSC-3 口腔癌細胞生長以細胞型態觀察 ................................. 69 圖 4-4 NAC 使 HSC-3 口腔癌細胞的細胞週期停滯於 G1 期 ............................. 70 圖 4-5 NAC 使 TW-206 口腔癌細胞的細胞週期停滯於 G1 期 ........................... 71 圖 4-6 NAC 抑制 cyclin D1 的活化 ........................................................................ 72 vii.
(9) 圖 4-7 NAC 增加 HBP1 蛋白(A) 與 mRNA(B) 的表現 ........................................ 73 圖 4-8 NAC 增加 -2kb HBP1 啟動子的表現 .......................................................... 74 圖 4-9 NAC 抑制 EGFR 蛋白(A) 與 mRNA(B) 表現 ........................................... 75 圖 4-10 NAC 抑制 Akt 活化與誘導 ERK 磷酸化 ................................................. 76 圖 4-11 NAC 抑制 EGF 所誘導的 EGFR 訊息傳遞路徑 ...................................... 77 圖 4-12 NAC 抑制 p47phox mRNA 表現 .................................................................. 78 圖 4-13 NAC 增加曲線左移現象抑制細胞內 ROS 的生成 .................................. 79 圖 4-14 NAC 抑制細胞內 ROS 的生成以量化圖顯示 ........................................... 80 圖 4-15 建立 HBP1 knockdown 細胞株 .................................................................. 81 圖 4-16 HBP1 的含量影響 EGFR、Akt 以及 ERK 磷酸化 .................................. 82 圖 4-17 HBP1 的含量影響 EGF (time course) 誘發的 EGFR 傳遞路徑 .............. 83 圖 4-18 HBP1 的含量影響 EGF (dose dependent) 誘發的 EGFR 傳遞路徑 ........ 84 圖 4-19 HBP1 的含量影響 NAC 對 HSC-3 細胞的生長 ....................................... 85 圖 4-20 HBP1 的含量影響 NAC 對 HSC-3 細胞的生長以細胞型態觀察........... 86 圖 4-21 HBP1 的含量影響 NAC 對 EGFR 訊息傳遞路徑 ................................... 87. viii.
(10) 表目錄 表 2-1 民國 95 年全國男性與 25 - 44 歲男性癌症發生率之比較........................... 3 表 2-2 全球口腔癌發生及死亡情形 ........................................................................... 3 表 2-3 口腔癌分期 ....................................................................................................... 7 表 5-1 人類癌症中 Akt 的變異種類......................................................................... 93. ix.
(11) 縮寫對照表 縮寫. 全名. ADH. alcohol dehydrogenase. ALDH. aldehyde dehydrogenase. AML. acute myeloid leukemia. AJCC. American Joint Committee of Cancer. AR. amphiregulin. BSA. bovine serum albumin. BTC. betacellulin. CDK. cyclin dependent kinase. DCIS. ductal carcinoma in situ. DEPC. diethylpyrocarbonate. EGF. epidermal growth factor. EGFR. epidermal growth factor receptor. EREG. epiregulin. ERP. epiregulin. EtBr. ethidium bromide. FASC. flow cytometry. FsaL. Fas ligand. GSH. glutathione. H2DCF-DA. 2,7-dichlorofluorescein diacetate. HB-EGF. heparin-binding EGF. HBP1. HMG-box protein 1. HMG. high-mobility group. Ⅰ.
(12) IARC. international agency for research on cancer. MAPK. mitogen-activated protein kinase. NAC. N-acetylcysteine. NNK. 4-methylnitrosamino-1-3- pyridyl-1-butanone. NNN. N-nitrosonornicotine. NRG. neuregulins. PAH. polycyclic aromatic hydrocarbons. PBS. phosphate buffer saline. PDGF. platelet-derived growth factor. PTP. protein tyrosine phosphatase. RB. retinoblastoma. RISC. RNA-induced silencing complex. RNAi. RNA inference. ROS. reactive oxygen species. RTK. receptor tyrosine kinases. RT-PCR. reverse transcription polymerase chain reaction. SH2. Src-homology 2. TGF-α. transforming growth factor-α. VEGF. vascular endothelial growth factor. II.
(13) 摘要. 全球最常發生的癌症中口腔癌排名第五,而死亡率卻是所有癌症中最高的。行 政院衛生署調查發現,台灣口腔癌的發生率逐年增加,更是台灣男性所罹患的主要 癌症中,發生和死亡情形增加最快者。儘管治療口腔癌方式已逐年提升,但其預後 存活率仍然偏低。免疫組織化學檢查顯示, 55%-100% 的頭頸部癌症患者中,上皮 生長因子受體 (epidermal growth factor receptor;EGFR) 呈現過度表現,且伴隨著預 後不良、腫瘤分化不良以及低存活率的問題。因此,有效控制 EGFR 的活化顯然是 治療口癌症重要之課題。之前研究發現,轉錄抑制因子 HBP1 (HMG box protein 1) 可 藉由對氧化還原帄衡的調控,而抑制乳癌細胞 EGFR 的訊息傳遞。所以,尋找具有 抑 制 EGFR 活 性 的 自 然 生 物 活 性 物 質 成 為 目 前 研 究 焦 點 之 一 。 而 NAC (N-acetylcysteine),麩胱甘肽 (Glutathione;GSH) 的前驅物,具有抗發炎、抗突變和 抗癌功效,同時,NAC 亦可抑制 EGFR 活性,但其機制尚未清楚。因此,我們假 設 NAC 藉由活化 HBP1 來抑制 EGFR 訊息傳遞路徑而抑制口腔癌細胞生長。結果 顯示,NAC 誘導 HSC-3 口腔癌細胞中 HBP1 的表現,並抑制 EGFR 活性,導致細 胞生長停滯在 G1 期。同時,NAC 也抑制了 NADPH 氧化酶次單位 p47phox 的表現, 而減少細胞內活性氧物質 (Reactive oxygen species;ROS) 的生成。為了更進一步了 解 HBP1 在 NAC 抑制 EGFR 和細胞生長的角色,我們利用 RNAi 技術建立 HBP1 表現穩定降低的 HSC-3 細胞株。結果發現,HBP1 表現降低時呈現較強的 EGFR 路 徑活化,同時,也減弱了 NAC 對 EGF-EGFR 訊息路徑和生長的抑制。我們希望此 研究的結果提供對轉錄因子 HBP1 調控 EGFR 訊息傳遞路徑的分生機制有更深入 的認識,更重要地是,提供 HBP1 將來應用在口腔癌防治上重要調控標的有力的證 據。. ⅠII.
(14) Abstract. Oral cancer is the fifth most frequent cancer worldwide while its mortality rate is the highest among all cancers. In Taiwan, the incidence of oral cancer increases yearly, especially in men. Despite the therapy stratagem has been advanced dramatically,. the. prognosis. of. survival. rate. is. still. relatively. low.. Immunohistochemical examination showed over-expressed EGFR staining in 55% to 100 % of head and neck squamous cell carcinomas (HNSCC). EGFR overexpression is associated with poor prognosis, tumor differentiation, and consequently poor survival. Hence, finding compounds that can efficiently inhibit the EGFR signaling pathway has become a promising strategy in oral cancer therapy. NAC (N-acetylcysteine), known as an anti-inflammatory factor, has anti-EGFR function, but the mechanism is still unclear. Therefore, we hypothesized that NAC inhibits EGFR signaling pathway through induction of the transcription factor HBP1 in oral cancer. We chose HSC-3 oral cancer cell line as the study model due to the fact that HSC-3 has abundant EGFR expression but relatively low HBP1 expression. As results, we showed that NAC induces HSC-3 cells arrest in G1 accompanied with decreased cyclin D1 and EGFR activation. More importantly, HBP1 expression was induced in HSC-3 cells by NAC treatment in a dose-dependent manner. Moreover, NAC also inhibited the gene expression of p47phox, one of the NADPH oxidase subunit, and thereby suppressed ROS generation in oral cancer. Further, to test if NAC inhibits EGFR activation through induction of HBP1, we employed HBP1 shRNA to knockdown. IV.
(15) endogenous HBP1 gene in HSC-3 cells. Results indicated that HBP1 reduction leads to higher EGF-stimulated EGFR and downstream Akt activation than the control one. The most importantly, HBP1 knockdown abolished NAC-inhibited EGFR activation. Thus, our results may support the transcription factor HBP1 as a future biomarker and therapeutic target in oral cancer stratagem.. V.
(16) 第一章. 前言. 第一章、前言 口腔癌 (Oral cancer) 在全球最常發生的癌症中排名第五,但死亡率卻是所有癌症 中最高的。行政院衛生署調查發現,癌症目前居國人十大死因首位,其中口腔癌位居 男性癌症死亡排名的第五位,而以癌症發生率來看,口腔癌亦高居男性癌症發生率的 第五位。口腔癌的發生與嚼食檳榔、吸菸、喝酒等有密切關係,根據統計,約 90% 口腔癌病人有嚼食檳榔的習慣,台灣男性嚼食檳榔比率則高達 16%;隨著嚼食檳榔人 口的增加,預期口腔癌發生率將會持續上升。 免疫組織化學檢查顯示,在頭頸部癌症中大約有 55%-100% 的患者,上皮生長 因子受體 (Epidermal Growth Factor;EGFR) 有過度表現的情形,且伴隨著預後不良、 腫瘤分化不良以及低存活率的問題。EGFR 以及其突變型 (EGFR variant III) 已知在 許多腫瘤細胞過度表現,尤其是口腔癌。由此可知,對於治療口腔癌,EGFR 扮演 著革命性的角色。我們先前研究發現,轉錄抑制因子 HBP1 (HMG box protein 1) 可 藉由對氧化還原帄衡的調控,而抑制乳癌細胞 EGFR 的訊息傳遞,但 HBP1 在口腔 癌調控的角色尚未被探討。 已有研究顯示,NAC (N-acetylcysteine) 具有調節身體體內氧化還原帄衡的能力, 而且是一個有效的自由基清除劑,有許多研究證實,NAC 具有抗癌抗腫瘤的效果。 因此,也開始有許多研究發現 NAC 能透過許多不同的機制來達到抑制癌症的發生。 同時,NAC 亦有抑制 EGFR 活化,但其機制尚未完全清楚。 本研究主要是探討 NAC 是否藉由活化 HBP1 來抑制 EGFR 的訊息傳遞路徑。 希望此研究將提供轉錄因子 HBP1 為一個治療口腔癌的重要標的,對於口腔癌的防 治有進一步的貢獻。 1.
(17) 第二章. 文獻探討. 第二章、文獻探討 一、口腔癌 (Oral Cancer). I. 介紹 自民國七十一年起,癌症躍居國人十大死因之首,而其發生率與死亡率逐年增 加,而在十大癌症死亡率中口腔癌排名第七位,若單以男性而言,則位居第五,近 十年內,台灣每年罹患口腔癌的人數從 1 千 7 百位增加為 4 千 7 百位;死亡人數則 從約 1 千位增加為 2 千 2 百位,成長幅度皆相當大,是台灣男性所罹患的主要癌症 中,發生和死亡情形增加最快者 。此外,25 – 44 歲的男性癌症中,口腔癌發生率為 第一位,且帄均死亡年齡才只有 55 歲,比其他癌症早 10 歲以上。另外,在國際癌 症研究總署 (International Agency for Research on Cancer, IARC) 2003年研究報告也顯 示,全球每年罹患口腔癌人數約計有 27 萬人 (男性 17 萬、女性 10 萬),死亡人數約 計有 13 萬人(男性 8 萬人、女性 5 萬人)。. II.病理特徵 口腔癌一般界定發生範圍為口唇到扁桃腺之前,包括唇、舌、口底、口蓋、頰 黏膜、齒槽粘膜、齒齦、臼齒後三角區、上顎竇、硬顎、軟顎、扁桃腺、喉嚨後壁 及下咽部。從組織學上區分,包括鱗狀上皮細胞癌、疣狀癌、肉瘤、腺樣囊狀癌、 腺癌、惡性多形性腺瘤、惡性淋巴瘤、黏液表皮樣癌、惡性黑色素瘤、骨瘤、脂肪 肉瘤等,上述癌症中以鱗狀上皮細胞癌所占的比率最高。口腔癌的好發部位在美國 與其他已開發國家均位於舌部,其次是唇部與口底 (1),但是,在其他開發中國家, 則是因生活習慣不同而好發於不同的部位。在台灣行政院衛生署的統計中,以舌癌 占的比例最多,其次為頰癌與齒齦癌。. 2.
(18) 第二章. 文獻探討. 表 2-1 民國 95年全國男性與 25 - 44 歲男性癌症發生率之比較 全國男性. 順. 25-44 歲男性. 位. 原發部位. 1. 肝及肝內膽管. 7,167. 53.7. 口腔、口咽及下咽. 1,214. 30.1. 2. 結腸及直腸. 5,793. 42.7. 肝及肝內膽管. 728. 18.2. 3. 肺、支氣管及氣管. 5,756. 41.5. 結腸及直腸. 406. 10.2. 4. 口腔、口咽及下咽. 4,879. 35.9. 鼻咽. 356. 8.95. 5. 攝護腺. 3,073. 21.9. 肺、支氣管及氣管. 214. 5.25. 個案數 粗發生率. 原發部位. 個案數 粗發生率. 資料來源:中華民國行政院衛生署, 2006. 表 2-2 全球口腔癌發生及死亡情形 男性. 女性. 國家/地區 發生人數. 死亡人數. 發生人數. 死亡人數. 全球. 175,916. 80,736. 98,373. 48,723. 發展程度較高區域. 64,830. 22,422. 26,311. 8,259. 發展程度較低區域. 111,011. 58,282. 72,022. 38,438. 資料來源:GLOBOCAN 2002 database, IARC. 3.
(19) 第二章. 文獻探討. 圖 2-1 口腔癌的發生過程 資料來源:(2). III. 口腔癌發生過程 事實上,口腔癌的形成是一種多階段的變化,起初,正常口腔黏膜細胞開始產 生異常的鱗狀細胞增生,而形成潰瘍、白斑、紅斑及疣狀上皮增生等癌前期徵兆。 然而,經由長期發炎或食物毒性刺激而造成細胞嚴重變異,使細胞不斷的增生,因 細胞增生太快而使表面營養不足,則會產生腫瘤處表面的潰瘍,造成原位性口腔癌 的發生。進一步當口腔癌轉移到淋巴時,常會在頸側觸摸到固定無痛的腫大淋巴結, 癌細胞最後會轉移至肺、肝及骨髓等全身部位。. IV. 口腔癌之危險因子 造成口腔癌的危險因子往往是多元的,對於口腔的慢性刺激是造成口腔癌的重 要因素,然而,其他地區性的特異生活習慣或是個人內因性因子的影響,也是口腔 癌發生的主要原因。以下為口腔癌之危險因子:. 4.
(20) 第二章. 文獻探討. 嚼食檳榔 國際癌症研究總署 (IARC) 已證實檳榔子具有致癌性,且已發表公布檳榔子為 第一類致癌物(3)。尤其,在東南亞地區嚼食檳榔明顯增加頭頸部癌症的罹患率 (4,5), 一半以上的口腔癌病人有嚼食檳榔的習慣(6)。檳榔致癌之原因,主要是嚼食檳榔會 使口腔暴露於許多生物鹼與多酚類化合物之中,而多酚類化合物在鹼性的環境下, 所釋放出的活性氧物質會使口腔細胞的細胞膜產生脂質過氧化,或是直接造成 DNA 的改變或是斷裂,而產生基因毒性。此外,唾液中生物鹼在亞硝酸鹽的存在下,經 過硝化作用後產生的衍生物也會對細胞具有基因毒性與致突變性(7-9)。 吸菸/嚼食菸草 吸菸一直是造成頭頸部癌症的重要因素,約有四分之一的口腔癌發生原因是吸 煙(10)。另外,在動物實驗以及臨床實驗證實,嚼食菸草也具有致癌的效果,而且呈 現劑量關係(11,12)。這樣的結果歸咎於,菸草中含有亞硝胺,例如,4-甲基亞硝胺基 -1-3-吡啶基-1-丁酮 (4-methylnitrosamino-1-3- pyridyl-1-butanone;NNK)、 N-亞硝基 尼古丁 (N-nitrosonornicotine;NNN) 以及多環芳香族碳氫化合物 (polycyclic aromatic hydrocarbons;PAH),這些物質會使 DNA 造成變異,造成口腔癌的發生 (13,14)。尤 其,合併吸菸與喝酒或是合併嚼食菸草與喝酒,更大幅地增加罹患口腔癌的風險 (15). 。. 飲酒 Seitz 等學者指出,飲酒會增加罹患口腔癌的風險且呈現劑量關係,事實上,每 天喝 4 - 5 個酒精飲料單位的酒,造成口腔癌的風險比沒飲酒的人高出 2 - 3 倍以上(16, 17). 。哺乳類動物中,主要代謝酒精的酵素為乙醇脫氫酶 (alcohol dehydrogenase;ADH),. 當酒精進入人體吸收後,乙醇脫氫酶將酒精轉化為乙醛,再由乙醛脫氫酶 (aldehyde dehydrogenase;ALDH) 代謝成不具毒性的乙酸,最後變成二氧化碳跟水排出體外。 由於在酒精代謝過程中所產生的乙醛具有毒性,當過量的長期酗酒會導致乙醛堆積 5.
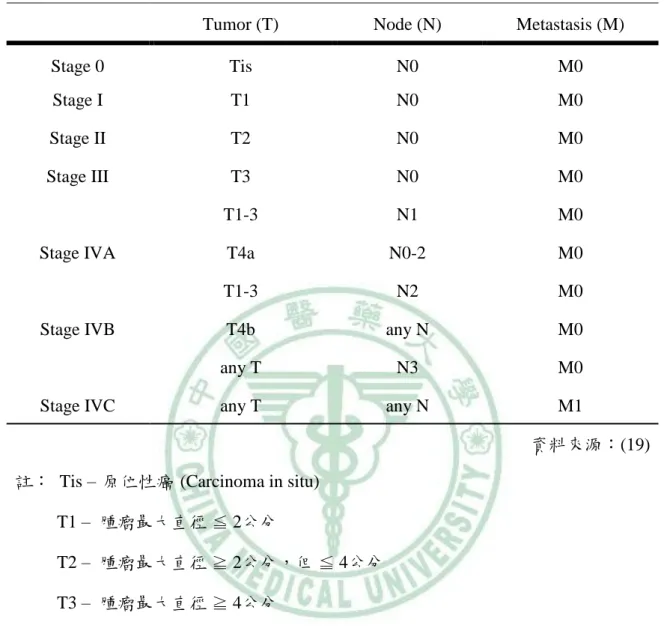
(21) 第二章. 文獻探討. 在口腔黏膜上,使口腔上皮細胞 DNA 發生變異,進而造成口腔癌的發生(16, 18)。. V. 口腔癌分期 口腔癌的臨床分期除了靠視診、觸診外,有時也須藉助電腦斷層或核磁共振檢 查才得以完整。口腔癌分期的主要目的在確立治療方式的選擇,評估預後及比較不 同治療方式的結果。依據美國癌症聯合委員會 (American Joint Committee;AJCC) 系 統將口腔癌分期為三個階段,原位腫瘤的大小(T)、頸部淋巴結轉移與否 (N) 以及 是否有遠方轉移(M)。口腔癌一般較容易轉移的部位除了頸部淋巴結外還包括肺臟、 肝臟及骨骼。以下為口腔癌的分期: 0 期:原位癌腫瘤細胞侷限於口腔黏膜上皮內。 I 期:腫瘤的最長徑小於或等於 2 公分,且無頸部淋巴結或遠方轉移。 II 期:腫瘤的最長徑大於 2 公分但不大於 4 公分,且無頸部淋巴結或遠方轉移。 III 期:腫瘤的最長徑大於 4 公分或已轉移到同側頸部一個淋巴結,此淋巴結之最長 徑不超過 3 公分。 IV 期: IVA - 腫瘤侵犯鄰近的組織 (穿過骨外層,深入深層肌肉、上頜竇、皮膚) IVB - 頭部淋巴結轉移的數目超過一個 (不論是在原發病灶的同側、對側或是 兩側都有)、或是淋巴結的最大徑已經超過 3 公分。 IVC - 已發生遠方轉移。. 6.
(22) 第二章. 文獻探討. 表 2-3 口腔癌分期 Tumor (T). Node (N). Metastasis (M). Stage 0. Tis. N0. M0. Stage I. T1. N0. M0. Stage II. T2. N0. M0. Stage III. T3. N0. M0. T1-3. N1. M0. T4a. N0-2. M0. T1-3. N2. M0. T4b. any N. M0. any T. N3. M0. any T. any N. M1. Stage IVA. Stage IVB. Stage IVC. 資料來源:(19) 註: Tis – 原位性癌 (Carcinoma in situ) T1 – 腫瘤最大直徑 ≦ 2公分 T2 – 腫瘤最大直徑 ≧ 2公分,但 ≦ 4公分 T3 – 腫瘤最大直徑 ≧ 4公分 T4a – 腫瘤侵入鄰近的組織 T4b – 腫瘤侵入咀嚼間隙、翼突板或是顱底 N0 – 無頸部淋巴結轉移 N1 – 與腫瘤同側的頸部淋巴結轉移,轉移瘤最大直徑≦ 3公分 N2 – 與腫瘤同側的頸部淋巴結轉移,轉移瘤最大直徑≧ 3公分,但≦ 6公分 N3 – 頸部淋巴結轉移,轉移瘤最大直徑≧ 6公分 M0 – 無遠方轉移 M1 – 有遠方轉移. 7.
(23) 第二章. 文獻探討. VI.口腔癌與 EGFR 在非小細胞性肺癌、乳癌以及卵巢癌等癌症中都發現 EGFR 都有過度表現的情 形(20-22),然而,口腔癌也不例外(23)。大約 90%-100% 的口腔癌患者,EGFR 皆有過 度的表現的情形,而造成口腔癌預後不佳及存活率低的問題(24, 25)。 學者進一步發現,在口腔上皮癌前期細胞轉變為口腔癌細胞時,EGFR 特別地 過度活化(26)。然而,不同的頭頸部部位的腫瘤中,EGFR 的表現也不盡相同,例如, 在咽部及口腔的腫瘤中比喉部的腫瘤有較高的 EGFR 表現(27)。此外,頭頸部癌症中, 其他 ErbB 家族的成員也有過度表現的情形,HER2 (3%-29%)、HER3 (21%) HER4 (26%)(28)。事實上,EGFR、HER2 與 HER4 的過度表現出現在侵襲癌及原位癌上, 而 HER3 的過度表現只出現在侵襲癌中(29)。 在 2004 年,Weinberger 等學者指出,EGFR 可從細胞膜轉位置細胞核中成為 轉錄因子(30, 31),然而,在口咽部癌細胞的免疫組織染色中發現,EGFR 同時存在於 細胞核與細胞質中,也與先前研究推論有相似之處,特別的是,這些帶有細胞核 EGFR 過度表現的病患,卻有較高的原位癌復發性與存活率低(32)。 總而言之,雖然治療口腔癌的方式已提升,但存活率仍然偏低,為所有癌症中 死亡率最高。再加上 EGFR 的表現與口腔癌呈現密切相關性,所以 EGFR 對口腔癌 的影響不容忽視。. 8.
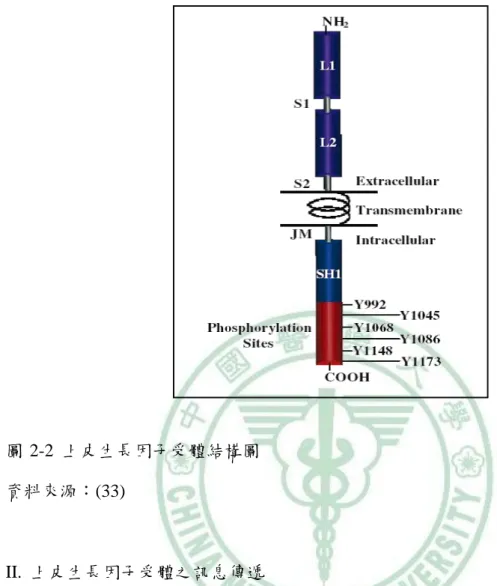
(24) 第二章. 文獻探討. 二、上皮生長因子受體 (Epidermal Growth Factor Receptor;EGFR). I. 介紹 上皮生長因子受體是一種橫跨細胞膜的受體,屬於 ErbB 家族,基因落在第七 號染色體上 7p12.1-12.3 的位置,含有 28 個表現區域 (exon), 基因體序列 (genomic sequence) 長度約為 188 kb,而 mRNA 長度約 5.6 kb,蛋白質為 1210 個胺基酸組 成,分子量為 170 kDa。具有受體酪胺酸激酶 (receptor tyrosine kinases;RTKs)的活 性,為許多訊息傳遞路徑之首,參與調控細胞增生、存活、黏附、遷移及分化(33, 34)。 上皮生長因子受體家族共包含四種不同的受體,分別為 EGFR (HER1)、HER2、 HER3 與 HER4,EGFR 是最早被發現的受體。這些受體結構依所在位置分為三個 部 分 , 細 胞 外 介 質 結 合 區 (extracellular ligand-binding domain) 、 穿 透 細 胞 膜 區 (transmembrane domain)、細胞內區 (intracellular domain)以及尾部 C 端自體磷酸化區 域 (COOH-terminal domain )(34) 。在正常的細胞中,上皮生長因子 (Epidermal Growth Factor;EGF) 廣泛分佈於所有組織中,微量的 EGF 與其受體 EGFR 結合後, 就能刺激細胞週期進行,使細胞生長及分化,維持細胞正常的代謝功能。另外,正 常的細胞中的 EGFR 表現非常微弱,且多半呈現不活化狀態,僅供維持細胞一般正 常生長。一般而言,當細胞受損時,游離的 EGF 就會自然的聚集,與其受體結合 後,促進下游訊息傳遞路徑,增加生物活性等,使細胞分裂、增殖以、分化及修復 後再生。. 9.
(25) 第二章. 文獻探討. 圖 2-2 上皮生長因子受體結構圖 資料來源:(33). II. 上皮生長因子受體之訊息傳遞 ErbB 家族四個成員 EGFR、HER2、HER3 與 HER4 是典型的受體酪胺酸激酶, 具有細胞外配體結合位點、單次α-螺旋跨膜區以及胞漿蛋白酪胺酸激酶結構區。當 ErbB 受體與配體結合時會發生結構改變,然而,ErbB 受體能夠識別特定的配體, 意謂著不同配體與相同之 ErbB 受體結合後會使不同的酪胺酸殘基發生磷酸化,同 時,ErbB 受體具有配體選擇性,而選擇性的激活下游不同的訊息傳遞路徑以及溶酶 體降解路徑(35, 36)。而其中上皮生長因子 (epidermal growth factor;EGF)、轉化生長 因子 (transforming growth factor;TGF-α)、雙調蛋白 (amphiregulin;AR) 以及表原 (epigen;EPG) 易與 EGFR 結合。另外,β細胞素 (betacellulin;BTC)、肝素結合性 表皮生長因子 (heparin-binding EGF;HB-EGF) 以及表皮調節素 (epiregulin;EPR) 易. 10.
(26) 第二章. 文獻探討. 與 EGFR 及 HER4 結合。而神經調節素 (neuregulins;NRG) 家族的配體,NRG-1、 NRG-2、NRG-3 和 NRG-4 可與 HER3 及 HER4 結合,但不會與 EGFR 結合(37)。 當 配 體 與 受 體 結 合 後 , 會 使 受 體 成 為 同 質 雙 元 體 (homodimer) 或 異 直 雙 元 體 (heterodimer) 的形式,並活化受體酪胺酸激酶,使受體尾端的酪胺酸殘基 (tyrosine residues) 磷酸化(38)。而被磷酸化的酪胺酸殘基會被含有 Src 同源體 2 (Src-homology 2 domains;SH2) 的蛋白質結合,例如, Grb2、Shc 以及 PLCγ,進而活化下游的訊 息傳遞(39, 40)。EGFR 主要活化的下游訊息傳遞路徑包括,Ras-Raf-MEK-ERK1/2、 STAT3 以及 STAT5,這些路徑作用於調控基因轉錄、細胞週期 G1-S 期與細胞的增 生、分化(41, 42) ;然而,PI3K-Akt-mTOR 路徑則與細胞存活及抗細胞凋亡有關(43-45)。. 圖 2-3 ErbB 接受體與其配體 資料來源:(37). 11.
(27) 第二章. 文獻探討. 圖 2-4 上皮生長因子受體的訊息傳遞 資料來源:http://www.bio-itworld.com/issues/2008/april/amgen.html. III. EGFR 磷酸化位點 EGFR 酪胺酸磷酸化位點位於細胞內區的尾部 C 端自體磷酸化區域,約 194 個 胺基酸位置(46)。在體內實驗中,有五個 EGFR 自體磷酸化位點已被確定,分別為三 個主要磷酸化位點,Tyr1068、Tyr1148 和 Tyr1173;另外,還有兩個次要的磷酸化位點, Tyr992 以及 Tyr1086。然而,隨著這些磷酸化位點的不同,所活化下游的路徑也有區 別(46-49)。以下為常見位點及其作用之介紹: Tyr845 當此位點磷酸化時,穩定 EGFR 活化環,且保持其活性,提供與其他蛋白質結 合,使 c-Src 磷酸化,活化 Shc-Grb2-Sos-Ras-MAPK 路徑,進而促使細胞增生與腫 瘤的形成(50-52)。. 12.
(28) 第二章. 文獻探討. Tyr992 可與含有 SH2 區的 PLCγ 結合,而促使 PLCγ 活化,水解 PIP2 而生成 PI3,進 而造成鈣離子的釋放,此外 PLCγ 的活化也與細胞存活及侵襲能力有關(53,54)。 Tyr1045 此位點磷酸化後,會生成與 c-CBL 的接合位點,而導致泛素化 (ubiquitination) 與 EGFR 的降解作用(55,56)。 Tyr1068、Tyr1086 與輔助蛋白 Grb2 的 SH2 區結合後,活化下游 Sos-Ras-MAPK 訊息傳遞路徑, 調節細胞增生與分化(57)。 Tyr1148、Tyr1173 此位點磷酸化後,會生成與 SHC 鷹架蛋白的接合位點,而參予 MAPK 路徑與 p85-PDK-Akt 路徑(58)。. 圖 2-5 標準的 EGFR 訊息傳遞路徑與磷酸化位點 資料來源:(59). 13.
(29) 第二章. 文獻探討. IV. EGFR 與氧化壓力 Bae 等學者指出,血小板源生長因子 (platelet-derived growth factor;PDGF) 以 及 EGF 等配體的刺激可使細胞短時間內產生活性氧物質,而與受體酪胺酸激酶-Ras 的路徑有關(60,. 61). 。當配體與受體結合使酪胺酸激酶活化後,伴隨著 SOS (Son of. sevenless;Ras- specific guanine exchange factor) 表現,而與受體酪胺酸激酶及 Grb2 形成複合體,接著促進 Ras 上的 GDP 轉換為 GTP,並轉位至細胞膜上,進而活化 NADPH 氧化酶之 Rac 的表現,促使超氧化物及其他活性氧物質的產生(62)。 另一方面,刺激配體而產生的活性氧物質,除了增加細胞內氧化壓力外,也同 時可藉由抑制蛋白質酪胺酸水解酶 (protein tyrosine phosphatase;PTP) 的活化來調節 受體酪胺酸激酶的磷酸化,而扮演著訊息傳遞的角色 (63,. 64). 。而受體酪胺酸激酶與. PTP 此兩酵素的作用互相結抗,對於調控細胞酪胺酸的磷酸化扮演著重要的角色(65, 66). 。當細胞處於氧化壓力下,可調節蛋白的半胱胺酸殘基 (cysteine residues),形成. 穩定的 Cys-SOH 結構(67),將 PTP 上的半胱胺酸殘基轉變成穩定的氧化態結構,抑 制了 PTP 的活性,而無法阻斷受體酪胺酸激酶的促磷酸化及 EGFR 的訊息傳遞路 徑(68-70)。因此,EGFR 的活化與 ROS 的產生有關,而其結果更導致 EGFR 訊息傳 遞路徑的持續進行,這樣的惡性循環,造成了細胞增生。. V. EGFR 與 HBP1 由上述得知,當 EGFR 受到生長因數刺激後,會使細胞質內的 Ras 活化,進而 活化 NADPH 氧化酶,增加細胞中 ROS 的生成(71, 72)。而生成的 ROS 會抑制細胞質 中的 PTPase (Protein Tyrosine Phosphatase) 的活化,進而也刺激 EGFR 訊息傳遞路 徑,造成細胞週期的進行,促進細胞增生(73, 74)。 然而,NADPH 氧化酶為細胞內活性氧化物生成的重要酵素複合體,其次單位 p47phox 之啟動子上含有 HBP1 之 DNA 結合序列,進而抑制 p47phox 的轉錄作用。. 14.
(30) 第二章. 文獻探討. 使 NADPH 氧化酶無法活化而降低超氧化物的生成(75)。在本實驗室先前的研究發現, HBP1 藉由抑制 p47phox 的轉錄,影響細胞內氧化還原的帄衡,進而抑制 EGFR 的活 性。 在口腔癌中 EGFR 通常有過度表現的情況,但是,由於 EGFR 的自體磷酸化 位點位於細胞質面,當突變的 EGFR 持續不斷的自發性磷酸化時,更造成口腔癌的 惡化以及預後不良。因此,尋找另一種可由細胞內調控 EGFR 活化的新途徑將可彌 補或協同目前用於抑制 EGFR 藥物的功效,進而更有效治療 EGFR 異常表現的相關 癌症。或許,能藉由直接調控 HBP1 的活性,而抑制因 EGFR 過度表現而造成的訊 息傳遞路徑活化,則 HBP1 在口腔癌的治療與預防上扮演重要的角色。. 15.
(31) 第二章. 文獻探討. 三、HBP1 (HMG (High-mobility group) - Box Protein 1). I. 介紹 HBP1 為一個轉錄抑制因子,屬於 HMG (high-mobility group) 家族的成員,大 小約 513 個胺基酸,其結構包含,HMG-box DNA 結合區 (HMG-box DNA binding domain)、抑制區 (repression domain)、RB 結合區 (RB binding domain) 以及 p38 結 合區 (p38 binding domain)。. 圖 2-6 HBP1結構圖 資料來源:(76). II. HBP1 轉錄因子調控細胞生長 HBP1 最早被發現於大鼠的腦部,而基本功能為抑制酵母菌其鉀離子運輸缺陷 之突變,成為鉀離子通道缺陷的補充劑(77),然而,有趣的是,鉀離子通道與細胞分 化及癌症的發展有顯著的相關性(78)。隨後,有關 HBP1 調控細胞生長週期與癌症的 研究相繼出現。 在 1998 年,Dr. Yee 等學者指出,HBP1 可以抑制細胞週期,而抑制細胞的增 生,而在肌肉細胞中,當細胞週期停滯的情況下,HBP1 的活化會促使肌肉細胞分 化(79)。然而,在 HBP1 過度表現的細胞中,可誘導細胞週期停滯在 G1/S 期(80)。因 此,在細胞及動物的細胞週期實驗確立了 HBP1 在調控 G1 期發展的角色。這樣的 發現,也顯示出 HBP1 藉由抑制細胞週期的活化因子,進而抑制細胞增生。. 16.
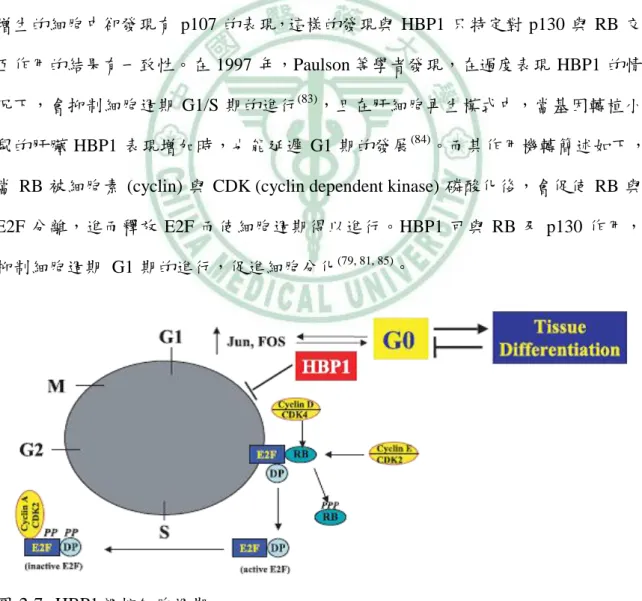
(32) 第二章. 文獻探討. 更重要的是,HBP1 具有抑制細胞週期的功能,也表示 HBP1 具有抑制腫瘤發 展的潛在功能。HBP1 調控癌症的路徑大致上分為兩種,第一,HBP1 可抑制 Wnt 訊 息傳遞路徑的標的基因。HBP1 與癌症的第二個連結,則是透過 p38 MAPK 訊息傳 遞路徑的調控。 i. HBP1 與 RB HBP1 對於抑制細胞增生的功能與 RB (retinoblastoma) 對細胞分化與 G1 期的 調控相似(76)。RB 家族 (RB、p107、p130) 中,RB 與 p130 被認為是調控細胞週期 與細胞分化的主要因子(81, 82)。然而,p107 在細胞分化中的功能還尚未清楚,但是在 增生的細胞中卻發現有 p107 的表現,這樣的發現與 HBP1 只特定對 p130 與 RB 交 互作用的結果有一致性。在 1997 年,Paulson 等學者發現,在過度表現 HBP1 的情 況下,會抑制細胞週期 G1/S 期的進行(83),且在肝細胞再生模式中,當基因轉植小 鼠的肝臟 HBP1 表現增加時,也能延遲 G1 期的發展(84)。而其作用機轉簡述如下, 當 RB 被細胞素 (cyclin) 與 CDK (cyclin dependent kinase) 磷酸化後,會促使 RB 與 E2F 分離,進而釋放 E2F 而使細胞週期得以進行。HBP1 可與 RB 及 p130 作用, 抑制細胞週期 G1 期的進行,促進細胞分化(79, 81, 85)。. 圖 2-7 HBP1 調控細胞週期 資料來源:(76) 17.
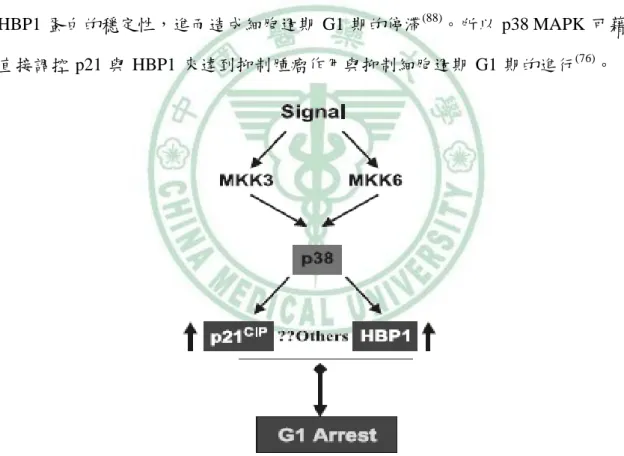
(33) 第二章. 文獻探討. ii. HBP1 與 p38 MAPK 當 p38 MAPK 路徑活化時,參與細胞凋亡及造成胞週期停滯,具有抑制腫瘤的 作用,然而,p38 MAPK 的活性喪失與癌症的發生有關(76)。另外,CDK 抑制者 p21 是抑制細胞週期 G1 期進行的重要因子,而其作用機轉為阻斷 CDK 的活性。在不 同的肝細胞再生模式中都指出,HBP1 與 p21 皆能阻斷細胞週期 G1 期的進行(79, 86)。 在 2002 年,Kim 等學者發現,p38 MAPK 可作用於 p21 的磷酸化位點上 (Ser190), 而增加 p21 蛋白的穩定性 (87) 。另外 p38 MAPK 的接合位點 (aa 81–125) 與 p38 MAPK 的磷酸化位點 (Ser 401),皆在 HBP1 蛋白中被發現,而 p38 MAPK 可增加 HBP1 蛋白的穩定性,進而造成細胞週期 G1 期的停滯(88)。所以 p38 MAPK 可藉由 直接調控 p21 與 HBP1 來達到抑制腫瘤作用與抑制細胞週期 G1 期的進行(76)。. 圖 2-8 HBP1 為p38 MAPK 路徑之作用目標 資料來源:(76). 18.
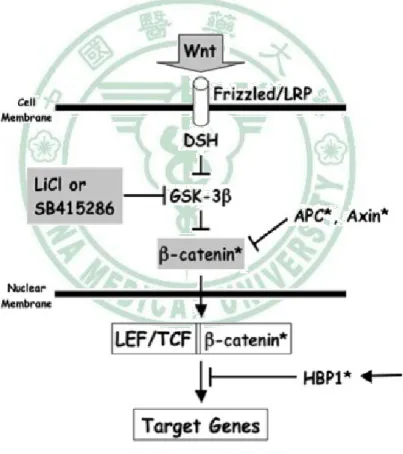
(34) 第二章. 文獻探討. iii. HBP1 抑制 Wnt 訊息傳遞路徑 Wnt 的訊息傳遞與乳癌、直腸癌及其他癌症的發生有關(89,. 90). 。當 Wnt 訊息傳. 遞路徑持續活化時,抑制細胞內 β-catenin 的裂解,而增加其穩定性,使 β-catenin 在 細胞質裡堆積後,並轉位至細胞核中與 Tcf/Lef 轉錄因子形成複合體,促進下游基 因表現,例如,cyclinD1 以及 c-myc,進而促使細胞異常增生而導致癌化(90)。然而, HBP1 可藉由與 Lef/Tcf 競爭結合到 cyclin D1 以及 c-myc 之啟動子上,降低基因的 轉錄作用(91),進而抑制細胞增生、侵襲及轉移的能力。. 圖 2-9 HBP1 標的基因-Wnt 資料來源:(91). 19.
(35) 第二章. 文獻探討. iv. HBP1 抑制 NADPH 氧化酶之次單位 p47phox 的表現 NADPH 氧化酶為細胞內活性氧化物生成的重要酵素複合體,其次單位 p47phox 的啟動子 -1243 至 -1318 處上含有 HBP1 之 DNA 結合序列,且有實驗證實,HBP1 可藉由結合至啟動子上來抑制 p47phox 的轉錄,使 NADPH 氧化酶無法活化而降低 超氧化物的生成(75)。然而,在本實驗室先前的研究發現,HBP1 藉由抑制 p47phox 的 轉錄,影響細胞內氧化還原的帄衡,進而抑制 EGFR 的活性。. 圖 2-10 p47phox 之啟動子 資料來源:(75). 圖 2-11 HBP1 調控 NADPH 氧化酶 資料來源:(75). 20.
(36) 第二章. 文獻探討. III. HBP1 與癌症 在 2001 年,Lin 等學者發現,人類骨髓細胞、B 淋巴細胞及一些非骨髓細胞中 有較高的 HBP1 表現,與骨髓細胞的分化完全有關。然而,原位性乳癌 (ductal carcinoma in situ;DCIS) 及急性骨髓性白血病 (acute myeloid leukemia;AML) 中, HBP1 轉錄因子常有突變的情形發生。在骨髓細胞中,HBP1 可抑制腫瘤生長且促 進骨髓細胞的分化完全,抑制紅白血病細胞的生長(92)。此外,在原位性乳癌中,HBP1 可以抑制細胞週期的進行、抑制 wnt 訊息傳遞路徑以及抑制標的基因 cyclinD1 與 c-myc,進而抑制乳癌細胞的增生。另一方面,當細胞中 HBP1 表現降低時,會增加 乳癌的侵襲及轉移的能力 (93) 。而在本實驗室先前的研究也發現,轉錄抑制因子 HBP1 可以經由氧化還原的調控,進而抑制乳癌細胞配體依賴型之 EGFR 訊息傳遞 路徑。事實上,在口腔癌中 EGFR 通常有過度表現的情況,且尚未有研究探討 HBP1 與口腔癌的關係,若能藉由直接調控 HBP1 的活性,而抑制因 EGFR 過度表現而造 成的訊息傳遞路徑活化,則 HBP1 在口腔癌的治療與預防上扮演重要的角色。. 圖 2-12 正常 HBP1 與突變的 HBP1 結構 資料來源:(93). 21.
(37) 第二章. 文獻探討. 四、NAC (N-acetyl-L-cysteine). I. 介紹 NAC 為 L-半胱胺酸 (L-Cysteine) 中的胺基 (NH2) 上加一個乙醯基 (Acetyl; -CO-CH3),而其乙醯基的功能可以使口服的胱胺酸更容易消化吸收。而其結構中的 含硫基團可以產生抗氧化的功能。NAC 是麩胱甘肽 (Glutathione;GSH) 的前驅物, 所以,NAC 的攝取可增加體內 GSH 的含量。. 圖 2-13 Cysteine 與 NAC 之結構 資料來源:http://www.benbest.com/nutrceut/NAC.html. II. NAC 與 GSH GSH 是由榖胺酸 (Glutamic acid)、半胱胺酸 (Cysteine) 以及甘胺酸 (Glycine), 三個胺基酸在細胞內連結而成,基本上,GSH 存在全身體內所有的細胞中,許多重 要器官的運作都需要靠 GSH 的幫助,也是人體內最主要的抗氧化酵素。另外,組 成 GSH 的三種胺基酸中,甘胺酸與榖胺酸可由食物中得到足夠的來源,然而,食 物中以及體內的半胱胺酸來源稀少,則限制了 GSH 的合成,因此,半胱胺酸才是 決定 GSH 合成的關鍵。單一補充 GSH 並無法提高體內 GSH 的含量,因為 GSH 幾 乎無法進入細胞中,儘管補充 GSH 後,亦會被胃蛋白酶消化分解,變成胺基酸, 對於 GSH 的合成並無幫助。然而,決定 GSH 合成關鍵的半胱胺酸,並非為人體必. 22.
(38) 第二章. 文獻探討. 需胺基酸,是可由其他胺基酸轉換而得,但因半胱胺酸的結構並不穩定,吸收率及 轉換為 GSH 的效率不高。而 NAC 為半胱胺酸的前驅物,所以補充 NAC 就可以立 即提高體內 GSH 的含量。. III. NAC 與癌症 最早於 1960 年,已有實驗證明,對於治療呼吸性疾病上,NAC 廣泛地被使用 作為化痰藥物(94-96)。1984 年後,NAC 抗癌抗腫瘤的效果陸續被研究證實,例如, 肺癌、皮膚癌、頭頸部癌症、乳腺癌以及肝癌(97,. 98). 。而 NAC 的抗癌能力,著重在. 於氧化還原帄衡狀態及 ROS 的調節(97)。以下為 NAC 調控癌細胞生長的主要生理功 能: i. NAC 與抗突變:NAC 可以直接減低突變物質的破壞、阻斷原突變物的代謝以及 與亞硝酸鹽結合並抑制亞硝基化反應 (nitrosation reaction)(99-101)。 ii. NAC 與抗氧化:NAC 具有捕捉活性氧物質、抑制 COX-1 所誘導致癌物的活化以 及抑制 COX-2 的表現以及抑制發炎反應及病毒誘導的脂質過氧化(102-104)。 iii. NAC 對粒線體的影響:增加 complex I、IV 以及 V 的活性並且抑制依年紀降低 的氧化磷酸化反應 (105) 、增加 ATP 的含量 (106) 、抑制粒線體 DNA 的附合物 (adducts) 的形成(107)、預防粒線體膜電位的降低(108)以及減少粒線體突觸的蛋白質 碳基含量(109)。 iv. NAC 與 DNA 的修復:抑制自發性的突變與基本的 DNA 修復有關 (110)、修正 DNA 的低甲基化情形(111)以及保護細胞核酵素,例如,PARP,以及增強 DNA 的 修復功能(112)。 v. NAC 抑制基因毒性以及細胞的轉型:抑制突變以及 DNA 的損傷、抑制化學物誘 導的細胞轉型以及保護遺傳細胞的變異(113)。 23.
(39) 第二章. 文獻探討. vi. NAC 調節基因表現以及訊息傳遞路徑:轉錄後修飾增加 p53 的表現(114)、抑制 RB 蛋白的磷酸化進而抑制細胞生長(115)、抑制 c-fos 以及 c- jun 的活化(116)、抑制轉 錄因子 AP-1 的活化以及結合能力、抑制轉錄因子 NFκB 的活化以及細胞核的轉 位(117, 118)、促進 ERK-MAPK 的磷酸化(119)、誘導 p16(INK4a) 以及 p21(WAF/CIP1) 的基因表現,延長細胞週期 G1 期(120)。 vii. NAC 抑 制腫 瘤 細胞 的 增生 與 形成 :抑制 血 管內 皮 細胞 生長因 子 (vascular endothelial growth factor;VEGF) 的分泌以及抑制肺癌的惡化及形成。另外,NAC 可抑制 TPA 所誘發的 cyclin D1 與 DNA 合成以及透過 p38 MAPK 路徑而抑制 不正常的細胞週期進行(121, 122)。. IV. NAC 與 EGFR 先前有研究指出,NAC 可以藉由降低細胞內 ROS 的產生,而誘導 PTP 的活化, 進而抑制 EGF 的雙聚體化以及 EGFR 活化(123)。另外本實驗室先前研究指出,NAC 顯著地抑制 EGFR 以及下游 Akt 的活化情形,然而其抑制 EGFR 訊息傳遞路徑的 機制尚未清楚。在本實驗室先前的研究發現,HBP1 藉由抑制 p47phox 的轉錄,影響 細胞內氧化還原的帄衡,進而抑制 EGFR 的活性。Zhang 等學者發現,NAC 可以抑 制 NADPH 氧化酶次單位 Rac 、 gp91phox 以及 p47phox 的表現與活化(124)。這樣的結 果顯示,NAC 與轉錄抑制因子 HBP1 的功能有類似之處,皆可以調控 p47phox 的表 現以及 EGFR 訊息傳遞路徑,針對於此,本實驗中將探討 NAC 對 HBP1 的影響。. 24.
(40) 第二章. 文獻探討. 五、RNA 干擾術 (RNA interference;RNAi). I. 介紹 RNAi 最早於 1990 年時被發現,起初欲想將查爾酮合酶 (chalcone synthase) 的 基因轉殖於矮牽牛花中,希望能藉由增加一套基因而使花色更鮮豔。結果卻發現轉 殖的基因沒有表現,且造成原本存在的基因失去功能而出現白花,當時稱此現象為 「共同抑制 (co-suppression)」。直到 1998,Fire 與 Mello 在線蟲 (Caenorhabditis elegans) 中也發現類似的 RNA 干擾現象,並首度被稱為 RNAi。在 2001 年初, Thomas Tuschl 首先證明了在哺乳動物細胞中,亦可以使用 RNAi 來抑制特定基因 的表現,因此 RNAi 技術也由植物延伸到了哺乳類動物,對於其機制也有了更深入 的了解。然而到 2006 年時,RNAi 技術也透過諾貝爾獎受到肯定(125)。. II. 原理 RNAi (RNA interfering) 是利用細胞內的雙股 RNA 所引發的基因降解作用。長 鏈的雙股 RNA 先經由 Dicer (一種RNase) 將其切割成多個小段,每段約 19~25 nt, 稱為小干擾 RNA (small interfering RNA),也就是所謂的 siRNA。 siRNA 會被細胞 質中的核糖核酸誘導沉默複合體 (RNA-induced silencing complex;RISC) 辨識並結 合,使雙股的 siRNA 解開,形成 sense 與 antisense 兩個單股的 RNA,並將其中的 正義股 (sense) 分解,保留反義股 (antisense)。而保留的反義股則會引導 RISC,利 用其序列專一性找到目標 mRNA,之後 mRNA 會被 RISC 切斷,使其無法轉譯為 蛋白質,因此標的基因的表現遭受抑制且失去其功能(125-127)。. 25.
(41) 第二章. 文獻探討. 圖2-14 RNAi 之作用原理 資料來源:(126). III. 應用 RNAi 技術的應用相當廣泛,在生物醫學方面,因為 RNAi 技術可以非常的快 速且有效地抑制基因的表現,然而,許多疾病與癌症的發生是因為特定基因表現異 常或過度表現,藉由 RNAi 技術來有效抑制這些異常或過度活化的基因。理論上說, 若能關閉致病基因的表達,則達到治療疾病與癌症的效果。在動物實驗中已證明, 可以透過 RNAi 的方法抑制導致血膽固醇升高的基因;病毒性疾病,眼疾,心血管 代謝性疾病等方面的臨床試驗也正在進行中。因此,透過 RNAi 技術的基因「默化」 機制,將病毒的複製或致病機轉關閉,未來將可應用於治療癌症、病毒感染甚至預 防疾病的發生。. 26.
(42) 第二章. 文獻探討. 六、實驗目的與動機. 全世界口腔癌的發生率逐年增加,且其預後存活率仍然偏低。然而,大約有 55~100% 的口腔癌患者,其 EGFR 有過度表現的情形,而且也造成口腔癌預後不佳 及存活率低的問題。EGFR 以及其突變型 (EGFR variant III) 已知在許多腫瘤細胞過 度表現,尤其是口腔癌。由此可知,對於治療口腔癌,EGFR 扮演著革命性的角色。 我們先前研究發現,轉錄抑制因子 HBP1 (HMG box protein 1) 可藉由對氧化還原帄 衡的調控,而抑制乳癌細胞 EGFR 的訊息傳遞,但 HBP1 在口腔癌調控的角色尚未 被探討。 已有研究顯示,NAC (N-acetylcysteine) 具有調節身體體內氧化還原帄衡的能力, 而且是一個有效的自由基清除劑,有許多研究證實,NAC 具有抗癌抗腫瘤的效果。 因此,也開始有許多研究發現 NAC 能透過許多不同的機制來達到抑制癌症的發生。 同時,NAC 亦有抑制 EGFR 以及下游 Akt 活化,但其機制尚未完全清楚。本研究 主要是探討 NAC 是否藉由活化 HBP1 來抑制 EGFR 的訊息傳遞路徑。希望此研究 將提供轉錄因子 HBP1 為一個治療口腔癌的重要標的,對於口腔癌的防治有進一步 的貢獻。. 27.
(43) 第三章. 第三章、材料與方法 一、實驗設計. HSC-3. NAC 對口腔癌細胞的生長抑制. 細胞計數測試存活率 生長曲線. 利用流式細胞儀測試 細胞週期分佈. NAC 是否誘發 HBP1 的表 現並抑制 EGFR 訊息傳遞 路徑 EGFR 與 Akt 活性 p47phox mRNA 表現 ROS 含量. HBP1 蛋白 HBP1 mRNA. NAC 是否透過誘導 HBP1 的表現而抑 制 EGFR 的活化. HBP1 表現降低: 減低 NAC 對細胞生長的抑制 減低 NAC 對 EGFR 活化的抑制. 28. 材料與方法.
(44) 第三章. 材料與方法. 二、實驗藥品與儀器 藥品:. 名稱. 廠牌. 儲藏溫度. Acrylamide. Genepure. 4℃. Agarose. AMRESCO®. 室溫. Ampicillin. Bio Basic Inc.. 4℃. Ammonium Persulfate. J. T. Baker. 室溫. β-mercaptoethanol. J. T. Baker. 室溫. Bovin Serum Album. USBiological. 4℃. Bromophenol Blue. Bio Basic Inc. 室溫. Deoxycholate. Sigma. 室溫. DMSO. Sigma. 室溫. Dulbecco’s Modified Eagle Medium. Gibco. 4℃. Dulbecco’s Modified Eagle Medium : Nutrient Mixture F-12 Ham (1:1). Gibco. 4℃. Dual light. Applied Biosystems. 4℃. ECL. PerkinElmer. 4℃. EDTA. J. T. Baker. 室溫. Ethanol. 東華化工. 室溫. Etidium Bromide. Genepure. 4℃. A. B. D. E. F. 29.
(45) 第三章. 材料與方法. Fetal Bovine Serum. Gibco, USA. -20℃. FuGENE® 6. Roche. 4℃. Glycine. USBiological. 室溫. Isopropanol. Sigma. 室溫. L-Glutamine. Gibco. -20℃. LipofectamineTM 2000. invitrogen. 4℃. Lucigenin. Sigma. 4℃. Luria Bertani medium. Himedia. 室溫. Luria Bertani Agar. Himedia. 室溫. NaCl. AMRESCO®. 室溫. N-acetylcysteine. sigma. 4℃. OPTI-MEM® I. Gibco. 4℃. 10x PBS. UniRegion Bio-Tech. 室溫. Penicillin/Streptomycin. Gibco. -20℃. Phosphatase Inhibitors Cocktail. Sigma. -20℃. Polybrene. Sigma. -20℃. Protease Inhibitors Cocktail. Sigma. -20℃. Protein Assay Dye Reagent Contrate. BioRad. 4℃. Puromycin. Sigma. -20℃. G. I. L. N. O. P. 30.
(46) 第三章. 材料與方法. S SDS. Merck. 室溫. Sodium Bicarbonate. Sigma. 室溫. 50x TAE. UniRegion Bio-Tech. 室溫. TEMED. J. T. Baker. 室溫. Tris-base. USBiological. 室溫. Triton X-100. J. T. Baker. 室溫. Trypsin. Gibco. -20℃. Tween 20. Showa. 室溫. T. 儀器: 名稱. 廠牌. 倒立式顯微鏡. Olympus. 離心機. Sigma. 微量離心機. DENVILLE. iCycler. BioRad. MultilmageTM Light Cabinet. Alpha Innotech Corporation. Mulpid® -2 plus electrophoresis. ADVANCE. CLC-110 chemiluminescence detector. TOHOKU. CLC-10 CL counter. TOHOKU. PowerPacTM Basic Power Supply. BioRad. Mini-PROTEAN® 3 Cell. BioRad. Mini Trans-Blot® Electrophoretic Transfer Cell. BioRad. 31.
(47) 第三章. 材料與方法. 三、細胞培養( Cell Culture ) 資料來源:(128-130) I. 細胞株及細胞培養條件 人類口腔癌細胞株 HSC-3 以及 SCC-4,分別受贈自楊新玲教授與鍾景光教授實 驗室,將細胞培養於含有 10% Fetal Bovine Serum 與 1% Antibiotic Antimycotic 之 DMEM/F12 中,置於 37℃、5% CO2 之培養箱內培養,每隔 2~3 天更換一次培養 液,當細胞長至八分滿時即進行繼代培養。 HEK-293T 人類胚胎腎臟上皮細胞株以及人類口腔癌細胞株 TW-206,分別受 贈自賴志河教授與鍾景光教授實驗室,將細胞培養於含有 10% Fetal Bovine Serum 與 1% Antibiotic Antimycotic 之 DMEM 中,置於 37℃、5% CO2 之培養箱內培養, 每隔 2~3 天更換一次培養液,當細胞長至八分滿時即進行繼代培養。. II. 試劑配製 DMEM/F12 Dulbecco’s Modified Eagle Medium : Nutrient Mixture F-12 Ham (1:1) 取一包粉末, 內含 15 mM HEPES buffer、L-glutamine、pyridoxine hydrochloride 溶於 800 ml 的無 菌水中,加入 1.2 g NaHCO3 (Sigma)。溶解後調整 pH 值至 7.1-7.2 之間,再加入 10% FBS (Fetal bovine serum) 以及 1% Antibiotic Antimycotic,混合後將體積定量至 1000 ml。最後將配好之溶液移至無菌操作台中,以 0.22 μm 血清瓶專用無菌過濾膜過濾, 保存於 4℃。 DMEM Dulbecco’s Modified Eagle Medium (DMEM) 粉末溶於 800 ml 的無菌水中,加 入 1.5 g NaHCO3 (Sigma),溶解後調整 pH 值至 7.1-7.2 之間,再加入 10% FBS (Fetal bovine serum) 以及 1% Antibiotic Antimycotic,混合後將體積定量至 1000 ml。最後 32.
(48) 第三章. 材料與方法. 將配好之溶液移至無菌操作台中,以 0.22 μm 血清瓶專用無菌過濾膜過濾,保存於 4℃。. 1× 磷酸緩衝液(phosphate-buffer saline ; PBS) 由 10× PBS (UniRegion Bio-Tech) 中取出 100 ml 溶在 900 ml 的二次水中,再經 121℃、30 分鐘高壓滅菌後使用並放於室溫備用。. III. 繼代培養 將培養盤中之培養液吸除後,加入 10 ml 滅過菌之 PBS 清洗 1 至 2 次。加入 1 ml trypsin-EDTA,放入 37℃ 培養箱中培養 5 分鐘後,於倒立顯微鏡下觀察細胞是 否全數脫落。確定細胞完全脫落後,加入 10 ml 培養液中和 trypsin 的作用,並將細 胞液取出放入 15 ml 離心管中,以 1000 rpm 速度離心 5 分鐘後,去除上清液,加 入適量的培養液將細胞打散後,取 40 μl 細胞懸浮液與等量之 trypan blue 溶液混合 均勻,用細胞計數器 (hemocytometer) 計數細胞數,依實驗需要之細胞密度均勻的 分至培養盤中,置於 37℃、5% CO2 之培養箱內培養。. IV. 細胞冷凍 將生長狀態良好的細胞之培養液吸除後,加入 10 ml 滅過菌之 PBS 清洗 1 至 2 次。加入 1 ml trypsin-EDTA,放入 37℃ 培養箱中培養 5 分鐘後,於倒立顯微鏡 下觀察細胞是否全數脫落。確定細胞完全脫落後,加入 10 ml 培養液中和 trypsin 的 作用,並將細胞液取出放入 15 ml 離心管中,以 1000 rpm 速度離心 5 分鐘後,去 除上清液,每管加入 2 ml 含有 7% DMSO 的培養液,分裝 1 ml 至冷凍保存管中, 先放入 4℃ 冰箱裡 10 分鐘後,移至 -20℃ 放置 30 分鐘後,之後放到 -80℃ 中 24 小時,最後移至液態氮中保存。. 33.
(49) 第三章. 材料與方法. 四、細胞生長率 (Growth) 與存活率 (Viability) 測定 資料來源:(131,132) I. 原理 正常細胞由於細胞膜完整,遇到加入 trypan blue 染劑時,則不會被染色,呈現 亮點為活細胞;反之,死細胞或是受損的細胞則因細胞膜通透性已被破壞,染劑可 進入細胞內加以染色,成為藍色細胞。細胞生長率亦稱為 subconfluent,也就是將細 胞種到未全滿的階段,加入藥物試劑反應,確認是否會抑制細胞生長;細胞存活率 亦稱為 confluent,也就是將細胞種到全滿的階段,加入藥物試劑反應,確認藥物是 否對細胞具有毒性的分析方法。. II. 試劑配製 100 mM NAC 分子量為 163.2,取 0.4896 g 之 NAC (sigma),加入 20 ml 滅過菌之 PBS ,調 整 pH 值至 7.0 後,用 PBS 定量至 30 ml,移至無菌操作台,以 0.22 μm 的濾膜過濾 後放置 - 20℃ 儲存。. III. 細胞型態觀察 在 6 孔盤中種下 5×105 顆的 HSC-3 細胞,等至細胞貼附後,加入不同濃度的 NAC 處理 12、24 及 48 小時後。以倒立式顯微鏡 (phase microscope) 觀察細胞型態 並拍攝存檔。. IV. 實驗步驟 細胞生長率分析 在 6 孔盤中種下 3×105 顆的 HSC-3 細胞,等至細胞貼附後,加入不同濃度的 34.
(50) 第三章. 材料與方法. NAC 處理 12、24 及 48 小時,將細胞以 trypsin-EDTA 打下後,取細胞懸浮液中的 50 μl 再加上 100 μl 的 trypan blue,混合均勻後,以血球計數器來計算未被染色的 HSC-3 細胞數目。 細胞存活率分析 在 6 孔盤中種下 5×105 顆的 HSC-3 細胞,等至細胞貼附後,加入不同濃度的 NAC 處理 12、24 及 48 小時,將細胞以 trypsin-EDTA 打下後,取細胞懸浮液中的 50 μl 再加上 100 μl 的 trypan blue,混合均勻後,以血球計數器來計算未被染色的 HSC-3 細胞數目。 細胞計數 將細胞懸浮液與 trypan blue 按比例體積混合,取出 20 μl 混合液注入血球計數 盤凹槽中,於倒立式顯微鏡下觀察計數。計算計數盤中上下共十大方格中細胞總數 後除以十,乘以稀釋倍數,最後再乘以 104 (血球計數盤每一方格的體積為 10-1 mm3), 及為每毫升中細胞懸浮液之細胞數。. 35.
(51) 第三章. 材料與方法. 五、細胞週期 (Cell Cycle) 分析 資料來源:(133) I. 原理 細胞週期大致可分為四個不同時期,G1 phase、G2 phase、S phase 以及 M phase。 由於各時期的 DNA 含量不同,通常正常細胞的 G1/ G0 期具有二倍體細胞的 DNA 含量 (2N),而 G2/ M 期具有四倍體細胞的 DNA 含量 (4N) ,而 S 期的 DNA 含量 介於二倍體和四倍體之間。因此,利用 PI (propidium iodine) 染細胞核中的核酸,再 射入特定波長的雷射光,激發光的強弱即反映出細胞內核酸的多寡,將細胞週期各 時相區分為 G1/ G0 期、S 期和 G2/ M,並可通過特殊軟體計算各時期的百分率。. II. 試劑配製 Propidium Iodine (PI) 染劑 Component Propidium Iodine Triton X-100 RNase A PBS. Stock solution. Final solution. Volume. 100 μg/ml. 4 μg/ml. 40 μl. 10 %. 1%. 100 μl. 100 mg/ml. 0.5 mg/ml. 5 μl. -. -. 855 μl. total volume. 1 ml. 70% 酒精 取出 99.8% 分生專用酒精,用二次水稀釋至 70%。 1× 磷酸緩衝液(phosphate-buffer saline ; PBS) 由 10× PBS (UniRegion Bio-Tech) 中取出 100 ml 溶在 900 ml 的二次水中,再經 121℃、30 分鐘高壓滅菌後使用並放於室溫備用。. 36.
(52) 第三章. 材料與方法. III. 實驗步驟 固定細胞 在 6 孔盤中種下 4×105 顆 HSC-3 細胞,等至隔日細胞貼附後,以 10 ml PBS 清 洗,換置 serum starvation 之培養液培養 24 小時後,加入不同濃度的 NAC 後 24 小 時,以 PBS 清洗後再經 trypsin-EDTA 反應 5 分鐘刷下,離心 (1000g,5 分鐘) 之 後倒掉上清液,將細胞完全打散後,再以 10 ml 之 PBS 清洗離心。倒掉上清液,將 細胞打散後,以 -20℃ 冰的 70% 酒精進行細胞固定步驟 (以慢速震盪,緩慢將 3 ml 酒精滴入),隨後將細胞固定步驟完成的樣品置於 -20℃ 冰箱。 流式細胞儀分析 固定結束後隔天,將樣品從 -20℃ 冰箱取出後離心 (1000g,5 分鐘) 去除酒精。 將細胞完全打散,加入 10 ml 的 PBS 清洗 1 次後將細胞完全打散。最後在每個試 管中加入 500 μl (視細胞數目增減) 的 PI 染劑,用 1 ml pipette 在 15 ml 離心管中抽 吸數次後,將細胞移於絹布製的篩子過濾到 FACS 專用管,避光並置於冰上反應 30 分鐘。最後以流式細胞儀 (Flow cytometry; FAC) 進行樣品分析,每一秒細胞數不超 過 300 顆細胞,每個數據收集 10000 顆細胞,數據以 Modfit LT® 軟體進行處理分 析,每個實驗組皆重複三次。. 37.
(53) 第三章. 材料與方法. 六、ROS (Reactive Oxygen Species) 測定 資料來源:(134) I. 原理 2,7-dichlorofluorescein diacetate (H2DCF-DA) 是一種脂溶性染劑,本身具有螢光 且可以通透細胞膜,進入細胞可以與細胞內的乙醯脂酶 (esterases) 結合形成非螢光 性的DCFH,之後被 H2O2 氧化成具螢光性的 DCF。藉此使用流式細胞儀來評估細 胞內 H2O2 的濃度變化,以分析細胞內ROS的生成量。. II. 試劑配製 10 mM H2DCF-DA 染劑 分子量為 487.3,取 4.873 mg 之 H2DCF-DA,加入 1 ml 已滅菌的 PBS,實驗 時再用已滅菌的 PBS 稀釋成 10 μM。. III. 實驗步驟 將 4×105 細胞種至培養皿中,經過 24 小時細胞貼附,分別給予不同濃度的 NAC 培養 30 分鐘以及 1、6、12、24、48 小時後,將上清液抽掉,以 10 ml 之 PBS 清 洗,加入 trypsin-EDTA 反應 5 分鐘後刷下,離心 (1000g,5 分鐘) ,倒掉上清液, 利用手指用力彈管壁使細胞完全打散,再以 10 ml 之 PBS 清洗離心。倒掉上清液, 再利用手指用力彈管壁使細胞完全打散後,在每個離心管中加入 500 μl 的 10 μM H2DCF-DA,用 1 ml pipette 在 15 ml 離心管混合均勻後,將細胞移於絹布製的篩子 過濾到 FACS 專用管,全程避光並置於 37℃ 水浴 30 分鐘,最後以流式細胞儀 (Flow cytometry; FACS) 進行樣品分析。. 38.
(54) 第三章. 材料與方法. 七、蛋白質萃取 資料來源:(135) I. 原理 利用細胞刮除法使細胞破碎以及利用高滲蛋白裂解液讓細胞溶漲破裂,使蛋白 溶解變性並抑制蛋白酶活性使蛋白穩定,再利用超高速離心,收集上清液提取總蛋 白。. II. 試劑配製 RIPA buffer Component. Concentration. NaCl. 150 mM. Tris buffer. 10 mM. EDTA. 5 mM. SDS. 0.1%. Triton X-100. 1%. Deoxycholate. 1%. III. 實驗步驟 10 公分培養盤中的細胞以 PBS 清洗過後,加入 100 μl RIPA buffer (含 protease inhibitors cocktail 與 phosphatase inhibitors cocktail ),以細胞刮勺將細胞刮下,放到 eppendorf,置於冰上 30 分鐘。之後 cell lyste 以 12000 rpm 轉速離心 15 分鐘後, 取上清液,放至 -80℃ 冰箱中保存使用。. 39.
(55) 第三章. 材料與方法. 八、蛋白質定量 資料來源:(135) I. 原理 蛋白質定量分析是根據 Bradford protein-binding assay 的原理所設計,利用 Coomassie Brilliant Blue 會與蛋白質結合的特性,在與蛋白質結合後,其顏色會從紅 色轉變成為藍色,此時在 595 nm 波長下,會有較高的吸收。藉由比對 BSA 標準品 的定量標準曲線,即可換算出待測樣品的蛋白質濃度。. II. 標準曲線製備 Concentration. BSA(0.1 μg/μl). 二次水. Bio Red Dye. 0 μ g/ml. 0 μl. 800 μl. 200 μl. 2 μ g/ml. 20 μl. 780 μl. 200 μl. 4 μ g/ml. 40 μl. 760 μl. 200 μl. 6 μ g/ml. 60 μl. 740 μl. 200 μl. 8 μ g/ml. 80 μl. 720 μl. 200 μl. 10 μ g/ml. 100 μl. 700 μl. 200 μl. total volume. 1 ml. III. 實驗步驟 利用二次水分別配製 0、2、4、6、8、10 μg/ml 之牛血清白蛋白 (bovine serum albumin;BSA) 蛋白標準溶液 800 μl,震盪均勻後,再加入 200 μl protein assay dye (Bio-Red),均勻混和靜置室溫 5 分鐘。放入分光光度計讀取波長 595 nm 的吸光值, 藉由 595 nm 的吸光值作為標準曲線,分析最佳標準迴歸直線,求出此線的方程式,. 40.
(56) 第三章. 材料與方法. 當此直線的迴歸分析結果之 R2>0.998 時,此直線方程式的值始可信。得知最佳標 準迴歸直線後,將取 1 μl 的待測蛋白質溶液加入 799 μl 二次水,震盪均勻後,再加 入 200 μl protein assay dye,均勻混合後,室溫下反應 5 分鐘後測吸光值,再以樣品 所測的結果扣除背景值後,帶入方程式即可求得蛋白質的濃度。. 41.
(57) 第三章. 材料與方法. 九、西方點墨法 (Western Bloting) 資料來源:(135) I. 原理 Western bolt 採用的是聚丙烯醯胺凝膠電泳 (SDS-PAGE),被檢測物是蛋白質, 探針是一級抗體 (Primary antibody),顯色用標記的二級抗體 (Secondary antibody), 介面活性劑,SDS 可將蛋白變性並使其分子表面均勻佈上一層負電荷,接通電源後, 使帶負電的蛋白分子向正極移動,分子量大者泳動率小,相反地,分子量小者泳動 率大。梯度電泳使用由稀到濃的梯度膠體,膠體中的孔徑由上到下逐漸變小,樣本 中分子量越小的分子就可跑的越下面,因此可說是依分子量的大小來分離的。經過 SDS-PAGE 分離蛋白樣本後,轉移到固相載體 (如:PDVF膜) 上,固相載體以非共 價鍵型式吸附蛋白質,且能保持電泳分離的蛋白分子及其生物學活性不變。以固相 載體上的蛋白質作為抗原,與對應的一級抗體發生免疫反應,再與酶或同位素標記 的二級抗體反應,最後經過顯色或顯影來檢測電泳分離的蛋白表現。. II. 試劑配製 鑄膠. 4×Lower Tris Component. Concentration. Tris-base (1.5 M). 36.34 g. SDS (0.4%). 0.8 g. ddH2O. X ml. pH. 8.8. total volume. 200 ml. 42.
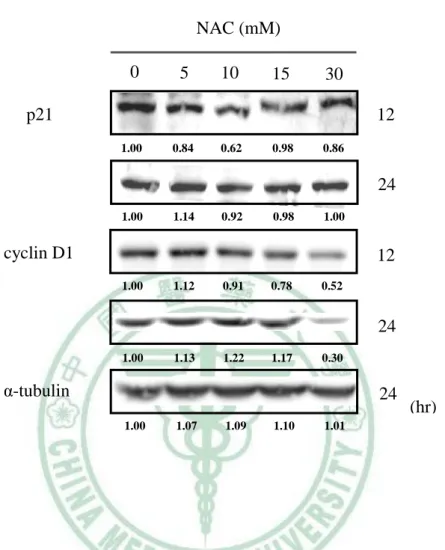
(58) 第三章. 材料與方法. 4×Upper Tris Component. Concentration. Tris-base (0.5 M). 12.11 g. SDS (0.4%). 0.8 g. ddH2O. X ml. pH. 6.8. total volume. 200 ml. APS (0.1 g/ml) Component. Concentration. Ammonium persulfate (10%). 1g. ddH2O. X ml. total volume. 10 ml. Running and stacking gel Stock solution. 5% running gel. 8% running gel. 10% running gel. 4% stacking gel. 40% Acylamide. 1 ml. 1.6 ml. 2 ml. 0.4 ml. Upper Tris (4×). -. -. -. 1 ml. Lower Tris (4×). 2 ml. 2 ml. 2 ml. -. Water. 5 ml. 4.4 ml. 4 ml. 2.6 ml. APS. 40 μl. 40 μl. 40 μl. 40 μl. TEMED. 4 μl. 4 μl. 4 μl. 4 μl. total volume. 8.044 ml. 43.
(59) 第三章. 跑膠 10× running buffer Component. Concentration. Tris-base (0.25 M). 30.3 g. Glycine (1.9 M). 144 g. SDS (1%). 10 g. ddH2O. X ml. pH. 8.6. total volume. 1000 ml. 轉印 10× Transfer buffer Component. Concentration. Tris-base (0.25 M). 30 g. Glycine (1.9 M). 144 g. ddH2O. X ml. pH. 8.3. total volume. 1000 ml. 免疫染色 10× Tris-base buffer saline Component. Concentration. Tris-base (0.2 M). 0.2 M. NaCl (1.4 M). 80 g. ddH2O. X ml. pH. 7.6. total volume. 1000 ml 44. 材料與方法.
數據
Outline
相關文件
Human papillomavirus- related squamous cell carcinoma of the oropharynx: a comparative study in whites and African Americans. Prevalence of human papillomavirus type 16 DNA in
We describe the clinical, macroscopic, cytological, histopathological, immunohistochemical, serodiag- nostic and aspects of pemphigus vulgaris (PV) in the oral gingiva
The great majority of HPV relate SCC of the OP is nonkeratinizing as described above. However, more re- cently increasing numbers of variants of squamous cell carcinoma,
High pre-treatment serum level of vascular endothelial growth factor (VEGF) is associated with poor outcome in small-cell lung cancer. Telomerase as tumor
Samples of oral fibrous hyperplasia were used as positive controls for E-cadherin and vimentin staining. In addition, samples of normal cardiac striated muscle and
Malins, “Squamous cell carcinoma arising in the lining of an epidermoid cyst within the sublingual gland—a case report,” British Journal of Oral and Maxillofacial Surgery, vol..
Persons with a phenotype mediated by one of these MC1R genetic variants are at greater risk of UV-induced skin cancers, because pheomelanin not only provides less effective
Clinical findings and risk factors to oral squamous cell carcinoma in young patients: A 12-year retrospective analysis.. Hellen-Bandeira-de-Pontes Santos 1 , Thayana-Karla-Guerra