新吸附型膀胱灌洗劑
全文
(2) 中 文 摘 要 : 長期使用導尿管感染問題日趨嚴重,長照中心內長期安裝導尿管患 者在使用導尿管超過30天後,常因細菌滋生導致泌尿道感染,併發 腎盂腎炎及續發性菌血症而死亡。因此我們開發了一種吸附型膀胱 灌洗劑灌洗膀胱,藉由活性碳本身具有很大的比表面積與吸附特性 ,吸附細菌產生的內、外毒素的效果,減緩細菌對生物體的致病性 ,協助醫師爭取對症下藥時間。 本計畫主要有3大項目,現況如下,第1項膀胱灌洗劑項目,已 完成新吸附型膀胱灌洗劑:阿博特膀胱灌注液(“ABSORBTA” Instillation Solution)之Pics GMP廠委託代工、滅菌確效、包材 測試(老化前與老化後) 、2年加速老化(55度)、無菌試驗等項目 ;通過ISO 10993生物相容性測試,包括細胞毒性試驗、敏感性試驗 、皮內刺激試驗、陰道黏膜刺激試驗、急性系統注射毒性試驗、鼠 傷寒沙門氏菌回復突變試驗、溶血試驗、熱原試驗等8項試驗;完成 感染偵測套件Testing kit開發。 第2項法規建置項目,已初步建置ISO 13485品質系統,已建立 1階(1份)與2階品質文件(7份);完成新吸附型膀胱灌洗劑ISO 14971風險管理報告1份;完成美國FDA pre-submission 1 案,美國 FDA判定本產品為De novo醫療器材;完成CDE諮詢3次,衛生福利部 TFDA 已判定為第三類醫療器材。 第3項臨床試驗項目,已於107年7月17日取得台中榮民總醫院人 體臨床研究/試驗計畫許可書,目前正第二次平行送審衛福部送審中 ,希望能及早取得衛生福利部同意,以啟動本案人體臨床試驗進行 。 中 文 關 鍵 詞 : 導尿管相關泌尿道感染(CAUTI)、吸附性材料、ISO 10993 生物相容 性試驗 英 文 摘 要 : Long-term installation of catheter patients in nursing home often have urinary tract infection by the bacteria grow uncontrollably inside the bladder. It always happens when the use of catheter is more than 30 days. Moreover, the infection can cause the deadly complication such as pyelonephritis, bacteremia and death. Therefore, we have developed an adsorption type bladder irrigation solution. Since the submicron activated carbon has a large surface area and adsorption properties, it can adsorb the endotoxin produced by bacterias. It can not only slow down the pathogenicity of bacteria to the organism but also help physicians have more time for drug sensitivity test, to correct the right medicine. There are three major items in this project. The current situation is as follows. Item 1, product develop project. completed a batch of “ABSORBTA Instillation Solution” was manufactured by Pics GMP. Completed “ABSORBTA” package shelf life validation after accelerated aging time 92 days, passed the seal peel strength test, burst, creep tests, dye penetration test and sterility test. Complete sterilization validation of gamma irradiation. Passed eight kind of ISO.
(3) 10993 biocompatibility test, according in vitro cytotoxicity test, intracutaneous reactivity test, skin irritation test, vaginal irritation test, skin sensitization study (Maximization Test), systemic inject test/acute systemic toxicity, salmonella reverse mutation test, hemolysis test, and pyrogen test. Developed Urine Infection Detection Kit (Testing kit). Item 2, quality regulations establish project. The 1st order (1 part) and 2nd order quality documents (7 parts) of ISO 13485 quality system have been established. Completed one part of ISO 14971 risk management report for “ABSORBTA”. Completed the US FDA pre-submission. The official FDA response that “ABSORBTA” product is De novo medical device. Complete 3 times consultation with CDE. The Ministry of Health and Welfare (TFDA) has determined that“ABSORBTA” is class III medical device. Item 3, Clinical trial project. On July 17, 2018, obtained “Absorbta” Human trial of certificate of approval of Institutional review board I & II of Taichung Veterans General Hospital. At present, it is being sent to TFDA for approval for the second time. We hope can get the certificate of approval of TFDA as soon as possible to start the human trial in this project. 英 文 關 鍵 詞 : Catheter-associated Urinary Tract Infections (CAUTI), Adsorption material, ISO 10993 Biocompatibility test.
(4) 科技部補助專題研究計畫成果報告 (■期中進度報告/□期末報告). 新吸附型膀胱灌洗劑 計畫類別:■個別型計畫 □整合型計畫 計畫編號:MOST 107-2321-B-006-006- 執行期間:107 年 01 月 01 日至 108 年 02 月 28 日 執行機構及系所:國立成功大學醫學系泌尿科 計畫主持人:楊文宏 副教授 共同主持人:歐建慧 副教授 計畫參與人員:翁振勛、洪銘謙、黃聖洋、張嘉容 本計畫除繳交成果報告外,另含下列出國報告,共 2 份: □執行國際合作與移地研究心得報告 □出席國際學術會議心得報告 ■出國參訪及考察心得報告. 中. 華. 民. 國 108 年 2 月 12 日.
(5) 目錄 1.. 中文摘要: .................................................................................................................................................................... 5. 2.. Abstract ........................................................................................................................................................................ 6. 3.. 計畫目的...................................................................................................................................................................... 7. 4.. 執行重點...................................................................................................................................................................... 7. 3.. 2.1. 計畫架構 ............................................................................................................................................................ 7. 2.2. 計畫甘特圖 ........................................................................................................................................................ 8. 2.3. 第一期與第二期計畫執行項目與執行進度表 ................................................................................................ 9. 執行成果.................................................................................................................................................................... 11 3.1. 產品簡介 .......................................................................................................................................................... 11. 3.2. 相關測試 .......................................................................................................................................................... 11. 3.3. 委託代工 .......................................................................................................................................................... 11. 3.4. ISO 10993 生物相容性測試 ............................................................................................................................ 13. 3.5. 產品法規建置 .................................................................................................................................................. 14. 3.6. 法規相關 .......................................................................................................................................................... 15. 3.7. 臨床前動物試驗結果 ...................................................................................................................................... 19. 3.8. 人體臨床試驗案申請 ...................................................................................................................................... 20. 3.8.1. 與台中榮總泌尿外科合作人體臨床試驗 .................................................................................................. 20. 3.8.2. 申請衛服部審查執行情形 .......................................................................................................................... 21. 3.8.3. 臨床試驗設計規劃簡述如下: ..................................................................................................................... 23. 3.9. 尿液感染偵測儀執行現況 .............................................................................................................................. 25. 3.9.1. 尿液感染監測系統概念圖 .......................................................................................................................... 25. 3.9.2. 尿液感染偵測儀可行性問卷設計 .............................................................................................................. 26. 3.9.3. 尿液感染偵測儀可行性調查結果 .............................................................................................................. 27. 藍芽尿液感染偵測儀電路圖 .................................................................................................................................... 28 3.9.4 4.. 藍芽尿液感染偵測儀主機板設計圖與成品照 .......................................................................................... 29. 結論............................................................................................................................................................................ 30. II.
(6) 圖目錄 圖 1、育苗計畫執行架構圖 ............................................................................................................................. 7 圖 2、育苗計畫第一期與第二期工作內容甘特圖 ......................................................................................... 8 圖 3、阿博特(Abosrbta)膀胱灌注液產品圖 .................................................................................................. 11 圖 4、國立成功大學與利達製藥合作意向書 ............................................................................................... 12 圖 5、阿博特膀胱灌注通過 8 種 ISO 10993 生物相容性測試報告封面圖 ............................................... 13 圖 6、阿博特膀胱灌注液屬性判定通知公文 ............................................................................................... 15 圖 7、新吸附型膀胱灌洗劑申請美國 FDA Pre submission 審查文件 ....................................................... 16 圖 8、美國 FDA Pre-submission 分類分級建議文件第 1 頁 ........................................................................ 17 圖 9、美國 FDA Pre-submission 分類分級建議文件第 2 頁 ........................................................................ 18 圖 10、新吸附型膀胱灌洗劑安全性與有效性動物實驗判定報告書 ......................................................... 19 圖 11、臺中榮民總醫院人體研究倫理委員會「新吸附型膀胱灌洗劑」人體臨床試驗同意函 ............. 20 圖 12、衛服部無法准予執行「新吸附型膀胱灌洗劑」臨床試驗案公文 ................................................. 21 圖 13、「新吸附型膀胱灌洗劑」人體臨床試驗案第二次送衛生福利部進行審查 ................................... 22 圖 14、新吸附型膀胱灌注液臨床收案規劃 ................................................................................................. 24 圖 15、尿液感染監測系統概念圖 ................................................................................................................. 25 圖 16、尿液感染偵測儀可行性問卷 ............................................................................................................. 26 圖 17、藍芽尿液感染偵測儀連接濁度計之電路設計圖 ............................................................................. 28 圖 18、藍芽尿液感染偵測儀主機板設計圖與成品照 ................................................................................ 29. III.
(7) 表目錄 表 1、阿博特膀胱灌注之 ISO 10993 生物相容性測試結果表 .................................................................... 13 表 2、ISO 13485 品質系統之第一階與第二階文件 ..................................................................................... 14. IV.
(8) 1. 中文摘要: 長期使用導尿管感染問題日趨嚴重,長照中心內長期安裝導尿管患者在使用導尿管超過 30 天 後,常因細菌滋生導致泌尿道感染,併發腎盂腎炎及續發性菌血症而死亡。因此我們開發了一種吸 附型膀胱灌洗劑灌洗膀胱,藉由吸附性材料本身具有很大的比表面積與吸附特性,吸附細菌產生的 內、外毒素的效果,減緩細菌對生物體的致病性,協助醫師爭取對症下藥時間。 本計畫主要有 3 大項目,現況如下,第 1 項膀胱灌洗劑項目,已完成新吸附型膀胱灌洗劑:阿博 特膀胱灌注液(“ABSORBTA” Instillation Solution)之 Pics GMP 廠委託代工、滅菌確效、包材測試(老 化前與老化後) 、2 年加速老化(55 度)、無菌試驗等項目;通過 ISO 10993 生物相容性測試,包括細 胞毒性試驗、敏感性試驗、皮內刺激試驗、陰道黏膜刺激試驗、急性系統注射毒性試驗、鼠傷寒沙 門氏菌回復突變試驗、溶血試驗、熱原試驗等 8 項試驗;完成尿液感染偵測套件 Testing kit 開發。 第 2 項法規建置項目,已初步建置 ISO 13485 品質系統,已建立 1 階(1 份)與 2 階品質文件(7 份);完成新吸附型膀胱灌洗劑 ISO 14971 風險管理報告 1 份;完成美國 FDA pre-submission 1 案, 美國 FDA 判定本產品為 De novo 醫療器材;完成 CDE 諮詢 3 次,衛生福利部 TFDA 已判定為第三類 醫療器材。 第 3 項臨床試驗項目,已於 107 年 7 月 17 日取得台中榮民總醫院人體臨床研究/試驗計畫許可 書,目前正第二次平行送審衛福部送審中,希望能及早取得衛生福利部同意,以啟動本案人體臨床 試驗進行。 關鍵字: 導尿管相關泌尿道感染(CAUTI)、吸附性材料、ISO 10993 生物相容性試驗. 5.
(9) 2. Abstract Long-term installation of catheter patients in nursing home often have urinary tract infection by the bacteria grow uncontrollably inside the bladder. It always happens when the use of catheter is more than 30 days. Moreover, the infection can cause the deadly complication such as pyelonephritis, bacteremia and death. Therefore, we have developed an adsorption type bladder irrigation solution. Since the submicron activated carbon has a large surface area and adsorption properties, it can adsorb the endotoxin produced by bacterias. It can not only slow down the pathogenicity of bacteria to the organism but also help physicians have more time for drug sensitivity test, to correct the right medicine. There are three major items in this project. The current situation is as follows. Item 1, product develop project. completed a batch of “ABSORBTA Instillation Solution” was manufactured by Pics GMP. Completed “ABSORBTA” package shelf life validation after accelerated aging time 92 days, passed the seal peel strength test, burst, creep tests, dye penetration test and sterility test. Complete sterilization validation of gamma irradiation. Passed eight kind of ISO 10993 biocompatibility test, according in vitro cytotoxicity test, intracutaneous reactivity test, skin irritation test, vaginal irritation test, skin sensitization study (Maximization Test), systemic inject test/acute systemic toxicity, salmonella reverse mutation test, hemolysis test, and pyrogen test. Developed Urine Infection Detection Kit (Testing kit). Item 2, quality regulations establish project. The 1st order (1 part) and 2nd order quality documents (7 parts) of ISO 13485 quality system have been established. Completed one part of ISO 14971 risk management report for “ABSORBTA”. Completed the US FDA pre-submission. The official FDA response that “ABSORBTA” product is De novo medical device. Complete 3 times consultation with CDE. The Ministry of Health and Welfare (TFDA) has determined that“ABSORBTA” is class III medical device. Item 3, Clinical trial project. On July 17, 2018, obtained “Absorbta” Human trial of certificate of approval of Institutional review board I & II of Taichung Veterans General Hospital. At present, it is being sent to TFDA for approval for the second time. We hope can get the certificate of approval of TFDA as soon as possible to start the human trial in this project. Keyword: Catheter-associated Urinary Tract Infections (CAUTI), adsorption material, ISO 10993 biocompatibility test. 6.
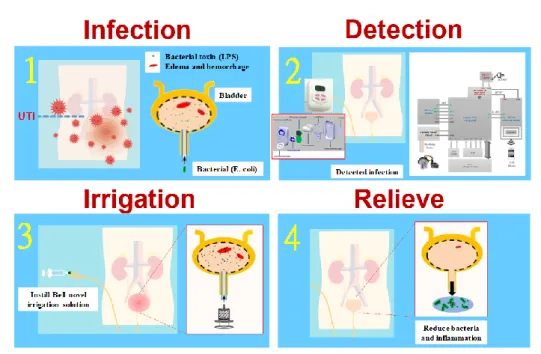
(10) 3. 計畫目的 本計畫預計開發出一款具有物理性吸附的灌洗劑,透過透過灌洗過程,來協助長期使用導尿管 患者。具物理性吸附灌洗劑其原理主要透過吸附性材料本身具有很大的比表面積與吸附特性,可以 抑制細菌生長,並吸附細菌產生的內、外毒素,來減緩細菌對生物體的致病性。因此本吸附性灌洗 劑,可以快速移除膀胱內細菌,使細菌數減低到最低致病量(105)以下以降低發炎反應。本灌洗劑主 要用在年長者無法承受高劑量抗生素以及其副作用時,可以透過物理性吸附的灌洗劑,延緩年長者 泌尿道感染病程,並爭取驗尿時間,以供醫師對症下藥。 4. 執行重點 2.1 計畫架構. 新 吸 附 型 膀 胱 灌 洗 劑. 圖 1、育苗計畫執行架構圖. 7.
(11) 2.2 計畫甘特圖 育苗計畫第一期與第二期工作內容甘特圖: 圖示: ■ 第一期 ■ 第二期 月 次. 第一期. 第二期. 執行 2018 2019 進度 第 第 第 第 第 第 第 第. 工作項目. (%) 新吸附型膀胱灌洗劑. 1 2 3 4 1 2 3 4 季 季 季 季 季 季 季 季. 90% a1 a4 a2 a5 a3. 灌洗劑材料生產、代工與確效. a6. 灌洗劑生物相容性驗證 100%. 法規建置. b1 b2. 產品法規建置 臨床實驗 TFDA, US FDA pre-submission 或 513(g) IRB 臨床試驗規劃 人體臨床實驗許可函證明. 100%. c1. 100%. c2. 80%. c3 c4. 安全性人體臨床研究/試驗報告 尿液感染偵測儀. 100% d1 d2. 可行性分析與開發設計 ISO 14971 風險分析. d3. 尿液感染警示儀雛型品. d4. 尿液感染警示儀雛型品測試. d5 d6 0%. 資訊傳輸系統 WIFI 傳輸模組軟硬體開發. e1. Gateway 與通訊網路介面設計. e2. Indoor Server 資料存取與管理. e3 e4. 尿液感染監測傳輸系統驗證 0%. 專利. f1. 申請專利 圖 2、育苗計畫第一期與第二期工作內容甘特圖. 8.
(12) 2.3 第一期與第二期計畫執行項目與執行進度表 a1.. a2. a3.. a4.. a5.. a6. b1. b2. c1.. c2.. c3.. 執行項目 執行進度 灌洗劑委託充填代工(合作意向書 1 份): 灌洗劑委託充填代工事宜,待衛福部 原料經過製造加工後,再委託 GMP 代 同意臨床試驗劑量後進行代工,目前 工廠充填、封瓶、包裝、裝箱。 已經簽訂備忘錄,預計於 108 年 2 月 18 日完成充填代工 500 瓶。 滅菌確效報告 1 份:因變更原料供應 依據 CDE 建議,學術行人體臨床試 商,因此需要重新認證。 驗,可以使用先前滅菌確效報告。 包材確效試驗報告 1 份:委託廠商進行 已委託金屬工業研究發展中心進行臨 包材確效(包含 ASTM F1929 染料穿 床試驗用樣品之 1 年加速老化價儲期 透,ASTM F1140 爆破測試,ASTM 測試後,再進行包材確效測試,包含 F1140 緩破測試,ASTM F88 封口強度 ASTM F1929 染料穿透,ASTM F1140 試驗,ISO 11607 微生物穿透測試)。 爆破測試,ASTM F1140 緩破測試, ASTM F88 封口強度試驗,ISO 11607 微生物穿透測試等,皆通過測試。 物化性測試報告 1 份:確認材料經最大 經過 GAMMA 滅菌後測試重金屬含 劑量 GAMMA 滅菌,不會改變材料物 量與灌洗劑吸附性能,皆無變化。 化性能。 架儲期試驗報告 1 份:完成產品 6 個月 已委託金屬工業研究發展中心完成 1 與 1 年的加速老化 架儲期測 試 (ISO 年加速老化價儲期測試,並請通過測 11607-1)。 試。 生物相容性試驗報告 1 份:委託廠商進 委託亮宇生技公司執行,已通過測試 行生物相容性驗證(黏膜刺激性實驗)。 ISO13485 輔 導 案 1 件 : 輔 導 建 置 已完成設計管制以及 1 階與部分 2 階 ISO13485 品質系統。 品質文件。 ISO 14971 風險管理評估案 1 件:評估產 已完成 ISO 14971 風險管理評估報告。 品可能的風險及相關改進措施。 US FDA Pre-submission 或 513(g): 確 US FDA Pre-submission 已於 107 年 7 認台灣與美國之申請路徑是二類醫材 月 3 日送出申請,預計於 107 年 8 月 或 510K or De novo。確認產品為“重大 31 日與美國 FDA 進行視訊會議,美 風險”(SR)或“非重大風險”(NSR) 國 FDA 判定為 De-novo 無類似品醫療 醫療器材。確認臨床前測試是否足夠, 器材。 並諮詢 FDA 人體臨床試驗流程是否正 確。 臨床試驗規劃及:確定臨床試驗規格需 已完成臨床試驗相關申請文件並送台 求,輔導 IRB 申請書撰寫、送審、監測、 中榮民總醫院人體研究倫理審查委員 管理、安全性通報、試驗資料處理與統 會進行審查,IRB 編號為 SF18186B。 計分析。 人體臨床實驗許可函證明:取得人體臨 1. 第二期執行 床實驗許可。 2. 首次申請於 107 年 7 月 20 日函文衛 福部進行人體臨床試驗審查,於 107 年 11 月 7 日回文未於時限內補 正所需資料,原因是要補第三方單 位具名之動物實驗報告。 3. 108 年 1 月 16 日再次送衛服部進行 人體臨床試驗案審查,目前正進行 9. 執行(%) 90%. 100% 100%. 100%. 100%. 100% 100% 100% 100%. 100%. 80%.
(13) c4.. d1.. d2.. d3.. d4. d5.. d6. e1.. e2.. e3.. e4.. f1.. 審查中。 安全性人體臨床研究/試驗報告: 完成 第二期執行 安全性人體臨床研究/試驗 8 例,以 3+3 方式進行劑量增量試驗評估,,主要評 估指標(Primary endpoints)評估產品安 全性與耐受性,次要評估指標 (Secondary endpoints)評估產品對清除 菌尿、膿尿之有效性。收案期間每 3 個 月會發佈不良反應/重大不良反應報告 (AE/SAE eport)。完成收案後,經分析 顯 示 主 要 指 標 (endpoint) 具 有 統 計 意 義,且無重大不良反應,代表新吸附型 膀胱灌洗劑安全性人體臨床研究/試驗 成功。 尿液感染偵測儀可行性分析報告 1 份: 已完成可行性分析報告 1 份。 透過使用者訪談,來設計出最適合的設 計圖面 1 份,以及可行性報告 1 份。 尿液感染偵測儀設計圖 1 份:濁度感測 已完成尿液感染偵測儀設計圖 1 份。 器(感測範圍: 10~1000 NTU,正常值約 為 50~200 NTU)。 尿液感染偵測儀 ISO14971 風險分析報 告 1 份:針對尿液感染偵測儀進行風險 評估與分析。 尿液感染警示儀雛型品 2 台:製造 2 台 尿液感染警示儀雛型品。 雛型品設計規劃報告 1 份:修改後設計 爆炸圖一份,各項零組件組成之物料清 單(BOM 表)。 產品性能確效報告書 1 份: 模擬尿液 感染警示儀之感染偵測功能確效。 WIFI 端電路設計圖 1 份、傳輸模組 2 個: 包含 ESP8266 Module 與硬體電路 設計圖,製作傳輸模組 2 個。 Gateway 傳 輸 系統 1 組 : 架設 中繼 Embedded system 來接收與傳輸偵測器 傳輸訊號到系統 架設 Indoor Server 資料存取系統: 架 設 Indoor Server PC 伺服器進行資料儲 存與感染訊號裝置介面設計 通過尿液感染監測傳輸系統存取驗證: 架設 2 床尿液感染偵測儀進行資料傳輸 系統展示。 申請專利: 如臨床試驗案成功,且找出 安全性劑量與有效性應用,將會申請台 灣、美國專利。. 0%. 100%. 100%. 已完成風險分析報告 1 份。. 100%. 第二期執行. 100%. 第二期執行. 100%. 第二期執行. 10%. 第二期執行. 100%. 第二期執行. 10%. 第二期執行. 10%. 第二期執行. 10%. 第二期執行. 0%. 10.
(14) 3. 執行成果 3.1 產品簡介 阿博特(Absorbta)膀胱灌注液(下稱本產品)是置於玻璃瓶內已滅菌黑色粉末,具有良好之生物 相容性。本產品使用時以 0.9%注射用生理食鹽水依比例稀釋成灌注液。本產品需搭配無菌之導尿 管使用,並僅供一次性使用。本產品主要用於減緩長期留置導尿管引起之泌尿道感染患者發炎不 適現象。原理是灌注液含有吸附性成分,患者經由膀胱灌注本灌洗劑來清潔膀胱,吸附膀胱內毒 素及有害物質,最後透過導尿管排尿排出,可減緩長期留置導尿管引起之泌尿道感染引起之發炎 不適現象。 3.2 相關測試 本產品為安瓶無菌包裝,採最終滅菌方式生產,將製備好的粉末送入環控區,再將原料充填 到已高溫高壓滅菌的玻璃安瓶內,接著置入已滅菌的膠塞與鋁蓋,封蓋後,再將安瓶放入 PET 泡 殼內封膜(或以泰維克袋封裝),最後以紙盒包裝,再經過 Gamma 滅菌後,經過相關檢驗合格後, 就可以使用,製作過程並沒有添加其他酸液、鹼液與其他添加劑,試量產產品包裝如圖 3 所示。. 圖 3、阿博特(Abosrbta)膀胱灌注液產品圖 產品使用 Gamma 滅菌法滅菌,並且通過滅菌確效驗證(委託中國生化公司測試),經 CDE 建議 因為製成沒有改變而且是學術型驗證,不須重複驗證,待申請查驗登記時再行驗證。產品通過包 裝可靠性評估:評估項目為 2 年加速老化試驗(6.5 週),爆破試驗、緩破試驗、染料滲透、無菌試 驗(委託中國生化公司測試)。而且試打樣產品通過 USP<85>內毒素測試,定量結果小於<0.005 EU/mL(委託塑膠中心測試)。 3.3 委託代工 本新吸附型膀胱灌洗劑委託 Pics-GMP 利達製藥股份有限公司代工生產,並簽屬合作意向書 1 份,如圖 4 所示,已委託利達製藥股份有限公司生產 1 批共 500 瓶。. 11.
(15) 圖 4、國立成功大學與利達製藥合作意向書. 12.
(16) 3.4 ISO 10993 生物相容性測試 本阿博特膀胱灌注液產品,經試小批次打樣生產後,經過 Gamma 滅菌與品質檢驗通過,接著 進行產品 ISO10993 生物相容性測試,共進行細胞毒性試驗(Agar 法)、皮內刺激試驗、皮膚刺激性試 驗、敏感性試驗、溶血試驗與熱原試驗等 8 項測試,並完全通過,證明產品具有良好的生物相容性。 如表 1 與圖 5 所示。 表 1、阿博特膀胱灌注之 ISO 10993 生物相容性測試結果表 檢驗項目 Test description. 標準方法 Standard. 細胞毒性試驗(Cytotoxicity). ISO10993-5 and ISO10993-12. 結果 Result. 補充說明. PASS. GLP. 皮內刺激試驗(Intracutaneous reactivity test) ISO 10993-10. PASS. GLP. 皮膚刺激性試驗(Skin Irritation Test). ISO 10993-10. PASS. TAF. 敏感性試驗. ISO 10993-10. PASS. GLP. ISO 10993-10. PASS. GLP. PASS. GLP. 大白兔陰道黏膜刺激 (White Rabbit viganil Irrigation test) 基因毒-沙門菌逆突變試驗試驗報告. ISO 10993:Biological evaluation. (Salmonella Reverse Mutation Test). of medical device –part 3. 溶血試驗 Hemolysis Test. ISO 10993-4. PASS;. GLP. 熱原試驗 Pyrogen Test. USP <151>. PASS;. GLP. 圖 5、阿博特膀胱灌注通過 8 種 ISO 10993 生物相容性測試報告封面圖 13.
(17) 3.5 產品法規建置 關於 ISO 13485 品質系統,目前已完成第一階段 ISO13485 品質系統建置,已建立 1 階品質手冊 與部分 2 階品質文件系統,並完成新吸附型膀胱灌洗劑 ISO 14971 風險管理報告 1 份。 表 2、ISO 13485 品質系統之第一階與第二階文件 文件階層 第一階. 第二階. 文件名稱. 文件編號. 版次. 備註. 1. 品質手冊. QM-01-001. 1. 品保部. 1.教育訓練管理程序 2.管理審查管理程序 3.流程監督與目標管理程序 4.內部品質稽核管理程序 5.文件與資料管理程序 6.不合格品管理程序. QP-01-002 QP-02-001 QP-02-002 QP-02-003 QP-02-005 QP-02-008. 1 1 1 1 1 1. 品保部. 7.設計開發管理程序書. QP-02-010. 1. 研發部. 14.
(18) 3.6 法規相關 本新吸附型膀胱灌洗劑,於 2018 年 1 月、7 月與 11 月諮詢醫藥品查驗中心 CDE 共 3 次,並 依照 CDE 建議,向衛生福利部申請屬性判定以利本計畫執行,並已於 107 年 10 月 19 日經衛生福 利部判定為第三類醫療器材,如圖 6 所示。 本新吸附型膀胱灌洗劑完成一份 Pre submission 報告,如圖 7,送美國 FDA 審查,以了解產品 分類分級情形,經過與 FDA 電話 Pre-submission (案件標號:Q181252)後,FDA 審查員確認阿博特 膀胱灌洗劑為無類似品醫療器材,並分類為 De-Novo 醫療器材,如圖 8 與圖 9 所示。. 圖 6、阿博特膀胱灌注液屬性判定通知公文. 15.
(19) 圖 7、新吸附型膀胱灌洗劑申請美國 FDA Pre submission 審查文件. 16.
(20) 圖 8、美國 FDA Pre-submission 分類分級建議文件第 1 頁. 17.
(21) 圖 9、美國 FDA Pre-submission 分類分級建議文件第 2 頁. 18.
(22) 3.7 臨床前動物試驗結果 自 2015 年執行成功大學 SPARK 計畫開始,到執行第一期育苗計畫,已建立新吸附型膀胱灌 洗劑六種不同動物模型試驗,分別為阿博特膀胱灌注液灌注 1 次小鼠急性安全性模型(n=5)、8 個 月(每個月 1 次)灌注小鼠安全性模型(n=7)與 11 個月(每個月 1 次)灌注小鼠安全性模型(n=5)、49 天 高劑量灌注豬安全性模型(n=4)、灌注治療 Kp 菌誘導泌尿道感染小鼠有效性模型(n=13)、灌注治療 導尿管誘導泌尿道感染小鼠膀胱細菌陪養有效性模型(n=3)與灌注治療導尿管誘導急性泌尿道感染 豬有效性模型(n=5)。 經諮詢醫藥品查驗中心 CDE 後,建議團隊找第三方公正公司來出具新吸附型膀胱灌洗劑安全 性與有效性動物實驗判定報告書,經詢問後委由鉤端生物科技公司來進行判定,報告封面如圖 10 所示,安全性與有效性豬動物試驗評估報告結論如下:在對不同動物研究進行了六次不同條件試驗 後,證明了 Absorbta®不會引起任何組織刺激,並且從低劑量到高劑量的單次或多次滴注後沒有殘 留物殘留。有效性研究表明,Absorbta®能夠減少膀胱中的炎性細胞因子和細菌菌落。此外,與對 照組動物相比,膀胱炎症狀減少。因此,Absorbta®應被視為可靠且無害的醫療器械,在其他藥物 的組合下提供支持性治療方式。. 圖 10、新吸附型膀胱灌洗劑安全性與有效性動物實驗判定報告書. 19.
(23) 3.8 人體臨床試驗案申請 3.8.1 與台中榮總泌尿外科合作人體臨床試驗 感謝科技部育苗計畫的支持,新吸附型膀胱灌洗劑自開發迄今十年後,才有機會進一步於人 體上驗證其功效。本案在商品化中心與成功大學醫學院泌尿外科楊文宏主任的協助下,於 107 年 6 月 25 日與臺中榮民總醫院泌尿外科程千里主任,一起合作申請「新吸附型膀胱灌洗劑」,並在臺 中榮民總醫院進行臨床試驗案申請。感謝臺中榮民總醫院人體研究倫理委員會的協助,使本案順 利於 107 年 7 月 17 日取得「新吸附型膀胱灌洗劑」人體臨床試驗同意函,如圖 11 所示。. 圖 11、臺中榮民總醫院人體研究倫理委員會「新吸附型膀胱灌洗劑」人體臨床試驗同意函. 20.
(24) 3.8.2. 申請衛服部審查執行情形. 因本「新吸附型膀胱灌洗劑」為無類似品之新醫療器材,必須通過衛生福利部的核准,因此 在臺中榮民總醫院人體臨床試驗中心的協助下,於 107 年 7 月 20 日函文衛服部進行審查,但衛生 福利部於 107 年 11 月 7 日行文臺中榮民總醫院,因動物實驗沒有訂定生化血液檢測正常值範圍, 且超過補件時間,因此無法准予執行,如圖 12 所示。. 圖 12、衛服部無法准予執行「新吸附型膀胱灌洗劑」臨床試驗案公文 21.
(25) 在 107 年 11 月底諮詢醫藥品查驗中心 CDE 後,CDE 輔導專員建議找第三方單位來出具「新 吸附型膀胱灌洗劑」的動物實驗評估報告,並重送新案申請,因此在準備完相關資料後,於 108 年 1 月 16 日再次申請「新吸附型膀胱灌洗劑」人體臨床試驗案送衛生福利部進行審查,如圖 13 所示,目前正等候通知中。. 圖 13、「新吸附型膀胱灌洗劑」人體臨床試驗案第二次送衛生福利部進行審查 22.
(26) 3.8.3. 臨床試驗設計規劃簡述如下: 1. 2. 3. 4. 5. 6. 7.. 品名:"阿博特"膀胱灌注液/ "ABSORBTA" instillation suspension 劑型:不可重複使用安瓿瓶,內含吸附性無菌粉末,用於膀胱滴注 給藥頻率: 每周 1 次 製造廠名稱:利達製藥股份有限公司。 製造廠地址:437 台中市大甲區中山路一段 906 號 適應症:導管相關無症狀菌尿的患者(catheter-associated asymptomatic bacteriuria)。 預期用途:“阿博特®”(Absorbta®)灌注液是一種用於膀胱表面清洗之灌注液,使用物理性方 式來清除表面的微生物等有害物質,藉由該滴注液灌洗膀胱來減緩膀胱炎症狀。 8. 試驗目的:一項開放式,單臂和劑量遞增試驗研究,旨在研究新吸附型膀胱灌注液的安全 性和耐受性,用於導管相關無症狀菌尿的患者 9. 主要目標(Primary Objective): 評估新吸附型膀胱灌注液 Absorbta®的安全性和耐受性 10. 次要目標(Secondary Objectives): 評估每次滴注後 24 小時的 Absorbta®清除率 評估滴注後 Absorbta®的殘留情況 評估使用 Absorbta®每週一次膀胱滴注後導管相關無症狀菌尿的臨床結果 評估接受 Absorbta®滴注的受試者的生活質量 11. 樣本數:可評估人數 30 人 12. 收案流程規劃:每周 1 次,連續 3 周,如圖 14 所示。. 23.
(27) Visit description. Screening. Visit Day ± window. Instillation. EOS/ET. 1. 2. 3. 4. 5. - 14 ± 7. 0±3. 7±3. 14 ± 3. 21± 3. X. X. X. Informed consent. X. Inclusion/exclusion criteria. X. Demographics. X. Medical history. X. Vital signs1. X. Physical examinations. X. X. Urinalysis. X. X2. X2. X2. X. Urine culture. X. X2. X2. X2. X. X. Laboratory/Biochemical tests. X. X. Serum pregnancy test. X. X. X. X. Cystoscopy3 Voiding cystourethrography (VCUG). X. Adverse events (AEs). X. Questionnaires. X. 4. 5. X. X. X. X. X. X. X. X. X. X. X. Concomitant medications Change Foley. X. Bladder instillation. X. Urine bag distribution. X. X. X. 24-hour urine collection6. X. X. X. Diary card/urine collection container distribution7. X. X. X. Urine collection8. X. X. X. X. X. X. X. X. Diary card collection Return urine samples9. 圖 14、新吸附型膀胱灌注液臨床收案規劃. 24. X.
(28) 3.9 尿液感染偵測儀執行現況 3.9.1 尿液感染監測系統概念圖 本先導性概念主要是希望長期使用導尿管患者,可以透過濁度感測的機制,來達到早期偵測 尿意濁度的變化,透過雲端資料庫的建立,來對患者發出警示訊息,以提醒醫護人員及早進行檢 測與治療,如圖 15 所示。. 通訊平台 藍芽傳送尿 液濁度訊號. WIFI傳輸. 藍芽傳輸 藍芽尿液感染偵測儀. 上傳雲端 伺服器 4G傳輸. WIFI/藍芽/Gateway. Server端. 通知醫護人員 王XX. 先生. 病歷號:12345678 主治醫師:陳醫師 護理師:葉XX 床位:A1. 超過警戒值 發出警示. 病歷資料 尿液狀態:. 異常! 有感染風險. 上醫囑系統 簽收醫囑. 濁度: 500. 圖 15、尿液感染監測系統概念圖. 25. 執行醫囑. 進行 治療.
(29) 3.9.2. 尿液感染偵測儀可行性問卷設計. 圖 16、尿液感染偵測儀可行性問卷. 26.
(30) 3.9.3. 尿液感染偵測儀可行性調查結果 1. 尿液感染偵測儀可行性調查初步結果如下: 1. 有 80%受訪者會採用一套可以監控尿液感染結合手機 APP 通知的設備。 2. 有 70%受訪者希望設備有感染徵兆通知。 3. 有 80%受訪者希望至少 1 小時偵測 1 次。 4. 有 60%受訪者希望使用電池電源。 5. 有 60%受訪者希望費用訂於 1000 元至 1 萬元。 6. 有 50%受訪者可以接受每周 1000 元至 3000 元。 2. 計畫目標與目的: 本先導性概念主要是希望長期使用導尿管患者,可以透過濁度感測的機制,來達到早期偵 測尿意濁度的變化,透過雲端資料庫的建立,來對患者發出警示訊息,以提醒醫護人員及早進 行檢測與治療. 3. 是否有類似品: 無類似品。 4. 市場調查: 受訪者表示有一定需求,但經營模式需要協同醫院或長照中心執行,需要有一定數量才會 有經濟效益。 5. 功能定位: 尿液感染監測功能、雲端資料庫、Wifi/藍芽功能、手機 APP、遠端監控感染情形。 6. 結論: 根據受訪者資料,顯示具有一定的市場需求,以及希望藉由本裝置來盡早通知醫護人員進 行檢查,來減少後續醫療不易之問題,建議可以朝及早偵測、低價、微小化等方向來進行,經 評估後顯示尿液感染偵測儀是可行的。. 27.
(31) 藍芽尿液感染偵測儀電路圖 已完成藍芽尿液感染偵測儀連接濁度計之電路設計圖,如圖 17 所示。. 圖 17、藍芽尿液感染偵測儀連接濁度計之電路設計圖. 28.
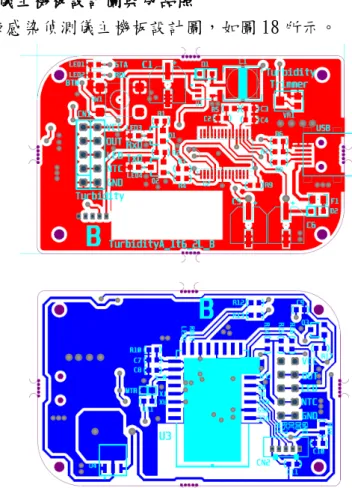
(32) 3.9.4. 藍芽尿液感染偵測儀主機板設計圖與成品照 已完成藍芽尿液感染偵測儀主機板設計圖,如圖 18 所示。. 圖 18、藍芽尿液感染偵測儀主機板設計圖與成品照. 29.
(33) 4. 結論 本團隊所有參與人員,非常感謝科技部育苗計畫與商品化中心長官們的協助,本案才得以順利進 行。以下是計畫執行現況。 臨床前測試現況達成率為 100%。3 月底會完成 Pics GMP 廠委託充填代工一批,完成產品物化性 測試驗證不含有害物質驗證(通過有毒重金屬(鉛/砷/鉻/汞/銅)測試、通過不純物測試與 USP85 內毒素測 試),通過 2 年的加速老化架儲期測試(ISO 11607-1),通過包材確效試驗,通過 ISO10993 生物相容性 6 項驗證測試,包含細胞毒性測試(Agar 法)、內皮刺激、敏感性測試、陰道黏膜刺激、溶血試驗與兔熱 源測試。 品質系統執行現況達成率為 100%。主要建置 ISO 13485 品質系統一階與二階文件,與一份 ISO14971 風險管理報告 1 份。 法規與臨床試驗現況達成率為 100%。已確認本阿博特 Absorbta®膀胱灌注液產品 TFDA 判定為第 三類醫療器材,美國 FDA 判定為 De novo 無類似品醫療器材。阿博特 Absorbta®膀胱灌注液第三方動 物實驗報告指出,本產品阿博特 Absorbta®從低劑量到高劑量的單次或多次滴注後沒有殘留物殘留,能 夠減少膀胱中的炎性細胞因子和細菌菌落,與對照組相比,治療組的炎症反應明顯減少,本阿博特 Absorbta®應被視為可靠且無害的醫療器械。臨床試驗申請已取得臺中榮民總醫院人體臨床試驗同意 函,目前正平行送審衛服部審查中。 尿液感染偵測儀執行現況達成率為 100%。目前設計尿液感染偵測儀可行性問卷 1 份。尿液感染 偵測儀可行性(Usability)分析報告 1 份。尿液感染偵測儀設計圖 1 份。 本案目前皆依照進度進行,唯獨人體臨床試驗案部分,目前尚未通過衛福部許可,本團隊會繼續 努力,以祈早日將產品商品化,造福長期使用導尿管患者。. 30.
(34) 2018 新加坡醫療展參展報告-貝爾醫材 這次貝爾醫材團隊很榮幸的受到「成功大學國際產學聯盟」的邀請,一同參加 2018 新加坡醫療展,這次同行的不只是成功大學新創醫材技術團隊,同時也有從學校 技術團隊商品化成功,成立公司的伙伴,這一團大約有三十多人,其中我們團隊有三 人參加,從台南出發至桃園星喜飯店,搭一早的飛機到新加坡。 這次的醫療展為期三天(8/28~9/1),兩年一次在新加坡展出,由德國杜塞爾多夫 公司主辦,是亞洲地區最知名的醫療展之一,吸引超過 40 個國家 800 家廠商參展。展 出地點為新加坡最有名的金沙會展中心,佔地超過 10000 平方公尺,據說使用率超過 90%,幾乎每週都有展覽在此展出使用率非常的高,展出樓層為一樓和地下一樓兩層。 這次參展的國家不只有亞洲國家,甚至有義大利,中東國家參展,門口有管制,只有 廠商和相關專業人員進出,未對一般民眾開放參觀。去年 2017 年,團隊也有在台北國 際醫療展展出,以相較於台北醫療展而言,台北醫療展參展單台灣為政府相關單位、 法人單位、醫院、學校、廠商較為多元化,規模雖然稍小,但是設展品質不輸新加坡 醫療展,台灣醫療展主打的是醫院的智慧醫療與照護服務,參展的醫院和廠商、單位 全力推廣其服務項目和方案之外也大力行銷本身之型象,除了廠商或相關人士參展, 更多的是讓民眾了解台灣的醫療科技和對於政府注重的長照問題民間廠商和醫院提供 了什麼相對應解決方案和產品。而這次參新加坡坡醫療展則是以醫療耗材、輔具為大 宗,大都是已經商品化的產品,而來參展的人,以我們攤位為例大部分都是廠商在找 新的產品和項目合作販售或是可以介紹行銷通路的代理商,是來找已經完成或成熟的 產品已經通過認証和即將可以上市販售的產品,商業的氣息比較濃厚。另外一種來參 展的人則是對於新的醫療科技有濃厚性趣的第一線專業人員像是醫生和護士為主。因 此在展覽期間我們可以發現,在成大團隊的攤位上尋問度最高的是覓特的 N95 口罩, 已經包裝經過修正設計且已經可以販售的成品。另外以技術方面來說,不論是專業人 士和業者,對於細菌檢測技術都很感興趣,這也是因為細菌致病在醫療上一直是一個 非常重要的問題,在臨床上細菌的抗藥性和抗生素的選擇是一直都存在的難題。有關 於本團隊的產品,在醫療技術的開發者或者是在第一線照護病人的醫生和護士等,都 非常感興趣也覺得非常實用,著實給了我們很大的鼓勵,不過同時也了解到,我們的 產品還需要經過人體試驗,只有通過人體試驗才能証明產品的價值與安全性,在此之 前醫生和醫材廠商都保持的保守的態度但樂觀其成。 這次的展覽,工業局特別邀請新加坡南洋理工大學洪維德教授來為台灣的業者 演講,並介紹台灣幾間優秀的醫材公司與他交流。洪教授在醫後療器材投入了非常多 的心力,在產官學界都有相當大的影響力。在他的演說指明了新加坡醫療的問題,像 出生率低,醫療人力嚴重不足需要引進國外的人力,但卻因為政策限制外勞引進使的 問題更加嚴重,這些方面和台灣的問題都很相似可以參考他們的解決方法。洪教授指 出,新加坡最大的優勢就是政府有足夠的強勢並有良好的部門整合,政府與產、學界 進行討論並資源整合,他們有來自世界各地的人材,人材是他們最重要的資產,而他 們讓這些人才來幫他們解決問題。這些問題是新加坡最先遇到的其他國家之後也會遇 到,而他們解決問題的方法不能只有他們適用,必需也可以在其他國家使用,然後將 這些解決方法出口。新加坡不生產,必需把產品和方案的設計走在最前端,也就是產 品最前面的概念和想法都要快速的去嚐試和執行,政府提供資金給企業、大學、研究 院解決問題,而其產生之產品或方案快速的在公家醫院可以直接使用,快速的發現問 題並改正讓產品不斷的改進而加速其產品上市的品質和時間,我覺得他們整個國家就 像是一個大型的新創公司,快速的設計然後試驗,以找出最有效的解法。.
(35) 再次感謝成大國際產學聯盟熱情的邀請團隊參加這次的醫療展,團隊在這次展 覽中吸收了許多寶貴的經驗,也了解到現在世界上的醫療器材產業的正進行的方向, 很多東西都是要親自感受才能真正的領會到,打開廣闊的視野。. 圖 1. 團隊技術產品和宣傳單展示陳列. 圖 2. 成大團隊展示會場實況,參觀者踴躍反應熱絡.
(36) 圖 3. 其他國家日本之醫療技術展示攤位,這次展覽許多展示攤位是以國家為單位的展 出,以表示國家醫療產業技術發展的實力。.
(37) Medical Fair Asia 新加坡醫材展參展心得報告_張嘉容 一、 參加會議經過 Medica Fair Asia 新加坡醫材展是東南亞指標性醫療展覽,今年於新加坡濱海灣金沙酒 店開幕,共有 23 個國家館及 62 國家廠商參展,參加廠商超過 1,050 家,這次的醫療展 為期三天,展出內容包含醫療設備、牙科設備、診斷儀器、醫用耗材、手術用具、復健 儀器及輔具等超過 10,000 項先進產品。 受到國立成功大學國際產學聯盟的參與邀約,我跟著貝爾醫材團隊赴新加坡參與本次 醫材展,參展期間從 2018 年 8 月 29 日至 2018 年 8 月 31 日為期三日,本人在 8 月 28 日從台灣桃園國際機場出發到新加坡濱海灣金沙酒店參加本次展覽,並於 9 月 1 日參 展結束後回國。 貝爾醫材團隊在本次醫材展展出”可攜式智慧膀胱灌洗尿液裝置”以及”新吸附型膀胱灌 洗劑”技術,以解決目前臨床上對於尿路感染(urinary tract infections,UTI)病患面臨的問 題,UTI 是院內感染最常見的感染部位,大約是所有院內感染的 30%至 40%,而其中 約有 90%與放長期留置導尿管有關,如脊髓損傷、長照病患、糖尿病患者、孕婦、患有 帕金森氏症、皮質性中風、腦腫瘤患者。根據美國疾病管制局 2007 年的估計,約有高 達 139,000 人次的導管相關泌尿道感染 (catheter-associated urinary tract infections, CAUTIs) 發生,CAUTIs 會增加病患的死亡率、致死率、住院費用。病患泌尿道感染引 致之血流感染,死亡率高達 32.8%。主要原因是細菌侵犯人體泌尿系統造成膀胱發炎、 嚴重者會導致敗血症而死亡。因此團隊開發出以物理性療法的灌洗劑,並搭配可攜式智 慧灌洗裝置及感測晶片,來協助長期使用導尿管患者降低泌尿道感染發生率,並能即時 監測感染的情況以爭取治療的黃金時期。. 圖 1.參展攤位與團隊合影.
(38) 參展期間與從事與泌尿感染相關工作的參觀者對於貝爾醫材的產品反應熱絡,特別是 長照相關的護理人員非常能體會目前病患所面臨的窘境,對於產品未來正式上市寄予 厚望。此外也有泌尿科醫師、製藥廠、晶片代工廠、獸醫師、新加坡醫材聯盟等相關 人員對於貝爾醫材深感興趣,與團隊有良好的互動並留下聯絡方式待未來進一步的合 作機會。. 圖 2. ”可攜式智慧膀胱灌洗尿液裝置”以及”新吸附型膀胱灌洗劑”裝置、產品之 宣傳展示. 二、 心得 三天的展期接觸到各種不同領域的專家,並進行各種不同角度的討論醫材問題,實在 是受益良多,很感謝成功大學國際產學聯盟和貝爾醫材團隊讓我有機會參加展覽開拓 視野。 在介紹產品的過程中,其中令我印象深刻的是有不少獸醫師對產品十分有興趣,鑒於 人體臨床試驗的門檻與漫長的時程,先往寵物泌尿道感染發展,不僅能讓公司先能獲 利,還能一邊強化產品的數據庫結果,或許是團隊可以考慮的方向。此外自己也因為 本次展覽認識了許多成大的新創團隊,看到成大的同伴們為了理想而奮鬥,對於成大 醫工的未來也充滿願景。 參展期間除了介紹團隊的產品也有到其他攤位參觀,一路參觀下來不僅學習到不少, 更感受到貝爾醫材產品的新穎性,特別是灌洗劑的部分目前面臨的競爭者不多,特別 是在本次展覽完全沒有看到相似競品。若能好好深入並專注發展,待產品發展成熟在 未來天時地利人和的情況下將能闖出一片天,不僅將泌尿道感染變成可預防的技術, 並,造福無數受泌尿道感染所苦的長照病患。.
(39) 圖 3.成大各新創團隊合影. 三、 建議 本次展覽共有 47 家臺灣廠商參與展出,且幾乎都是台灣醫療器材大廠如五鼎生技、榕 懋實業、雃博、益達醫療儀器、長庚醫學科技、伍氏科技、台灣舒潔、明基材料,身為 學研單位的成功大學雖很榮幸能登上如此大的舞台進行產品推廣,但也因為產品幾乎 都在開發階段,對於技術和想法的保護成為難以避免的問題。雖然貝爾醫材已經申請多 項專利保護,但仍有產品被抄襲的隱憂。 而在這次的展覽主辦單位也有安排新加坡的教授和台灣的業者交流,而新加坡醫療的 問題其實與台灣的十分類似,例如出生率低,醫療人力嚴重不足需要引進國外的人力, 但卻因為政策限制外勞引進使的問題更加嚴重,這些問題台灣都可以參考新加坡政府 的解決方法。.
(40) 四、 其他 貝爾醫材於新加坡醫療展發放手冊之內文 Technology Technology Type Contact Person. Bell Medical Device - Absorbta ® irrigating solution and Smart portable urine infection detection device □Biotechnology. ▓Device/Diagnostics. □Pharmaceutical. □Others:_____________-. Name: Ming-Chien Hung. Title: Postdoc. Telephone(work): +88662757575#63431#135. Mobile: +886-926129005. Email: 9999lv@gmail.com Link. line://ti/p/@fpt9019w As the world’s population ages, patients with long-term use of catheters have also increased significantly. As long as the catheter is used for more than 30 days, the chance of Catheter-associated Urinary Tract Infections (CAUTI) will approach 100%. CAUTI may lead to sepsis and even death. Therefore, CAUTI is one of the most. Technology Description. serious problems in hospitals and long-term care (LTC) centers. At present, among these catheter users, doctors can only use antibiotics to treat CAUTI. Unless the catheter is removed, CAUTI will occur again and again. However, antibiotics cause more problems due to drug resistance. Finally, there is no medicine to cure. To solve those problems, we develop a new alternative for urinary tract infections by irrigating Absorbta ® Irrigation Solution. It is a medical device for the bladder surface cleaning. It uses physical methods to remove surface microbes and other harmful substances without side effects and drug resistance. After irrigating the Absorbta, the symptoms of cystitis can be slow down. It also can effectively inhibit the spread of infection and reduce patient discomfort. We also develop the portable intelligent urine infection detection device, it is easy to use and safe. The portable intelligent device has an optical detection device and will send an alarm message when detected urine infection. Our device operated via the APP for alarm medical staff. Bacteria and other harmful substances will be removed from the patient’s bladder after irrigating the Absorbta by the portable intelligent device..
(41) Intellectual Property. We have obtained multinational patents from USA, UK, China, and Taiwan. 1. Estimated market value/business opportunity. Business Opportunity. The patients who undergo long-term catheterization is about 100 million, and those patients average have infection 3 times each year. The treatment procedure of our product including three times irrigation, each ext-factory price is $15 USD. Therefore, the total price for each patient is $135 UDS each year. If we have a 5% share of the market. The revenue is 675 million USD each year in USA. 2. Business model We will use the B2B2C model to sell Absorbta. After obtaining the medical material code and insurance code, it is sold to the LTC Center, the hospital, and the pharmacy channel via agents or dealers. 3. We are seeking the cooperative partner: distributors, agents, and access.. Figures. The steps of using Absorbta: When the CAUTI happen, we will inject the Absorbta into the bladder with 15-30 minutes. It can bind and remove harmful substances from the bladder to eliminate the bladder inflammation..
(42) Medica 德國杜賽道夫醫材展參展心得報告_張嘉容 一、 參加會議經過 Medica 德國杜賽道夫醫材展是全球最大之專業醫療器材展,每年 11 月中旬德國杜塞到 夫展覽公司會舉辦 MEDICA(醫療器材展)與 COMPAMED(醫藥原料及醫療器械展)的聯 合展覽,今年跨遍全球各地共有 6,186 家參展廠商,其中臺灣廠商佔 231 家,是第 8 大 參展國。根據主辦單位統計,除了地主國德國(計 1,204 家)外,前 10 大海外參展國依序 為中國大陸、美國、義大利、法國、英國、南韓、臺灣、西班牙,四天展期吸引大約 12 萬參訪人次,德國參訪者佔 34%,外國旅客佔 64%。 受到國立成功大學國際產學聯盟的參與邀約,我跟著貝爾醫材團隊赴德國杜賽道夫參 與本次醫材展,參展期間從 2018 年 11 月 12 日至 2018 年 11 月 15 日為期四日,本人 在 11 月 9 日從台灣高雄小港機場出發,中間在香港轉機到達杜賽道夫,稍作休息後於 11 月 11 日至 Medica 第 17 會場布展,並於 11 月 17 日參展結束後回國。. 圖 1.參展攤位與成大新創團隊 貝爾醫材團隊在本次 Medica 德國醫材展同上次新加坡醫材展為推廣和介紹產品,並希 望能在這廣大的舞台找到投資人以及合作廠商,貝爾醫材展出”可攜式智慧膀胱灌洗尿 液裝置”以及”新吸附型膀胱灌洗劑”技術,以解決目前臨床上對於尿路感染(urinary tract infections,UTI)病患面臨的問題。UTI 是院內感染最常見的感染部位,大約是所有院內 感染的 30%至 40%,而其中約有 90%與放長期留置導尿管有關,如脊髓損傷、長照病 患、糖尿病患者、孕婦、患有帕金森氏症、皮質性中風、腦腫瘤患者。根據美國疾病管 制 局 2007 年 的 估 計 , 約 有 高 達 139,000 人 次 的 導 管 相 關 泌 尿 道 感 染 (catheterassociated urinary tract infections, CAUTIs) 發生,CAUTIs 會增加病患的死亡率、致死 率、住院費用。病患泌尿道感染引致之血流感染,死亡率高達 32.8%。主要原因是細菌.
(43) 侵犯人體泌尿系統造成膀胱發炎、嚴重者會導致敗血症而死亡。因此團隊開發出以物理 性療法的灌洗劑,並搭配可攜式智慧灌洗裝置及感測晶片,來協助長期使用導尿管患者 降低泌尿道感染發生率,並能即時監測感染的情況以爭取治療的黃金時期。. 圖 2. ”可攜式智慧膀胱灌洗尿液裝置”以及”新吸附型膀胱灌洗劑”裝置、產品之 宣傳展示 參展期間貝爾醫材成員輪流駐守攤位,並對產品感興趣的參觀者進行解說。而在本次 展覽也有多家公司、代理商、相關廠商對貝爾醫材產品深感興趣,並認為產品符合臨 床需求具有開發價值,期間不少廠商都有留下聯絡方式。圖 3 為貝爾醫材團隊在參展 過程中為參展者解說產品,當參觀者想對產品有更進一步的了解,例如想知道更詳細 的實驗結果、市場、適應症、應用範圍等資訊,我們有準備解說資料為參觀者說明。. 圖 3. 團隊向參訪者解說產品.
(44) 在 Medica 展期我們也有造訪多家參展商攤位,尋求有機會合作的對象,因為想提升 智慧膀胱灌洗裝置的偵測性能和價值,故特別留意開發檢測技術的廠商。圖 4 為開發 利用影像判別細菌以及紅白血球技術之廠商,此項技術有機會應用到智慧膀胱灌洗裝 置,我們有和對方交換名片並希望未來有機會合作並提升產品的價值。. 圖 4. URISED 攤位. 二、 心得 這次也很感謝成功大學國際產學聯盟和貝爾醫材團隊讓我有機會參加展覽大開眼界, Medica 德國杜賽道夫醫材展不愧是全球最大之專業醫療器材展,光是展場的占地面積 就大得驚人,還有設置類似機場的輸送帶,且即使有四天的展期仍無法好好的將所有 攤位逛完,只能從中取捨特別感興趣的領域。 主辦單位在各方面的準備也十分周全,對於入場系統的規劃也比新加坡醫材展完善很 多,還有考慮到參展者的通勤問題。而對於不同主題館位的劃分也十分有系統,也提 供給許多頂尖的醫療大廠絕佳的展示舞台,有些廠商甚至把整座大型裝置搬運到會場 讓參展者實際體驗,十分新奇和有趣。 四天的展期比新加坡展接觸到更多不同領域的專家,也受到許多如何改善和推廣產品 的寶貴建議,這次成大參展的團隊也很多都已經成立公司,老師們都很樂意和我們交 流和分享創業經驗,並引導我們如何避開容易走的冤枉路,真的是非常感謝。 參展期間除了介紹團隊的產品也有到其他攤位參觀,主要是想尋找合作對象,期間也 得到不少方向和靈感。而這次雖然有許多廠商參展,但令人慶幸的是在本次展覽也沒 有看到和貝爾醫材相似的競品,也為團隊帶來不少信心。.
(45) 圖 5.成大各新創團隊合影. 圖 6. 德國 KALMS CONSOLTING GmbH 公司與貝爾醫材合影. 三、 建議 本次展覽貝爾醫材團隊也面臨同樣的問題,來參展的幾乎都是發展成熟的公司且數量 龐大,雖然參展有利於尋找合作廠商甚至是投資者,因為產品還在開發的階段,因此會 有技術和想法被抄襲的疑慮,這對新創團隊參展幾乎是不可避免的問題,但還是希望有 機會想出相應的配套措施。.
(46) 四、 其他 貝爾醫材於 Medica 醫療展發放之產品宣傳示意圖。. 圖 7.產品宣傳圖.
(47) 貝爾醫材 Medica 參展心得報告 1. 2018 MEDICA 醫材展介紹 本展為全球最大之專業醫療器材展,上屆(2017 年)計有來自全球 6,876 家 專業醫療器材廠商參展,展區共有 19 個展館,每年吸引全球超過 130 個國家 及高達 12 萬名國際買主前來參觀。 貝爾醫材團隊榮幸參與國立成功大學國際產學聯盟邀約,赴德國杜賽道 夫 2018 年 MEDICA 醫材展參展,參展期間從 2018 年 11 月 12 日至 2018 年 11 月 15 日,總共 4 天。圖 1 為參展前 1 天至展場佈展時,在展區門口所拍 的照片(2018 年 11 月 11 日)。圖 2 為展前一天與國立成功大學國際產學聯盟 一同合照(2018 年 11 月 11 日)。. 圖 1.參展前 1 天至展場佈展時,在展區門口所拍的照片(2018 年 11 月 11 日)。. 圖 2.展前一天與國立成功大學國際產學聯盟一同合照(2018 年 11 月 11 日) 2. 貝爾醫材團隊介紹.
(48) 貝爾醫材團隊本次共有兩位參展,由國立成功大學前瞻醫療器材科技中 心洪銘謙博士及國立成功大學醫工系博士生張嘉容助理一同參展。 貝爾團隊成員有成大醫院泌尿科 楊文宏醫師為 PI,成大醫院泌尿科歐 建慧醫師與前瞻醫材中心 翁振勛 組長為 Co-PI,成大前瞻醫材中心 洪銘謙 博士、成大生物醫學工程學系 黃聖洋博士、以及醫工系張嘉容博士生組 成。 貝爾醫材團隊本次展出”可攜式智慧膀胱灌洗尿液裝置”以及”新吸附型 膀胱灌洗劑”技術,本醫療器材為解決常見的尿路感染(UTI)所開發的。UTI 是 許多醫院院內感染最常見的感染部位,約佔所有院內感染的 30%至 40%,其 中又約有 90%與放長期留置導尿管有關,如脊髓損傷、長照病患、糖尿病患 者、孕婦、患有帕金森氏症、皮質性中風、腦腫瘤患者。主要原因是細菌侵 犯人體泌尿系統造成膀胱發炎、嚴重者會導致敗血症而死亡。本研究開發出 以物理性療法的灌洗劑,透過自行開發的可攜式智慧灌洗裝置及感測晶片, 來協助長期使用導尿管患者。透過本醫療器材可延緩年長者泌尿道感染病 程,並爭取驗尿時間,以供醫師對症下藥,”可攜式智慧膀胱灌洗尿液裝 置”以及”新吸附型膀胱灌洗劑”如圖 3 所示。圖 4 為貝爾醫材團隊代表洪 銘謙博士與參展產品一同拍照。圖 5 為貝爾醫材團隊洪銘謙博士及張嘉容助 理與產品合照。圖 6 為國立成功大學國際產學聯盟與貝爾醫材洪銘謙博士一 同拍照。圖 11. 拜訪康定股份有限公司郭義松董事長(左 3)(2018 年 11 月 14 日) 3. 推廣貝爾醫材產品 參展期間有多家公司、代理商、相關廠商來了解貝爾醫材產品,並且對 貝爾醫材產品了事有濃厚興趣,期間有印度代理商詢問是否能在印度推廣。 如圖 7 為印度代理商市場分析員 Dhruva Jagtap 一行人聆聽貝爾醫材產品。 圖 8 為德國 KALMS CONSOLTING GmbH 公司助理顧問 Christopher Kruse 一行 人了解貝爾醫材產品。圖 9. 冠達彩藝公司一行人聆聽貝爾醫材產品。 參展期間仙家美企業有限公司執行長陳茂松博士與廣泰金屬工業有限公 司周泰隆董事長醫同來成功大學展位參觀,並了解貝爾醫材產品,並進行相 關簡介,周董事長表示對貝爾醫材產品可以緩解長照泌尿道感染患者發炎感 染病症表示肯定。圖 10 為仙家美企業有限公司執行長陳茂松博士、廣泰金 屬工業有限公司周泰隆董事長、成功大學工程科學系林裕城教授、成功大學 國際產學聯盟周文凱協理、林昭芬經理、醫視科技公司陳建誠執行長、洪銘 謙博士(由左至右,2018 年 11 月 14 日) 4. 展後心得 本次貝爾醫材團隊很榮幸有機會受國立成功大學國際產學聯盟邀請展出 貝爾醫材產品,也感謝各位長官對貝爾醫材團隊的照顧,產品才得以順利展.
(49) 出,在此向各位長官說聲感恩、謝謝。 展會期間也參觀了相當多間的公司,可以發現到有許多公司擺出許多低階醫 材,如針筒、敷料、導管、手術器械、血壓計、內視鏡等,導致低階醫材淪為低 價競爭的局面,可以明顯看出是高度競爭的紅海市場。而中高階醫療器材設備廠 商則紛紛推出新產品,如 IOT 智慧診間、醫院器械清潔滅菌設備、影像診斷、雲 端 IVD 檢測產品等新一代產品,試圖推廣到世界上各大醫院與經銷商。 本次參展最大的震撼是大陸在低階醫材參展廠商數量數以百計,頭如數千 到數萬人次來佈展,產品重疊性太高,展位太小,逛得讓人頭皮發麻,而且不 容易看到低階產品的差異性與價值。在參展後深深地發覺,新創中高階醫療器 材是一條必須走的路,而且必須繞過中國大陸廠商你抄襲我,我抄襲你的惡 習,才會走出一條國際大廠該有的高技術門檻,不易抄襲的長遠的路。 貝爾醫材會繼續走創新的路,會著重在解決泌尿道疾病相關醫療器材產品 開發,希望從台灣開始,把泌尿道感染變成可預防的技術。. 圖 3. ”可攜式智慧膀胱灌洗尿液裝置”以及”新吸附型膀胱灌洗劑”產品展示。 (2018 年 11 月 12 日).
(50) 圖 4. 貝爾醫材團隊洪銘謙博士與參展產品一同拍照。. 圖 5. 貝爾醫材團隊洪銘謙博士及張嘉容助理與產品合照.
(51) 圖 6. 國立成功大學國際產學聯盟侯明欽博士(技轉中心副主任)、林昭芬經理、 周文凱協理與貝爾醫材洪銘謙博士一同拍照(由左至右, 2018 年 11 月 12 日)。. 圖 7. 印度代理商市場分析員 Dhruva Jagtap 一行人聆聽貝爾醫材產品。.
(52) 圖 8. 德國 KALMS CONSOLTING GmbH 公司助理顧問 Christopher Kruse 一行人 了解貝爾醫材產品。. 圖 9. 冠達彩藝公司一行人聆聽貝爾醫材產品(2018 年 11 月 13 日).
(53) 圖 10. 仙家美企業有限公司執行長陳茂松博士、廣泰金屬工業有限公司周泰隆董 事長、成功大學工程科學系林裕城教授、成功大學國際產學聯盟周文凱協 理、林昭芬經理、醫視科技公司陳建誠執行長、洪銘謙博士(由左至右,2018 年 11 月 14 日). 圖 11. 拜訪康定股份有限公司郭義松董事長(左 3)(2018 年 11 月 14 日).
(54) 107年度專題研究計畫成果彙整表 計畫主持人:楊文宏. 計畫編號:107-2321-B-006-006-. 計畫名稱:新吸附型膀胱灌洗劑 成果項目. 學術性論文. 量化. 期刊論文. 0. 研討會論文. 0. 專書. 0 本. 專書論文. 0 章. 技術報告. 0 篇. 其他. 0 篇. 專利權 國 內. 發明專利. 申請中. 0. 已獲得. 0. 新型/設計專利. 篇. 0. 商標權 智慧財產權 營業秘密 及成果 積體電路電路布局權. 0. 著作權. 0. 品種權. 0. 其他. 0. 件數. 0 件. 收入. 0 千元. 期刊論文. 0. 研討會論文. 0. 專書. 0 本. 專書論文. 0 章. 技術報告. 0 篇. 其他. 0 篇. 技術移轉. 學術性論文. 國 外. 質化 (說明:各成果項目請附佐證資料或細 單位 項說明,如期刊名稱、年份、卷期、起 訖頁數、證號...等) . 專利權. 發明專利. 0 件 0. 申請中. 0. 已獲得. 0. 新型/設計專利. 篇. 0. 商標權 智慧財產權 營業秘密 及成果 積體電路電路布局權. 0. 著作權. 0. 品種權. 0. 其他. 0. 0 件 0.
(55) 技術移轉. 本國籍 參 與 計 畫 人 力 非本國籍. 件數. 0 件. 收入. 0 千元. 大專生. 3. 計畫期間幫助3位醫學工程系大學生考取 碩士班. 碩士生. 1. 計畫期間幫助1位醫學工程系碩士生考取 醫學工程系博士班. 博士生. 0. 博士後研究員. 2. 專任助理. 1. 大專生. 0. 碩士生. 0. 博士生. 0. 博士後研究員. 0. 專任助理. 0. 其他成果 (無法以量化表達之成果如辦理學術活動 、獲得獎項、重要國際合作、研究成果國 際影響力及其他協助產業技術發展之具體 效益事項等,請以文字敘述填列。) . 聘請洪銘謙博士後研究員與黃聖洋博士 後研究員來協助執行本計畫 人次 聘請專任助理1名來協助本案科研採購事 宜. 本計畫支持技術產品於2018至台北、新加坡、德國國際醫 療展設攤參展,宣傳台灣醫療科技實力之外並增進與國際 廠商交流。此外,本技術產品榮獲第十五屆國家新創獎臨 床應用產品。.
(56) 科技部補助專題研究計畫成果自評表 請就研究內容與原計畫相符程度、達成預期目標情況、研究成果之學術或應用價 值(簡要敘述成果所代表之意義、價值、影響或進一步發展之可能性)、是否適 合在學術期刊發表或申請專利、主要發現(簡要敘述成果是否具有政策應用參考 價值及具影響公共利益之重大發現)或其他有關價值等,作一綜合評估。 1. 請就研究內容與原計畫相符程度、達成預期目標情況作一綜合評估 ■達成目標 □未達成目標(請說明,以100字為限) □實驗失敗 □因故實驗中斷 □其他原因 說明: 2. 研究成果在學術期刊發表或申請專利等情形(請於其他欄註明專利及技轉之證 號、合約、申請及洽談等詳細資訊) 論文:□已發表 □未發表之文稿 □撰寫中 ■無 專利:□已獲得 □申請中 ■無 技轉:□已技轉 □洽談中 ■無 其他:(以200字為限) 3. 請依學術成就、技術創新、社會影響等方面,評估研究成果之學術或應用價值 (簡要敘述成果所代表之意義、價值、影響或進一步發展之可能性,以500字 為限) 台灣社會人口結構型態已有別於過往的「高齡化社會」,老年人口已遠超過 7%門檻,佔達總人口的14%,正式進入「高齡社會」,老年人口在亞洲排名第 3,人口老化的速度只增不減。因此,高齡長期照護的需求激增, 政府機關更 提出長照2.0政策應對此問題。在長照中心內,長期安裝導尿管患者在使用導 尿管超常因細菌滋生導致泌尿道感染,併發腎盂腎炎及續發性菌血症而導致死 亡。本計畫開發之創新醫材為一種吸附型膀胱灌洗劑灌洗膀胱,藉由吸附性材 料本身具有很大的比表面積與吸附特性,吸附細菌產生的內、外毒素的效果 ,減緩細菌對生物體的致病性,協助醫師爭取對症下藥時間,減輕醫護人員照 護之人力負擔,減少醫院、養護中心感染控制成本,以達到將醫療資源用到最 需要的地方,造福大眾。 4. 主要發現 本研究具有政策應用參考價值:■否 □是,建議提供機關 (勾選「是」者,請列舉建議可提供施政參考之業務主管機關) 本研究具影響公共利益之重大發現:□否 □是 說明:(以150字為限).
(57)
數據



Outline
相關文件
Wilcoxon Rank Sum test (Mann- Whitney U test). Kruskal-
Repeated Measure ANOVA / Friedman test McNemar test / Cochran’s Q
D Global warming causes less precipitation, thus causing the glaciers to retreat.. •
which can be used (i) to test specific assumptions about the distribution of speed and accuracy in a population of test takers and (ii) to iteratively build a structural
By correcting for the speed of individual test takers, it is possible to reveal systematic differences between the items in a test, which were modeled by item discrimination and
Tokamak Fusion Test Reactor 1982 - 1997. JET
For consistent predictions or strongly ordinal costs, if g makes test error ∆ in the induced binary problem, then r g pays test cost at most ∆ in ordinal ranking. a one-step
For consistent predictions or strongly ordinal costs, if g makes test error ∆ in the induced binary problem, then r g pays test cost at most ∆ in ordinal ranking. a one-step