國立臺灣大學 公共衛生學院 公共衛生碩士學位學程 碩士論文-實務實習成果報告
Master of Public Health Degree Program College of Public Health
National Taiwan University Master Thesis ─ Practicum Report
不同分子型態乳癌的腫瘤浸潤淋巴細胞反應以及不同 種族流行病學研究
Tumor Infiltrating Lymphocyte Response and Racial Difference in Epidemiology to Different Molecular Types
of Breast Cancer 李佳晴 CHIA-CHING LEE
校內單位指導教師:盧子彬 博士 實習單位指導教師:林季宏 博士
Advisor:
TZU-PIN LU, Ph.D.
Preceptor:
CHING-HUNG LIN, Ph.D.
中華民國 110 年 1 月 January, 2021
論文口試委員審定書
謝辭
終於順利完成了我的論文,回想寫論文的過程真是困難重重,因為平常還要 上班,所以總是拿工作很忙當作不寫論文的藉口,導致論文完成的期限一延再延,
也逐漸消耗我一開始想要積極拿到碩士學位的熱忱,再加上對生物醫學領域的不 熟悉,使得我遲遲無法開始動筆寫論文,甚至萌生出是否要放棄的念頭,還好這 個念頭只是一閃而過,最終還是堅持下來完成了這篇論文。
從 104 年決定要報考研究所時,就受到健保署長官與同事的鼓勵及支持,先 是有李丞華副署長及郭垂文專門委員幫忙寫推薦函,成功地進入學校後,因為需 要利用白天時間至學校上課,感謝同事詩蓉、鈺嵐、賢悅、書瑋、佩琪、欣蓉姐、
茉莉姐及香豔姐幫忙處理公務,在我想要請假的時候從來沒有第二句話,讓我能 無後顧之憂的在學校上課學習。
到了二年級需要修習公共衛生實務專題討論這門課時,感謝指導教授子彬老 師的引導,使我確定了我的研究題目,自此踏入了微陣列資料分析的世界,在完 成論文的過程中對於基因、微陣列資料、R 語法、ESTIMATE、CIBERSORT 等資 訊,我總充滿著各式各樣的問題,謝謝子彬老師、敬軒、露葶及涵晴總是可以耐 心地解答我的疑惑,感謝霽修提供我的各項協助和陪伴。感謝子彬老師幫我找到 實習的地點,也謝謝林季宏醫師願意擔任我的校外指導老師,並且在實習期間給 了我許多幫忙,也指導了我的研究方向及內容。感謝口試委員林季宏醫師、黃其 晟醫師、惟量老師對我的論文提出各項的指導與建議,使我可以更加完善我的論 文。
最後要感謝我的媽媽在我唸書這段期間對我的支持與包容,總是無條件的支 持我想要做的事,當我最大的後盾。
摘要
惡性腫瘤自民國 71 年起即位列十大死因的第 1 名,乳癌則是從民國 92 年起 首度超越子宮頸癌拿下國人女性惡性腫瘤發生率的第 1 名,中華民國 107 年癌症 登記報告指出乳癌為女性癌症發生率的第 1 名,死亡率則是第 2 名,顯見乳癌對 國人婦女所造成的威脅,近年來隨著分子生物科技的發展,乳癌已被視為是一種 異質性的疾病,不同亞型的乳癌有不同的癌症治療計畫,如何讓罹癌婦女依據自 身的健康情形,打造獨一無二的治療計畫,則仰賴於對乳癌亞型更深入的認識。
本研究旨在探討種族對不同乳癌亞型間腫瘤浸潤淋巴細胞的影響暨乳癌亞 型、種族、年齡、腫瘤浸潤淋巴細胞對乳癌復發與死亡的影響,分別使用了 ESTIMATE 和 CIBERSORT 方法,前者得到了免疫分數用來推估免疫細胞的浸潤 程度,免疫分數愈高代表免疫浸潤淋巴細胞愈多,後者獲得了 22 種免疫細胞的相 對比例。資料來自基因表達資料庫(Gene Expression Omnibus ,GEO)獲得原發性乳 癌的基因表達微陣列,一共分析 7 個資料集的資料,分別是西方資料集 4 個 (GSE58644、GSE6532、GSE21653、GSE25066)和東方資料集 3 個(GSE20685、
GSE131769、GSE102484)。
在這項研究發現東方乳癌患者相較於西方乳癌患者更為年輕(p 值< 2.2E-16)、
免疫分數較高(p 值=4.36E-02)、具有較長的復發時間(p 值=1.50E-02)。東西方乳癌 的免疫分數除了受到乳癌亞型的影響外,年齡也會產生交互作用,在≦50 歲的 Luminal A 亞型可看到西方乳癌的免疫分數高於東方乳癌(p 值=2.40E-02),這可能 是年輕的乳癌在種族上受到環境因素的影響,才導致此一相反的結果。東西方的 免疫細胞組成在記憶 B 細胞、漿細胞、CD8 T 細胞、濾泡輔助 T 細胞、Treg 細胞、
活化的自然殺手細胞、單核球、M1 巨噬細胞、M2 巨噬細胞、休眠樹突細胞和嗜 中性白血球之間有顯著差異(q 值介於:4.72E-15~6.41E-136)。休眠記憶 CD4 T 細
胞量(HR=0.77 ,95% CI:0.63~0.94)和休眠肥大細胞(HR=0.73 ,95% CI:0.59~0.90)在 乳癌病人浸潤愈多愈不容易復發,活化肥大細胞在乳癌病人浸潤愈多愈容易復發 (HR=1.37 ,95% CI:1.13~1.66),Gamma delta T 細胞浸潤愈多愈不容易死亡
(HR=0.51 ,95% CI: 0.33~0.78)。
在乳癌的治療上若能考慮各乳癌亞型、種族、年齡、免疫細胞組成的不同,
找出真正可以從治療中受益的病人,減少過度治療或療效不足的問題,減少藥物 的副作用,給予病人更準確有效的治療策略,以達個人化醫療的目標,相信可以 減少醫療浪費並把握黃金治療時間。
關鍵字:乳癌、分子亞型、腫瘤浸潤淋巴球
Abstract
Malignant tumor is the leading cause of death in Taiwan for 39 years. Breast cancer have become the most common cancer among women, and have exceeded cervical cancer in Taiwan since 2003. Furthermore, the mortality of breast cancer ranks second in cancer among women. Breast cancer is regarded as a heterogeneous disease because of development of molecular biotechnology in recent years. Breast cancer with different subtypes has different responses to systemic and local therapies. Therefore, unique treatments can be designed for individual based on expanding our understanding of disease.
This study aimed to assess the TILs influence on breast cancer with different molecular subtypes. Additionally, we expected to explore the prognosis or recurrence contribution of breast cancer subtype, race, age and tumor-infiltrating lymphocytes among patients with breast cancer.This study analysis was applied to gene expression microarray data from primary breast tumors , which were obtained from the Gene Expression Omnibus (GEO), including four data sets from cohorts of Western patients (GSE58644, GSE6532, GSE21653, and GSE25066), and three data sets from a cohort of Asian patients (GSE20685, GSE131769, and GSE102484). ESTIMATE and
CIBERSORT were used in this study. Immune score which calculated with ESTIMATE indicates the amount of tumor-infiltrating immune cells. There was a positive
correlation between immune scores and tumor-infiltrating lymphocytes. The proportions of 22 immune cell subsets from tumor transcriptomes were calculated with
CIBERSORT.
The results showed that Eastern patients were younger (p value< 2.2e-16), higher
immune score (p value=4.36E-02) and longer DFS (p value=1.50E-02) than Western patients. The immune scores of breast cancer were affected by breast cancer subtypes, age, both of Eastern and Western patients. Moreover, there is interaction between race and immune scores. Younger (≤50 years) Western patients with breast cancer had a significantly higher immune score in the Luminal A subtype (p value =2.40E-02).
Environment factor is likely to be the reason. Statistical analysis was significant that memory B cells,plasma cells,CD8 T cells,follicular helper T cells,regulatory T cells, activated NK cells,monocytes,M1 macrophages,M2 macrophages,resting dendritic cells,and neutrophils had different percentage between races(q value:
4.72E-15~6.41E-136). Higher resting CD4 T cell (HR=0.77 ,95% CI:0.63~0.94) and resting mast cell (HR=0.73 ,95% CI:0.59~0.90) were associated with longer DFS.
Higher activated mast cell was associated with shorter DFS (HR=1.37 ,95%
CI:1.13~1.66). Higher gamma delta T cell was associated with longer OS HR=0.51 ,95% CI: 0.33~0.78).
Treatment strategies should be considered for subtype, race, age, the composition of tumor-infiltrating lymphocytes. Hence, it may discover patients who could have benefit from therapies, and reduce occurrence of overtreatment, insufficient efficacy, and side effects of medicine. More accurate and effective treatment strategies to achieve the goal of personalized medical treatment are believed to reduce medical waste and grasp the golden treatment time.
Keywords:breast cancer,molecular subtype, tumor-infiltrating lymphocyte
目錄
論文口試委員審定書 ... i
謝辭 ... ii
摘要 ... iii
Abstract ... v
第一章 導論 ... 1
第一節 研究動機 ... 1
第二節 研究目的 ... 4
第三節 研究問題 ... 4
第四節 文獻回顧 ... 4
壹、 乳癌分子亞型的介紹 ... 4
貳、 乳癌亞型的流行病學 ... 6
參、 腫瘤的微環境 ... 8
肆、 腫瘤浸潤淋巴細胞(TILs) ... 12
伍、 乳癌亞型與腫瘤浸潤淋巴細胞(TILs)的關聯 ... 14
第五節 研究假設 ... 15
第二章 材料與方法 ... 16
第一節 研究方法 ... 16
第二節 研究架構 ... 17
第三節 數據處理 ... 17
壹、 資料來源 ... 17
貳、 變項定義 ... 18
參、 統計分析 ... 19
第三章 結果 ... 21
第一節 基本資料描述性統計 ... 21
第二節 乳癌亞型與免疫分數的差異及預後 ... 21
第三節 以乳癌亞型分層比較不同種族乳癌免疫分數的差異 ... 22
第四節 乳癌亞型與 22 個免疫細胞的差異 ... 22
第五節 以乳癌亞型分層比較不同種族乳癌的 22 個免疫細胞差異 ... 28
第六節 以乳癌亞型分層比較不同種族乳癌的抗腫瘤及促腫瘤免疫細胞差異 ... 30
第七節 單變項存活分析 ... 30
壹、 乳癌亞型、免疫分數、年齡、種族變項的存活分析 ... 30
貳、 22 種免疫細胞變項的存活分析 ... 31
第八節 多變項存活分析 ... 32
第四章 討論 ... 34
參考文獻 ... 77
圖目錄
圖 1、乳癌亞型間免疫分數差異 ... 70
圖 2、免疫分數組別在各乳癌亞型的 DFS 曲線 ... 71
圖 3、免疫分數組別在各乳癌亞型的 OS 曲線 ... 72
圖 4、依乳癌亞型分層繪製東西方乳癌免疫分數箱型圖 ... 73
圖 5、大於 50 歲者依乳癌亞型分層繪製東西方乳癌免疫分數箱型圖 .. 74
圖 6、小於等於 50 歲者依乳癌亞型分層繪製東西方乳癌免疫分數箱型圖 ... 75
圖 7、免疫細胞在不同乳癌亞型間的差異 ... 76
表目錄
表 1、資料集的基本訊息 ... 39
表 2、7 個資料集的描述性統計 ... 40
表 3、乳癌亞型間免疫分數的差異 ... 41
表 4、依乳癌亞型分層,比較不同種族的免疫分數差異 ... 42
表 5、依乳癌亞型及年齡分層,比較種族與免疫分數之間的差異 ... 43
表 6、比較乳癌亞型與免疫細胞的差異 ... 44
表 7、未受刺激 B 細胞乳癌亞型間的比較 ... 45
表 8、記憶 B 細胞乳癌亞型間的比較 ... 46
表 9、漿細胞乳癌亞型間的比較 ... 47
表 10、CD8 T 細胞乳癌亞型間的比較 ... 48
表 11、休眠記憶 CD4 T 細胞乳癌亞型間的比較 ... 49
表 12、濾泡輔助 T 細胞乳癌亞型間的比較 ... 50
表 13、Treg 細胞乳癌亞型間的比較 ... 51
表 14、單核球乳癌亞型間的比較 ... 52
表 15、M0 巨噬細胞乳癌亞型間的比較 ... 53
表 16、M1 巨噬細胞乳癌亞型間的比較 ... 54
表 17、M2 巨噬細胞乳癌亞型間的比較 ... 55
表 18、休眠樹突細胞乳癌亞型間的比較 ... 56
表 19、休眠肥大細胞乳癌亞型間的比較 ... 57
表 20、嗜中性白血球乳癌亞型間的比較 ... 58
表 21、比較不同種族的免疫細胞差異(樣本=2,615) ... 59
表 22、在 Luminal A 亞型中比較不同種族的免疫細胞差異(樣本=791) 60 表 23、在 Luminal B 亞型中比較不同種族的免疫細胞差異(樣本=800) 61 表 24、在 HER2-enriched 亞型中比較不同種族的免疫細胞差異(樣本=373) ... 62
表 25、在 Basal-like 亞型中比較不同種族的免疫細胞差異(樣本=529) . 63 表 26、在 Normal breast-like 亞型中比較不同種族的免疫細胞差異(樣本 =122) ... 64
表 27、比較不同種族在抗腫瘤及促腫瘤免疫細胞的差異 ... 65
表 28、乳癌亞型、年齡、免疫分數、種族的單變項存活分析 ... 66
表 29、免疫細胞的單變項存活分析_DFS ... 67
表 30、免疫細胞的單變項存活分析_OS ... 68
表 31、免疫細胞的多變項存活分析 ... 69
第一章 導論
第一節 研究動機
由於醫療科技的進步,臺灣的疾病型態從早期的傳染性疾病,近五十年來轉 變成以慢性疾病和惡性腫瘤為主,惡性腫瘤更是自民國 71 年起即位列十大死因的 第 1 名1,乳癌則是從民國 92 年起首度超越子宮頸癌拿下國人女性惡性腫瘤發生 率的第 1 名2,從中華民國 100 年~107 年癌症登記報告中可知,近年來乳癌占據女 性癌症發生率的第 1 名,死亡率則是從 100 年~104 年的第 4 名,自 105 年躍升為 第 3 名,在 106 年起更是推進至第 2 名3。
根據國際癌症研究總署(IARC)2017 年發表的五大洲女性乳癌年齡標準化發生 率第 11 版(Cancer Incidence in Five Continents,CI5 XI)2008~2012 年統計資料,美國 (北美洲)女性乳癌年齡標準化發生率每十萬人口約 83.8,加拿大英屬哥倫比亞省(北 美洲)女性乳癌年齡標準化發生率每十萬人口約 79.6;荷蘭(歐洲)女性乳癌年齡標 準化發生率每十萬人口約 99,義大利米蘭(歐洲)女性乳癌年齡標準化發生率每十萬 人口約 96.6,法國下萊茵(歐洲)女性乳癌年齡標準化發生率每十萬人口約 96.4,英 國(歐洲)女性乳癌年齡標準化發生率每十萬人口約 87.4;阿根廷查科省(拉丁美洲 和加勒比)女性乳癌年齡標準化發生率每十萬人口約 47.2,祕魯利馬(拉丁美洲和加 勒比)女性乳癌年齡標準化發生率每十萬人口約 40.8,智利安托法加斯塔(拉丁美洲 和加勒比)女性乳癌年齡標準化發生率每十萬人口約 31.7;烏干達洽冬鬥(非洲)女 性乳癌年齡標準化發生率每十萬人口約 29.1,南非共和國東開普省(非洲)女性乳癌 年齡標準化發生率每十萬人口約 12.7;日本廣島(亞洲)女性乳癌年齡標準化發生率 每十萬人口約 63.9,菲律賓馬尼拉(亞洲)女性乳癌年齡標準化發生率每十萬人口約 53.9,馬來西亞檳榔島(亞洲)女性乳癌年齡標準化發生率每十萬人口約 51.7,南韓 (亞洲)女性乳癌年齡標準化發生率每十萬人口約 41.2,中國北京(亞洲)女性乳癌年
齡標準化發生率每十萬人口約 40.9,泰國曼谷(亞洲)女性乳癌年齡標準化發生率每 十萬人口約 35,臺灣(亞洲)女性乳癌年齡標準化發生率每十萬人口約 59.3。由此可 知,北美洲和歐洲是乳癌高發生率的地區,亞洲和拉丁美洲的發生率次之,非洲 是乳癌低發生率的地區,因此可看出乳癌的發生率因地理位置而有所差異,隱含 著種族和乳癌的發生有關。
從上述地區的 CI5 XI 乳癌年齡別發生率可知,北美洲乳癌發生率的年齡高峰 出現在約 65~80 歲,歐洲乳癌發生率的年齡高峰出現在約 65~85 歲,拉丁美洲和 加勒比乳癌發生率的年齡高峰出現在約 65~80 歲,非洲乳癌發生率的年齡高峰出 現在約 50~60 歲,亞洲乳癌發生率的年齡高峰出現在約 45~60 歲,臺灣乳癌發生 率的年齡高峰出現在約 45~55 歲。由此可知,非洲及亞洲的女性乳癌患者相較於 北美洲、歐洲及拉丁美洲和加勒比的女性乳癌患者年輕,這也意味著不同種族罹 患乳癌的好發年齡層有著明顯的不同。
由於乳癌的高發生率,在女性惡性腫瘤的重要性不可言喻,近年來,隨著分 子生物科技、基因體學、腫瘤生物學的進展,使得以往認為乳癌是一個單獨的疾 病,轉變成將乳癌腫瘤類型,依據分子醫學的分類,將乳癌區分為 4~5 種亞型,
而每一種亞型被視為是一種不同的獨立疾病,會因為期別、腫瘤位置、年齡的不 同而有不同的治療方式、預後、復發的時間及形式4。
早在 19 世紀末美國外科醫師科禮(William Coley)就發現細菌感染引發的免 疫反應,可能會提升免疫力,進而使腫瘤細胞變小或消失,正式開啟了「免疫療 法」的新序章,但可惜的是免疫療法未能引起大眾的注意,直到 20 世紀末美國教 授艾利森(James P. Allison)及日本教授本庶佑(Tasuku Honjo)分別發現了免疫系統 的煞車器 cytotoxic T lymphocyte antigen 4(CTLA-4)及 programmed death 1(PD-1),
自此免疫療法造成了一股新浪潮,2011 年美國食品藥品管理局(FDA)即核准免疫療 法用於治療黑色素細胞瘤5,到了 2015 年美國前總統卡特使用了抗 PD-1 的免疫檢
查點抑制劑成功的治癒轉移到腦部的黑色素瘤,至此免疫療法開始聲名大噪,成 為癌末病人的一道曙光,臺灣全民健康保險署亦於 2019 年 4 月開始給付免疫療法 相關藥品。
常聽到有人詢問為什麼相同癌症期別的病人在接受手術、化學治療、放射線 治療或標靶藥品後,卻對癌症治療的反應大不相同,這是由於腫瘤的微環境所造 成,腫瘤細胞以外的細胞與物質就稱之為腫瘤微環境,包括腫瘤相關巨噬細胞、
腫瘤相關纖維母細胞、血管結構、細胞外基質、免疫細胞等物質與腫瘤細胞共同 建構出一個環境,對腫瘤細胞可以造成促進或是抑制的作用。我們可以把腫瘤細 胞看成一顆種子,腫瘤微環境則是種植種子的土壤,一顆種子是否能開花結果,
除了土壤本身的好壞,更是受到陽光、水份、溫度、濕度、肥料等因素的影響,
因此可以說腫瘤微環境在抗癌成功的路途上占有舉足輕重的位置。而免疫療法則 是利用自身的免疫系統去攻擊腫瘤細胞,也就是創造出不利於腫瘤細胞生長的環 境,進而消滅腫瘤細胞,若免疫療法和化學治療、放射線治療或是標靶藥物合併 使用,創造出更適合這些療法治療的環境,相信更能事半功倍的殺死腫瘤細胞。
隨著癌症治療的進步與推陳出新,精準醫療已成為當代癌症治療最重要的議 題,過去的傳統醫療,是指將相同的藥品無差別地使用在不同病人的身上,因此 可能會對病人衍生出三種效果,分別是有效、無效或產生副作用的情況,造成浪 費醫療資源,增加不必要的醫療支出,而精準醫療則是在診斷的步驟中,增加一 個生物標記的檢測,進而篩選出適合使用相對應藥品治療的病人,給予病人更準 確有效的治療策略,以達個人化醫療,也就是對症下藥的概念,可減少醫療浪費 並把握黃金治療時間6; 7。因此,若我們能對不同種族、年齡、乳癌亞型的腫瘤浸 潤淋巴細胞有更深一層的認識,將可為每個癌症病人量身打造最適合的治療方 法,減少不必要的多餘治療及其衍生的副作用,相信可以減少醫療浪費並把握黃 金治療時間。
第二節 研究目的
基於上述研究動機,本研究有下列二項研究目的:
一、 探討種族對不同乳癌亞型間腫瘤浸潤淋巴細胞的影響。
二、 探討乳癌亞型、種族、年齡、腫瘤浸潤淋巴細胞對乳癌復發與死亡的影 響。
第三節 研究問題
一、 種族是否會影響初次診斷乳癌的年齡?
二、 種族是否會影響罹患乳癌亞型的類別?
三、 乳癌亞型間免疫分數是否有所不同?
四、 種族是否會影響乳癌亞型間的免疫分數?
五、 種族對乳癌亞型間免疫分數的差異是否會受到年齡的影響?
六、 乳癌亞型是否會影響腫瘤浸潤淋巴細胞的數量?
七、 哪些乳癌亞型會影響腫瘤浸潤淋巴細胞的數量?
八、 種族是否會影響腫瘤浸潤淋巴細胞的數量?
九、 種族是否會影響乳癌亞型間腫瘤浸潤淋巴細胞的數量?
十、 乳癌亞型、種族、年齡、免疫分數及腫瘤浸潤淋巴細胞是否會影響乳癌 的復發與死亡?
第四節 文獻回顧
壹、 乳癌分子亞型的介紹
Perou et al. 8在 Nature 發表了以微陣列分析人類乳癌腫瘤的基因表達,並確定
了乳房上皮生物學的 4 種亞型,也就是雌激素接受體陽性(ER+) /管腔細胞型 (Luminal-like)、基底細胞型(Basal-like)、人類上皮生長因子第二型接受器陽性 (Erb-B2+)及類正常乳腺型(Normal breast),因為乳癌亞型有不同的流行病學危險因 子、不同的自然史,以及對全身性或局部性治療反應的不同,因此推翻了過去將
乳癌視為單一的疾病的理論,而應將乳癌視為不同的疾病進行治療9。隨後的研究
又將管腔細胞型(Luminal-like)分為管腔細胞 A 型(Luminal A)和管腔細胞 B 型 (Luminal B)10。乳癌由於亞型、細胞組成成份、臨床結果的不同,在發展有效的預 測臨床和預後的腫瘤分類形成了一個挑戰,因此使用了微陣列分析和反轉錄聚合 酶的資料,開發出以 50 個基因亞型的預測因子模型,用來改善乳癌病人的預後及 判斷乳癌病人是否需要接受化學治療,被稱作微陣列的預測分析 50(prediction analysis of microarray 50,PAM 50)11。
基因表現譜(gene expression profiling,GEP)由於成本、複雜性的考量,以及對 於新鮮冷凍組織的要求,限制了基因表現譜在臨床上的實用性,因此發展出了免 疫組織化學染色法(immunohistochemistry, IHC)的替代物來定義分子亞型,免疫組 織化學染色法可用於檢測雌激素接受體(ER)、黃體素接受體(PR)和增殖的替代標記 Ki-67,免疫組織化學染色法或原位雜交化學技術(ISH)則可用於檢測人類上皮生長 因子第二型接受器(Her-2)的過度表達或增殖12; 13。在 2011 年 St Gallen 國際專家共 識會議使用了免疫組織化學染色法定義了 4 種乳癌內源性亞型9:
一、Luminal A:ER+ and/or PR+, HER2-, Ki-67 low(<14%) 二、Luminal B
(一) HER2 negative:ER+ and/or PR+, HER2-, Ki-67 high(≥14%)
(二) HER2 positive:ER+ and/or PR+, HER2 over-expressed or amplified, any Ki-67
三、HER2 positive(non luminal):ER- and PR-, HER2 over-expressed or amplified
四、Triple negative (ductal):ER- and PR-, HER2-
後來陸續召開的 St Gallen 國際專家共識會議或是其他的相關研究,對於區分 管腔細胞 A 型(Luminal A)和管腔細胞 B 型(Luminal B)生物標記 Ki-67 的最佳切點 閾值仍然是有爭論的,大部分的專家可以接受 Ki-67 約在 20~29%之間定義為管腔 細胞 B(Luminal B),不過會受限於每個地區實驗室的病理品質而有所不同,但能確 定的是 Ki-67 是乳癌重要的預測及預後指標12; 14; 15。
貳、 乳癌亞型的流行病學
乳癌不論在臨床上或是生物學上都可被看作是一種異質性的疾病,在加拿大 安大略省的 2010~2012 年的研究,依據免疫組織化學染色法(IHC)將乳癌分為 4 型,
發現管腔細胞 A 型(Luminal A)的發生率最高,存活率最佳,三陰性(Triple negative) 的發生率次之,存活率最差,管腔細胞 B 型(Luminal B)的發生率第三,存活率第 二,人類上皮生長因子第二型接受器過度表現型(HER2 over-expressed)的發生率最 低,存活率第三,因此可知道荷爾蒙受體陽性的乳癌比起荷爾蒙受體陰性的乳癌 有較高的存活率及較低的死亡率,荷爾蒙受體陽性乳癌發生率比較常發生在停經 後婦女,荷爾蒙受體陰性乳癌發生率比較常發生在停經前婦女16; 17; 18; 19,三陰性 乳癌好發在年輕女性較具侵襲性,時常或偶爾會帶有 BRCA 突變20。
由於分子組成因素和表觀遺傳學的不同,在非裔美國女性身上比起美國白人 女性可以觀察到較差的乳癌預後,具有非洲血統女性的乳癌相較於美國白人女性 的乳癌,其腫瘤細胞更具有侵襲性的特徵(組織學的分期較後期、ER、PR、HER2 三種指標均呈現陰性),無疾病存活率(DFS)及整體存活率(OS)較差,預後也較差,
而且比較容易阻礙標靶治療。非裔美國女性的乳癌好發在年輕女性,特別是在 50 歲以下的年輕女性21。
乳癌的發生率、死亡率、預後以及分子型態會因為種族而有所不同,在 2007
年美國的調查研究中發現,乳癌發生率最高的是非西班牙裔白人,接下來依續是 非裔美國人、亞裔美國人/太平洋島上居民、西班牙裔/拉丁美洲裔的美國女性,相 反的,乳癌死亡率最高的是非裔美國人,死亡率最低的是亞裔美國人,雖然亞裔 美國人相較於其他種族有較低的整體乳癌死亡率,但是這種比較有利的預後並沒 有平均的分配到所有的亞洲種族,比起菲律賓人和韓國人,中國人和日本人有比 較高比率的管腔細胞 A 型(Luminal A)乳癌,菲律賓人有比較高比率的人類上皮生 長因子第二型接受器過度表現型(HER2 over-expressed)乳癌,韓國人有比較高比率 的三陰性(triple negative)乳癌,中國人和白人女性有相當的乳癌存活率,日本人則 是有比較好的乳癌存活率,菲律賓人在所有亞洲族群中乳癌的死亡率最高,這意 味著乳癌腫瘤的生物學會受到種族因素的影響22; 23。
被診斷為乳癌的年輕族群發生率及死亡率在這些年中逐漸上升,依據 Stapleton, Oseni, Bababekov, Hung, and Chang 24研究指出在美國,乳癌診斷年齡小於 50 歲者 中以西班牙裔美國人占率最高,白人占率最低,亞裔美國人占率次之,黑人占率 第三。大約有 11~12%初次診斷女性乳癌的年紀小於 45 歲,比起老年性乳癌,年 輕乳癌通常有較差的預後、較高的局部復發率、由於較具侵襲性的作用造成年輕 乳癌對治療的反應較差18; 25。
之前的研究顯示,亞洲乳癌發生的年齡相較於西方國家乳癌發生的年齡來得 更早26,臺灣乳癌的年齡別發生率呈現鐘形分佈,年齡高峰期大約在 45~55 歲,
而美國的年齡別發生率則是隨著年齡的增加而持續上升,在 70~79 歲時達到穩定 狀態27。
在西方人口,年輕女性乳癌(<50 歲)相較於老年性乳癌(≧50 歲)有較高的雌激 素接受體(ER)陰性比率和組織學第三級的腫瘤,因此更容易演變成生物侵襲性的 乳癌,非常年輕的女性乳癌(<35 歲)相較於年輕女性乳癌(35~55 歲)有比較高機率 是侵襲性乳癌腫瘤,非裔美國人比起非非裔美國人有較高機率是侵襲性乳癌腫
瘤。在臺灣年輕女性乳癌(<50 歲)比起老年性乳癌(≧50 歲)則是有較高盛行率的管 腔細胞 A 型(Luminal A),較低盛行率的基底細胞型(Basal-like),這是因為年輕女性 乳癌(<50 歲)比老年性乳癌(≧50 歲)有較高的雌激素接受體(ER)和/或黃體素接受體 (PR)表現28。在美國的卡羅來納州乳癌研究顯示,非裔美國人中停經前比起停經後 的管腔細胞 A 型(Luminal A)盛行率較低、基底細胞型(Basal-like)盛行率較高,這也 導致了非裔美國人停經前乳癌的預後較差,然而,非非裔美國人不論在停經前或 停經後的乳癌,其管腔細胞 A 型(Luminal A)和基底細胞型(Basal-like)的盛行率則是 無顯著差異29。
參、 腫瘤的微環境
疾病的生物學和腫瘤的預後受到腫瘤微環境(tumor microenvironment,TME)的 調節,特別是在腫瘤細胞及相關基質之間的交互作用,代表著一個影響疾病開始、
惡化及預後的強而有力關係時,腫瘤微環境的調節對於正常組織的動態平衡及腫 瘤生長在細胞和其微環境之間的雙向溝通是不可或缺的30。
1863 年 Rudolf Virchow 是第一位提出慢性發炎和腫瘤形成之間的關聯,接著 發現腫瘤細胞周邊常有浸潤淋巴細胞,流行病學研究顯示,慢性發炎通常會有較 高的癌症發生率,如不同病因的肝硬化造成肝細胞癌病人的死亡,免疫反應缺失 可能會有會有較高的癌症發生率,如愛滋病病人除了罹患卡波西氏肉瘤(愛滋病相 關的癌症)的機會增加,其他如舌、皮膚、肺、中樞神經系統和多發性骨髓瘤相關 的癌症(愛滋病不相關的癌症)機率也會增加,適當的免疫功能可能會對某些癌症有 保護作用,但也有可能抑制了腫瘤的生長,因此解釋了腫瘤微環境的複雜及挑戰
30; 31。
腫瘤轉移的持續生長是造成大部份癌症死亡的原因,Paget 在 1889 提出著名 的「種子和土壤」假說,指出腫瘤的轉移不是一個偶發的事件,而是只會發生在 具有潛在轉移的癌症細胞身上(種子),並且要在可以相容的適當器官環境中(土壤)
才會造成32。
腫瘤微環境通常係指靠近實體腫瘤存在的區域,除了乳癌細胞,腫瘤微環境 也包含了大量其他不同型態的細胞,包括血管內皮細胞(VECs)、腫瘤相關纖維母 細胞(CAFs)、免疫系統細胞像是腫瘤相關巨噬細胞(TAMs)和腫瘤浸潤淋巴細胞、
骨髓來源抑制細胞(MDSCs)、肌上皮細胞、脂肪細胞、基質細胞等,這些細胞會分 泌細胞激素、趨化因子、生長因子、發炎改製酶和基質改製酶共同建構修飾腫瘤 基質、血液和淋巴腺系統,此外,一些非細胞成份之細胞外基質(ECM)、外泌體、
可溶解的細胞激素、訊號分子也包含在腫瘤微環境中,腫瘤微環境的物理特性和 正常組織不同,具有組織缺氧、酸性及高組織液壓力的特性32; 33。
腫瘤區域免疫反應的品質和數量可以幫助我們找到能夠從免疫療法獲得效益 的病人,也可以促進我們對腫瘤宿主生物學的了解,研究證實高度免疫浸潤的乳 癌和較佳的臨床預後有關,尤實是在雌激素接受體(ER)陰性的病人身上,可以發 現具有較多 CD8+ T 細胞與較好的整體存活率(OS)有關,此外,高度免疫浸潤與使 用前導性化學治療及輔助化學治療具有較好的反應有關31,調控性 T 細胞(T regs) 具有負向的免疫特徴,不論是在雌激素接受體(ER)陽性或是陰性的乳癌病人身 上,都會創造一個免疫抑制的環境,因此與較差的預後有關34,由此可知腫瘤微環 境與乳癌病程的進展密不可分,以下就腫瘤微環境的成分和乳癌之間的相互作用 說明:
一、纖維母細胞(Fibroblasts):纖維母細胞是乳癌基質中數量最多的細胞型態,也 被稱作腫瘤相關纖維母細胞(cancer-associated fibroblasts ,CAF),被認為是活化 的纖維母細胞,會分泌可溶解的因子,如趨化因子或生長因子,進而調節腫 瘤基質和促進腫瘤成長和侵襲32; 35,在最近 Hu et al. 36的後設分析
(meta-analysis)中發現,活化的纖維母細胞密度增加與乳癌的淋巴結轉移和較 差的腫瘤分化有關,進而合理地推論活化的腫瘤浸潤纖維母細胞能夠使腫瘤 惡化,臨床預後較差,因此有較低的整體存活率(OS)和無疾病存活率(DFS)37。
二、樹突細胞(Dendritic cells ,DC):由於樹突細胞具有交叉呈現抗原給 CD4+和 CD8+ T 細胞的能力,因此能夠活化樹突細胞去攻擊腫瘤細胞,並在誘發抗腫 瘤的反應扮演著重要的角色,腫瘤相關基質表現出大量具有抗腫瘤免疫能力 缺損的不成熟樹突細胞,腫瘤相關的不成熟樹突細胞會製造促進血管新生因 子和增加內皮細胞的遷移,因此會促進腫瘤生長,這種促進血管新生的特性 受到樹突細胞成熟的抑制,事實上,原發性腫瘤病灶中成熟的樹突細胞浸潤 與較少的轉移和較好的臨床預後相關35。
三、巨噬細胞(Macrophages):巨噬細胞是屬於吞噬細胞系統而且是免疫細胞體系 的一員,在乳癌腫瘤微環境中是比較大量表現的大單核細胞,在腫瘤惡化、
免疫抑制、治療抗性中扮演著重要的角色,腫瘤相關巨噬細胞(tumor-associated macrophage ,TAM)表現大的可塑性而且可以分化為不同的表現型,分別為典型 活化巨噬細胞(classically activated macrophage ,M1)和替代型活化巨噬細胞 (alternatively activated macrophage ,M2),第一型輔助性 T 細胞(T helper 1 ,Th1) 激活分化為 M1 巨噬細胞,可以觸發抗腫瘤免疫反應,第二型輔助性 T 細胞(T helper 2 ,Th2)細胞激素如轉化生長因子(transforming growth factor
β1 ,TGF-β1)、白血球介素 4(interleukin-4 ,IL-4)、白血球介素
13(interleukin-13 ,IL-13)刺激產生 M2 巨噬細胞,活化靶基因 STAT6,可以抑 制免疫系統功能和促進腫瘤細胞增殖,由於致癌物形成腫瘤微環境的期間,
最可能驅動 M1 巨噬細胞轉變成 M2 巨噬細胞,因此 M2 腫瘤相關巨噬細胞是 乳癌最常見的類型32; 37,Sousa et al. 38的研究顯示 M2 巨噬細胞數量較多和原 發性乳癌的快速增殖、較差的分化、雌激素接受體(ER)陰性、組織學乳腺管 型有強烈相關。
四、自然殺手細胞(Natural killer cells ,NK):自然殺手細胞是參與先天性免疫系統 的胞毒性淋巴球,可以藉由在靶細胞上自然殺手細胞活化接受器配體的表達 機制,有效地辨認和殺死腫瘤細胞,活化的自然殺手細胞會分泌多樣性的細 胞激素,如腫瘤壞死因子-α(tumor necrosis factor-α ,TNF-α)和干擾素-γ (interferon-γ,IFN-γ),而且透過顆粒酶的釋出和胞毒性穿孔素行使細胞溶解 作用37,Verma et al. 39分析了局部晚期乳癌病人接受了新輔助化學療法
(neoadjuvant chemotherapy)後,觀察到血液中自然殺手細胞的增加和比較好的 病理完全緩解率(pathologic complete response,pCR)有關。
五、腫瘤浸潤淋巴細胞(tumor infiltrating lymphocytes, TILs):腫瘤浸潤淋巴細胞的 定義是浸潤在腫瘤組織的單核免疫細胞,在蘇木精和嗜伊紅染色(Hematoxylin and Eosin stain ,H&E stain)的腫瘤塊上,計算腫瘤浸潤淋巴細胞佔據面積/總基 質面積的一個連續性變量的百分比,腫瘤浸潤淋巴細胞浸潤基質面積的切點 在 50~60%之間,已經被廣泛地使用在定義淋巴細胞佔優勢的乳癌
(lymphocyte-predominant breast cancers ,LPBCs),約佔所有侵襲性乳癌的 11%,在分化不良的病灶、三陰性乳癌(TNBC)和人類上皮生長因子第二型接 受器陽性(HER2+)乳癌病人身上,可以觀察到較多的腫瘤浸潤淋巴細胞37; 40, 有可靠的數據支持在三陰性乳癌(TNBC)和人類上皮生長因子第二型接受器陽 性(HER2+)乳癌中,高程度的腫瘤浸潤淋巴細胞浸潤與與較好的預後有關41, 在使用了前導性治療(neoadjuvant setting)的三陰性乳癌(TNBC)和人類上皮生 長因子第二型接受器陽性(HER2+)乳癌身上,腫瘤浸潤淋巴細胞的高水平與高 度病理完全緩解率(pCR)有關42。
六、細胞外基質(Extracellular Matrix ,ECM):細胞外基質是包圍和穩定細胞的複雜 蛋白質網絡,包含了三種的主要蛋白質類型:結構蛋白(如膠原蛋白/彈力蛋 白)、糖蛋白(纖維黏連蛋白)和蛋白聚糖(軟骨素硫酸鹽),雖然最初只是將細胞 外基質視為提供支持的穩定結構,但在最近的研究指出,細胞外基質在細胞 的生長、增殖和遷移扮演著重要的角色,其動態和多變性另人驚訝,癌症中 的細胞外基質通常是混亂和失控的,藉由回饋調整機制導致細胞的異常行 為,改變腫瘤細胞外基質新陳代謝最重要的因素是腫瘤相關纖維母細胞(CAF) 和免疫細胞。細胞外基質主要的蛋白質成份是膠原蛋白,其完整性在癌症生 長佔據著重要的位置,因為蛋白酶降解膠原蛋白 IV 會導致癌細胞侵襲至基底 膜(basement membrane ,BM),蛋白酶活性的改變在癌症中是很常見的,而且 顯示出和病人的預後有關,細胞外基質除了生物化學性質的改變外,其結構、
物理和生物化學特性在癌症中也有根本地不同,乳癌基質比起正常的基質較 硬,這也是造成乳癌可以摸得到的原因之一,異常的細胞外基質會透過阻止 T
細胞經歷正常的分化和成熟使得癌細胞生長,因此破壞了免疫系統控制癌細 胞的努力,總而言之,異常的細胞外基質不但會促進癌細胞的轉化和組織侵 襲,也會幫助建立致癌的微環境,進而促使腫瘤的惡化35。
肆、 腫瘤浸潤淋巴細胞(TILs)
乳癌藉由浸潤免疫細胞、細胞激素和生長因子維持著高度炎症性的微環境特 徵,乳癌的免疫浸潤透過治療反應的調節顯示和臨床預後有關34,在特定的乳癌亞 型中腫瘤浸潤淋巴細胞的存在已經證實具有潛在地預測性和預後性,在大型的輔 助性療法研究中顯示,無論如何治療人類上皮生長因子第二型接受器陽性(HER2+) 乳癌和三陰性乳癌(TNBC)的病人,其原發性組織切片上的高水平腫瘤浸潤淋巴細 胞與改善整體存活(OS)和減少復發有關,該二種亞型乳癌接受新輔助療法後的腫 瘤浸潤淋巴細胞水平增加也與較高的病理完全緩解率(pCR)有關,此外,人類上皮 生長因子第二型接受器陽性(HER2+)並且有高水平腫瘤浸潤淋巴細胞的乳癌病人 較容易從接受輔助性 Trastuzumab(Herceptin)療法中受益43。
腫瘤浸潤淋巴細胞已經是腫瘤微環境的重要成員之一,T 淋巴細胞(CD3+)是 腫瘤浸潤淋巴細胞的主要成份,包括 CD4+輔助細胞、具有 CD4+、CD25+、FOXP3+
表現型的調控性 T 淋巴細胞(T-regulatory cells ,Treg)、免疫執行細胞如自然殺手細 胞和 CD8+ T 淋巴細胞35,腫瘤浸潤淋巴細胞的次要成份由漿細胞和 B 細胞組成,
CD4+和 CD8+ T 淋巴細胞是最重要的抗腫瘤細胞37。
CD8+ T 淋巴細胞會辨識腫瘤的特異性抗原如第一類主要組織相容性複合體
(major histocompatibility complex ,MHC-1),藉由促發炎干擾素-γ(IFN-γ)和穿孔 素-顆粒酶複合體的釋放進而在腫瘤微環境中對抗腫瘤活動37,CD8+免疫執行 T 細 胞的浸潤與較長的乳癌特定存活有關,透過共同刺激和共同抑制作用訊號之間的 平衡也稱作免疫檢查點(immune checkpoint)來調控 CD8+胞毒性 T 細胞的作用35, 在許多癌症中 CD8+腫瘤浸潤淋巴細胞和第一型輔助性 T 細胞(Th1)的細胞激素有
關,因此有較佳的預後37。
CD4+ T 淋巴細胞能夠分化成特定的免疫執行的 T 細胞,包括第一型輔助性 T 細胞(Th1)和第二型輔助性 T 細胞(Th2),第一型輔助性 T 細胞(Th1)會分泌白血球 介素 2(IL-2)、干擾素-γ(IFN-γ)、干擾素-α(IFN-α)可以增加巨噬細胞、自然殺 手細胞,具有對抗腫瘤的能力,第二型輔助性 T 細胞(Th2)會分泌白血球介素 4(IL-4)、白血球介素 5(IL-5)、白血球介素 6(IL-6)、白血球介素 10(IL-10)、白血球 介素 13(IL-13),會增加巨噬細胞的促腫瘤活性37。
調控性 T 淋巴細胞(Treg)通常藉由抑制自體反應性的 T 細胞來預防對抗自體免 疫疾病,但在腫瘤微環境中卻轉變成阻斷抗腫瘤的反應,調控性 T 淋巴細胞(Treg) 能夠抑制不同種類的免疫細胞,包括 CD8+ T 淋巴細胞、自然殺手細胞、B 細胞和 抗原呈現細胞,最近的研究顯示調控性 T 淋巴細胞(Treg)會製造大量的 RANKL,
會活化表達 RANK 的乳癌細胞並促進轉移,因此可以在乳癌病人身上發現高水平 的調控性 T 淋巴細胞(Treg)與較差的預後有關,腫瘤經由前列腺素 E2 分泌作用和 轉化生長因子(TGF-β)訊號自行生成 T 淋巴細胞(Treg),也會分泌白血球介素 10(IL-10)和轉化生長因子(TGF-β)來抑制免疫執行細胞的功能進而建立免疫抑制的 微環境35。
在所有的乳癌中有 25%可以發現 B 細胞,通常和 CD4+、CD8+ T 淋巴細胞與 樹突細胞在第三級淋巴結構被發現,和 T 淋巴細胞相同,B 細胞在髓狀乳癌有較 好的存活率而且是乳癌的常見類型,研究顯示在三陰性乳癌(TNBC)病人身上,高 度的腫瘤內漿細胞與較長的無疾病存活(DFS)有關37。
細胞程式死亡受體-1(programmed death-1 ,PD-1)、毒性 T 淋巴细胞抗原-4 (cytotoxic T lymphocyte antigen 4 ,CTLA-4)、B 和 T 淋巴细胞衰减因子(B and T lymphocyte attenuator,BTLA)都是免疫檢查點(immune checkpoint)分子,可以抑制 T 細胞的功能,因此可以防止不適當的免疫反應,而且可以限制免疫反應的程度和
持續時間,PD-1 是研究最廣泛的免疫檢查點接受器,屬於共同抑制作用的接受器,
透過 PD-1 的配體 PD-L1(PD ligand 1)、PD-L2(PD ligand 2)結合,T 細胞的功能便 會受抑制,腫瘤細胞也可以經由此路徑減弱或逃脫抗腫瘤的 T 細胞免疫而建構免 疫抑制的微環境,這個用來促進腫瘤惡化的現象被稱為「分子遮罩(molecular shield)」,乳癌已經被證明在腫瘤浸潤淋巴細胞會表現 PD-1,在腫瘤細胞會表現 PD-L1,這二個分子的表現和較差的預後有關,腫瘤細胞對於這個路徑的使用可能 也解釋了在多個 T 細胞輸入療法(adoptive cell therapy ,ACT)的實驗中,雖然誘 導了癌症特異性 T 細胞並伴隨著腫瘤區域的浸潤,腫瘤生長卻很少被控制住,PD-1 的抗體或其配體 PD-L1 的抗體能夠抑制免疫檢查點路徑,因此在乳癌的治療多了 一種新的選擇35。
伍、 乳癌亞型與腫瘤浸潤淋巴細胞(TILs)的關聯
一、 CD8+ T 淋巴細胞:在三陰性乳癌(TNBC)和非管腔型人類上皮生長因子第 二型接受器陽性(HER2+ non-luminal)乳癌的侵襲邊緣比起管腔細胞 A 型 (Luminal A)有較多的胞毒性 T 細胞(cytotoxic T cells ,CTLs),管腔細胞 B 型 (Luminal B)比管腔細胞 A 型(Luminal A)在腫瘤的侵襲邊緣有較多的胞毒性 T 細胞數量(CTLs)44。在雌激素接受體陰性(ER-)的腫瘤,CD8+ T 淋巴細胞與較 有利的預後相關45,無論人類上皮生長因子第二型接受器(HER2)的表現與否 在雌激素接受體陽性(ER+)腫瘤中較高的 CD8+ T 淋巴細胞耗竭標誌分數與較 短的復發時間(DFS)有關43。
二、 調控性 T 淋巴細胞(Treg):在三陰性乳癌(TNBC)和非管腔型人類上皮生 長因子第二型接受器陽性(HER2+ non-luminal)乳癌比起管腔細胞 A 型
(Luminal A)有比較多的調控性 T 淋巴細胞(Treg)和比較高的 Treg/Th2 細胞比 率,比較高的調控性 T 淋巴細胞(Treg)百分比和荷爾蒙接受器表達下降、Ki67 值的上升、比較大的管腔腫瘤大小和淋巴結轉移的表現有關,在三陰性乳癌 (TNBC)腫瘤內的調控性 T 淋巴細胞(Treg)也比管腔細胞 A 型(Luminal A)高,
管腔細胞 B 型(Luminal B)比管腔細胞 A 型(Luminal A)在腫瘤的侵襲邊緣有較
多的調控性 T 淋巴細胞(Treg)44。調控性 T 淋巴細胞(Treg)在雌激素接受體陽性 (ER+)和雌激素接受體陰性(ER-)的腫瘤中均與較差的預後有關45。調控性 T 淋 巴細胞(Treg)在人類上皮生長因子第二型接受器陽性(HER2+)乳癌與較低的病 理完全緩解率(pCR)和較短的復發(DFS)和存活(OS)有關43。
三、 M0 巨噬細胞及 M2 巨噬細胞:不論雌激素接受體(ER)的存在與否,M0 巨噬細胞及 M2 巨噬細胞與較差的預後有強烈的相關45。M0 巨噬細胞在雌激 素接受體陽性(ER+)乳癌與較差的復發(DFS)有關,在在雌激素接受體陽性 (ER+)/人類上皮生長因子第二型接受器陰性(HER2-)乳癌則有較差的存活 (OS)43。
四、 活化記憶 T 細胞:在雌激素接受體陰性(ER-)的乳癌,活化的記憶 T 細胞 與較有利的預後有關45。
五、 濾泡輔助性 T 細胞:在接受新輔助性化學療法的雌激素接受體陰性(ER-) 乳癌中較高的濾泡輔助性 T 細胞與病理完全緩解率(pCR)有關45。
六、 Gamma delta T 細胞:在所有的乳癌病人中 Gamma delta T 細胞與較高的 病理完全緩解率(pCR)和較長的無疾病存活時間(DFS)有關,在人類上皮生長 因子第二型接受器陽性(HER2+)腫瘤中有較長的存活時間(OS)43。
七、 活化肥大細胞:在人類上皮生長因子第二型接受器陽性(HER2+)腫瘤較高 的活化肥大細胞與較高的復發(DFS)和較低的存活(OS)有關43。
第五節 研究假設
歸納本研究目的、相關文獻的各種敘述,擬定本研究的研究假設有下列 4 項:
一、 東方比起西方有較年輕的乳癌患者。
二、 較高程度的腫瘤浸潤淋巴細胞與較好的預後和治療反應有關。
三、 CD8+ T 細胞與較好的存活有關。
四、 調控性 T 淋巴細胞(Treg)與較差的預後有關。
第二章 材料與方法
第一節 研究方法
本研究分別使用了 Yoshihara et al. 46的 ESTIMATE(Estimation of STromal and Immune cells in MAlignant Tumours using Expression data)方法來評估免疫分數,和 Newman et al. 47的 CIBERSORT(Cell-type Identification By Estimating Relative Subsets Of RNA Transcripts)方法來估計 22 個免疫細胞的百分比,以下就二種方法 介紹:
一、 ESTIMATE:ESTIMATE 分數是透過 Agilent、Affymetrix 平臺、基於 RNA 序 列及可以得到的癌症基因體圖譜(The Cancer Genome Atlas,TCGA)的概況,分 析了 11 種不同腫瘤類型樣本的腫瘤純度 DNA 拷貝數的相關性,總共找到 10,412 個共同基因,經過 5 個篩選步驟,設計了 2 個基因標誌,1 個是「基質 標誌」用來獲得腫瘤組織中基質的存在(141 個基因),另一個是「免疫標誌」
目的是代表腫瘤組織中免疫細胞的浸潤(141 個基因),利用單一樣本基因集富 集分析(single-sample gene set enrichment analysis ,ssGSEA)計算基質和免疫分 數,用來預測基質和免疫細胞的浸潤程度,將基質和免疫分數結合成估計分 數(ESTIMATE score)藉以推論腫瘤組織的腫瘤純度。針對每一個樣本的基因表 達值進行等級標準化和等級排序,計算標誌基因和剩餘基因的經驗累積分布 函數,藉由經驗累積分布函數之間的差異進行積分得到統計數值,使用非線 性的最小平方(nonlinear least squares)方法確定預測腫瘤純度的公式,腫瘤純度
=cos(0.6049872018 + 0.0001467884 × ESTIMATE 分數)。基質分數和免疫分數 之間呈現正相關,也就是基質分數愈高,免疫分數也愈高,低腫瘤純度則是 有較高的基質分數和免疫分數。
二、 CIBERSORT:CIBERSORT 是一種從基因表現譜描繪複雜組織細胞成分的方 法,需要輸入一個參考基因表達特徵的矩陣,用於估計關注的每一個細胞的 相對比例,設計和驗證一組白血球基因特徵矩陣(leukocyte gene signature matrix ,LM22),LM22 含有可以辨別 22 個人類造血細胞表現型的 547 個基因,
包括 T 細胞類型、未受刺激和記憶性 B 細胞、漿細胞、自然殺手細胞和骨髓 子集,對於每個病人來說,所有免疫細胞分數的總和為 1,使用了對雜訊具有 高度穩定的新機器學習方法,也就是線性支持向量迴歸(linear support vector regression ,SVR)的原理,透過反摺積(deconvolution)的分析,推論 22 種浸潤免 疫細胞的相對比例,已經證實 CIBERSORT 在新鮮、福馬林和固定組織(包括 實質固態瘤)的 RNA 混合物中應用造血子集的計數時,其在雜訊、未知混合 物內容和緊密相關的細胞類型上勝過其他方法。
第二節 研究架構
第三節 數據處理
壹、 資料來源
乳癌亞型 種族
免疫分數 腫瘤浸潤淋巴細胞
變項 種族
年齡 乳癌亞型 免疫分數
腫瘤浸潤淋巴細胞
乳癌預後
從基因表達資料庫(Gene Expression Omnibus ,GEO)獲得原發性乳癌的基因表 達微陣列,資料的選擇以樣本數大於 250 且是 2006 年以後發表的資料,需有種族、
年齡、無轉移/復發的存活時間或是整體存活時間的變項才會納入分析,微陣列平 臺選擇以較常見的 Affymetrix 和 Illumina 為主,包含了 Affymetrix Human Genome U133A Array、Affymetrix Human Gene 1·0 ST Array、Affymetrix Human Genome U133 Plus 2.0 Array、Illumina HumanHT-12 V3.0 expression beadchip 4 種類型,共 找到了 7 個資料集,分別是西方資料集 4 個(GSE58644、GSE6532、GSE21653、
GSE25066),東方資料集 3 個(GSE20685、GSE131769、GSE102484),雖然 GSE102484 資料集沒有存活的變項,但因為該資料集的樣本是臺灣人,且樣本數共有 683 人,
所以還是納入研究,只是在後續進行存活分析時予以排除,GSE6532 和 GSE25066 的存活變項分別是無遠端轉移存活(distant metastasis free survival)、無遠端復發存 活(distant relapse free survival),但因為只單純發生近端轉移的機率較小,可以忽略 不計,因此這 2 個資料的存活分析變項皆視為無疾病存活(disease free survival)。(表 1)
貳、 變項定義
一、 乳癌亞型:使用 R package 的 genefu 以 PAM 50(prediction analysis of microarray 50)將乳癌分成 5 種亞型,分別是 Luminal A(表格中以 Lum A 表示)、Luminal B(表格中以 Lum B 表示)、HER2-enriched、Basal-like(表格中以 Basal 表示)、
Normal breast-like(表格中以 Normal 表示)。
二、 年齡:西方國家停經的中位數在 48~52 歲之間48,臺灣的自然停經年齡中位 數是 50 歲49,因此以 50 歲為切點,小於等於 50 歲者定義為停經前,大於 50 歲者定義為停經後。
三、 免疫分數分高低組:以免疫分數的平均值為切點,小於等於平均值者定義為 低免疫分數組,大於平均值者定義為高免疫分數組。
四、 22 個免疫細胞分高低組:以各免疫細胞的平均值為切點,分成二個組別,平
均值以下定義為低免疫細胞組,平均值以上定義為高免疫細胞組
五、 種族:將加拿大、英國、瑞典、美國、法國定義為西方,臺灣和南韓定義為 東方。
六、 抗腫瘤免疫細胞分高低組:將漿細胞、CD8 T 細胞及 M1 巨噬細胞的比例加 總,定義為抗腫瘤免疫細胞,以抗腫瘤免疫細胞的平均值為切點,小於等於 平均值者定義為低抗腫瘤免疫細胞組,大於平均值者定義為高抗腫瘤免疫細 胞組。
七、 促腫瘤免疫細胞分高低組:將 Treg 細胞、M0 巨噬細胞及 M2 巨噬細胞的比 例加總,定義為促腫瘤免疫細胞,以促腫瘤免疫細胞的平均值為切點,小於 等於平均值者定義為低促腫瘤免疫細胞組,大於平均值者定義為高促腫瘤免 疫細胞組。
參、 統計分析
類別變項和類別變項之間的關聯性均使用卡方檢定、2×2 類別變項則是使用葉 氏連續性校正(Yate's continuity correction)的卡方檢定,乳癌亞型與免疫分數之 間的差異先使用 Bartlett’s 檢定,檢測變異數是否相等,因變異數不相等,使用 Kruskal-Wallis 進行差異檢定。種族與免疫分數之間的差異,先進行 F 檢定,判斷 變異數是否相同,若 F 檢定的變異數相同,使用變異數相同的獨立雙樣本 t 檢定 (Equal variance T test),若 F 檢定的變異數不相同,則使用變異數不同的獨立雙樣 本 t 檢定(Separate T test)。
使用 Kruskal-Wallis 檢定 22 種免疫細胞在乳癌亞型之間是否有差異,
Benjamini-Hochberg 方法進行 P 值的校正,事後多重比較採用 Dunn 檢定,使用 Wilcoxon rank-sum 檢定種族與 22 種免疫細胞之間的差異,一樣使用
Benjamini-Hochberg 校正 P 值,使用 Kaplan-Meier 繪製免疫分數高低組別在各乳癌 亞型間的存活曲線,並採用 log-rank test 檢定是否有差異,利用 Cox Proportional
Hazard model 檢定種族、年齡、免疫分數和 22 種免疫細胞比例是否影響存活,所 有的統計分析均使用 R 3.6.3 版本進行分析,顯著水準(α level)設為 0.05,採雙尾 檢定。
第三章 結果
第一節 基本資料描述性統計
本研究共納入 7 個資料集,乳癌病人數共計有 2,615 例,東方乳癌病人數為 1,311 例(51.1%),西方乳癌病人數為 1,304 例(49.9%),東方乳癌病患≦50 歲有 782 例(59.6%),西方乳癌病患≦50 歲有 529 例(40.6%),在此資料集中東方乳癌患者較 西方乳癌患者年輕(P 值=<2.2E-16)。東方乳癌病患免疫分數較高的有 620 例 (47.3%),西方乳癌病患免疫分數較低的有 580 例(44.5%),東方乳癌患者較西方乳 癌患者免疫分數高,但未達統計上顯著意義(P 值=0.16)。東方乳癌患者在 Luminal A 亞型有 405 例(30.9%)、HER2-enriched 亞型有 230 例(17.5%)及 Normal breast-like 亞型有 90 例(6.9%)這三種亞型的病例數均較西方乳癌患者高,西方乳癌患者在 Luminal B 亞型有 434 例(33.3%)和 Basal-like 亞型有 309 例(23.7%)這二種亞型的病 例數均較東方乳癌患者高,不同種族乳癌亞型之間是有差異的(P 值=3.59E-14)。(表 2)
第二節 乳癌亞型與免疫分數的差異及預後
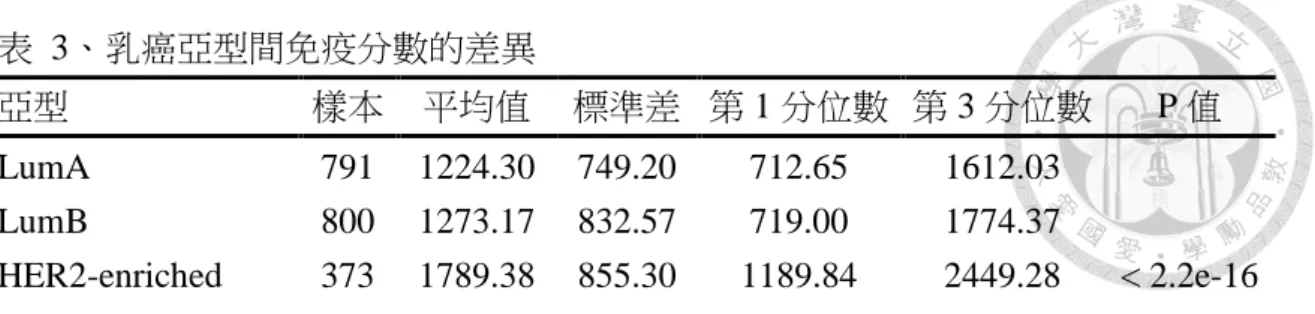
從各乳癌亞型免疫分數的箱型圖(圖 1)中可以發現 HER2-enriched 亞型和 Basal-like 亞型免疫分數的平均值較高,分別是 1789.38、1788.82,Luminal A 亞型 和 Luminal B 亞型免疫分數的平均值較低,分別是 1224.3、1273.17,採用
Kruskal-Wallis 檢定,乳癌亞型間免疫分數是有所不同的(P 值=<2.2E-16),達統計 上顯著差異。(表 3)
高免疫分數組相較於低免疫分數組有較長的無疾病存活時間(DFS),在
Luminal B 亞型、HER2-enriched 亞型和 Basal-like 亞型高免疫分數組相較於低免疫 分數組有較長的無疾病存活時間(DFS),P 值分別為 0.0097、0.0015、0.00049(圖 2)。
在 Luminal B 亞型和 Basal-like 亞型高免疫分數組相較於低免疫分數組有較長的整
體存活時間(OS),P 值分別為 0.056、0.00012。(圖 3)
第三節 以乳癌亞型分層比較不同種族乳癌免疫分數 的差異
東方乳癌免疫分數的平均值為 1,486.39,西方乳癌免疫分數的平均值為
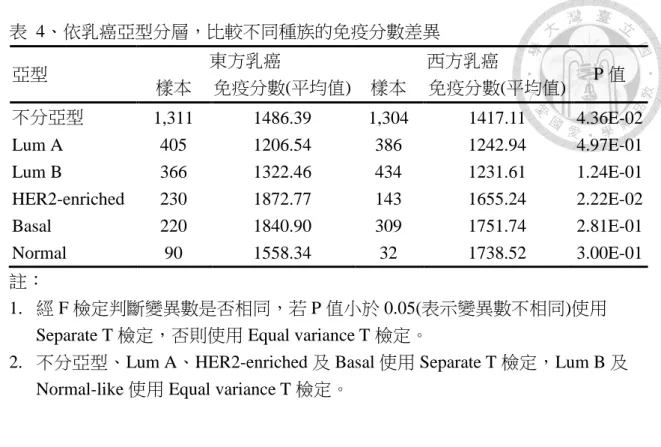
1,417.11,P 值 0.04,表示東方乳癌的免疫分數較西方乳癌高,在 5 個乳癌亞型中,
Luminal B 亞型、HER2-enriched 亞型和 Basal-like 亞型都是東方乳癌的免疫分數較 西方乳癌高,但只有 HER2-enriched 亞型的 P 值為 0.02,其餘二種亞型皆未達到統 計上顯著意義,Luminal A 亞型和 Normal breast-like 亞型則是西方乳癌的免疫分數 較東方乳癌高,但 P 值皆大於 0.05,未達統計上顯著意義。(圖 4、表 4)
因東方乳癌患者較西方乳癌患者年輕,因此想知道調整年齡變項後,東西方 乳癌患者的免疫分數是否仍有差異,因此將乳癌亞型再依年齡分層,進行種族的 比較,因 Normal breast-like 亞型病例數只有 122 例,若依年齡分層後再進行種族 的比較,樣本數可能太小會影響檢定,故在此不做 Normal breast-like 亞型的分層 比較,在大於 50 歲的乳癌病人身上,不論是何種乳癌亞型或是不分亞型,皆是東 方乳癌的免疫分數大於西方乳癌的免疫分數,但只有不分亞型、Luminal A 亞型及 Luminal B 亞型的 P 值小於 0.05(圖 5、表 5)。在小於等於 50 歲的乳癌病人身上,
除了不分亞型和 Luminal A 亞型是西方乳癌的免疫分數大於東方乳癌的免疫分數 外,其餘亞型都是東方乳癌的免疫分數大於西方乳癌的免疫分數,在 Luminal A 亞 型及 HER2-enriched 亞型的 P 值都小於 0.05(圖 6、表 5)。
第四節 乳癌亞型與 22 個免疫細胞的差異
利用 CIBERSORT 方法得到的 22 個免疫細胞百分比,有許多樣本的免疫細胞 百分比為 0,為了不影響檢定的準確性,因此將免疫細胞百分比等於 0 的比例大於 等於 50%的免疫細胞剔除不予分析,剔除後剩餘 15 種免疫細胞,使用 Kruskal-Wallis 分別檢定乳癌亞型與 15 個免疫細胞是否有所差異,並使用 Benjamini-Hochberg 方
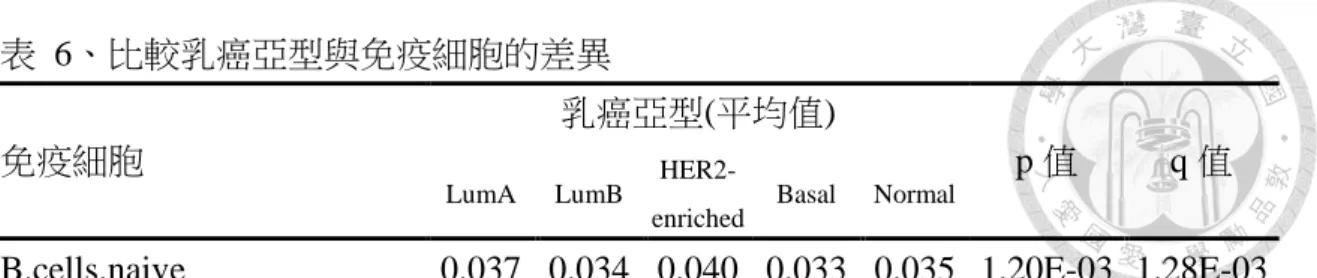
法校正 P 值,從表 6 中可以觀察到未受刺激的 B 細胞(q 值=1.28E-03)、記憶 B 細 胞(q 值=4.55E-04)、漿細胞(q 值=5.07E-22)、CD8 T 細胞(q 值=1.15E-04)、休眠記 憶 CD4 T 細胞(q 值=7.46E-09)、濾泡輔助 T 細胞(q 值=1.02E-08)、Treg 細胞(q 值
=1.22E-11)、單核球(q 值=1.12E-27)、M0 巨噬細胞(q 值=1.93E-21)、M1 巨噬細胞 (q 值=8.51E-37)、M2 巨噬細胞(q 值=3.72E-20)、休眠樹突細胞(q 值=7.18E-08)、休 眠肥大細胞(q 值=1.89E-47)和嗜中性白血球(q 值=1.99E-25)共 14 種免疫細胞在 5 個乳癌亞型間的比例是有所差異的,均達到統計上的顯著意義。(圖 7)
接下來想要知道這 14 種免疫細胞在哪些亞型間有所差異,因此利用 Dunn 方 法進行事後多重比較,以 Benjamini-Hochberg 方法進行 P 值的校正,在未受刺激 的 B 細胞方面,Luminal A 亞型比 Basal-like 亞型有較高的未受刺激的 B 細胞比例 (q 值=2.52E-02),HER2-enriched 亞型比 Luminal B 亞型有較高的未受刺激的 B 細 胞比例(q 值=8.12E-03),HER2-enriched 亞型比 Basal-like 亞型有較高的未受刺激的 B 細胞比例(q 值=4.26E-03),表示 HER2-enriched 亞型和 Luminal A 亞型未受刺激 的 B 細胞比例較高。(表 7)
在記憶 B 細胞方面,Basal-like 亞型比 Luminal A 亞型有較高的記憶 B 細胞比 例(q 值=1.95E-02),Luminal B 亞型比 HER2-enriched 亞型有較高的記憶 B 細胞比 例(q 值=3.38E-02),Basal-like 亞型比 Luminal B 亞型有較高的記憶 B 細胞比例(q 值=2.95E-02), Basal-like 亞型比 HER2-enriched 亞型有較高的記憶 B 細胞比例(q 值=8.22E-05),表示 Basal-like 亞型的記憶 B 細胞比例最高。(表 8)
在漿細胞方面,HER2-enriched 亞型比 Luminal A 亞型有較高的漿細胞比例(q 值=1.69E-10),Normal breast-like 亞型比 Luminal A 亞型有較高的漿細胞比例(q 值
=8.17E-11),HER2-enriched 亞型比 Luminal B 亞型有較高的漿細胞比例(q 值
=2.65E-14),Normal breast-like 亞型比 Luminal B 亞型有較高的漿細胞比例(q 值
=1.95E-13),HER2-enriched 亞型比 Basal-like 亞型有較高的漿細胞比例(q 值
=2.62E-08),Normal breast-like 亞型比 HER2-enriched 亞型有較高的漿細胞比例(q 值=3.09E-02),Normal breast-like 亞型比 Basal-like 亞型有較高的漿細胞比例(q 值
=1.20E-09),表示 Normal breast-like 亞型的漿細胞比例最高。(表 9)
在 CD8 T 細胞方面,Luminal A 亞型比 HER2-enriched 亞型有較高的 CD8 T 細 胞比例(q 值= 6.88E-03),Luminal A 亞型比 Normal breast-like 亞型有較高的 CD8 T 細胞比例(q 值=1.22E-02),Luminal B 亞型比 HER2-enriched 亞型有較高 CD8 T 細 胞比例(q 值=7.65E-04),Luminal B 亞型比 Normal breast-like 亞型有較高的 CD8 T 細胞比例(q 值=3.67E-03),Basal-like 亞型比 HER2-enriched 亞型有較高的 CD8 T 細胞比例(q 值=4.12E-02),Basal-like 亞型比 Normal breast-like 亞型有較高的 CD8 T 細胞比例(q 值=4.17E-02),表示 Luminal B 亞型和 Luminal A 亞型的 CD8 T 細胞較 高,Normal breast-like 亞型的 CD8 T 細胞最少。(表 10)
在休眠記憶 CD4 T 細胞方面,Luminal A 亞型比 Basal-like 亞型有較高的休眠 記憶 CD4 T 細胞比例(q 值=2.53E-08),Luminal A 亞型比 Normal breast-like 亞型有 較高的休眠記憶 CD4 T 細胞比例(q 值=2.78E-02),Luminal B 亞型比 Basal-like 亞 型有較高的休眠記憶 CD4 T 細胞比例(q 值=1.49E-05),HER2-enriched 亞型比 Basal-like 亞型有較高的休眠記憶 CD4 T 細胞比例(q 值=1.48E-06),HER2-enriched 亞型比 Normal breast-like 亞型有較高的休眠記憶 CD4 T 細胞比例(q 值=2.61E-02),
表示 HER2-enriched 亞型、Luminal A 亞型及 Luminal B 亞型的休眠記憶 CD4 T 比 例較高。(表 11)
在濾泡輔助 T 細胞方面,Luminal A 亞型比 HER2-enriched 亞型有較高的濾泡 輔助 T 細胞比例(q 值=9.96E-03),Basal-like 亞型比 Luminal A 亞型有較高的濾泡輔 助 T 細胞比例(q 值=1.14E-04),Luminal B 亞型比 HER2-enriched 亞型有較高的濾 泡輔助 T 細胞比例(q 值=1.45E-02),Basal-like 亞型比 Luminal B 亞型有較高的濾泡 輔助 T 細胞比例(q 值=6.31E-05),Basal-like 亞型比 HER2-enriched 亞型有較高的濾
泡輔助 T 細胞比例(q 值=1.43E-08),Basal-like 亞型比 Normal breast-like 亞型有較 高的濾泡輔助 T 細胞比例(q 值=1.19E-04),表示 Basal-like 亞型的濾泡輔助 T 細胞 比例最高。(表 12)
在 Treg 細胞方面,Luminal B 亞型比 Luminal A 亞型有較高的 Treg 細胞比例(q 值=1.78E-04),Luminal A 亞型比 Normal breast-like 亞型有較高的 Treg 細胞比例(q 值=1.65E-05),Luminal B 亞型比 HER2-enriched 亞型有較高的 Treg 細胞比例(q 值
=1.77E-05),Luminal B 亞型比 Basal-like 亞型有較高的 Treg 細胞比例(q 值
=7.31E-05),Luminal B 亞型比 Normal breast-like 亞型有較高的 Treg 細胞比例(q 值
=2.87E-10),HER2-enriched 亞型比 Normal breast-like 亞型有較高的 Treg 細胞比例 (q 值=7.62E-04),Basal-like 亞型比 Normal breast-like 亞型有較高的 Treg 細胞比例 (q 值=8.03E-05),表示 Luminal B 亞型的 Treg 細胞比例最高,Normal breast-like 亞 型的 Treg 細胞比例最低。(表 13)
在單核球方面,Luminal A 亞型比 Luminal B 亞型有較高的單核球比例(q 值
=1.19E-08),Luminal A 亞型比 HER2-enriched 亞型有較高的單核球比例(q 值
=1.52E-26),Luminal A 亞型比 Basal-like 亞型有較高的單核球比例(q 值=3.98E-14),
Luminal A 亞型比 Normal breast-like 亞型有較高的單核球比例(q 值=1.86E-02),
Luminal B 亞型比 HER2-enriched 亞型有較高的單核球比例(q 值=1.75E-09),Luminal B 亞型比 Basal-like 亞型有較高的單核球比例(q 值=1.55E-02),Basal-like 亞型比 HER2-enriched 亞型有較高的單核球比例(q 值=4.38E-04),Normal breast-like 亞型 比 HER2-enriched 亞型有較高的單核球比例(q 值=3.79E-05),表示 Luminal A 亞型 的單核球比例最高,HER2-enriched 亞型的單核球比例最低。(表 14)
在 M0 巨噬細胞方面,Luminal B 亞型比 Luminal A 亞型有較高的 M0 巨噬細 胞比例(q 值=2.50E-04),HER2-enriched 亞型比 Luminal A 亞型有較高的 M0 巨噬細 胞比例(q 值=9.56E-05),Basal-like 亞型比 Luminal A 亞型有較高的 M0 巨噬細胞比
例(q 值=4.64E-18),Luminal A 亞型比 Normal breast-like 亞型有較高的 M0 巨噬細 胞比例(q 值=9.85E-03),Basal-like 亞型比 Luminal B 亞型有較高的 M0 巨噬細胞比 例(q 值=7.87E-08),Luminal B 亞型比 Normal breast-like 亞型有較高的 M0 巨噬細 胞比例(q 值=1.05E-05),Basal-like 亞型比 HER2-enriched 亞型有較高的 M0 巨噬細 胞比例(q 值=3.00E-04),HER2-enriched 亞型比 Normal breast-like 亞型有較高的 M0 巨噬細胞比例(q 值=2.88E-06),Basal-like 亞型比 Normal breast-like 亞型有較高的 M0 巨噬細胞比例(q 值=2.67E-13),表示 Basal-like 亞型的 M0 巨噬細胞最高,Normal breast-like 亞型的 M0 巨噬細胞最低。(表 15)
在 M1 巨噬細胞方面,Luminal B 亞型比 Luminal A 亞型有較高的 M1 巨噬細 胞比例(q 值=3.19E-05),HER2-enriched 亞型比 Luminal A 亞型有較高的 M1 巨噬細 胞比例(q 值=1.39E-16),Basal-like 亞型比 Luminal A 亞型有較高的 M1 巨噬細胞比 例(q 值=6.37E-26),Luminal A 亞型比 Normal breast-like 亞型有較高的 M1 巨噬細 胞比例(q 值=5.26E-03),HER2-enriched 亞型比 Luminal B 亞型有較高的 M1 巨噬細 胞比例(q 值=7.15E-07),Basal-like 亞型比 Luminal B 亞型有較高的 M1 巨噬細胞比 例(q 值=5.11E-12),Luminal B 亞型比 Normal breast-like 亞型有較高的 M1 巨噬細 胞比例(q 值=8.25E-07),HER2-enriched 亞型比 Normal breast-like 亞型有較高的 M1 巨噬細胞比例(q 值=3.47E-14),Basal-like 亞型比 Normal breast-like 亞型有較高的 M1 巨噬細胞比例(q 值=1.13E-17),表示 Basal-like 亞型和 HER2-enriched 亞型的 M1 巨噬細胞比例較高,Normal breast-like 亞型的 M1 巨噬細胞比例最低。(表 16)
在 M2 巨噬細胞方面,Luminal A 亞型比 HER2-enriched 有較高的 M2 巨噬細 胞比例(q 值= 1.37E-02),Luminal A 亞型比 Basal-like 亞型有較高的 M2 巨噬細胞比 例(q 值=1.51E-13),Luminal B 亞型比 HER2-enriched 有較高的 M2 巨噬細胞比例(q 值=5.35E-05),Luminal B 亞型比 Basal-like 亞型有較高的 M2 巨噬細胞比例(q 值
=2.60E-20),HER2-enriched 比 Basal-like 亞型有較高的 M2 巨噬細胞比例(q 值
=2.31E-04),Normal breast-like 亞型比 Basal-like 亞型有較高的 M2 巨噬細胞比例(q 值=2.64E-04),表示 Luminal B 亞型和 Luminal A 亞型的 M2 巨噬細胞比例較高,
Basal-like 亞型的 M2 巨噬細胞比例最低。(表 17)
在休眠樹突細胞方面,Luminal A 亞型比 HER2-enriched 亞型有較高的休眠樹 突細胞比例(q 值=4.26E-07),Luminal A 亞型比 Basal-like 亞型有較高的休眠樹突細 胞比例(q 值=3.77E-05),Luminal B 亞型比 HER2-enriched 亞型有較高的休眠樹突 細胞比例(q 值=3.07E-04),Luminal B 亞型比 Basal-like 亞型有較高的休眠樹突細胞 比例(q 值=1.63E-02),Normal breast-like 亞型比 HER2-enriched 亞型有較高的休眠 樹突細胞比例(q 值=1.37E-02),表示 Luminal A 亞型、Normal breast-like 亞型及 Luminal B 亞型的休眠樹突細胞比例較高。(表 18)
在休眠肥大細胞方面,Luminal A 亞型比 HER2-enriched 亞型有較高的休眠肥 大細胞比例(q 值=1.31E-06),Luminal A 亞型比 Basal-like 亞型有較高的休眠肥大細 胞比例(q 值=3.92E-43),Luminal A 亞型比 Normal breast-like 亞型有較高的休眠肥 大細胞比例(q 值=2.96E-02),Luminal B 亞型比 HER2-enriched 亞型有較高的休眠 肥大細胞比例(q 值=7.32E-05),Luminal B 亞型比 Basal-like 亞型有較高的休眠肥大 細胞比例(q 值=9.99E-38),HER2-enriched 比 Basal-like 亞型有較高的休眠肥大細胞 比例(q 值=1.18E-11),Normal breast-like 亞型比 Basal-like 亞型有較高的休眠肥大 細胞比例(q 值=7.03E-08),表示 Luminal A 亞型及 Luminal B 亞型的休眠肥大細胞 比例較高,Basal-like 亞型的休眠肥大細胞比例最低。(表 19)
在嗜中性白血球方面,Luminal B 亞型比 Luminal A 亞型有較高的嗜中性白血 球比例(q 值=2.84E-09),HER2-enriched 亞型比 Luminal A 亞型有較高的嗜中性白 血球比例(q 值=1.92E-09),Basal-like 亞型比 Luminal A 亞型有較高的嗜中性白血球 比例(q 值=6.08E-24),Basal-like 亞型比 Luminal B 亞型有較高的嗜中性白血球比例 (q 值=3.32E-06),Luminal B 亞型比 Normal breast-like 亞型有較高的嗜中性白血球
比例(q 值=1.21E-03),Basal-like 亞型比 HER2-enriched 亞型有較高的嗜中性白血球 比例(q 值=6.17E-03),HER2-enriched 亞型比 Normal breast-like 亞型有較高的嗜中 性白血球比例(q 值=1.88E-04),Basal-like 亞型比 Normal breast-like 亞型有較高的 嗜中性白血球比例(q 值=8.98E-09),表示 Basal-like 亞型的嗜中性白血球比例最高。
(表 20)
第五節 以乳癌亞型分層比較不同種族乳癌的 22 個免 疫細胞差異
利用 CIBERSORT 方法得到的 22 個免疫細胞百分比,有許多樣本的免疫細胞 百分比為 0,為了不影響檢定的準確性,因此將各乳癌亞型中免疫細胞百分比等於 0 的比例大於等於 50%的免疫細胞剔除不予分析,使用 Wilcoxon rank-sum 方法檢 定,並使用 Benjamini-Hochberg 校正 P value。
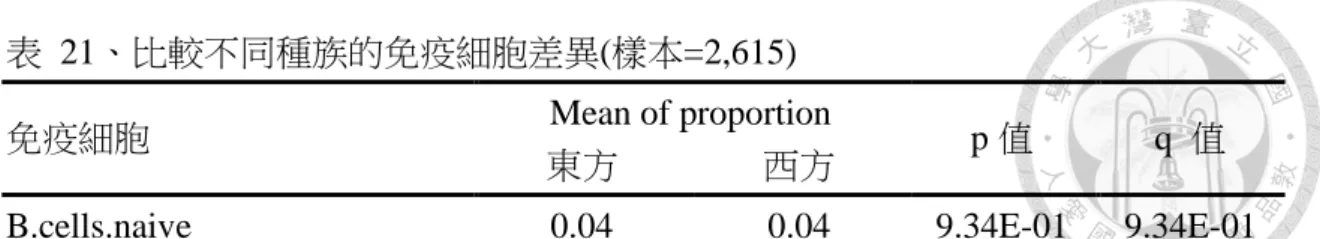
在東方乳癌病患中可以看出漿細胞(q 值=1.36E-40)、濾泡輔助 T 細胞(q 值
=3.59E-16)、活化的自然殺手細胞(q 值=4.65E-27)、M1 巨噬細胞(q 值=9.59E-32)和 M2 巨噬細胞(q 值=5.02E-26)這 5 種的免疫細胞的比例較西方乳癌病患多,在西方 乳癌病患中可以看出記憶性 B 細胞(q 值=4.72E-15)、CD8 T 細胞(q 值=6.41E-136)、
Treg 細胞(q 值=2.58E-81)、單核球(q 值=9.03E-37)、休眠的樹突細胞(q 值=1.91E-18) 和嗜中性白血球(q 值=5.32E-45)這 6 種的免疫細胞的比例較東方乳癌病患多。(表 21)
在 Luminal A 亞型中可以看到東方乳癌病患的漿細胞(q 值=1.75E-08)、濾泡輔 助 T 細胞(q 值=3.12E-11)、M0 巨噬細胞(q 值=4.00E-03)、M1 巨噬細胞(q 值=1.58E-11) 和 M2 巨噬細胞(q 值=7.43E-10)的比例較西方乳癌病患多,在西方乳癌病患中可以 看出記憶 B 細胞(q 值=1.43E-06)、CD8 T 細胞(q 值=1.93E-47)、Treg 細胞(q 值
=8.75E-27)、單核球(q 值=8.04E-14)、休眠樹突細胞(q 值=2.81E-06)和休眠肥大細 胞(q 值=3.83E-02)的比例較東方乳癌病患多。(表 22)