行政院國家科學委員會補助專題研究計畫 □ 成 果 報 告
■期中進度報告 新型智慧感光控制分子及其聚合物微胞材料之研究(1/2)
計畫類別:■ 個別型計畫 □ 整合型計畫 計畫編號:NSC 98-2113-M-011-004-MY2
執行期間: 98 年 8 月 1 日至 100 年 7 月 31 日
計畫主持人:何郡軒 共同主持人:
計畫參與人員:羅家凱、莊昭力、李東憲
成果報告類型(依經費核定清單規定繳交):■精簡報告 □完整報告
本成果報告包括以下應繳交之附件:
□赴國外出差或研習心得報告一份
□赴大陸地區出差或研習心得報告一份
□出席國際學術會議心得報告及發表之論文各一份
□國際合作研究計畫國外研究報告書一份
處理方式:除產學合作研究計畫、提升產業技術及人才培育研究計畫、列管 計畫及下列情形者外,得立即公開查詢
□涉及專利或其他智慧財產權,□一年□二年後可公開查詢 執行單位:台灣科技大學 化學工程系
中 華 民 國 99 年 5 月 28 日
新型智慧感光控制分子及其聚合物微胞材料之研究(1/2)
計畫編號:NSC 98-2113-M-011-004-MY2 執行期間:98年8月1日 至 100年7月31日
計畫主持人:何郡軒 台灣科技大學 化學工程系 計畫參與人員:羅家凱、莊昭力、李東憲
中文摘要:
3-苯乙烯呋喃 (3-styrylfuran, 1a) 在鹼性環境下經由 300 nm 紫外光照射,可以進行新的光 化學反應,產生萘的衍生物 naphthalen-2-yl-acetaldehyde (2a)及 naphthalene-2-carbaldehyde (3a)。
化合物 2a 產生的反應機構,可能是反應中間體 naphtho[1,2-b]furan 經由鹼性催化進行 elimination 反應,而 furan ring 裂解使其氧原子成為離去基,接著進行 tautomerization 而形成。
化合物 3a 產生的反應機構可能是經由[2+2]光環化加成反應,再經由逆反應而得到。後續將進 行更詳細的研究以得到更確切的証據。
關鍵字:鹼催化、光化學反應、苯乙烯呋喃。
Abstact:
3-Styrylfuran (1a) could undergo a novel photoreaction by 300 nm ultraviolet radiation in basic media. This reaction gave the derivatives of naphthalene as the photoreaction products, including naphthalen-2-yl-acetaldehyde (2a) and naphthalene-2-carbaldehyde (3a). The product 2a could be gotten through successive reactions, including photocyclization, a base-catalyzed elimination reaction of the intermediate, naphtho[1,2-b]furan, fragmentation of the furan ring, expelling the oxygen atom of furan from naphthyl part, then tautomerization. The formation of 3a could result from the reactions, a [2+2] photocycloaddition and a consequent reverse cycloaddition reaction.
Further studies for the details and evidences of both mechanisms arestill in progress.
Keywords: base-catalyzed, photoreaction, styrylfuran.
一、前言
感光控制材料近年來愈來愈受重視,其研究的對象包括聚合物 1、微胞 2、液晶 3、碳管4 及奈米粒子5…等。由於感光材料可以利用照射光源的主動控制,而達到控制反應作用時間及 區域的目的,所以提供了材料實際應用的優勢。例如利用照光造成微胞分解而達成釋放藥物效 果的微胞研究 (Scheme 1)2,比起其他因子(例如熱、酸鹼…等)驅動來的更易操縱及掌控。
目前這類感光控制材料所使用的光化學反應,對環境並無特別之選擇性,也就是一旦接受 到激發光源,感光控制材料就會致動。為了提昇這類材料的應用性能,我們計畫研究可同時感 測其他因子的光化學反應分子,即智慧感光控制分子,並研究其反應及反應機構。
hydrophobic
hydrophilic hydrophilic hydrophilic
micelle
Destruction
Scheme 1: Application of photoresponsive diblock copolymers in micelles.
二、研究目的
「智慧型感光控制材料」的研究目的,就是在一般的感光材料中,研發出可以針對環境的 不同而產生不同反應的感光控制材料。要達到這個目的,就要研究感光控制材料所利用的感光 分子結構及其光化學反應的運作原理,也就是開發對環境敏感而能產生特殊光化學反應的有機 化合物,並研究其光化學反應的機制。在我們先前研究的具取代基之二苯乙烯或苯乙烯雜環化 合物在酸性反應溶液中之光化學反應,發現原本在純中性溶劑只會進行光化學順反異構化反應 的起始物,在酸性溶液中照光,會經由酸催化而進行不同的光化學反應而產生新的照光產物 (Scheme 2)6-7。
OCH3
O
0.5M HCl CH3CN
O hv
hv 0.005M HCl CH3CN
Scheme 2: Acid-catalyzed photoreactions of 4-methoxystilbene.
我們計畫在二苯乙烯類化合物的基礎上,研究出具感測其他因子的有機化合物,並研究其 光化學反應。
三、結果與討論
在這部分研究中,我們發現了一個新的鹼性催化的光化學重排反應。利用鹼性的反應條件 可以讓 3-styrylfuran (1a)反應生 成新的照 光產物,包 括 naphthalen-2-yl-acetaldehyde (2a), naphthalene-2-carbaldehyde (3a)及一些難解且無法以重力管柱層析分離的複雜產物 (Scheme 3)。
H O
O H
O tBuOK
THF hv
+ + unindentified
mixture
1a 2a 3a
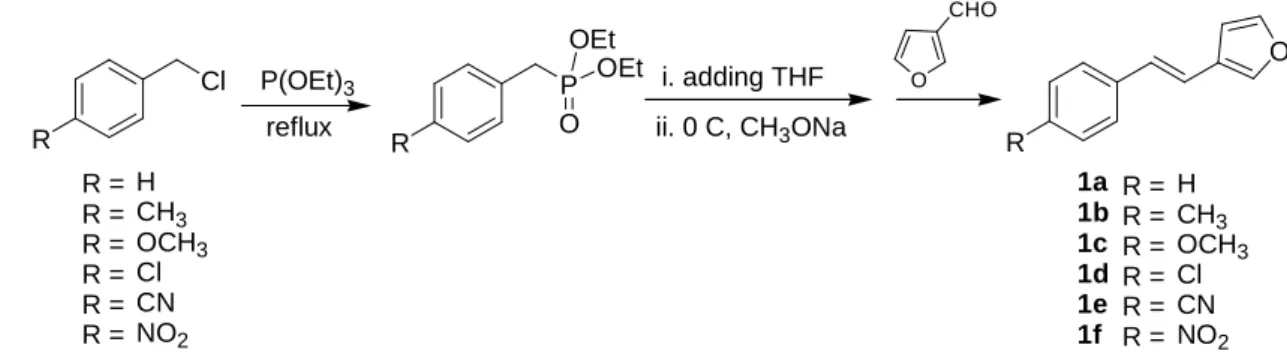
我們利用 Wittig Horner 反應合成照光起始物 1a:先將 benzyl chloride 與 P(OEt)3加熱迴流 3 至 5 小時,產生反應中間體 phosphonate ester,回溫後加入溶劑並使反應降溫至 0°C,加入甲 醇鈉後低溫攪拌,再逐滴緩慢加入 3-furanal 避免大量放熱。反應攪拌回溫至室溫,將反應倒 入水中產生沉澱,以抽氣過濾收集固體產物,再以管柱層析純化,即可得到照光起始物 3-styrylfuran (1a) (Scheme 4)。
Cl R
P
R O
OEt P(OEt)3 OEt
reflux
i. adding THF ii. 0 C, CH3ONa
O CHO
O
R R =
R = R = R = R = R =
H CH3 OCH3 Cl CN NO2
R = R = R = R = R = R =
H CH3 OCH3 Cl CN NO2 1a
1b 1c 1d 1e 1f
Scheme 4: Syntheses of the reactants 3-(4’
-substitutedstyryl)furans.3-styrylfuran (1a)在鹼性條件下進行照光反應後,我們以反應的 crude H-NMR 分析,即可 明顯看出在 δ10 ppm 左右的位置有兩個明顯的醛基的吸收峰,此為兩個新的照光產物,
naphthalen-2-yl-acetaldehyde (2a)8及 naphthalene-2- carbaldehyde (3a)8的醛基吸收。以管柱層析 純化得到兩個化合物的光譜後,進一步分析,化合物 2a (Scheme 3)具有 δ3.86 (d, J = 2.4 Hz, 2H) 及 9.84 (t, J = 2.4 Hz, 1H)的吸收,分別屬於取代基 acetaldehyde 的 CH2及 CHO 的吸收峰,而在 δ7.32-7.88 ppm 吸收峰的化學位移、分裂型態、分裂 J 值及積分面積符合具有在 2 位置有 acetaldehyde 取代基的 naphthalene。而化合物 3a (Scheme 3)具有 δ10.18 ppm 的吸收,是屬於取 代基 carbaldehyde 的 CHO 的吸收峰。而在 δ7.58-8.36 ppm 吸收峰的化學位移、分裂型態、分 裂 J 值及積分面積符合具有在 2 位置有 carbaldehyde 取代基的 naphthalene。
Table 1: Reaction conditions and results of the photoreaction of 3-styrylfuran in basic media.
solvent tBuOK(g)
hv time
Convers(%).2a:3a
Yields(%)1a THF 0.2 6 100 0.3:1 --c
2a THF 0.4 6 100 0.3:1 --c
3a THF 0.8 6 100 1:1 --c
4a THF 0.8 9 100 0.1:1 --c
5 THF 0.8 6 98 1:1 25b
6a tBuOH 0.8 3 55 0.5:1 60b a. General reaction condition: 20 mg 3a + 20 mL solvent + N2bubble degas.
b. Reaction yields were reported based on their conversions.
c. Without isolated yields.
我們利用 3-styrylfuran (1a)為照光起始物,在不同量的tBuOK 及溶劑(THF 及tBuOH)條件 下,照光可以使化合物 1a 產生變化(Table 1)。Table 1 中之 entry 1-4 為測試反應,我們以 20 mg 起始物在 20 mL 溶劑中,依表中所記載之鹼量及照光時間進行反應。反應終了時以 TLC 片及
crude H-NMR 評估反應結果。同樣以 THF 為溶劑,在加入不同的鹼的量時(entry 1-3),反應會 得到產物 2a 及 3a,化合物 3a 在少量鹼時會有較高之比例。而在照光時間的比較上(entry 3,4),
化合物 3a 在加長照光時間時會有較高之比例。Entry 5 為 entry 3 的放大實驗並進行分離產率定 量。結果我們得到 2a+3a 的總分離產率只有佔約 25%。由於tBuOK 在 THF 中並没有很好的溶 解度,所以我們更換反應溶劑為tBuOH (entry 6),再依表上條件進行照光反應,得到反應轉換 率約 30%,2a+3a 的總分離產率約 30%,若考量照光反應的轉換率,反應產率估算為 60%,而 產物 2a 及 3a 之比率為 0.5:1。
O
O H O
tBuO
O O H
trans-1a
2a cis-1a
K
K
DHNF
KNEol
hv hv
Scheme 5: A possible mechanism of compound 2a formation.
反應產物 2a 可能的生成反應機構如 Scheme 5 所示,反式的起始物 1a 經由照光產生順式
1a 化合物,再經由照光進行光化學六電子環化反應而得到反應中間體 naphtho[1,2-b]furan
(DHNF),此時溶液中的強鹼第三丁醇鉀與 DHNF 進行 E2 反應,furan 在裂開時,利用其氧原 子作為離去基,而形成 naphthene 衍生化合物 2-naphthalen-2-yl-ethenol 的鉀鹽化合物 (KNEol)。在照光停止後,中和反應使 enol form 轉變為 keto form 就得到化合物 2a。
O O H
2a K
KNEol
+ hv
O K
O
K O O
H a possible part of
unidentified mixtures 3a
Oxetane
+
(may undergo photoreaction again) (stable under irradiation)
Scheme 6: A possible mechanism of compound 3a formation.
反應產物 3a 可能的生成反應機構如 Scheme 6 所示,鹼性照光生成的反應中間體 KNEol 在照光反應未停止前,部分已變為 keto form (2a)。此時 KNEol 與產物 2a 可能發生了[2+2]光 化學環化加成反應,而得到一個不穩定的 Oxetane 反應中間體,接著在反應系中,再進行一次
[2+2]的逆反應而解開,形成化合物 3a。由於化合物 3a 對照光所使用的光源(300 nm)相對穩定,
所 以 穩 定 存 在 於 反 應 系 當 中 。 而 另 一 個 生 成 物 , 在 變 為 keto form 後 成 為 3-naphthalen-2-yl-propionaldehyde,此 aldehyde 在照光所使用的光源相並不安定,或可能再次 與中間體 KNEol 發生了[2+2]光化學環化加成反應,所以衍生成為多而雜且尚未鑑定完成之混 合物。
為了進一步研究這個新的光重排反應,我們也合成了一系列含有各種取代基的起始物,包 括甲基(1b)、甲氧基(1c)、氯基(1d)、氰基(1e)及硝基(1f)(Scheme 4),將進行一系列更詳細的研 究。
四、總結
我們成功合成數種具取代基 3-苯乙烯呋喃化合物(1a-1f),並利用了 3-苯乙烯呋喃(1a)研究 出 新 的 鹼 性 環 境 下 進 行 的 光 化 學 反 應 。 此 反 應 可 產 生 新 的 具 側 鏈 萘 環 化 合 物 naphthalen-2-yl-acetaldehyde (2a)及 naphthalene-2-carbaldehyde (3a)。我們也推論了一個可能的 反應機構,更確認的証據將在後續進行更詳細的研究。
五、參考文獻
1. Yu, Y.; Nakano, M.; Ikeda,T. Nature 2003, 425, 145.
2. Jiang, J.; Tong, X.; Zhao, Y. J. Am. Chem. Soc. 2005, 127, 8290.
3. Matsumoto, M.; Terrettaz, S. and Tachibana, H. Adv. Col. Inter. Sci. 2000, 87, 147-164.
4. Alvaro, M.; Aprile, C.; Ferrer, B. and Garcia, H. J. Am. Chem. Soc. 2007, 129, 5647-5655.
5. Lim, H.S.; Han, J. T.; Kwak, D.; Jin, M. and Cho, K. J. Am. Chem. Soc. 2006, 128, 14458-14459.
6. Ho, T.-I.; Ho, J.-H.; Wu, J.-Y. J. Am. Chem. Soc. 2000, 122, 8575-8576.
7. Ho, J.-H.; Ho, T.-I.; Liu, R. S. H. Org. Lett. 2001, 3, 409-411.
8.1H NMR spectral data of 1a:1H NMR (500 MHz, CDCl3) δ7.54 (s, 1H), 7.46 (d, J = 7.6 Hz, 1H), 7.42 (s, 1H), 7.35 (t, J =7.7 Hz, 2H), 7.24 (t, J = 7.4 Hz, 1H), 6.98 (d, J = 16.3 Hz, 1H), 6.83 (d, J
= 16.3 Hz, 1H), 6.67 (d, J = 1.3 Hz, 1H). 2a: 1H NMR (500 MHz, CDCl3) δ9.84 (t, J = 2.4 Hz, 1H), 7.91-7.81 (m, 3H), 7.71 (s, 1H), 7.53-7.47 (m, 2H), 7.34 (dd, J = 8.4, 1.8 Hz, 1H), 3.86 (d, J
= 2.4 Hz, 1H). 3a:1H NMR (500 MHz, CDCl3) δ10.18 (s, 1H), 8.02 (d, J = 8.2 Hz, 1H), 7.97 (dd,
J = 8.6, 1.5 Hz, 1H), 7.95 (d, J =8.6 Hz, 2H), 7.92 (d, J = 8.2 Hz, 1H), 7.66 (td, J = 8.2, 1.3 Hz,
1H), 7.60 (td, J = 8.2, 1.2 Hz, 1H).六、計畫成果自評
1. 原計畫前段工作是開發新的感測環境因子的光化學反應:我們成功設計並合成出新的苯乙 烯雜環類化合物,此化合物具有在鹼性環境下快速進行新的光重排反應之能力。
2. 此新的光重排反應,具備芳香環的裂解與再生,而產生分子骨架的明顯變化,在有機合成 的應用及光化學反應機構的研究都極具學術價值。
3. 此新的光重排反應之特性,足以符合本計畫所欲開發之「智慧型感光控制材料」的需求,
所以是一個成功的「新型智慧感光控制分子」的開發。