行政院國家科學委員會專題研究計畫 成果報告
利用噬菌體重組抗體檢測牛乳品質 (2/2)
計畫類別: 個別型計畫 計畫編號: NSC92-2313-B-009-002- 執行期間: 92 年 08 月 01 日至 93 年 12 月 31 日 執行單位: 國立交通大學生物科技學系(所) 計畫主持人: 毛仁淡 計畫參與人員: 陳文亮, 劉惠君, 宋俊瑩 報告類型: 完整報告 處理方式: 本計畫可公開查詢中 華 民 國 93 年 12 月 23 日
中文摘要
牛乳是台灣畜產業重要產品之一。市面上所售之鮮乳經由生乳均質,過濾,加溫滅菌 及其他流程而產製。其中最重要的課題是在加溫中儘量減少蛋白質之物理及化學性質改 變,證據顯示乳清中主要蛋白 α-lactalbumin、β-lactglobulin、albumin、immunoglobulin 及 lactoferrin 的分子結構在加熱中會受到破壞。而在最近研究指出 lactalbumin 及 lactoglobulin
皆具有抗癌及降低膽固醇效能。含鈣的lactalbumin 在 68℃可以大量流失鈣質。因此骨骼疏 鬆症患者飲用品質不佳之過熱處理鮮乳(overheated milk)而造成鈣質吸收不良,具有抗菌 作用之乳鐵蛋白(lactoferrin)也可因過度加熱而失去其生物活性。在我們實驗中以 native-SDS-PAGE 法比較生乳及鮮乳蛋白質成分,發現在市面上銷售的鮮乳( n=5 )中 lactoglobulin 大量減少。但是,在美國市面上銷售的鮮乳( n=4 )及一些國外進口的奶粉(澳 洲與紐西蘭)並無此 lactoglobulin 減少現象。目前我們不知此改變之生化與營養意義,但值 得研究及討論。由於鮮乳品質在熱處理過程中受到改變,所以我們發展一種加溫指標,或 多種指標而建立加溫圖譜。利用免疫化學測定乳蛋白之品質及變化將是一個相當快速及適 宜的方法。 因此我們利用細胞融合的方式製作出四株單株抗體,此四株單株抗體只辨識還 原乳,而不辨識生乳,進一步將還原乳以不同比例添加入生乳,其結果發現只要添加 5% 之還原乳即可被偵測出,分析此抗體辨認區為LG 結構上之 D 位置上,只要 LG 經加熱此 部位結構位由β-sheet,轉變成 disorder 結構而將抗體辨認區暴露出,因此可被抗體辨認到, 此外將此抗體結合蛋白質晶片之技術,同樣可偵測出生乳中添加還原乳,但在此技術上更 快速,只要2 分鐘即可偵測出。另一方面為了解 LG 之功能,我們進行抗氧化試驗,我們 發現LG 為牛乳中最主要之抗氧化蛋白,其主要的機制為 LG 利用 SH group 防止其他蛋白 被氧化,更發現經加熱後之 LG 完全上失其抗氧化的功能。因此牛乳品質的控制更需要嚴 格的控制,經本計畫執行後,可利用本計畫所製作出之單株抗體嚴格監控牛乳品質。
英文摘要
Cow milk is one of the major dairy products in Taiwan. The fresh milk sold in the market is prepared from the processes of homogenization, filtration, thermal sterilization (pasteurization) and other necessary treatments. One of the essential subjects is to minimize the conformational and physical changes of whey proteins during the heat treatment. Alpha-lactalbumin, beta-lactoglobulin, albumin, immunoglobulin, and lactoferrin are major components of the whey proteins. More recently, lactalbumin and lactoglobulin have show to possess antitumor and hypocholesterolemic effects. Evidence has indicated that the overall ordered structure of these proteins can be disrupted during the heat. Tremendous loss of the association of calcium in alpha-lactalbumin is found when lactalbumin is heated at 68℃. Thus, it may retard the intestinal absorption of calcium for osteoporosis patients who routinely take dairy products as an intervention. The antibacterial activity of lactoferrin is also lost upon the heat. We have recently studied the protein profiles between the raw- and thermal processed- fresh milk using native-polyacrylamide gel electrophoresis (SDS-PAGE), marked loss of lactoglobulin is identified in the fresh milk sold in the market (n=5). However, such loss of lactoglobulin is not observed from those obtained in the American market (n=4), neither in some of imported powdered milk (Australia and New Zealand). It is not known presently that such change may contribute for the loss of biological or nutritional function, certainly it would be of worth for the future studies. Owing to the changes of quality of the milk upon the heat treatment, it would be a necessary to develop a bioindicator or multiple finger print to monitor the thermal denaturation during the process of raw to fresh milk. We have attempted to determine the quality of milk using an immunochemical method. Four monoclonal antibodies against dry milk, but not raw milk, have been produced. In contrast to polyclonal antibodies, only this specific mAb can detect the dry milk spiked into the raw milk as low as 5% in concentration (vol/vol). Using a novel antibody chip, only two minutes are needed to identify the marketed milk containing dry milk. Antigenic mapping of this mAb showing the epitope we defined is located within the denatured D strand (residues 66-76) of β-LG. We conclude that strand D of β-LG participated in the thermal denaturation, where the region was not clearly defined previously. Upon the heating, the structure converts a β-sheet to a disorder structure and the therefore inducing the binding site of the D strand to be exposed. Also, the antioxidant activity of raw milk was analyzed, LG was found to be a major antioxidant component. While SH- group is responsible for the antioxidant activity. It is useful to monitor the quality of milk by the four monoclonal antibodies produced in this grant.
前言
新鮮牛乳為台灣畜產界的重要產品之一。目前市售鮮乳 (pasteurized milk) 為達到滅 菌及保存新鮮的目的,自乳牛取得的生乳 (raw milk) 需先經過均質 (homogenization) 、 去脂、加溫(heat treatment) 、 過濾等主要流程處理後才予上市。生乳中主要之乳清蛋白 (whey protein) 有 α-lactalbumin、β- lactoglobulin、albumin (BSA) 、immunoglobulin 及 lactoferrin 等。以不破壞生乳蛋白的條件為研究的出發點來說,在 2000 年由美國 John Hopkins 大學的 Hendrix (1) 及 1996 年比利時的 Vanderheeren (2) 等人發表的資料中指 出生乳中含鈣的 α-lactalbumin (正常溫度下,鈣離子及 α-lactalbumin 的親合力 (Ka) 為 2.9 x 108 M-1) 加熱至 68℃時,鈣離子呈現游離狀態,使 α-lactalbumin 對人之生理活性降 低。為增加鈣離子與α-lactalbumin 的親和性,Pardon (3) 等人利用基因重組法將 lysozyme 及lactalbumin 製成混合蛋白 (chimeric protein) 表現於酵母菌中,此混合蛋白不僅未失去 對鈣離子的親和性,反而增加其抗熱溫度達73℃-90℃。可見鈣離子與 α-lactalbumin 間之 重要性且深受學者們的重視 (4) 將來甚至可利用 chimeric 技術將混合蛋白表現於基因轉 殖 (5) 而生產抗熱含鈣蛋白牛乳。 另一方面,臨床研究指出,熱處理的牛乳可以減少病人對鮮乳的過敏反應 (如下痢、 皮膚紅斑、氣喘等) 並降低病人產生對乳蛋白之抗體及抗體細胞(6,7) 。而高溫處理下有 機鈣可與含鈣蛋白分離而不易吸收,因此如飲用低溫處理的鮮乳可以預防骨質疏鬆症 (osteoporosis) (8,9) 。經由上述說明,乳業界相當重視乳蛋白品質及其生理功能之改變 (4,6-11) ,有關鮮乳的加溫及乳蛋白變化之研究便成為一個重要的研究課題。乳蛋白的 二級及三級結構會隨牛乳的加溫而破壞;在氧化及非氧化的情況下,前者會將結構中分子 的–SH group 氧化形成 disulfide 的共價鍵型態 (12) ,後者則會造成蛋白結構上的 unfolding (13) 。除了 α-lactalbumin 及鈣離子間在加熱過程所遭遇之相關問題的研究 外,其他乳蛋白如β-lactoglobulin (4,14,15) ,immunoglobulin (12) 及 albumin (16) 也 有相類似的報導。目前如果要監控及了解乳蛋白的之變化,大部分方法是利用極光掃描 (circular dichroism) (13) 、螢光 (flurorescent spectrum) (17) 、NMR (18) 或熱容量方法
(7) 來決定某特定已經純化的蛋白質;若蛋白質處於未純化的全乳情況時,則利用免疫化 學法來進行將是一個優良的辦法。1999 年 Jeanson 等人 (10) 即利用酵素免疫測定法 (ELISA)來了解 α-lactalbumin 的變化,報告中希望藉此 bioindicator 能區分生乳 (raw milk) ,鮮乳 (pasteurized) ,或極高溫鮮乳 (ultra high-temperature) ,結果卻發現其單 株抗體 (monoclonal antibody) 只能區別極高溫 (UHT) 處理的乳品。報告中(32)指出 利用hydrophobic chromatography 可偵測還原乳中變性蛋白(denatured protein)之含 量,如:α-、β-及 κ-casein。因此這類蛋白在區分生乳與還原乳中具有相當重要的角色。 另有研究指出(33),利用還原乳之物理特質,如:溼度、蛋白質含量、乳糖、脂肪、加 工後之殘留物、pH 值、溶解度、黏度及顆粒大小等亦能顯著的區分生乳與還原乳。
牛乳whey protein (乳清蛋白,去除 casein 之部分) 中 β-lactoglobulin (LG) 約佔總蛋
白質的10~15%,它是一個最容易被小腸所吸收之牛乳蛋白質 (1)。在西元 2000 前之 60
年間,有文獻非常清楚的報導 LG 生化特性 (2),但對其特定的生理功能卻不十分清楚
(3)。最近的結果顯示其生理功能可以降低膽固醇 (4),2003 年 review 報告 (5) 指出絕大
部分之乳蛋白皆有抗菌之功用。本年度 2003 更指出乳清蛋白 (whey protein) 中之
cystein- rich 蛋白 (LG 即是其中之一) 與細胞中之 glutathione (GSH) 新陳代謝機制略 同 , 除 了 具 有 抗 氧 化 功 能 之 外 , 並 可 在 動 物 中 能 誘 導 p53 及 阻 礙 新 血 管 形 成 (neoangiogenesis),所以有抗癌作用 (6)。LG 是一個很特殊的乳蛋白,可以抗酸及抗蛋 白酵素之攻擊並且可直接經由腸胃道吸收進入人體中。初生嬰兒在斷奶後服用牛乳,可在 血液中找到約µg/L level 的 LG (7)。與牛不同的是在人乳中並不存在 LG,但母親哺乳期 間飲用牛乳,在其母乳中也會發現LG (8)。如上所述 LG 可抗氧化及抗癌又能直接被人體 所吸收,並提供嬰兒快速成長所需的胺基酸 (9, 10). 因此牛乳中之 LG 成分具有特殊的重 要性。我們的實驗室過去兩年成果中指出 (11, 12, 13.),LG 是一個高效能的抗氧化分子, 其抗氧化機制在於第 121 胺基酸序列位置中 cys 的 free-SH。其扮演一個極重要的角色 (LG 有五個 cys,其他四個分別在 66-160 及 106-119 位置形成雙硫鍵鍵結)。利用化學修 飾 (chemical modification) 將 第 121 位 置 之 free-SH group 修 飾 後 (carcoxylmethylation),其抗氧化的功能也隨之消失 (11)。我們另外在一篇論文(13)中也
同樣指出國內所有市售廠商的鮮乳中,80%之 LG 已經不存在(figure 2),其主要的原因是 國內鮮乳嚴重過度加熱 ,並且發現其機制是 free-SH group 早已與其他蛋白質鍵結形成高 分子聚合物 (12)。但若將-SH 先 block 則 LG 即不能與其他的蛋白質鍵結或自行形成 polymers,但有趣的結果是所測的美國鮮乳中 LG 卻極完整 (100%)。 至於如何去檢測thermal denatured 之 LG,我們也在這兩年中 (2001-2002)發展出超 快速五分鐘晶片檢測法及ELISA,在 900 個奶粉單株抗體中,我們篩選到 4 株只能辨認奶 粉不能辨認生乳之專一性抗體。此4 株體可以區分奶粉與鮮奶,在實驗中若將生乳摻雜奶 粉即可立即用抗體晶片發現 (如 figure17),並且利用光電效果將其數位化後可以定量。此 法靈敏度高只需要10nL (1*10-9L) 的乳品即可檢測。在鮮乳加工廠中可在加熱滅菌前先行 檢驗即可得之有無摻雜奶粉,另外100%生乳若以 UHT 滅菌處理或處理時間過長 (如保久 乳或市面之”鮮乳”), LG 受到嚴重破壞也可以利用我們的快速檢測法測出。本實驗已清楚 的指出國內市售鮮乳中之品質問題。當然未做田野實驗研究 (field study),我們無法預設 立場,究竟是國內市場的鮮乳過度加熱還是摻雜奶粉?雖然我們無法在此時下定論,但是 國內市售鮮乳的確有改善的空間。
研究目的
1. 利用特異性單株抗體區別乳蛋白在加溫後的化學性質變化。 2. 發展能特異性辨認在鮮乳中已變性乳球蛋白 (denatured lactoglobulin) 的單株抗體,並建 立此蛋白為初期品質指標 (bioindicator/bioindex) 。 3. 研究在生乳、鮮乳及保久乳中未與 lactoalbumin 或其他鈣結合蛋白 (calcium-binding protein) 結合的游離鈣質的濃度。4. 利用 recombinant phage-display 法快速 (high-through-put) 篩選各乳品中之專一合成抗 體群。
5. 分析及鑑定 4)中之乳蛋白抗原群,並建立抗原變化圖譜。
6. 以專一抗體研發 immunogold 簡易法 (single-step strip) 測定鮮乳品質,初期以α -lactalbumin 及β-globulin 之專一抗體 (conformational-dependent) 為主,中後期以其他蛋
白抗體建立多重指標 (multiple bioindicator)。
7. 以 immunogold strip 方法製成 nitrocellulose 抗體蛋白“晶片"(microarray antibody chip) 提供學術及產業界評估鮮乳品質。
研究方法
1. 牛乳樣品分析
一般蛋白質在加熱後產生二級及三級結構變化之研究已行之有年(1-4)。但最受重視 的基礎及應用研究,牛乳蛋白可謂首屈一指(1-4,6-18)。其中主要原因是生乳在保健營養功 能方面要較熱處理者優良,加熱後α-lactalbumin 失去與鈣的親和力(2-4),lactoferrin 則失 去抗氧化及抗腸胃道細菌能力(41),以及其他維生素之生物活性等而必需給予適溫處理 (42)。同時由於微波爐(microwave oven)之普及,鮮乳在日常生活中加溫已相當普遍, 因此加熱程度對鮮乳之品質更為重要 (42) 。分析加熱鮮乳樣品方法將依下頁 Flow Chart 1 所示:Flow Chart 1:分析牛乳產品之流程
Analysis of Milk Product
Chemical Analysis SDS-PAGE Physical analysis Immunogold determination Immunochemical analysis Thermal
denaturation Western blot
Phage-displayed monoclonal light chin antibody Non-Competitive ELISA Competitive ELISA Ca2+ binding Circular dichroic spectrum Scanning spectrum Fluorescent probe Protein Data bank
HPLC Native-PAGE Hybridoma monoclonal antibody Thermal denaturation curves
2. 鈣質(free Ca
2+)之測定
一般牛奶中之鈣質(有機鈣)濃度約1.2 mg / ml 在小腸之吸收率遠比服用鈣片(無機鈣)
有效(43, 44)。但將無機鈣加入鮮奶中的吸收效果也有一定之限制,因為生乳中與鈣結合之蛋 白(lactalbumin)及其它 caseins,α1-casein,α2-casein,β-casein,Kappa-casein,whey basic protein(MBP)等已呈飽和狀態,在乳中濃度為一定數。最近 Vegarud et al 報告中(45)指出 帶有鈣質及其它礦物質之乳肽(milk peptides)在乳中具有極大的生理功能,而利用鮮乳為飲 料可以克服平時礦物質攝取之不足,這類蛋白甚至已利用於醫藥界。這類具生理功能產品已是 今日新一代之Superfood。Toba et al(47)以含鈣之 milk basic protein(MBP)予病人口服,每 日300mg 連續 16 日,發現血中骨髓荷爾蒙(osteocalcin)濃度明顯增加,而發現 MBP 可以促 進新骨骼成長。本實驗要調查國內市售之保久乳(高溫滅菌),鮮乳及生乳其游離之 Ca2+ 離子 濃度,而最後分析在加工後乳品中Ca2+ 離子分別在whey protein,casein,lactoalbumin,及 MBP 之濃度。Ca2+ 離子濃度之檢測法則可用顏色滴定定量法及標準金屬原子吸收光譜法(AA)等 決定。進行之流程在Chart 2 中說明。
Flow Chart 2:分析牛乳產品之游離鈣流程
Raw milk Processed fresh
milk Powdered milk storaged milk Long-term
Total calcium determination Bound Ca2+ Protein Unbound free Ca2+ Milk protein purification Caseins (αβκetc) Milk basic protein Lactalbumin Atomic absorbance analysis Colorimetric analysis Ionic chromatographic analysis Mass spectrum analysis
3. Page-display 方法篩選能夠區分生乳,鮮乳及奶粉蛋白之抗體
利用HPLC,Native-PAGE 及 2D-PAGE 等分析方式在不同加熱條件下之乳蛋白先行分開。 分開後之純化物(或半純化物)將分成(1) HPLC soluble fraction 及 (2 ) Native-PAGE 所表現之 分子兩類。再分別利用具有1010 diversity 之 phage-display 抗體進行篩選及利用 ELISA / Western 兩方法來進行偵測。此法之優點是: 1)不需要純化所有抗原;2)乳蛋白濃度較低時可以直 接與 blot 在 nitrocellulose 上的 phage 抗體結合;3)不需要先行 clone 抗體;4)快速 (high-through-put)篩選得來的 phage 可立刻 transform 至 E. coli 中進行量產;5)不需要 immunization。最後有免疫化學反應之抗體再進行與抗原作用之專一性測定。如此,具有分辨 能力之專一性抗體將被量產及定性;具有指標特性之乳蛋白抗原則可被純化及定序。
Phage Display 為一種利用 phage 將蛋白質以融合蛋白之方式表現於 phage 的蛋白外鞘 (29-31, 39, 40),用以篩選藥物、偵測疾病、尋找接受器(receptor)及接合物(ligand)、製作
抗體及治療疾病。本研究計劃致力於利用phage display 製作乳蛋白抗體用以區分熱不穩定蛋白
之原性與變性結構。
Phage library 之建構:
取動物體之脾臟,萃取其mRNA,利用 RT-PCR 製作 cDNA library,利用 PCR 由 cDNA library 得到抗體light chain 及 heavy chain 之基因,及合成 linker。將 light chain 及 heavy chain 之基因 與linker 組合成 heavy chain – linker - light chain,植入 DNA vactor 為 phagemid 其內包含有抗藥 基因、polylinker 及 G3 gene(G3 為 phage 之 capsid protein 負責 phage 的吸附及 DNA 的穿透如 下圖)。
成功植入的 vector 再轉移進入 E coli. 將此 phagemid 大量表現於菌體中,再加入 helper phage(此 phage 為 M13)(48)將 phage particles 由 E coli 中帶出,被帶出含有 recombinant phagemid 之phage 再感染 E coli 所產生新的 phage 即為表現 cDNA gene 之 phage,此稱為 phage library。
利用phage library 篩選目標物:
將sample 固定後再加入 phage library 與 sample 結合,其中 phage library 會產生與 sample 結合及不結合之phage(即 phage 表現出能抵抗 sample 之抗體),利用washing 除掉不能與 sample 結合phage,再利用 anti-M13 phage 的抗體(anti-M13 phage 的抗體為 anti M13 之 cost protein) 偵測與sample 結合之 phage,再加入受質即能呈現出顏色,將此與 sample 結合 phage 送入 E coli 大量增殖後,萃取出phagemid 後,用限制脢將所植入的 cDNA 切下做 DNA sequence,如此即 能大量得到antibody 的 DNA 序列:。如下圖:
4. Monoclonal antibody 之製作:
Monoclonal antibody 主要利用脾臟細胞內之 B 細胞與骨髓瘤細胞相互融合,產生專一性 之單株抗體。用以診斷疾病,進一步治療疾病及區分蛋白質結構。本計劃將利用單株抗體之專 一性來區分牛乳中熱不穩定蛋白,因熱所導致結構上的不同。 小鼠之免疫法 將sample 與佐劑混合均勻後,以腹腔及背部注射方式,注射至 Balb/c 品系之小鼠,第一 劑注射後三天注射第二劑,第二劑注射後七天後注射第三劑,注射後三天採集血清和脾臟細胞 (26, 28)。 Hybridoma cell 之製作 利用PEG 與 DMSO 將脾臟細胞內之 B 細胞與骨髓瘤細胞相互融合(5:1),使其融合細 胞不但具有骨髓瘤細胞快速分裂之特性,且另一方面也具有脾臟細胞生產特異性抗體的性質。 單株抗體之篩選將能與antigen or sample 反應之 hybridoma 細胞團,利用 limiting dilution 的方式將細胞團 分散成單一細胞,待單一細胞proliferation 後再與 sample 確認,則此抗體即為單株抗體(26, 28)。
利用兩大製作抗體之技術,製作乳蛋白之抗體,主要目的在於區分乳蛋白中之熱不穩定 蛋白在加熱與後所產生之不同結構,此抗體之產生能成功的將牛乳之加工過程更加標準化,此 外同時能區分生乳與還原乳之不同。在篩選時構想為:
Phage display
利用phage display 之獨特篩選技術,先將能與 native-LG 結合之 anti-phage 去除後,再將 與Native-LG 不能結合之 anti-phage 與變性 LG 反應,反覆篩選並篩選出只能與變性 LG 結合之 anti-phage。篩選出之 anti-phage 再量產成抗體之結構。此抗體即能用於區分 native-LG 及變性 LG。
Monoclonal antibody
Monoclonal antibody 之篩選過程中所採用的方式如下圖所示:將單株抗體分別與 native-LG 及變性LG 交叉反應,此方式會產生與 native-LG 結合之抗體及與變性 LG 結合之抗體,再將此 兩種抗體交叉比對找出區分native-LG 及變性 LG 之抗體。 ● ● ● ● ○ ● ● ● ○ ● Native LG 抗原 Denatured LG 抗原
●為同時辨認 native LG 及 denatured LG 結合之抗體。○為專一者能區分 native-LG 及 denatured LG 之抗體。
Immunogold 快速檢測
利用區分Native-LG 及變性 LG 之抗體與 immunogold 結合,用以快速檢測出 native-LG 與 變性LG。如下圖 A.及 B.為同一種檢測試片。
A. B. A. Sample 為生乳含 native-LG。 B. Sample 為加溫之鮮乳會有變性 LG。結果顯示變性 LG 會與 immunogol 上及檢測試片上 之抗體結合,因而在檢測試片上呈現紅色標記。
5. 簡易型牛乳品質之測定:
此簡易型測試紙將分別固定可以用來識別加溫前後的乳蛋白抗體於同一試紙上,最後再 觀察其差異性。此immunogold 法之好處是不需要任何沖洗及 incubation 時間,1 分鐘內之單一 流程(Single Step)即可獲得結果。整體製作流程將依 Flow Chart 3 所示。Flow Chart 3:Immunogold 之製作流程
生 乳 Raw milk 鮮 乳 Fresh milk HPLC Separation Native-PAGESelection of interested clones
Immunogold
Antigen identification by Purification &
Sequence identification
其 他 乳 類 產 品 Other milk product
奶 粉 Milk powder
ELISA
Immunochemical differentiation by Phage-displayed Antibody6. Immunogold 之製作:
Colloidal gold 之製作
利用1973 年 Frens (49) 和 1983 年 Chow 所述 (50),配好 0.01% chloroauric acid (HAuCl4)
及7.6% sodium citrate 溶液,以 sodium citrate:HAuCl4=1:182 的體積比例混合均勻,再以加
熱器使溶液溫度上升來使gold chloride (Au3+) 被 sodium citrate 還原成 gold particles (Au0)。 在反應過程中可觀察到溶液顏色變化由灰-紫-紫紅-紅需 1 小時。製成的 colloidal gold,直徑大 約20 nm。將此溶液在避光及冷房下混合 5-10 分鐘,即能用於連接抗體 (51, 52)。
Conjugation of antibody to colloidal gold 之流程
將1ml colloidal gold 溶液加入新鮮配置之 1% K2CO3溶液,調整至適當pH 值,再加入定
量抗體(IgG fraction),抗體溶在含有1% BSA 溶液中,於室溫中反應 5-10 分鐘,再以 BSA 溶 液去block colloidal gold,配置完成後室溫放置 5-10 分鐘後離心,去除上清液,沉澱物用 50ul 之上清液重新懸浮。此溶液即為immunogold solution11。
Coating of nitrocellulose strip with antigen 之方法
利用 0.2% BSA 稀釋純化出之抗原至所需知濃度,再將此稀釋後抗原固定至轉漬帶
(nitrocellulose strip)中央處,利用空氣自然風乾 1 小時,風乾後利用 1% BSA blocking,再用 PBS 洗淨未附著上的抗原即完成。風乾後保存於 4℃。
Dot immunogold assay
利用1999 年 Dykman 所述 (53) 的步驟將之改良,在轉漬膜(nitrocellulose strip)中心點 點上sample (antigen),再將此轉漬膜放入已製備好之 immunogold,與 immunogold 上的抗體相 互雜交。Immunogold 抗體稀釋成 OD520 值為 0.5。當抗體與 sample 反應時會產生紅色點,3-5 分鐘顏色即產生,1 小時顏色會加深,反應完畢直接用水清洗或泡在水中即可(泡在水中可長 期保存)。
Effect of antibody dose on colloidal gold coupling
再以BSA 溶液去 block colloidal gold,配置完成後室溫放置 5-10 分鐘後離心,去除上清液,沉 澱物用50ul 之上清液重新懸浮完成 immunogold solution。利用 dot immunogold assay 來分析相 同量之LG(lactoglobulin),來確認 conjugation 在 colloidal gold 的抗體的多寡對於鍵結效率的 影響。如下圖所示:
Effect of time on antibody coupling with colloidal gold 如下圖所示:
Effect of antibody dose on colloidal gold coupling
0 20 40 60 80 100 120 0 100 200 300 400 500 LG antibody (ug) Percentage of maxim a binding
Effect of antibody dose on colloidal gold coupling。利用不同劑量 LG 抗體與colloidal gold coupling,經由 immunogold assay 顯現不同強 度之紅顏色來決定鍵結效率。
Commercial sandwich detection method
利用 0.2% BSA 稀釋純化出之抗體至所需知濃度,再將此稀釋後抗體固定至轉漬帶
(nitrocellulose strip)中央處,利用空氣自然風乾 1 小時,另在轉漬帶之一邊接合吸附有 immunogold 抗體之紙片。此將形成一檢驗試片,如下圖所示:
Effect of time on antibody coupling with colloidal gold
0 20 40 60 80 100 120 0 10 20 30 40 50 60
Incubation time (min)
Percentage of maxim
a
binding
Effect of time on antibody coupling with colloidal gold。利用 LDL 抗體與 colloidal gold,經不同 coupling time,由 immunogold assay 顯現不同強 度之紅顏色來決定鍵結效率。 Immunogold 抗體 擴散方向 Sample 抗體 Immunogold 檢驗試片示範圖。將 sample(antigen)放置在圖左側,sample 會利用毛細現象往右擴散,當sample 經過 immunogold 抗體時,抗原會與 抗體結合並將immunogold 往右方運送,運送至轉漬帶放置抗體處,抗原 會再一次與轉漬帶上之抗體結合,形成”抗體-抗原-抗體”之複合物,且將 immunogold 固定在放置抗體處呈現紅色,沒有結合之抗體則繼續往右移 動不會固定住。如此來證明有抗體-抗原反應。
結果與討論
1. 建立台灣目前市面鮮乳之部分品質指標:
利用native-PAGE, figure 1 顯示市面鮮乳(processed milk)加工後,whey protein fraction 中之 lactoglobulin (LG)大量減少。由於 LG 在腸胃中有降膽固醇之功能(4),所 以 LG 之大量減少破壞或失性(denaturation)後可影響牛乳之品質。另外台灣 5 種名牌 與美國市場鮮乳比較(figure 2),發現美國產品中之LG 與生乳(raw milk)無顯著差異。
而進口之澳洲、紐西蘭(除丹麥外)奶粉中其 LG 之流失則相當有限,因此台灣本土之
鮮乳產品有待大家繼續努力研究。在我們的實驗中發現:加熱過程可以使 LG 大量改變
其負電荷之生化特性(figure 3),而在 Westernblot 中(figure 4)更發現加熱可使 LG 形 成聚合大分子(polymerization)。這些聚合分子在美國市售之鮮奶中並無發現。
2. 建立生乳中摻雜奶粉的檢測方式:
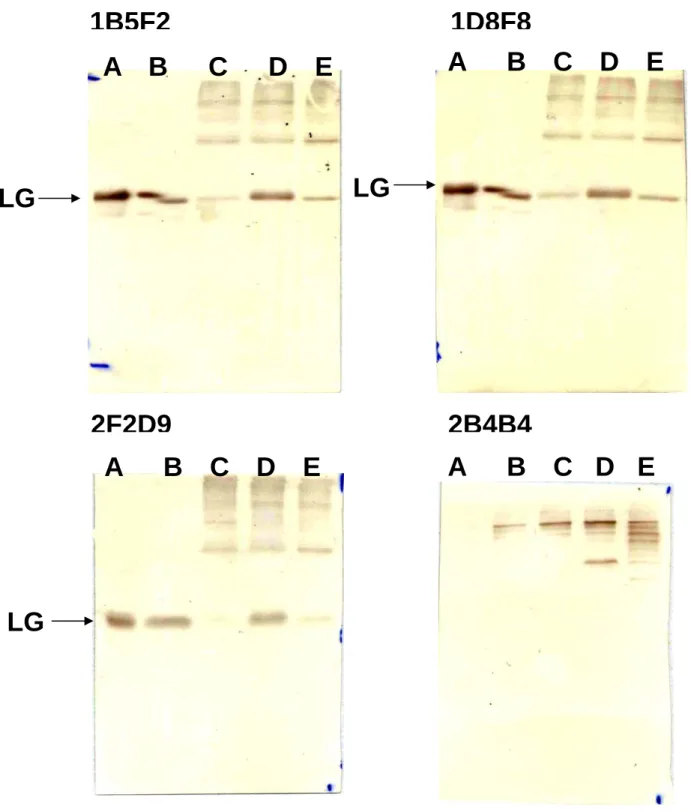
生乳中摻雜奶粉的問題,在台灣已存在四十多年皆無法解決,申請人利用在單株抗 體的技術預解決此問題,因此申請人先製作出對還原乳(奶粉沖泡之牛奶)高專一性之 單株抗體,進而利用ELISA 逐一篩選分別與生乳及還原乳反應,進一步篩選出與兩種乳 有不同反應之單株抗體,此抗體即可區分生乳與還原乳。如 figure 5 結果顯示初步篩選 出之單株抗體共八株,將titer 高的抗體株單株化,所得四個單株抗體分別為 1B5F2, 2F2D9, 1C10F10 及 1D8F8。由結果得知此單株抗體只能與還原乳中之蛋白質產合,不能與生乳 中之蛋白質結合。因此能將此抗體運用於區分生乳及還原乳。在深入研究中我們將奶粉 直接以不同比例摻雜入生乳中,利用此抗體偵測,其結果發現摻雜10%以上的奶粉入生 乳中可順利的偵測出。如figure 6。另一方面將生乳經加熱後,此抗體只辨認加熱後的生 乳而不辨認沒加熱過之生乳。如figure 7。此結果說明所製作出的單株抗體僅辨認受溫度 改變之乳中蛋白,因此我們再將生乳經不同溫度不同時間加熱,利用此偵測發現在80℃ 加熱一分鐘以上之生乳才會被此抗體偵測出。如figure 8,說明此抗體辨認的是加熱過度 的牛乳,此結果說明在學術上可用於研究因加熱導致結構改變的蛋白,在產業上可運用 於制訂牛乳製成中加熱的標準,進一步監控牛乳品質。利用Westernblot 分析此四株單株抗體分別辨認牛乳中何種蛋白,分析結果得知所篩選出之單株抗體全部辨識LG 如 figure 9,此結果更可證明 LG 為熱敏感性蛋白與 Regester GO 等人所做之理論相同(17),因此 LG 在乳蛋白中扮演一個相當重要的角色,可用於當作熱處理後的指標,並且進一步運 用於監控牛乳的品質。
3. 完成 LG 的 epitope mapping
蛋白質加熱後會導致結構的改變,而這結構的改變會造成新的抗體產生,乳蛋白中 的LG 亦是如此,LG 經熱處理後其二級結構嚴重改變如 figure 10,這些新生成的結構就 會造成新抗體的產生,因此辨認奶粉不辨認生乳的單株抗體結合的區段應為 LG 經加熱 後所產生的新的 epitope。本實驗室進一步分析此單株抗體結合的區段,因此我們利用trypsin 及 CNBr 分解 LG,再用 Western blot 分析此單株抗體,辨認在 LG 的哪一個區段, 結果得知經trypsin 及 CNBr 各別分解後,在逐一拼出此單株抗體所辨認的區段為 LG 靠 近N 端部位,如 figure 11 及 figure12。另一方面利用化學修飾法將 LG 上的 Lys group 修 飾(acetylation)後與此單株抗體反應,結果發現修飾後的 LG 並不會被此抗體辨認,因 此推斷此抗體辨認的區段應與Lys group 有關。由上述的結果為了更精確的尋找出辨認的 區段本實驗室再用peptide 合成的方式,合成多段的 peptides 與此抗體結合,逐一拼出此 抗體的結合部位如figure 13。此結合部位位於 LG 結構中β-sheet 上之 D 區段,此區段會 因加熱後破換其β-sheet 之結構,而將抗體辨認區暴露出,導致 LG 經加熱後即可被此抗 區所區分。
4. 分析出 LG 加熱後與牛乳中的 casein、lactalbumin(La)及 BSA 產生結合
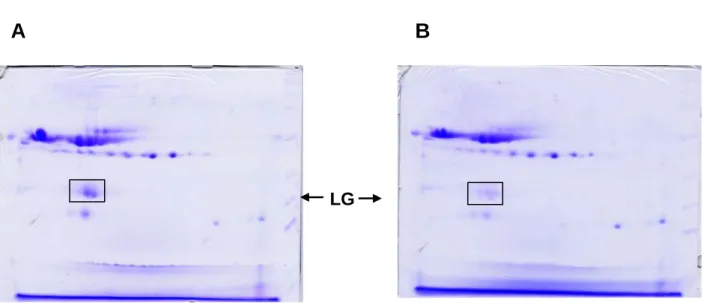
還原乳中與生乳加熱後在SDS 或 native-PAGE 中分析,結果發現 LG 大量減少(figure 1),利用Western blot 分析發現加熱後的生乳,LG 與乳中的蛋白質形成大分子(figure 4)。而此大分子是LG 與乳中何種蛋白質結合目前無直接的證據證明,因此我們嘗試利用 IEF
2D-PAGE 及本實驗室所研發出的 2D-PAGE 分析,在 IEF 2D-PAGE 中並無發現明顯的不 同,除LG 明顯減少外,如 figure 14。而在本實驗室所研發出的 2D-PAGE 分析中發現,
BSA,如 figure 15,結合的機制是利用 SH group 相互結合,因本實驗室所研發出的 2D-PAGE 中加入還原劑使利用 SH group 相互結合結合大分子變成單一蛋白質分子,所 以能清楚且直接的分析出LG 與乳蛋白中的 casein、La 及 BSA 結合,並分析出結合機制 是用雙硫鍵結合。
5. 建立蛋白質晶片偵測牛乳品質
本實驗室致力發展蛋白質晶片已二年,現階段已相當成熟,不僅是樣品的快速檢測 或是不同疾病的檢測皆已研發完成其結果如figure 16。因此在牛乳的品質檢驗我們結合 蛋白質晶片用以快速檢驗大量的牛乳樣品,其原理為利用單株抗體與 gold 結合成之immunoglold 與吸附於 nitrocellulose strip 上之生乳、還原乳反應,immunogold 利用毛細 現象與吸附於nitrocellulose strip 上之蛋白質結合,形成紅色為還原乳,無法呈色為生乳。 如figure 17,將生乳中摻有不同比例的奶粉,分別吸附於 nitrocellulose strip 上,與 gold 結合之單株抗體反應其結果在二分鐘內即可偵測出生乳中摻雜奶粉,而在結果發現摻雜
比例越高顏色越深,摻雜比例 5%以上即可偵測出。此結果說明我們已成功結合蛋白質
晶片用於牛乳品質的檢測上,我們將可運用此技術大量檢測國內牛乳品質。
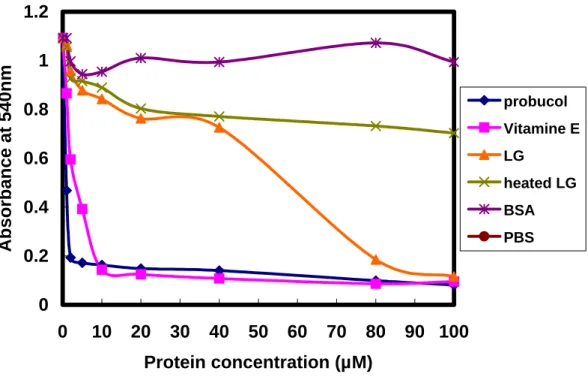
6. 分析出 LG 具有抗氧化的功能
LG 的功能試驗中,我們發現 LG 具有抗氧化的功能如 figure 18,取 IC50的LG 做長
時效的抗氧化實驗,在SDS-PAGE 中我們發現隨著時間的增加 monomer 越來越少,dimer 越來越多。所以我們推測其抗氧化的機制是利用蛋白質本身被氧化,保護其他蛋白質不
會因氧化壓力而氧化。為了證明我們看到的是 LG 而不是其他雜蛋白,利用本實驗室所
製造出anti-LG 的單株抗體證明其確實為 LG。氧化後 LG 形成 dimer 或是 polymer 的型 態與加熱過後的形式非常相似如figure 19,根據文獻指出 dimer 的型態是利用 LG 的 SH group 形成(18, 19,20,21,22),所以利用化學修飾及加熱的方式將free-SH group 修飾,發 現LG 就會失去抗氧化的功能,如 figure 20。所以 LG 主要是利用其為在第 121 胺基酸位 置的free-SH 來抵抗氧化的壓力,藉由犧牲自己來避免 LDL 的氧化。
以乳蛋白中lactalbumin 及 lactoglobulin 為篩選的抗原,利用 phage-display 技術製
作具有專一性的抗體,進而檢測乳品品質。我們已成功地利用phage display 的技術經
過四到五次篩選而得到專一性高之噬菌體;同時,也成功地運用ELISA plate 篩選噬菌
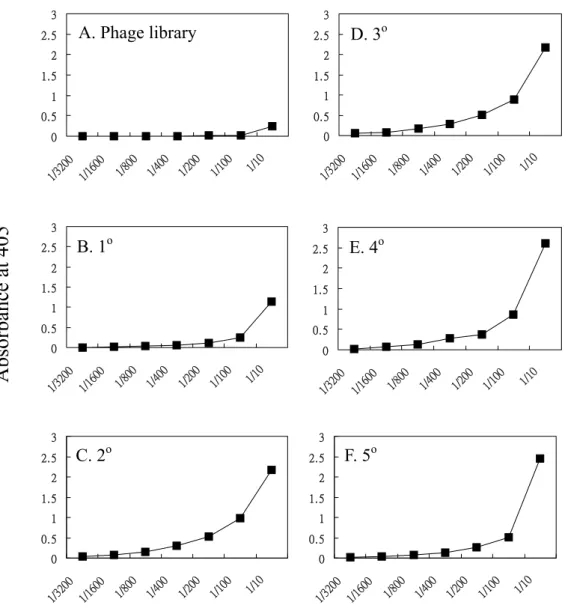
體並取代傳統使用之immunotube 篩選方法。如 Figure 21,我們利用 phage display 的技
術經過五次篩選後,針對每次所得之 polyclonal phages 進行抗原專一性之標定曲線
(titration of phage binding curve)。同時也成功地篩選出對 LA and LG 有專一性之單株噬 菌體,其對抗原之活性如Figure 22 所示;取高表現之噬菌體作專一性之 dose responsive 曲線如Figure 23。在表現(expression)可溶性單株抗體片段 (soluble monoclonal antibody fragments) 方面,經由將對 LA 有專一性之單株噬菌體感染進入用 E.Coli / HB2151 後, 萃取細菌preplasma fraction 之蛋白質與來自 9E10 融合瘤細胞株(9E10 hybridoma cell line) 之 anti-cMyc 單株抗體經由 ELISA 測試結果如 Figure 24 所示。
β-LG β-LG α-LA
A B
Figure 1:本實驗室利用 15% Native-PAGE 之電泳膠片分析生乳及鮮乳 圖。A Lane 為生乳。B Lane 為加工過之生乳。其中在 Lane A 上之兩種 蛋白質(β-LG)經加溫處理後大量消失。
1 3
2 8
4
5
6
7
9
10
11 12 13
Figure 2:利用 15% Native-PAGE 之電泳膠片分析台灣不同廠牌之市售鮮 乳及奶粉。其中Lane 1 為直接由牧場取得之生乳、Lane 2 至 Lane 6 為台 灣市售鮮乳、Lane 7 至 Lane 9 為進口奶粉分別來自丹麥、澳洲及紐西蘭、 Lane 10 至 Lane 13 為來自美國市售鮮乳。在鮮乳之β-LG 明顯減少,而 奶粉與美國市售鮮乳中β-LG 仍然存在。
1 3
2
4
5
6
7
β-LG β-LG α-LA Figure 3:利用 15% Native-PAGE 之電泳膠片分析不同時間熱處理(95℃) 之α-LA 及β-LG 之變化。 Lane 1 至 7 為不同熱處理時間分別為 0、30、 60、120、240、480 及 720 秒。 β-LG 之變性與時間成正比A. Native - PAGE
B. SDS - PAGE
7.4 84 120 205 36 52 30 M 0 480 90015 30 60 120 240 0 15 30 60 120 240 480 900Figure 4:利用 Western blot 分析在不同時間熱處理後之β-LG 變化。(A) 15% Native-PAGE。(B) 15% SDS-PAGE。分析與β-LG 抗體之反應,Lane 左至右為不同熱處理時間分別為0、15、30、60、120、240、480 及 900 秒。β-LG 明顯在加熱時間越長蛋白濃度逐漸降低。並且發現高分子聚 合物 (panel B)。
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0 2 4 5 10 20 40 60 80 100
Percentage of dry milk added into raw milk
OD at 405 n m 0 0.1 0.2 0.3 0.4 0.5 0.6 1 2 3 4 5 6 7 8 Primary clones OD at 405 nm Raw milk Dry milk Figure 5:利用 ELISA 初步所篩選出只會辨認還原乳不會辨認生乳。篩選 出有高titer 的抗體株單株化分別為 1, 2, 3 及 5 (1B5F2, 2F2D9, 1C10F10 及1D8F8) Figure 6:利用 ELISA 分析辨認還原乳單株抗體在生乳中加入不同比例的 還原乳的免疫結合能力。由結果得知加入還原乳比例越高所分析的讀值越 高,因此可利用此單株抗體解決生乳中還原乳的摻雜問題。
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 1B5F2 2F2D9 1C10F10 1D8F8 2B4B4 Clones OD at 405 nm
Raw milk Raw milk heated
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45 0 50 60 70 80 90 Temperature OD at 405nm 15secs 30secs 1mins 2mins 4mins 8mins 16mins Figure 7:利用 ELISA 分析辨認牛乳的單株抗體與生乳加熱後的結合力。 生乳加熱後加(熱 95℃15 分鐘)與此單株抗體的結合力增加五倍以上, 此結果可推測加熱後會暴露出新的epitope。2B4B4 的單株抗體為同時辨認 生乳與還原乳。 Figure 8:利用 ELISA 生乳經不同時間不同溫度加熱後此辨認還原乳單株 抗體的免疫結合力。將生乳用50, 60, 70, 80 及 90℃加熱 15’’, 30’’, 1’, 2’, 4’, 8’ 及 16’。結果當生乳加熱 80℃以上 1 分鐘即可被此抗體辨認。因此可用 此抗體訂定國家標準。
Figure 9:利用 Western blot 分析還原乳的專一性單株抗體(1B5F2, 2F2D9 及1D8F8)及缺乏專一性的單株抗體的特性。每一個 lane 放入 10ug 的乳 蛋白。Lane A:為 native LG、lane B:為生乳、lane C:為市售鮮乳、lane D:為還原乳及 lane E:加熱 95℃15 分鐘後的生乳。
1B5F2
1D8F8
A B C D E
A B C D E
A B C D E
2F2D9
A B C
D
E
2B4B4
LG
LG
LG
-10 -8 -6 -4 -2 0 2 4 190 200 210 220 230 240 250 260 WAVELENGTH (nm)
ELLIPTICITY (1000deg cm2 / dmole)
Heat Non-heat
Figure11:利用 western blot 分析 LG 由 CNBr 所分解後 epitope 的分佈情形。每一個 well 加入的蛋白質濃度分別為 30ug, 10ug 及 10ug 。Lane M:marker。 lane B: LG + CNBr。lane C:LG + CNBr。lane D:BSA。此抗體與 LG 結合的部位應在 9 kDa 的位置。
M A B C
9 kDa
Figure 10:利用 CD(Circular Dichroism)分析純化後之 LG 經加熱後之蛋白質結構。
虛線為未加熱處理之純化後LG,實線為加熱處理後之 LG。明顯得到在加熱處理後
之LG 部分結構已由α-helix 變為 random coil。由此可說明加熱處理造成構型 (conformation)上的改變。
Figure13:利用 peptide 合成的技術合成 16 片段,所包含的部位大多位於 CNBr 及 trypsin 所拼出的部位(N 端位置)。利用抗體分析後灰色區域 (胺機酸 67-75)即為抗體所 辨識的區域。
Figure12:利用 western blot 分析 LG 由 trypsin 分解後 epitope 的分佈情形。每一個 well 加入的蛋白質濃度 30ug。LG 和 trypsin 量的比例是 10000:1。 Lane M:marker。 Lane A:native LG。Lane B:LG+ trypsin 反應 10min。Lane C:LG+ trypsin 反應 30min。 Lane D:LG+ trypsin 反應 1hr。此抗體與 LG 結合的部位應在 12 kDa 的位置。
M A B C D
Figure 15:利用本實驗室研發出的 2D-PAGE 分析。牛乳經加熱後 LG 與乳中哪幾 種蛋白質結合。A:並未加熱的生乳。B:加熱後的生乳。結果發現生乳經加熱 後LG 與 BSA、Casein 及 LA 結合成大分子。
LG
Figure 14:利用 IEF 2D-PAGE 分析牛乳經加熱後 LG 與乳中哪幾種蛋白質結合。 A:並未加熱的生乳。B:加熱後的生乳。結果並未發現有不相同的地方。
A B
LG BSA Casein LAA B
大分子 小分子 小分子 小分子Figure16:利用蛋白質晶片快速檢測不同病人有無得到疾病。此晶片大小為 1.5 cm x 2 cm,晶片上共有 100 病人檢體,此結果在二分鐘以內即可診斷出。
Figure17:利用蛋白質晶片快速檢測牛乳中有無摻雜奶粉。由右至左摻雜濃度為 100, 90, 80, 70, 60, 50, 40, 30, 20, 10, 5 及 0%,最右邊為 positive control。用此晶片偵測,
0 0.2 0.4 0.6 0.8 1 1.2 0 10 20 30 40 50 60 70 80 90 100 Protein concentration (µM) Absorbance at 540nm probucol Vitamine E LG heated LG BSA PBS Figure 18:不同物質及β-LG 的抗氧化能力分析。LG 在濃度 80ug 達到最大抗氧化 效力,加熱過的LG 則無抗氧化的能力。
Figure 19:利用 SDS-PAGE 分析加熱後與氧化後之 LG。Lane M:為 maker。 Lane A:為 native LG。 Lane B:為加熱後之 LG。Lane C:為氧化後之 LG。在加熱後 與氧化後之LG 會形成 dimer 的結構。 KDa 119 79 46 24 19 31 M A B C
0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0
20
40
60
80
100
120
LG conentration(µM)
Absorbance at 540nm
LG modify LG Figure 20:利用化學修飾法將 LG 修飾後分析其抗氧化力。經化學修飾後之 LG 抗氧化力明顯比native LG 低。證明 SH group 為主要參與 LG 抗氧化機制。Figure 21:Polyclonal phages 對 α- lactalbumin 專一性之標定曲線。
首先將由library 產生而來的噬菌體(圖 A)與抗原在 ELISA 盤上結合, 洗去沒有結合之噬菌體,利用0.1M glycine-HCl 緩衝液(pH2.0)將與抗原結 合之噬菌體沖出,此沖出的噬菌體溶液感染到 E.Coli / TG1,所得的噬菌 體溶液即為1o篩選(圖 B),重複此篩選步驟即得 2o -5 o篩選(圖 C-F);將 每次篩選所的之噬菌體與抗原結合,以帶peroxidase conjugated
monoclonal antibody against M-13 (anti-M13-HRP)進行 ELISA 實驗,即得 圖中每次篩選之dose-respousive 曲線。
Dilution factors of polyclonal phages
Absorbance at 405
0 0. 5 1 1. 5 2 2. 5 3 1/10 1/100 1/200 1/400 1/80 0 1/16 00 1/320 0 0 0. 5 1 1. 5 2 2. 5 3 1/10 1/10 0 1/200 1/40 0 1/800 1/1600 1/320 0 0 0. 5 1 1. 5 2 2. 5 3 1/10 1/10 0 1/200 1/400 1/800 1/1600 1/320 0 0 0. 5 1 1. 5 2 2. 5 3 1/10 1/100 1/200 1/40 0 1/800 1/16 00 1/320 0 0 0. 5 1 1. 5 2 2. 5 3 1/10 1/100 1/20 0 1/400 1/800 1/160 0 1/320 0 0 0. 5 1 1. 5 2 2. 5 3 1/10 1/100 1/200 1/400 1/80 0 1/16 00 1/320 0 A. Phage library B. 1o F. 5o C. 2o E. 4o D. 3oFigure 22:單株噬菌體之抗原專一性分析。圖 A 為 LA 為抗原,圖 B 為 LG 為抗原。
經過4-5 次篩選後,被感染的 E.Coli / TG1 會生長於含抗生素的培養基, 從此培養基篩選single colony,此單一 clone 即含有 single epitope gene 之單株 噬菌體質體 (phagemid),經由 helper phage 協助將可表現抗體片段的噬菌體 rescue 出來,所得到的噬菌體即為單株噬菌體。圖中顯示篩選單株噬菌體具 抗體片段並對抗原有專一性 (specifity)。
Monoclonal phages
Absorbance at 405
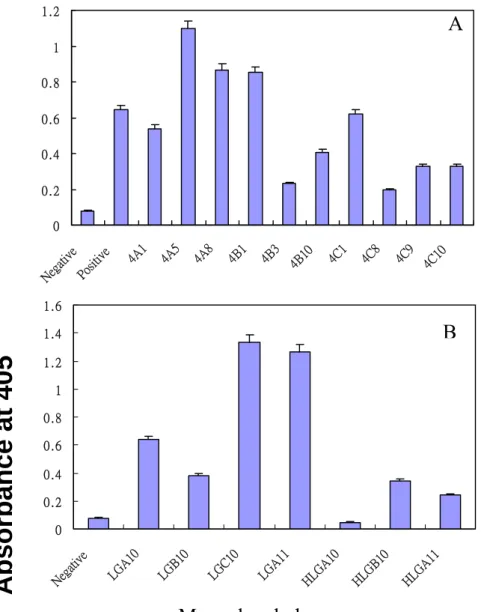
0 0 . 2 0 . 4 0 . 6 0 . 8 1 1 . 2 Nega tive Positive4A1 4A5 4A8 4B1 4B3 4B10 4C1 4C8 4C9 4C10
0 0 . 2 0 . 4 0 . 6 0 . 8 1 1 . 2 1 . 4 1 . 6 Nega tive
LGA10 LGB10 LGC10 LGA11 HLGA10 HLGB10 HLGA11
B
0 0 .5 1 1 .5 2 2 .5 1/10 1/100 1/200 1/400 1/800 1/1600 1/3200 1/6400 1/12800 1/25600 A1 A5 A8 C 1 - 0 . 5 0 0 . 5 1 1 . 5 2 2 . 5 1 1/2 1/4 1/8 1/16 1/32 1/64 1/128 1/516 1/1024 1/2048 1/4096 LGA4 LGD2 LGA1 1
A
B
Dilution factors of monoclonal phage
Absorbance at 405
Figure 23:單株噬菌體對 LA 及 LG 之 dose-respousive 曲線。 篩選具有高抗原專一性的單株噬菌體再度感染到 E.Coli / TG1 以大量複製 此噬菌體,連續稀釋後再利用anti-M13-HRP 進行 ELISA 實驗,即得圖中之 dose-respousive 標定曲線。圖 A 為對 LA 具抗原專一性的單株噬菌體,圖 B 為對LG 具抗原專一性的單株噬菌體。0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 1/10 1/100 1/20 0 1/400 1/800 1/160 0 1/320 0 1/640 0 1/128 00 1/256 00
Dilution factors of expression protein
Absorbance at 405
Figure 24:可溶性單株抗體片段的表現。利用 ELISA 測試表現之單株蛋白片 段與anti-cMyc 單株抗體間的親和性。
具有抗原高專一性之噬菌體株(Fig. 14-A 之 LAA5)感染 E.Coli /HB2151 表 現可以得到single epitope antibody fragment,以 mouse monoclonal antibody against c-Myc 最為 1o Ab 及 peroxidase conjugated goat anti-mouse IgG 為 2o Ab 進行ELISA 實驗,圖中得表現之單株蛋白片段與 anti-cMyc 單株抗體間的親 和性dose-respousive 曲線。
研究成果
2001~2003 年承蒙國科會補助從事檢測牛乳品質的相關性研究,本計畫研究目的共 7 項,其中包含乳蛋白之物理化學分析、單株抗體的製作、抗體晶片之研發及建立乳蛋 白變性指標,研究成果遠超出所提之研究項目,研究成果如下:
(1). 2001 年利用 native-gel、SDS-gel、Western blot 及 circular dichroic spectrum 分析,發 現牛乳中生乳及奶粉中有一主要蛋白(lactoglobulin),經熱處理後在結構上有相當大 的改變,更發現在台灣市售的鮮乳中乳蛋結構嚴重改變,更進一步分析生乳及美國 購得的鮮乳,其乳中蛋白大致相同並未有改變,台灣市售的鮮乳乳中蛋白甚至比還 原乳(由奶粉沖泡的乳)結構改變更嚴重,此結果已在台灣生物醫學年會及美國生物 醫學年會中發表,並準備投稿至Journal of Dairy Science
進一步分析乳中lactoglobulin 經熱處理後結構的改變,研究發現結構隨著加熱 溫度及加熱時間的增加改變越嚴重,結果大約在加熱70℃, 15 秒鐘以上結構開始嚴 重改變。 (2). 2002 年利用 2001 年的研究結果推測還原乳乳蛋白結構上必定與生乳中乳蛋白不 同,因此想利用單株抗體來區分還原乳及生乳,研究結果成功的製作出四株單株抗 體可區分生乳及還原乳,更成功的解決台灣四十年無法處理得奶粉摻雜問題。更有 趣的是此四株單株抗體所辨認的乳蛋白皆為lactoglobulin,此結果與 2001 年用不同 方式分析的結果相符。結果已在台灣生物醫學年會及美國生物醫學年會中發表,並 已被Journal of Dairy Science 所接受於 2004 年八月刊出。
在同年上半年(2002)利用噬菌體表現的重組抗體(phage display),成功的篩選出 會辨認乳中蛋白lactoglobulin 及 lactalbumin 的重組抗體,此結果已在台灣生物醫學 年會中發表。 (3). 2003 年深入研究 lactoglobulin 的功能,結果發現 lactoglobulin 具有抗氧化的效果, 並且已研究出抗氧化的機制是利用蛋白質本身被氧化,保護其他蛋白質不會因氧化 壓力而氧化,此結果已在生化工程年中發表,且預計於 2004 年在生物醫學年會中
發表,並投稿至Journal of Dairy Science。
同時深入研究科區分生乳及還原乳單株抗體所辨認的區段,結果發現利用 trypsin、CNBr 分解及化學修飾 lactoglobulin,再用 Western blot 分析,抗體所辨認 的區段應含有Lys 胺基酸,且在靠近 N 端部位,此結果或許可說明 lactoglobulin 加 熱變性後所呈現新的抗體辨認區(eptope)應靠近 N 端部位。此結果將在 2004 年生物 醫學年會中發表。並投稿至Journal of biological chemistry
2001~2003 年執行牛乳相關計畫所發表之論文期刊
國際及國內會議(international conference)
1. Chen W. L., M. T. Hwang, H. C. Liu, C. W. Li, and S. J. T. Mao, Distinction between dry and raw milk using monoclonal antibodies prepared against dry milk proteins. J Dairy Sci. 2004, 87:2720-2729.
2. Song C. Y, W. L. Chen, M. C. Yang, J. P. Huang, S. J. T. Mao. Epitope mapping of a monoclonal antibody specific to bovine dry milk. Involvement of residues 66-76 of strand D in thermal denatured beta -lactoglobulin. J Biol Chem. 2004 Nov 9; [Epub ahead of print]
3. Chen W.L., C.Y. Liau, and S. J. T. Mao. Analyses of β-Lactoglobulin as a thermal marker in raw and commercially processed milk using native gel electrophoresis, Westernblot, and circular dichroic spectrum. (Accepted by J Dairy Sci. 2005)
4. Liu H. C. and S. J. T. Mao. Effect of disulfide bond for the antioxidant activity of β-Lactoglobulin (2004) (Submitted to J Dairy Sci.)
國際及國內會議(international conference)
1. Chen W. L., S. J. T. Mao. Analyses of β-lactoglobulin as a thermal marker in raw and
commercially processed milk using a native gel electrophoresis and circular dichroic spectrum. Experimental Biology 2002 New Orleans, LA, USA. FASEBJ.16: A1187 2. Chen W. L., S. J. T. Mao. Distinguish between dry and raw milk using monoclonal
antibodies prepared against dry milk proteins: LG is a sensitive thermal marker in dry milk. Experimental Biology 2003 San Diego, USA. FASEB. 17:A1127
3. Chen W. L., M. T. Huang, C. W. Li, H. C. Liu, S. J. T. Mao. (2004) Thermal denaturation of β-lactoglobulin as probed by an monoclonal antibody. Experimental
Biology 2004 Washington, DC, USA. FASEB.18 :A144.
4. Chen W. L., Ho J. C., Hoang K. C., and S. J. T. Mao. Differentiation between fresh and powdered milk using chemical, physical, and immunochemical analyses. The sixteenth
joint annual conference of biomedical sciences. (2001) Programs & abstracts.
5. Liau C. Y., Chen W. L., Wu Y. J., Lin C. C., and S. J. T. Mao. Differentiation of Milk Proteins Using Phage Displayed Antibodies. The Seventeenth Joint Annual
Conference of Biomedical Sciences. (2002) oral presentation.
6. Chen W. L., Huang M. T., Liu H. C., Li C. W., S. J. T. Mao. Production of conformationally
dependent monoclonal antibodies prepared against thermal-denatured milk. The
presentation.
7. Song C. Y., W. L. Chen, S. S. Wang, S. J. T. Mao. (2004) Thermal denaturation of milk β-lactoglobulin. The nineteenth joint annual conference of biomedical sciences.
參考文獻:
1. Hendrix T, Griko YV, Privalov PL. A calorimetric study of the influence of calcium on the stability of bovine alpha-lactalbumin. Biophys. Chem. 2000; 84: 27-34.
2. Vanderheeren G, Hanssens I, Meijberg W, Van Aerschot A. Thermodynamic characterization of the partially unfolded state of Ca(2+)-loaded bovine alpha-lactalbumin: evidence that partial unfolding can precede Ca2+ release. Biochemistry. 1996; 35: 16753-16759.
3. Kulmyrzaev A, Bryant C, McClements DJ. Influence of sucrose on the thermal denaturation, gelation, and emulsion stabilization of whey proteins. J. Agric. Food Chem. 2000; 48: 1593-1597.
4. Relkin P. Thermal unfolding of beta-lactoglobulin, alpha-lactalbumin, and bovine serum albumin. A thermodynamic approach. Crit. Rev. Food Sci. Nutr. 1996; 36: 565-601.
5. Tu CF, Hsieh SL, Lee JM, Yang LL, Sato T, Lee KH, Weng CN, Mao SJT, Tsuji K, Lee CJ. Successful generation of transgenic pigs for human decay-accelerating factor and human leukocyte antigen DQ. Transplantation Proceedings. 2000; 32(5): 913-915.
6. Kondo N, Agata H, Fukutomi O, Nishida T, Kameyama T, Fujii H, Hayashi T, Shinbara M, Yamasaki M, Utsumi M, et al. Reduced responses of peripheral blood lymphocytes to heat-denatured food antigens in food-sensitive atopic dermatitis. Ann. Allergy. 1993; 70: 467-469.
7. Enomoto A, Konishi M, Hachimura S, Kaminogawa S. Milk whey protein fed as a constituent of the diet induced both oral tolerance and a systemic humoral response, while heat-denatured whey protein induced only oral tolerance. Clin. Immunol. Immunopathol. 1993; 66: 136-142. 8. Barrett-Connor E, Chang JC, Edelstein SL. Coffee-associated osteoporosis by daily milk
consumption. The Rancho Bernardo Study. JAMA. 1994; 271: 280-283.
9. Yoshida H, Nagaya T, Hayashi T, Takahashi H, Kawai M. Milk consumption decreases activity of human serum alkaline phosphatase: a cross-sectional study. Metabolism. 1995; 44: 1190-1193.
10. Jeanson S, Dupont D, Grattard N, Rolet-Repecaud O. Characterization of the heat treatment undergone by milk using two inhibition ELISAs for quantification of native and heat denatured alpha-lactalbumin. J. Agric. Food Chem. 1999; 47: 2249-2254.
11. Moneret-Vautrin DA. Modifications of allergenicity linked to food technologies. Allerg. Immunol (Paris). 1998; 30: 9-13.
Food Chem. 2000; 48: 672-679.
13. Griko YV. Denaturation versus unfolding: energetic aspects of residual structure in denatured alpha-lactalbumin. J Protein Chem. 1999; 18: 361-369.
14. Relkin P. Reversibility of heat-induced conformational changes and surface exposed hydrophobic clusters of beta-lactoglobulin: their role in heat-induced sol-gel state transition. Int. J. Biol. Macromol. 1998; 22: 59-66.
15. Hoffmann MA, van Mil PJ. Heat-induced aggregation of beta-lactoglobulin as a function of pH. J Agric Food Chem. 1999; 47: 1898-1905.
16. Recio I, Olieman C. Determination of denatured serum proteins in the casein fraction of heat-treated milk by capillary zone electrophoresis. Electrophoresis. 1996; 17: 1228-1233. 17. Tsonev LI, Hirsh AG. Fluorescence ratio intrinsic basis states analysis: a novel approach to
monitor and analyze protein unfolding by fluorescence. J Biochem Biophys Methods. 2000; 45: 1-21.
18. Mora-Guiterrez A, Farrell HM Jr. Sugar-casein interaction in deuterated solutions of bovine and oxygen-17 and carbon-13 nuclear magnetic resonance: a case of preferential interactions. J Agric Food Chem. 2000; 48: 3245-3255.
19. Mao SJT, Kazmar RE, Silverfield JC, Alley MC, Kluge K, Fathman CG. Immunochemical properties of human low density lipoproteins as explored by monoclonal antibodies. Binding characteristics distinct from those of conventional serum antibodies. Biochem. Biophys. Acta 1982; 713: 365-374.
20. Patton JG, Alley MC, Mao SJT. Evaluation of monoclonal antibodies to human plasma low density lipoproteins. A requirement for lipids to maintain antigenic structure. J. Immunol. Meth. 1983; 55: 193-203.
21. Mao SJT, Patton JG, Badimon JJ, Kottke BA, Alley MC, Cardin AD. Monoclonal antibodies to human plasma low density lipoproteins. I. Enhancement of the binding of 125I-low density lipoproteins by combination of two monoclonal antibodies. Clin. Chem. 1983; 29: 1890-1897.
22. Patton JG, Badimon JJ, and Mao SJT. Monoclonal antibodies to human plasma low density lipoproteins. II. Evaluation of monoclonal antibodies for apolipoprotein B radioimmunoassay in patients with coronary artery disease. Clin. Chem. 1983; 29: 1898-1903.
23. Mao SJT, France DS. Enhancement of limiting dilution in cloning mouse myeloma and spleen hybridomas by human low density lipoproteins. J. Immunol. Meth. 1984; 75: 309-316.
24. Marcovina S, France D, Phillips RA, Mao SJT. Monoclonal antibodies can precipitate low-density lipoprotein I. Characterization and use in determining apolipoprotein B. Clin. Chem. 1985; 31: 1654-1658.
25. Marcovina S, Kottke BA, Mao SJT. Monoclonal antibodies can precipitate low-density lipoprotein II. Radioimmunoassays with single and combined monoclonal antibodies for determining apolipoprotein B in serum of patients with coronary artery disease. Clin. Chem. 1985; 31: 1654-1663.
26. Mao SJT, Rechtin AE, Jackson RL. Monoclonal antibodies that distinguish between active and inactive forms of human post-heparin plasma hepatic triglyceride lipase. J. Lipid Res. 1988; 29: 1023-1029.
27. Mao SJT, Yates MT, Owen TJ, Krstenansky JL. Preparation of antibodies to a synthetic C-terminus of hirudin and identification of an antigenic site. J. Immunol. Methods. 1989; 120: 45-50.
28. Mao SJT, Rechtin AE, Krstenansky JL, Jackson RL. Characterization of a monoclonal antibody specific to the amino terminus of the a-chain of human fibrin. Thrombosis and Homeostasis. 1990; 63: 445-448.
29. Lu J, Sloan SR, An alternating selection strategy for cloning phage display antibodies. J. Immunol. Methods. 1999; 228: 109-119.
30. de Bruin R, Spelt K, Mol J, Koes R, Quattrocchio F. Selection of high-affinity phage antibodies from phage display libraries. Nature Biotechnology. 1999; 17: 397-399.
31. Huls GA. et. al. A Recombinant, fully human monoclonal antibody with antitumor activity constructed from phage-displayed antibody fragments. Nature Biotechnology. 1999; 17: 276-281.
32. Bramanti E, Sortino C, Raspi G, Synovec RE. Separation and determination of denatured caseins by hydrophobic interaction chromatography Part II. Method validation and applications. Analyst. 2001, 126 (7): 995-1000
33. el-Samragy YA, Hansen CL, Mcmahon DJ. Production of ultrafiltered skim milk retentate powder. 1. Composition and physical properties. J. Dairy Science. 1993, 76 (2) 388-92.
34. De Jong, P. Modeling and optimization of thermal processes in the dairy industry. NIZO Verslag, Ede, 1996, V341.
35. Lieske, B. The influence of preliminary treatments on structural properties of casein micelles affecting the rennetability. Le Lait. 1997, 77:201-209.
36. Ruegg, M., Morr, U., and Blanc, B. A calorimetric study of the thermal denaturation of whey protein in simulated milk ultrafiltrate. J. Dairy Res. 1997, 44:509-520.
37. Nagaoka, S., Yu, F., Keiji, M., Takako, A., Kouhei, Y., Yoshihiro, K., Kojima, T., and Tamotsu, K. Identification of novel hypocholesterolemic peptides derived from bovine milk β- lactoglobulin. Biochem. Biophys. Res. Commun. 2001, 281:11-17.
38. Negroni L, Bernard H, Clement G, Chatel JM, Brune P, Frobert Y, Wal JM, Grassi J. Two-site enzyme immunometric assays for determination of native and denatured beta-lactoglobulin. J. Immunol. Methods. 1998; 220: 25-37.
39. Sche PP, McKenzie KM, White JD, Austin DJ. Display cloning: functional identification of natural product receptors using cDNA-phage display. Chemistry & Biology. 1999; 8: 707-116.
40. FitzGerald K. In vitro display technologies-new tools for drug discovery. DDT. 2000; 5: 253-258.
41. Sanchez L, Peiro JM, Oria R, Castillo H, Brock JH, Calvo M. Kinetic parameters for the heat denaturation of bovine lactoferrin in milk, and its effect on interaction with monocytes. Adv. Exp. Med. Biol. 1994; 357: 253-257.
42. Sigman-Grant M, Bush G, Anantheswaran R. Microwave heating of infant formula: a dilemma resolved. Pediatrics. 1992; 90: 412-415.
43. Pointillart A, Coxam V, Seve B, Colin C, Lacroix CH, Gueguen L. Availability of calcium from skim milk, calcium sulfate and calcium carbonate for bone mineralization in pigs. Reprod. Nutr. Dev. 2000; 40: 49-61.
44. Heaney RP, Dowell MS, Rafferty K, Bierman J. Bioavailability of the calcium in fortified soy imitation milk, with some observations on method. Am. J. Clin. Nutr. 2000; 71: 1166-1169. 45. Vegarud GE, Langsrud T, Svenning C. Mineral-binding milk proteins and peptides;
occurrence, biochemical and technological characteristics. Br. J. Nutr. 2000, 84 Suppl 1:S91-98.
46. Wang SH. Yang TS, Lin SM, Tsai MS, Wu SC, Mao SJT. Expression, characterization, and purification of recombinant porcine lactoferrin in Pichia pastoris. Protein Expression and Purification. 2002. ( In Press ).
47. Toba Y, Takada Y, Matsuoka Y, et.al. Milk basic protein promotes bone formation and suppresses bone resorption in healthy adult men. Biosci. Biotechnol. Biochem. 2001, 65 (6) :1353-1357.
48. Rondot S, Koch J, Breitling F, Dubel S. A helper phage to improve single-chain antibody presentation in phage display. Nat. Biotechnol. 2001; 19: 75-78.
49. Frens G. Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions. Nature Phys. Sci. 1973; 241: 20.
50. Chow M. K. and Zukoski C.F. Gold sol formation mechanisms : Role of colloidal stability. Journal of colloid and interface science. 1994, 165: 97-109.
51. Bhaskar S, Singh S, Sharma M. A single-step immunochromatographic test for the detection of Entamoeba histolytica antigen in stool samples. J. Immunol. Methods. 1996; 196: 193-198. 52. Huang Q, Lan X, Tong T, Wu X, Chen M, Feng X, Liu R, Tang Y, Zhu Z. Dot-immunogold
filtration assay as a screening test for syphilis. J. Chin. Microbiol. 1996; 34: 2011-2013. 53. Dykman LA, Bogatyrex VA. Use of the dot-immunogold assay for the rapid diagnosis of
acute enteric infections. FEMS Immunol. Med. Microbiol. 2000; 27: 135-137.
54. Yang SJ, Mao SJT. A simple HPLC purification procedure for porcine plasma haptoglobin. J. Chromatagr. 1999; 731: 395-402.
55. Mao SJT, Sparrow JT, Gilliam EB, Gotto AM, Jackson RL. Mechanism of lipid-protein interaction in the plasma lipoproteins. Biochemistry. 1977; 16: 4150-4156.
56. Mao SJT, Downing MR, Kottke BA. Physical, chemical, and immunochemical studies of apolipoprotein A-I from pigeon plasma high density lipoproteins. Biochem. Biophys. Acta. 1980; 620: 100-110.
57. Mao SJT, Yates MT, Owen TJ, Krstenansky JL. Interaction of hirudin with thrombin: Identification of a minimal binding domain that inhibits clotting activity. Biochemistry. 1988, 27: 8170-8173.
58. Chen L, Mao SJT, McLean L, Powers RW, Larsen WJ. Mechanism of stabilization of cumulus extracellular matrix: Evidence of direct interaction of ESF and hyaluronic acid. J. Biol. Chem. 1994; 269: 8282-8287.