合成不同形貌之銀奈米催化劑於氧氣還原反
應之應用
研究生:陳致源
指導教授:林鵬 博士
吳樸偉 博士
國立交通大學 材料科學與工程研究所碩士班中文摘要
發展非鉑系觸媒催化氧氣還原反應之研究對於燃料電池普 及化與便利化具有極重大的影響,其中銀系催化劑在成本上可以 有效地降低,且在催化活性上也有優異的表現,另外,銀系催化 劑的活性與其形貌有明顯的關係,因此,有效控制不同形貌的奈 米銀可以有效提升其氧氣還原的反應。本研究分為三個主軸進行, 首先,接續實驗室之前的研究,在立方體結構上進行形貌的改變, 合成出具有較優異的氧氣還原反應的反應面;另一方面,合成不 同深寬比的棒狀奈米銀結構探討形狀上對於催化氧氣還原反應 之影響;最後一部分合成不同碳厚度的截角立方體奈米銀(Ag@C) 結構,分別探討碳包覆銀對於催化氧氣還原反應之影響。II 首先截角立方體奈米銀觸媒部分,利用水熱法合成。由 TEM 結果確認藉由控制界面活性劑與還原劑的濃度可以有效改變不 同成長面的成長速度。由 XRD 分析探討截角立方體奈米銀的繞 射峰值有明顯的改變。經由電化學分析,截角立方體之奈米銀結 構對於催化氧氣還原反應具有優於立方體之效果,且進一步進行 截角立方銀奈米顆粒尺寸對於氧氣還原反應的探討,。 在不同深寬比的奈米銀觸媒部分則利用添加鐵離子來控制 晶種,藉由改變鐵離子濃度合成不同深寬比的奈米銀結構。經由 TEM 圖譜確認合成不同深寬比的奈米銀。由 XRD 分析探討不同 深寬比的奈米銀皆為 fcc 結構。最後藉由電化學分析得知,不同 深寬比的奈米銀有不同的電化學活性,以最大的深寬比其電化學 活性最佳。 最後,Ag@C 的部分,利用第二階段的升溫的方法合成。由 TEM 結果確認不同碳化時間可以控制碳膜的厚度,且在碳化時間 過長時會導致結構的團聚現象。由 XRD 分析證實,在高溫處理 過後所合成的銀依舊為 fcc 結構。最後進行電化學的分析,可以 得知在不同碳膜下電化學有不同的活性,當碳膜太厚時,導致電 子傳導上不易降低了電化學活性,找到最佳的碳膜厚度可以有效 穩定進行電化學反應下的銀奈米結構。
Controlled Synthesis of Silver Nanoparticles
Electrocatalyst for Oxygen Reduction
Reaction in Alkaline Electrolyte
Student:Chih-Yuan Chen Advisor: Dr. Pang Lin Dr. Pu-Wei Wu Department of Materials Science and Engineering
National Chiao Tung University
Abstract
Non-platinum based electrochemical active materials were developed to catalyze the oxygen reduction reaction (ORR) in an alkaline electrolyte. Many research indicated that the silver has demonstrate excellent ability for ORR. In addition, the morphology of silver affected its ability greatly. For this reason, it is our objective to control the morphology of silver particles to promote ORR ability. First, we followed the self-established synthesis condition to fabricate silver cubes and truncated cubes to increase the specific facets with better catalysis for ORR. Second, silver nanorods in various aspect ratios were synthesized and the ORR analysis was carried out. Finally, to increase the stability of silver for ORR, Ag@C was synthesized to stabilize the structure of silver.
In the synthesis for truncated cubes, we employed a hydrothermal method to form the desirable morphology. From the
IV
TEM images, we confirmed that an effective control for the concentration of surfactant and reducing agent could change the growth rate of at different faces. From the XRD, it revealed that the ratio of (111) to (200) has changed notably. Finally, we determine that the morphology with better performance is truncated cube instead of regular cube for ORR. As expected, the silver nanoparticles with different sizes have different electro-catalytic activities for ORR.
In the second part, silver nanorods were synthesized by adding different concentrations of iron ions to control silver seed. From TEM images, they confirmed that different aspect ratios of silver nanorods were synthesized successfully. We determined that the structure of silver nanorod was fcc from XRD. The potentiodynamic test demonstrated that the ORR was improved by increasing the aspect ratio of silver nanorods.
Carbon-decorated silver truncated cubes with a core-shell structure were formed by a two-stage hydrothermal synthesis. From TEM images, they confirmed that the thickness of carbon shell was effectively controlled depending on processing time. From XRD, the structure was still fcc. Finally, the Ag@C structure was prepared in optimized parameter, revealing outstanding performances for ORR.
致謝
兩年的研究生生活就在轉眼間過去了,回顧這 700 多天的日 子,受到了許多人的幫助與指導,使自己可以平安順遂的碩士班 畢業,首先要感謝兩位指導教授:林鵬教授、吳樸偉教授,在這 兩年的研究生活中給予無私的指導與幫助,讓我體會到正確的學 習態度與培養邏輯思考能力,讓我受益良多,因為您們對我的耐 心教導,才可以讓平時鮮少訓練機會的我一天天地茁壯,在此真 心地感謝您們。感謝我的父母、家人給予我經濟與心靈上的支持, 讓我無後顧之憂的進行研究,在研究的路上有你們給予我的精神 支持,真的很感謝您們。感謝張雲閔學長在實驗上給予的建議與 討論,以及不厭其煩的 TEM 儀器觀測;謝育淇學長在電化學問 題上耐心的討論;陳境妤學姐 XRD 儀器的全力幫忙;張玉塵學 長在電化學基材的碳布提供;以及黃昆平學長、高嘉駿學長、林 勝結學長、謝逸凡學長、葉耕余學長、張瀠方學姊、梁茹夢學姊 以及李佳勳學長,謝謝你們這兩年的幫助與陪伴,讓這兩年的碩 士班研究可以平安順利的完成。也要感謝陪伴我度過這兩年研究 生涯的同伴:張詠策、張立忠、邱于凡、王儷曄、陳儷尹同學們, 在這兩年與你們一同努力、一同生活,要跟你們說一聲:「認識 你們真好」。另外還有各位學弟妹,謝謝你們忍受我壓力大下無VI 理取鬧的要求,也謝謝你們的努力與幫忙。此外,還要特別感謝 前來口試的口試委員,李積琛教授願意前來指導學生,讓論文內 容更為周全完整。 受到太多人的幫助,要感謝的人也太多了,誠摯的向大家說 聲謝謝,因為有大家的存在與幫助讓我可以順利度過碩士班生涯, 讓我有足夠的勇氣面臨人生下一個階段的考驗,只能再次說聲謝 謝,有你們真好。
目錄
中文摘要
Ⅰ英文摘要
Ⅲ致謝
Ⅴ主目錄
Ⅶ圖目錄
XI表目錄
XV第一章
前言
1 1-1 研究背景 1 1-2 研究動機 2第二章
文獻回顧
4 2-1.燃料電池 4 2-1.1 燃料電池簡介 4 2-1.2 燃料電池分類 5 2-1.3 鹼性燃料電池簡介 8 2-1.4 鹼性燃料電池工作原理 9 2-2.電極動力學 12 2-2.1 電池極化反應現象介紹 12VIII 2-2.2 氧氣還原反應 13 2-2.3 氫氣氧化反應 18 2-3 奈米結構銀合成 19 2-3.1 光還原法 (photoreduction) 20 2-3.2 Polyol process 合成 22 2-3.3 晶種還原法 (seed-mediated growth) 24 2-3.4 水熱法 (hydrothermal) 26
第三章
實驗方法與流程
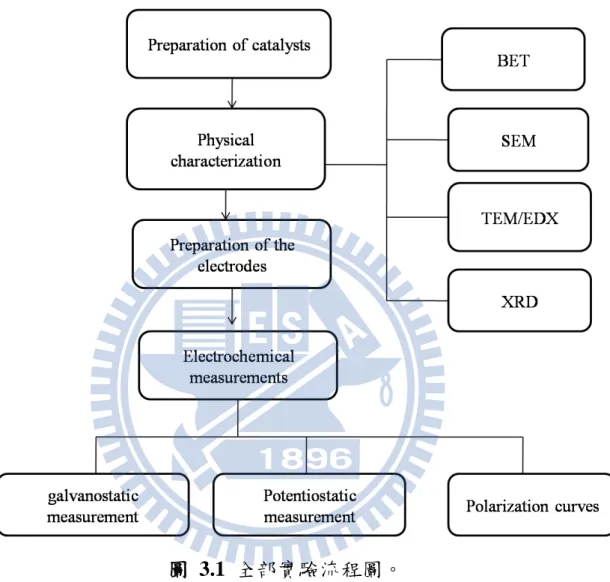
29 3-1 實驗藥品與設備 29 3-1.1 實驗藥品與氣體 29 3-1.2 實驗設備 29 3-2 實驗流程 31 3-2.1 總實驗流程 31 3-2.2 截角立方體奈米銀合成 32 3-2.3 棒狀奈米銀合成 33 3-2.4 六角狀奈米銀合成 34 3-2.核殼結構碳-奈米銀合成 35 3-3 催化劑合成 35 3-3.1 截角立方體奈米銀顆粒的合成 353-3.2 棒狀奈米銀顆粒的合成 37 3-3.3 六角狀奈米銀顆粒的合成 38 3-3.4 核殼結構(奈米銀-碳)的合成 39 3-4 分析儀器 40 3-4.1 定性分析 40 3-4.2 電化學分析 42
第四章
結果與討論
45 4-1 不同大小之截角立方體銀奈米顆粒對氧氣還 原反應之電催化活性探討 45 4-1.1 截角立方體奈米銀結構之物理性質分析 46 4-1.1.1 TEM 觀測 46 4-1.1.2 SEM 觀察 54 4-1.1.3 紫外光-可見光吸收光譜 (UV-VIS)分析 56 4-1.1.4XRD 分析 58 4-1.1.5 HRTEM 分析與 SEM 成分分析 59 4-1.2 電化學分析 61 4-2 棒狀及六角狀銀奈米顆粒對氧氣還原反應 之電催化活性探討 67X 4-2.1 線狀及六角狀奈米銀結構之物理性質分
析 68 4-2.1.1 TEM 觀測 68 4-2.1.2 紫外光-可見光吸收光譜 73 4-2.1.3 棒狀及六角狀 XRD 分析 74 4-2.2 棒狀奈米銀對於氧氣還原的電化學 75 4-3 核殼結構(奈米銀-碳)對於氧氣還原電催化活性探討 76 4-3.1 核殼結構之物理性質分析 76 4-3.1.1 TEM 觀測 76 4-3.1.2 紫外光-可見光吸收光譜 80 4-3.1.3 XRD 分析 81 4-3.2 電化學分析 82
第五章
結論
84第六章
參考文獻
86圖目錄
圖 2.1 各種燃料電池簡易示意圖 6 圖 2.2 鹼性燃料電池之示意圖 9 圖 2.3 模電極組 (MEA)示意圖 10 圖 2.4 電池放電極化曲線之示意圖 13 圖 2.5 氧氣還原反應機制示意圖 15 圖 2.6 模擬氧氣吸附在催化劑表面產生還原反應可能進 行的反應路徑 16 圖 2.7 Pauling model 氧氣還原反應機制 17 圖 2.8 Bridge model 氧氣還原反應機制 18 圖 2.9 光還原金屬機制示意圖 21 圖 2.10 40W 螢光下照射不同時間之 TEM 圖 21 圖 2.11 不同硝酸銀濃度於 30W 汞燈還原之 TEM 圖譜 22 圖 2.12 polyol process 方法合成不同形狀的奈米銀結構 24 圖 2.13 晶種成長法之示意圖 25 圖 2.14 晶種成長法棒狀結構成長示意圖 25 圖 2.15不同合成條件下利用晶種成長法合成銀奈米棒之 TEM圖譜 26XII 圖 2.16 不同合成條件下利用水熱法合成不同形狀結構奈 米銀 28 圖 3.1 全部實驗流程圖 31 圖 3.2 截角立方體奈米銀合成 32 圖 3.3 棒狀奈米銀合成 33 圖 3.4 六角狀奈米銀合成 34 圖 3.5 核殼結構(奈米銀-碳)合成 35 圖 3.6 電化學裝置 43 圖 3.7 電化學裝置 44 圖 4.1 CTAB 2 mM TEM 圖 48 圖 4.2 CTAB 3 mM TEM 圖 48 圖 4.3 CTAB 8.3 mM TEM 圖 49 圖 4.4 CTAB 10 mM TEM 圖 49 圖 4.5 CTAB 12 mM TEM 圖 50 圖 4.6 0.28 mM glucose TEM 圖 52 圖 4.7 0.98 mM glucose TEM 圖 52 圖 4.8 4.2 mM glucose TEM 圖 53 圖 4.9 立方體 之 SEM 圖 54 圖 4.10 截角立方體之 SEM 圖 55
圖 4.11 立方體與截角立方體之紫外光-可見光吸收光 譜(UV-VIS) 58 圖 4.12 截角立方體與立方體的 XRD 59 圖 4.13 截角立方體奈米銀之 HRTEM 圖譜、SAED 分 析與 EDX 成分分析 61 圖 4.14 截角立方體與立方體陰極極化曲線比較圖 64 圖 4.15 電化學測試後之 TEM 圖 64 圖 4.16 不同大小銀顆粒陰極極化曲線比較圖 65 圖 4.17 定電壓放電測試 66 圖 4.18125 nm 棒狀奈米銀之 TEM 69 圖 4.19 250 nm 棒狀奈米銀之 TEM 70 圖 4.20 600 nm 棒狀奈米銀之 TEM 70 圖 4.21 0.03 mM 銅離子 TEM 72 圖 4.22 0.3 mM 銅離子 TEM 72 圖 4.23 0.5 mM 銅離子 TEM 73 圖 4.24 棒狀及六角狀奈米銀之紫外光-可見光吸收光 譜(UV-VIS) 74 圖 4.25 棒狀及六角狀之 XRD 75 圖 4.26 不同深寬比奈米銀陰極極化曲線圖 76
XIV 78 78 79 79 81 82 83 圖 4.27 碳化反應時間兩小時 TEM 圖 圖 4.28 碳化反應時間四小時 TEM 圖 圖 4.29 碳化反應時間六小時 TEM 圖 圖 4.30 碳化反應時間八小時 TEM 圖 圖 4.31 Ag@C 紫外光-可見光吸收光譜(UV-VIS) 圖 4.32 不同碳化時間之 XRD 圖 4.33 不同碳化時間之陰極極化曲線比較圖
表目錄
表 4.1 界面活性劑對奈米銀結構的影響 50 表 4.2 還原劑對奈米銀顆粒結構的影響 53 表 4.3 定電壓與極化曲線下的電流值比較 67 表 4.4 不同碳化時間得結果 801
第一章 前言
1-1 研究背景
人們享受著生活上的便利性,不管是每天帶給我們方便的電 器商品,或是交通運輸,甚至到食衣住行上都可以說是來自不同 形式的能源消耗。而石油可說是最為人類廣泛使用的能源,於二 十世紀初開始,急速晉升成為主要的能源供給,目前已成為現今 支配全球能源使用中最重要的來源。近年來全球研究顯示出地球 所蘊藏的石油有朝一日終究會消耗殆盡,且國際原油價格持續的 攀升,使得石油短缺的議題已逐漸浮上檯面,因此尋找替代能源 已成為目前科學家研究之主流。 此外,人類大量使用石油的情況下,大量的二氧化碳也伴隨 而來,其產生的一連串效應對地球的自然環境產生極大的影響, 如溫室效應、地球氣候異常改變,最後造成全球暖化、兩極冰川 融化,導致海平面上升,導致許多物種瀕臨滅絕。 因此,替代能源與再生能源的發展,以及二氧化碳的減量, 已成為各國政府與科學家研究之主軸。 替代能源的主要考量點為低二氧化碳排放、低成本、低汙 染以及能源轉換效率高。目前替代能源的研究中又以燃料電池、 太陽能電池、風力發電等研究最受科學家們高度重視。然而燃料電池的來源為氫氣,其是為零污染環境的燃料,藉由陽極產生氫 氣的氧化反應和陰極產生氧氣的還原化學反應提供電能,而且燃 料電池不受卡諾循環的限制,使其成為目前替代能源中極具發展 潛力的新世代替代能源。 燃料電池發展至今已一個世紀的歷史,但是由於價格昂貴、 能源轉換率低等因素限制其發展。直到美國太空總署阿波羅登月 計畫中使用鹼性燃料電池發電才又引起世人的目光。但是其價格 居高不下,降低價格是目前最為注意的地方,因此,利用鹼性燃 料電池系統中,其催化劑受腐蝕的程度較低,可使用非鉑系觸媒 來替代,使得成本可以有效的降低。 本篇研究藉探討非鉑系觸媒應用於鹼性燃料電池系統中陰 極氧氣還原反應。
1-2 研究動機
燃料電池之電解液主要分為鹼性環境與酸性環境兩種,由於 氧氣還原反應速率於鹼性環境中較酸性環境迅速,且電解液鹼性 時,金屬的腐蝕速度相較於酸性溶液下大幅降低,使得鹼性電池 為目前燃料電池系統中能源轉換效率最高的 (55-60%)。因此, 可以使用非鉑系催化劑來取代高價的貴重金屬催化劑,例如以銀、 鎳、鈣鈦礦氧化物、氧化鈷錳等催化劑取代白金觸媒,不但有效3 地達到反應速率,並可以達到降低成本的目的。 本篇研究為發展非鉑系觸媒應用於鹼性燃料電池系統中氧 氣還原反應之研究,然而文獻中已有大量報導銀系觸媒在鹼性燃 料系統中對氧氣還原反應之影響,當中指出銀系觸媒在氧氣還原 反應中有不錯的催化活性,且相較於高價的貴重金屬(例:鉑)其 成本較低。而此研究的目的在於合成不同形狀的奈米銀顆粒其在 鹼性電解液中對於氧氣還原反應的影響。文獻中指出不同的奈米 結構對於不同的應用上有其獨特的特性,例如在電學、光學、生 物標記、催化特性方面等,其中較少提到不同奈米結構的銀對於 氧氣還原反應上的影響,因此本篇研究發展合成出不同的奈米形 狀的銀顆粒催化劑,應用於鹼性燃料電池中的氧氣還原反應的應 用,進一步探討銀奈米結構的催化活性的影響,並進一步與文獻 中大量提到過氧氣還原反應有相當優異效果的鈷金屬做比較。
第二章 文獻回顧
2-1 燃料電池
2-1.1 燃料電池簡介 近年來由於人類大量的消耗石化燃料,將造成石油不足所帶 來的能源危機,且其生產及消耗時所排放的汙染物,使得自然環 境失去平衡,危及人類的永續發展,因此,減低石化燃料的使用 及積極開發再生能源已變成人類目前最為關心的研究目標,當中, 燃料電池的研發特為重視,其原理簡單且不受到環境的影響。燃 料電池具有以下的優點: 1. 能源供應裝置安定:燃料電池只要保持穩定的燃料供給並可 以提供電力,且其轉動構件少,另系統更加安全可靠。 2. 能源使用效率高:燃料電池為單純的單一能量轉換,化學能直 接轉換成電能,由氫與氧產生化學反應產生電流,可以擁有 35%的轉換效率。 3. 低排放污染:燃料電池的反應物為氫與氧,產物為水,在環境 中為低排放污染的裝置。 4. 低噪音發電系統:燃料電池反應時並無太大的聲音,可提供安 靜的工作環境。 燃料電池為一種電化學裝置,直接將燃料做化學性的轉換產5 生電能,化學反應中藉由電荷的轉移,電子與離子可藉由不同的 途徑完成電荷的轉移產生電力,其存在極高的能源轉換效率。現 今主要的燃料為氫氣、甲醇、乙醇、天然氣或是其他碳氫化合物, 氧化劑為空氣中的氧氣,主要副產物為熱、純水、極少量的二氧 化碳,見低污染的特性,對於各國重視環保與替代能源開發的研 究來看,燃料電池的開發有其發展的價值。就目前燃料電池所面 臨的瓶頸是在於電池性能的提升、替代貴金屬催化劑的研究開發、 低成本量產的技術及周邊系統的建立。 早期燃料電池可應用於昂貴的研究計畫,例如:太空總署的燃 料電池系統執行太空計劃,現今要將燃料電池普及化及便利化, 主要改善為降低成本及其供電效率足以提供生活上的用電 2-1.2 燃料電池分類 燃料電池的應用依據其操作溫度範圍來決定,區分為高溫型 燃料電池、中溫型燃料電池及低溫型燃料電池。若結合電解液的 選用、操作溫度的範圍及反應物的選用,可進一步分類為鹼性燃 料電池(AFC),固態氧化物燃料電池(SOFC),熔融碳酸鹽燃料電 池 (MCFC) , 磷 酸 燃 料 電 池 (PAFC) , 質 子 交 換 薄 膜 燃 料 電 池 (PEMFC)等五種如圖 2.1 [1]。
圖 2.1 各種燃料電池簡易示意圖 [1]。 A. 鹼性燃料電池(AFC): 鹼性燃料電池陰、陽極分別為氫氣、氧氣氣體擴散電極,其 電解質為氫氧化鉀鹼性溶液。其電極反應式: anode:2 H2+ 4 OH- → 4 H2O+ 4e -cathode:O2+ 4e-+ H2O → 4 OH -操作溫度約為 70℃,屬於低溫型燃料電池。 B. 固態氧化物燃料電池(SOFC): 為高溫型燃料電池,以氧化釔、氧化鋯固體氧化物為電解質, 因氧化物須於高溫下才有足夠的氧離子傳導性,所以操作溫度約 為 500℃~1200℃。陽極部分為鎳與陶瓷的混和材料(Ni-YSZ: nickel- Yttria-stabilized zirconia);陰極部分目前最廣為使用之觸媒
7 為 LaMnO4。 anode:2O2- +2H2→2H2O +4e- cathode:O2 + 4e- → 2O-2 C. 熔融碳酸鹽碳酸鹽燃料電池 (MCFC): 利用碳酸鉀、碳酸鋰等兩種以上碳酸鹽類混合物作為電解質, 當溫度約為 650℃時,會熔融成液體狀態,產生碳酸根離子,從 陰極流向陽極,與氫結合生成水、二氧化碳和電子。 anode:H2+ 2 CO32-+ CO → 3 CO2+ H2O + 4e -cathode:4e-+ 2 CO2 + O2 → 2 CO3 2-D. 磷酸燃料電池(PAFC) 利用多孔碳化矽和聚四氟乙烯製備微孔結構隔膜,以液態 H3PO4 電解液,故長期運轉下會有腐蝕與電解液漏液的問題,其 操作溫度為 150℃~200℃,屬於中溫型燃料電池。其電極是使用 白金作為電催化反應觸媒,不但價格昂貴,而且容易與出現在燃 料中的一氧化碳反應而發生中毒現象,導致發電性能衰退 E. 質子交換薄膜燃料電池(PEMFC) 又稱為固態聚合物電解質燃料電池,其電解質為質子交換膜。 以質子交換膜研究來說,目前主要突破為杜邦(Dupont)公司發展 出的 Nafion 薄膜,主要是以四氟乙烯為基礎構造。此燃料電池為
低溫型燃料電池,其操作溫度約 85~105℃。此燃料電池兩電極皆 為多孔性的氣體擴散電極,確保氣體可以充分的供應到觸媒層已 產生反應 [2]。 2-1.3 鹼性燃料電池簡介 鹼性燃料電池相對於其他燃料電池,鹼性燃料電池的能量轉 化效率較高,高達 55%~60%,主要是因為在鹼性電解質中氧氣還 原反應速度較酸性電解質高,因此,在酸性條件下會被腐蝕的非 鉑系觸媒,在鹼性燃料電池中,即可以使用,並進一步可以取代 成本極高的鉑金屬,例如: 雷尼鎳、銀、環狀非貴金屬錯合物等。 燃料電池是以電解質性質而定,以氫氧化鉀為電解質的即為鹼性 燃料電池,電解質若以傳導氫氣離子的高分子模,稱為鹼性燃料 電池(AMFC)。圖 2.2 為鹼性燃料電池之示意圖。 鹼性燃料電池相較其他電池優於其操作溫度並不高,為低溫 型的燃料電池,且轉換效率好,觸媒的使用選擇上多價格便宜, 但是若是使用空氣當作氧化劑,空氣中的二氧化碳會導致電解質 酸化,導致發電的效果降低,因此移除空氣中的二氧化碳為重要 的研究方向,也因此產生了操作的複雜度與成本的上升、操作中 必須將電化學反應所生成的水及時排掉以防止電解質的酸化的 兩個問題,成為各國燃料電池的研究無法成為主要開發的原因,
9 因此改善以上缺點才可以令燃料電池的研究發展下去,盡可能由 昂貴的太空計劃中移至商業上的使用。 圖 2.2 鹼性燃料電池之示意圖 [3]。 2-1.4 鹼性燃料電池工作原理 燃料電池基本上是由三個基本組建構而成:陽極 (anode)、 陰極 (cathode)、以及兩電極之間電解質 (electrolyte),通常由氫 氣為燃料、氧氣為氧化劑。燃料與氧化劑不可混合,而是分開進 入燃料電池系統中,個別在電池的陽極及陰極產生反應。燃料(氫 氣)經電化學反應後產生電子,電子經由電極(陽極)及電池外線路 流向另一電極(陰極)與氧化劑(氧氣)反應,氧化劑接受電子後產生 反應,生成水,產生的離子經由電解質傳導,形成電池運轉的迴
路。而燃料電池是由這樣的基本組件串連組成較大功率的電極組, 燃料電池基本構造模電極組 (Membrane Electrode Assembly; MEA)如圖 2.3 所示。 圖 2.3 模電極組 (MEA)示意圖 [4]。 膜電極組主要分為五層結構,最外兩層為陽、陰極的擴散層, 擴散層旁為陰、陽極觸媒層,中間則為電解質的隔膜,分隔不同 電解質互相接觸。 A. 氣體擴散層:使氣體均勻分布擴散進入催化層,避免氣體濃 度不一導致電化學反應性不一致,並添加疏水性材料以防止電解 液漏液。氣體擴散層的疏水化處理,通常添加不親水的物質:四氟 乙烯 (PTFE),由於四氟乙烯不親水性質,所以電極模組的水氣 不會凝聚於此,避免水氣阻礙氣體擴散,此外,四氟乙烯的化學
11 性質穩定,不會因電位操作改變其結構與性質,可以利用其具有 黏著的特性,來當作接合劑。由於電化學反應所需的電子需由氣 體擴散層傳遞,故其必須能傳導電子且導電性好,但是四氟乙烯 導電性不佳,所以其所添加比例須謹慎控制,一般氣體擴散層材 料為碳布或碳紙,兩者須經高溫石墨化,使其具有導電性並增加 抗蝕性,因此,多添加此高導電度的碳粉來增加導電度,改善四 氟乙烯導電性不佳的缺點,來提高電池效能。 B. 觸媒層:電化學反應皆在觸媒的表面上產生,而觸媒表面必 須與電解質接觸,因此電化學反應是在界面中發生,故不能添加 太多的疏水層材料導致觸媒無法與電解質接觸。而反應所需的氫 離子皆由電解質傳遞,所以如果觸媒與電解質接觸不良,將不利 反應的進行。觸媒層夾在高分子膜與氣體擴散層之間,其製造方 法是先將適量的觸媒與高分子膜的溶液均勻混合,將其塗在氣體 擴散層上。 C. 隔離膜:其作用為避免陰陽極直接接觸而短路,並同時傳導 離子,所以厚度必須越小越好,才可以達到最大效率的傳導 效果。 在燃料電池電化學反應發生時,陰極相對於陽極有較大的電 流及電壓損失,因此,陰極電極的優劣扮演極重要的角色,所以
一般選擇具有高的比表面積、高孔隙度且能提供穩定的氣液固三 相反應介面作為陰極電極。電極反應步驟為:氣體的溶解→擴散 →吸附→電化學反應→反應物脫離進入溶液。
2-2 電極動力學
2-2.1 電池極化反應現象介紹 當有電流通過電極時,其電極電動勢偏離平衡值的現象稱極 化現象。在理想狀態下,燃料電池應具備很高的發電效率,但實 際上卻只有 30~60%之間,造成效率降低的主要原因是來自於電 極反應所產生的過電位 (overpotential)或極化 (polarization)現象。 理想電極反應為一平衡狀態,但過電位存在時,會產生不可逆的 電位,導致能量損失 [5]。 燃料電池發電過程中常伴隨著下列幾種極化現象如圖:A. 活性極化 (Activation polarization;ηactivation):電極反應過程中
所產生的阻力。由於牽涉到反應物電荷轉移過程的限制,造 成電荷轉移困難,又稱電化學極化。
B. 歐姆極化 (Ohmic polarization;ηohmic):電解質或是電極的內
電 阻 使 得 電 解 液 與 電 極 界 面 所 產 生 的 電 位 降 (Potential drop)。
13 生的濃度梯度導致的電位降,或稱擴散極化。 由上述可知,總電極反應所產生的損失,因此實際所產生的 能量必須減去所損失的能量 [6]。 ion concentrat ohmic activation loss E =η +η +η loss ideal actual E E E = − 圖 2.4 電池放電極化曲線之示意圖 [7]。
2-2.2 氧氣還原反應 (Oxygen Reduction Reaction;ORR)
燃料電池的陰極部分為氧氣還原反應 (ORR),該過程的反應 可以分為兩種反應途徑:四電子直接還原途徑 (direct 4-electron pathway)及氧氣先還原得兩個電子成為雙氧水之後再進一步還原 成水的過氧化物二電子還原途徑 (peroxide pathway) [8]。
四電子直接還原途徑 (direct 4-electron pathway): A. 酸性條件下:
O2 + 4H + + 4e-→ 2H2O E0=1.229 V vs. NHE B. 鹼性條件下: O2 + 2H2O + 4e -→4OH E0=0.401 V vs. NHE 二電子還原途徑 (peroxide pathway): A. 酸性條件下: O2 + 2H + + 2e- → H2O2 E0=0.670 V vs. NHE 過氧化氫再發生還原或是分解 H2O2 + 2H + + 2e- → 2H2O E0=1.770 V vs. NHE 2H2O2→ 2H2O + O2 B. 鹼性條件下: O2 + H2O +2e - →HO 2 + OH- E0= -0.065 V vs. NHE 過氧化氫再發生還原或是分解 HO2 + 2H2O + 2e - → 3OH E0=0.867 V vs. NHE 2HO2 2OH- + O2
氧氣還原反應中直接 4-電子路徑 (direct 4-electron pathway) 通常伴隨著許多步驟,其還原步驟中可能伴隨著吸附在催化劑上 的過氧化氫中間產物 (peroxide intermediate),但是這些中間產物 並不會在水溶液中發現;而相反的二電子 (peroxide pathway)路徑 則會脫附過氧化氫分子在水溶液中,因此可利用旋轉電極法來判 別反應中是否有雙氧水等中間產物生成[9],環電極(ring electrode) 用來監測過氧化氫離子是否於圓盤電極(disk electrode)上產生,此 方法常用來判定氧氣還原反應的路徑 [10-12]。而實際上電極表 面的氧氣還原所進行的反應機構十分複雜,隨著電池材料與催化
15
劑材料的不同,反應特性也可能不同,也隨著電解質 pH 環境相 異而有不同的機制,氧氣在電極表面所牽涉的反應機制如圖 2.5
圖 2.5 氧氣還原反應機制示意圖 [13]。 大致上可以分為五個步驟:
1. 氧氣從空氣中氣體擴散層(gas diffusion layer,以下簡稱 GDE) 外部擴散至 GDE 的表面。 2. 氧氣由 GDE 的外部進入到 GDE 的內部氣體擴散孔洞間擴散 吸附至與電解質交會的三相反應區。 3. 或者氧氣擴散吸附至 GDE 中的活性觸媒物質表面與電解質 交會的界面上。 4. 吸附的反應物氧氣進行電荷轉移步驟(charge transfer),接受電 子進行還原反應生成 OH-或是 OH 2-。 5. 生成物(OH-或是 OH2-)進行更進一步的還原或分解的反應後
擴散通過電雙層進入電解質中。 Yeager 總結文獻提出三種模式,模擬氧氣吸附在催化劑表面 產生還原反應可能進行的反應路徑,如圖 2.6 所示: 圖2.6 模擬氧氣吸附在催化劑表面產生還原反應可能進行的反應路 徑 [13]。 a) Griffiths model:氧氣分子的π 軌域和催化劑的空 dz2軌域互相 產生影響。若催化劑和氧氣分子間吸附鍵結越強,則造成 O-O 鍵長變長,O-O 鍵結變弱,可能導致 O-O 斷鍵。為圖 2.6 中 pathwayⅠ。
b) Pauling model:氧氣分子吸附在催化劑表面上,以 end-on 的 形式出現,部分的電子轉移產生過氧化物的中間產物。在此
17 模式下產物為水的為 4-電子反應;產物為過氧化氫的為 2-電 子反應。為圖 2.6 中 pathwayⅡ。Evans、Tseung 和 Bevan 提 出氧分子有可能會吸收熱能而分解為氧原子,氧分子會先偽 分離 (pseudo-splitting)形成氧原子,並吸附在電極表面上:而 後在 kink site 的氧原子和水分子進行還原反應。如圖 2.7 所示 圖 2.7 Pauling model氧氣還原反應機制 [13]。
c) Bridge model:為圖 2.6 中 pathwayⅢ。Goldstein 和 Tseung 表 示兩個氧原子都化學吸附在催化劑表面上,以 side-on 的形式
出現。由於在鹼性電解液中,催化劑表面會吸附很多 OH-離
子,氧分子通過擴散層吸附在電極表面上且從外界電路進行 部分電子轉移,以單鍵鍵結成 O-O (Bridge model),O-O 會和
鄰近的 OH-交換氫離子形成氫鍵,若在電極表面上有晶格缺
陷或不純物產生易形成 kink site (高催化位),而在 kink site 的
OH-則容易和鄰近的水分子形成氫鍵,電子傳遞而將 O-O 鍵
和水分子打斷,最後則會打斷 OH-鍵並在電極表面上重新排
列。如圖 2.8 所示。
圖 2.8 Bridge model氧氣還原反應機制 [13]。
2-2.3 氫氣氧化反應 (Hydrogen Oxidation Reaction;HOR)
在燃料電池的陽極部分為氫氣氧化反應 (HOR),氫氣為燃料, 由氣體擴散層擴散到觸媒與電解質交會的表面,產生氧化反應, 生成電子與質子 (proton)。其反應式為: H2 + 2H2O → 2H3O + + 2e- 電子由電極引導到外電路,產生電流;質子則藉由電解液傳
19 導到陰極。 在電化學反應發生時,陰極部分的氧氣還原反應相對於陽極 有較大的電流與電壓的損失,因此陰極電極的優劣扮演極重要的 角色,而氧氣還原反應中電子轉移步驟為速率決定步驟,如何找 出加速其反應的催化劑一直是目前大家致力研究的目標,目前氧 氣還原反應的催化劑大致可分為金屬 (例如:Pt [14],Ag [15-19] 等)、混和金屬合金 (例如:Pt-Ni,Pt-Pd 等)、金屬氧化物 (metal
oxides),例如 RuO2 [20-21]、MnO2、CoO,等等),鈣鈦礦化合物
perovskites (LaCoO3、 La0.6Ca0.4CoO3 [22-25]) , 尖 晶 石 化 合 物
spinels(NixAl1-xMn2O4、Ni2Co2O4、Mn3xCo3-3xO4),以及金屬螯合
物型催化劑 pyrolyzed N-4 chelate compound (CoTMPP)。而其中貴 重金屬催化劑多半屬於四個電子轉移的直接還原反應,如 Pt、Pd、 Ag 等等。而過渡金屬氧化物與一般的碳材多屬於二電子的雙氧 水間接反應,如石墨、碳黑、二氧化錳、氧化鈷,另外包括金屬 螯合物催化劑。由於氧氣還原反應相較於陽極有較大的電流電壓、 損失,目前許多科學家投入大量時間、新血研究,尋找高效能的 催化劑已達改善燃料電池效能,更進一步將燃料電池實用化。
2-3 奈米結構銀合成
燃料電池分為陽極氧化及陰極還原的反應,陰極還原反應中,面臨催化劑的使用問題。目前有許多文獻報導,加速氧氣還原反 應的催化劑有許多種,其中以鉑或鉑的合金的還原效率最為顯著, 但由於白金的價格過於昂貴且對反應的選擇性低等缺點,使得研 究主軸趨向於具有足夠催化活性且能有效降低成本的催化劑。文 獻中提到,銀系觸媒具有不錯的催化效果,且相較於白金成本較 為低廉。其中,雖然奈米銀顆粒對於催化氧氣還原反應已有許多 文獻報導指出有不錯的催化效果 [26],但目前文獻鮮少研究關於 特殊銀奈米結構應用於催化氧氣還原反應的影響,由於不同的奈 米結構有其獨特的特性,因此本篇研究為合成不同形狀奈米銀顆 粒當做催化劑,應用於鹼性燃料電池氧氣還原反應中,進一步探 討其結構對於催化活性之影響。而常見的合成奈米銀顆粒方法有 Polyol process 合成、光還原法、晶種成長法、水熱法等,而每一 種合成方式都有其基本原理,主要為成核、成長,成核與成長互 相影響,因此,調控不同的條件以達到控制形狀的目的,包含: 溫 度、反應時間、濃度、界面活性劑、還原劑、添加金屬離子等, 皆對於銀合成上的有所影響。 2-3.1 光還原法 (photoreduction) 利用特定波長能量的光源,照射金屬離子或奈米金屬顆粒使 其還原成長的一種方法,稱為光還原 [27-29],其還原方法如示
21 意圖2.9 [27]。 圖 2.9 光還原金屬機制示意圖。 利用使用不同介面活性劑、硝酸銀濃度、反應時間、不同光 源能量等因素,還原銀成奈米顆粒。利用化學還原法製造出球型 奈米顆粒,再利用 40 W 螢光照射,隨著時間增長,銀顆粒都由 球型轉變為三角形。 圖 2.10 40 W螢光下照射不同時間之TEM圖,A)照射前,B)照射 40,C)照射55,D)照射70 hr銀奈米粒子 [27]。 而改變保護劑,改由 PVA 當作保護劑,以及改變硝酸銀濃 度,利用 30 W 汞燈還原銀奈米顆粒,成長出不同寬度的樹狀奈 米銀結構。如圖 2.11 所示 [28]。
3wt% PVA,10-3M AgNO3 3wt% PVA,10-2M AgNO3
圖 2.11 不同硝酸銀濃度於30W汞燈還原之TEM圖譜 (a) 稀疏的
樹枝狀奈米銀 。(b)濃密的樹枝狀奈米銀。
2-3.2 Polyol process 合成
為一種有機相的合成方法,利用 PVP (poly vinyl pyrrolidone) 為界面活性劑,乙二醇 (ethylene glycol)為溶劑,且為一種隨著溫 度上升而還原力增強的還原劑,進一步利用加熱還原金屬離子的 一種化學還原方法,可以藉由控制反應時間、硝酸銀及 PVP 濃度、 及兩者比例改變、反應溫度不同,還原成不同形狀的奈米銀顆粒。
實驗架構主要將 AgNO3和 PVP 之 ethylene glycol 溶液分別以固定
緩慢的速率加入至溫度為 140-160℃ 純 ethylene glycol 溶液中, 加熱令其還原力增強而得到銀顆粒。由文獻指出利用此方法可以 獲得高產率的不同形狀奈米銀結構 [30-33]。圖 2.12 為利用此方 法合成不同形狀的奈米銀結構。
23
[PVP]/[Ag]=1.5,[AgNO3]=0.25 M,time=45 min
PVP]/[Ag]=1.5,[AgNO3]=0.25 M [PVP]/[Ag]=15,[AgNO3]=0.25 M
[PVP]/[Ag]=1.5,[AgNO3]=0.085 M
(a)
(b)
(c)
(d)
[Ag]/[Br]=8.4 × 105,Time=2.5 hr
圖 2.12 polyol process方法合成不同形狀的奈米銀結構 (a) (b) 立 方體 (c) (d) PVP濃度對立方體合成的影響 (e) (f) 線狀 (g) (h) 三角錐[30-33]。 2-3.3 晶種還原法 (seed-mediated growth) 晶種還原法主要有兩個步驟: a) 合成晶種:通常利用 citrate 水溶液為包覆劑,加入低濃度金 屬鹽類(例如:金、銀),接著加入強還原劑(NaBH4),使其還 原成 3-5 nm 小晶種奈米顆粒。 b) 成長步驟:將晶種加入成長溶液中,成長溶液通常包含介面 活性劑(CTAB)、弱還原劑(ascorbic acid)、金屬鹽類、NaOH 來調節 pH 值。界面活性劑通常可形成較大微胞 (micelle)或 柱狀結構[34-35]。圖 2.13 為晶種成長法之示意圖 [36]。
(g)
(h)
25 圖 2.13 晶種成長法之示意圖 [36]。 其成長機制為界面活性劑於適當濃度下形成柱狀結構,稱為 軟性的模板 (soft template) ,小顆粒的晶種銀顆粒於模板內成長成 棒狀結構,其成長機制示意圖如圖2.14所示 [37]。 圖 2.14 晶種成長法棒狀結構成長示意圖 [37]。 晶種成長法的優點為製作方式快速簡單、可在室溫下進行反 應與適合在實驗室進行等。圖 2.15 為不同條件下合成銀奈米棒 之 TEM 圖譜。
不同晶種體積、酸鹼值合成銀奈米線 圖 2.15 不同合成條件下利用晶種成長法合成銀奈米棒之TEM圖 譜 [34-35]。 2-3.4 水熱法 (hydrothermal) 利用水或不同的溶劑(例:乙二醇)為介質,外加適當的溫度, 在密封的壓力容器中內產生高壓而進行反應。目前利用水熱法製 備奈米等級產物的方法已經引起研究者高度的興趣,其特點為純 度高、粒徑易控制、分佈均勻、顆粒團聚輕且合成設備簡單及成 本低等優點。其合成步驟,是先把反應物與溶劑放入反應器內, 再把反應器旋緊、密閉後,放入加熱反應爐中進行實驗反應。反 不 同 酸 鹼 值 下 合 成 銀 奈 米 棒 之 TEM 圖 a) pH=6.95 b) pH=12.24 不同溫度下合成銀奈米棒之TEM圖 a)20℃ b) 30℃
27 應後取出產物過濾之,反應器再清洗烘乾即可。依反應溫度可分 為中溫高壓型:溫度範圍由 100℃-275℃間,以鐵氟龍為內容器 材質;高溫高壓型:大於 275℃。當處於高溫高壓狀態下,溶劑(例: 水)的性質會產生變化,所以處於臨界狀態下晶體生長速度增加。 可以藉由控制界面活性劑(surfactant)、AgNO3、還原劑等濃 度與反應的時間、溫度,還原成不同形狀的奈米銀顆粒。如下圖 2.16 所示,利用不同合成條件下利用水熱法合成不同形狀結構奈 米銀 [38-41]。 線狀
AgNO3=0.003 M ,NaCl=0.003 M,glucose=0.006 M;Temp=180℃,18 hr [38]。
三角形 AgNO3=43 mM,PVP=210 mM ,Temp=160℃, time=4 hr [39]。 截角三角形 AgNO3=17.3 mM,PVP=210 mM Temp=140℃,time=6 hr [39]。
立方體
Ag(NH3)2+=2.8 mM,CTAB=8.3 mM glucose=4.16 mM Temp=120℃;time=8 hr [40]。
三角形:
Ag(NH3)2+=5.8 mM,CTAB=8.3 mM glucose=4.16 mM Temp=120℃;time=8hr [41]。
線狀
Ag(NH3)2+=6.5 mM,CTAB=8.3 mM glucose=4.16 mM Temp=120℃;time=8hr [41]。
29
第三章 實驗方法與流程
3-1 實驗藥品與設備
3-1.1 實驗藥品與氣體 1.硝酸銀(silver nitrate):SHOWA,純度 99.8 wt% 2.溴化十六烷三甲基銨(hexadecyltrimethylammonium bromide CTAB):ACROS,純度>99 wt% 3.葡萄糖(glucose):Merck,純度 99 wt%4.硝酸鐵 (iron nitrate nonahydrate ): Acros,純度 98+ wt% 5.硝酸銅 (copper nitrate dihydrate): SHOWA,純度 99wt% 6.氫氧化鈉(sodium hydroxide):SHOWA,純度 96 wt% 7.氫氧化鉀(potassium hydroxide):SHOWA,純度 85 wt% 8.氨水(ammonia solution):SHOWA,純度 28 wt% 9.碳布(E-TEK):中科院提供,疏水處理過的碳布。 10.氧氣(oxygen):建仁股份有限公司,99.95 vol% 3-1.2 實驗設備 1.電子天平:Precisa,model XS 225A 2.加熱攪拌器:COFNING 3.超音波震盪器:TOHAMA D200H 4.去離子水機:SUNTEX RM-220
5.高壓釜:宸昶企業-內容量 100 mL 6.離心機:HSIANGTAI
7.電化學系統:Solartron,SIC 1287 8.掃描式電子顯微鏡:Hitachi JSM 6500
9.穿透式電子顯微鏡:Philip TECNAI20、JEOL-2000FX 10.x-ray 繞射儀:Bruker AXS D8 Discover
31
3-2 實驗流程:
3-2.1 全部實驗流程:
3-2.2 截角立方體奈米銀合成
33 3-2.2 棒狀奈米銀合成
3-2.3 六角狀奈米銀合成
35 3-2.4 核殼結構(奈米銀-碳)合成 圖 3.5 核殼結構碳-奈米銀合成流程圖。
3-3 催化劑合成
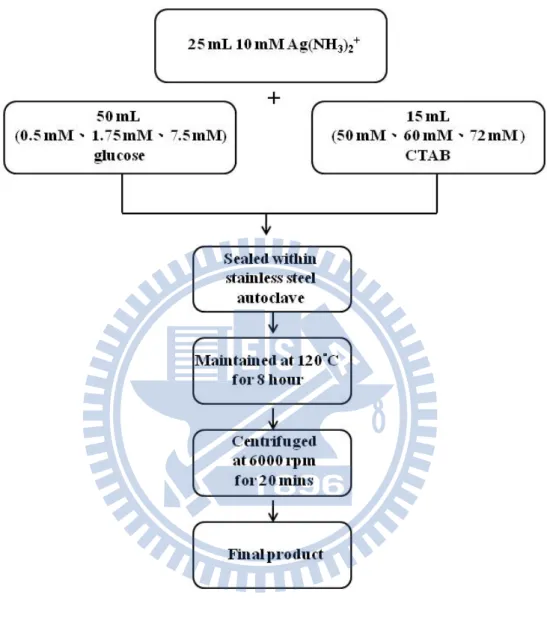
3-3.1 截角立方體奈米銀顆粒的合成 a) 配製 10 mM 銀氨錯離子水溶液:1. 秤取 0.1699 g AgNO3溶於 20 mL 水溶液中。 2. 緩慢滴入 1 M NH3 水溶液,溶液由澄清變為土黃色,繼續滴 入 NH3 水溶液直到再次澄清為止。 3. 將 上 述 溶 液 稀 釋 至 100 ml 為 止 , 即 配 製 完 成 10 mM [Ag(NH3)2]+水溶液。 b) 配 製 不 同 濃 度 (50 mM 、 60 mM 、 72 mM) CTAB (hexadecyltrimethylammonium bromide)水溶液。 c) 配製不同濃度(0.5 mM、1.75 mM、7.5 mM) glucose 水溶液。 d) 取 10 mM 25 mL [Ag(NH3)2]+水溶液、不同濃度(0.5 mM、1.75 mM、7.5mM ) 50mL glucose 水溶液、不同濃度(50 mM、60 mM、 72 mM) 15 ml CTAB 水溶液來製備不同尺寸的銀,將其放置 於容量為 100 mL 鐵氟龍瓶中,均勻混合。 e) 將鐵氟龍瓶放入高壓釜中密封,放置於烘箱中,加熱至 120 ℃,8 小時。 f) 待其自然冷卻室溫,取出以 6000 rpm 轉速離心 20 分鐘。蒐 集沉澱物即合成截角立方體結構奈米銀。 電極製作:將截角立方體奈米銀直接塗佈於2 × 2 cm2 經疏水處 理過之碳布上,烘乾製成。
37 3-3.2 棒狀奈米銀的合成 a) 配製 10 mM 銀氨錯離子水溶液: 1. 秤取 0.1699 g AgNO3溶於 20 mL 水溶液中。 2. 緩慢滴入 1 M NH3 水溶液,溶液由澄清變為土黃色,繼續滴 入 NH3 水溶液直到再次澄清為止。 3. 將上述溶液稀釋至 100 l 為止,即配製完成 10 M [Ag(NH3)2]+ 水溶液。
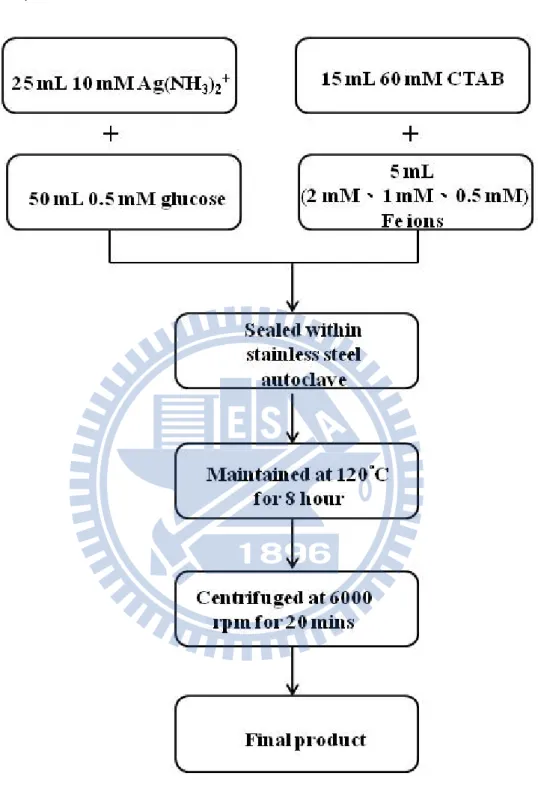
b) 配製 60 mM CTAB hexadecyltrimethylammonium bromide)水 溶液。 c) 配製濃度 0.5 mM glucose 水溶液。 d) 配置濃度為 2 M、1 mM、0.5 mM 的 Fe 離子 100 mL e) 取 10 mM 25 mL [Ag(NH3)2]+水溶液、0.5 mM 50 mL glucose 水溶液、60 mM 15mL CTAB 水溶液及不同濃度(2 mM、1 mM、 0.5 mM)5 mL 鐵離子來製備棒狀的銀,將其放置於容量為 100 mL 鐵氟龍瓶中,均勻混合。 f) 將鐵氟龍瓶放入高壓釜中密封,放置於烘箱中,加熱至 120 ℃,8 小時。 g) 待其自然冷卻至室溫,取出以 6000 rpm 轉速離心 20 分鐘。 蒐集沉澱物即合成棒狀結構奈米銀。
電極製作:將棒狀奈米銀直接塗佈於2 × 2 cm2 疏水處理過之碳 布上,烘乾製成。 3-3.3 六角狀奈米銀的合成 a) 配製 10 mM 銀氨錯離子水溶液: 1. 秤取 0.1699 g AgNO3溶於 20 mL 水溶液中。 2. 緩慢滴入 1 M NH3 水溶液,溶液由澄清變為土黃色,繼續滴 入 NH3 水溶液直到再次澄清為止。 3. 將 上 述 溶 液 稀 釋 至 100 ml 為 止 , 即 配 製 完 成 10 mM [Ag(NH3)2]+水溶液。
b) 配製 60 mM CTAB (hexadecyltrimethylammonium bromide)水 溶液。 c) 配製濃度 0.5 mM glucose 水溶液。 d) 配置濃度為 0.5 mM、5 mM、10 mM 的 Cu 離子 100 mL e) 取 10 mM 25 mL [Ag(NH3)2]+水溶液、0.5 mM 50 mL glucose 水溶液、60 mM 15mL CTAB 水溶液及不同濃度(0.5 mM、5 mM、10 mM) 5 mL 銅離子來製備六角狀的銀,將其放置於容 量為 100 mL 鐵氟龍瓶中,均勻混合。 f) 將鐵氟龍瓶放入高壓釜中密封,放置於烘箱中,加熱至 120 ℃,8 小時。
39 g) 待其自然冷卻至室溫,取出以 6000 rpm 轉速離心 20 分鐘。 蒐集沉澱物即合成之產物。 3-3.4 核殼結構(奈米銀-碳)的合成 a) 配製 10 mM 銀氨錯離子水溶液: 1. 秤取 0.1699 g AgNO3溶於 20 mL 水溶液中。 2. 緩慢滴入 1 M NH3 水溶液,溶液由澄清變為土黃色,繼續滴 入 NH3 水溶液直到再次澄清為止。 3. 將 上 述 溶 液 稀 釋 至 100 ml 為 止 , 即 配 製 完 成 10 mM [Ag(NH3)2]+水溶液。
b) 配製 60 mM CTAB (hexadecyltrimethylammonium bromide)水 溶液。 c) 配製濃度 3 mM glucose 水溶液。 d) 取 10 mM 25 mL [Ag(NH3)2]+水溶液、3 mM 50mL glucose 水 溶液、60mM 15ml CTAB 水溶液來製備截角立方體銀,將其 放置於容量為 100 mL 鐵氟龍瓶中,均勻混合。 e) 將鐵氟龍瓶放入高壓釜中密封,放置於烘箱中,加熱至 120 ℃,8 小時。 f) 再升溫至 160℃進行第二段升溫進行包碳處理。 g) 待其自然冷卻至室溫,取出以 6000 rpm 轉速離心 20 分鐘。
蒐集沉澱物即合成核殼結構(奈米銀-碳)。 電極製作:將立方體奈米銀直接塗佈於2 × 2 cm2疏水處理過之碳 布上,烘乾製成。
3-4 分析儀器
3-4.1 定性分析 A. 穿透式電子顯微鏡 (TEM): 穿透式電子顯微鏡具有極高的穿透能力及高解析度,已成為 材料科學研究上極有效的工具之一。藉由穿透式電子顯微鏡進行 材料分析主要可得到以下三種訊息:(1)擷取穿透物質的電子 (transmitted electron)或彈性散射電子 (elastic scattering electron)而成像;(2)由電子繞射圖樣 (diffraction pattern),做為微細組織
和晶體結構之研究;(3)搭配 X-光能譜分析儀 (EDX)或電子能 量散失分析儀 (electron energy loss spectroscope, EELS)做化學成 份分析。本實驗採用之 TEM 為 Philip TECNAI20 及 JEOL-2000FX 利用 TEM 觀察探討催化劑的結構與形貌,有助於與電化學量測 結果做更進一步的探討 [42]。
B. X 光繞射分析儀(XRD) [42]:
41
之面間距 d 中之格子面 (hkl)測物之,對入射 X 光剛好傾斜 θ 角
(Bragg’angle),符合布拉格 (Bragg’s)公式:nλ=2dsinθ 時,此時入
射之 X 光會產生繞射。將所得結果與 JCPDS 軟體對照,找出觸 媒之晶體結構資料。本實驗所使用之 X 光繞射分析儀為 Bruker AXS: D8 Discover,使用 Cu Kα (λ=1.5418 Å)作為激發源,使用低 掠角模式,掃描角度為 30~80 度,掃描速率為θ=0.05o /s。 C. 掃描式電子顯微鏡 (SEM): SEM 主要利用電子槍產生電子束,經過三個電磁透鏡所組成 的電子光學系統,聚集成一微小電子束照射至試片的表面。試片 表面原子受到入射電子的撞擊,會產生二次電子、反射電子、歐 傑電子等等。而試片產生出的二次電子,其能量小於 50 eV 的低 能量電子,只有在試片深度 50-500 Å 才可能逃離試片表面而受到 偵測,且其數量也會受到試片表面起伏所影響。故藉由觀察二次 電子的影像可以瞭解試片表面之形貌特徵。實驗中使用之掃描式 電子顯微鏡型號為 JEOL JSM-6500,操作加速電壓為 15 kV。成 份之定性及定量分析則使用其所附加之 EDX 進行。 D. 可見光-紫外光吸收光譜儀 (UV-VIS): 利用金屬奈米粒子在不同型態下會對不同波長產生表面電漿共
振,因此可藉由觀察金屬奈米粒子吸收波段不同來判別其所產生之變 化。利用可見光-紫外光吸收光譜,可以測量並分析溶液的吸收度, 樣品的吸收度會與濃度呈現性關係,可由 Beer’s law 表示 A = logPP = 0 εbc A:樣品吸收度; P0:入射光強度; P:穿透光強度 ε:樣品吸收系數 ; b:cell 的長度 ;c:樣品濃度 3-4.2 電化學分析 A. 定電壓放電(氧氣還原)測試 (potentiostatic experiment): 催化劑在氧氣還原反應測試,使用三電極的半電池反應;其 中以氣體擴散陰極為工作電極,電極反應面積為 3 cm2;輔助電 極為鍍上氧化釕與氧化銥的鈦網;以 Ag/AgCl 標準電極為參考電 極,電解質為 1M 氫氧化鉀 (KOH),提供參予反應的氧氣為空 氣中的氧。整體的電化學裝置可見於圖 3.6。定電壓放電實驗中, 量 測 陰 極 在 固 定 電 壓 時 長 時 間 放 電 能 力 , 測 試 條 件 範 圍 為 0.2~0.4 V,觀測其電流輸出值之穩定性。
43 圖 3.6 電化學裝置。 a) 電流對電壓極化曲線 (potentiodynamic experiment): 電 流 對 電 壓 極 化 曲 線 使 用 三 電 極 的 半 電 池 反 應 , 其 中 以 2 × 2 cm2 塗佈奈米銀觸媒於經過疏水處理之碳布上做為工作電 極;輔助電極為鉑片;參考電極為 Ag/AgCl 標準電極,電極反應 面積為 1 cm2;電解質為 1 M 氫氧化鉀 (KOH),通以純氧。實驗 裝置圖如圖 3.7 在測試中逐漸增加電壓輸出量(1 mV/sec),測量相對輸出電 流的改變,以此電流與電壓之變化量做圖。在曲線中,極化現象 為偏離理想電極特性行為的表現,且可藉此判斷觸媒電極特性優
劣。
45
第四章 實驗結果與討論
4-1 不同大小之截角立方體銀奈米顆粒對氧氣
還原反應之電催化活性探討
文獻中常見合成不同形狀奈米銀粒子的方法有許多種,例如: 利用 UV 光來進行光還原反應;polyol process 合成 [30-33],其 利用多醇基作為還原劑還原金屬;水相晶種成長法、晶種成長法 [34-37]等方法,本篇研究選用水熱法來合成截角立方體的奈米銀 結構,相對於其他方法優點為 a) 具有高能量的反應環境、b) 反 應步驟簡易、c) 溶劑為水適合現有鹼性燃料電池的應用 d) 合成 產物高產率、粒徑均一與分佈均勻 e) 實驗重複性高。而在水熱 合成法中,可藉由調控反應溫度、反應時間、pH 值、與反應壓 力等方法來控制奈米銀的成長,而本實驗藉由還原劑與介面活性 劑的控制來合成截角立方體的奈米銀結構。 介面活性劑對於合成奈米顆粒有明顯的作用,藉由介面活性 劑對成長面反應性差異,有效地控制不同成長面的相對成長速度, 適當地調整介面活性劑的濃度可以調整成長面的相對反應性,且 CTAB 中的溴離子 [44],可以藉由蝕刻能量較高的雙晶面(twin plane)來控制晶種的種類,因此更可以達到控制形狀的效果。 本研究中主要改變介面活性劑(CTAB)的濃度來控制成長面的成長速度,以及改變還原劑的濃度來控制還原銀的量以及控制 還原劑氧化所產生的的酸性物質對於合成奈米銀的影響。 4-1.1 截角立方體奈米銀結構之物理性質分析 4-1.1.1 TEM 觀測 a) 介面活性劑濃度對合成奈米銀的影響: 改變介面活性劑
濃度將 Ag(NH3)2+ 25 mL、Glucose 50 mL、CTAB 15 mL 均
勻混合,放入高壓釜中加熱至120℃,反應八小時,改變介面 活性劑的濃度為參數來探討濃度對於奈米銀形狀合成之影響, 反應濃度為0.2 mM、3 mM、10 mM、20 mM。由TEM圖可以 得到,當濃度過低時,奈米銀顆粒主要成長為球狀的形貌, 以及有一些棒狀以及立方體的不規則形狀,主要原因為介面 活性劑的反應不足以影響成長面的成長速度差異,因此,呈 現均向成長的現象;介面活性劑隨著濃度到達3 mM,界面活 性劑與成長面反應漸為顯著,達到抑制成長的效果,由圖中 可以明顯看到有立方體的銀顆粒生成,而界面活性劑的濃度 依舊為低,CTAB中的溴離子蝕刻反應不足以產生單晶體 (single-crystal)的晶種,且濃度不足,對於成長面的成長速率
47 控制無法均一,無法與所有的晶種反應,產率僅有25%;當濃 度為10 mM時,TEM圖譜顯示可以合成出產率接近95%的立 方體銀顆粒,由於晶種合成的條件控制,利用CTAB中溴離子 的蝕刻作用,合成晶種為單晶體(single-crystal),成長步驟中, 介面活性劑有效降低(200)面的成長速率,銀在成長上有反應 上的快慢,由成長機制來看 [45],成長速率較快的成長面最 後會成長完全而消失,最後的擇優取向(preferred orientation) 為成長速率較慢的成長面,因此最後主要的形狀為立方體為 主;當濃度到達20 mM時,由於介面活性劑與(200)及其他成 長面的反應已無太大差異,使得控制成長面的條件失去效果, 因此開始產生不規則的形狀,大大降低了立方體的產率;也 由於介面活性劑濃度對於奈米銀的反應有所差異,銀濃度與 界面活性劑的濃度比例不同,相對地界面活性劑對於銀的影 響也有所不同,濃度影響主要是改變銀成長的整體速率,隨 著濃度增加,銀的尺寸也有明顯的變小。
圖 4. 1 CTAB 2 mM 之 TEM 圖。
49
圖 4. 3 CTAB 8.3 mM 之 TEM 圖。
圖 4. 5 CTAB 12 mM 之 TEM 圖。 表4.2 界面活性劑對銀奈米顆粒結構之影響。 介面活性劑濃度 結果 2.0 Mm 形狀不規則 3.0 mM 約 40% 、65 ± 5 nm nanocube 8.3 mM 90%以上 約 70 ± 5 nm nanocube 10 mM 90%以上 約 50 ± 5 nm truncated nanocube 12 mM 約 80% 約 40 ± 5 nm nanocube
51
b) 還原劑對合成奈米銀的影響: 改變還原劑的濃度
將 Ag(NH3)2+ 25 mL、Glucose 50 mL、CTAB 15 mL 均勻混 合,此時使用最佳介面活性劑濃度 10 mM ,放入高壓釜中加熱 至 120℃,反應八小時,改變還原劑的濃度為參數來探討濃度對 於奈米銀形狀合成之影響,反應濃度為 0.28 mM、0.98 mM、4.2 mM,與 Ag 的莫耳比為 1:0.1, 1:0.35, 1:1.5。由 TEM 圖譜 4.6 得到,當濃度為 0.28 mM 時,可以合成出 truncated cube,size 為 50 ± 5 nm,由於還原劑濃度可以控制還原銀的量,再加上介面 活性劑有效控制成長面的速率,成長面在成長過程中有競爭關係, 當還原的銀有限,在成長速度較快的成長面上無法完全反應成長, 因此產生了截角的形狀,在此截角立方體中,主要的八個面為 (200),而產生的截角面為(111),十二個邊上的面為(110),產率約 90%;從 TEM 圖 4.7 及 4.8 看到,當還原劑的量提高時,截角立 方體的形狀開始有所變化,不規則形狀開始出現,也由截角立方 體變成立方體,主要原因為當還原的量足夠時,較快的成長面有 足夠的銀成長,導致成長面的消失,因此銀奈米顆粒主要由(200) 面為主,不規則的形狀主要原因為還原劑(glucose)氧化會產生酸, 溶液中存在(H+ ),也是一種 etchant,H+與銀晶格中的氧作用,導 致晶種的氧蝕刻效應變低,因此,晶種無法達到控制,最終的形
狀呈現不規則的形狀。
圖 4. 6 0.28 mM Glucose 之 TEM 圖。
圖 4. 7 0.98 mM Glucose 之 TEM 圖。
53 圖 4. 8 4.2 mM Glucose 之 TEM 圖。 表4.3 還原劑對銀奈米顆粒結構之影響。 還原劑濃度 結果 0.2 Mm 約 95% 約 50 ± 5 nm truncated nanocubes 0.95 mM 約 80% 65 ± 5 nm nanocubes 4.2 mM 約 60% 75 ± 5 nm nanocubes
4-1.1.2 SEM 觀察 從 SEM 圖可以觀察合成產物的產率。從圖 4.9 可以看 出,立 方體的產率高達 95%以上,界面活性劑可以有效地控制每個銀的 形狀,純的立方體銀再進一步進行以下的分析,可以確保我們所 分析的產物為純的立方體結構;而在圖 4.10 中,(a) 圖中可以看到 立方體的角有明顯的圓弧,並非菱角出現,代表截角的產生,且 在(b) 圖中可以發現,合成產物為大面積的產物,產率為 95 %以 上。從 SEM 得知,所得到的立方體或是截角立方體都為可高產 率的合成方法。 圖 4. 9 CTAB 8.3 mM 之 SEM 圖。
55
圖 4. 10 0.28 mM Glucose 之 SEM 圖(a) 高倍率下 SEM 與(b) 低倍率下 SEM 之圖譜。
4-1.1.3 紫外光-可見光吸收光譜 (UV-VIS)分析
Surface Plasma Absorption Spectroscopy 通常被應用為觀察奈 米粒子形狀或大小,主因為不同形狀或大小相對會反應出不同光 學特性,利用 UV-VIS 吸收光譜證實合成的截角立方體的結構。 圖 4.11 為截角立方體與立方體的 UV 吸收光譜圖。此外,以晶種 當作背景值 UV-VIS 吸收光譜圖,圖中可觀察到晶種只有單一較 寬廣的吸收峰位於 384 nm,應該為小顆均勻的球形結構。根據 過去的文獻提到 [46],金屬被入射光照射時,入射光的電場會引 起金屬奈米粒子表面電子產生極化現象,使得電子雲和原子核產 生分離。由於庫倫吸引力會產生一回復力造成震盪的產生,當震 盪頻率與入射光頻率相同時就會產生電子集體震盪的行為,此現 象稱為表面電漿共振(Surface Plasma Resonance;SPR),然而,對 金屬奈米粒子而言,這個頻率的震盪通常發生在可見光區,因此 可在 UV-VIS 吸收光譜發現明顯的特徵性吸收。然而,立方體與 截角立方體的銀之 UV-VIS 吸收光譜與晶種相比皆有不一樣的吸 收圖譜;過去文獻指出表面電漿共振(SPR)之特性吸收受奈米粒 子其顆粒大小、幾何形狀、組成與環境之介電常數等因素影響 [47]。可利用理論計算方式計算出表面電漿共振 (SPR)之吸收訊 號,立方體奈米銀結構利用理論計算方式計算出應有 6 個 SPR 模
57 式,但實際上只會打出 4 個較明顯的吸收,其為立方體之邊與角 的電荷極化現象 (charge polarizability)造成,將合成的立方體奈米 銀之 UV-VIS 光譜圖與文獻 [47-48]之圖形比較,有相同的圖形出 現,但吸收峰位置有些微差距,推測吸收峰位置與文獻不同之原 因是由於立方體奈米銀分散於不同溶液中,其介電常數不同造成 訊號位移,但可以利用 UV-VIS 吸收光譜之特定形狀圖譜簡單的 確認是否成功合成立方體奈米銀結構。由圖 4.11 UV-VIS 吸收光 譜可以再次印證此實驗成功的合成立方體奈米銀。而當尺寸為 50 nm 左右的截角立方體於文獻中也有印證 [32、44],其吸收值在 350、400、450 nm 處有吸收峰產生,與此研究中所合成的截角 立方體有相同的吸收位置,可以左右印證所合成的產物為截角立 方體。
300 400 500 600 700 800 900 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 A b s o rb a n c e ( A rb . u n it s ) Wavelength (nm) cube truncated cubes seed 圖 4. 11 紫外光-可見光吸收光譜(UV-VIS) 分析,分別為立方 體、截角立方體、晶種。 4-1.1.4 XRD 分析 圖 4.12 為截角立方體奈米銀結構之 XRD 分析結果,在 38.20∘、44.40∘、64.40∘與 77.3∘分別有(111) 、(200)、(220) 與(311)面繞射峰訊號出現,由這些吸收峰可以判定其為 FCC 結 構,利用此圖計算出晶格常數為 4.081 Å,將此 XRD 結果與標準 資料庫的 Ag 比對,其晶相與資料庫中的(JCPDS-04-0783)完全符 合。在此 XRD 圖中發現(111)與(200)特徵峰的相對比例與原本的 比例有明顯的降低,可以與文獻中比對此繞射峰的比例 [30], 代表(200)的面明顯的提高,此為(200)面的長成所導致,代表截角 立方體其相對(200)與球狀的銀有明顯的不同面的成長。
59 30 40 50 60 70 80 0 500 1000 1500 2000 Int e ns it y ( a rb. uni ts ) 2
θ
(degree) cube truncated cube 圖 4.12 截角立方體與立方體的 XRD。 4-1.1.5 HRTEM 分析與 SEM 成分分析 圖 4.13 為截角立方體奈米銀之 HRTEM、SAED 與 EDX 分析 結果。圖 4.13 a)為隨機選區之截角立方體奈米銀,大小約 50 nm, 更進一步利用 SAED pattern 得到圖 4.13 b)分析,將圖 4.13 b) SAED 圖與 FCC 結構之 pattern 圖對應,確認繞射圖形對應出的 為(200)面。此外,利用 EDX 分析成分,其結果為圖 4.13 c)。經 由 EDX 分析結果發現有銀、矽與鈦等訊號產生,而圖中出現的 矽與鈦等訊號為基版本身所產生的訊號。再著,利用高解析度電 子顯微鏡做更進一步的分析,其結果如圖 4.14 d) 所示。 由圖 4.14 d) 中 , 可 明 顯 觀 察 到 截 角 立 方 體 奈 米 銀 之 晶 格 條 紋 (latticefringes),去計算平均層與層之間的距離,算出其相對於層間距為 1.98 Å,與標準資料庫(JCPDF 040783)比對其對應出應為銀的 (200)面,則可以確定晶格常數即為 1.98 Å;由以上分析可以確認 此實驗方法合成出的樣品是由銀組成的截角立方體結構。 (a) (b) (c)
61
圖 4.13 截角立方體奈米銀之 a) 隨機選取截角立方體分析、 b) SAED 分析、c) EDX 成分分析與 d) HRTEM 圖譜。 4-1.2 電化學分析 選用 10 mM Ag(NH3)2+ 25 mL、0.75 mM Glucose 50 mL、60 mM CTAB 15 mL 水溶液均勻混合,放入高壓釜中加熱至 120 ℃, 加熱至 18 小時之樣品,其截角立方體產率可高達 95 %以上,測 試截角立方體奈米銀之催化活性,與立方體做比較,探討截角對 於電化學活性的關係,更進一步與介面活性劑濃度較高所合成出 來尺寸較小的截角立方體的銀做比較,探討其尺寸與電化學活性 的關係。 (d)
極化曲線測試 (Potentiodynamic test): a) 截角立方體氧氣還原測試: 圖 4.14 為催化劑含量相同的截角立方體奈米銀與立方體奈 米銀測試其氧氣還原反應催化活性之極化曲線圖。由圖可以明顯 得知,當沒有添加銀奈米顆粒的電極其沒有反應電流的產生,而 添加了銀奈米顆粒之後即有電流值的產生,表示銀在氧氣還原上 確有催化活性;而不同形狀對於氧氣還原的效果也有其不同的反 應效果;立方體的最大電流密度為 11 mA/cm2,發生在-0.7 V 處, 之後往負電壓繼續量測,可以明顯發現輸出電流值皆明顯變小, 推測原因為在高電壓的條件下,氧氣還原反應速率急劇上升,大 量消耗觸媒界面上的氧氣,溶液中的氧氣來不及補充完全,無法 提供氧氣來產生電化學反應,造成輸出電流下降;在相同觸媒含 量下,含有截角立方體的電極,其電化學的表現較立方體更為優 異,在電流密度上達到 16 mA/cm2,相較於立方體的電流密度有 大大的提升,其結果可推斷為截角所產生的(111)面所造成,在電 化學氧氣還原方面,文獻中有提到 [49],在氧氣還原反應下, (110)>(111)>(200),因此,所合成的截角立方體中,擁有更多反 應性優於擇優取向為(200)立方體的(111),在電化學的電流上表現 才會有其優異性,此外,之後也可以明顯發現電流值開始大幅度
63 的下降,推測原因與立方體的結果一樣;此測量主要是比較催化 劑的活性差異性,擁有較大電流即推斷其為較好的催化劑,並無 法明確指出催化劑的實際催化活性。 在圖 4.15 中進一步進行電化學後的 TEM 觀測,可以明顯發 現,經過電化學測試後立方體奈米銀結構產生改變,奈米顆粒大 小並沒有太大的變化,但顆粒產生聚集與變形現象,形狀變為不 規則,可能導致其活性受到影響。
-0.8 -0.6 -0.4 -0.2 0.0 -18 -15 -12 -9 -6 -3 0
C
ur
re
nt
de
ns
it
y
(mA
/c
m
2
)Potential (volt vs. Ag/AgCl)
noncatalyzed cubes truncated cubes 圖 4.14 截角立方體與立方體的陰極極化曲線比較圖。 圖 4. 15 電化學測試後之 TEM 圖。 b) 不同大小截角立方體對於氧氣還原測試 圖 4.16 為催化劑量相同之不同大小的截角立方體的極化曲 線,測試其大小對於氧氣還原反應性的差異性。當形狀不變時,
65 控制其大小來當做催化劑進行氧氣還原反應時,當尺寸為 50 nm 時,-0.6 V 時的電流密度為-16.4 mA/cm2,高電壓下依舊有氧氣 不足的現象,導致電流大幅度的降低;當尺寸較小時,其在-0.6 V 時的電流密度為-18.073 mA/cm2,與 50 nm 的電流值比較有些微 的提升,代表氧氣還原反應受到尺寸大小的影響;相同奈米銀的還 原量,當尺寸較大時,表面積相對尺寸較小的奈米銀顆粒來的少, 因此可以進行氧氣還原反應的面積相對提升,催化效果隨尺寸變 小而提升。 -0.8 -0.6 -0.4 -0.2 0.0 -18 -15 -12 -9 -6 -3 0
C
ur
re
nt
de
ns
it
y
(mA
/c
m
2
)Potential (volt vs. Ag/AgCl)
noncatalyzed 10mM 45nm 12mM 40nm 圖 4. 16 不同大小銀顆粒的陰極極化曲線比較圖。 c) 定電壓放電測試(potentiostatic experiment) 為了可以確定所合成的截角立方體銀觸媒之穩定性,接著利 用電壓放電來測試催化劑的穩定度,且在儀器裝置上改為空氣擴
散電極,可以模擬催化劑所反應的實際含氧狀況下,真實表現銀 的催化能力,此測試使用不同電壓(-0.2 V、-0.3 V、-0.4 V)進行測 量,測試時間為 12 小時來探討截角立方體的穩定性,由圖 4.17 得 知,不同的電壓下在反應十二小後曲線保持水平,並沒有太大的 波動,代表反應沒有削減,依舊保持穩定而持續催化反應,催化 劑仍然保有它催化的效果;可由此實驗中確定所合成的銀催化劑 在長時間的反應下依舊具有其催化活性。 0 10000 20000 30000 40000 50000 -0.40 -0.35 -0.30 -0.25 -0.20 -0.15 -0.10 -0.05 0.00 C ur re nt de ns it y

![圖 2.1 各種燃料電池簡易示意圖 [1]。 A. 鹼性燃料電池(AFC): 鹼性燃料電池陰、陽極分別為氫氣、氧氣氣體擴散電極,其 電解質為氫氧化鉀鹼性溶液。其電極反應式: anode:2 H 2 + 4 OH - → 4 H 2 O+ 4e -cathode:O 2 + 4e - + H 2 O → 4 OH -操作溫度約為 70℃,屬於低溫型燃料電池。 B](https://thumb-ap.123doks.com/thumbv2/9libinfo/8360221.176783/21.892.165.755.107.848/質為氫氧化鉀鹼性溶液其電極反應式H++溫度約為屬於低溫.webp)
![圖 2.5 氧氣還原反應機制示意圖 [13]。 大致上可以分為五個步驟:](https://thumb-ap.123doks.com/thumbv2/9libinfo/8360221.176783/30.892.164.749.245.838/圖25氧氣還原反應機制示意圖13大致上可以分為五個步驟.webp)
![圖 2.8 Bridge model氧氣還原反應機制 [13]。](https://thumb-ap.123doks.com/thumbv2/9libinfo/8360221.176783/33.892.216.750.320.801/圖28Bridgemodel氧氣還原反應機制13.webp)

![圖 2.12 polyol process方法合成不同形狀的奈米銀結構 (a) (b) 立 方體 (c) (d) PVP濃度對立方體合成的影響 (e) (f) 線狀 (g) (h) 三角錐[30-33]。 2-3.3 晶種還原法 (seed-mediated growth) 晶種還原法主要有兩個步驟: a) 合成晶種:通常利用 citrate 水溶液為包覆劑,加入低濃度金 屬鹽類(例如:金、銀),接著加入強還原劑(NaBH 4 ),使其還 原成 3-5 nm 小晶種奈米顆粒。](https://thumb-ap.123doks.com/thumbv2/9libinfo/8360221.176783/39.892.194.731.122.342/線狀三角錐晶種還原利用包覆劑加入低濃度屬鹽類例如金銀接顆粒.webp)