* 通信作者:蘇銘燦(Ming-Tsan Su);FAX:886-2-29312904;E-mail:mtsu@ntnu.edu.tw
果蠅血管收縮素轉化酵素相關基因表現受
tinman 基因直接調控
廖芳足 林煥雯 李靜怡 蘇銘燦*
國立臺灣師範大學生命科學系 (收稿日期:2013.4.28,接受日期:2013.5.10) 摘 要血管收縮素轉化酵素相關基因(Angiotensin converting enzyme related, acer)為哺乳類動 物血管收縮素轉化酵素2 (Angiotensin converting enzyme 2, ACE2)在果蠅的同源基因,二者皆
保有類似的酵素特性。為能進一步了解 acer 基因在果蠅的功能,我們利用原位雜合解析其 在胚胎發育時期的動態表現型態,實驗發現acer 信息核酸位於未受精的卵中,証實 acer 為 一母源基因,在胚胎發育初期acer 短暫消失無任何表現,在胚胎發育第十一期時 acer 則表 現在羊漿胚膜(aminoserosa)及未來形成心臟先驅細胞的背部中胚層,到胚胎發育第十四期時 acer 持續表現於羊漿胚膜細胞並開始出現在心臟先驅細胞中,在胚胎發育晚期 acer 則僅在 心肌細胞中表現,另由報導基因研究發現,調控acer 在心臟細胞表現的加強子(enhancer)位
於5’端到第二內插子約 1.4 kb 的 DNA 片段中,此一加強子驅動報導基因表現可受 tinman (tin)
的表現而表現,突變加強子則不受影響,另由染色體免疫沈澱實驗,我們發現tin 蛋白可結 合在加強子上,基於上述結果我們認為tin 可直接調控 acer 的表現。 關鍵詞:果蠅、心肌細胞、血管收縮素轉化酵素、心臟特異加強子
緒 言
腎 素- 血 管 收 縮 素 - 醛 固 酮 系 統 (Renin- angiotensin-aldosteron-system, RAAS) 為一哺 乳類動物調控血壓及體液衡定的重要內分泌 系統,此一系統中腎臟介由過濾再吸收及排泄 尿液等方式,調節體內電解質、酸鹼值和水分 含量以維持血液滲透壓及血壓的恒定,血液滲 透壓過高會刺激腦下垂體分泌抗利尿激素,增 加水分的再吸收以減少排尿量及降低血液滲 透壓(Ferreira and Santos, 2005; Kurdi et al., 2005; Leckie, 2005)。此一系統也可藉由腎素的 分泌對血壓進行調節,在血壓降低時,近腎小 球複合體(Juxtaglomerular apparatus, JGA)會分 泌 出 腎 素 將 肝 臟 製 造 出 的 血 管 收 縮 素 原 (angiotensinogen) 水 解 成 血 管 收 縮 素 I (Angiotensin I, Ang I),血管收縮素轉化酵素 (Angiotensin converting enzyme, ACE)進而將 Ang I 水解成血管收縮素 II (Angiotensin II, Ang II),血管收縮素 II 可直接促進小動脈 (arteriole)的收縮,而使血壓上升,血管收縮素 II 也 可 刺 激 腎 上 腺 皮 質 細 胞 產 生 醛 固 酮 (aldosterone),促進鈉離子和水的再吸收,藉 由增加總血液量而間接增加血壓。上述過程若 有一環節受到抑制,即可降低血壓,而這也是 目前臨床控制高血壓最常用的方式(Ferrario etal., 2005a; Ferrario et al., 2005b; Karram et al.,
2005; Keidar et al., 2005)。血管收縮素轉化酵 素 同 源 基 因 - 血 管 收 縮 素 轉 化 酵 素 2 (angiotensin converting enzyme 2, ACE2)的發 現(Donoghue et al., 2000; Burrell et al., 2004; Guy et al., 2005a; Guy et al., 2005b),更為上述 RAAS 調控血壓的方式增添複雜度,因 ACE2 可將Ang II 進一步水解成 Ang 1-7,有趣的是, Ang 1-7 雖由 Ang II 水解而來,但它卻反而造 成 血 管 舒 張 降 低 血 壓(Riviere et al., 2005; Keidar et al., 2007)。研究發現 ACE2 基因剔除 鼠血液中Ang II 量上升,且降低心臟收縮功能 (Crackower et al., 2002)。
無脊椎動物動物中血管收縮素轉化酵素 基因也相當保守,在果蠅基因體中發現共有六 個血管收縮素轉化酵素同源基因,分別是ance
(Drosophila Angiotensin converting enzyme)、
ance2、ance3、ance4 與 ance5 及 acer (血管收
縮 素 轉 化 酵 素 相 關 基 因 , Angiotensin converting enzyme-related) (Houard et al., 1998)。ance (亦稱為 race) 具有一個金屬性肽 酶 活 性 區 , 胚 胎 發 育 過 程 中 表 現 在 果 蠅 amnioserosa、前腸道及後腸道、晚期則在與免 疫功能有關淋巴腺體(lymph gland)及背血管
(心臟)表現(Siviter et al., 2002);由於 ance 異型 合子突變果蠅有雄性不孕的情形,證實其在睪 丸及精子生成有重要的功能(Hurst et al., 2003), Ance 同型合子突變果蠅死於幼蟲時期,外型 上沒有顯著的發育異常,生化研究發現由胚胎 中純化出來的 Ance 能將人類 Ang I 轉變為
Ang II,且 ACE 抑制劑可抑制其酵素活性 (Williams et al., 1996; Siviter et al., 2002; Kim
et al., 2003),一般認為 Ance 應有調控心臟生 理的功能,然上述推論尚未實証。 ance2、ance3、ance4 以及 ance5 核酸序 列雖與 ance 高度相似,但序列分析顯示,這 四個基因不具金屬性胜肽酶活性區塊,所以不 認為具有如ance 般的酵素活性;但其 N 端含 有訊息胜肽(signal peptide)的片段,顯示其可 能為膜或分泌性蛋白質(Coates et al., 2000),除 上述預測性序列分析的資料外,這四個基因的 表現位置及功能仍待研究。這類與胜肽酶序列 有高度同源,卻無酵素活性的「非胜肽酶」 (non-peptidase)蛋白質,也可在線蟲、老鼠及 人類基因體中發現(Huang et al., 2003),線蟲非 胜肽酶同源蛋白 UNC-71 可調控運動神經元 軸 突 引 導 及 肌 肉 纖 維 母 細 胞 的 移 動 有 關 (Huang et al., 2003),另線蟲血管收縮素轉化酵 素同源基因 ACN-1 可調控線蟲幼蟲蛻皮的相 關功能(Brooks et al., 2003)。 序列分析顯示果蠅 Acer 與人類 ACE 中 N 端的金屬性胜肽酶活性區有比較高度的相 似性(Taylor et al., 1996),由酵素受體以及抑制 劑專一性研究,証實Acer 具酵素活性(Isaac et
al., 2000),Acer 在胚胎及蛹期有表現(Quan et al., 2001),由 acer 在胚胎發育晚期專一性地表 現在果蠅的背血管中,推測 acer 在果蠅心臟 可能一定的功能,研究發現 acer 突變果蠅心 臟細胞減少的缺陷(Crackower et al., 2002),然 acer 突變如何造成心臟發育缺失原因及調控 表現的上下游因並不清楚,本研究發現 acer 為一母源基因,且胚胎發育的過程中都表現在 心臟相關的組織細胞中,包括心臟先驅細胞及 心肌細胞中,另我們也確認調控 acer 在心肌 細胞表現的加強子,此一加強子含tin 蛋白質 結合位點,且 tin 可結合在加強子上,另 tin 表現可調控的acer 表現,這些結果說明 tin 為 acer 的上游的直接調控基因。
材料與方法
果蠅品系及遺傳操作 本研究所使用的Drosophila melanogaster 果蠅品系w1118由Bloomington Drosophila stockcenter 取得。果蠅以葡萄糖酵母培養基,於 18 ℃或25℃的培養箱中培養。
原位雜合
原位雜合實驗依前人方法稍為修改(Su et al., 1998),acer RNA 探針製備,acer cDNA (clone LD28328) 由 果 蠅 基 因 體 資 源 中 心 (Drosophila genomic resource center)取得,利 用XbaI 限制酵素切成線狀,DNA 片段經純化 後,做為模版以 T7 RNA 聚合酵素及 DIG RNA 標定套組(Roche Applied Science)依廠商 建議方式合成Dig-Labeled 之反股 RNA 探針。 在純化探針後,依照以下程序分別對果蠅胚胎 進行染色。首先以果汁洋菜膠收集 0-16 小時 果蠅(w11118)胚胎後,加 30%漂白水處理 5 分鐘 以去除卵殼,以二次水沖洗胚胎三次去除殘餘 漂白水,將胚胎置入15 mL 的小玻璃瓶中, 依序加入 5 mL 正已烷及同體積含 4% 甲醛 之1× PBS 緩衝溶液,將小玻璃瓶於在小震盪 器上固定胚胎 20 分鐘;然後去除下層固定緩 衝溶液,以二次水清洗去除甲醛,在加入5 mL 甲醇後,劇烈搖晃約20 秒以去卵膜,胚胎以 100%酒精洗 2~3 次去除殘餘甲醇。進行雜合 時則以稀釋序列酒精-磷酸緩衝混合液讓胚胎 復水(依序為 95%, 75%, 50%, 25%),每次處理 胚胎浸泡5 分鐘,最後將酒精置換成 1× PBS, 復水過的胚胎再以3.7%福馬林固定 20 分鐘, 之後以PBT 緩衝液(PBS 含 0.1% Triton X-100) 洗 3 次,每次 5 分鐘;再加入雜合溶液(50% formamide, 5×SSC, 100 g/mL yeast tRNA, 50 g/mL heparin, 100 g/mL herring sperm DNA, 0.1% Tween 20)及合成 RNA 探針後,於 65℃ 的溫箱進行雜合反應16 小時,反應完成後依 序以雜合溶液及PBT 清洗胚胎,每次清洗 20 分鐘,最後再將在PBT 中的胚胎冷卻至室溫, 加入稀釋成1:2000 之 Dig-AP 偶合抗體(Roche Applied Science),進行反應 2 小時,後以 PBT 清洗 4 次,每次 20 分鐘;最後加入 AP 緩衝 液及NBP/BCIP 呈色,以顯微照相紀錄結果。 轉殖果蠅及加強子確認 為鑑定控制 acer 在心臟表現的加強子, 涵蓋acer 基因的不同區域的 DNA 片斷由下列 的 引 子 對 以 PCR 放 大 : En1-5: 5’-TAAAGTTATATGCTCGTGCG-3’; En1-3: 5’-AAGTGCACCGAAATTAGGTA-3’; En2-5: 5’-AACTGGCTTGGTATTGGCGG-3’; En2-3:
5’-AGAAGCCGCAGTTCCATTGC-3’; En3-5: 5’-TTGAAAAGCTCCTCCGTTCA-3’; En3-3: 5’-ATCGAATTACGCACGAGCAT-3’,放大的 DNA 片段分別命名為 EN1 (-188 至 1211), EN2 (963 至 2362)及 EN3 (-2024 至-160)(詳見圖 2A), 並以pCR™II 載體(Invitrogen Co.)進行選殖後 定序確認,DNA 片段再次以限制酵素 KpnI 及 XbaI 切下,選殖於 pH-Stinger 轉殖載體(Barolo et al., 2004),並用於果蠅轉殖,轉殖果蠅步驟 根據前人報告進行(Spradling and Rubin, 1982), 轉殖果蠅品系建立後,收集胚胎,於雷射掃描 共軛焦顯微鏡(Leica SP2, Leica Co.)下觀察紀 錄。
染色體免疫沈澱
tinman cDNA (clone RE01329)由果蠅基 因 體 資 源 中 心 取 得 , 以 下 列 引 子 放 大 : 5’-CACCATGTTGCAGCACCATCAGCAG-3’; 5’-CATGTGCTGCATCTGTTGCTG-3’。 放大 之 DNA 片 段 選 殖 於 pENTR-Topo 載 體 (Invitrogen Co.) 後 定 序 確 認 , 後 再 次 利 用 Gateway 系統選殖於含 Flag 片段的 pAWF 表 現載體。 Schneider 2 (S2)細胞培養於果蠅 M3 昆蟲 培 養 基 中 , 並 加 10% 熱 處 理 過 的 FBS (GibcoCo.),S2 細胞培養至 1×106/mL 於不含 血 清 的 培 養 基 中 , 以 Fugene 試 劑 (Roche Applied Science)依廠商提供方法轉染表現載 體,轉染 S2 細胞持續培養 16-24 小時後,以 Easy ChIP 套組(Upstate Millipore Co.)依前人 步 驟 稍 作 修 改 進 行 染 色 質 免 疫 沈 澱 分 析 Chromatin Immunoprecipitation (ChIP) Assay) (Das et al., 2004),簡述步驟如下:S2 細胞以 1%的甲醛固定 10 分鐘後以 0.125 M 的 glycine 停止反應,以 1×PBS 清洗並收集細胞,並以 差異離心方式取得細胞核,並回溶於 Nuclei lysis 溶液,保持樣品於冰上進行超音波震碎染 色質,樣品以Flag M2 抗體進行免疫沈澱反應 後(Sigma),tin 蛋白結合的 DNA 片段,以聚 合酶鏈鎖反應(PCR)及下列引子對放大偵測: Acer 1-5: 5’-TAAAGTTATATGCTCGTGCG-3’; Acer 1-2-3: 5’-TGCATTATCGGCGGGTTAGC -3’; Acer 2-5: 5’-AACTGGCTTGGTATTGGCG G-3’; Acer 1-3: 5’-AAGTGCACCGAAATTAG GTA-3’。 S2 細胞培養及報導基因表現測定 acer 基因加強子序列上的二個 tin 蛋白質 結 合 位 點 序 列 , 以 體 外 突 變 套 組(in vitro
mutagenesis kit, Stratagene, La Jolla, CA)及下 列 引 子 對 進 行 序 列 突 變 : T1m-S : 5’-ATTGTATCATTCTACCAGGAACCGTTT TTTATAA-3’; T1m-A : 5’-TTATAAAAAACG GTTCCTGGTAGAATGATACAAT-3’; T2m-S: 5’- AGAAATAGCTTATCCCAGGGACATTT ATCTGTGG-3’and T2m-A: 5’-CCACAGATA AATGTCCCTGGGATAAGCTATTTCT-3’( 劃 底線部分為更改過之突變序列),原野生型正 常 之 加 強 子 (T1+T2)及突變加強子(T1m+ T2m),以 KpnI 及 XhoI 限制酵素切割,並建 構入 pGL3 Firefly Luciferase 報導載體中 (Promega Co.)。建構好的 pGL3 報導載體、tin 表現質體及 Act5C-Relina Luciferase 共轉染 入S2 細胞,於 25℃培養 48 小時後,以冷光 酶分析套組進行加強子活性試驗(Promega Co.),雙冷光酶活性以冷光儀(Promega Co.) 測 定 。Firefly Luciferase 的 活 性 以 Relina Luciferase 的活性進行標準化,每次實驗以雙 樣 品 進 行 , 實 驗 重 複 進 行 三 次 , 數 據 以 Student’s t test 統計分析。
結果與討論
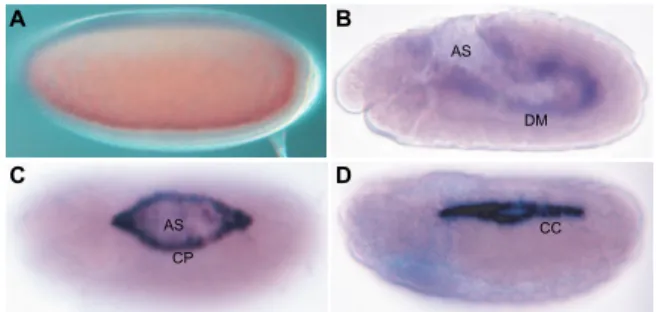
Acer 基因在胚胎時表現心臟新生的細胞中 前人研究顯示 acer 突變果蠅胚胎,心臟 細胞會有缺失的性狀(Crackower et al., 2002), 顯見acer 為果蠅心臟發育所需,然 acer 是否 表現於心臟或其在胚胎發育時期表現的型態 並不清楚,為了解 acer 在果蠅胚胎時期表現 的動態樣式,我們進行原位雜合反應,如圖一 所示,acer mRNA 可在剛下的卵中偵測到, 顯見其為一母源基因(圖 1A),acer mRNA 在 胚胎發育的早期很快就消失,直到胚胎發育第 十一期時 acer 則開始表現在羊漿胚膜及背部 中胚層(圖 1B),上述的表現型態持續到胚胎發 育第十四期(圖 1C),這時羊漿胚膜隨發育進程 而逐漸消失,acer 表現在心臟先驅細胞時更為 明顯(圖 1C),在胚胎發育第十五期以後到晚期 acer 則僅限在心肌細胞中表現(圖 1D),此時 前後端兩排心肌的細胞在背部中線互相接合 形成背血管,值得注意的是 acer 僅表現在心 肌細胞而非圍心細胞(pericardial cells),且每個 體節每側僅四個心肌細胞有表現 acer mRNA (圖 1D),由上述原位雜合結果,摒除 acer 在 新生卵中及羊漿胚膜細胞的表現外,acer 在胚 胎發育中期,表現於未來為心臟細胞形成的背 部中胚層(圖 1B),且在中晚期表現在心臟先驅 細胞及心肌細胞(圖 1C, D)的動態表現型態,圖一、Acer 在果蠅在胚胎發育時期的表現樣式: (A) acer 表現在剛產下的卵中;(B)胚胎發育第十一 期時acer 表現在羊漿胚膜及背部中胚層;(C)胚胎 發育第十四期時 acer 表現在羊漿胚膜及心臟先驅 細胞;(D)胚胎發育第十六期 acer 僅在心肌細胞中 表現。AS,羊漿胚膜細胞;DM,背部中胚層;CP, 心臟先驅細胞;CC,心肌細胞。
Figure 1. The dynamic expression pattern of acer during embryogenesis: (A)acer is expressed in fresh laid eggs; (B) acer is expressed in aminoserosa and dorsal mesoderm at stage 11; (C) acer is expressed in aminoserosa and cardial precursors at stage 14; (D) acer is restricted in cardial cells at stage 16. AS, aminoserosa; DM,dorsal mesoderm; CP, cardial precursor; CC, cardial cell.
可推測 acer 在果蠅心臟發育有一定的功能, 由於 acer 突變果蠅有心臟細胞缺失的性狀 (Crackower et al., 2002),更可推論 acer 在果蠅 心 臟 發 育 的 功 能 為 自 發 性 的 (cell autonomous)。 確認acer 心臟特異表現加強子 為進一步了解acer 表現於心肌細胞的調 控機制,我們以轉殖果蠅確認 acer 心臟特異 表現加強子。涵蓋 acer 基因上游及內插子 (intron)可能具備調控序列的 DNA 片段,分別 以 PCR 的方式放大,並選殖於轉殖載體,由 於轉殖載體在下游處含水母綠螢光蛋白基因, 因此加強子活性均可籍綠螢光蛋白的表現呈 現出來。 利用上述的分析方法,我們找到一DNA 片段可控制綠螢光蛋白於果蠅胚胎發育時期 表現在心臟相關的組織細胞中(EN1, 圖 2),這 一段DNA 包含 acer 基因上游(-188)到第二內 插子(intron, +1211)的部分(圖 2A)。由綠螢光 蛋白表現分析顯示,這段具加強子活性 的 DNA 在胚胎發育第十一期開始將綠螢光蛋白 表現於羊漿胚膜細胞(圖 2B),到胚胎發育第十 四期綠螢光蛋白同時表現於羊漿胚膜及心臟 先驅細胞上述的表現型態持續(圖 2C),在胚胎 發育第十五期,綠螢光蛋白表現在少數零星未
圖二、acer 心臟特異表現加強子:(A) acer 基因結 構,方格為外顯子,灰色區塊為開放譯讀區,EN1、 EN2 及 EN3 DNA 片段用以測試加強子活性,EN1 (-188 至+1211)具心臟特異表現加強子活性,三角 形標示tin 蛋白質結合位點 T1及T2;(B)胚胎發育 第十一期綠螢光蛋白表現於羊漿胚膜細胞;(C)胚 胎發育第十四期綠螢光蛋白同時表現於羊漿胚膜 及少數心臟先驅細胞;(D)胚胎發育第十五期綠螢 光蛋白表現在未退化完全的羊漿胚膜細胞及心肌 細胞中;(E)胚胎發育第十六期綠螢光蛋白表現在 心肌細胞。
Figure 2. acer heart specific enhancer: (A) The genomic structure of acer gene. The exon is depicted in box. Open reading frame is shaded. EN1, EN2 and EN3 are DNA fragments that used to test the heart specific enhancer activity. EN1 DNA (-188 to +1211) contains heart specific enhancer activity, tin binding sites (T1 and T2) are marked with open arrow
heads; (B) The reporter gene, green fluorescent protein (GFP), is expressed in aminoserosa at stage 11; (C) At stage 14, GFP is expressed in aminoserosa and few cardial precursors; (D) GFP is expressed in cardial cells and un-degenerated aminoserosa at stage 15; (E) GFP is expressed in cardial cells at stage 16. 退化完全的羊漿胚膜細胞外,綠螢光蛋白大量 表現在心肌細胞中(圖 2D),在胚胎發育第十六 期,報導綠螢光蛋白在心肌細胞中的表現更明 顯(圖 2E),可很清楚看到每側背血管在每一體 節中有四顆心肌細胞表現報導綠螢光蛋白(圖 2E),由於這段 DNA 片段在胚胎發育的不同時 期,可將報導綠螢光蛋白表現於心臟相關組織 細胞中,我們將這段 EN1 DNA 定名為 acer 心臟特異表現加強子(acer heart enhancer)。
值得注意的是acer 心臟特異表現加強子, 驅動綠螢光蛋白表現的樣式,與原位雜合實驗 結果在心臟相關組織細胞雖大部分相同(圖 1A-D 及圖 2B-E),但在胚胎發育第十一期時 綠螢光蛋白在背部中胚層的表現不明顯(圖 1A, 2B),推測驅動基因表現在背部中胚層的 A B C D AS AS DM CP CC E B C D -188 1211 T1 T2 A 963 2362 -2024 -160 EN1 EN3 EN2
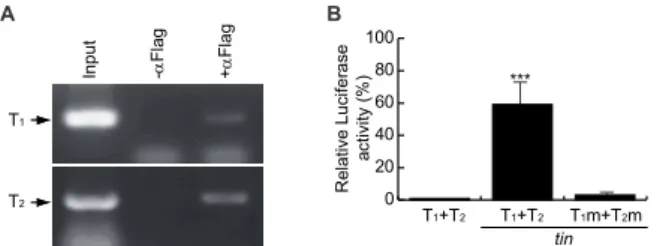
加強子位在此片段之外,此外,這段心臟特異 表現加強子並無法使綠螢光蛋白表現在剛下 的卵中,顯然驅動 acer 在卵中表現的母源基 因加強子在其他位置。 acer 基因表現受 tin 蛋白直接調控 我們發現 acer 基因在胚胎發育時的動態 表現樣式,與tin 基因表現有高度的重疊,如 二者皆在胚胎發育第十一期表現在背部中胚 層,在胚胎發育第十四期後二者皆表現在心臟 先驅細胞中,更明顯的是在第十六期心臟發育 完成後,acer 僅表現在每體節中的四顆表現 tin 的心肌細胞中(圖 1A-D),上述的表現樣式比 對更讓我們相信acer 與 tin 基因應有上下游的 作用關係,分析 acer 心臟特異表現加強子 DNA 序列,我們發現有二個 tin 蛋白可能結合 位點(T1, 5’-CACTTAA-3’; T2, 5’-CACTTGA -3; 圖 2A)。由於 tin 為轉錄蛋白質,若其可與 acer 心臟特異表現加強子 DNA 結合,即可推 論tin 作用於 acer 基因上游,為証實上述推論, 我們進行染色體免疫沈澱分析,由圖三 A 結 果顯示,在 S2 細胞中 tin 蛋白確實可結合至 acer 心臟特異表現加強子中 T1 及 T2 的位置 (圖 3A)。 為進一步証實tin 可調控 acer 的表現,我 們測試acer 心臟特異表現加強子是否會因 tin 基因的表現而驅動Firefly Luciferase 報導基因 的表現,由圖三 B 結果顯示,含 T1 及 T2 序 列的心臟特異表現加強子單獨轉染至S2 細胞 中時,並無法驅動Firefly Luciferase 報導基因 的表現(T1+T2),但在共同轉染 tin 表現載體時 則可增加Firefly Luciferase 活性達 59 倍之多 (圖 3B)。由序列分析,我們發現 acer 基因靠 近轉錄起始有一TATA box 序位在-132 的位置, 推測此為acer 基因的啟動子 (promoter),由於 acer 心臟特異表現加強子已包含這段啟動子 序列,但由上述基因表現活性分析的結果顯示 (圖 3B) ,在沒有 tin 表現的情況下,報導基因 僅有基本的(basal)活性,然而在 tin 共表現的 情況下,報導基因的表現則非常顯著地增加 (圖 3B) 。此外,我們利用體外突變技術,將 tin 蛋白結合位點序列改變 (詳見材料與方法, T1m, 5’-CCAGGAA-3’; T2m, 5’-CCAGGGA -3’),此突變加強子(T1m + T2m)無法如正常加 強子在S2 細胞中回應 tin 的表現而表現(圖 3B), 基於上述結果,我們認為tin 可直接調控 acer 基因在果心臟細胞的表現,換言之,tin 為 acer 上游的作用基因。
圖三、tin 直接調控 acer 基因表現:(A) 染色體免 疫沈澱分析顯示tin 與 acer 心臟特異加強子結合; (B) 相對 acer 心臟特異表現加強子活性分析,正常 加強子活在無 tin 表現時設為 1,數值為三次實驗 所得平均,且以平均值±標準差表示,並以Student’s t test 統計分析, ***, p < 0.001。
Figure 3. tin regulates the expression of acer directly: (A) tin binds to the acer heart enhancer specifically in vivo as assessed by ChIP assays; (B) Relative activity of acer heart enhancer was analyzed. The activity of acer heart enhancer was set to 1 when tin is not co-expressed. The assay was repeated trice with duplicated samples. Data were analyzed with Student’s t test, and present as average ± sd. ***, p < 0.001.
在本 研究中我們 釐清果蠅胚 胎發育時 acer 在心臟相關組織細胞中的表現樣式,顯見 acer 在心臟發育有一定的功能,的確心臟細胞 缺失的性狀可在 acer 突變果蠅胚胎中觀察到 (Crackower et al., 2002),但值得注意的是,acer 為哺乳類ACE2 的同源基因,而 ACE2 對哺乳 類心臟發育沒有作用,由ACE2 基因剔除鼠的 研究顯示,ACE2 功能缺失時小鼠血中 Ang I 濃度上升,且心臟收縮功能降低,顯見ACE2 為 維 持 小 鼠 正 常 心 臟 生 理 功 能 所 需 (Crackower et al., 2002),據此推論,可能 ACE2 在脊椎及無脊椎動物功能不同,另一可能則是 acer 除具果蠅心臟發育功能外,或許也可調控 成體果蠅心臟生理功能,的確,利用核酸干擾 技術,我們發現降低 acer 的表現,可影響成 體果蠅心臟的收縮性,且降低心臟功能及果蠅 壽命(另稿審查中),據此我們認為 ACE2 對心 臟生理功能是保守的。 由上述討論,雖然我們認為果蠅 acer 與 脊椎動物 ACE2 同具調節心臟收縮之生理功 能,但兩者之生理作用方式可能不盡相同。以 血壓調控為例,在脊椎動物中ACE2 是藉由其 胜肽酶活性將 Ang I 或 Ang II 水解轉換成 Ang(1-7),由於 Ang II 俱血管收縮增高血壓功 能,ACE2 的作用可有效降低血中 Ang II 含量, 因之造成血管舒張且降低血壓。果蠅 ACER 蛋白雖具ACE2 相同的胜肽酶活性,但果蠅基 因體中並未含 ACER 蛋白的受質基因-血管收 T1 T2 - F la g + F la g In pu t tin T1+T2 T1m+T2m T1+T2 R el at iv e Lu ci fe ra se ac tiv ity ( % ) 0 20 40 60 80 100 *** A B
縮素原,據此而言,我們可推論,果蠅可能沒 有如脊椎動物般,利用血管收縮素代謝來調控 血壓的系統,又或血壓的調控對果蠅生理功能 並不特別重要,因為相對於哺乳動物的封閉式 循環系統,心壓的高低對心臟的功能有直接的 影響,且體內各臟器藉由血管與心臟連接,血 壓也會影響這些臟器的生理功能,而果蠅循環 系統為開放式,其血淋巴細胞(haemolymph cells)從體腔由竇口(ostium)進入背血管後,受 心肌細胞收縮作用,將血淋巴再次由背血管前 端開口排入體腔完成循環作用,雖然當心肌細 胞收縮時,血淋巴細胞及體液會對背血管管壁 有相對的作用力,但因為果蠅是開放式循環系 統,其作用力在背血管管壁不僅相對較小也無 法維持,且浸泡在血淋巴及體液中的各臟器, 只要體腔中體液的總體積不改變,其感受到的 壓力即為恆定,換言之,就果蠅而言血壓可能 不具調節臟器生理的功能。 原位雜合實驗中我們發現 acer 信息核酸 主要表現在心臟相關細胞中(圖 1A-D),但由 其胺基酸序列分析顯示其蛋白質 N 端含訊息 胜肽(Coates et al., 2000),據此推論 ACER 為 分泌性或細胞膜上蛋白質,換句話說,ACER 除了可作用在心肌相關細胞外,也可能具非自 發性的(nonautonomous)功能,作用在其他組織 細胞中。例如,在成體果蠅中 ACER 可表現 在大腦及腹部脂肪體細胞,並分泌至血淋巴組 成的體液中(Carhan et al., 2011)。研究發現 ACER 突變果蠅有夜間睡眠時間減少及片斷 化的性狀(Carhan et al., 2011),由於果蠅控制 日 夜 周 期 的 主 要 細 胞 為 側 腹 神 經 元(lateral ventral neurons) (Helfrich-Forster, 1998; Blanchardon et al., 2001),推論 ACER 可能籍 由其胜肽酶活性切割具調控代謝及活動能力 的蛋白質(Carhan et al., 2011)。至於 ACER 蛋 白是否位於細胞膜上,目前並不清楚,但其哺 乳類同源蛋白 ACE2 被証實可表現在細胞膜 上 , 並 為 嚴 重 急 性 呼 吸 系 統 綜 合 症(Severe acute respiratory syndrome, SARS)病毒進入細 胞之受體(Prabakaran et al., 2004; Turner et al., 2004; Guy et al., 2005b)。
誌 謝
本 研 究 為 國 科 會 經 費 補 助(95-2311-B- 003-006-MY2; 96-2311-B-003-005) , 並 感 謝 Bloomington Drosophila stock center 及 Drosophila genome resource center 提供果蠅品
系及cDNA,另感謝國立台灣師範大學貴重儀 器中心-分子影像核心實驗室,協助顯微影像 的取得。
參考文獻
Barolo S, Castro B, Posakony JW (2004) New Drosophila transgenic reporters: insulated P-element vectors expressing fast-maturing RFP. Biotechniques 36:436-440, 442. Blanchardon E, Grima B, Klarsfeld A, Chelot E,
Hardin PE, Preat T, Rouyer F (2001) Defining the role of Drosophila lateral neurons in the control of circadian rhythms in motor activity and eclosion by targeted genetic ablation and PERIOD protein overexpression. The European journal of neuroscience 13:871-888.
Brooks DR, Appleford PJ, Murray L, Isaac RE (2003) An essential role in molting and morphogenesis of Caenorhabditis elegans for ACN-1, a novel member of the angiotensin-converting enzyme family that lacks a metallopeptidase active site. J Biol Chem 278:52340-52346.
Burrell LM, Johnston CI, Tikellis C, Cooper ME (2004) ACE2, a new regulator of the renin-angiotensin system. Trends Endocrinol Metab 15:166-169.
Carhan A, Tang K, Shirras CA, Shirras AD, Isaac RE (2011) Loss of Angiotensin- converting enzyme-related (ACER) peptidase disrupts night-time sleep in adult Drosophila melanogaster. J Exp Biol 214:680-686.
Coates D, Isaac RE, Cotton J, Siviter R, Williams TA, Shirras A, Corvol P, Dive V (2000) Functional conservation of the active sites of human and Drosophila angiotensin I-converting enzyme. Biochemistry 39:8963-8969.
Crackower MA, Sarao R, Oudit GY, Yagil C, Kozieradzki I, Scanga SE, Oliveira-dos- Santos AJ, da Costa J, Zhang L, Pei Y, Scholey J, Ferrario CM, Manoukian AS, Chappell MC, Backx PH, Yagil Y, Penninger JM (2002) Angiotensin- converting enzyme 2 is an essential regulator of heart function. Nature 417:822-828.
Das PM, Ramachandran K, vanWert J, Singal R (2004) Chromatin immunoprecipitation assay. Biotechniques 37:961-969.
Donoghue M, Hsieh F, Baronas E, Godbout K, Gosselin M, Stagliano N, Donovan M, Woolf B, Robison K, Jeyaseelan R, Breitbart RE, Acton S (2000) A novel angiotensin-converting enzyme-related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1-9. Circ Res 87:E1-9.
Ferrario CM, Jessup J, Chappell MC, Averill DB, Brosnihan KB, Tallant EA, Diz DI, Gallagher PE (2005a) Effect of angiotensin-converting enzyme inhibition and angiotensin II receptor blockers on cardiac angiotensin-converting enzyme 2. Circulation 111:2605-2610.
Ferrario CM, Jessup J, Gallagher PE, Averill DB, Brosnihan KB, Ann Tallant E, Smith RD, Chappell MC (2005b) Effects of renin-angiotensin system blockade on renal angiotensin-(1-7) forming enzymes and receptors. Kidney Int 68:2189-2196.
Ferreira AJ, Santos RA (2005) Cardiovascular actions of angiotensin-(1-7). Braz J Med Biol Res 38:499-507.
Guy JL, Jackson RM, Jensen HA, Hooper NM, Turner AJ (2005a) Identification of critical active-site residues in angiotensin- converting enzyme-2 (ACE2) by site-directed mutagenesis. Febs J 272:3512-3520.
Guy JL, Lambert DW, Warner FJ, Hooper NM, Turner AJ (2005b) Membrane-associated zinc peptidase families: comparing ACE and ACE2. Biochim Biophys Acta 1751:2-8.
Helfrich-Forster C (1998) Robust circadian rhythmicity of Drosophila melanogaster requires the presence of lateral neurons: a brain-behavioral study of disconnected mutants. Journal of comparative physiology A, Sensory, neural, and behavioral physiology 182:435-453.
Houard X, Williams TA, Michaud A, Dani P, Isaac RE, Shirras AD, Coates D, Corvol P (1998) The Drosophila melanogaster- related angiotensin-I-converting enzymes Acer and Ance--distinct enzymic characteristics and alternative expression during pupal development. Eur J Biochem 257:599-606.
Huang X, Huang P, Robinson MK, Stern MJ, Jin Y (2003) UNC-71, a disintegrin and metalloprotease (ADAM) protein, regulates
motor axon guidance and sex myoblast migration in C. elegans. Development 130:3147-3161.
Hurst D, Rylett CM, Isaac RE, Shirras AD (2003) The Drosophila angiotensin-converting enzyme homologue Ance is required for spermiogenesis. Dev Biol 254:238-247. Isaac RE, Siviter RJ, Stancombe P, Coates D,
Shirras AD (2000) Conserved roles for peptidases in the processing of invertebrate neuropeptides. Biochem Soc Trans 28:460-464.
Karram T, Abbasi A, Keidar S, Golomb E, Hochberg I, Winaver J, Hoffman A, Abassi Z (2005) Effects of spironolactone and eprosartan on cardiac remodeling and angiotensin-converting enzyme isoforms in rats with experimental heart failure. Am J Physiol Heart Circ Physiol 289:H1351-1358.
Keidar S, Kaplan M, Gamliel-Lazarovich A (2007) ACE2 of the heart: From angiotensin I to angiotensin (1-7). Cardiovascular research 73:463-469.
Keidar S, Gamliel-Lazarovich A, Kaplan M, Pavlotzky E, Hamoud S, Hayek T, Karry R, Abassi Z (2005) Mineralocorticoid receptor blocker increases angiotensin-converting enzyme 2 activity in congestive heart failure patients. Circ Res 97:946-953.
Kim HM, Shin DR, Yoo OJ, Lee H, Lee JO (2003) Crystal structure of Drosophila angiotensin I-converting enzyme bound to captopril and lisinopril. FEBS Lett 538:65-70.
Kurdi M, De Mello WC, Booz GW (2005) Working outside the system: an update on the unconventional behavior of the renin-angiotensin system components. Int J Biochem Cell Biol 37:1357-1367.
Leckie BJ (2005) Targeting the renin- angiotensin system: what's new? Curr Med Chem Cardiovasc Hematol Agents 3:23-32. Prabakaran P, Xiao X, Dimitrov DS (2004) A
model of the ACE2 structure and function as a SARS-CoV receptor. Biochem Biophys Res Commun 314:235-241.
Quan GX, Mita K, Okano K, Shimada T, Ugajin N, Xia Z, Goto N, Kanke E, Kawasaki H (2001) Isolation and expression of the
ecdysteroid-inducible angiotensin- converting enzyme-related gene in wing
Biol 31:97-103.
Riviere G, Michaud A, Breton C, VanCamp G, Laborie C, Enache M, Lesage J, Deloof S, Corvol P, Vieau D (2005) Angiotensin- converting enzyme 2 (ACE2) and ACE activities display tissue-specific sensitivity to undernutrition-programmed hypertension in the adult rat. Hypertension 46:1169-1174.
Siviter RJ, Taylor CA, Cottam DM, Denton A, Dani MP, Milner MJ, Shirras AD, Isaac RE (2002) Ance, a Drosophila angiotensin-converting enzyme homologue, is expressed in imaginal cells during metamorphosis and is regulated by the steroid, 20-hydroxyecdysone. Biochem J 367:187-193.
Spradling AC, Rubin GM (1982) Transposition of cloned P elements into Drosophila germ line chromosomes. Science 218:341-347. Su MT, Golden K, Bodmer R (1998) X-gal
staining of Drosophila embryos compatible with antibody staining or in situ hybridization. Biotechniques 24:918-920, 922.
Taylor CA, Coates D, Shirras AD (1996) The Acer gene of Drosophila codes for an angiotensin-converting enzyme homologue. Gene 181:191-197.
Turner AJ, Hiscox JA, Hooper NM (2004) ACE2: from vasopeptidase to SARS virus receptor. Trends Pharmacol Sci 25:291-294.
Williams TA, Michaud A, Houard X, Chauvet MT, Soubrier F, Corvol P (1996) Drosophila melanogaster angiotensin I-converting enzyme expressed in Pichia pastoris resembles the C domain of the mammalian homologue and does not require glycosylation for secretion and enzymic activity. Biochem J 318 ( Pt 1):125-131.
*Corresponding author: Ming-Tsan Su; FAX: 886-2-29312904; E-mail: mtsu@ntnu.edu.tw
The Expression of
Angiotensin Converting Enzyme-related Gene Is
Controlled by tinman Directly
Fang-Tsu Liao, Huan-Wen Lin, Jing-Yu Lee, Ming-Tsan Su*
Department of Life Science, National Taiwan Normal University Taipei, Taiwan
(Received: 28 April 2013, accepted: 10 May 2013) ABATRACT
Angiotensin converting enzyme-related (acer) is a Drosophila homolog of mammalian angiotensin converting enzyme 2 (ACE2). Both ACER and ACE2 exhibit similar enzymatic activity. To better understanding the developmental function of acer in Drosophila, we have characterized the dynamic expression patterns of acer during embryogenesis. We find that acer is a maternal gene as its mRNA can be detected in fresh laid eggs. During early embryogenesis, the expression of acer is absent. The expression of acer is re-appeared in aminoserosa and the dorsal mesoderm at stage 11. At stage 14, acer mRNA is restricted in aminoserosa and cardial precursors. The expression of acer is maintained in cardial cells during late embryogenesis. Additionally, we have characterized a 1.5 kb DNA fragment that confers the cardial-specific expression pattern of acer. The enhancer activity can be modulated by the expression of tinman. Additionally, tin protein can bind to the enhancer in vivo. Based on the above observations, we conclude that tin regulates the expression of acer directly.
Key word: Drosophila, cardial cell, Angiotensin converting enzyme,heart enhancer