國立臺灣大學工學院化學工程研究所 碩士論文
Department of Chemical Engineering College of Engineering
National Taiwan University Master Thesis
離子液體在各類共沸物分離製程之應用
Application of Ionic Liquids in
Separations of Various Azeotropic Systems
陳柏彰 Bo-Zhang Chen
指導教授:錢義隆 博士 Advisor: I-Lung Chien, Ph.D.
中華民國 102 年 7 月
July, 2013
致謝
於這兩年的碩士生涯中,首先要感謝吾師錢義隆教授這兩年細心的指導,感 謝其於研究上不斷地給予方向以及建議,我從中學習到不只是專業上的能力,更 多的是做事上嚴謹的態度。感謝口試委員陳誠亮教授、王國彬教授、李豪業教授 提供的建議與指正,使本論文更趨完善。
感謝士暐、義章、乾元、志耀、瑞元、玉龍、郁迪、惠楚、玠廷平時於研究 上不斷地給予意見以及幫忙。感謝我最好的同伴們,士凱、小魚、馨右、立文、
瑋鈞、則賢、瓜友、穎凱、丰議,謝謝你們平時的相處與鼓勵。感謝學弟妹們,
明龍、崇政、峻維、敬學、耀賢、孔凌、子翔、柏賢,謝謝你們平時的辛勞與付 出。
最後感謝生活中不斷地陪伴著我的黃姵瑀,因為有你的支持與相處,才能使 這兩年變得非常特別。謝謝生我養育我的爸媽,因為有你們我才會在這裡,謝謝 你們。
中文摘要
離子液體於近二十年來快速發展,離子液體可用於共沸物系統之分離,其中 包含萃取蒸餾以及萃取兩大系統,但現今之研究主要著重於前段分離之好處,而 鮮少討論整廠製程之模擬。本研究分成兩大部分,其一,以離子液體[EMIM][Cl]
萃取蒸餾酒精與水系統,並與傳統夾帶劑甘油比較,發現離子液體於萃取蒸餾系 統中即便提升相對揮發度之能力較傳統共沸劑為佳,但因為離子液體幾乎無相對 揮發度之性質,反倒使得分離上會產生高溫與高熱負載,雖然以絕熱低壓驟沸分 離器回收離子液體,於整廠熱負載上較甘油低 9.59%,但因為於萃取蒸餾塔中需使 用燃油作為熱源,較甘油使用之高壓蒸氣成本為高,且在萃取蒸餾系統中因離子 液體回收須達高純度,以低壓蒸餾的方式對於降低高溫的效應不大。其二,以離 子液體[EMIM][EtSO4]萃取 ethyl tert-butyl ether 與酒精系統,並與傳統之變壓蒸餾 製程比較,發現以萃取製程無論在總年成本上與操作成本上皆較傳統之變壓蒸餾 為低,且於萃取系統中離子液體回收純度並不需要太高,因此以低壓蒸餾的方式 回收對於降低塔底溫度及熱負載之效應則較佳。
關鍵字:離子液體、共沸物、分離、萃取蒸餾、萃取
Abstract
Ionic liquids started receiving closer attention in the last two decades. Ionic liquids could be used in separations of azeotropic systems, including extractive distillation and extraction; however, nowadays the research in the open literature mostly focus on the benefits of the preceding separation part, but seldom discuss the entire process design.
This research is divided into two part: first part, separation of ethanol and water by extractive distillation using ionic liquid [EMIM][Cl] as entrainer. Comparing to the conventional entrainer, glycerol, although the ability to increase the relative volatility of [EMIM][Cl] is better than the glycerol, the non-volatility of ionic liquid leads to high temperature and high reboiler duty on the bottom of column. In the process, using adiabatic low pressure flash to separate ionic liquid, and the entire reboiler duty will be lower than glycerol 9.59%, but the reboiler heat source of extractive distillation column should be oil, which is more expensive than the high pressure steam of glycerol case. In extractive distillation system, the recycle ionic liquid should be in high purity, so the effectiveness of using low pressure distillation to decrease the high temperature is not good. Second part, separation of ethyl tert-butyl ether and ethanol by extraction using ionic liquid [EMIM][EtSO4] as solvent. Comparing the extraction to the pressure swing distillation, both of the total annual cost and operation cost of extraction are lower than the pressure swing distillation. On the other hand, the ionic liquid recycle flow could not reach high purity, so the low pressure distillation could decrease the high temperature and high reboiler duty effectively.
Keywords: Ionic liquids, azeotrope, separation, extractive distillation, extraction
目錄
口試委員會審定書 ... II 致謝 ... IV 中文摘要 ... VI Abstract ... VIII 目錄 ... X 圖目錄 ... XIV 表目錄 ... XVIII
第一章 緒論 ... 1
1.1 前言 ... 1
1.2 離子液體之介紹 ... 3
1.3 各類共沸物分離方法之介紹 ... 6
1.3.1 萃取蒸餾(Extractive distillation) ... 6
1.3.2 變壓蒸餾(Pressure swing distillation) ... 7
1.3.3 萃取(Extraction) ... 8
1.4 文獻回顧 ... 11
1.5 研究動機 ... 13
1.6 組織章節 ... 14
第二章 離子液體模型建立 ... 15
2 . 1 前言 ... 15
2 . 2 離子液體模型之建立 ... 15
2.2.1 液相蒸氣壓模型 ... 16
2.2.2 氣相定壓熱容模型與汽化熱模型以得到液相定壓熱容模型 .... 16
2.2.3 黏度模型 ... 17
2.2.4 純成分性質 ... 18
2.3 離子液體模型之參數 ... 19
2.3.1 [EMIM][Cl]之參數 ... 19
2.3.1.1 液相蒸氣壓模型 ... 19
2.3.1.2 氣相定壓熱容模型與汽化熱模型以得到液相定壓熱容模型... 21
2.3.1.3 純成分參數 ... 22
2.3.2 [EMIM][EtSO4]之參數 ... 28
2.3.2.1 液相蒸氣壓模型 ... 28
2.3.2.2 氣相定壓熱容模型與汽化熱模型以得到液相定壓熱容模型... 28
2.3.2.3 純成分參數 ... 29
第三章 萃取蒸餾—酒精與水系統 ... 31
3.1 前言 ... 31
3.2 系統使用之熱力學模式 ... 31
3.3 以傳統共沸劑甘油分離 ... 32
3.3.1 熱力學參數 ... 32
3.3.2 最適化設計 ... 34
3.3.3 熱整合設計 ... 37
3.4 以新式離子液體分離 ... 40
3.4.1 熱力學參數 ... 40
3.4.2 初步穩態模擬設計 ... 45
3.4.3 低壓絕熱驟沸分離器設計 ... 48
3.4.4 最適化分析 ... 51
3.4.4.1 最適化流程 ... 51
3.4.4.2 最適化設計 ... 53
3.4.4.3 熱整合設計 ... 62
3.5 結果與討論 ... 66
第四章 萃取—ETBE 與酒精系統 ... 69
4.1 前言 ... 69
4.2 系統之熱力學模式 ... 69
4.3 以傳統變壓蒸餾分離 ... 70
4.3.1 熱力學參數 ... 70
4.3.2 初步穩態模擬設計 ... 72
4.3.3 最適化分析 ... 76
4.3.3.1 最適化流程 ... 76
4.3.3.2 最適化設計 ... 78
4.3.3.3 熱整合設計 ... 83
4.4 以離子液體萃取分離 ... 85
4.4.1 熱力學參數 ... 85
4.4.1.2 液液平衡參數 ... 85
4.4.1.3 氣液平衡參數 ... 87
4.4.1.3.1 ETBE 與酒精系統 ... 87
4.4.1.3.2 酒精與[EMIM][EtSO4]系統 ... 87
4.4.1.3.3 ETBE 與[EMIM][EtSO4]系統 ... 88
4.4.1.4 熱力學性質探討 ... 93
4.4.2 穩態模擬設計 ... 96
4.4.2.1 設計概念 ... 96
4.4.2.2 初步穩態模擬設計 ... 96
4.4.2.3 以驟沸分離器回收萃取劑之設計 ... 100
4.4.3 最適化分析 ... 102
4.4.3.1 離子液體回收塔之塔壓探討 ... 102
4.4.3.2 酒精產物塔之塔壓探討 ... 107
4.4.3.3 離子液體回收塔之板數探討 ... 112
4.4.3.4 驟沸分離器之設計壓力探討 ... 113
4.4.3.5 最適化流程 ... 115
4.4.3.6 最適化結果 ... 119
4.5 結果與討論 ... 129
第五章 結論 ... 131
命名法 ... 133
參考文獻 ... 135
附錄 總 年 成 本 計 算 公 式 ... 139
作者簡介 ... 143
圖目錄
圖 1- 1 BASILTM製程之反應流程[4] ... 2
圖 1- 2 1-ethyl-3-methylimidazolium chloride 結構式 ... 3
圖 1- 3 質子型與非質子型離子液體於氣液兩相之示意圖[8] ... 5
圖 1- 4 Dong et al.(2013)[9]以模擬驗證離子液體於氣相型態之結果 ... 6
圖 1- 5 萃取蒸餾系統流程圖 ... 7
圖 1- 6 變壓蒸餾流程示意圖 ... 8
圖 1- 7 三成分之液液平衡關係與溫度對兩相區之影響 ... 9
圖 1- 8 同向萃取示意圖 ... 10
圖 1- 9 反向萃取示意圖 ... 11
圖 2- 1 各種離子液體其液相蒸氣壓與溫度之關係 ... 20
圖 2- 2 使用兩種不同蒸氣壓模型之比較 ... 26
圖 2- 3 使用兩種不同蒸氣壓模型與實驗值之比較 ... 27
圖 2- 4 [EMIM][EtSO4]之液相定壓熱容與溫度之關係 ... 29
圖 3- 1 酒精、水與甘油系統中之氣液平衡圖 ... 33
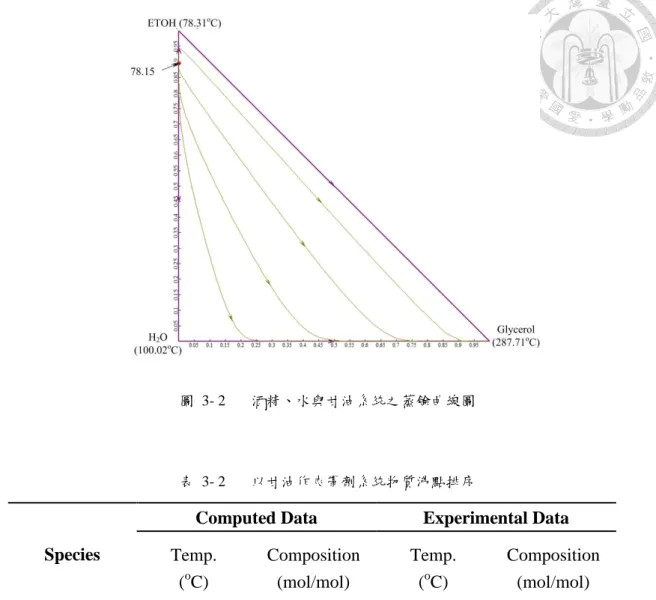
圖 3- 2 酒精、水與甘油系統之蒸餘曲線圖 ... 34
圖 3- 3 以甘油作夾帶劑之最適化結果 ... 36
圖 3- 4 以甘油作夾帶劑之最適化結果加熱整合 ... 39
圖 3- 5 酒精、水與[EMIM][Cl]系統中相對揮發度實驗值與模擬結果比較 41 圖 3- 6 酒精、水與[EMIM][Cl]系統之氣液平衡圖 ... 42
圖 3- 7 酒精、水與[EMIM][Cl]系統之蒸餘曲線圖 ... 43
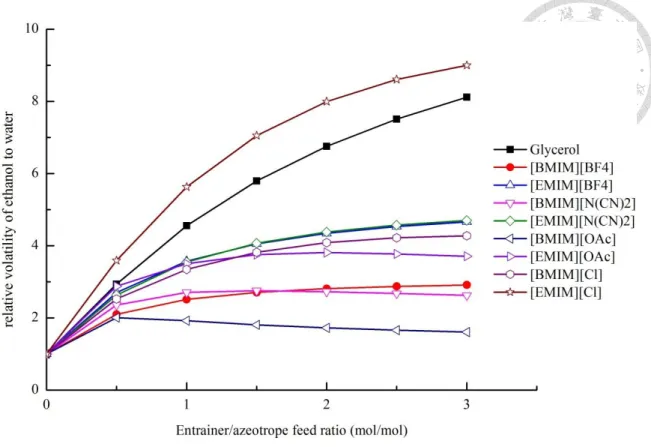
圖 3- 8 不同夾帶劑對酒精與水系統提升相對揮發度之能力比較 ... 44
圖 3- 9 以[EMIM][Cl]做夾帶劑之初步穩態模擬結果 ... 47
圖 3- 10 低壓絕熱驟沸分離器回收設計模擬結果 ... 50
圖 3- 11 酒精、水與[EMIM][Cl]系統之最適化流程圖 ... 52
圖 3- 12 PFlash=0.001 atm,FIL=38 kmol/hr 時之最小再沸器熱負載圖 ... 54
圖 3- 13 PFlash=0.001 atm,FIL=39 kmol/hr 時之最小再沸器熱負載圖 ... 54
圖 3- 14 PFlash=0.001 atm,FIL=40 kmol/hr 時之最小再沸器熱負載圖 ... 54
圖 3- 15 PFlash=0.001 atm,FIL=41 kmol/hr 時之最小再沸器熱負載圖 ... 55
圖 3- 16 PFlash=0.001 atm,FIL=42 kmol/hr 時之最小再沸器熱負載圖 ... 55
圖 3- 17 PFlash=0.001 atm 時之最小再沸器熱負載總圖 ... 55
圖 3- 18 PFlash=0.002 atm,FIL=39 kmol/hr 時之最小再沸器熱負載圖 ... 56
圖 3- 19 PFlash=0.002 atm,FIL=40 kmol/hr 時之最小再沸器熱負載圖 ... 56
圖 3- 20 PFlash=0.002 atm,FIL=40 kmol/hr 時之最小再沸器熱負載圖 ... 56
圖 3- 21 PFlash=0.002 atm,FIL=42 kmol/hr 時之最小再沸器熱負載圖 ... 57
圖 3- 22 PFlash=0.002 atm,FIL=43 kmol/hr 時之最小再沸器熱負載圖 ... 57
圖 3- 23 PFlash=0.002atm 時之最小再沸器熱負載總圖 ... 57
圖 3- 24 酒精、水與[EMIM][Cl]系統之最小再沸器熱負載結果總圖 ... 58
圖 3- 25 以[EMIM][Cl]作夾帶劑最適化結果 ... 59
圖 3- 26 EDC 塔之液相組成分佈 ... 60
圖 3- 27 EDC 塔之氣相組成分佈 ... 60
圖 3- 28 EDC 塔之溫度分佈 ... 60
圖 3- 29 夾帶劑進料溫度對再沸器熱負載之影響 ... 62
圖 3- 30 夾帶劑進料溫度對熱移除之影響 ... 62
圖 3- 31 以[EMIM][Cl]作夾帶劑之最適化結果加上熱整合 ... 65
圖 4- 1 ETBE 與酒精之氣液平衡實驗數據與模擬結果比較圖 ... 71
圖 4- 2 不同壓力 ETBE 與酒精之 Txy 及 XY 圖 ... 73
圖 4- 3 變壓蒸餾初步穩態模擬結果 ... 75
圖 4- 4 壓力變換系統最適化流程 ... 77
圖 4- 5 不同 C2 總板數下之最適化結果 ... 80
圖 4- 6 變壓蒸餾之最適化結果總圖 ... 80
圖 4- 7 變壓蒸餾系統之最適化結果 ... 82
圖 4- 8 理想熱整合之設計 ... 84
圖 4- 9 ETBE、酒精與[EMIM][EtSO4]系統之液液平衡實驗與模擬結果比較 ... 86
圖 4- 10 酒精與[EMIM][EtSO4]之氣液平衡實驗值與模擬值比較 ... 88
圖 4- 11 ETBE、酒精與[EMIM][EtSO4]系統未刪不合理數據回歸之 PseudoXY 圖... 90
圖 4- 12 ETBE、酒精與[EMIM][EtSO4]系統刪除不合理數據回歸之 PseudoXY 圖... 91
圖 4- 13 ETBE、酒精與[EMIM][EtSO4]系統氣液平衡圖 ... 94
圖 4- 14 不同溫度下液液平衡區間之變化 ... 95
圖 4- 15 ETBE、酒精與[EMIM][EtSO4]系統之蒸餘曲線圖 ... 95
圖 4- 16 萃取製程設計概念圖 ... 96
圖 4- 17 萃取分離之初步穩態模擬結果 ... 99
圖 4- 18 以驟沸分離器回收萃取劑之設計 ... 101
圖 4- 19 離子液體回收塔之操作成本與其設計壓力關係 ... 104
圖 4- 20 離子液體回收塔之設備成本與其設計壓力關係 ... 104
圖 4- 21 各單元之年成本與離子液體回收塔設計壓力關係 ... 105
圖 4- 22 整廠製程總年成本與離子液體回收塔設計壓力關係 ... 105
圖 4- 23 離子液體回收塔低壓之設計 ... 106
圖 4- 24 酒精產物塔塔壓改變時最適化 reflux ratio(RR)之結果 ... 108
圖 4- 25 改變酒精產物塔塔壓對總年成本之影響 ... 108
圖 4- 26 ETBE 與酒精降壓後之 Txy 圖 ... 109
圖 4- 27 酒精產物塔常壓之設計 ... 110
圖 4- 28 酒精產物塔低壓之設計 ... 111
圖 4- 29 離子液體回收塔板數與再沸器能耗關係圖 ... 112
圖 4- 30 離子液體回收塔板數與冷凝器能耗關係圖 ... 112
圖 4- 31 離子液體回收塔板數與全系統總年成本關係圖 ... 113
圖 4- 32 驟沸分離器設計壓力與其直徑關係圖 ... 113
圖 4- 33 驟沸分離器設計壓力與其成本關係圖 ... 114
圖 4- 34 改變驟沸分離器設計壓力與全系統總成本關係圖 ... 114
圖 4- 35 XETBE與 XETBE out之位置示意圖 ... 116
圖 4- 36 萃取系統最適化流程圖 ... 118
圖 4- 37 萃取系統不同進料比時最適化結果 ... 124
圖 4- 38 萃取系統最適化結果總圖 ... 125
圖 4- 39 萃取系統最適化結果 ... 126
圖 4- 40 ILC 塔之液相組成分佈 ... 127
圖 4- 41 ILC 塔之氣相組成分佈 ... 127
圖 4- 42 ILC 塔之溫度分佈 ... 127
表目錄
表 1- 1 離子液體中常見的陰陽離子 ... 4
表 1- 2 可作為酒精與水系統夾帶劑之離子液體 ... 12
表 1- 3 可作為 ETBE 與酒精系統萃取劑之離子液體 ... 13
表 2- 1 各種離子液體之平均液相蒸氣壓 ... 21
表 2- 2 [EMIM][Cl]之 Cp 計算參數 ... 22
表 2- 3 Valderrama and Rojas 基團貢獻法各基團數值 ... 23
表 2- 4 Valderrama and Rojas 基團貢獻法計算式 ... 24
表 2- 5 [EMIM][Cl]之純成分參數 ... 28
表 2- 6 [EMIM][EtSO4]之純成分參數 ... 29
表 3- 1 酒精、水與甘油系統的 NRTL 參數 ... 32
表 3- 2 以甘油作夾帶劑系統物質沸點排序 ... 34
表 3- 3 再製 Gil et al.(2012)之最適化穩態模擬結果 ... 35
表 3- 4 有無熱整合設計之能耗比較 ... 37
表 3- 5 再製 Gil et al.(2012)之最適化穩態模擬結果加上熱整合設計 ... 38
表 3- 6 酒精、水與[EMIM][Cl]系統的 NRTL 參數 ... 41
表 3- 7 以甘油作夾帶劑系統物質沸點排序 ... 43
表 3- 8 以不同夾帶劑之初步穩態模擬結果比較 ... 46
表 3- 9 以[EMIM][Cl]做夾帶劑之初步穩態模擬結果 ... 46
表 3- 10 以不同分離架構之結果比較 ... 48
表 3- 11 以驟沸分離器分離之穩態模擬結果 ... 49
表 3- 12 以[EMIM][Cl]作夾帶劑之最適化結果 ... 61
表 3- 13 以不同夾帶劑之最適化結果比較 ... 61
表 3- 14 以[EMIM][Cl]作夾帶劑之最適化結果加上熱整合 ... 64
表 3- 15 有無熱整合設計之能耗比較 ... 64
表 3- 16 以不同夾帶劑之能耗比較 ... 66
表 4- 1 酒精與 ETBE 的 NRTL 參數 ... 70
表 4- 2 變壓蒸餾系統物質沸點排序 ... 70
表 4- 3 不同壓力下之共沸組成及蒸氣選擇 ... 72
表 4- 4 變壓蒸餾系統之初步穩態模擬結果 ... 74
表 4- 5 C2 總板數為 14 板時之最適化結果 ... 78
表 4- 6 C2 總板數為 15 板時之最適化結果 ... 78
表 4- 7 C2 總板數為 16 板時之最適化結果 ... 79
表 4- 8 C2 總板數為 17 板時之最適化結果 ... 79
表 4- 9 C2 總板數為 18 板時之最適化結果 ... 79
表 4- 10 變壓蒸餾系統之最適化結果 ... 81
表 4- 11 有無熱整合設計之能耗比較 ... 83
表 4- 12 ETBE、酒精與[EMIM][EtSO4]的液液平衡 NRTL 參數 ... 86
表 4- 13 酒精與[EMIM][EtSO4]的氣液平衡 NRTL 參數 ... 87
表 4- 14 回歸出之 NRTL 參數與文獻值比較 ... 92
表 4- 15 不同 NRTL 參數 RMSD 與實驗值之比較 ... 93
表 4- 16 ETBE、酒精與[EMIM][EtSO4]的氣液平衡 NRTL 參數 ... 93
表 4- 17 萃取系統物質沸點排序 ... 93
表 4- 18 有無驟沸分離器回收萃取劑之比較 ... 100
表 4- 19 最適化過程中 ETBE 產物流所產生之三種型態 ... 116
表 4- 20 FIL=20 kmol/hr 時可行之最適化區間範圍 ... 119
表 4- 21 FIL=20 kmol/hr 時之最適化結果 ... 119
表 4- 22 FIL=30 kmol/hr 時可行之最適化區間範圍 ... 120
表 4- 23 FIL=30 kmol/hr 時之最適化結果 ... 120
表 4- 24 F =40 kmol/hr 時可行之最適化區間範圍 ... 121
表 4- 25 FIL=40 kmol/hr 時之最適化結果 ... 121
表 4- 26 FIL=50 kmol/hr 時可行之最適化區間範圍 ... 122
表 4- 27 FIL=50 kmol/hr 時之最適化結果 ... 122
表 4- 28 FIL=60 kmol/hr 時可行之最適化區間範圍 ... 123
表 4- 29 FIL=60 kmol/hr 時最適化結果 ... 123
表 4- 30 萃取系統最適化結果總表 ... 125
表 4- 31 萃取系統之最適化結果 ... 128
表 4- 32 以變壓蒸餾及萃取方式分離之總年成本比較 ... 129
表 4- 33 以變壓蒸餾熱整合及萃取方式操作成本比較 ... 129
第一章 緒論
1.1 前言
近年來於化學工業中,環保及節能減碳愈來愈受重視,而往往於工業中製備 產品,在反應器下游除了產物外還有許多不純物產生,或產生互溶之混合流,此 混合流需經過分離程序始得再利用。在許多情況下混合流中會形成共沸物,無法 以 普 通 蒸餾 之 方 法分離 , 於 工業 上 分 離共沸 物 之 方法 如 萃 取蒸餾 (Extractive distillation)、變壓蒸餾(Pressure swing distillation)、萃取(Liquid-liquid extraction )、
膜分離(membrane separation)、吸附(adsorption)等被大量使用在分離共沸物系統。
其中萃取蒸餾為最常分離共沸物之方法,因其能以氣液平衡之方式有效分離且能 適應於許多系統,唯其需要以熱負載為驅動力使之達氣液平衡分離,因此於能耗 上仍需要一定量之消耗。萃取之方式以物質間之液液平衡分離,因此在共沸物之 分離上並不需要提供熱負載而達節能之目的。
離子液體為陰陽離子以離子鍵鍵結而成,並呈現液體之狀態,即可稱為離子 液體。一般而言以離子鍵鍵結之狀態,容易形成熔點很高之離子晶體,在室溫之 情況以固體存在。於 1914 年 Paul Walden 合成第一個低溫離子液體,1951 年第一 個室溫離子液體(Room temperature ionic liquid)出現[1],此類離子液體於室溫下可 以液體之狀態存在,1992 年以 imidazolium 作為陽離子核心架構之離子液體問世[2],
此類離子液體於水及空氣中相當穩定,因此近 20 年來許多離子液體之開發都圍繞 在 imidazolium 型態之離子液體研究,離子液體雖然已出現一世紀之久,但於 imidazolium 型態之離子液體出現後才逐步獲得關注。而一般離子液體這個名稱,
即代表熔點小於 100 oC 之室溫離子液體。
離子液體具有相當低之揮發度(non-volatile)、不燃性(non-flammable thermally)、
以及穩定之性質,使得近年來離子液體被認為是一綠色介質(green media),而有研 究指出某些離子液體之毒性仍然不可忽略,但於大部分離子液體之應用中,離子 液體具有之毒性仍舊低於傳統製程。另外,離子液體可針對設計者之需求,經由 置換陰陽離子之方式合成各式各樣具有不同功能或不同性質之溶劑,滿足設計上 之需要。
離子液體的價格昂貴,因此於工業上利用則價格上勢必是一重要的考量,文 獻上指出未來離子液體若以噸的量級購買則價格上會大大降低,約莫在 25 至 50 歐元之間[3]。於工業上 IFP(French Petroleum Institute )公司於 1998 年提出之商業 製程 Difasol process 利用離子液體做催化劑,使丁烯(butene)反應生成異辛烯 (isooctane)。巴斯夫(BASF)公司亦於 2003 年成功商轉採用離子液體設計之製程,
將 離 子 液 體之 使用 推 向新 的里 程碑, 其 製 程名稱為 BASILTM (Biphasic Acid Scavenging using Ionic Liquids) , 製 程 中 將 下 游 產 品 再 反 應 之 方 式 而 生 成 1-methyl-imidazolium 離子液體,因此產生液液平衡區間,使離子液體與反應得到 之產品分離,離子液體會再經去質子化(deprotonation)過程使之重新再利用。圖 1- 1 即為 BASILTM製程之反應途徑。
圖 1- 1 BASILTM製程之反應流程[4]
離子液體於分離共沸物上之應用,主要可分為萃取蒸餾以及萃取兩大系統,
於萃取蒸餾系統中離子液體可做為夾帶劑提升兩物質間之相對揮發度達分離之效
果,於萃取系統中可作為溶劑,形成液液平衡之分離。本研究主題即針對離子液 體於分離共沸物之萃取蒸餾系統以及萃取系統做一討論。
1.2 離子液體之介紹
離子液體可隨著離子液體中陰陽離子之改變,搭配出許多不同之離子液體,
可能形成之離子液體具有 1018種[5],因此其命名法亦相當重要。離子液體之命名 法相當簡易,可直接以陽離子名稱與陰離子名稱組合而成,通常組合而成之名稱 皆 會 相 當 冗 長 , 因 此 一 般 來 說 會 使 用 縮 寫 之 方 式 表 示 離 子 液 體 。 例 如 1-ethyl-3-methylimidazolium chloride 結構式如圖 1- 2,陽離子上三碳與兩氮所組 成之環即為 imidazolium,而於環上 1 號位之氮接了 1 個乙基,並於三號位之氮上 接了一 1 個甲基,此陽離子與氯離子鍵結,可縮寫成[EMIM][Cl]。表 1- 1 為常作 為分離劑之離子液體的陰陽離子。近年來所發展之離子液體,因使用 imidazolium 型態之離子液體穩定性較佳,而最為受到關注,文獻中可使用作為分離共沸物系 統之離子液體,陽離子之使用以 1-alkyl-3-methylimidazolium 為最大宗,約佔 75%。
陰離子部分較常使用[Cl]-、[PF6]-、[BF4]-、[OTf] -、[NTf2] -、[EtSO4] -等[6]。
圖 1- 2 1-ethyl-3-methylimidazolium chloride 結構式
表 1- 1 離子液體中常見的陰陽離子[6]
室溫離子液體以陰陽離子鍵結並以液相存在,其具有幾項特性,包含低熔點、
可忽略之蒸氣壓、熱穩定性佳、熱導性佳、不可燃、高黏度、高分子量等性質。
其中低熔點及可忽略之蒸氣壓使之於廣大之溫度範圍內皆以液相存在,許多應用 皆著眼於其液相之使用,包含提升相對揮發度及萃取等。因為離子液體幾乎無相 對揮發度,亦很難以儀器測得其蒸氣壓,一般皆認為無法使用蒸餾之氣液平衡方 法分離[7],若有低揮發度之物質與離子液體混合,則欲分離出高純度之離子液體 則會遭遇許多困難。雖然離子液體在廣大的溫度區間內熱穩定度佳,但於高溫之 狀態會有熱分解(thermal decomposition)之現象,熱分解之現象即是因為離子液體逐 漸由液相形成少部分之氣相分子,而氣相分子無法維持如液體狀態之離子鍵結,
而使得氣態中之陰陽離子結構改變,而重新組態的過程,而在經過冷凝使之成為 液態時會形成多種不同物質之混合物。但 Earle et al.(2006)[8]提出離子液體實際上 可經由低壓蒸餾之方式分離且不會有熱分解現象,離子液體若再細分可分為質子
型離子液體(Protic ionic liquid),以及非質子型離子液體(Aprotic ionic liquid),質子 型離子液體即是於陽離子上有酸性質子(acidic proton),而非質子型並沒有。根據 Earle et al.之研究,質子型之離子液體因為其質子會轉移至陰離子上,而造成結構 改變,熱分解效應亦相當強烈,而非質子型離子液體在沒有質子傳遞至陰離子之 情況下,形成氣相亦不會造成結構上之改變,熱分解效應則相當小。圖 1- 3 即為 Earle et al.所提出之模型圖,質子型離子液體如左圖所示,其陽離子上之氫會傳遞 至陰離子而形成不同的物質;非質子型則如右圖所示,陽離子上之氫無法傳遞至 陰離子上。而以 imidazolium 為陽離子主要型態之離子液體,亦屬於非質子型離子 液體。
圖 1- 3 質子型與非質子型離子液體於氣液兩相之示意圖[8]
Dong et al.(2013)[9]以量子統計熱力學(quantum statistical thermodynamics)之方 式探討非質子型離子液體於氣相時之結構,當離子液體從液體形成不同組合狀態 之氣相時,汽化熱亦會不同,其以模擬之結果與實驗所測得之汽化熱比較,如圖 1- 4 所示,其中 Y 軸為汽化熱,X 軸為不同之 clusters,其中橫向之實線表示實驗所 測得之汽化熱,由此模擬分析可知陰陽離子在一起形成之氣相較接近實驗值,因 此此模擬亦可說明此類非質子型離子液體生成之氣相會將陰陽離子綁定,冷凝過 後亦一同形成氣相,而較不會有熱分解現象。
圖 1- 4 Dong et al.(2013)[9]以模擬驗證離子液體於氣相型態之結果
1.3 各類共沸物分離方法之介紹
本小節針對本研究中所使用到之共沸物分離方法做一簡單介紹,包含萃取蒸 餾、變壓蒸餾以及萃取等。
1.3.1 萃取蒸餾(Extractive distillation)
於工業程序上共沸物之分離一直是眾人關注的議題,其中萃取蒸餾之方法藉 由加入揮發度低之夾帶劑,以提升系統中雙成分之相對揮發度,而達到打破共沸 點,分離出高純度產物之效果。一般傳統之萃取蒸餾系統如圖 1- 5 所示,程序中 分為兩部分,其一為萃取蒸餾塔(Extractive distillation column),重的夾帶劑由萃取 蒸餾塔較上端之板進料,並且藉由氣液平衡逐步將 B 成分帶往塔底,而於塔頂則 可得到高純度之 A 成分。B 成分與夾帶劑則會在下游之回收塔分離,將夾帶劑回 收至萃取蒸餾塔中。
通常添加之夾帶劑為系統中沸點最高之成分,且其揮發度亦需要低於系統中 之兩成分,才可藉由氣液平衡將 B 往下帶而使 B 及夾帶劑不會分向塔頂,而 B 與
夾帶劑亦需要容易分離,基本上夾帶劑之選擇是進行程序設計前最重要之事,有 許多選擇的原則[10-12],其中最常使用之判斷原則為提升相對揮發度之能力,提 升相對揮發度能力愈佳,一般來講較具經濟優勢。
Relative volatility of A to B =𝑦𝑦𝐴𝐵⁄𝑥𝐴 𝑥𝐵
⁄ (1-1)
夾帶劑因為於系統中不斷回收再利用,因此夾帶劑於系統中之流量為一重要 之設計變數,一般來說夾帶劑流量愈大,提升相對揮發度能力愈佳,對於分離共 沸物之效果愈好,但因為夾帶劑於萃取蒸餾塔及回收塔中亦需要經過蒸發冷凝之 過程,因此過多的夾帶劑亦會提高熱負載,因此適當之夾帶劑流量為重要之設計 變數。
圖 1- 5 萃取蒸餾系統流程圖
1.3.2 變壓蒸餾(Pressure swing distillation)
利用共沸物對壓力的敏感性,藉由改變操作壓力來使共沸物之組成移動,進 而將共沸物分離。圖 1- 6 為變壓蒸餾之示意圖,變壓蒸餾系統由低壓塔及高壓塔 組成,首先進料進入低壓塔系統,於塔底可分離出純成分之 A,於塔頂則分離出 接近共沸組成之產物,此流再經過一高壓塔,高壓塔中因為操作壓力之不同,使 得共沸組成改變,因而從塔底分離出 B,於塔頂則分離出接近共沸組成之產物,回
流至低壓塔內。
圖 1- 6 變壓蒸餾流程示意圖
1.3.3 萃取(Extraction)
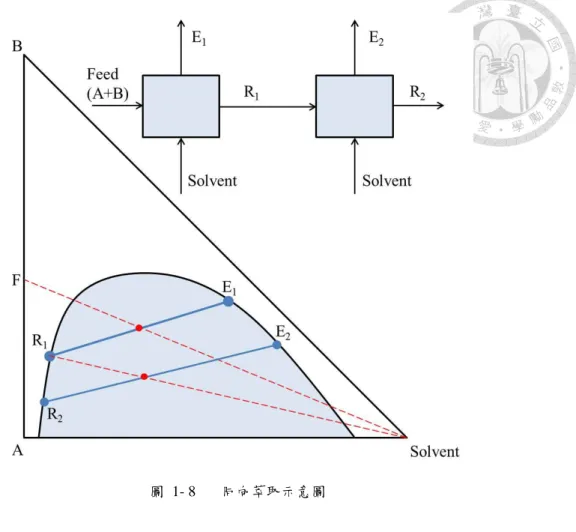
萃取是利用合適的溶劑把液體中之目的成分溶解出來,利用兩相溶解度之不 同而達分離之效果。一般來講於工業上之分離最主要仍使用蒸餾,因為僅需考慮 氣液平衡而並不需要如萃取添加入第三成份,但如遇到共沸物,或相對揮發度接 近 1 之物質分離,則需要較高之能耗或塔板數較多之蒸餾塔,或是遇到熱敏感物 質,以上之情況下萃取之方式就顯得較為有優勢。
三成分系統之液液平衡如圖 1- 7 所示,其中 F 為 A 與 B 之混合物,若於此系 統中加入溶劑(Solvent)則系統之組成會往溶劑處移動至 F’,因落在液液兩相區,故 會自動依據 tie line 分出包含溶劑之萃取物(Extract)及溶劑較少之萃餘物(Raffinate)。
其中用來判斷溶劑萃取能力之指標有二,其一為選擇度(Selectivity),其二為分散 係數(Distribution coefficient),一般來說選擇度及分散係數愈大則是愈好之溶劑,
其計算方式分別如下:
Selectivity β =(𝑥(𝑥BB⁄ )𝑥A E
𝑥A
⁄ )R
(1-2) Distribution coefficient K = (𝑥(𝑥B)E
B)R (1-3)
摺點(plait point)即選擇度為 1 之點,即分出之兩相組成一樣之點,亦可說是無法再 分離之限制點。一般來說液液兩相區之大小與溫度相關,在高溫狀況液液兩相區 會逐漸縮小,而溫度降低時液液兩相區會較大。
圖 1- 7 三成分之液液平衡關係與溫度對兩相區之影響
萃取之方式可分為同向(co-current)及反向(counter-current)萃取兩種,同向萃取 之方式如下圖所示,溶劑由多段萃取進入,以減小單段萃取恐不理想之情況,但 此方式也增加溶劑之需求量。
圖 1- 8 同向萃取示意圖
於工業上較常使用之方式為反向萃取,反向萃取之方式將萃餘液及萃取液進 行多段串連,如圖 1- 9 所示,將之作質量平衡之分析可得以下式子:
F + 𝐸𝑛+1= 𝑅𝑛+ 𝐸1 (1-4) 𝐹 − 𝐸1 = 𝑅𝑛− 𝐸𝑛+1(= 𝑃) (1-5) Rn−1+ 𝐸𝑛+1 = 𝐸𝑛+ 𝑅𝑛 (1-6) Rn−1− 𝐸𝑛 = 𝑅𝑛− 𝐸𝑛+1(= 𝑃) (1-7) 因此可以看出相鄰兩槽間兩液相流量之差相等且為一定值,而於三相圖上 Rn、En+1 與 P 則會形成一直線關係,由反相萃取可不斷地將兩成分皆提純至較高之程度。
圖 1- 9 反向萃取示意圖
1.4 文獻回顧
酒精為工業上之重要產品,而其與水形成之共沸物相當難以分離,遂成為一 直以來許多研究者探索之主題。最常使用來分離酒精與水之方式,包含萃取蒸餾、
吸附、膜分離等。其中萃取蒸餾系統因為可以得到高純度之酒精產品,為工業上 常使用之方式,萃取蒸餾系統必須加入第三成分之夾帶劑,提升酒精與水之相對 揮發度來分離,Gil et al.(2012)[13]提出以夾帶劑甘油來分離之萃取蒸餾製程。而因 為離子液體之特殊性質,於萃取蒸餾塔中相當難以汽化,可作為一良好之夾帶劑,
而不會汙染塔頂產物,在下游處之分離系統亦相當容易分離。Seiler et al.(2004)[13]
提出以離子液體[EMIM][BF4]作為萃取蒸餾系統之夾帶劑分離酒精加水系統。對於
酒精與水系統中,許多研究者提出許多可作為夾帶劑之離子液體及其氣液平衡數 據,如表 1- 2 所列。
表 1- 2 可作為酒精與水系統夾帶劑之離子液體[6]
Azeotrope Ionic liquids Water + ethanol [EMIM][N(CN)2]
[EMIM][OTf]
[EMIM][EtSO4] [EMIM][BF4] [EMIM][Cl]
[EMIM][(Me)2PO4] [EMIM][OAc]
[EMIM][(Et)2PO4] [BMIM][Cl]
[BMIM][MeSO4] [BMIM][BF4] [BMIM][OTf]
[BMIM][N(CN)2] [BMIM][OAc]
[BMIM][Br]
[BMIM][PF6] [OMIM][OTf]
[OMIM][PF6] [HMIM][Cl]
[HMIM][NTf2] [HMIM][PF6] [EMpy][EtSO4] [MMIM][(Me)2PO4] [MMIM][(Me)2PO4] [EEIM][(Et)2PO4] [PMIM][Br]
[(EtOH)NH3][OAc]
[(EtOH)3NH][OAc]
[(EtOH)2NH2][Cl]
[P6 6 6 14][N(CN)2]
[P6 6 6 14][((Me)3Pe)2PO2]
ETBE(ethyl tert-butyl ether)可作為 MTBE (methyl tert-butyl ether)之取代劑,而 MTBE 通常做為汽油中之添加劑,提高汽油之辛烷值,但於近年來逐漸發現因 MTBE 易溶於水中,常因為地下汽油儲存槽外洩而汙染地下水,已於美國部分地 區遭禁用,因此 ETBE 也逐漸獲得重視。ETBE 於工業上主要以異丁烯(isobutene) 與過量之酒精製備而成,但於反應段後下游形成之 ETBE 與酒精共沸物相當難以 分離,於文獻上亦沒有使用傳統方式分離此系統之討論。若以加入第三成分萃取 ETBE 來說,文獻中有許多使用離子液體進行萃取分離此系統之研究,如表 1- 3 所示。
表 1- 3 可作為 ETBE 與酒精系統萃取劑之離子液體[6]
Azeotrope Ionic liquids Ethanol + ethyl tert-butyl ether [EMIM][EtSO4]
[EMIM][OTf]
[EMIM][MeSO3] [BMIM][OTf]
1.5 研究動機
離子液體近年來之研究,著重於何種離子液體可以用來分離共沸物系統,並 提出氣液平衡或液液平衡實驗數據,但鮮少有人將之應用於程序設計之中,以整 廠之製程瞭解使用離子液體之優缺點,因此本研究以蒐集熱力學資料並以程序模 擬研究離子液體於萃取蒸餾系統,及萃取系統兩種不同取向之分離程序,並從中 找出離子液體於製程中之優缺點。
酒精與水系統中,Gil et al.(2012)[14]使用甘油作為夾帶劑萃取蒸餾分離酒精與 水,此甘油提升相對揮發度之能力較 Seider et al.(2004)[13]所使用之 [EMIM][BF4]
來得好很多,於一般之狀況提升相對揮發度能力愈強之夾帶劑,於成本上亦較經 濟。因此本研究使用提升相對揮發度能力較甘油更好之離子液體[EMIM][Cl]作夾
帶劑,並探索離子液體於萃取蒸餾系統中之潛力。
ETBE 與酒精系統中,本研究以傳統之變壓蒸餾分離此系統,但變壓蒸餾之缺 點為能耗較高。亦可使用[EMIM][EtSO4]作萃取劑,使此系統產生液液平衡而使之 分離,而於萃取段後並搭配下游之分離系統,而形成一整廠製程,並與傳統之變 壓蒸餾方法做比較,進而歸納出結論。
本研究期望以離子液體對於萃取蒸餾系統以及萃取系統之研究歸納出離子液 體於程序設計中之優缺點,並將其應用於工業上共沸物之分離的可能性作一驗 證。
1.6 組織章節
本論文共分為五章,第一章為緒論,分別針對離子液體之發展,及離子液體 之命名法,與離子液體之性質等作概略性之介紹,並針對離子液體對萃取蒸餾系 統以及萃取系統之應用作說明,及闡述研究動機。第二章為離子液體模型之建置,
本研究使用模擬軟體 Aspen Plus v7.3,因此對於在 Aspen Plus 內建置離子液體作一 詳細的描述,使於模擬中能夠盡量接近真實情況。第三章則是對萃取蒸餾系統酒 精與水之設計進行一探討,夾帶劑分別使用甘油與離子液體[EMIM][Cl],具有熱 力學模型之計算,並包含其最小化再沸器熱負載穩態結果之設計,以探討離子液 體於萃取蒸餾系統中之優缺點。第四章為萃取系統 ETBE 與酒精,分別以變壓蒸 餾以及離子液體[EMIM][EtSO4]萃取之方式分離,穩態設計結果以總年成本(Total annual cost, TAC)計算,並比較整廠製程之結果。第五章為結論,本章將綜合上述 章節之研究結果與討論,提出本論文之總結。
第二章 離子液體模型建立
2 . 1 前言
室溫離子液體以離子鍵鍵結而成,且在大範圍之溫度區間內都可以液體之型 態存在,為了要進行後續離子液體對於系統之萃取蒸餾以及萃取之探討,純成分 離子液體之模型建立相當重要。此研究使用之程序模擬軟體為 Aspen Plus v7.3TM。
2 . 2 離子液體模型之建立
首先開啟 Aspen plus v7.3 後,須先建立一空白之物質,並給予一可依使用者 自訂之名稱。在建立此空白物質後,目前並無任何純成分性質之描述於此空白物 質內,因此下一步應該將純成分性質之描述建置。於 Aspen Plus 工作視窗中,點 選左方功能欄之 Properties > parameters > Pure Component,以新建純成分性質。
對於離子液體之描述必須包括以下幾項模型建置,Aspen plus v7.3 才具有足夠 的資料得以進行穩態模擬,以下各小節即針對每一項模型作一概述:
1. 液相蒸氣壓模型;
2. 氣相定壓熱容模型與汽化熱模型以得到液相定壓熱容模型;
3. 黏度模型;
4. 純成分性質。
2.2.1 液相蒸氣壓模型
液相蒸氣壓模型使用內建之 PLXANT 模型,PLXANT 模型其計算方式使用 Extended Antoine Equation 去描述,其公式如下:
液相蒸氣壓模型(PLXANT) lnP = C1 + C2
T + C3+ C4T + C5lnT + C6TC7
for C8 ≤ T ≤ C9 (2-1)
一般來說離子液體其液相蒸氣壓相當小,小至可忽略的程度,但在模擬中此蒸氣 壓的描述相當重要,因為此液相蒸氣壓模型不僅僅可以描述蒸氣壓,亦可描述離 子液體的沸點,所謂的沸點即是液相蒸氣壓與外界壓力相等時的溫度,故此模型 也提供了離子液體的沸點計算,而其沸點的溫度在模擬當中相當重要。
2.2.2 氣相定壓熱容模型與汽化熱模型以得到液相定壓熱容模型
於 Aspen Plus 內必須建置氣相定壓熱容模型與汽化熱模型才可進行穩態模擬,
若缺少此兩項則穩態模擬資料不足。於現實情況中,因為離子液體其可忽略之液 相蒸氣壓與高沸點,相當不容易形成氣相,亦即是說氣相的離子液體幾乎微乎其 微,造成氣相定壓熱容模型與汽化熱模型也變得較不重要,故文獻中也鮮少討論 氣相定壓熱容模型與汽化熱模型。相對來說,離子液體幾乎以液相存在,其吸放 熱的情況便相當重要,因此液相定壓熱容模型需要建置於離子液體模型中,但於 Aspen Plus 內並無法直接建立液相定壓熱容模型,Aspen Plus 內計算出液相定壓熱 容之方式為:輸入定壓氣相熱容模型與汽化熱模型則會自動算出液相定壓熱容。
由文獻上可以得到離子液體之液相定壓熱容,因此必須輸入定壓氣相熱容模 型與汽化熱模型使 Aspen Plus 算出之液相定壓熱容與文獻上相同。輸入之方式如
下:將液相定壓熱容模型之參數輸入至氣相定壓熱容模型,並將汽化熱模型各項 參數設為零,則計算出之液相定壓熱容與氣相定壓熱容會相同,且離子液體之汽 化熱為零,其中兩種模型之公式如下:
氣相定壓熱容模型(CPIG)
Cpig = C1+ C2T + C3T2+ C4T3+ C5T4+ C6T5
for C7 ≤ T ≤ C8 (2-2)
汽化熱模型(DHVLPO)
∆vapH = C1+ C2T + C3T2+ C4T3+ C5T4+ C6T5 + C7T6 + C8T7+ C9T8 + C10T9 for C11≤ T ≤ C12 (2-3)
以此方式即可描述出與文獻上相同之液相熱容,但氣相熱容與汽化熱和實際 情況並不相同,但因前述所說之幾乎無氣相之離子液體存在,故氣相熱容與汽化 熱之誤差並不重要。
2.2.3 黏度模型
黏度模型使用內建之 MULPO 模型,此模型主要於使用 Aspen Plus 之蒸餾塔 RadFrac 單元,若無建置此黏度模型仍可進行穩態模擬,但無法使用 RadFrac 單元 中計算塔徑之 Tray Sizing 功能,而無法得到塔徑之資料。黏度模型主要是在於計 算蒸餾塔塔徑,但蒸餾塔塔徑之計算是由氣相體積流率而來,因此液體之黏度其 實並不會影響到塔徑之結果,因此可將黏度模型之參數皆設為零,其中 MULPO 模型之公式如下:
黏度模型(MULPO)
η = C1+ C2T + C3T2 + C4T3+ C5T4+ C6T5 + C7T6+ C8T7 + C9T8+ C10T9 for C11≤ T ≤ C12 (2-4)
2.2.4 純成分性質
除了建置以上之模型外,仍須輸入以下之純成分性質以去描述離子液體,包 含以下七點:
1. 分子量 (Molecular weight, MW);
2. 沸點 (Normal boiling point, TB);
3. 臨界溫度 (Critical temperature, TC);
3. 臨界壓力 (Critical pressure, PC);
4. 臨界體積 (Critical volume, VC);
5. 臨界壓縮因子 (Critical compressibility factor, ZC);
6. .離心因子(Acentric factor, OMEGA);
7. 偶極矩 (Dipole moment, MUP)。
其中偶極矩之部分為計算液體黏度部分所需要,而黏度模型主要是在於計算 Tray Sizing 功能之蒸餾塔塔徑,因此此一描述液體之偶極矩亦不重要,於 Aspen Plus 中,系統自動預設值為零,因此本研究亦參考其設定值設為零。
2.3 離子液體模型之參數
本研究探討以離子液體分離共沸物,其中主要討論之兩系統為 1. 萃取蒸餾系統: 酒精、水與[EMIM][Cl]
2. 萃取系統: Ethyl tert-butyl ether (ETBE)、酒精與[EMIM][EtSO4]
本小節即對於所使用到之兩離子液體[EMIM][Cl]與[EMIM][EtSO4]之模型參數作 一討論。
2.3.1 [EMIM][Cl]之參數 2.3.1.1 液相蒸氣壓模型
因為離子液體幾乎可忽略之揮發度,文獻中鮮少對於離子液體之液相蒸氣壓 做討論,文獻中亦無[EMIM][Cl]之蒸氣壓實驗數據,但蒸氣壓參數為模擬中必要 之參數,在缺少實驗數據之情況下,僅能假設成很小之蒸氣壓。另一方面,因為 由蒸氣壓可以計算出物質之沸點,假如蒸氣壓設太小,則會計算出過高之沸點。
例如假設蒸氣壓為零,則計算出之離子液體沸點則為無限大,此結果於以氣液平 衡為分離手段之蒸餾系統來說,只要分離出高純度之離子液體就會產生出實際上 工廠操作不可能達到之高溫,因此蒸氣壓之假設相當重要。由文獻中蒐集各種離 子液體之蒸氣壓實驗數據與溫度之關係[15-18],將之做圖可得如圖 2- 1 之結果。
可由圖上看出蒸氣壓與溫度在經由取自然對數以及倒數之運算後,在實驗範圍內 相當線性,因此可經由式 2-1 之公式求出液相蒸氣壓之參數 C1 與 C2,其中 C3=C4=….=C7=0,其結果如表 2- 1 所示。為了要得到[EMIM][Cl]可使用之 C1、C2
參數,在缺少實驗值之狀況,僅能以 C1、C2之平均數值作為[EMIM][Cl]之蒸氣壓 估計式。因此最後[EMIM][Cl]之液相蒸氣壓如式 2-5 所示,其中 T [=] K、P [=] pa,
且以此蒸氣壓計算之 1 大氣壓沸點為 609.75oC,在合理範圍內。
圖 2- 1 各種離子液體其液相蒸氣壓與溫度之關係
表 2- 1 各種離子液體之平均液相蒸氣壓
Case Ionic liquid C1 C2 Boiling point(K) 1 [C2mim][NTf2] 27.34 -14316.70 905.07 2 [C4mim][NTf2] 26.74 -14203.80 933.71 3 [C6mim][NTf2] 28.32 -14848.95 884.23 4 [C8mim][NTf2] 30.05 -15891.35 857.98 5 [C2mim][NTf2] 25.81 -13797.69 966.26 6 [C2mim][N(CN)2] 36.02 -16905.51 690.06 7 [C4mim][NTf2] 27.14 -14428.70 924.27 8 [C2mim][NTf2] 26.00 -13785.17 952.69 9 [C3mim][NTf2] 25.86 -13637.55 951.13 10 [C4mim][NTf2] 26.84 -14165.06 925.19 11 [C5mim][NTf2] 28.11 -14797.00 892.42 12 [C6mim][NTf2] 28.79 -15163.74 878.22 13 [C7mim][NTf2] 29.26 -15486.62 873.29 14 [C8mim][NTf2] 28.91 -15470.90 889.71 15 [C10mim][NTf2] 30.29 -16362.09 872.14 16 [C12mim][NTf2] 30.94 -16881.08 869.70 Average 28.53 -15008.87
*T [=] K, P [=] pa
lnP = 28.53 +−15008.87T (2-5)
2.3.1.2 氣相定壓熱容模型與汽化熱模型以得到液相定壓熱容模型
此部分如 2.2.2 節所述,必須先從文獻中找出之液相定壓熱容模型參數輸入至
氣相定壓熱容模型,並將汽化熱模型參數皆設為零,則 Aspen Plus 內所計算出之 液相熱容即與文獻上之結果相符。但於文獻上亦未找到關於[EMIM][Cl]之液相定 壓熱容實驗數據。Nasrin Farahania et al.(2013)[19]提出以離子液體之結構式來估計 離子液體液相定壓熱容之方式,其計算法如下
Cp = −122.16826 + 0.45794T + 12.8395Ncation− 56.85424 CH3 Rcation +19.25836Nanion− 11.36109 nHanion (2-6)
其中 Cp 之單位為 KJ/kmol-K,T 之單位為 K,Ncation為陽離子中元素個數,
CH3 Rcation為陽離子中接於環上之甲基基團個數,Nanion為陰離子中元素個數,nHanion
為陰離子中氫原子個數。由[EMIM][Cl]之結構式可得 Cp 之計算參數如下表所示:
表 2- 2 [EMIM][Cl]之 Cp 計算參數
Ncation CH3 Rcation Nanion nHanion
value 19 1 1 0
因此由表 2- 2 及式 2-6 可得[EMIM][Cl]之液相定壓比熱如下式,其中 Cp [=]
KJ/kmol-K,T [=] K。
Cp = 84.18636 + 0.45794T (2-7)
2.3.1.3 純成分參數
純成分參數需輸入[EMIM][Cl]之分子量、常壓沸點、臨界性質(包含溫度、壓 力;體積、壓縮因子)、離心因子、偶極矩等。
分子量部分可經由[EMIM][Cl]之結構式計算出。常壓沸點因文獻中並無離子 液體之沸點實驗值,且於 Aspen Plus 內沸點之計算乃由液相蒸氣壓而來,因此以 2.3.1.1 節所假設之蒸氣壓常壓沸點 609.75oC 為[EMIM][Cl]之沸點輸入 Aspen 內。
臨界性質部分,因離子液體之高沸點及在接近沸點之高溫處於較不穩定之型態,
於實際上並不可能經由實驗之方法實際測得離子液體之臨界性質。Valderrama and Rojas (2009)[20]發表以基團貢獻法(Group Contribution method)估計離子液體臨界 性質之方法,根據離子液體所具有之官能基並搭配公式計算,可得臨界溫度、臨 界壓力、臨界體積、臨界壓縮因子、離心因子等,亦可推得常壓沸點。Valderrama and Rojas 之計算方式如表 2- 3 及表 2- 4 所示。
表 2- 3 Valderrama and Rojas 基團貢獻法各基團數值[20]
表 2- 4 Valderrama and Rojas 基團貢獻法計算式[20]
Model equation Constants
The method
𝑇b(𝐾) = 198.2 + ∑𝑛∆𝑇b 𝑇c(𝐾) = 𝑇b
[𝐴 + 𝐵∑𝑛∆𝑇c− (∑𝑛∆𝑇c)2] 𝑃c(bar) = 𝑀
[𝐶 + ∑𝑛∆𝑃c]2 𝑉𝑐(𝑐𝑚3⁄𝑚𝑜𝑙) = 𝐷 + ∑𝑛∆𝑉𝑐
𝐴 = 0.5703, 𝐵 = 1.0121
𝐶 = 0.2573 𝐷 = 6.75
Density model for testing
𝜌 =𝐴 𝐵+ (2
7) [𝐴 + 𝑙𝑛𝐵
𝐵 ](𝑇 − 𝑇𝑏) (𝑇𝑐− 𝑇𝑏)
𝐴 = 𝑎 +𝑏𝑀 𝑉𝑐
𝐵 = (𝑐 𝑉𝑐+𝑑
𝑀)𝑉𝑐𝛿
𝑎 = 0.3411, 𝑏 = 2.0443, 𝑐 = 0.5386, 𝑑 = 0.0393, 𝛿 = 1.0476
Critical
compressibility factor
𝑍𝑐 =𝑃c𝑉𝑐 𝑅𝑇𝑐
𝑅 = 84.31
(𝑏𝑎𝑟 ∙ 𝑐𝑚3⁄(𝑚𝑜𝑙∙ 𝐾))
Acentric factor
𝜔 = (𝑇𝑏− 43)(𝑇𝑐− 43)
(𝑇𝑐− 𝑇𝑏)(0.7𝑇𝑐− 43)log [𝑃𝑐 𝑃𝑏]
−(𝑇𝑐− 43) (𝑇𝑐− 𝑇𝑏)log [𝑃𝑐
𝑃𝑏] + log [𝑃𝑐 𝑃𝑏] − 1
𝑃𝑏= 1.01325(𝑏𝑎𝑟)
In the equations, 𝑀 is in g mol⁄ , 𝑇b 𝑎𝑛𝑑 𝑇c 𝑎𝑟𝑒 𝑖𝑛 𝐾, 𝑃𝑐 is in bar and 𝑉𝑐 is in (𝑐𝑚3⁄𝑚𝑜𝑙).
根據 Valderrama and Rojas 之方法計算出[EMIM][Cl]之臨界溫度 TC=475.45oC,
常壓沸點 TB=239.15oC,其計算出之沸點相當低,與本研究中經由回歸各種離子液 體所推得之蒸氣壓沸點 609.75oC 有大的差距。回顧 Valderrama and Rojas 之計算方 法中,計算離心因子ω (acentric factors)如式 2-8,並代入 Rudkin 修改之液相蒸氣
壓 Antoine equation[21],如式 2-9。
ω = − log (PPs
c)T
Tc
− 1.0 (2-8)
log Ps = A −T−43B (2-9) 其中,
A =TTc−43
c−TblogPc (2-10)
B = (Tc−43)(TT b−43)
c−Tb logPc (2-11)
將 A、B 代入式 2-9 及將式 2-9 代入式 2-8 即可得到文獻上之ω計算式如下:
ω =(T(Tb−43)(Tc−43)
c−Tb)(0.7Tc−43)log (PPc
b) −TTc−43
c−Tblog (PPc
b) + log (PPc
b) − 1 (2-12)
因此於文獻中亦可求出液相蒸氣壓之公式,由基團貢獻法求出之[EMIM][Cl]液相 蒸氣壓如下式所示,其中 P [=] bar,T [=] K。
log Ps = 4.581 −2154.282T−43 (2-13)
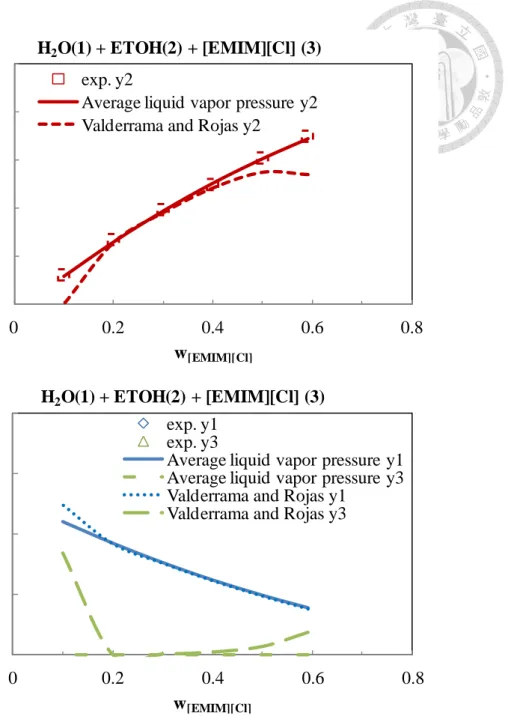
由各種離子液體平均蒸氣壓與由基團貢獻法求出之蒸氣壓做一比較如圖 2- 2,可 發現在蒸氣壓部分基團貢獻法求出之蒸氣壓明顯高出許多。由第三章所討論之酒 精、水與[EMIM][Cl]系統中,Ge et al. (2008)[22]對於此三成分系統之氣液平衡有 完整之實驗數據並回歸出 NRTL 參數,若以 Ge et al.之 NRTL 參數及實驗數據,分 別以此兩種不同之液相蒸氣壓輸入 Aspen Plus 內則結果如圖 2- 3 所示,可以看到 以各種離子液體平均蒸氣壓為模型之結果與實驗值相當接近,但以基團貢獻法之 蒸氣壓為模型之結果與實驗數據差異很大,特別是在離子液體所占比例較高時,
於氣液平衡中之液相會慢慢出現離子液體,這與實驗現象相當不合,由此可以看 出由基團貢獻法去預估離子液體之性質與真實情況有所偏差。因此在蒸氣壓及沸 點部分仍舊使用以各種離子液體蒸氣壓所計算出之 609.75oC,臨界性質部分因為
並無其他來源可參考因此仍沿用 Valderrama and Rojas 所計算出之值。其中設定之 臨界溫度為 475.45oC,較沸點 609.75oC 來得低,此一現象較不合理,但因為臨界 溫度在系統中主要是計算混合流之液態體積流率,因此在系統中主要會影響到的 是單元 Sizing 的大小,但以蒸餾塔來說,塔高由板數決定,塔徑由氣相體積流率 決定,因此其實此變數對於系統影響不大。
圖 2- 2 使用兩種不同蒸氣壓模型之比較
0 1
2 34 5
6 78
70 120 170 220 270 320 370 420 470 520 570 620
L iq u id vap or p re ss u re ( at m )
Temperature (
oC)
Valderrama and RojasAverage liquid vapor pressure
圖 2- 3 使用兩種不同蒸氣壓模型與實驗值之比較
0.95 0.96 0.97 0.98 0.99 1.00
0 0.2 0.4 0.6 0.8
m ol e f rac ti on i n vap or p h as e
w
[EMIM][Cl]H
2O(1) + ETOH(2) + [EMIM][Cl] (3) exp. y2
Average liquid vapor pressure y2 Valderrama and Rojas y2
0.00 0.02 0.04 0.06 0.08
0 0.2 0.4 0.6 0.8
m ol e f rac ti on i n va p or p h as e
w
[EMIM][Cl]H
2O(1) + ETOH(2) + [EMIM][Cl] (3) exp. y1
exp. y3
Average liquid vapor pressure y1 Average liquid vapor pressure y3 Valderrama and Rojas y1
Valderrama and Rojas y3
表 2- 5 [EMIM][Cl]之純成分參數
Data set Units Value MW kg/kmol 146.62
TB C 609.75
TC C 475.45
PC bar 34.2
VC cc/mol 454.5
OMEGA - 0.4165
ZC - 0.2495
MUP debye 0.00
2.3.2 [EMIM][EtSO4]之參數 2.3.2.1 液相蒸氣壓模型
文獻中亦無[EMIM][EtSO4]之液相蒸氣壓數值,因此參考 2.3.1.1 液 相 蒸 氣 壓 模型節之敘述,以各種離子液體之平均蒸氣壓為[EMIM][EtSO4]之設定,其中 P [=]
pa, T [=] K。
lnP = 28.53 +−15008.87T (2-14)
2.3.2.2 氣相定壓熱容模型與汽化熱模型以得到液相定壓熱容模型
文 獻 中 可 找 到 [EMIM][EtSO4]之液相定壓熱容實驗數據[23],可發現液相定 壓熱容與溫度大致成一線性關係,因此以線性回歸之方式得到[EMIM][EtSO4]之 Cp 方程式如下,其中 T [=] K,Cp [=] J/mol-K。
Cp = 297.70 + 0.2648 T (2-15)
圖 2- 4 [EMIM][EtSO4]之液相定壓熱容與溫度之關係
2.3.2.3 純成分參數
沸點部分採用 TB=609.75oC,其餘性質則採用 Valderrama and Rojas 以基團貢 獻法計算出之數值。
表 2- 6 [EMIM][EtSO4]之純成分參數
Data set Units Value MW kg/kmol 236.29
TB C 609.75
TC C 794.35
PC bar 40.5
VC cc/mol 659.8
OMEGA - 0.3744
ZC - 0.3008
MUP debye 0
Cp = 297.70 + 0.2648 T R² = 0.9968
340 360 380 400
150 200 250 300 350 400
C p ( J/ m ol /K )
T (K)
第三章 萃取蒸餾—酒精與水系統
3.1 前言
萃取蒸餾系統中利用添加夾帶劑而提升物質間之相對揮發度,並以蒸餾過程 分離,利用蒸發冷凝之氣液平衡關係而達分離之目的。而離子液體於分離上之應 用中,其一即為作為萃取蒸餾系統中之夾帶劑,有效提升相對揮發度。本章節以 離子液體[EMIM][Cl]作為夾帶劑,分離酒精與水系統。流程中首先以萃取蒸餾塔 分離出酒精,並搭配下游之回收系統分離出夾帶劑回流,並分離出水產物流。因 為離子液體幾乎可忽略之蒸氣壓,故不會汙染產物且易於分離之特性,成為其吸 引眾多目光之原因,因此直觀上在上游之萃取蒸餾塔中,離子液體應為一良好且 不汙染酒精之夾帶劑,而在下游之分離系統應該具有相當容易分離之優勢。本章 節逐步以改變設計架構與熱整合之方式改善再沸器熱負載需求量,亦將離子液體 [EMIM][Cl]與傳統分離酒精與水之夾帶劑甘油作比較,並針對離子液體作為萃取 蒸餾系統之夾帶劑進行一系列之優缺點討論。
3.2 系統使用之熱力學模式
於模擬中必須選用合適的熱力學模式來描述系統三成分間氣液平衡等相平衡 關係,才能使模擬結果更加精確且提高真實性。萃取蒸餾製程中所使用的熱力學 模式為 NRTL model (Non-random two-liquid model),此熱力學模式對於描述氣液平 衡有相當好的精確度,且只需雙成分配對參數(binary interaction parameter)即可描 述多成分系統,NRTL model 之公式及計算液相活性系數參數之公式如式 31 所示
1 1
1
1 1 1
ln
nc nc
ji ji j nc k ki kj
j j ij k
i nc nc ij nc
j
ki k kj k kj k
k k k
G x x G
x G
G x G x G x
(3-1)其中,
exp( ),
ij, , 1, 0
ij ij ij ij ij ij ij ii ii
G a b c G
T
(3-2)
3.3 以傳統共沸劑甘油分離
3.3.1 熱力學參數
本文以 Gil et al.(2012)[14]之文獻以傳統之夾帶劑甘油搭配萃取蒸餾方法分離 酒精與水,並有完整之最適化結果,因此以夾帶劑甘油分離酒精加水系統中,亦 引用其設計結果進行再製。其所使用之熱力學參數為 Aspen Plus 內建之 NRTL 參 數組,如表 3- 1 所示。
表 3- 1 酒精、水與甘油系統的 NRTL 參數
Component i H2O H2O ETOH Component j ETOH Glycerol Glycerol
Temp. units K K K
Source APV73 VLE-IG APV73 VLE-IG. APV73 VLE-IG
Property units:
aij 3.4878 -1.2515 0
aji -0.8009 -0.7318 0
bij -586.0809 272.6075 442.7130 bji 246.1800 170.9167 36.1390
cij 0.3 0.3 0.3
![表 2- 3 Valderrama and Rojas 基團貢獻法各基團數值[20]](https://thumb-ap.123doks.com/thumbv2/9libinfo/9602961.629384/45.892.211.645.362.1113/表23ValderramaandRojas基團貢獻法各基團數值2.webp)
![表 2- 4 Valderrama and Rojas 基團貢獻法計算式[20]](https://thumb-ap.123doks.com/thumbv2/9libinfo/9602961.629384/46.892.124.777.109.940/表24ValderramaandRojas基團貢獻法計算式2.webp)
![圖 2- 4 [EMIM][EtSO4]之液相定壓熱容與溫度之關係](https://thumb-ap.123doks.com/thumbv2/9libinfo/9602961.629384/51.892.145.811.114.710/圖24EMIMEtSO4之液相定壓熱容與溫度之關係.webp)
![圖 3- 6 酒精、水與[EMIM][Cl]系統之氣液平衡圖 75859510500.20.40.60.81T (oC)](https://thumb-ap.123doks.com/thumbv2/9libinfo/9602961.629384/64.892.150.780.111.951/圖36酒精水與EMIMCl系統之氣液平衡圖7585951524681T.webp)
![圖 3- 7 酒精、水與[EMIM][Cl]系統之蒸餘曲線圖](https://thumb-ap.123doks.com/thumbv2/9libinfo/9602961.629384/65.892.118.774.114.728/圖37酒精水與EMIMCl系統之蒸餘曲線圖.webp)