國立宜蘭大學動物科技學系(研究所)
碩士論文
Department of Animal Science National Ian University
Master Thesis
人工授精站公猪精液品質與生育力之評估
Evaluation on semen quality and fertility of boars in artificial insemination station
指導教授:陳銘正博士 Ming-Cheng Chen, Ph. D.
研究生:張育京 Yu-Ching Chang
中華民國九十七年六月
中文摘要
猪隻人工授精 ( artificial insemination, AI ) 技術,為有效簡便之 育種改良方式,優良種公猪之精液可對眾多母猪進行授精,其效益將 比自然配種高出數倍,故預測公猪生育力極為重要。本試驗之目的乃 評估人工授精站公猪稀釋精液品質與生育力之相關性。本試驗分三部 份,試驗一選定4 間位於北中南東之人工授精站,檢測 4 間人工授精 站共36 頭公猪精液稀釋後保存 1 日與 3 日之酸鹼值、精子活力、成 熟率、頭巾完整率、形態正常率與存活力。試驗二使用此等稀釋精液 進行體外受精 ( in vitro fertilization ),紀錄其精子穿透率、多精入卵 率與平均入卵精子數。試驗三則以宜蘭地區之商業猪場,預定發展為
地區性人工授精站,除檢查場內使用之3 頭公猪之精液品質外,並使
用流式細胞儀 ( flow cytometry ) 評估精子粒線體功能與存活力,亦 使用稀釋精液進行體外受精與人工授精試驗,取得體外受精參數與配 種後母猪之分娩率與出生活仔數。試驗結果顯示,人工授精站之稀釋
精液保存期間,除酸鹼值無差異外,其餘精液品質參數在保存3 日後
均顯著下降,體外受精參數卻無顯著差異,然而不論精液品質參數或 體外受精參數,4 間人工授精站間則具有顯著差異。分析精液品質與 體外受精參數之相關性,形態正常率與體外受精參數之相關性達顯著 正相關,其餘精液品質評估參數與體外受精參數之相關性皆不明顯。
形態正常率高 ( > 70 % ) 之精液,其穿透率顯著高於形態正常率低者 ( < 70 % )。在試驗三,商業猪場 3 頭公猪之精液品質於試驗期間隨時 間而變化,且公猪間具顯著差異,其稀釋精液保存期間,精液品質參
數在保存3 日後均顯著下降。應用流式細胞儀評估精子粒線體功能與
存活力,在3 頭公猪間無顯著差異,體外受精參數、人工授精後之分
娩率與出生活仔數亦無顯著差異,精液品質參數皆與出生活仔數之相 關性不明顯,3 項體外受精參數均與出生活仔數有正相關,平均入卵 精子數之相關值接近顯著水準。總結上述,公猪個體與每次射精皆可 能隨時間而變化,須長久監控公猪精液品質,俾維持人工授精之品 質,然而一般精液品質評估僅可檢測出生育力極差之公猪,並無法進 一步從初步篩選後之公猪挑選生育力更佳者,因此之後可以再輔以體 外受精系統,進一步評估公猪生育力之動態變化。
英文摘要
Artificial insemination (AI) is an effective technique for porcine breeding. The semen of superior boars can serve large numbers of females.
The benefit of AI is higher then natural mating. Thus, the prediction of boar fertility is very important in breeding farm and AI station. The objective of the present study was to evaluate the relationship of semen quality and fertility of boars in AI station. Three experiments were carried out in present study. Experiment 1 was evaluated semen quality of 36 boars from 4 AI stations located in north, middle, south and east in Taiwan, respectively. The parameters of semen quality were including pH, motility, maturation, acrosome integrity, normal morphology and viability of spermatozoa in diluted semen stored for 1 and 3 days after dilution. In experiment 2, these semen samples were used for in vitro fertilization (IVF) test, and we recorded the penetration, polyspermy rates and average number of spermatozoa per oocyte as IVF parameters. In experiment 3, we evaluated semen quality of 3 boars from a pig farm in Ilan, and used the flow cytometry to evaluate the mitochondrial function and viability of these semen samples. Besides, these semen samples were also used for IVF and AI.
The IVF parameters, farrowing rates and litter size were recorded. The results showed that the parameters of semen quality were decreased
significantly when the semen samples were stored for 3 days, but there was no significant difference in pH and IVF parameters. However, the parameters of semen quality and IVF were significant different between 4 AI stations. There were no clear relationship between the semen quality and IVF parameters, however, the normal morphology rate was positively correlated with the IVF parameters. When semen samples were allocated into two groups according to normal morphology rate, the penetration rate of IVF were significantly higher in the more normal spermatozoa ( > 70 %). In experiment 3, the parameters of semen quality of 3 boars varied among ejaculates along with time, and revealed the difference between boars in the pig farm. When the semen samples were stored for 3 days, the parameters of semen quality were also decreased significantly, but the mitochondrial function and viability assessed by flow cytometry were no significant different. The IVF parameters, farrowing rates and number of pigs born alive were no significant different among 3 boars. Also, there was no obvious correlation between the parameters of semen quality and the number of pigs born alive. However, all IVF parameters were positively correlated with the number of pigs born alive, and the correlation coefficient of mean number of sperm per penetrated oocyte was close to significant. In conclusion, the inherent variation among ejaculates and boars fertility are vary with time, to
monitor the boars permanently is therefore necessary to ensure the quality of dilute semen from AI station. However, the classical methods of semen evaluation only can eliminate the markedly poor fertility boars, but can not distinguish boars with excellent fertility from those with medium fertility.
IVF technique was a better tool for evaluating the fertilizing capacity of boar semen for AI than classical methods of semen evaluation.
誌謝
試驗的艱辛跟寫論文的痛苦,在這一刻終告結束。最感謝指導教授 陳銘正博士於試驗上的指點,也在撰寫論文時提供方向,使我寫得更順 利。我會永遠記得老師的叮嚀:「厚植基礎,邁向尖端」,然而在生殖技 術研究室期間,學到的不只是試驗技術,更是待人處事的方法。感謝 胡 怡浩博士與 林佳靜博士抽空參加論文口試,並在論文上的指正。本論 文能順利完成,亦感謝 4 家人工授精站提供稀釋精液,更感謝 許文騰 大哥的幫忙,不只提供公猪新鮮精液,更提供母猪進行人工授精,使本 論文更完整。
感謝學長朱建安跟沈偉仁在我初入研究室的指導,還有學弟妹在試 驗研究上的幫忙,尤其李文涵跟簡志明的協助,使研究過程更順利;大 學部的徐漢明、侯佳妤、劉映均、莊齊寧、張慧卉、楊能凱、胡曉明,
跟碩士班的楊雅琳、郭妍希、詹廷威,在這段時間培養出飯友兼戰友的 情感,我會永遠珍惜與懷念,另外同窗2 年的汪世崇、游昌偉、林以琁、
李明德、鄭浩均、簡維綱、葉琇如與余秉樺,雖然不同研究室,我們都 瞭解研究生涯的辛苦,感謝之外也祝福各位。
最後感謝家人的支持鼓勵,尤其是我父母,即使不清楚我的研究,
也給予完全的支持,讓我無後顧之憂的完成論文,僅以此論文獻給我最 親愛的家人。
張育京 中華民國九十七年七月
目錄
頁次 中文摘要...I 英文摘要...III 目錄...VII 表次...XII 圖次...XIV 附次...XV
壹、前言...1
貳、文獻檢討...3
ㄧ、猪人工授精...3
(一)、人工授精之進展與貢獻...3
(二)、影響人工授精配種效率之因素...4
1、母猪...4
2、配種季節...6
3、人工授精器具與授精部位...6
4、公猪精液...7
(1)、精液處理...7
(2)、授精精子數...9
二、公猪生育力...10
(一)、公猪...10
1、睪丸...11
2、附睪...13
3、輔性腺...14
4、陰莖...14
(二)、營養...15
(三)、環境...16
(四)、精液儲存...17
三、公猪生育力之檢測...19
(一)、公猪生育力之體內測定...19
(二)、人工授精站例行性之精液檢測...19
1、物理性狀...20
2、精子活力...20
3、精子存活力...21
4、精子形態...21
5、精子耐久性測驗...21
(三)、人工授精站非例行之精液檢測...22
1、低滲透壓膨脹測試...22
2、離心法...23
3、甲醇緊迫法...23
4、電腦輔助之精液檢測...23
(1)、流式細胞儀...24
A、精子之死活染色...24
B、精子之頭巾完整性...25
C、精子之粒線體功能...25
D、精子之獲能狀態...26
E、精子之DNA結構...26
(2)、電腦輔助精子分析...27
5、分子與基因之檢測...29
(1)、分子...29
(2)、基因...30
四、公猪生育力之體外測定...32
(一)、影響體外受精之因素...33
1、卵母細胞...33
2、精子...34
3、培養液組成...34
4、精子與卵母細胞比例...35
5、共培養時間...35
(二)、體外受精評估公猪生育力...35
參、材料與方法...38
一、稀釋精液之來源...38
二、精液品質評估...38
(一)、活力...38
(二)、存活力...39
(三)、形態...39
三、流式細胞儀評估精液品質...44
(一)、存活力...44
(二)、粒線體功能...44
四、卵母細胞之體外成熟與體外受精...49
(一)、體外成熟...49
(二)、體外受精...50
五、卵母細胞之形態觀察...51
六、受精評估...52
七、人工授精...52
八、試驗設計...52
(一)、人工授精站稀釋精液之品質與保存期間之變化...56
(二)、應用體外受精技術評估人工授精站稀釋精液之生育力...56
(三)、人工授精站公猪生育力檢測方式之建立...57
九、統計分析...58
肆、結果...59
一、人工授精站稀釋精液之品質與保存期間之變化...59
二、應用體外受精技術評估人工授精站稀釋精液之生育力...64
三、人工授精站公猪生育力檢測方式之建立...81
伍、討論...98
一、人工授精站稀釋精液之品質與保存期間之變化...98
二、應用體外受精技術評估人工授精站稀釋精液之生育力...100
三、人工授精站公猪生育力檢測方式之建立...104
陸、結論...109
柒、參考文獻...110
捌、附錄...131
表次
頁次
表 1. 四間人工授精站稀釋精液稀釋後一日之品質...60
表 2. 人工授精站稀釋精液保存日數對精液品質之影響...62
表 3. 四間人工授精站稀釋精液稀釋後三日之精液品質...63
表 4. 人工授精站稀釋精液保存期間精子活力百分比累計表...65
表 5. 人工授精站稀釋精液保存期間精子形態百分比累計表...66
表 6. 猪卵母細胞發育階段對穿透率之影響...68
表 7. 卵丘細胞對猪卵體外受精之影響...69
表 8. 四間人工授精站稀釋精液稀釋後一日之體外受精參數...71
表 9. 人工授精站稀釋精液保存期間對體外受精之影響...72
表10. 四間人工授精站稀釋精液稀釋後三日之體外受精參數...73
表11. 人工授精站稀釋精液稀釋後一日精子形態對體外受精之影 響...75
表12. 人工授精站稀釋精液稀釋後一日之精子形態對保存三日精 液體外受精之影響...76
表13. 人工授精站稀釋後一日之稀釋精液品質與體外受精參數間 之相關係數………..77 表14. 人工授精站稀釋後一日之精液品質與後三日體外受精參數
間之相關係數……...79 表15. 人工授精站稀釋後三日之稀釋精液品質與體外受精參數間
之相關係數………...………..80 表16. 商業猪場 AI 公猪之稀釋後精液品質...82 表17. 商業猪場 AI 公猪稀釋精液保存期間對精液品質之影響…….85 表18. 商業猪場 AI 公猪稀釋精液保存三日之品質...86 表19. 商業猪場 AI 公猪稀釋精液保存期間精子活力百分比累計表.88 表20. 商業猪場 AI 公猪稀釋精液保存期間精子形態百分比累計表.89 表21. 流式細胞儀評估商業猪場 AI 公猪稀釋精液保存期間之品質
變化………...………..90 表22. 商業猪場 AI 公猪稀釋精液保存一日之體外受精參數...91 表23. 商業猪場 AI 公猪稀釋精液保存期間對猪卵體外受精之影響.92 表24. 商業猪場 AI 公猪稀釋精液保存三日之體外受精參數……….94 表25. 商業猪場 AI 公猪稀釋精液人工授精後之分娩率與活仔數...95 表26. 商業猪場 AI 公猪稀釋後精液品質與人工授精參數之相關係
數...96
圖次
頁次
圖 1、精子經 EN 染色後之形態...40
圖 2、精子之成熟形態...41
圖 3、精子之頭巾形態...42
圖 4、精子之正常形態...43
圖 5、精子存活力之螢光染色分析...45
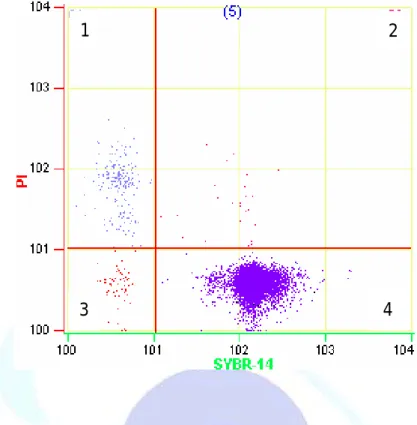
圖 6、流式細胞儀分析精液樣品存活力之點圖...46
圖 7、精子粒線體功能性之螢光染色分析...47
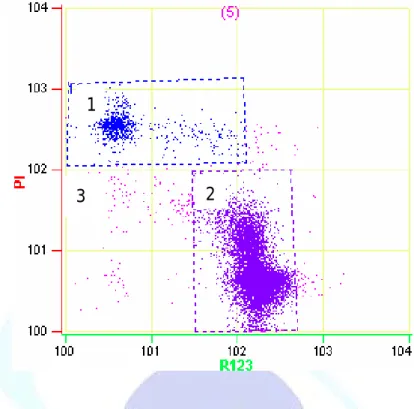
圖 8、流式細胞儀分析精液樣品粒線體功能性之點圖...48
圖 9、經體外受精後 16 - 18 小時,猪卵母細胞被精子穿透之形態...53
圖10、經體外受精後 16 - 18 小時,受精卵母細胞原核之形態...54
圖11、經體外受精後 16 - 18 小時,猪卵母細胞多精入卵之形態...55
圖12、商業猪場 3 頭公猪試驗期間之精液品質變化...84
圖13、商業猪場公猪精子體外穿透率、多精入卵率、平均入卵精 子數與出生活仔數之相關性...97
附次
頁次
附錄 1. 伊紅-苯胺黑精子死活染劑...131
附錄 2. BF3 精子固定液...132
附錄 3. 磷酸緩衝鹽溶液 ( D-PBS ) ...133
附錄 4. 北卡羅萊納州立大學-23 培養液 ( NCSU-23 ) ...134
附錄 5. 精子洗滌液...135
附錄 6. 三羥甲基氨基甲烷緩衝培養液 ( TBM ) ...136
壹、前言
近十年來猪隻人工授精 ( artificial insemination, AI ) 之普及率已 大幅增加,猪隻人工授精技術為有效簡便之育種改良方式,一頭優良 種公猪之精液,可對眾多母猪進行授精,其效益將比自然配種高出數 倍,故預測公猪生育力在育種改良上極為重要。最直接評估公猪生育 力之方法,乃直接以公猪精液對一些母猪進行人工授精,以懷孕率、
分娩率與產仔數為評估指標,惟此需要數量眾多之母猪才具代表性,
消耗大量時間與金錢,故不適合以此為人工授精站公猪生育力之日常 評估。目前台灣地區之人工授精站均以傳統精液檢測方法評估新鮮與 儲存精液之品質,如濃度、活力、形態與存活力等,但未進一步評估 公猪之生育力,因此僅能檢測出生育力極低之公猪,不足以預測公猪 生育力。比起單方面檢測精子結構與功能之方式,直接分析配子間之
交互作用也許更適合做為評估公猪生育力之指標,早在 20 年前,一
般均以去除透明帶倉鼠卵母細胞評估多種哺乳動物精子之受精能 力,惟此方式易造成卵母細胞孤雌致活現象,使其評估有所偏差,若 能使用同種動物之卵母細胞進行測試,將更準確與具有代表性。猪體 外受精系統已證實可鑑定公猪精子經電穿孔處理後之受精能力,且研 究發現體外受精參數,包括:受精率、多精入卵率與平均每顆卵母細 胞鑽入之精子數,在不同公猪間具有顯著差異,因此運用猪卵體外成
熟技術,提供大量之猪卵母細胞,將可鑑定公猪精子受精能力,故本 試驗之目的乃分析人工授精站公猪精液之品質,並運用體外受精系 統,評估公猪稀釋精液之體外生育力,分析精液品質、體外受精與人 工授精間之相關性。
貳、文獻檢討
一、猪人工授精
(一)、人工授精之進展與貢獻
最早有文獻記載之人工授精 ( artificial insemination, AI ) 約始於 200 多年前,首先用於兩棲動物與狗。1900 年人工授精首次被應用於 牛與綿羊,1926 年 Ivanov 嘗試應用於猪,惟到 1930 年間才由 Milovanov et al.試驗成功 ( Serdiuk, 1970 )。
美國政府於 1936 年支持國內乳牛之人工授精,間接促使他國開
始支持人工授精產業,中國大陸於 1956 年推廣猪隻人工授精,台灣
地區於 1958 年開始辦理猪隻人工授精推廣業務。隨著稀釋液配方之
開發與應用,使精液保存更久,品質更穩定,因此逐年增加人工授精 之比例。猪隻人工授精最先於歐洲發展,1970 至 1990 年間,普及率 在某些國家已達90%,美國在 1993 年只有 5 %, 1999 年成長至 50 % ( Johnson et al., 2000 ),歐盟養猪較興盛之國家,2003 年人工授精之 普及率於已達90 %以上,荷蘭更達 95 %,公猪精液幾乎已達最大利 用率。目前台灣猪人工授精之普及率僅 40 %,尚有進步空間 ( 劉, 2004 )。台灣地區受中央畜產會輔導之人工授精站約有 30 家,全年約 供應30 萬劑之稀釋精液,供應劑量有逐年增加之趨勢 ( 王, 2002 )。
人工授精具許多優點,可將單次射精之精液稀釋,配種於多批母
畜,可用於家畜性能之遺傳改良 ( Heape, 1897 ),且因減少公畜之飼
養頭數,可節省大量購買公畜之成本;例如在年產 2000 頭肉猪場,
使用人工授精對發情母猪進行配種,與自然配種之猪場比較,每年可 節省12 萬至 24 萬元 ( 郭, 2007 )。進行人工授精時,公猪並未直接 與母猪接觸,可減少傳染性疾病之傳播,且每次授精前可對精液進行 檢查,確保每次授精之精液品質,提高猪之懷孕率。人工授精可以同 時被用於配種多頭母猪,因此在繁殖管理上,母猪發情可以被同期化 進行批次配種,使仔猪成群飼養,統進統出,有利於疾病之控制。公 猪與母猪之體型差異很大,自然配種時母猪容易受傷害,也可藉由人 工授精之實施,減少母猪傷害之淘汰率。雖然人工授精須花費較多時 間確定母猪之發情期,也須要培養具有熟練技術之人員,且若使用帶 病原之精液,傳播速度也比自然交配快,這些都是人工授精不利之因 素;但若疾病防治切實,精液檢查工作完善,人工授精帶來之效益遠 大於其缺點,這也是人工授精日益蓬勃發展之原因。
(二)、影響人工授精配種效率之因素 1、母猪
雌性哺乳動物一生之卵原細胞數目乃胚胎時期即決定,出生後所 有之卵原細胞即發展為初級卵母細胞,故出生後環境因素之影響,如 食物中毒 ( Alm et al., 2006 ) 可能長久影響卵母細胞之品質。此外內
泌素之調控 ( Hansel and Dowd, 1986 ) 或營養改變 ( Butler, 1998 ) 均會影響母畜之配種效率。
為求提高母猪之懷孕率,在發情期適當之時間進行人工授精極為 重要。母猪離乳時會因下視丘 ( hypothalamus ) 分泌較多激性腺素釋 放素 ( gonadotropin releasing hormone, GnRH ),造成腦垂腺前葉之排 卵素 ( luteinizing hormone, LH ) 潮湧 ( surge ) ( Shaw and Foxcroft, 1985 ),發情再啟,並於LH潮湧後40 - 45小時排卵,人工授精應於排 卵前6小時進行。商業猪場對母猪發情管理可以採同期化方式,除方 便管理母猪群外也大幅節省勞力,可於母猪離乳後24小時先注射馬絨 毛膜激性腺素 ( equine chorionic gonadotropin, eCG ),之後72小時再 注射人類絨毛膜激性腺素 ( human chorionic gonadotropin, hCG ),預 測排卵將在注射hCG後40 - 42小時發生 ( Roca, et al., 2003; Vazquez et al., 2003 );另一有效之同期發情法,乃使用人工合成之前列腺素異
構物或助孕素類 ( Martinat-Botte et al., 1985, 1990; Srikandakumar and Downey, 1989 ),不僅有發情同期化之效果,亦改善夏季母猪GnRH分 泌量較低產生之乏情現象 ( 曾等, 2000 )。
不同品種之母猪繁殖性能具有差異性,通常藍瑞斯與約克夏種之 母猪,平均每窩可以分娩較多之仔猪 ( 鄒, 1998; Baas et al., 1992 ),
而且雜交母猪之繁殖性能亦較純種為佳,具有雜交優勢 ( 鄒等, 1985;
黃等, 2002 )。在母猪產次方面,一般認為經產母猪優於初產者 ( 黃 等, 2002; Bates et al., 1991; Hughes, 1998 ),其母猪之產次介於3至6次 者最佳 ( Yen et al., 1987 )。新母猪之配種日齡亦影響其繁殖性能,太 早配種可能因生理狀況未臻成熟而減少窩仔數,通常新母猪第二或第 三次發情時再配種會有較佳之繁殖成績 ( Brooks and Smith, 1980 )。
2、配種季節
母 猪 夏 季 時 易 發 生 乏 情 或 延 遲 發 情 現 象 ,Koziorowski et al.
( 2006 ) 研究指出,熱季因母猪動情週期為 28 - 30 日,遠較涼季時期 之21 - 22 日長。諸多研究報告亦指出,夏季母猪繁殖性能降低,而 在 涼 季 時 則 恢 復 較 佳 之 繁 殖 性 能 ( Kennedy and Moxley, 1978;
Hurtgen and Leman, 1980; Bates et al., 1991; Love et al., 1993 ),故季節 乃影響母猪繁殖性能之重要因素之一。尤有甚者,學者亦指出母猪具 季節與產次間之交感效應 ( 黃等, 2002; Xue et al., 1994 ),然而也有 報告指出管理方式,如高餵飼量 ( > 3.6 kg / 母猪 / 日 ) 與母猪個別 飼養,大於季節影響 ( Love et al., 1995; Peltoniemi et al., 1999 )。
3、人工授精器具與授精部位
猪人工授精為插入式授精器,操作較為容易,不須目視尋找子宮 頸口,更不必固定子宮頸。通常猪人工授精之授精棒前端製成螺旋或 球型,模仿公猪陰莖螺旋體形狀,俾能在人工授精時被子宮頸鎖住。
黃等 ( 1990 ) 曾研究不同授精器對人工授精效果之影響,顯示球塞 型人工授精棒簡易又經濟。
一般授精器僅將精液注至子宮頸,然而越接近精子與卵之體內受 精 部 位 , 對 提 高 懷 孕 率 越 有 幫 助 , 如 子 宮 內 授 精 ( intrauterine insemination ),比起子宮頸授精有較高之懷孕率與窩仔數 ( Watson and Behan, 2002 ),且若於排卵時進行子宮內授精,母猪分娩率與窩 仔數均高於排卵前與排卵後 ( Roca et al., 2002 )。子宮內授精不僅縮 短精子到達受精地點之路程,可避免白血球之吞噬作用,又因降低精 液逆流之現象,可以大幅降低授精之精子數,增加公猪之使用效率。
授精時間之長短亦影響人工授精之效果,若延長授精時間 5 - 8
分鐘,可增加約10 %分娩率與 0.2 窩仔數;若模仿自然配種時公猪前 腳夾住母猪前胸,也可以提高母猪之懷孕率 ( Bearden et al., 2004 )。
4、公猪精液 (1)、精液處理
目前猪場之人工授精乃以液體稀釋精液為主,但基於基因改良,
具優良基因之精液常來自國外,為確保精液於運輸期間可有效受精,
冷凍精液之技術實乃必須,早期冷凍解凍精液無法成功產下仔猪,直 至1970年始成功應用外科手術 ( Polge et al., 1970 ) 與子宮頸內授精 ( Crabo and Einarsson, 1971 ),使母猪懷孕與分娩,然而冷凍解凍精液
之受精力仍不如新鮮精液,其分娩率與窩仔數均顯著較低 ( Johnson et al., 1981; 郭, 1998 ),而不同形式之冷凍解凍精液,如粒狀與麥管,
其分娩率與窩仔數間無顯著差異 ( 郭, 1998 ),另冷凍解凍精子活力 較差,授精時間以接近排卵為佳,研究建議之授精時間為排卵前4 - 6 小時 ( Bertani et al., 1997 )。
另外一般認為使用同品種兩頭以上公畜之混合精液,理論上會有 互補效果,猪方面之研究顯示混合精液不一定比單一純種公猪較佳 ( Godet et al., 1996; 郭與黃, 2003 )。
利用流式細胞儀 ( flow cytometry ) 進行 X 與 Y 精子之分離,可 能損傷精子 ( Johnson, 2000; Guthrie et al., 2002 ),使性別分選後精子 之懷孕率與分娩率均較未分選者差,如同冷凍解凍精液,此類生育力 不如新鮮精液者,若加以使用內泌素控制排卵時間,可有效增加性別 分選後精液之授精效率 ( Vazquez et al., 2003 )。
精子媒介基因轉殖 ( sperm-mediated gene transfer, SMGT ) 之技 術,精子須先與外源基因共培養外,或利用電穿孔法處理精子,增加 結合外源基因,精子之活力會隨共培養時間增加而下降 ( Wu et al., 2008 ),且提高電場強度對精子進行電穿孔處理,會降低精子頭巾完 整率與體外受精率 ( 陳, 1995 ),因此,這些預先處理之精子常藉子 宮內授精,增加受精之機會 ( Wu et al., 2008 )。
(2)、授精精子數
公猪一次射精之精子總數為 30 × 109以上,自然配種時約 70 % 會因子宮內白血球吞噬作用而死亡,人工授精時約30 – 35 %之精液 逆流 ( Rodríguez-Martínez et al., 2005 ),到達輸卵管受精處之精子數 僅數百隻,因此不易發生多精入卵 ( polyspermy ) ( Hunter, 1996 )。
Steverink et al. ( 1998 ) 研究發現授精之精子數僅 1 × 109 / 80 ml 時,精液逆流量較大之母猪,其懷孕率較差,若精子數增加至3 × 109 以上時則無差異。每次人工授精使用之精子數,根據Weitze ( 1990 ) 建議每劑量含3 × 109之存活精子,實際上歐美國家人工授精之劑量 為2 – 3 × 109 / 80 ml,台灣為 5 × 109 / 80 ml,郭與黃 ( 2003 ) 之研 究發現每劑量含3 × 109或 5 × 109,對母猪繁殖性能並無影響。
授 精 位 置 越 接 近 宮 管 接 合 處 , 可 減 少 100 倍之授精精子數 ( Hunter, 2001 )。一般子宮內授精之精子數約為 1 × 109 / 80 ml ( Watson and Behan, 2002 ),使用外科手術進行子宮角末端授精之精 子數為5 × 108 / 20 ml,即可獲得 70 %以上之懷孕率 ( Wolken et al., 2002 ),若授精位置發生於宮管接合處,精子數可以降至 1 × 107 / 0.5 ml ( Krueger and Rath, 2000 )。
二、公猪生育力
鑒於猪之繁殖性能乃採用母猪配種後懷孕、分娩與產仔性狀,當 做生育力參數,故一般猪場若生產效率不佳,大多歸因於母猪。以猪 人工授精來說,一頭公猪之精液可以配種多頭母猪,若公猪之生育力 不佳,造成之損失將非常慘重,另就遺傳改良之角度而言,具優良基 因之公猪可以一次傳遞於多頭母猪之後代,改良效果遠比母猪速度 快,職是之故,更應重視公猪之生育力。
精液從公猪體內製造到射出,稀釋與儲存,乃至進行人工授精,
被注射到母猪生殖道內,過程中許多因素皆可能影響精液之生育力,
人工授精之影響已於前述,以下從公猪與精液之觀點說明:
(一)、公猪
公 猪 之 產 精 性 能 可 能 因 種 別 與 年 齡 不 同 而 存 在 差 異 ( 許 等 , 1996 ),鄭 ( 1973 ) 研究指出杜洛克 ( Duroc ) 公猪對高溫之耐受性 較差,而隨著公猪年齡之增加,精液量與總精子數上升 ( Swieratra, 1973; Kennedy and Wilkins, 1984 )。此外,對公猪進行生長性能之選 拔亦影響精液品質,生長性能指數高之公猪反而具有較差之產精性能 ( 池等, 1980; 許等, 1996 )。
公猪生殖系統主要包括睪丸 ( testis )、附睪 ( epididymis )、輔性腺 ( accessory glands ) 與陰莖 ( penis ) 等,茲分別介紹如下:
1、睪丸 ( testis )
睪丸為主要製造精子之場所,動物出生時,睪丸內無任何精子,
精子乃日後於生精細管 ( seminiferous tubules ) 內不斷製造而成。成 熟公猪兩個睪丸之重量約為體重之1 / 250,較大之睪丸具有較佳之生 精與配種能力 ( Neely et al., 1980 )。公猪睪丸乃胚胎發育時期於腹腔 內形成,於母猪之懷孕後期,經由腹股溝管 ( inguinal canal ) 落入體 外之陰囊 ( scrotum ),若無正常落下,即稱為隱睪症 ( cryptorchid )。
單側隱睪之公猪尚有生育力,惟雙側隱睪會導致不育,雖可藉由外科 手術治療,但此性狀可遺傳至後代,故若於猪群中發現隱睪者應淘汰。
精子發生 ( spermatogenesis ) 分三個階段,包括精母細胞發生 ( spermatocytogenesis ) 、 減 數 分 裂 ( meiosis ) 與 精 子 形 成 ( spermiogenesis )。精母細胞發生,乃生精細管之基底小室內之前精 原細胞 ( gonocytes ) 於發身 ( puberty ) 時被致活成為精原幹細胞 ( spermatogonial stem cell ),精原幹細胞行有絲分裂 ( mitosis ),產生 初級精母細胞 ( primary spermatocyte ) 之過程。在減數分裂階段,初 級精母細胞進行兩次減數分裂,第一次形成單套染色體之次級精母細 胞 ( secondary spermatocyte ),隨後繼續進行第二次分裂,形成染色 體數減半之精細胞 ( spermatid )。最後進行精子形成,此時精細胞經 一系列外形之變化,包括頭巾 ( acrosome )、赤道區 ( equatorial
region ) 、 頭 巾 後 帽 區 ( post-acrosome cap region ) 、 細 胞 核 ( nucleus )、中節 ( midpiece ) 與尾部 ( flagellum ) 等之形成,細胞質 於最後形成原生質滴 ( cytoplasmic droplet ) 附於頸部 ( neck )。歷經 精子形成之精子 ( spermatozoa ) 再經精子游離 ( spermiation ) 後釋 入 生 精 細 管 中 。 各 物 種 產 生 精 子 所 需 時 間 不 同 , 公 猪 約 需34日 ( Swiestra, 1971 )。
睪丸內一些內泌素之產生亦具有重要功能,抑制素 ( inhibin ) 與 發軔素 ( activin ) 分別於來狄吉細胞 ( Leydig cells ) 與賽透力細胞 ( Sertoli cells ) 被 發 現 有 其 受 體 ; 來 狄 吉 細 胞 產 生 之 催 產 素 ( oxytocin ),可刺激生精細管與附睪之運動;睪固酮在生精細管間之 來狄吉細胞合成,係受排卵素 ( luteinizing hormone, LH ) 所刺激,為 發展雄性第二性徵與正常配種行為所需。雄性動物發身時睪固酮上 升,精原幹細胞被致活而開啟一系列有絲分裂。睪固酮也結合生精細 管內賽透力細胞之結合體,支持精子發生。腦垂腺前葉分泌激濾泡素 ( follicle stimulating hormone, FSH ),刺激賽透力細胞上睪固酮接受體 之 產 生 ,FSH 與 睪 固 酮 之 協 同 作 用 , 使 精 子 發 生 得 以 順 利 完 成 ( Allrich et al., 1982 )。
睪 丸 內 之 血 液-睪丸障阻 ( blood-testis barrier ) 係基底小室 ( basal compartment ) 與近腔小室 ( adluminal compartment ) 產生緊
密接合之複合體 ( junctional complex ),防止精子進入體循環,無障 組之結果將導致抗精子抗體 ( anti-spermatozoal antibodies ) 發生,引 起自體過敏性睪丸炎 ( autoallergic orchitis ),導致生育力下降。生精 細管之管內液組成不同於血漿與淋巴,血液-睪丸障阻可防止離子與 蛋白質等物質自由進入生精細管。
高溫對生精作用產生之影響可由前述之隱睪症得知,睪丸之溫度 應低於體溫4 – 7 ℃,與體溫相同之溫度會導致不育。睪丸不僅靠陰 囊 ( scrotum ) 與精索 ( spermatic cord ) 提供支撐,也調節睪丸之溫 度,陰囊表皮之蒸發作用,也有助於降低睪丸之溫度,另一顯著之降 溫機制乃依賴血液循環系統,動脈血進入睪丸前,須通過蔓狀靜脈叢 ( pampiniform venous plexus ),可有效降低動脈血溫度。
2、附睪 ( epididymis )
睪丸內之生精細管匯集成睪丸網 ( rete testis ) 後經輸出管 ( vasa efferentia ) 連結至附睪,附睪結構上分為頭 ( caput )、體 ( corpus ) 與 尾 ( cauda ) 三部份,精子於此成熟、濃縮、儲存與運輸。精子經輸 出管至附睪頭部時,尚未具有活力與受精力,於附睪尾部之精子始具 此能力。此外,精子形成之最後步驟,產生原生質滴,也於附睪中脫 落,職是之故,原生質滴之有無,成為射出精液之精子成熟指標。公 猪睪丸內精子之濃度約為1 × 108,附睪會吸收來自睪丸之液體,使
精子濃度濃縮至4 × 109,此過程主要發生在附睪之頭部與體部,最 後儲存於附睪尾部。附睪尾部pH低、二氧化碳濃度高、配合高黏稠 度與睪固酮之作用,皆有利於降低精子代謝,並維持精子存活力。
公猪精子於附睪中之運輸過程約需9 - 14日 ( Swiestra, 1971 ),生 精細管不斷生成精子,被強迫通過睪丸網與輸出管至附睪。射精時,
附睪之收縮,促使精子進入輸精管 ( vas deferens ) 與尿道 ( urethra )。
3、輔性腺 ( accessory sex glands )
精液之精漿部分主要由三種輔性腺分泌而成,分別為儲精囊 ( seminal vesicle ) 、 前 列 腺 ( prostate gland ) 與 尿 道 球 腺 ( bulbourethal gland )。儲精囊分泌果糖 ( fructose ) 與山梨聚糖醇 ( sorbitol ),為精子主要能量來源,也分泌磷酸鹽 ( phosphate ) 與碳 酸 鹽 ( carbonate ) 以 維 持 精 液 之 pH ; 前 列 腺 主 要 分 泌 含 鈉 ( sodium )、氯 ( chlorine )、鈣 ( calcium )、鎂 ( magnesium )等離子之 液體,為精子維持正常機能所必須;公猪之尿道球腺分泌膠體於自然 配種時防止精液逆流,惟此膠體須於進行人工授精前過濾之。
4、陰莖 ( penis )
陰莖為雄性動物交配用之性器官,尖端外型因物種不同而有所差 異。公猪陰莖尖端為S型螺旋體,對壓力敏感,但對溫度遲鈍,當螺 旋體部分感受到子宮頸給予之壓力,便會完全伸出且開始射精。公猪
射精大概可區分為三階段,第一階段為含極少精子之澄清液體與膠 體,其次即為富含精子 ( sperm-rich ) 部分,最後為澄清液體與膠體,
整個射精過程約5 - 10分鐘。
(二)、營養
睪 丸 中 富 含 多 元 不 飽 和 脂 肪 酸 ( polyunsaturated fatty acids, PUFA ),使精子膜組成含高比例之PUFA,尤其ω-3系列 ( Lenzi et al., 1996 )。精子富含脂質之膜具重要之生物活性,不僅與精子活力成正 相關 ( Zalata et al., 1998 ),頭部高量之PUFA也在獲能作用 ( Surai et al., 2000 ) 與膜融合 ( Roldan and Harrison, 1993 ) 中扮演重要角色。
故飼糧中額外添加脂肪酸,可改善精子膜之脂質組成 ( Paulenz et al., 1999; Rooke et al., 2001; Strzeżek et al., 2004 ),提高公猪之生育力。
某些微量營養素也影響生殖功能,如矽 ( selenium ) 缺乏造成生 精細管退化,導致精子腺苷三磷酸 ( adenosine trephosphate, ATP ) 濃 度 與 麩 胱 甘 肽 過 氧 化 酶 ( glutathione peroxidase ) 活 性 降 低 ( Marin-Guzman et al., 2000 )。維生素E缺乏導致精原細胞退化,產生 之精子數減少 ( Cooper et al., 1987 ),此外維生素E與矽可以調節前列 腺素F2α ( Prostaglandin F2α ) 之分泌 ( Hope et al., 1975; Doni, et al., 1981 ),影響精子之活力與數量。維生素A係精子形成所必須,賽透 力細胞確實存在維生素A之接受體,飼糧中完全缺乏維生素A時,導
致減數分裂中之精母細胞停止於細紐期。Ivos ( 1971 ) 認為維生素C 可改善熱緊迫公猪之生育力,Audet et al. ( 2004 ) 亦指出,脂溶性與 水溶性維生素之添加,也許可以增加高採精頻率公猪之精液量。
(三)、環境
溫度影響公猪之繁殖性能,與涼季相比,熱季時不僅公猪射出之 精液量與精子數降低,精子活力與正常形態之比率亦降低 ( Mcnitt and First, 1970; Wettemann et al., 1976; Cameron and Blackshow, 1980;
Kunavongkrit and Prateep, 1995; 廖等, 1996 ),此也許與熱季時公猪之 採食量降低有關 ( Rinaldo et al., 2000 )。採食量下降,減少蛋白質攝 取,造成體內雌素二醇17β ( estradiol 17β ) 下降,而使性慾與精 液量降低 ( Louis et al., 1994 )。此外,高溫對公猪生育力之負面效應 也存在個體差異,容易緊迫之公猪會增高此負面效應 ( Cameron and Blackshow, 1980; Kunavongkrit and Prateep, 1995 )。
緊迫與皮質醇 ( cortisol ) 之分泌量有關,公猪在突然接觸較高環
境溫度時,皮質醇會迅速上升,但大部分公猪在 72 小時後會恢復為
正常之皮質醇濃度,表示公猪歷經熱緊迫時,體內會做適當生理調
整,然而在熱季時,日夜溫差往往高於10 ℃,過大之溫度波動也許
令公猪無法調節適應 ( Kunavongkrit et al., 2005 )。
目前猪場對於公猪舍熱季降溫之主要策略,一為灑水系統降溫,
簾式猪舍之公猪,夏季之精液性狀明顯改善 ( 江, 2002 )。
(四)、精液儲存
由於交通運輸之方便性與各猪場之繁殖管理制度之差異,公猪之 稀釋精液不一定當日即被使用,有時會保存3 - 5日,一般稀釋精液儲 存2日內之分娩率約65 – 70 %,5日後約50 % ( Johnson et al., 2000 )。
分娩率降低乃因儲存4日後各項精子品質評估參數均顯著降低所致 ( Vazquez et al., 1998 )。影響稀釋精液保存效果之主要因素為溫度與 稀釋液兩項。儲存期間為使精子新陳代謝降低,以延長其體外存活 力,通常於稀釋劑中添加化學抑制劑,或使用低溫保存方式。
公猪精子外膜之膽固醇含量高於內膜,因此內膜較容易受冷休克 傷害,若精液溫度從35 ℃迅速降低15 ℃以下,精子極易因冷休克而 顯著喪失活力;反之,稀釋後之精液若置於15 ℃以上之溫度2 - 7小 時,精子對冷休克較具抵抗力,緩慢降溫至10 ℃之精液也具此效果 ( Pursel et al., 1973; Butler and Roberts,1975 )。
稀釋液可提供精子活力之能量來源與防止pH之變化,但過度稀釋 時反而大大降低精子之存活力,Watson ( 1995 ) 認為此一稀釋效應 ( dilution effect ) 可能是細胞內成分之流失與精液內保護因子被稀釋 所致,此稀釋效應可藉移除精漿之蛋白質而得到證實,稀釋液中額外 添加血清白蛋白,可再次刺激精子之活力 ( Harrison et al., 1982 )。一
般長效型稀釋劑中含有牛血清白蛋白 ( bovine serum albumin, BSA ) 已被證實可以刺激儲存精液之活力 ( Waberski et al., 1989 ) 與受精 力 ( Waberski et al., 1994 )。
公 猪 射 出 精 液 之pH 約 7.2 - 7.5 間 , 稀 釋 液 中 添 加 碳 酸 氫 鈉 ( sodium bicarbonate ) 或檸檬酸鈉 ( sodium citrate ),可以緩衝儲存期 間pH之波動,惟碳酸氫鈉之添加,可能改變膜脂質結構 ( Harrison, 1996 )。氯化鉀 ( potassium chloride ) 可防止細胞內鉀離子耗盡與維 持活力 ( Alvarez and Storey, 1982 )。精液之稀釋與冷卻均使膜滲透性 增加 ( Ortman and Rodriguez-Martinez, 1994 ),導致游離之鈣離子進 入精子,誘發獲能作用與頭巾反應,此等反應不利精子之儲存,為求 抑 制 此 等 反 應 , 一 般 常 在 稀 釋 液 中 添 加 二 乙 胺 四 乙 酸 ( ethylenediamine-tetra-acetic acid, EDTA ),會抓取包含鈣離子之二價 金屬離子,降低獲能作用與頭巾反應之發生。
稀釋液提供能量,相對地也為細菌之溫床,為達抑菌目的,稀釋 液 中 常 額 外 添 加 抗 生 素 , 如 僅 大 黴 素 ( gentamycin ) 或新黴素 ( neomycin ) , 也 常 聯 合 使 用 盤 尼 西 林 ( penicillin ) 、 鏈 黴 素 ( streptomycin )、林可黴素 ( lincomycin ) 與觀黴素 ( spectinomycin )。
三、公猪生育力之檢測
(一)、公猪生育力之體內測定
公猪生育力最有效指標乃直接配種母猪之生育力參數。體內異源 授精 ( heterospermic insemination ) 因多頭公猪之混合精液配種於同 一頭母猪,減少來自母猪之變異,產下之仔猪可以利用毛色或聚合酶 鏈鎖反應 ( polymerase chain reaction, PCR ) 判斷其父畜,藉以區別特 定公猪之後代數目,排序受測公猪生育力,此檢測方法也與體外穿透 率相關 ( Berger et al., 1996 )。此外,母猪配種後之卵母細胞,防止多 精入卵之機制僅發生於透明帶深處,外部仍容許精子穿透,穿透之輔 精子 ( accessory sperm ) 數目,也可以評估公猪精子之受精能力 ( Ardón et al., 2003; 2005 )。
惟取得母猪生育力參數過程耗時耗費,且需有一定之數量,才能 獲得準確之估值,並不適於實際應用,故發展出以精液品質評估值預 測公猪生育力之方法 ( Malmgren and Larsson, 1984 )。
(二)、人工授精站例行性之精液檢測
依照猪隻人工授精站標準作業書手冊,人工授精站例行之精液檢 查項目應包括:精液物理性狀、精子活力 ( motility )、精子存活力 ( viability )、精子形態 ( morphology )、精子頭巾形態 ( acrosome morphology )、精子濃度 ( concentration )、總精子數 ( total number )
與精子耐久性測驗等,兹分別闡述如下:
1、物理性狀
檢查採集精液,應先觀察其物理性狀,包括顏色、氣味與體積,
通常每次公猪射精之精液量約於150 - 250 ml,但個體變異之存在,有 時低至50 ml,有時高至500 ml。正常之精液應呈乳白色,但精子濃度 越低時顏色越透明,反之,濃厚之精液會呈乳黃色,若有紅褐色或其 他異常色澤,可能受血液或尿液污染。新鮮之原精液應有淡淡腥味,
但若被尿液或包皮內液體污染,可能帶阿摩尼亞味。血球計數盤 ( haemocytometer chamber ) 或光電比色計 ( photoelectric colorimeter ) 常被用於估測精液之精子濃度 ( concentration ) 與總精子數 ( total number ),惟光電比色計須定期進行校正。
2、精子活力
無論是自然配種或人工授精,具有充足活力之精子始可到達受精 部位,完成受精作用,職是之故,精子活力為受精力首要指標,在多 變量模式 ( multivariate model ) 估計影響生育力之精子品質評估參 數中,活力為顯著影響懷孕率與窩仔數之因子 ( Gadea et al., 2004 )。
檢 查 精 子 活 力 之 方 法 通 常 使 用 顯 微 鏡 檢 查 或 電 腦 輔 助 精 液 系 統 ( computer-assisted semen analyzer, CASA)。
3、精子存活力
檢查精子之活力雖可檢查出具活動力之精子,然而精子儲存時可 能呈現假死狀態,故也檢測精子之存活力 ( viability ),常利用死活精 子 膜 完 整 性 不 同 造 成 染 色 之 差 異 , 常 用 之 染 劑 如 碘 化 丙 啶 ( propidium iodide, PI )、SYBR-14、Hoechst 33258、錐蟲藍 ( trypan blue ) 與伊紅-苯胺黑 ( eosin-nigrosin ) 等。
4、精子形態
為求進一步檢測精子之細微結構,亦使用福馬林 ( formalin ) 緩 衝液或含戊二醛 ( glutaraldehyde ) 之固定液,於油鏡下檢查精子之形 態與頭巾完整 ( acrosomal integrity )。精子尾部不含原生質滴,表示 其已完成精子成熟步驟;頭巾完整之精子乃頭巾反應所必須;形態異 常之精子通常不具正常活動力,而無法到達受精部位。
5、精子耐久性測驗
台灣人工授精站通常使用短效型稀釋液,故也定期進行稀釋精液 保存三日之耐久性測試,檢測精子活力,不低於70 %才算通過此一耐 久性測驗,未通過者不能出售。
此類例行之精液檢查,使用之材料便宜且操作簡單,檢查之結果 直接與睪丸產精功能相關,為睪丸發生病變時之重要參數。但此類例 行檢測結果有時相互矛盾,例如精子活力差不代表其存活力不好,而
且上述精液檢查只觀察單一事件,例如存活力參數只判斷死活,並無 其他功能性評估;再者,此類例行檢查的確可檢測出生育力極差之公 猪,但無法比較生育力中等以上公猪之差異性 ( Gadea et al., 1998 ),
故須開發更準確評估公猪生育力之方法。
(三)、人工授精站非例行之精液檢測 1、低滲透壓膨脹測試
獲能作用、頭巾反應與卵之融合作用皆與精子細胞膜之功能性相 關 ( Correa and Zavos, 1994 ),目前已開發低滲透壓膨脹測試 ( hypoosmotic swelling test, HOST ) 檢測精子膜之生物活性。Devrius 與Eriksson ( 1966 ) 首先使用此法測試牛精子膜之生物活性,具活性 者會因溶液流入精子而膨脹,之後更被應用於檢測人 ( Jeyendran et al., 1984 ) 與猪 ( Vázquez et al., 1997 ) 之精子。精液經低滲透壓膨脹
測試,活性較高之精液確實具較高之體外穿透率 ( Gadea and Matás, 2000 ),進行人工授精後母猪之分娩率也較高 ( Gadea et al., 1998;
Perez-Llano et al., 2001 )。另一類似低滲透壓膨脹測試之檢測方法為 滲透壓抵抗測試 ( osmotic resistance test, ORT ) ( Schilling and Vengust, 1987 ),主要觀察在低滲透壓溶液作用後,精子頭部頭巾完 整比率。因低滲透壓膨脹測試之尾捲曲較滲透壓抵抗測試之頭巾完整 較容易被觀察,且兩者與生育力之相關值接近 ( Gadea et al., 1998;
Gadea and Matás, 2000 ),故低滲透壓膨脹測試使用較為廣泛。
2、離心法
也有利用離心之方式區分精子活動力之方法,上游法 ( swim-up ) 與Percoll密度梯度離心法。上游法通常將精液以低速離心 ( 如500 rpm ),取上層可抵抗離心之精子,會有較佳之活力。Percoll密度梯度 離心後可分不同濃度之Percoll溶液 ( 如90 %、70 %與50 % ),在高濃
度Percoll層中之精子活力較佳。應用倉鼠卵進行穿透試驗,顯示
Percoll篩選之精子對倉鼠卵之穿透力較上游法篩選者為佳 ( Berger and Parker, 1989 )。雖然Percoll篩選之精子與單精入卵率具顯著正相 關,卻與體內生育力間無相關性存在 ( Popwell and Flowers, 2004 )。
3、甲醇緊迫法
較新發展出之甲醇緊迫法 ( methanol stress ),觀察精子與甲醇作 用後之活力,結果與人工授精後母猪之不重發情率具顯著正相關 ( Sutkeviciene et al., 2005 )。
4、電腦輔助之精液檢測
前述之精液檢測方法,不論形態或染色之結果,皆使用顯微鏡觀 察,為主觀之判斷,可能因操作者不同而產生差異,且通常為獲得正 確之觀測值,每項檢查之精子數為 100 至 200 隻,幾項例行檢查做完 耗費相當長之時間,職是之故,具備客觀、大量、快速等優點之電腦
輔助分析系統,遂被廣泛使用。
(1)、流式細胞儀 ( flow cytometry )
流式細胞儀為觀測細胞各式狀態之儀器,包含分裂週期、DNA ( deoxyribonucleic acid ) 含量、細胞凋亡 ( apoptosis )、鈣離子濃度變 化等。此技術乃細胞於流動情況下被觀測與分類,流式細胞儀可概分 成三系統,1、流體學系統 ( fluidics ):液體加壓使細胞可一顆顆排 列,2、光學系統 ( optics ):使細胞被雷射光激發後,散射光與螢光 經一連串光學鏡片過濾,3、電子系統 ( electronics ):將顯微影像轉 成電子訊號,並以電腦紀錄分析。
Evenso et al. ( 1980 ) 首先以流式細胞儀分析精子之 DNA 含量,
之後,此儀器便廣泛應用於精液之分析,例如存活力 ( viability )、頭 巾 完 整 性 ( acrosomal integrity ) 、 粒 線 體 功 能 ( mitochondrial function )、獲能狀態 ( capacitation status )、膜流動性 ( membrane fluidity ) 與 DNA 狀態 ( DNA status ) 等,分述如下。
A、精子之死活染色
應 用 流 式 細 胞 儀 檢 測 精 子 存 活 力 , 最 初 以 螢 光 染 劑 FDA ( fluorescein diacetate ) ( Resli et al., 1983 ) 或較穩定之 CAM ( calcein acetomethyl ester ) ( Donoghue et al., 1995 )染色,其區別死活之染色原 理為染劑經由膜進入精子,被活精子之酯酶 ( esterases ) 轉變為不滲
透膜之螢光物質。然近年來較常使用可滲透膜之 DNA 染劑,如 SYBR-14,其變異性較前述依靠酵素之染劑小,且染色結果較一致 ( Garner et al., 1996 )。死亡之精子,可被不滲透膜之染劑染上,此類 染 劑 包 括 :PI ( Garner and Johnson, 1995 )、EthD-1 ( ethidium homodimer-1 ) ( Althouse and Hopkins, 1995 ) 或 Hoechst 33258 ( De Leeuw et al., 1991 ) 等。結合可以染上死亡或存活之此兩類染劑,可 以提供更準確之結果,一般較常使用為SYBR-14 與 PI 之組合,染色 時間短,溫度要求不嚴格,兩者皆為核染劑,試驗誤差小。
B、精子之頭巾完整性
一般使用凝集素 ( lectin ) 檢測精子頭巾狀態,若精子已發生頭巾 反應或頭巾破損,其頭巾外部醣蛋白 ( glycoprotein ) 可被結合螢光 物質FITC ( fluorescein isothiocyanate ) 之 PNA ( peanut agglutinin ) 染上 ( Waterhouse et al., 2004 );另一檢測頭巾反應與破損之凝集素 為FITC-PSA ( pisum sativum agglutinin ),可特異性染上頭巾基質之 醣 蛋 白 。 此 外 , 完 整 之 精 子 頭 巾 為 酸 性 , 可 用 嗜 酸 性 染 劑 LysoTrackerTM標記 ( Thomas et al., 1997 )。
C、精子之粒線體功能
粒 線 體 功 能 為 精 子 活 動 之 重 要 指 標 , 粒 線 體 之 電 子 傳 遞 鏈 ( electron carrier chain ) 若具有活性,內膜產生電位差,可被親脂性之
陽離子染劑Rhodamine 123 染上粒線體內膜 ( Garner et al., 1997 )。另 一更敏感之親脂性陽離子染劑為JC-1 ( Huo et al., 2002 ),當粒線體膜 電位小於100 mV 時為單體 ( monomer ),發綠色螢光;膜電位增高,
隨著量之增加而轉變為橘色螢光之J 聚體 ( J-aggregates )。
D、精子之獲能狀態
精子鈣離子之增加為獲能作用之特徵,因此可以利用結合鈣之螢 光物質檢測,如氯四環黴素 ( chlortetracycline, CTC ) ( Maxwell and Johnson, 1997 ) 或 AM ( fluo-3-acetomethoxy ) ( Harrison et al., 1993 ),檢測精子內鈣離子之濃度,作為精子獲能作用之評估指標。
獲能作用另一特徵為膜之流動性改變,造成脂質雙層不對稱性被破 壞。M540 ( Merocyanine 540 ) 為可插入精子外膜孔中之螢光物質,
可 藉 此 得 知 膜 流 動 性 之 變 化 ( Harkema et al., 1998 )。此外,
FITC-Annexin V 與 Ro-09-0198,可分別結合獲能作用時外露於膜外 之 磷 脂 絲 氨 酸 ( phosphatidylserine, PS ) 與 磷 脂 醯 乙 醇 胺 ( phosphatidylethanolamine, PE ) ( Gadella and Harrison, 2002 ),因此均 可用於檢測精子之獲能狀態。
E、精子之DNA結構
目前廣為應用精子核染質結構分析 ( sperm chromatin structure assay, SCSA ) 檢測精子DNA結構之完整性,原理為酸處理後之精
子,結構不穩定之精子會因此變性,以AO ( acridine orange ) 染色,
雙股DNA為綠色,變性之單股DNA為紅色 ( Ambrogi et al., 2006 )。
另 外 應 用TUNEL ( terminal deoxynucleotidyl transferase-mediated dUTP nick-end labeling ) 檢測精子DNA之片段化,利用標記螢光之核 甘酸 ( nucleotide ) 與斷裂之DNA結合,藉此得知DNA片段化程度 ( Nakai et al., 2007 )。
雖然目前流式細胞儀之應用仍受限於儀器之高價位,且螢光染劑 通常所費不眥,尚未被廣泛應用於檢測精液品質,但其檢測精液樣品 具有快速且大量之優點,更可利用兩種以上螢光物質,同時檢測多項 參數,且只有顆粒物質可被偵測,不必沖洗游離染劑,將可成為檢測 精子品質之利器。
(2)、電腦輔助精子分析 ( Computer-assisted semen analysis, CASA ) 鑒於一般活力之顯微鏡檢查方式無法提供精子運動品質之資 訊,遂發展出電腦輔助精子分析系統,除了可以分析精子之一般活力 外,更可以評估多項活力指標,包括精子獲能作用後之過動現象 ( hyperactivity ) ( Schmidt and Kamp, 2004 )。
CASA 通常被用於分析下列數種精子活力指標,包括曲線速率 ( curvilinear velocity, VCL )、活動路徑平均速率 ( average path velocity, VAP )、直線速率 ( straight line velocity, VSL )、側頭位移之振幅
( qmplitude of lateral head displacement, ALH )、直線性 ( linearity, LIN )、搏動頻率 ( beat cross frequency, BCF )、平均角位移 ( mean angular displacement, MAD )、每隻精子頭部路徑面積。
比起不同CASA 系統,操作者之經驗與精液品質之差異為檢測變
異主要來源 ( Holt et al., 1994 ),雖然目前與體內生育力尚無顯著之 相關 ( Hirai et al., 2001; Quintero-Moreno et al., 2004 ),但 Holt et al.
( 1997 ) 與 Farrell et al. ( 1998 ) 均曾指出,VAP、VCL 或 ALH 與人 工授精後母猪之不重發情率具顯著相關性,尤有甚者,使用多項 CASA 參數之多重回歸 ( multiple regression ) 更能分析此相關性 ( Mortimer et al., 1995 ),惟 CASA 之參數與體外受精率並無顯著相關 ( Grunert et al., 1989 )。
除CASA之應用外,其他種類之儀器如自動精子形態分析儀
( Automated sperm morphology analysis, ASMA ) 與精子品質分析儀 ( Sperm Quality Analyzer, SQA-IIC ),已用於許多物種之精子品質分 析,除檢測精子活力外,更可檢測精子之形態與濃度,然此類儀器甚 少應用於養猪產業,但隨著人工授精普及率之上升,將可能普遍用於 養猪業 ( Hirai et al., 2001; Vyt et al., 2004 )。
雖CASA 參數與精液之體內生育力之相關尚有爭議,但 CASA 確 實可準確分析精子活動形態之微小差異,亦可檢測精子於儲存、冷凍
或其他處理後對精子活力造成之影響 ( Amann and Katz, 2004 )。如同 流式細胞儀,在快速且準確之原則下,若能調降儀器價格價格,與更 適合養猪產業之設計,也有可能成為例行性之精液檢測方法。
5、分子 ( molecule ) 與基因 ( gene ) 之檢測
為提早評估公猪之產精潛能,並用於改良公猪之精液品質,分子 與基因檢測之發展確實提供新方向,其進展概述如下。
(1)、分子
動物體內許多分子已被鑑定出可影響精液之品質,例如生理濃度 之類胰島素生長因子 ( insulin-like growth factor, IGF ) 可增加牛精子 洗滌後之活力 ( Henricks et al, 1998 ),在人類精液之研究更證實,精 漿中IGF 之濃度與精液品質呈正相關 ( Glander et al, 1996 ),然而在
猪之研究卻顯示,精漿中IGF 濃度與精液品質或配種後之體內生育力
無關 ( Hirai et al., 2001 )。
在人類之試驗顯示,生育力正常與不育者間之腫瘤壞死因子 ( tumor necrosis factor, TNF ) 含量並無差異 ( Papadimas et al, 2002 ),然而在猪之研究顯示,TNF 與精子活力及存活力間具有正相 關,與精子尾部形態異常呈負相關 ( Turba et al., 2006 )。
前已述及,精子膜富含不飽和脂肪酸,使其極易遭受氧化傷害,
尤其是儲存期間精子之氧化傷害更明顯 ( Cerolini et al., 2000 )。熱緊
迫蛋白 ( heat shock protein, HSP ) 為已知之保護因子,其中 70 kDa HSP ( HSP70 ) 與精液品質相關 ( Huang et al., 2000 ),且抗 HSP70 抗 体添加於精液中,顯著降低精子之體外受精率 ( Spinaci et al., 2005 )。
頭巾素活性 ( acrosin activity ) 之檢測也被建立做為頭巾完整性 之指標 ( Penn et al., 1972 ),具頭巾素活性之精子會於明膠 ( gelatin ) 周圍形成消化暈 ( digestion halo ),但此一檢測結果卻與體內生育力 不具相關性 ( Popwell and Flowers, 2004 )。
ATP 濃度為精子活力之重要參數 ( Brackett and Williams, 1967 ),
ATP 濃度較高之精子具較佳之體外穿透率 ( Gadea and Matás, 2000 ),但與窩仔數之相關卻不顯著 ( Gadea et al., 1998 )。
(2)、基因
影響母猪窩仔數與排卵率之基因 ( Linville et al., 2001 ),包括一 些內泌素與其受體,均與公猪生殖相關,被視為影響公猪精液性狀之 候選基因 ( candidate gene )。
前述熱緊迫蛋白 ( HSP70.2 ) 顯著影響熱季公猪之總精子數與精 子形態 ( Huang et al., 2002 )。輔肌動蛋白 ( actinins ) 基因 ( ACTN ) 於精子中表現,與精子頭巾反應相關 ( Casale et al., 1988 )。
泌乳素 ( prolactin ) 協同 LH 作用於來狄吉細胞,大鼠試驗證實 其受體與精子產生相關 ( Hondo et al., 1995 ),人類精漿中泌乳素濃度
亦與精子濃度及活力相關 ( Aiman et al., 1998 ),然而泌乳素受體基因 ( PRLR ) 卻不影響公猪精液性狀與體內生育力 ( Lin et al., 2006 )。
下視丘分泌之GnRH,可開啟 LH 與 FSH 之合成與釋放,影響精 子之發生,Lin et al. ( 2006 ) 研究證實 GnRH 受體基因 ( GNRHR ) 確 實影響精子之活力、成熟與形態異常。
FSH 除影響精子之發生外,更影響公猪睪丸形態與功能 ( Zanella et al., 1999 )。FSH 乃不同基因產生之α與β次單位所結合之異雙聚
體 ( heterodimer )。公猪中 FSHB 基因之表現與發軔素具正相關 ( Li et al., 1998 ) , 基 因 剔 除 FSHB 之 小 鼠 睪 丸 較 小 且 精 子 稀 少
( oligospermia ) ( Layman, 2000 ),然而 FSHB 基因卻不影響公猪之精 液性狀與體內生育力 ( Lin et al., 2006 )。
與FSH 相似,LH 亦由兩次單位α與β所組成,LHB 基因之表現 與曼龍 ( blue gourami ) 之精子發生相關 ( Degani et al., 2003 ),人類 LHB 基因之突變,造成 LHβ次單位之不活化,而導致自發性發身缺
乏與不育 ( Huhtaniemi et al., 1999 )。然而 LHB 基因亦不影響公猪之 精液性狀與體內生育力 ( Lin et al., 2006 )。
抑制素及發軔素與精子之發生具有相關,在小鼠之研究指出,兩 者調控FSH之分泌與性腺功能 ( Cho et al., 2001 )。精漿中抑制素之濃 度可以反應精子發生與生精細管之狀態 ( Hu and Huang, 2002 )。抑制
素β之兩次單位基因INHBA與INHBB亦調控大鼠之精子發生 ( Kaipia et al., 1992 ),而猪之INHBA基因顯著影響精子之成熟與形態異常,
INHBB則影響精子濃度 ( Lin et al., 2006 )。
許多與精液品質相關之基因陸續被提及,例如類固醇 21-羥化酶
( steroid 21-hydroxylase ) 基因 ( CYP2 ) ( Kmiec et al., 2002 )、磷酸甘 油酸激酶2 ( phosphoglycerate kinase 2 ) 基因 ( PGK2 ) ( Chen et al., 2004 ) 與 ryanodine 受體基因 ( RYR1 ) ( Urban and Kuciel, 2001 ) 等,基因乃與生俱來,若於出生後即檢測,及早淘汰基因不良之公畜,
減少飼養將來可能生育力不佳之公猪,可以節省可觀之飼養經費。
四、公猪生育力之體外測定
上述精液品質之檢測方法,通常僅單方面檢測精液樣本,但受精 作用乃精子與卵母細胞之交互作用,因此若能準備卵母細胞,應可以 更準確評估精子之受精能力。
哺乳動物之體外受精 ( in vitro fertilization, IVF ) 源自於 Chang ( 1959 ) 所創,以兔子體外成熟 ( in vitro maturation, IVM ) 之卵母細 胞進行體外受精,成功產下子代。猪體外受精技術之開發,係Cheng ( 1985 ) 所建立,乃經由調整培養液之 pH 值、提高鈣離子濃度與受 精之培養溫度,順利完成猪卵之體外受精,並產下子代。體外受精不 僅有助受精機制之研究,也可被應用於檢測精子之受精能力。
(一)、影響體外受精之因素
雖然應用體外受精技術檢測精子受精能力,可以控制各項條件,
減少母猪體內之變異,然而一些因素也會影響體外受精之結果,分別 闡述於下。
1、卵母細胞
進行精子受精能力所使用之卵母細胞分為兩種,第一種為體外成 熟卵母細胞,經由屠宰場取回女猪之卵巢,在實驗室取得生發泡 ( germinal vesicle, GV ) 階段之卵母細胞,經由 44 至 48 小時體外成 熟培養,使其發育至第二次減數分裂中期 ( metaphase-II, MII );第二 種為直接經由外科手術取得之體內成熟卵母細胞。體外成熟者須將卵 巢保持在 30 ℃以上,若低於 25 ℃將降低卵母細胞之成熟能力 ( Yuge et al., 2003 );另外,體內成熟之卵母細胞因取得不易,故目前 研究多採用體外成熟之卵母細胞。
體內成熟之卵母細胞被排到輸卵管時,外圍包覆著卵丘細胞,雖 然GV階段之卵母細胞,其外圍卵丘細胞之多寡並不影響精子之穿透 ( Matás et al., 1996 ),而成熟卵母細胞外圍,卵丘細胞呈現粘稠且擴 散之現象,受精時卵丘細胞之存在,有助於精子之穿透作用與雄原核 之形成 ( Kikuchi et al., 1993 ),尤有甚者,卵丘細胞更被證實可以支 持早期胚之發育 ( Yamauchi and Nagai, 1999 ),職是之故,挑選體外
受精之卵母細胞時,應選擇有卵丘細胞之卵丘-卵母細胞複合體 ( cumulus-oocyte complex, COCs )。
2、精子
精子之品質對受精結果之影響已如前述,惟體外受精與體內受精 之主要差異,乃在自然配種時,精子之獲能作用是在雌性生殖道中完 成 ( Rodríguez-Martínez et al., 2005 ),而進行體外受精時,事先對精 子進行體外獲能處理。公猪精子於16 至 18 ℃靜置 16 小時以上,再 經洗滌之動作,可有助移除去獲能因子 ( decapacitation factors ),才 能順利完成體外受精 ( Cheng, 1985 )。
3、培養液組成
精子與卵母細胞被共培養於培養液中,因此培養液之組成亦影響 受精之結果。其中之鈣離子不僅是精子獲能所需,亦為卵母細胞發育 所需,職是之故,鈣離子之添加有利於體外受精 ( Cheng, 1985 )。重 碳酸鹽 ( bicarbonate ) ( Suzuki et al., 1994 )、三羥甲基氨基甲烷 ( tris ) 與胎牛血清有助於精子之獲能作用 ( Abeydeera and Day, 1997a ),咖 啡因 ( caffeine ) 可延長並增加精子活力 ( Garbers et al., 1973 ),提高 細胞內環磷酸腺苷 ( cyclic adenosine monophosphate, cAMP ) 之濃度 ( Casillas and Hoskins, 1970 ),容易使精子產生獲能作用與頭巾反應 ( Funahashi et al., 2000 )。每次使用之猪濾泡液 ( porcine follicular fluid,
PFF ) 或BSA,其成份具有變異性,恐影響體外受精之結果,因此研 究者積極發展不含血清之培養液 ( Abeydeera et al., 1998; Kishida et al., 2004; Katayama et al., 2007 )。
4、精子與卵母細胞比例
多 精 入 卵 一 直 是 體 外 產 製 猪 胚 之 主 要 障 礙 ( Niwa, 1993;
Funahashi and Day, 1997; Kikuchi et al., 2002 ),與體內受精不同者,
乃體外受精之精子數遠高於體內受精者,雖然進行體外受精時減少精 子數,可以增加單精入卵率 ( monospermy rate ),但也伴隨著穿透率 之降低 ( Abeydeera and Day, 1997b; Gil et al., 2004a );反之,受精時 較多之精子數亦同時增高多精入卵率 ( Xu et al., 1996 )。而依照 Cheng ( 1985 ) 建議之體外受精之精子濃度,以 105至106 / ml 較適當。
5、共培養時間
精卵共培養時間也會影響精子對卵母細胞之穿透率,目前多使用 5 至 6 小時之共培養時間 ( Abeydeera and Day, 1997b; Gil et al., 2003 ),縮短共培養時間,的確可以提高單精入卵率 ( Coy et al., 1993 ),Gil et al. ( 2004b ) 證實共培養時間 1 小時與 6 小時之單精入 卵率顯著高於10 與 30 分鐘,卻不影響隨後胚之發育。
(二)、體外受精評估公猪生育力
精子於受精作用時,第一障礙為卵丘細胞 ( cumulus cell ) 與透明
帶,因此常用穿透率 ( penetration rate ) 評估精子之體外受精力。
Yanagimachi ( 1972 ) 證 實 公 猪 精 子 可 以 穿 透 無 透 明 帶 之 倉 鼠 ( hamster ) 卵母細胞,之後去除透明帶之倉鼠卵母細胞被用來檢測公 猪、牛與人等精子之受精能力 ( Imai et al., 1977; Bousquet and Brackeet, 1982; Shibahara et al., 1998 ),然而若能使用同種之卵母細胞 進行體外受精,將更符合自然之方式。
應 用 猪 卵 母 細 胞 進 行 精 子 之 體 外 穿 透 試 驗 , 生 發 泡 階 段 ( germinal vesicle, GV ) 之卵母細胞,與成熟卵母細胞具有相似程度 之被穿透能力 ( Martínez et al., 1993 ),可作為精子受精力之評估指標 ( Gadea and Matás, 2000 ),亦曾被用於評估新鮮精液與保存精液之受 精力 ( Vázquez et al., 1998 )。應用 GV 階段之卵母細胞進行精子之體 外穿透試驗,不需進行卵母細胞之體外成熟,可快速取得精子體外穿 透之結果,但並未進一步觀察受精後之發育,因此無法得知雄原核形 成與隨後胚發育之能力。
體外競爭試驗 ( competitive test ) 因使用同批卵母細胞,可減少 卵母細胞之變異,通常以特異性染劑對公猪精子進行染色,藉以區別 卵 母 細 胞 被 特 定 公 猪 之 精 子 穿 透 之 數 目 , 排 序 受 測 公 猪 生 育 力 ( Braundmeier et al., 2004 ),惟此方法只能檢測出少數公猪之生育力。
體外受精評估公猪生育力之最佳參數,係胚之生產能力 ( Larsson
and Rodriguez-Martinez, 2000 ),然而猪胚體外生產迄今困難重重 ( Day, 2000; Coy and Romar, 2002 ),職是之故,目前仍以體外受精參 數為主,而非胚發育參數。每顆卵母細胞被穿透之平均精子數,雖然 不代表體內受精之正常現象,但也許是高受精力公猪精子之指標。
參、材料與方法
一、稀釋精液之來源
本試驗所使用之稀釋精液係直接購買自宜蘭、苗栗、雲林與台南 等4處之人工授精站,不指定公猪,經由宅配運送至本校,共評估36 件稀釋精液樣品。另選擇宜蘭地區1間商業猪場進行人工授精,耳號 D593-1、D706-3與D706-5共3頭杜洛克 ( Duroc ) 公猪被用於本試 驗,D593-1為36月齡,後兩者為16月齡,每週三與週六以手握法取得 原精液,直接以BTS ( Beltsville5Thaw Solution ) 稀釋液進行1:1稀 釋,隨即帶回實驗室進行精液品質之檢測。
二、精液品質評估
本試驗首先按照人工授精站例行之精液檢測方法,進行精液品質
之評估,檢測方法係參考 2004 年再版之猪隻人工授精站標準作業書
手冊,檢測項目包括:精子活力 ( motility )、存活力 ( viability ) 與 形態 ( morphology ),各項檢測方法分述如下:
(一)、活力
取稀釋精液7 μl 滴在已預熱 39 ℃之載玻片上,蓋上蓋玻片後,
置於39 ℃加熱板上約 5 秒,以位相差顯微鏡 100 倍觀察,隨機觀察 10 隻精子,紀錄會動之精子所佔比率,隨機觀察 5 個不同視野,取 其平均值代表精子之活力。
(二)、存活力
依照 2004 再版之猪隻人工授精站標準作業書手冊,配製伊紅-苯 胺黑 ( eosin-nigrosin ) 死活染劑 ( 附錄 1 ),1 ml 染劑中加入 50 μl 之稀釋精液,置入37 ℃含 5 % CO2之培養箱中作用 15 分鐘,之後 取7 μl 置於載玻片上,蓋上蓋玻片後,以位相差顯微鏡 400 倍觀察,
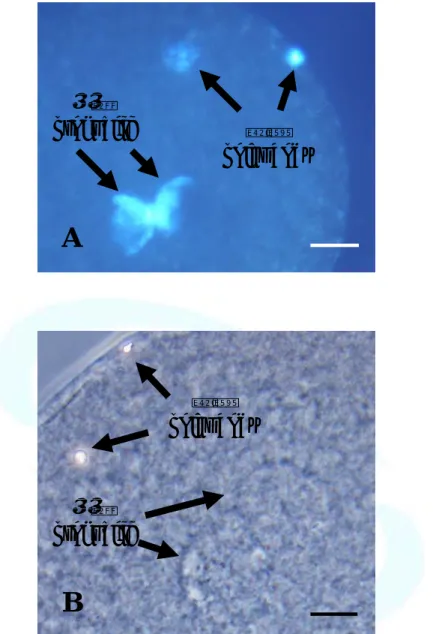
對應之光圈型號為0,透明未染上色之精子為活精子,死亡之精子會
被伊紅 ( eosin ) 染上紅色 ( 圖 1 )。隨機觀察 200 隻精子中存活精子 比率。
(三)、形態
觀察精子形態之固定液係含8 %戊二醛 ( glutaraldehyde ) 之 BF3 ( 附錄 2 ),先以 1:1 比例與稀釋精液混合後,取混合液 3 μl 滴在載
玻片上,蓋上蓋玻片後,以位相差顯微鏡 1000 倍油鏡觀察,分別觀
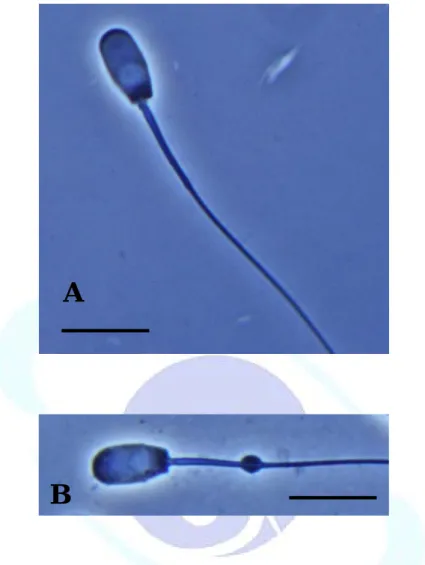
察精子之成熟率、頭巾完整率與形態正常率。成熟率係指不含原生質 滴精子佔總觀察精子數之百分比 ( 圖 2 );頭巾完整率係頭巾完整之 精子佔總觀察精子數之百分比 ( 圖 3 );形態正常率係成熟、頭巾完 整與形態正常之精子佔總觀察精子數之百分比 ( 圖 4 ),每項形態指 標皆隨機觀察200 隻精子。
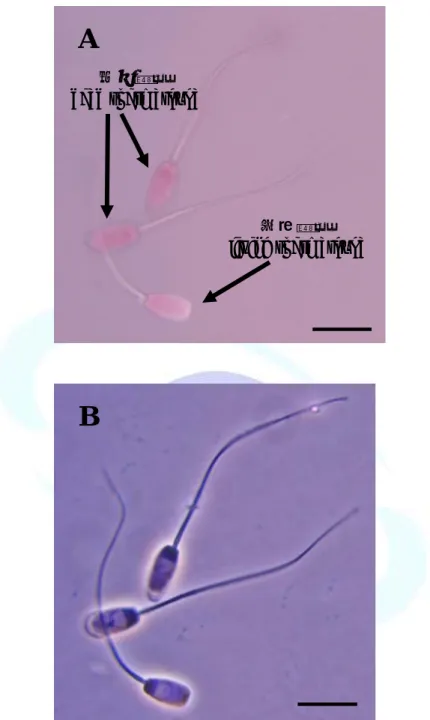
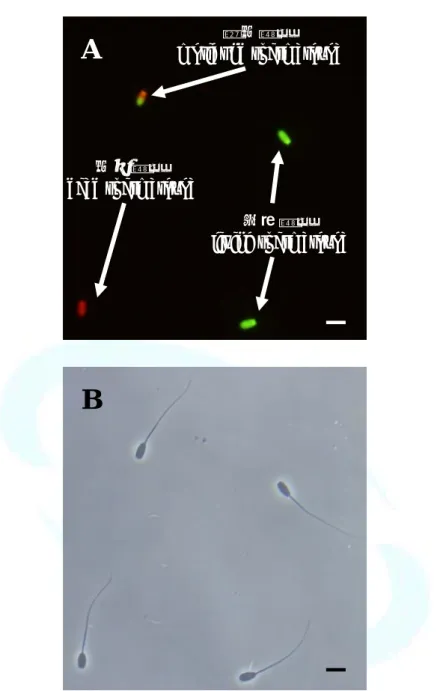
圖1、精子經 EN 染色後之形態 ( A )。死亡之精子被染劑呈紅色,存 活精子未被染色而呈現透明。圖B 為位相差之視野。Scale bar = 10 μm
Fig. 1. Micrograph of boar spermatozoa stained with eosin and nigrosin stain ( A ). The dead spermatozoa stained red, the living spermatozoa did not stain. The phase contrast microscope was used ( B ). Scale bar = 10 μm
存活精子 living spermatozoa 死亡精子
dead spermatozoa