國立臺灣大學醫學院臨床醫學研究所 碩士論文
Graduate Institute of Clinical Medicine College of Medicine
National Taiwan University Master Thesis
在臨床期別T1aN0M0之非小細胞肺癌,淋巴腺轉 移的預測因子
Predictive factors of lymph node metastasis in clinical T1aN0M0 non-small cell lung cancer
劉昭宇 Chao-Yu Liu
指導教授﹕陳晉興 教授
Advisor: Jin-Shing Chen, M.D., Ph.D.
中華民國 107 年 7 月
July 2018
誌謝
與陳晉興教授的認識是一個偶然的機緣。幾年前在一個陳教授主辦的工作坊 上,我試探性的問了一句:陳老師,如果我念台大臨醫所,能找您當我的指導老 師嗎?陳老師毫不猶豫的大聲說:沒問題!我很樂意! 這對一個從來沒有在台大 念過書,也不是從台大醫院訓練出來的臨床醫師而言,無疑是個最熱情的擁抱。
之後我真的念了台大臨醫所在職碩士班,並且跟陳教授有更多的接觸,更感受到 陳教授的熱情和友善是真摯的。在念臨醫所的過程中,其實能跟陳教授見面的時 間有限,畢竟我們都是臨床外科醫師,但是在工作繁忙之餘,每個月固定一個星 期天的早上,我常常在陳教授主導的研究會議上與陳教授以及其研究團隊的成員 同聚一堂,並且聆聽大家分享各自的研究進度和方向。坦白說,在那個場合,陳
教授跟團隊大家的分享和指教,讓我覺得收穫最大,我常開玩笑的說:「我臨醫所
真正上到的課其實就是在陳教授的研究會議中上的」,這句話,其實在我心中並不
是開玩笑。
這篇碩士論文的研究,其實就是陳教授眾多研究主題中的一個。陳教授在最 近這幾年在早期肺癌的努力,已有豐碩的成果,是大家有目共睹的。從大量的臨 床資料中,經過團隊成員的努力整理,便能夠回答很多我們臨床外科醫師天天所 面對的臨床問題。這些資料,無疑的是我們有心從事臨床研究的醫師最大的寶藏。
這篇論文的產生,只是研究的開端,並不是結束,還有許許多多臨床的問題有待 我們接下來的努力去尋找解答。
我覺得非常榮幸的能夠成為陳晉興教授研究團隊的一員。在陳教授的身上,
我不僅學到做研究的基本方法和態度,更學到「泰山不讓土壤,故能成其大;河 海不擇細流,故能就其深」的泱泱氣度。碩士論文只是研究路上的一個逗號,不 是句號,我將秉持熱情,繼續在研究之路上享受學習的過程!
中文摘要 背景
腫瘤體積較小的肺癌,在近年來有愈來愈多的病例因為電腦斷層篩檢的普即被 早期發現。針對這些小的肺癌,肺局部切除手術已被許多文獻報告其療效相當於 肺葉切除,包括病人術後的存活期。肺局部切除有保留病患肺功能的優點。然而 在決定是否使用局部切除前,預測該病人的淋巴腺轉移狀態是一件非常重要的工 作。在臨床分期T1N0M0的患者中,我們發現有一部分的病人,其預後特別差,通 常跟手術後發現淋巴腺轉移(nodal upstaging)有關。因此能否在術前預測這群病 人當中,什麼樣的患者其淋巴腺轉移的風險很高,是個重要的議題。在我們的研 究中,我們的目標是要評估在肺腺癌腫瘤大小等於或小於兩公分的腫瘤中,淋巴 節轉移的預測因子。
研究方法與材料
我們回溯性的蒐集自 2011 年 1 月至 2015 年 12 月在台大醫院接受肺癌手術的 肺腺癌病患。我們特別要研究的預測因子為腫瘤大小、術前血清 Carcinoembryonic antigen (CEA)值、電腦斷層影像上腫瘤毛玻璃部分佔整體腫瘤大小的比例。我們 將用邏輯斯回歸方法來評估各項變數對淋巴腺轉移的預測價值。
結果
總共 770 位病患納入本次研究。14 位(1.8%)為術後淋巴腺轉移(pN+)的患者。
比較大的腫瘤大小,毛玻璃變化比例較少的,以及較高的血清 CEA 值是術後淋巴 腺轉移的顯著預測因子。從腫瘤的組織病理亞型來看,較少 lepidic 的部份,有 臟層肺膜的侵犯、和有淋巴血管的侵犯也跟淋巴腺轉移有密切的相關。若將術前 的連續變項因子改為類別因子,我們可得到腫瘤大小≥ 1.5 cm 、血清 CEA 值≥ 3 ng/mL、和毛玻璃變化佔腫瘤比例< 25%有顯著的淋巴腺轉移的預測價值。
結論
在臨床分期為 T1aN0M0 (腫瘤≦2 公分)的非小細胞肺癌患者中,腫瘤大小、
術前血清 CEA 值、以及電腦斷層影像毛玻璃變化(GGO)所佔的比例,是為預測術後
淋巴腺是否轉移的顯著的預測因子。臨床實務上,若腫瘤< 1.5 公分,電腦斷層 影像上腫瘤呈現以 GGO 為主的影像型態,並且患者術前血清 CEA < 3 ng/mL,可以 選擇性地避免進行根除性淋巴結廓清,作為手術治療的策略。
關鍵詞:非小細胞肺癌、淋巴腺轉移、毛玻璃變化、肺局部切除、預測因子。
Abstract Introduction
Lung cancer with small tumor size is now frequently being detected because of the prevalent use of computed tomography (CT) as a screening tool for pulmonary lesions.
Sublobar resections (wedge resection/ segmentectomy) for small non-small cell lung cancer (NSCLC) have been reported to be non-inferior to lobectomy with regard to the surgical outcomes. However, a small group of cT1N0M0 NSCLCs tend to have a worse prognosis than expected, and nodal upstaging after surgery is the main reason.
Prediction of pathologic nodal upstaging is important. In our study, we aimed to reappraise the predictive factors of lymph node metastases in cT1aN0M0 (AJCC 7th edition for lung cancer) NSCLC.
Methods
Cases of cT1aN0M0 NSCLC after surgical resections in the National Taiwan University Hospital from 2011 to 2015 were retrospectively reviewed. The predictive factors of interest were tumor size, tumor ground glass opacity (GGO) percentage on chest CT, and preoperative serum carcinoembryonic antigen (CEA) level. Logistic regression model was used to find predictive factors for nodal upstaging.
Results
A total of 770 patients were included in the study. Of these, 14 (1.8%) were found to have pN+ (nodal upstaging) after pulmonary resection. Larger tumor size, less tumor GGO percentage on chest CT, and higher preoperative serum CEA levels were significant predictors for nodal upstaging. On a pathological viewpoint, decreased lepidic component of the tumor, presence of visceral pleural invasion, and presence of lymphovascular invasion were also significantly correlated with nodal upstaging. With preoperative variables grouped into categorical data, tumor size ≥ 1.5 cm, CEA ≥ 3
ng/mL, and GGO < 25% had strong predictive values for lymph node metastases.
Conclusion
For NSCLC patients with clinical stage T1aN0M0, tumor size, preoperative serum CEA levels, and GGO percentage on CT scan were significant predictive factors for lymph node metastases after surgery. For patients with tumor size less than 1.5 cm, serum CEA levels less than 3 ng/mL, and GGO predominant tumors, avoiding lymph node dissection can be a reasonable approach. Sublobar resection, instead of standard lobectomy, may be a good alternative for this group of patients.
Key words: Non-small cell lung cancer, nodal upstaging, ground-glass opacity, sublobar resection, predictive factors.
目 錄
口試委員會審定書……… i
誌謝………. ii
中文摘要……… iii
英文摘要………. v
碩士論文內容 一 、 緒 論… … … . . 1
二、研究方法與材料 ………..5
三、結果……….. …………..7
四、討論……….. …………..10
五、展望……….. …………..16
六、論文英文簡述(summary) ………17
七、參考文獻……….. ………21
八、圖表……….. …………..27
圖 1a………. ………. 27
圖 1b………. ………. …. .28
表 1………. .. ……..29
表 2………. ……..30
表 3………...31
表 4………... ... .32
九、中英對照表 ……….. ………….. .. 33
一、 緒論 概況
肺癌,已數年位居國人癌症十大死因之首。近年來由於胸腔電腦斷層逐 漸的普及,近年來在臨床上,觀察到有愈來愈多較小的肺部腫瘤,不論是透 過健檢的方式,或是國人就醫檢查時意外被發現 (Okada et al. 2006; Callol et al.
2007; Aberle et al. 2011)。從肺癌的分期系統(American Joint Committee on Canaer, AJCC)近幾版的演進,可看出一個趨勢,就是在腫瘤大小的定義上愈 分愈細。從第六版的只區分 T1: 腫瘤≤ 3 cm, 第七版將 T1 切割為 T1a: 腫瘤≤
2 cm, T1b: 2 cm 到 ≤ 3 cm,到第八版再將 T 切割成 T1a: ≤ 1 cm, T1b: > 1 到≤
2 cm, T1c: > 2 cm 到 ≤ 3 cm。整理如下:
T-staging of non-small cell lung cancer (by American Joint Committee on Canaer, AJCC)
6th TNM (2002) 7th TNM (2009) 8th TNM (2018)
T T1≤ 3 cm
T1a: ≤ 2 cm T1a: ≤ 1 cm T1b: >1 to ≤ 2 cm T1b: > 2 to ≤3 cm T1c: >2 to ≤ 3 cm T2> 3 cm
由此可見近幾年來大家對於愈來愈多的早期肺癌,有著更深入的研究。對於 腫瘤體積小,而且位置在肺部邊緣的肺癌而言,亞肺葉切除(sublobar
resection),相較於肺葉切除(lobectomy)而言,已有許多研究報告顯示能帶給患 者達到近似或相同的長期存活效益 (Kodama et al. 1997; Okada et al. 2001;
Yoshikawa, et al. 2002)。然而,對於肺部局部切除手術應用在肺癌的適應症上,
目前尚無定論。其關鍵問題之一就是淋巴腺轉移的問題,在臨床上可觀察到 在某些腫瘤不大的肺癌患者上,雖然臨床期別判定為第一期肺癌(cT1N0M0),
但手術後仍發現淋巴腺轉移,此現象稱為「淋巴腺病理分期升級」(nodal upstaging) (Ghaly et al. 2017)。換言之,「淋巴腺病理分期升級」就是指在手術 前,臨床上認為是第一期肺癌的患者,在手術後,病理分期改為第二或第三 期 (升級)的情況。對於這些淋巴結分期升級的患者而言,其病理分期(pStage) 上的肺癌期別事實上是較為晚期的(例如第二或第三期),手術的方式應該以肺 葉切除併根除性淋巴腺廓清,而不是肺部局部切除。尤其是肺腺癌,相較於
肺鱗狀上皮細胞癌,在本質上更具有轉移的特性 (De Leyn et al. 1997; Suzuki et al. 1999; Lee et al. 2007)。因此對於能否在手術前,準確的預測哪病人是屬 於淋巴腺轉移的高風險族群,以決定使用哪種手術的策略 (例如:肺葉切除或 亞肺葉切除)將是非常重要的課題。
淋巴腺轉移的預測因子— 腫瘤大小
對於肺癌患者,術前淋巴結轉移的預測因子研究,長久以來一直是外科 醫師感興趣的議題。最為人知的一項就是腫瘤本身的大小 (Asamura et al. 1996;
Kanzaki et al. 2011; Tsutani et al. 2012; Zhang et al. 2012; Chen et al. 2013; Li et al. 2013)。也就是說腫瘤本身體積愈大,伴隨淋巴腺轉移的機率就愈高。舉日 本學者 Asamura 的研究為例,根據其團隊發表的數據顯示,在可手術的肺癌 病患當中,腫瘤本身大小兩公分(含兩公分)以下的,其淋巴結轉移的比率約為 19.5%,而腫瘤大小在兩公分到三公分的,期淋巴結轉移的比率約為 32.5%
(Asamura et al. 1996)。然而在兩公分(含兩公分)以下的肺癌的病患族群中,腫 瘤的大小是否還是具有強烈的淋巴結轉移預測性?例如在腫瘤直徑一公分以 下,和一到兩公分之間的患者群中,其淋巴結轉移機率是否有差別?則需要 被再檢視,也是本研究其中一個目的。
淋巴腺轉移的預測因子— 腫瘤影像學特徵
另外一個在術前重要的臨床因子就是腫瘤在影像上的特徵,在此特別指 的是腫瘤在電腦斷層上的影像特徵。毛玻璃樣變化(ground-glass opacity, GGO) 是在形容肺癌在電腦斷層影像上的一個重要的名詞。其定義為在電腦斷層影 像上,腫瘤的陰影尚未能遮住肺實質中的血管影像。其相對的影像就是實質 腫瘤(solid tumor),意味著腫瘤的陰影濃度深到已遮蔽肺實質的正常結構;若 兩者都有即稱為半實質毛玻璃樣變化(part-solid GGO)。毛玻璃變化佔整個腫瘤 的比例,被認為與腫瘤的惡性度及侵犯性有關,很多文獻也報導可能成為一 個預測淋巴腺轉移的一個因子 (Kodama et al. 2001; Takamochi et al. 2001;
Matsuguma et al. 2002; Suzuki et al. 2002; Ohde et al. 2003; Okada et al. 2003)。
但在肺癌腫瘤小於等於兩公分的族群中,這個影像上的預測價值,目前還需
進一步證實。
淋巴腺轉移的預測因子— 血清 carcinoembryonic antigen (CEA)
在肺癌患者中,血清腫瘤指數 CEA 可反映腫瘤的惡性度,並且具預後的 價值 (Takamochi et al. 2001; Inoue et al. 2006; Koike et al. 2012; Chen et al.
2013; Li et al. 2013)。學者 Koike 等人報告在臨床分期 Ia 的肺癌患者中,血清 CEA 值是一個預測縱隔腔腫瘤轉移的重要因子 (Koike et al. 2012)。學者 Inoue 等人報告在肺癌腫瘤小於等於兩公分的族群當中,若 CEA 值大於等於 5 ng/mL,其五年存活率顯著的比 CEA 值小於 5 ng/mL 的患者還低 (92.1% vs.
77.6%; p< 0.01) (Inoue et al. 2006)。在同樣的報告當中,較高的 CEA 值也的確 合併較高的縱隔腔淋巴腺轉移的機率 (29.2% vs. 10.3%; p=0.02)。在本研究當 中,術前的 CEA 值是一個常規的檢查,我們也將審視 CEA 值在預測臨床期 別 T1aN0M0 的肺癌患者中,其淋巴腺轉移的預測價值。
腫瘤≦2 公分的研究
在本研究中,我們是要針對肺癌臨床分期 T1aN0M0,也就是腫瘤小於等 於 2 公分的患者,分析其淋巴腺轉移的預測因子。回溯文獻,只有少數的報 告是針對這樣的族群 (Inoue et al. 2006; Suzuki et al. 2006; Bao et al. 2014)。其 中,腫瘤大小 (Bao et al. 2014)、腫瘤位置(Bao et al. 2014)、術前血清 CEA 值 (Inoue et al. 2006; Bao et al. 2014)、腫瘤影像學特徵 (Suzuki et al. 2006)、是否 有臟層肋膜侵犯 (Inoue et al. 2006)等,均被報告與淋巴腺轉移有關,且可視為 腫瘤惡性程度的指標。然而,目前在腫瘤小於兩公分的早期肺癌族群中,我 們有的證據有限。在面臨這群患者逐漸增加的臨床趨勢中,能夠準確的預測 淋巴腺轉移是一個重要的課題,特別是對於外科醫師而言,直接影響了外科 醫師決定採用何種策略來進行手術。唯有能準確的預測淋巴腺狀態,外科醫 師才能合理的選擇在某些患者上,免除其淋巴腺廓清(lymph node dissection) 的動作,或者是改為簡單採樣(lymph node sampling)即可,同時,肺葉切除,
也可以局部切除來替代,減少病患的手術傷害及保留更多的肺功能。
關於本研究
本研究的假設是:對於非小細胞肺癌,臨床期別 T1aN0M0(影像上腫瘤等 於或小於兩公分)的患者,某些手術前的臨床因子,例如上述的腫瘤大小、影 像學上的特徵(特別指 GGO 佔腫瘤的比例)、以及術前的血清 CEA 值,具有預 測淋巴腺轉移的價值。某些術後腫瘤病理學的特徵上(例如某些腫瘤病理型態 的分型),也同時具有預後的價值,我們將一同分析。
透過本研究,我們期望能進一步了解什麼樣的患者,需要積極做根除性 淋巴腺廓清手術,哪些患者我們可以免除淋巴腺清除手術。
二、 研究方法與材料 研究對象
自 2011 年 1 月到 2015 年 12 月間,所有診斷非小細胞肺癌(non-small cell lung cancer)的患者,其臨床期別判定為 T1aN0M0 (根據 AJCC cancer staging 7th edition),也就是臨床影像上,腫瘤≦2 公分(T1a),且無淋巴腺轉移及遠端器 官轉移的臨床證據(N0,M0)的患者。其納入研究的標準(inclusion criteria)為須 接受手術切除腫瘤,並且是以治療為目的(curative intent)。手術後證實為非小 細胞肺癌(肺腺癌、鱗狀上皮細胞癌、其它病理分類),且病理上腫瘤確實≦2 公分。排除的標準(exclusion criteria)為病患同時有其他癌症(synchronous cancer)、同時有兩個或以上的原發性肺癌(synchronous lung cancer)、先前得過 肺癌經藥物或手術治療(previous lung cancer)、肺部有轉移性的惡性腫瘤 (metastatic carcinoma)、或是手術前肺癌先接受了新輔助治療(neo-adjuvant therapy)。
資料蒐集
我們將蒐集包含年齡、性別、抽菸習慣、術前肺功能報告、術前血清 CEA 值等的病患基本資料。並進一步蒐集腫瘤本身相關的資料,例如腫瘤的大小、
腫瘤在電腦斷層影像上的特徵、腫瘤病理形態上的分型、病理學上的特徵,
例如有無臟層肺膜的侵犯(visceral pleural invasion),微小淋巴管的侵犯
(lymphovascular invasion)等。以及手術相關的資料,如手術術式、淋巴結廓清 的程度(以取樣的淋巴結顆數為代表)等。
腫瘤大小的部分,我們是以病理報告的腫瘤大小(以公分為單位)為依據。
腫瘤影像學特徵是看腫瘤在電腦斷層上”毛玻璃變化”所佔整體腫瘤的比例,也 就是腫瘤的 GGO%。術前血清 CEA 是取最接近手術的該次檢查值為準。
統計方法
統計方面。我們將把蒐集到的患者分為無淋巴轉移(pN0),和有淋巴轉移 (意即 Nodal upstaging, pN+)兩組,連續型變數以 student’s t-test 檢定,類別型變 數以 chi-squared test 檢定來看兩組在各項變數上的差異性。進一步我們將針對
我們假設的項目:腫瘤大小、腫瘤影像學特徵、術前血清 CEA 值、腫瘤病理 學的分類、特徵等,透過羅吉斯迴歸分析(logistic regression model)去看應變數 (dependent variable)為”淋巴腺有無轉移”,那些因變數(independent variables)是 有意義的預測因子。最後針對兩群病患,使用 Kaplan-Meier 法進行存活分析,
並使用 Log-rank 法比較兩組存活(overall survival)和無疾病存活(disease-free survival)的表現。
三、 結果
有無淋巴腺轉移 (pN+ or pN0)
經過納入及排除條件的篩選,總共有 770 位符合本研究標準的患者進入
研究分析,「表格一」顯示本研究族群的特色,並且將研究族群分為「無病理
淋巴腺轉移」及「有病理淋巴腺轉移」兩組做比較分析。
整體而言,「有病理淋巴腺轉移」在本研究當中共 14 位患者,佔整體比 例約 1.8%。在患者年齡和性別上,兩組呈現無顯著差別;在兩組病患有無抽 菸習慣、術前肺功能報告(包含 Forced vital capacity 和 Forced expiratory volume in 1 second)也無統計學上的差距。術前血清 CEA 在 pN+組中平均為 3.87 ng/mL,相較於 pN0組的平均 1.80 ng/mL 為兩倍之多,雖未達統計學意 義(p=0.072),但看得到差異的趨勢。
腫瘤影像學特徵
在影像學上的特徵上,「毛玻璃狀變化」GGO 是一個重要的指標。我們大 致將 GGO 所佔整個腫瘤影像的比例小於 25%,與 GGO 比例大於或等於 25%
做二分法的區分。結果發現在 pN+的族群中,GGO< 25%的比例高達 92.6%,
相較於在 pN0 族群中的 39.5%,有統計學上的差距(p< 0.001)。
腫瘤大小
在腫瘤大小上,在 pN+組中,平均腫瘤大小為 1.66 公分,相較於 pN0組 中的 1.10 公分,有顯著的差別(p< 0.001)。病理分期上,我們可以看到 pN+組 中,在原本臨床分期為 Ia (cT1aN0M0)的患者,術後因為 nodal upstaging 的關 係,其相對病理分期也變成較為晚期,有一半(50%)的病人被升級到病理期別 的 IIIa 期。
手術術式
兩組在接受手術的術式上,我們也可以看到明顯的差別。在 pN0組的患 者中,接受肺葉切除的比例僅約為三成,而在 pN+組中,全部的病人均接受肺 葉切除。切除的淋巴結個數,一般也是反應了清除淋巴腺的積極程度,在兩
組比較上,pN+組明顯有較多的淋巴結個數(平均 15.07 顆),相較於 pN0 組的 8.85 顆有顯著的差異(p< 0.001)。
腫瘤病理組織型態
在腫瘤的組織型態上,兩組都是超過九成為肺腺癌,顯示本研究還是以 肺腺癌的患者為主體。在病理的亞型上,lepidic component 小於 25%在本研究 定為 Non-lepidic subtype,在 pN+組中,明顯看到百分之百具此特色,相較於 pN0 組中只有約四分之一的患者具有這種亞型的特色 (p< 0.001)。在腫瘤病理 報告中,有另外兩項重要的因子被認為與預後相關,一個是臟層肋膜侵犯 visceral pleural invasion (VPI),一個是淋巴血管侵犯 lymphovascular invasion (LVI),在本研究發現,pN+組中的患者,不管是 VPI 或 LVI 陽性的比例均顯 著較高 (p< 0.001)。
預測因子
「表格二」將各項被認為可能跟淋巴腺轉移的因子有關的變數,使用羅 吉斯回歸 (logistic regression)的方法進行分析。在單變項(univariate)的分析之 中,可發現腫瘤大小、血清 CEA 值、腫瘤影像 GGO 的比例、手術淋巴結取 樣的個數、Non-lepidic 組織學型態、臟層肺膜侵犯(VPI)、及微小淋巴管侵犯 (LVI)均為淋巴腺轉移的預測因子。若將手術前腫瘤大小、血清 CEA 值、腫瘤 影像 GGO 的比例,含手術中外科醫師可決定的因素(淋巴結清除個數)納入多 變項(multivariate)分析,可發現腫瘤大小(p=0.003)、血清 CEA 值(p=0.021)、
腫瘤影像 GGO 的比例(p=0.016)仍為淋巴腺轉移的預測因子。
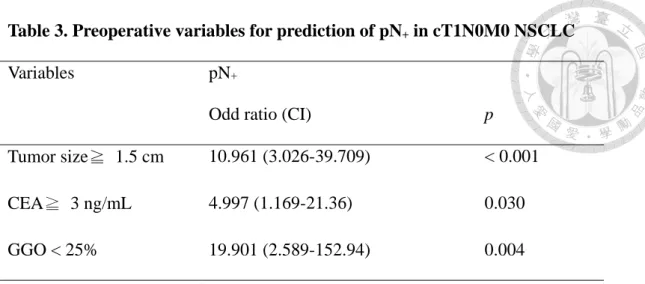
為了能幫助在臨床實務上的決定,「表格三」是將原本為連續型變數的「腫 瘤大小」、「血清 CEA 值」、及「腫瘤影像 GGO 的比例」轉為類別型變數,同 樣以羅吉斯回歸分析,結果是若腫瘤< 1.5 公分,電腦斷層影像上腫瘤呈現 以 GGO 為主的影像型態(GGO 所占整體腫瘤比例< 25%),或者患者術前血清 CEA < 3 ng/mL,其術後淋巴腺病理分期升級的風險將顯著增加。
淋巴腺病理分期升級之患者
「有病理淋巴腺轉移」在本研究當中共 14 位患者,我們認為這群病人,
人數雖少,但極具臨床價值。我們將其詳細資料列為「表格四」。可發現這 14
位患者明顯腫瘤大小均大於一公分,且幾乎為 GGO< 25%。血清 CEA 值雖然落 差很大,但是大致可看出 CEA≧ 3 ng/mL 的患者,幾乎都含 N2 metastases,
這也反映了 CEA 值與疾病的嚴重程度相關。再者,我們可以看出即便這些病 人淋巴腺轉移,其預後存活狀況良好,經過平均 41.2 (約 3 年半)個月的追蹤,
僅僅三人因肺癌死亡,6 人雖復發,但接受後續治療後,疾病皆得到控制,另 外 5 人手術後皆沒有復發跡象。
存活結果
不意外的,針對本研究的 pN0及 pN+兩群病患,用 Kaplan-Meier method 去看其存活(overall survival)及無病存活(disease-free survival)圖,如圖一(a, b),Log rank 比較 pN0與 pN+兩組的存活率及無病存活率,皆呈現顯著差異 p<0.001。
四、 討論
本研究的特色
回溯文獻,在非小細胞肺癌,臨床分期為 stage Ia (含 T1aN0M0 和
T1bN0M0),也就是腫瘤小於等於 3 公分的相關研究中,手術後淋巴腺轉移的 比例約為 7~20% 不等(Suzuki et al. 2006; Bao et al. 2014; Suzuki et al. 2011;
Ghaly et al. 2017; Hung et al. 2017)。如果縮小腫瘤大小的範圍到小於等於 2 公 分的族群(僅含 T1aN0M0)來看,手術後淋巴腺轉移的機會也大致在 10%~16%
(Ghaly et al. 2017; Bao et al. 2014; Suzuki et al. 2006)。然而,本研究族群的特色 是,在非小細胞肺癌,臨床分期為 T1aN0M0 族群中,pN+組的患者個數,只 有 14 位,佔整體的比例僅為 1.8%。探究其原因是因為近年來電腦斷層篩檢逐 漸普及,在台灣有愈來愈多的早期肺癌患者被篩檢出來,從表格一更可看到,
在 pN0組裡,有 20 位病患是診斷為非典型腺樣增生 Atypical adenomatous hyperplasia (AAH),其實在觀念上應視為肺腺癌的癌前病變。由於這幾年台大 醫院像這樣早期肺癌的案例大幅增加,也因此大大的增加了「腫瘤大小兩公 分以下、且無淋巴腺轉移的這個族群, 意即 pN0」,若手術後 pN+的患者為分 子,換言之就是加大了”分母”(pN0+pN+),以致本研究 pN+的比例就相對少。
在本研究族群的特色上,比較值得關注的是,在 pN0組的女性所佔的比 例將近 7 成(69.2%),且抽菸患者在 pN0組也接近 9 成(88.6%),這也正反應了 一個重要的事實,就是近年來的非小細胞肺癌患者,女性、不抽菸的比例愈 來愈高,讓我們對於 Never-smoker 的 lung cancer 更為關注,並對於肺部電腦 斷層篩檢的重要性,更加深了一層。同時,在對於民眾的衛教上,更需宣導
「不抽菸不表示不會得肺癌」的概念。
血清 CEA
血清 CEA 值,在臨床上是一個與非小細胞肺癌相關的一個重要的指標,
在臨床上可作為篩檢、診斷、治療效果和預後的參考。在本文「緒論」的部 份已提到諸多的研究,顯示血清 CEA 值與淋巴腺轉移相關。在許多肺癌專科 醫師的眼中,肺癌合併淋巴腺轉移,可視為系統性疾病,已不是局部疾病。
這樣的觀點其實可以從血清 CEA 值得到印證。在本研究當中,我們將血清 CEA
值(連續變數)去做 logistic regression analysis,結果其在多變項分析中,仍然顯 著的成為淋巴腺轉移的預測因子(odd ratio: 1.205, p= 0.021)。為了能應用在臨 床實務,我們將 CEA 值劃分為< 3 ng/mL 和≧3 ng/mL,分為兩組後,再用 logistic regression 去分析,結果是 CEA 值≧3 ng/mL 的患者,其淋巴腺轉移的 Odd ratio 為 CEA 值< 3 ng/mL 的 4.997 倍(信賴區間 1.169-21.360),統計學上 達顯著意義(p= 0.03)。也就是說,在臨床實務上,若術前血清 CEA 值≧3 ng/mL,即便腫瘤大小≦2 公分,臨床分期為 T1aN0M0,仍然要小心淋巴腺轉 移的可能,也就是手術後淋巴腺病理升級的可能。外科醫師在決定手術方法 時,可能盡可能選擇肺葉切除併淋巴腺廓清手術,已達到根除性切除惡性病 兆的目的。
腫瘤體積大小
腫瘤大小一直是肺癌的重要預後指標,在 AJCC cancer staging 7th 版中,
非小細胞肺癌 T1a 定義為腫瘤大小≦2 公分,然而,隨著近年來電腦斷層的普 及,愈來愈多更小腫瘤的肺癌被發現,臨床研究的結果也發現即使在小於兩 公分的肺癌中,腫瘤大小仍然是決定預後和疾病嚴重程度的重要指標23,24。在 AJCC cancer staging 8th版中,已經重新將腫瘤≦1 公分定義為 T1a,腫瘤 >1 公分,≦2 公分定義為 T1b,顯示腫瘤大小在兩公分以下情形的預後價值。在 本研究當中,可發現在 pN+組的 14 位患者中,腫瘤大小平均為 1.66 公分,若 用 1.5 公分當作切點,將病患分為≧1.5 公分為一組,<1.5 公分為一組,進行 logistic regression 分析,可發現≧1.5 公分的族群,其淋巴腺轉移的 odd ratio 為腫瘤<1.5 公分族群的 10.961 倍(信賴區間 3.026-39.709),統計學達顯著意義 (p<0.001)。也就是說,在臨床實務上,腫瘤大小若≧1.5 公分,外科醫師必須 注意盡可能進行肺葉切除併淋巴節廓清手術,以達到腫瘤根除性治療的效果。
腫瘤影像學特徵
腫瘤在電腦斷層上的特徵「毛玻璃變化(GGO)」在腫瘤所佔的比例,被認 為與腫瘤的惡性度及侵犯性有關 (Kodama et al. 2001; Takamochi et al. 2001;
Matsuguma et al. 2002; Suzuki et al. 2002; Ohde et al. 2003; Okada et al. 2003)。
有許多的量測及評估方法,是在用來表示 GGO 在腫瘤中所佔的比例。例如腫 瘤影像消失比例(tumor shadow disappearing rate, TDR) (Takamochi et al. 2001;
Okada et al. 2003)、視覺直接評估實質腫瘤法(visual estimation, VE) (Kodama et al. 2001; Matsuguma et al. 2002)、及實質部分比例 (consolidation/ tumor ratio, C/T ratio) (Ohde et al. 2003)。然而,一個前瞻性的研究,比較這三種方法,顯 示 C/T ratio 較能避免誤差,也比較適合來當作判斷淋巴腺有無轉移的良好指 標(Suzuki et al. 2011)。在本研究中,我們採用 C/T ratio 的概念,測量 GGO 占 整個腫瘤的比例,我們確實發現 GGO 佔腫瘤的的比例,在肺癌腫瘤小於兩公 分的族群裡,的確是一個預測淋巴腺轉移的重要預測因子,在 logistic regression 多變項分析中,GGO 的比例愈高,淋巴腺轉移的比例就愈低(Odd ratio 0.420, p= 0.016)。
手術術式
接下來是在手術和病理方面的討論。本研究中,pN0組有 51.9% (393/756) 的病人接受的是楔狀切除(wedge resection),也就是非解剖性切除
(non-anatomic resection),這在癌症的手術上視為一個腫瘤學上姑息的手術,
這樣的作法,必須要有充分的證據或臨床上需要的理由,才能這樣做。然而 從我們的資料來看,這些病人的確術後淋巴腺無轉移,且整體存活和無疾病 存活都表現良好(圖 1a, b)。從另外一個角度來分析,就是說另外 34.1% (258/756)
pN0的患者,接受了肺葉切除,是否需要?這是一個值得重視的議題。
再看切除淋巴腺個數的部分,我們可以看到在 pN+組的切除淋巴腺個數是 pN0組患者的兩倍左右(15.07 vs. 8.85, p<0.001)。是否意味著外科醫師清除淋巴 腺的多寡,可作為預測術後淋巴腺病理分期升級呢?就這點,本研究的結果 可以從兩方面來解釋:其一,因為這群 pN+的病人在術前臨床上就被判定為高 風險族群,因此均接受肺葉切除及淋巴結廓清手術,因此得到的淋巴腺個數 自然較高;其二,也就是因為這群病人被清除淋巴結個數較多,才造成發現
pN+的機會。因此到底外科醫師清除淋巴腺多寡,是否是淋巴腺病理分期升級
的預測因素? 其因果關係難以從本回溯性的研究中得到答案。從本研究的表 格二顯示,當將清除淋巴腺個數這一項放入 logistic regression 的多變項分析
時,其顯著性就消失了(p= 0.272),因此從統計學的角度來解釋,「清除淋巴腺 個數的多寡」與「淋巴腺病理升級」的因果關係較難以成立。
術後腫瘤病理結果
在病理結果方面,我們從「表格一」看的出來,整體肺腺癌所佔的比例 超過九成(95.58%),也反映了一個事實,也就是肺腺癌的比例隨著電腦斷層篩 檢的普及,也變得多了起來。意味著傳統的印象——「抽菸致癌」(鱗狀上皮 細胞癌)所佔的比例,慢慢在整個肺癌族群中減少。
針對肺腺癌,在病理組織學上,大致分為五個分類:”lepidic”, “acinar”,
“papillary”, “micropapillary”, 和 “solid” subtypes。按照其侵犯性的傾向,可大 致歸類為:低侵犯性為 lepidic subtype,中度侵犯性為 acinar 和 papillary subtypes,和高度侵犯性的 micropapillary 和 solid subtypes。已有文獻報告,對 於小於等於 2 公分的肺腺癌,lepidic subtype 伴隨較好的預後,和較長的無病 存活率 (Hung et al. 2017)。在本研究中,我們將在病理報告中,lepidic subtype 所占比例少於整個腫瘤的 25%以下,定義為 non-lepidic type。再對照淋巴腺轉 移的陽性與否,發現的確此種 subtype 在預測淋巴腺轉移上,可以是一個重要 的預測因子。在某些術前已經取得腫瘤切片的患者來說,可以是一個術前判 斷淋巴腺轉移的指標。但對於術前未有腫瘤切片的早期肺癌患者來說,需要 在手術中進冰凍切片(frozen section),可惜的是目前手術中所送的病理冰凍切 片,以目前的病理染色技術來說,尚無法在第一時間藉由病理科醫師的判斷,
告訴外科醫師切下的腫瘤是否屬於 lepidic 或 non-lepidic type。但是這技術是 否在將來若可以克服,我們便多了一項重要的指標,告訴我們病患淋巴腺轉 移的機會,便可以當作是外科醫師是否要進行淋巴結廓清以及是否進行肺葉 切除的參考。另外病理報告中,病患是否有臟層肺膜侵犯(VPI),或微小淋巴 血管侵犯 (LVI),很多研究也顯示為一個重要的預後因子。在本研究當中,也 的確反應了預測淋巴腺轉移的指標。然而這兩項指標均是需要經過詳細的腫 瘤病理檢查才能判定,因此在術前或術中的預測價值不大,僅能當作是術後 病人”預後”的指標,可決定病患是否術後需進行輔助治療。
全身正子攝影
最後,值得一提的是正子攝影(18F-2-deoxy-fluoro-D-glucose positron emission tomography, FDG-PET)的角色。回溯文獻,在許多的研究裡,正子攝 影扮演了重要肺癌臨床分期的角色 (Takamochi et al. 2005; Ozawa et al, 2010;
Kim et al, 2011; Lin et al. 2012; Takenaka et al. 2012; Li et al. 2013; Lu et al.
2014)。它的預測價值包含腫瘤惡性度、疾病的預後、和分期已被廣泛的研究 (Takenaka et al. 2012; Li et al. 2013)。然而,其在淋巴腺轉移的診斷準確度上被 質疑,尤其是當腫瘤很小的時候,或在肺結核盛行之區域 (Takamochi et al.
2005; Ozawa et al, 2010; Kim et al, 2011; Lin et al. 2012; Lu et al. 2014)。例如學 者 Takamochi K.等人認為組織發炎的情形會造成正子攝影「假陽性」的結果,
而在淋巴腺本身小於 7.5 mm 時,又常常出現「假陰性」的結果 (Takamochi et al. 2005)。學者 Lin 等人,也發表正子攝影在判斷「肺門淋巴腺」時,常常因 為發炎的關係,產生許多假陽性的結果,以致判斷結果不準確 (Lin et al.
2012)。在本研究當中,我們並未能納入正子攝影在預測淋巴腺轉移的分析,
最主要原因是本研究的族群中,在術前有接受正子攝影檢查的病人的比例太 少。其原因是由於在台灣的健保規範中,術前若未有病理組織診斷,健保將 不給付正子攝影的檢查,由於正子攝影自費的價格昂貴(約新台幣四萬元左 右),大部分的患者當臨床判斷上淋巴腺轉移機率不高時,傾向不做此檢查,
直接接受手術。
本研究的限制
本研究的限制是,由於病患 pN0族群中有相當多(51.9%)的患者接受非解 剖性切除手術,因此在淋巴腺的診斷上,可能會有低估的情況,但從整體五 年存活率和無疾病存活率皆 9 成以上,可判斷即便有淋巴腺低估的狀況,應 該也是少數,影響本研究的結論有限。總結,在臨床分期為 T1aN0M0 的非小 細胞肺癌患者中,腫瘤大小、術前血清 CEA 值、以及電腦斷層影像毛玻璃變 化所佔的比例,是為預測術後淋巴腺是否轉移的顯著的預測因子。臨床實務 上,若腫瘤< 1.5 公分,電腦斷層影像上腫瘤呈現以 GGO 為主的影像型態,
或患者術前血清 CEA < 3 ng/mL,可以選擇性地避免進行根除性淋巴結廓清,
並選擇使用肺局部切除,作為手術治療的策略。
五、 展望
本研究的結論是,在臨床分期為 T1aN0M0 (腫瘤≦2 公分)的非小細胞肺 癌患者中,腫瘤大小、術前血清 CEA 值、以及電腦斷層影像毛玻璃變化(GGO) 所佔的比例,是為預測術後淋巴腺是否轉移的預測因子。依本研究的分析結 果,進一步在臨床上的應用是:在臨床分期為 T1aN0M0 的非小細胞肺癌患者 中,當腫瘤大小≧1.5 公分、血清 CEA 值≧3 ng/mL、及 GGO 比例< 25%,
建議使用肺葉切除併淋巴腺廓清手術,以達到腫瘤根治及取得正確病理分期 之目的。換言之,在現在愈來愈多早期肺癌被電腦斷層篩檢出來的情況下,
若腫瘤< 1.5 公分,電腦斷層影像上腫瘤呈現以 GGO 為主的影像型態,並且 患者術前血清 CEA < 3 ng/mL,可以選擇性地避免進行根除性淋巴結廓清,並 選擇使用肺局部切除,如此除了減短手術時間之外,更可保留病患較多的肺 功能及降低術後併發症的機會。
在未來的臨床實務上,將會有愈來愈多的早期肺癌患者需接受手術治 療,對於外科醫師而言,決定手術的策略甚為重要。在現今微創手術為主流 的環境中,減少病人的傷害,加快手術後的恢復,是為重要的臨床指標。接 下來需要的是前瞻性的臨床試驗研究,來證實本研究的結論。
在預測淋巴腺的轉移上,是否能從手術中的冰凍切片,就能透過某些染 色技巧第一時間判斷種腫瘤細胞的亞型,也是一個努力的重點。至於是否能 有其它的生物標記,或影像工具,能夠讓外科醫師在術前就能做準確的預測 淋巴腺的轉移情況,也是在未來值得努力的目標。
六、 論文英文簡述 (Summary) Introduction
Non-small cell lung cancer (NSCLC) with small tumor size is now frequently being detected because of the prevalent use of computed tomography (CT) as a screening tool for pulmonary lesions. Sublobar resections have been reported to yield similar survival as with lobectomy for patients with small peripheral NSCLC. In determining the
indications for sublobar resection, prediction of the pathologic nodal status is important.
Tumor size is consistently a strong predictor for lymph node metastases. The
prevalence of mediastinal metastases increases with tumor size. Asamura and colleagues have found that among patients with resected peripheral non-small cell lung cancer, the prevalence of lymph node metastases increased from 19.5% in tumors 2 cm or smaller to 32.5% in tumors 2 to 3 cm in diameter (Asamura et al. 1996). However, with tumor size of 2 cm or less, the predictive power of lymph node metastases needed to be reappraised.
One of the preoperative predictors for lymph node metastases is radiologic
appearance of tumor on computed tomography (CT). The radiologic appearance of the tumor, categorized as pure ground-glass opacity (GGO), part-solid GGO, or solid tumor, has been reported to be the best predictor for the invasiveness and nodal status of
NSCLC (Kodama et al. 2001; Takamochi et al. 2001; Matsuguma et al. 2002; Suzuki et al. 2002; Ohde et al. 2003; Okada et al. 2003). The consensus is that the more GGO component in a tumor, the less possibility of lymph node metastases, and the better the prognosis of the disease. Reviewing the published literature, there is no solid evidence available to prove that GGO percentage is a good criterion to predict lymph node metastases in early NSCLC with tumor size of 2 cm or less.
reported that preoperative serum CEA level was a predictor for mediastinal nodal metastasis in clinical stage IA NSCLC patients (Koike et al. 2012). Inoue et al. reported that compared to patients with normal preoperative serum CEA levels and with NSCLC tumors of 2 cm or less in diameter, the 5-year mortality rate for patients with higher CEA levels (≥ 5 ng/mL) was significantly worse (92.1% vs. 77.6%; p<0.01). In addition, increased CEA level was associated with a much higher rate of lymph node metastasis in small NSCLC (29.2% vs. 10.3%; p=0.02) (Inoue et al. 2006). In our study,
preoperative CEA level was routinely collected in every lung cancer patient undergoing surgical resection. We evaluated the impact of preoperative CEA levels on lymph node metastases in our study.
In our study, we aimed to evaluate the predictive factors of lymph node metastases in NSCLC of tumor size 2 cm or less. Reviewing the previous literature, only a few studies focused on such a small size of lung cancer. Tumor size, preoperative CEA level,
radiological characteristics, and pleural invasion were reported to be associated with lymph node metastases, and those may be used as a surrogate for tumor invasiveness.
However, the evidence at hand is still weak in the category of patients with small NSCLC. Encountering a growing number of early lung cancer, accurate prediction of preoperative lymph node status may guide us in our surgical strategy. With better prediction of lymph node status, mediastinal lymph node dissection could be avoided in selected patients undergoing lung cancer surgery. Sublobar resection, via wedge
resection or segmentectomy, may also be justified in small NSCLC.
Methods and Materials
Cases of non-small cell lung cancer after surgical resection in the National Taiwan University Hospital from January 2011 to December 2015 were retrospectively
reviewed. Inclusion criteria were patients with solitary pulmonary tumor of preoperative
clinical staging T1aN0M0, pathologically-proven lung cancer after surgical resection, and pathological tumor size 2 cm or less. Exclusion criteria were cases of synchronous pulmonary malignancy, metastatic carcinoma of the lung, synchronous lung cancer, and lung cancer after neoadjuvant therapy. Data to be collected for analysis were age, sex, preoperative CEA level, preoperative pulmonary function results, pathological tumor size, tumor histology subtypes (lepidic, acinar, papillary, micropapillary or solid) for adenocarcinoma, pathological lymph node status (N1 and N2 status), visceral pleural invasion (VPI), lymphovascular invasion (LVI), radiological appearance of tumor, GGO ratio of tumor, and surgical method (wedge resection, segmentectomy or lobectomy).
The predictive factors of interest in our study were tumor size, preoperative CEA level, and radiological tumor appearance. The tumor size was recorded from the
pathology reports. The size was evaluated as categorical data and continuous data to see how the tumor size affects the prediction of lymph node metastases. Preoperative serum CEA level was reviewed from medical records. If there was more than one CEA level, the level immediately prior to surgery was recorded. Radiological tumor appearance was defined as GGO percentage. The ratio of GGO will be evaluated as categorical data (e.g. < 25%) to correlate with lymph node metastases.
Logistic regression analyses will be performed to identify predictors for lymph node metastases.
Results
Table 1 showed the demographic data of the two groups. No significant difference between pN0 and pN+ groups were found in relation to age, gender, smoking, and preoperative pulmonary function. Tumor size, GGO% on CT, surgical method (including number of resected lymph nodes), and pathologic results seemed to be associated with a significant difference between the pN and pN groups. Preoperative
serum CEA level was higher in the pN+ group than in the pN0 group, although the p value failed to reach significance (p=0.072). On logistic regression analysis for the prediction of lymph node metastases (Table 2), tumor size, preoperative CEA levels, GGO%, number of resected lymph nodes, non-lepidic subtype, VPI, and LVI were significant predictors for lymph node metastases. We included those preoperative factors that showed significance to predict lymph node metastases into multivariate analysis. Only tumor size, preoperative CEA level, and GGO% on CT remained significant predictors of lymph node metastases. With preoperative variables grouped into categorical data, tumor size ≥ 1.5 cm, CEA ≥ 3 ng/mL, and GGO < 25% were noted to have strong predictive values for lymph node metastases (Table 3).
Conclusions
For NSCLC patients with clinical stage T1aN0M0, tumor size, preoperative serum CEA levels, and GGO percentage on CT were significant predictive factors for lymph node metastases after surgery. For patients with tumor size less than 1.5 cm, serum CEA levels less than 3 ng/mL, and GGO predominant tumors, avoiding lymph node
dissection can be justified. Sublobar resection, instead of standard lobectomy, may be a good alternative for this group of patients.
七、 參考文獻
Aberle DR, Adams AM, Berg CD, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med 2011;365:395–409.
Asamura H, Nakayama H, Kondo H, et al. Lymph node involvement, recurrence, and prognosis in resected small, peripheral, non–small cell lung carcinomas. Are these carcinomas candidates for video-assisted lobectomy? J Thorac Cardiovasc Surg 1996;
111:1125–34.
Bao F, Yuan P, Yuan X, Lv X, Wang Z, Hu J. Predictive risk factors for lymph node metastasis in patients with small size non-small cell lung cancer. J Thorac Dis. 2014;
6(12):1697-703
Callol L, Roig F, Cuevas A, et al. Low-dose CT: a useful and accessible tool for the early diagnosis of lung cancer in selected populations. Lung Cancer 2007; 56:217–21.
Chen K, Yang F, Jiang G, Li J, Wang J. Development and validation of a clinical prediction model for N2 lymph node metastasis in non-small cell lung cancer. Ann Thorac Surg. 2013; 96(5):1761-8
De Leyn P, Vansteenkiste J, Cuypers P, Deneffe G, Van Raemdonck D, Coosemans W, et al. Role of cervical mediastinoscopy in staging of non-small cell lung cancer without enlarged mediastinal lymph nodes on CT scan. Eur J Cardiothorac Surg. 1997;
12:706-12.
Ghaly G, Rahouma M, Kamel MK, et al. Clinical Predictors of Nodal Metastases in Peripherally Clinical T1a N0 Non-Small Cell Lung Cancer.Ann Thorac Surg. 2017;
104(4):1153-1158.
Hung JJ, Yeh YC, Wu YC, Chou TY, Hsu WH.Prognostic Factors in Completely Resected Node-Negative Lung Adenocarcinoma of 3 cm or Smaller.J Thorac Oncol.
2017; 12(12):1824-1833.
Inoue M, Minami M, Shiono H, Sawabata N, Ideguchi K, Okumura M.
Clinicopathologic study of resected, peripheral, small-sized, non-small cell lung cancer tumors of 2 cm or less in diameter: pleural invasion and increase of serum
carcinoembryonic antigen level as predictors of nodal involvement. J Thorac Cardiovasc Surg. 2006; 131(5):988-93.
Kanzaki R, Higashiyama M, Fujiwara A, Tokunaga T, Maeda J, Okami J, et al. Occult mediastinal lymph node metastasis in NSCLC patients diagnosed as clinical N0-1 by preoperative integrated FDG-PET/CT and CT: Risk factors, pattern, and
histopathological study. Lung Cancer. 2011; 71(3):333-7.
Kim SJ, Kim YK, Kim IJ, Kim YD, Lee MK. Limited predictive value of
dual-time-point F-18 FDG PET/CT for evaluation of pathologic N1 status in NSCLC patients. Clin Nucl Med. 2011; 36(6):434-9.
Koike T, Koike T, Yamato Y, Yoshiya K, Toyabe S. Predictive risk factors for mediastinal lymph node metastasis in clinical stage IA non-small-cell lung cancer patients. J Thorac Oncol. 2012; 7(8):1246-51
Kodama K, Doi O, Higashiyama M, Yokouchi H. Intentional limited resection
for selected patients with T1 N0 M0 non–small cell lung cancer. J Thorac Cardiovasc Surg. 1997; 114:347-53.
Kodama K, Higashiyama M, Yokouchi H, et al. Prognostic value of ground-glass opacity found in small lung adenocarcinoma on highresolution CT scanning. Lung Cancer 2001; 33:17–25.
Lee PC, Port JL, Korst RJ, Liss Y, Meherally DN, Altorki NK. Risk factors for occult mediastinal metastases in clinical stage I non-small cell lung cancer. Ann Thorac Surg.
2007; 84(1):177-81.
Li L, Ren S, Zhang Y, Guan Y, Zhao J, Liu J. et al. Risk factors for predicting the occult nodal metastasis in T1-2N0M0 NSCLC patients staged by PET/CT: potential value in the clinic. Lung Cancer. 2013; 81(2):213-7.
Lin WY, Hsu WH, Lin KH, Wang SJ. Role of preoperative PET-CT in assessing mediastinal and hilar lymph node status in early stage lung cancer. J Chin Med Assoc.
2012; 75(5):203-8.
Lu P, Sun Y, Sun Y, Yu L. The role of (18)F-FDG PET/CT for evaluation of metastatic mediastinal lymph nodes in patients with lung squamous-cell carcinoma or
adenocarcinoma. Lung Cancer. 2014; 85(1):53-8
Matsuguma H, Yokoi K, Anraku M, et al. Proportion of ground-glass opacity on high-resolution computed tomography in clinical T1 N0 M0 adenocarcinoma of the lung: a predictor of lymph node metastasis. J Thorac Cardiovasc Surg 2002;
124:278 –284.
Ohde Y, Nagai K, Yoshida J, et al. The proportion of consolidation to ground-glass opacity on high resolution CT is a good predictor for distinguishing the population of non-invasive peripheral adenocarcinoma. Lung Cancer 2003; 42:303–310.
Okada M, Yoshikawa K, Hatta T, Tsubota N. Is segmentectomy with lymph node assessment an alternative to lobectomy for non–small cell lung cancer of 2 cm or smaller? Ann Thorac Surg. 2001; 71:956-61.
Okada M, Nishio W, Sakamoto T, et al. Discrepancy of computed tomographic image between lung and mediastinal windows as a prognostic implication in small lung adenocarcinoma. Ann Thorac Surg 2003; 76:1828 –1832.
Okada M, Koike T, Higashiyama M, Yamato Y, Kodama K, Tsubota N. Radical sublobar resection for small-sized nonsmall cell lung cancer: a multicenter study. J Thorac Cardiovasc Surg 2006; 132:769–75.
Ozawa Y, Hara M, Sakurai K, Nakagawa M, Tamaki T, Nishio M, Shibamoto Y.
Diagnostic accuracy of (18)F-2-deoxy-fluoro-D-glucose positron emission tomography for pN2 lymph nodes in patients with lung cancer. Acta Radiol. 2010; 51(2):150-5.
Zhang Y, Sun Y, Xiang J, Zhang Y, Hu H, Chen HA. Prediction model for N2 disease in T1 non-small cell lung cancer. J Thorac Cardiovasc Surg. 2012; 144(6):1360-4
Suzuki K, Nagai K, Yoshida J, Nishimura M, Takahashi K, Nishiwaki Y. Clinical predictors of N2 disease in the setting of a negative computed tomographic scan in patients with lung cancer. J Thorac Cardiovasc Surg. 1999; 117:593-8.
Suzuki K, Asamura H, Kusumoto M, et al. “Early” peripheral lung cancer: prognostic significance of ground glass opacity on thin-section computed tomographic scan. Ann Thorac Surg 2002; 74:1635–1639.
Suzuki K, Kusumoto M, Watanabe S, Tsuchiya R, Asamura H. Radiologic classification of small adenocarcinoma of the lung: radiologic-pathologic correlation and its
prognostic impact. Ann Thorac Surg. 2006; 81(2):413-9
Suzuki K, Koike T, Asakawa T, Kusumoto M, Asamura H, Nagai KA. Prospective radiological study of thin-section computed tomography to predict pathological noninvasiveness in peripheral clinical IA lung cancer (Japan Clinical Oncology Group
Takamochi K, Nagai K, Yoshida J, et al. Pathologic N0 status in pulmonary
adenocarcinoma is predictable by combining serum carcinoembryonic antigen level and computed tomographic findings. J Thorac Cardiovasc Surg 2001; 122:325–330.
Takenaka T, Yano T, Morodomi Y, Ito K, Miura N, Kawano D, et al. Prediction of true-negative lymph node metastasis in clinical IA non-small cell lung cancer by measuring standardized uptake values on positron emission tomography. Surg Today.
2012; 42(10):934-9.
Takamochi K, Yoshida J, Murakami K, Niho S, Ishii G, Nishimura M, et al. Pitfalls in lymph node staging with positron emission tomography in non-small cell lung cancer patients. Lung Cancer. 2005; 47(2):235-42.
Tsutani Y, Miyata Y, Nakayama H, Okumura S, Adachi S, Yoshimura M, Okada M.
Prediction of pathologic node-negative clinical stage IA lung adenocarcinoma for optimal candidates undergoing sublobar resection. J Thorac Cardiovasc Surg. 2012;
144(6):1365-71
Yoshikawa K, Tsubota N, Kodama K, Ayabe H, Taki T, Mori T. Prospective study of extended segmentectomy for small lung tumors: the final report. Ann Thorac Surg.
2002; 73:1055-9.
八、 圖表 圖 1a.
在腫瘤≤ 2 公分的非小細胞肺癌患者,手術後淋巴腺轉移 (淋巴腺病理分期升級) (pN+)與沒有淋巴腺轉移(pN0)患者的存活曲線。兩組存活率之差距達統計意義(log rank p< 0.001)。
圖 1b.
在腫瘤≤ 2 公分的非小細胞肺癌患者,手術後淋巴腺轉移 (淋巴腺病理分期升級) (pN+)與沒有淋巴腺轉移(pN0)患者的無病存活曲線。兩組存活率之差距達統計意義 (log rank p< 0.001)。
Table 1. Demographic data of cT1aN0M0 non-small cell lung cancer Variables pN0 (n = 756) pN+ (n = 14) p Age 58.38 ± 10.98 56.93 ± 10.22 0.753
Men (%) 233 (30.8%) 7 (50%) 0.147
Never smoker(%) 668(88.6%) 11(78.6%) 0.246
CEA 1.80 ± 1.87 3.87 ± 4.35 0.072
FVC 110.82 ± 52.61 107.8 ± 21.78 0.375 FEV1 108.19 ± 17.34 100.42 ± 15.80 0.045 CT GGO<25% 39.5% 92.6% <0.001 Tumor size 1.10 ± 0.45 1.66 ± 0.29 <0.001
pStage <0.001
0 24 0
Ia 687 0
Ib 44 0
IIa 0 7
IIIa 0 7
Surgery <0.001
Lobectomy 258 14
Segmentectomy 105 0
Wedge 393 0
Resected LN number 8.85 ± 7.17 15.07 ± 6.40 <0.001 Histology
Adenocarcinoma 723 13 0.379
AAH 20 0
SCC 9 1
Other# 3 0
Pathology
Non-lepidic subtype* 25.6% 100% <0.001 Visceral pleural invasion (%) 5.4% 28.6% <0.001 Lymphovascular invasion(%) 3.7% 14.3% <0.001 pN0= pathologic N0 disease, pN+= pathologic N1-2 disease, CEA= carcinoembryonic antigen, FVC= Forced vital capacity, FEV1= Forced expiratory volume in 1 second, CT= computed tomogrphay, GGO= ground glass opacity, pStage= pathologic stage, LN= Lymph nodes, AAH= Atypical adenomatous hyperplasia, SCC= Squamous cell
Table 2. Predictive factors for nodal metastases in cT1aN0M0 non-small cell lung cancer
Variables pN+
Univariate Multivariate
Odd ratio (CI) p Odd ratio (CI) p
Age 0.988 (0.942-1.037) 0.623 - -
FEV1 1.480 (0.640-3.425) 0.360 - -
Men 2.245(0.778-6.472) 0.135 - -
Tumor size 20.179 (4.505-90.393) <0.001 21.225(2.783-161.890) 0.003 CEA level 1.194 (1.035-1.379) 0.015 1.205(1.028-1.411) 0.021 GGO % 0.529 (0.329-0.852) 0.009 0.420 (0.207-0.851) 0.016 Resected LN number 1.087 (1.030-1.144) 0.002 1.054 (0.960-1.157) 0.272 Non-lepidic tumor* 0.122 (0.022-0.669) 0.015 - - Visceral pleural invasion 7.020 (2.109-23.366) 0.001 - - Lymphovascular invasion 156.0 (33.317-730.448) <0.001 - - pN+= pathologic N1-2 disease, CI: Confidence interval, FEV1= Forced expiratory volume in 1 second, CEA=
carcinoembryonic antigen, GGO= ground glass opacity, LN= Lymph nodes, *Lepidic component < 25%
Table 3. Preoperative variables for prediction of pN+ in cT1N0M0 NSCLC Variables pN+
Odd ratio (CI) p
Tumor size≧ 1.5 cm 10.961 (3.026-39.709) < 0.001 CEA≧ 3 ng/mL 4.997 (1.169-21.36) 0.030 GGO < 25% 19.901 (2.589-152.94) 0.004 pN+= pathologic N1-2 disease, NSCLC= non-small cell lung cancer, CEA=
carcinoembryonic antigen, GGO= ground glass opacity
Table.4 The patients with nodal upstaging Age Sex CEA
(ng/mL)
Size (cm) GGO Pathology N1 N2 Status at last follow-up
1 66 F 1.36 2.0 < 25% Adeno + - Alive with disease 2 45 M 1.20 1.9 < 25% Adeno + - Died of disease 3 62 F 2.00 1.8 >25% Adeno + - Disease free 4 67 M 4.00 1.5 < 25% SCC - + Disease free 5 70 M 5.52 1.8 < 25% Adeno - + Disease free 6 61 M 6.24 2.0 < 25% Adeno - + Alive with disease 7 48 F 1.28 1.7 < 25% Adeno + + Alive with disease 8 42 M 12.10 1.5 < 25% Adeno + + Disease free 9 58 F 1.80 1.7 < 25% Adeno + + Disease free 10 64 M 1.27 1.1 < 25% Adeno + + Alive with disease 11 65 F 1.37 1.3 < 25% Adeno + - Alive with disease 12 49 F 1.05 1.9 < 25% Adeno + - Died of disease 13 39 F 1.34 1.8 < 25% Adeno + - Alive with disease 14 61 M 13.70 1.2 < 25% Adeno + + Died of disease
CEA= serum carcinoembryonic antigen, GGO= ground glass opacity, M= male, F= female, Adeno= adenocarcinoma, SCC= squamous cell carcinoma, + and - = having or not having metastatic carcinoma
九、中英對照表 肺葉切除= lobectomy
亞肺葉切除= sublobar resection 楔狀切除= wedge resection 解剖性切除= anatomic resection
淋巴腺病理分期升級= nodal upstaging 病理分期= pStage
毛玻璃樣變化= ground-glass opacity (GGO) 實質腫瘤= solid tumor
半實質毛玻璃樣變化= part-solid GGO 淋巴結廓清= lymph node dissection 淋巴結採樣= lymph node sampling 術後無淋巴結轉移= pN0
術後有淋巴結轉移= pN+
新輔助治療= neoadjuvant therapy
臟層肋膜侵犯= visceral pleural invasion (VPI) 淋巴血管侵犯= lymphovascular invasion (LVI)
非典型腺樣增生= atypical adenomatous hyperplasia (AAH) 冰凍切片= frozen section