國
立
交
通
大
學
電
子
物
理
研
究
所
碩 士 論 文
氧化鎢─白金─氧化銥結構
之葡萄糖感測器的研究
Glucose microsensor device
Based on WO
3─Pt─
IrO
2structure
研究生:陳志恂
指導教授:趙書琦 博士
之葡萄糖感測器的研究
Glucose microsensor device
Based on WO
3─Pt─
IrO
2structure
研究生:陳志恂
Student: Chin-Hsun Chen
指導教授:趙書琦 博士
Advisor: Dr. Shu-Chi Chao
國 立 交 通 大 學
電 子 物 理 研 究 所
碩 士 論 文
A Thesis
Submitted to Institute of Electrophysics College of Science
National Chiao-Tung University in Partial Fulfillment of the Requirements
for the Degree of Master of Science
in
Electrophysics June 2005
Hsinchu, Taiwan, Republic of China 中華民國九十四年六月
氧化鎢─白金─氧化銥結構
之葡萄糖感測器的研究
研究生:陳志恂
指導教授:趙書琦 博士
國立交通大學電子物理研究所
中 文 摘 要
本論文的內容主要介紹,以氧化鎢/氧化銥二極體為基礎的葡萄糖感 測器,我們首先改變濺鍍薄膜的位置以證明雙載子注入為此二極體元件 工作的必要條件。之後沿用此結構,在工作區塗佈上含有葡萄糖氧化脢 的聚乙烯醇薄層,並利用固定化的技術,將其製成不溶於水的薄膜。此 種感測器中的葡萄糖氧化脢會催化葡萄糖溶液氧化產生氫離子,使得元 件整體電性受到影響,不同濃度的葡萄糖便能量測到不同的電流值,且 實驗發現元件可以長時間穩定工作,並能快速地以電流響應濃度改變, 表示此元件具有解析葡萄糖濃度的能力。Glucose microsensor device
Based on WO
3─Pt─
IrO
2structure
Student: Chin-Hsun Chen Advisor: Dr.Shuchi Chao
Institute of Electrophysics
National Chiao-Tung University
Abstract
A glucose microsensor based on WO3/IrO2 diode device. We have
changed the position of the WO3 and IrO2 thin film to improve that “Double injection” is the essential condition of our device.
We next placed a glucose oxidase layer over the WO3/IrO2
electrochemical microdiode and used it to detect glucose. Glucose is selectively oxidized in the reaction to generate H+ ion that can change current in forward bias. We can determine the concentration of glucose by measuring current. The glucose sensors current responded reproducibly to the concentration changes of the analysis in the range of 0.2mM~20mM. Such microdiode can work stably for a long time and don’t lose the characteristic.
誌謝
在充實的兩年研究生涯中我成長許多也受益匪淺,感謝趙書琦老師 這兩年不辭辛勞的指導與鼓勵。同時也感謝洪天河先生在實驗過程中熱 心協助、指教,還有實驗室的學長、同學、學弟妹們的協助,才能使論 文進展順利完成。 最後感謝我的父母兄長及女友在我遇上挫折時給予的關心與支持, 僅以此論文,獻給我愛的家人與師長,將此成果與你們共享。謝謝你(妳) 們。目錄
頁次 中文摘要 ……… I 英文摘要 ……… II 誌謝 ……… III 目錄 ……… IV 圖目錄 ……… Ⅵ 第一章 緒論 ……… 1 第二章 原理 ……… 5 2.1 氧化鎢的基本特性 ……… 5 2.2 氧化銥的基本特性 ……… 6 2.3 氧化鎢/氧化銥元件工作原理 ……… 7 2.3.1 元件工作原理 ……… 7 2.3.2 薄膜相對厚度對電流的影響 ……… 8 2.4 氧化鎢/氧化銥二極體葡萄糖感測元件 ……… 8 2.4.1 固定化生物催化劑作用機制 ……… 9 2.4.2 電化學元件機制 ……… 9 2.4.3 葡萄糖氧化脢薄膜固化機制 ……… 10 2.4.4 葡萄糖氧化脢內部作用機制 ……… 10 第三章 實驗裝置及過程 ……… 12 3.1 實驗材料 ……… 12 3.1.1 陣列型白金微電極晶片 ……… 12 3.1.2 靶材 ……… 13 3.1.3 不銹鋼圓孔光罩之製作 ……… 13 3.1.4 含葡萄糖之磷酸緩衝液 ……… 13 3.2 RF 濺鍍系統 ……… 14 3.3 元件製程 ………
14 3.3.1 晶片清潔 ……… 14 3.3.2 微影製程 ……… 15 3.3.3 濺渡氧化鎢 ……… 15 3.3.4 濺鍍氧化銥 ……… 16 3.3.5 薄膜厚度量測 ……… 16
3.3.6 元件封裝 ……… 16 3.4 葡萄糖氧化脢薄膜的製備與覆蓋 ……… 17 3.4.1 薄膜相關材料 ……… 17 3.4.2 酵素薄膜製程 ……… 17 3.5 實驗量測 ………
18 3.5.1 雙載子注入證明實驗 ……… 18 3.5.2 不同葡萄糖濃度的二極體 I-V 特性 ………… 19 3.5.3 感測元件對單一濃度響應實驗 ……… 19 3.5.4 感測元件對不同濃度響應實驗 ……… 20 第四章 結果與討論 ……… 21 4.1 元件二極體特性曲線與雙載子注入證明 ………… 21 4.2 元件對葡萄糖的 I-V 量測 ………
21 4.2.1 氧化銥濺鍍薄膜 160nm ……… 22 4.2.2 氧化銥濺鍍薄膜 90nm ……… 22 4.3 元件對單一濃度響應結果 ……… 23 4.4 元件對不同濃度響應結果 ……… 24 第五章 總結 ……… 27 參考文獻 ……… 29 圖表 ……… 31
圖表目錄
Fig 1.1 生物感測器在不同階段的工作流程 ………1 Fig 2.1 順向偏壓元件工作原理 ………7 Fig 2.2 逆向偏壓元件工作原理 ………8 Fig 2.3 液態葡萄糖微型感測元件工作原理示意圖 ………10 Fig 2.4 Bis-azide 化學結構式 ………10 Fig 2.5 蛋白質經戊二醛鏈結之示意圖 ………11 Fig 2.6 甘胺酸與殘留的戊二醛反應方程式 ………11Fig 3.1
(a)
Microelectrode array pattern………31
(b)
Stainless mask………31
Fig 3.2 白金電極製作流程 ………32
Fig 3.3 The sputtering equipment setup
………33
Fig 3.4 元件製作流程 ………34 Fig 3.5 葡萄糖氧化脢薄膜製作流程 ………36 Fig 3.6 雙載子注入量測實驗裝置 ………37 Fig 3.7 濃度響應裝置 ………38 Fig 4.1 雙載子注入證明實驗結果 ………39 Fig 4.2 不同葡萄糖濃度氧化鎢較厚之元件 I-V 特性 ………40 Fig 4.3 定電流下電壓與濃度關係實驗結果 ………41
Fig 4.4 不同葡萄糖濃度氧化銥較厚之元件 I-V 特性 ………42 Fig 4.5 定電流下電壓與濃度關係實驗結果 ………43 Fig 4.6 順向偏壓下葡萄糖與緩衝液切換實驗結果 ………44 Fig 4.7 順向偏壓下葡萄糖與緩衝液切換實驗結果比較 …………48 Fig 4.8 定電壓下電流變化與葡萄糖濃度關係實驗結果 …………49 Fig 4.9 順向偏壓下不同濃度葡萄糖溶液連續切換實驗結果 ……50 Fig 4.10 定電壓下電流與濃度關係實驗結果 ………51 Table 4.1 濃度切換之電流變化量 ………25 Table 4.2 葡萄糖濃度遞增之電流變化量 ………26 Table 4.3 葡萄糖濃度遞減之電流變化量 ………26
第一章 序論
1.1 前言
生物感測器可以定義為使用固定化的生物分子(immobilized biomolecules)來完成能量轉換的機制,並且可用來對生物體自身的化 學物質,或對某特定交互作用產生回應的一種裝置。生物感測器由兩 個關鍵部份所構成,其一是來自於生物體分子辨認元件,此功能可用 來做為生物感測器信號的接收或產生。另一屬於硬體儀器元件,其功 能為物理信號的轉換。因此,如何以生化方法分離、純化或合成特定 的生物活性分子(biological active materials),結合精確而且回應快速 的物理換能器(transducers)進而組合成生物感測器反應系統,成為研 究生物感測器的主要目的[1]。 Enzymes Electrodes Microorganism Transistor Tissue Thermistor Immunoagent Optical fiber
Micro electronic Amplifier
Biroreceptor Transducer Signal Processing data Biosensor Sample Enzymes Electrodes Microorganism Transistor Tissue Thermistor Immunoagent Optical fiber
Micro electronic Amplifier
Biroreceptor Transducer Signal Processing data Biosensor Sample Fig 1.1 生物感測器在不同階段的工作流程 生物感測器為了能夠獲得最佳的信號傳遞,固定化的生物元件通 常與信號轉換元件緊密地接合在一起。基本上,由信號產生方式的不 同,可以將生物感測器區分成兩種主要類型: (1)生物親和性感測器(Bioaffinity sensors) 當固定化生物元件與待測定之分析物發生親和性結合(bioaffinity binding)時,會造成外觀、厚度、質量、熱量、光學等物理量的變 化。此種經由分子辨認─結合過程的生物感測器如免疫感測器、 化學受體感測器等,其分析可為荷爾蒙、蛋白質、醣類、抗原或
抗體,而相對應的受體可為荷爾蒙受體、染劑、外源凝集素 (lectins)、抗體或抗原等。 (2)生物催化型感應器(Biocatalytic biosensors) 此類感測器之信號偵測並不在於分子辨認─結合的階段,而是當 固定化分子與待測物反應後,再經特定電極偵測該反應後的代謝 物並以電子訊號表現出來。目前有關此類生物感測器的兩個主要 研究發展方向為(1)使用酵素共軛物(enzyme conjugates)、環系酵 素群(cycling enzymes)和系列酵素來組合生物感測器,(2)使用微 生物細胞、動-植物組織切片或可滲透性細胞(permealized cells)等 來當作分子辨認元件。 欲發展具有某一特定功能的生物感測器之前,首先須根據選用的 生物分子特性、作用機制、信號的產生與輸出模式、待測物濃度範圍 以及可操作之環境等參數做通盤性的考慮,再慎選適當的信號轉換 器。感測器可依信號轉換器的不同分為下列數項主要技術: (1)電化學生物感測器(Eletrochemical Biosensor) 此類型的感測器發展的最早,由Clark 和 Lyons 首先開發出酵素 電極生物感測器,以電流計方式測定溶液中葡萄糖的濃度。大部 分的生化代謝型生物感測器均使用特定的電極當作訊號轉換器, 如溶氧電極、白金電極、氨電極、二氧化碳電極與 pH 電極等。而 信號輸出的方式又可分為電流、電壓與導電度測定等方法。酵素 電極的測定原理為利用特定電極量取反應產物之生成量或反應物 之消失量。 (2)半導體離子感測器─離子選擇性場效電晶體(ISFET) 由金屬絕緣場效電晶體(MISFET)改良而成,利用絕緣性佳且不易 被水分子及離子侵入的氮化矽(Si3N4) 薄膜取代MOSFET的金屬 氧化物薄膜[2]。此類感測器可直接置於待測溶液,當待測物與離 子感應膜上的接受器產生反應後,離子感應膜即產生界面電位變 化,信號便可由汲極(drain)輸出。假如以固定化酵素薄膜代替離 子感應膜,則此種設計稱為ENFET(酵素場效性半導體) 。 (3)光纖生物感測器(Fiber-optic biosensor) 利用光纖來做訊號的傳遞可以確保訊號不會因外界的干擾而產生 雜訊。此種感測器是在光纖橫切面固定上一層指示劑(生物螢光物 質、化學發光物質、染料),當感測時化學作用會使指示劑產生光
學訊號,再藉由光纖來傳輸,最後以儀器系統量取光量、螢光強 度、顏色變化、冷光變化等參數來達到測定的目的。
(4)壓電晶體生物感測器(Piezoelectric quartz crystal biosensor)
是最近幾年才被用作生物感測器的信號轉換器[3],最早發表是使 用甲醛去氫酵素(formaldehyde dehydrogenase)與輔因子固定在壓 電石英晶體電極上用來測定空氣中的甲醛成份,有關壓電晶體生 物感測器則尚在萌芽的階段。
1.2 實驗背景
本實驗室的生物感測器是一種酵素型的葡萄糖感測器,感測器主 體是以氧化鎢(WO3)/氧化銥(IrO2)為基礎的二極體元件[4][5][6],元件 薄膜是以濺鍍的方法製成,此種氧化物薄膜極為穩定,即使在液態環 境下仍可操作,不像傳統P-N接面二極體或金-半接面二極體會因為容 易成長氧化層而無法在液態環境下工作。而這個二極體元件的感測機 制則是在氫離子與電子雙重注入的條件下[7],兩薄膜會產生氧化還原 反應[8] [9]所設計,其反應式如下 : WO3 (淡黃色絕緣體) + xH+ +xe- R HxWO3 (深藍色導體) IrO2‧H2O (藍黑色導體)+ H+ + e- R Ir(OH)3 (無色絕緣體) 由方程式可以知道元件的整流特性和氫離子、電子的注入息息相關, 因此我們利用固定化[10] [11]的葡萄糖氧化脢(Glucose Oxide,簡稱GOD) 薄膜在含氧的情況下可催化葡萄糖,加速產生Glucose-和H+,當葡萄 糖的濃度越高則產生的氫離子濃度也越高,其反應式如下 : β-D-Glucose + 12O2 GODJJJJJG Glucose acid + H2O2 GOD : glucose oxide
由上式可知大部分以電化學為基礎的葡萄糖生物感測器皆以量測O2 消耗量,或是H2O2產生量,來做葡萄糖濃度的分析,我們則是利用 產生的H+擴散至我們的氧化鎢/氧化銥薄膜上,來達成雙載子注入的 先決條件,元件便可表現出二極體的整流特性,並藉由電訊號的傳遞 進行葡萄糖濃度的解析。我們的元件將結合電化學及離子反應生物測 器的特性,其特性如下:感測範圍 mM~µM、安定性 1~100 天、反
應時間0.1 分鐘~10 分鐘、尺寸微小化。由於我們的感測元件對葡萄 糖空間濃度上具有解析的能力,利用此特點可以判斷食品表面與內部 的葡萄糖濃度差異,將來可以應用在食品新鮮度的感測上。 本論文共分為五個章節,其中第二章將會詳細解釋元件的工作原 理,第三章用來說明元件的製程方法及相關的量測裝置,第四章則將 實驗的結果加以分析討論,第五章針對整體實驗作一個總結。
第二章 原理
本章將對一種能夠在液態環境下穩定工作的微型二極體葡萄糖 感測元件提供理論上的依據。元件對葡萄糖濃度響應主要可分為兩個 部分:氧化鎢(WO3)/氧化銥(IrO2)的氧化還原機制;以固化 (immobilization)技術製成不溶於水的葡萄糖氧化脢薄膜。藉由葡萄糖 氧化脢將葡萄糖催化後進行氧化作用,改變元件周圍的氫離子濃度, 進而完成薄膜氧化還原反應。
2.1 氧化鎢的基本特性
氧化鎢(Tungsten Oxide)是一種n-type[12]半導體化合物及陰極電 色材料[13] [14] [15] [16],薄膜成長的條件與方式會造成成分比例不同。我 們可將化學式記為WOz,z值會隨薄膜內位置的不同而改變[17],經分 析可知介於2.72~3 之間,我們一般不考慮此特性皆以WO3表示氧化 鎢化學式,在RF濺鍍後的回火(350℃)可使薄膜偏向單晶(Single crystal)或多晶(Poly crystal)的材料[17] [18]。氧化鎢材料在氧化還原過 程中有兩個重要的特性: (1)大量改變導電度 可由晶格結構與能帶分佈來解釋,氧化還原作用機制是由氫離子 和電子共同達成,稱為雙重注入(Double injection) [19] [20] [21] [22] [23] [24],兩者缺一不可。在雙重注入的條件下,由氧化鎢接觸的電極 提供電子,酸性環境則提供氫離子進入氧化鎢晶格結合成 HxWO3,可在氧化鎢的導電帶(Conduction Band)上提供價電子 [24],因此越多氫離子注入則導電帶上越多價電子,H xWO3整體導 電度上升。在還原的過程中,氧化鎢由原本Regular Octahedron晶 格結構,逐漸轉變為Perovskite晶格結構[25],其中x呈現連續性的 變化,可介於0~0.5 之間[26],當x值等於 0.32 左右導電度變化最 大,稱為insulator-metal transition,需外加反向偏壓才可使HxWO3產 生氧化反應變回WO3,在氧化的過程同時釋放出氫離子與電子, 稱為double extraction;還原的過程中若x值大於 0.4,會因為注入 離子的緊密結合而無法進行氧化反應回到WO3。其反應式如下 : WO3 (淡黃色絕緣體) + xH+ +xe- R HxWO3 (深藍色導體)
(2)電色特性 我們已知氧化態的WO3處於酸性環境下且外加負偏壓時會還原成 HxWO3,可以看到鎢的氧化數由正六價變為正五價(W6+ W → 5+),表示藉由價電子的遷移可吸收一個光子使得H xWO3呈現深 藍色,此現象稱為電色反應,過程稱為上色(coloration)。電色反 應具有記憶性,即使移除外加偏壓亦無法去除顏色,只能以外加 反向偏壓才可以再變回淡黃色,過程稱為消色(bleaching) [27]。
2.2 氧化銥的基本特性
氧化銥(Iridium Oxide)是一種陽極電色材料、Rutile結構,與其他 電色材料比較起來具有以下特性[28]:電色反應速度快、電色對比好、 光譜吸收寬、大範圍溫度操作、穩定性佳不易腐蝕、電色反應有記憶 性。氧化銥的可能氧化還原反應有以下兩種 : 酸性條件,移出H+機制為主 IrO2‧H2O (藍黑色導體)+ H+ + e- R Ir(OH)3 (無色絕緣體) 鹼性條件,移出OH-機制為主 IrO2‧H2O (藍黑色導體)+ H2O + e- R OH- + Ir(OH)3(無色絕緣體) 註:實驗是由葡萄糖被氧化所產生氫離子作用,因此我們採第一式也就是酸性條 件做為氧化銥的反應式。 用來解釋氧化銥的電色機制有三種: (1)電子轉移著色[29] [30]:在氧化的過程,銥的氧化數由正三價變為正 四價(Ir3+ → Ir4+),經由價帶電子的轉移造成可見光部分的吸收。 (2)著色中心著色[31]:電子被結構中的氧空缺(vacancy)捕捉,使得著 色中心吸收可見光造成薄膜顏色改變。 (3)能帶理論模型解釋:此模型假設費米能階由能帶內位移至能帶隙 間,造成氧化銥薄膜由著色態Ir4+轉移至消色態Ir3+。2.3 氧化鎢/氧化銥元件工作原理
2.3.1 元件二極體工作原理
WO3 (淡黃色絕緣體) + xH+ +xe- R HxWO3 (深藍色導體) IrO2‧H2O (藍黑色導體)+ H+ + e- R Ir(OH)3 (無色絕緣體) 當元件處於順向偏壓的情況下,我們定義是將高電位與氧化銥 薄膜連接,低電位與氧化鎢薄膜連接。此時氧化銥相對於氧化鎢具有 較高的電位,高電位接收氧化銥釋出的電子,而從還原態氧化成IrO2, 銥的氧化數(Ir3+ → Ir4+),薄膜由無色轉變為黑色;而此時氧化鎢薄 膜接受氫離子,加上負極所提供的電子,而從氧化態還原成HxWO3, 鎢的氧化數(W6+ → W5+),薄膜由淡黃色轉變成深藍色,如Fig 2.1 元件整體導電度上升。此元件由於氧化銥的標準電位比氧化鎢的標準 電位高,因此當外加偏壓在克服能位障之後,元件便可導通,以致電 流急遽增大,如同二極體在順向偏壓下的電特性。 H+ Fig 2.1 順向偏壓元件工作原理 相反的,逆向偏壓定義為高電位與氧化鎢薄膜連接,低電位與氧化銥 薄膜連接。此時氧化鎢相對於氧化銥具有較高的電位,高電位接收氧 化鎢釋出的電子,而從還原態氧化成WO3,鎢的氧化數(W5+ → W6+),薄膜由深藍色轉變為淡黃色;而此時氧化銥薄膜接受氫離子, 加上負極所提供的電子,而從氧化態還原成Ir(OH)3,銥的氧化數(Ir4+ Ir → 3+),薄膜由黑色轉變成無色,如Fig 2.2 元件整體導電度下降。 此時只有趨近於零的微小工作電流。 HxWO3 IrO2 CV-50 Pt Pt Pt+
-e- e-Ⅰ
FH+ Fig 2.2 逆向偏壓元件工作原理
2.3.2 相對厚度對電流的影響
當我們做葡萄糖濃度感測的實驗時,可以看到兩種相反的結果, 若我們濺鍍薄膜氧化鎢厚度大於氧化銥,則電流大小隨著葡萄糖濃度 上升而上升。但是若濺鍍氧化銥薄膜厚度大於氧化鎢,則電流大小隨 著葡萄糖濃度上升而下降。原因是由於元件的電性將被較厚的薄膜方 所主導,當氧化鎢薄膜厚時,由氧化還原方程式可知氫離子濃度增加 薄膜會由WO3還原成導電性佳的HxWO3,因此在固定電壓下電流將 隨著氫離子濃度增加而上升;相反的若元件的薄膜是氧化銥較厚則元 件電性將為氧化銥作為主導因素,由反應方程式可知當氫離子濃度增 加薄膜會由IrO2還原成導電性差Ir(OH)3,因此在固定電壓下電流將 隨著氫離子濃度增加而下降。
2.4 氧化鎢/氧化銥二極體葡萄糖感測元件
生物感測器(biosensors)通常由兩部分構成,其一是固定化的生 物催化劑(immobilized biocatalysts),另一則是電化學元件 (electrochemical device)。本實驗所用的生物催化劑是以葡萄糖氧化 脢與聚乙烯醇混合製成的酵素薄膜(enzyme membranes)但這種分子 聚合體會在水溶液中逐漸分解,因此我們使用固定化的技術使我們的 薄膜不會在實驗過程中剝離。而電化學則是架構在二極體元件的基礎 上,這種二極體可對葡萄糖氧化作用產生氫離子濃度變化有良好的感 WO3 Ir(OH)3 CV-50 Pt Pt Pt e- e--+
Ⅰ
R測性能。
2.4.1 固定化生物催化劑的作用機制
組成成分中最重要的便是葡萄糖氧化脢,它決定了感測元件的反 應速率。一般而言當葡萄糖在有氧氣的狀況下可以自然氧化產生 Gluconate-和氫離子,但此作用非常緩慢,若經由葡萄糖氧化脢的催 化作用便能在極短的時間內完成。反應式如下: β-D-Glucose + 12O2 GODJJJJJG Glucose acid + H2O2
GOD : glucose oxide
當含有葡萄糖的緩衝液滲透進到工作區的聚乙烯醇內部,便可在葡萄 糖氧化脢的催化下使葡萄糖加速被氧化,過程中將會產生氫離子,此 時氫離子便可擴散至薄膜下方的氧化鎢/氧化銥進行電化學反應。
2.4.2 電化學元件機制
由於薄膜厚度會影響電流改變的趨勢,我們只採用氧化鎢薄膜較 厚的情況下所製作而成的感測元件。當葡萄糖被氧化而產生的氫離子 進入到WO3-Pt-IrO2工作區,元件表現出的電性是電流上升;當不含 有葡萄糖的緩衝液進入工作區則葡萄糖氧化脢會停止催化作用,氫離 子濃度降低,電流進而下降回到原本的大小。再者當我們將葡萄糖濃 度增加,氧化所產生的氫離子濃度越大,電流相對變大。也就是說當 濺鍍出的薄膜厚度為氧化銥薄膜較厚時,整個電流改變將隨葡萄糖濃 度上升而下降。 總結上述兩部分元件工作機制,我們繪製了示意圖Fig 2.5,緩 衝液中的葡萄糖經擴散作用進入GOD 薄膜層,在氧氣與氧化脢的作 用下產生氫離子,並且擴散至元件工作區。另一方面利用外加偏壓, 提供電子進入,以便達成雙重注入的反應條件。
Pt Pt Pt
Diode layer
CV-50
WO3 film IrO2 film
GOD layer
Reagent layer
Gluconate
-+ H+
Glucose in buffer solution
Epoxy Epoxy
Pt Pt Pt
Diode layer
CV-50
WO3 film IrO2 film
GOD layer
Reagent layer
Gluconate
-+ H+
Glucose in buffer solution
Epoxy Epoxy Fig 2.3 液態葡萄糖微型感測元件工作原理示意圖
2.4.3 葡萄糖氧化脢薄膜固化機制
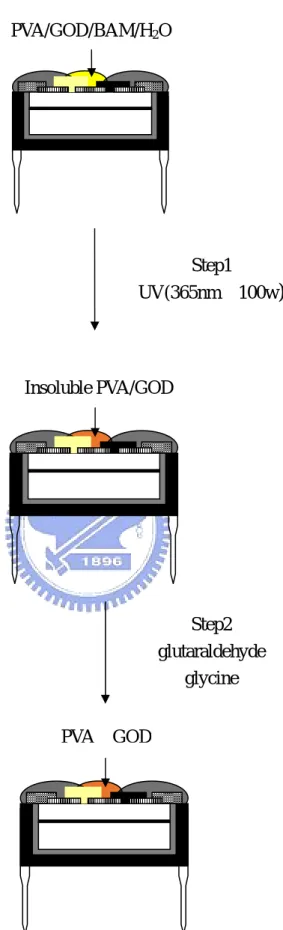
在我們的葡萄糖氧化脢薄膜固化的過程中,加入固化劑 (2,6-Bis(4-azidobenzylidene)-4-methylcyclohexanone)能使聚乙烯醇在 照紫外光之後產生交叉鏈結。由化學結構Fig 2.6 可看到Bis-azide含有 兩個azide反應鍵,因此能將兩串分子鏈結,使聚乙烯醇薄膜更固化。 相反的若未經過紫外光照射的聚乙烯醇,浸泡在溶液中數小時後薄膜 則會完全溶解[10] [11] [32],表示固化的過程中紫外光照射是極為重要的 步驟。 CH3 O N3 N3 CH CH CH3 O N3 N3 CH CH Fig 2.4 Bis-azide 化學結構式
2.4.4 葡萄糖氧化脢內部作用機制
在我們的葡萄糖氧化脢薄膜固化過程中,利用戊二醛 (glutaraldehyde)來進行蛋白質分子與分子間的交叉鏈結(cross-link),
若只使用戊二醛會使蛋白質的內部與外部都發生鏈結,但內部鏈結是 我們所不希望發生,因為這會對葡萄糖氧化脢的活性造成影響,因此 為阻止蛋白質分子內部交叉鏈結的發生,必須提高蛋白質的濃度,而 最常使用的方法是在薄膜製備時便加入牛血清蛋白(BSA)。在加入 BSA 之後,當戊二醛正促使蛋白質分子進行交叉鏈結時,其外部的蛋 白質鏈結已接近完成,我們在戊二醛擴散進入至蛋白質內部使內部進 行鏈結之前加入甘氨酸(glycine),使其和殘餘的戊二醛作用,以保持 蛋白質內部結構的完整性,如此便不會破壞我們製備的葡萄糖氧化脢 薄膜活性。 Protein N CH (CH2)3 CH N n Protein N CH (CH2)3 CH N n Fig 2.5 蛋白質經戊二醛鏈結之示意圖
(CH2)3 (Residual) + glycine imines (terminated)
CHO
CHO (CH2)3 (Residual) + glycine imines (terminated)
CHO CHO
第三章 實驗裝置及過程
3.1 實驗材料
3.1.1 陣列型白金微電極晶片
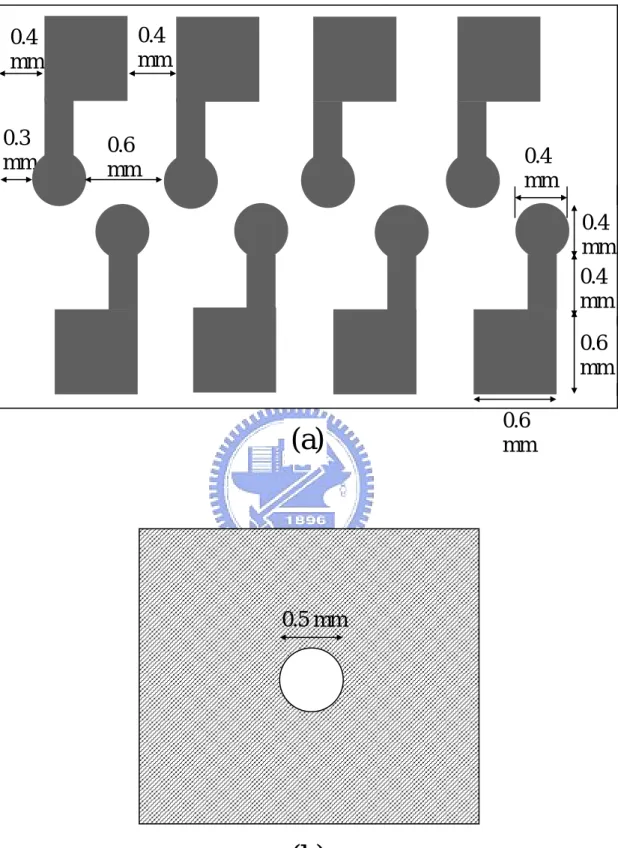
(1) 矽晶片實驗所用矽晶片是由昇美達公司代理的 4 吋晶片,參數如下 厚度 : 525±25µm 直徑 : 100±5mm 晶向 : (100)±0.5deg 摻雜 : 磷摻雜 N 型 電阻率 : 1-20 Ohm .cm (2) 光罩設計 製作白金微電極所用的玻璃光罩是用L-edit 軟體所設計並交由 國家奈米中心製作,單一電極長度1400µm、寬度 600µm、前端圓形 電極半徑200µm,兩電極之間相距 400µm。單一晶方為上下相對各四 個電極所組成,如Fig 3.1(a)所示,設計完成之光罩橫向、縱向分別 有15 及 22 個晶方,總共有 330 個晶方。 (3) 晶片製作
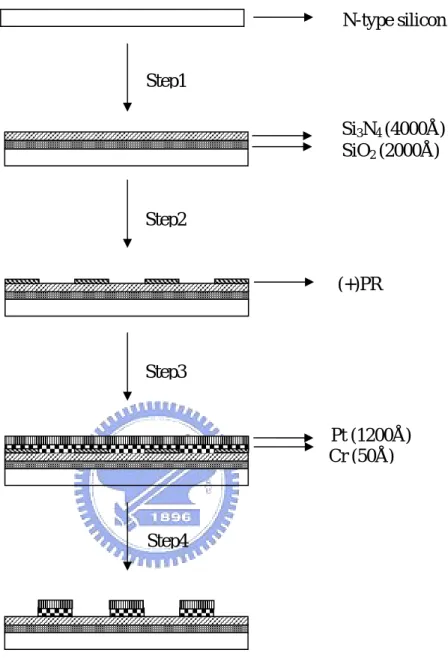
晶片的製作流程是由實驗室設計並交由交通大學半導體中心代 工製成。首先將晶片置入由硫酸與雙氧水3:1 混合液中並加熱至 75℃ ~80℃煮 20 分鐘,之後以去離子水沖洗 5 分鐘,再以濕式氧化成長 氧化矽(SiO2)2000Å,以隔絕白金電極與矽基板之間的漏電流。我 們再以低壓化學氣相沈積法(LPCVD)長氮化矽(Si3N4)4000 Å,如此 便可達到絕緣的效果,以利接下來的白金電極製作。 白金電極是以剝落(lift-off)製程,製作過程如 Fig 3.2,先在晶片 上塗蓋光阻,對準玻璃光罩,如此一來便可曝光並顯影出我們光罩上 的微電極陣列圖形,經過這一連串的微影過程後便以雙電子槍(Dual E-Gun)鍍上鉻(Cr)50 Å 與白金(Pt)1200 Å,鍍鉻的目的是為了使白金 與氮化矽之間增加附著力進而能緊密結合。最後再去除光阻以得到電 極陣列圖樣,整個垂直面結構由下至上依次為矽/氧化矽/氮化矽/鉻/
白金。
3.1.2 靶材
實驗鍍膜所用的靶材分別為氧化鎢(WO3)與銥(Ir),參數如下:
氧化鎢
生產 : ADMAT MIDAS INC. 純度 : 99.99% 密度 : 4.77 g/cc 尺寸 : 直徑 2”× 厚度 0.125” 銥
生產 : PURE TECH IMC. 純度 : 99.95% 密度 : 21.80 g/cc 尺寸 : 直徑 1”× 厚度 0.125”
3.1.3 不銹鋼圓孔光罩製作
我們需考慮晶方大小來製作光罩,首先取一不銹鋼薄片(厚度 0.05mm)切割成大小 2cm × 2cm 正方,在鋼片中央以針尖鑽一圓孔, 再以水砂紙及鑽石銼刀將圓孔周圍修飾圓潤,以避免刮傷晶面,此圓 孔大小直徑約0.5mm,如 Fig 3.1(b) ,接著清洗不銹鋼片,分別依 序以超音波震盪器在去離子水、三氯乙烷(TCA)、丙酮(ACE)、去離 子水中各震盪10 分鐘,再以氮氣槍吹乾且放入烤箱內,以 120℃高 溫烘烤2 小時,使表面水氣完全蒸發,最後將圓孔光罩鍍上黑色氧化 銥薄膜,以改善曝光時散射及反射的問題。3.1.4 含葡萄糖之磷酸緩衝液
實驗使用分別為含20mM、10mM、5mM、2mM、1mM、0.5mM、 0.2mM濃度的葡萄糖緩衝液。首先取KH2PO4(M=136.09g/mol) 1.3609g 與K2HPO4(M=174.18g/mol) 1.7418g先後加入少許去離子水待完全溶 解後再加水至總體積100ml,二者均勻混合形成濃度 100mM、體積 200ml的緩衝液,pH值為 6.8~7.0。 再分別取C6H12O6(M=180.16g/mol)1.8016g、0.18016g、 0.018016g,加入少許去離子水待完全溶解後加水至總體積 100ml,此 時葡萄糖濃度分別為100mM、10mM、1mM。
以配製20mM 溶液為例,我們由 100mM 葡萄糖溶液中取出 20ml 並加入緩衝液10ml,最後加入去離子水至總體積 100ml,因此可以取 得含有20mM 葡萄糖的磷酸緩衝液,其他不同濃度葡萄糖磷酸緩衝液 可依類似的方式得到。
3.2 RF 濺鍍系統
本實驗所用到的兩種濺鍍薄膜皆是反應式濺鍍(Reactive sputtering)系統,分別用來濺鍍氧化鎢薄膜與氧化銥薄膜,裝置如 Fig 3.3。主要由 RF 產生器(RF generator)、匹配器(Matching box)、磁控濺 鍍槍(Magnetron sputtering gun)、氣體流量計(Gas flow meter)、機械式 真空幫浦(Mechanical pump)、電容式真空計(Capacitance vacuum gauge) 、加熱系統、溫度量測系統及真空室所組成。 RF產生器操作為頻率 13.56MHz,經由匹配器自動控制將反射功 率維持於0W,並將RF產生器產生的電磁場帶至濺鍍槍輸出,氣體流 量計控制濺鍍過程中所需氧氣(O2)與氬氣(Ar)的比例與流量,機械式 真空幫浦將真空室內氣體抽至10-3torr之下,加熱系統則將底座加熱 至所需的濺鍍溫度及回火溫度。 氧化鎢濺鍍系統使用2 英吋靶材,靶材至基板距離約為 4cm,氧 化銥濺鍍系統則使用1 英吋靶材,靶材至基板距離約為 4cm。二者真 空室皆由Pyrex 中空玻璃圓柱構成,尺寸為內徑 20cm、高 30cm、厚 度0.5cm,在濺鍍槍與玻璃圓柱之間另外置入石英罩,如此以方便真 空室內的清洗。3.3 元件製程
3.3.1 晶片清洗
(1)以鎢鋼筆切割晶片成尺寸為 4.5mm × 3mm 的晶方(含 4 對白 金電極)。 (2)將切割好的晶方置入裝有去離子水的蒸發皿,用超音波 震盪10 分鐘,以去除表面灰塵,接著吹乾。 (3)將晶方置入裝有三氯乙烷的蒸發皿,震盪 10 分鐘,以去除晶 面上殘留的有機物,之後用去離子水沖洗並吹乾。(4)將晶方置入裝有丙酮的蒸發皿,震盪 10 分鐘,以去除晶面上 殘留的三氯乙烷,再用去離子水沖洗並吹乾。。 (5)將晶方置入裝有硫酸與雙氧水 3:1 之混合液的蒸發皿,震盪 5 分鐘,以去除白金電極上的氧化物,以增加白金電極的導電 度,接著再用去離子水沖洗並吹乾。 (6)將晶方放入烤箱內,以 120℃高溫烘烤 30 分鐘,使得表面水 氣完全蒸乾。
3.3.2 微影製程
(1)由冰箱取出正光阻劑(FH6400L),待至室溫再進行光阻塗佈。 (2)在清洗好的晶方上以針尖均勻塗佈光阻,放入 80℃烤箱軟烤 15 分鐘,以增加光阻附著力。 (3)在顯微鏡下將不銹鋼光罩對準欲濺鍍氧化鎢的位置,使曝光 的圓孔圖樣能橫跨在一對電極之上,接著將晶方放於紫外燈 光(365nm、100w)下曝光 3 分鐘,如此便完成曝光的動作。 (4)將曝光好的晶方置入顯影液(FHD-5)中,顯影 40 秒鐘,再以 去離子水沖洗乾淨並吹乾,此時需再透過顯微鏡確認顯影是 否完全成功,若有光阻殘留則再重複顯影步驟,才可以放入 120℃烤箱硬烤 20 分鐘。3.3.3 濺鍍氧化鎢
(1)將晶方放入氧化鎢濺鍍系統內,加熱基座溫度,並控溫在 85 ℃~90℃,以增加濺鍍薄膜的附著力。 (2)打開抽氣幫浦使濺鍍腔內氣壓降至 2mTorr~5mTorr,關閉閥 門隔絕抽氣再通入氬氣,純化濺鍍腔,並重複三次純化的步 驟盡量去除其餘的氣體。 (3)調整氣體流量計,維持氧氣與氬氣比例 40mTorr:80mTorr。 (4)調整 RF 產生器的輸出功率 140W 並開始濺鍍,濺鍍時間為 3
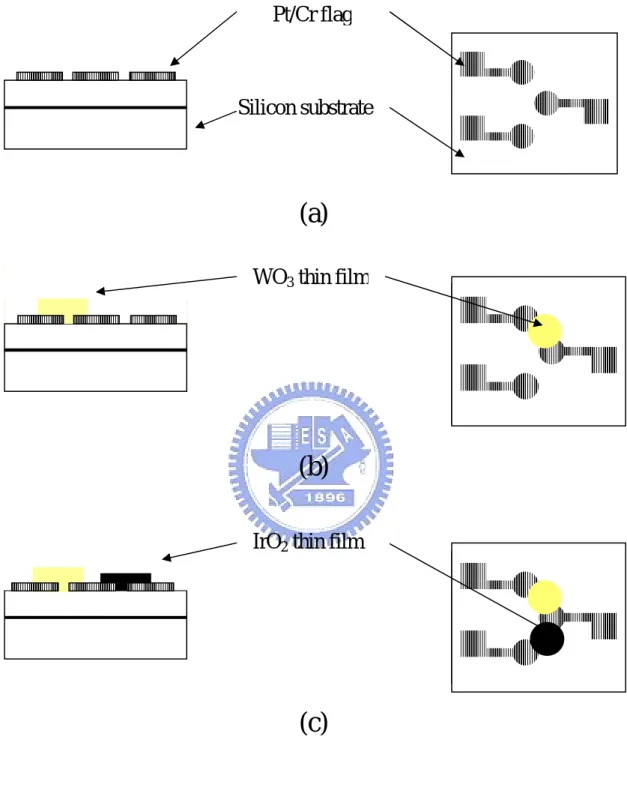
小時30 分鐘。 (5)將濺鍍完的晶方置入 2 杯裝有丙酮溶液的燒杯中,以超音波 震盪分別清洗3 分鐘、5 分鐘,之後用去離子水沖洗並吹乾, 如此完成剝離製程。 (6)將晶方放入烤箱內,以 120℃高溫烘烤 30 分鐘,使得表面水 氣完全蒸乾。 (7)將晶方放入氧化鎢濺鍍腔內,抽真空並加熱基座溫度,控溫 在350℃,氣體流量與之前濺鍍條件相同,維持 3 小時 30 分 鐘,之後關閉加熱系統與氣體,讓晶方自然冷卻到室溫,整 個回火(Annealing)過程可使薄膜由非晶系轉變偏向多晶系 或單晶系,其流程如Fig 3.4(a)、(b) 。
3.3.4 濺鍍氧化銥
(1)將回火完的晶方再次進行微影製程,但不同處在於曝光時的 電極選擇,我們選擇另一對,使得氧化鎢與氧化銥二者相隔 白金電極,整個平面結構順序為Pt-WO3-Pt-IrO2-Pt。 (2)將硬烤過的晶方放入氧化銥濺鍍系統,加熱基座在 85℃~ 90℃,以增加濺鍍薄膜的附著力。經過 3 次濺鍍腔氣體純化, 維持氣體流量氧氣與氬氣比例30mTorr:30mTorr。調整 RF 產 生器的輸出功率50W 並開始濺鍍,濺鍍時間為 1 小時 30 分 鐘。 (3)以丙酮去除晶方上的光阻,用去離子水沖洗並吹乾,放入烤 箱內,以120℃高溫烘烤 30 分鐘,使得表面水氣完全蒸發, 其流程如Fig 3.4(c)。
3.3.5 薄膜厚度量測
以表面輪廓儀(α-step)量測薄膜厚度,選擇工作區WO3-Pt-IrO2, 可以量到白金上的氧化鎢厚度160nm、白金上的氧化銥厚度 110nm, 因此可知氧化鎢較氧化銥厚50nm。3.3.6 元件封裝
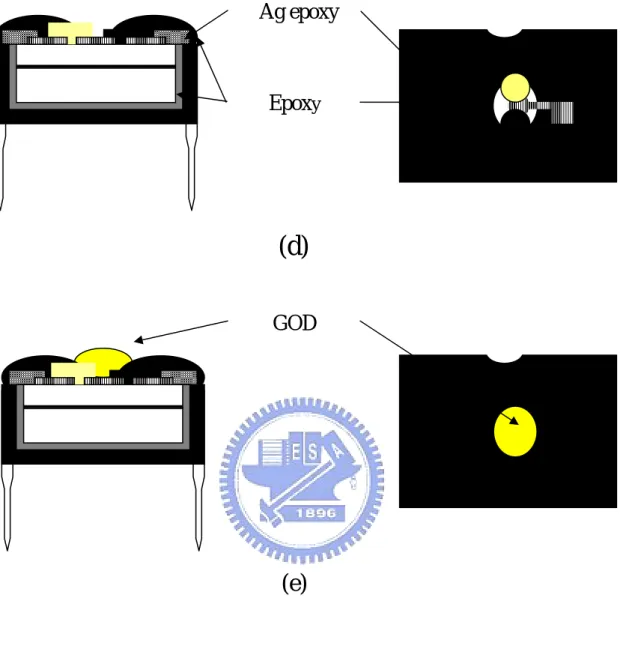
(1)先將環氧樹脂(conap
K-22)均勻混和,填滿 8-pin IC 圓孔腳座中央空洞處以便晶方的放置,將腳座放入60℃烤箱中烤 2 個 小時使樹脂能夠完全固化。 (2)將晶方用環氧樹脂黏著在 IC 腳座上,利用針尖移動晶方至適 當位置,並以環氧樹脂完整包覆晶方周圍的斷面,由於環氧 樹脂絕緣性佳,因此可以隔絕漏電流,確保電性量測的穩定 性。再將元件放入60℃烤箱中烤 2 個小時使樹脂能夠完全固 化。 (3)我們以銀膠(藤倉化成 FA-705A)做電極與 IC 腳座的連線, 由於銀膠須保存在冷藏室,使用前待至室溫方可使用,在顯 微鏡下以針尖連接鍍有氧化鎢與氧化銥的白金電極至IC 腳 座圓孔,再放入120℃烤箱中烤 2 個小時使銀膠能夠完全固 化,其流程如Fig 3.4 (d)。 (4)皆下來要完成整個元件外部封裝,依舊利用環氧樹脂將銀膠 及其他晶方外露部分覆蓋只留下工作區,防止漏電流而使元 件失效。另外要特別注意白金電極部分要完全蓋住,以免因 為白金接觸電解質溶液而剝落。若環氧樹脂以較高的溫度作 固化會有流動現象,可能會將整個工作區蓋住,因此封裝好 的元件放在25℃下 24 小時使其自然固化,如此便完成整個 元件的製作,其流程如Fig 3.4 (d)。
3.4 葡萄糖氧化脢薄膜的製備與覆蓋
3.4.1 薄膜相關材料
實驗所用到的藥品分別如下
聚乙烯醇(POLYSCIENCES,INC. PA18967-2590 133000g/mol) 固化劑(ALDRICH 283029-5G) 牛血清蛋白(SIGMA A-7888) 葡萄糖氧化脢(SIGMA G-2133) 註:使用前需等到藥品溫度升至室溫下再開啟使用,避免因水氣滲入使藥 品變質。
3.4.2 酵素薄膜製程
(1)首先泡製聚乙烯醇溶液,將聚乙烯醇及水以重量比 1:10 的比例混合並加熱至80℃,使聚乙烯醇能夠完全溶解水中,然後 冷卻至室溫,莫耳濃度0.752mM。 (2)取配製好的聚乙烯醇溶液 0.2ml、固化劑 15mg、牛血清蛋白 10mg、葡萄糖氧化脢 10mg,壓碎攪拌混合,此時的黏液即 可用牙籤均勻塗抹在氧化鎢/氧化銥二極體感測元件預留的 工作區上。 (3)將元件置於紫外燈光(365nm、100w)下照射 90 秒鐘,使固化 劑與聚乙烯醇交叉鏈結,薄膜顏色將由原本的淡黃色變成深 黃色,其流程如Fig 3.4(e)。 (4)再將元件浸泡於 25%戊二醛(glutaraldehyde)溶液 5 分鐘, 使聚乙烯醇薄膜表面的蛋白質分子進行交叉鏈結,避免在量 測時蛋白質會擴散到液體中。 (5)將元件以去離子水沖洗並吹乾,並立即放入 0.1M 甘氨酸 (glycine)溶液 15 分鐘,以便跟殘餘的戊二醛反應,防止葡萄 糖氧化脢薄膜內部的蛋白質分子繼續進行交叉鏈結,破壞脢 的活性。 (6)已成功完成固化程序的葡萄糖氧化脢/PVA 薄膜,長時間浸 泡在液體中也不會產生溶解,其流程如Fig 3.5。
3.5 實驗量測
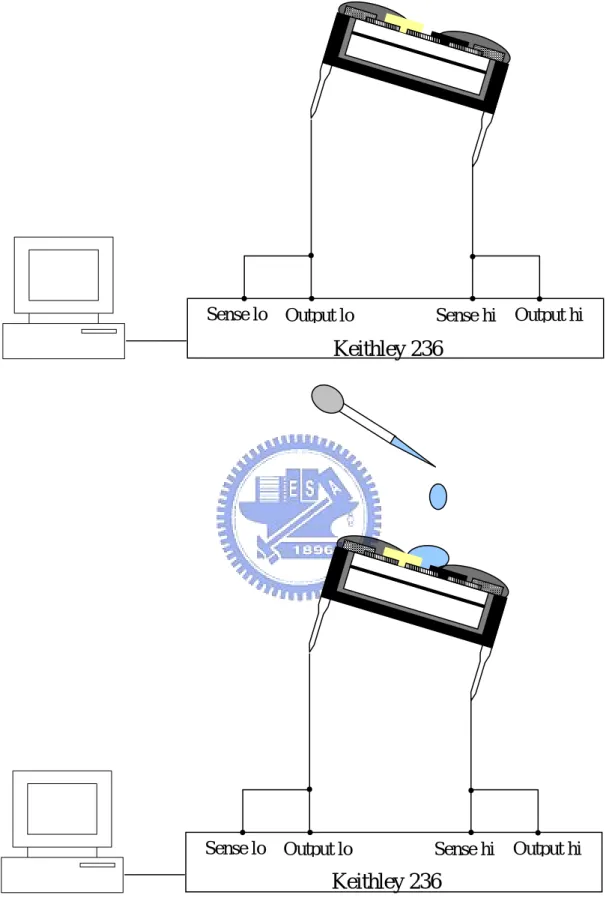
3.5.1 雙載子注入證明實驗
取尚未塗蓋葡萄糖氧化脢薄膜的元件插在 8-pin IC 長腳座上,使
用電流-電壓量測儀器Keithley Model 236 source measure units,將
Keithley 236 的 Sense Hi 及 Output Hi 鱷魚夾接頭共同接上元件氧化銥
薄膜端的IC 接腳上,將 Sense Lo 及 Output Lo 鱷魚夾接頭共同接上 元件氧化鎢薄膜端的IC 接腳上,由 GPIB 介面卡連接量測儀器及電 腦,在利用軟體LabVIEW 5.1 的控制程式來控制 Keithley 236 做電壓 與電流的量測並做圖,完成無電解質下的 I-V 量測。裝置如 Fig 3.6。 配製硫酸溶液(0.1M)當作電解質,將硫酸溶液滴在工作區上形成 一水域而持續供應H+,在與無電解質相同的條件下做電壓與電流的量
測並做圖,完成含電解質的I-V量測。
3.5.2 不同葡萄糖濃度的二極體 I-V 特性
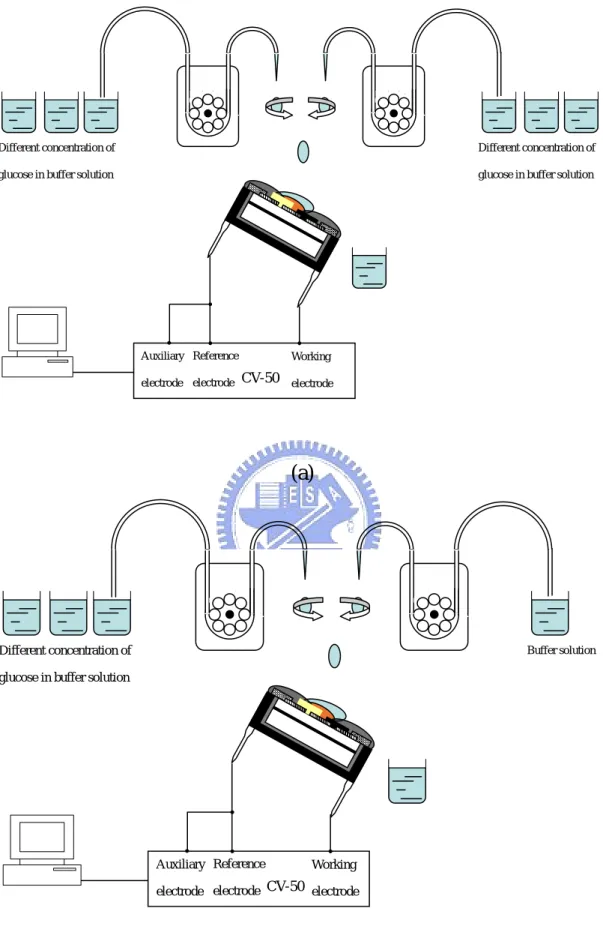
(1) 氧化鎢薄膜厚度大於氧化銥薄膜厚度將有覆蓋葡萄糖氧化脢薄膜的元件插在8-pin IC 長腳座上, 元件接在循環伏安計(Voltammetric Analyzer,CV-50),將 Working electrode 連接到氧化銥薄膜端的 IC 腳座上,另外將 Auxiliary electrode 與 Reference electrode 連接到氧化鎢薄膜
端的IC 腳座上,裝置如 Fig 3.7(a)。選擇 Linear Sweep
Voltammetry 模式量測 I-V 特性,為了在量測的過程中保持 元件穩定,黏 O-ring 在工作區上以便溶液滴入能形成水域, 同時由蠕動幫浦吸取含有不同濃度的葡萄糖磷酸緩衝液,轉 速每分鐘 3 轉,幫浦管是用內徑3.18mm 的 Tygon tube,並 在末端接上一段1ml 針筒,將針筒靠近元件使溶液流入,依 次記錄二極體特性曲線。 (2) 氧化銥薄膜厚度大於氧化鎢薄膜厚度 藉由改變鍍膜的時間可以轉換氧化鎢與氧化銥厚度的相對 關係,將鍍氧化鎢的時間改為2 小時,氧化銥則維持 1 小時 30 分鐘,以相同方法覆蓋葡萄糖氧化脢薄膜,再依次量測 不同濃度下的二極體特性曲線。
3.5.3 感測元件對單一濃度響應實驗
將葡萄糖感測器元件插在8-pin IC 長腳座上,元件接在 CV-50, 將Working electrode 連接到氧化銥薄膜端的 IC 腳座上,另外將Auxiliary electrode 與 Reference electrode 連接到氧化鎢薄膜端的 IC 腳
座上,選擇Single Potential Time Base 模式,設定電壓量測電流變化,
裝置如Fig 3.7(b) 。由於此元件是以二極體為基礎的感測元件,因此 將工作電壓設定在2.0V 的順向偏壓下,當不同濃度溶液通過元件表 面,則元件的導通電流會產生變化。 以含有0mM 和 0.2mM 的葡萄糖溶液做切換為例,首先利用兩座 蠕動幫浦分別吸取0mM(稀釋成 10mM 的磷酸緩衝液,不含葡萄糖) 與0.2mM 的溶液,先將 0mM 溶液注入待元件穩定後再注入 0.2mM 溶液,如此反覆切換3 次,記錄電流的變化。 再以相同方法做(0mM,0.5mM)、(0mM,1mM)、(0mM,2mM)、
(0mM,5mM)、(0mM,10mM)、(0mM,20mM)7 組濃度切換的實驗。
3.5.4 感測元件對不同濃度響應實驗
本實驗量測葡萄糖感測元件能夠連續反應濃度的切換,並且有可
逆的特性。將葡萄糖感測器元件插在8-pin IC 長腳座上,元件接在
CV-50,將 Working electrode 連接到氧化銥薄膜端的 IC 腳座上,另外
將Auxiliary electrode 與 Reference electrode 連接到氧化鎢薄膜端的 IC
腳座上,裝置如Fig 3.7(a)。選擇 Single Potential Time Base 模式,設
定順向偏壓1.8V 量測電流變化。
溶液先以0mM 為起始注入濃度,再切換到 0.2mM、0.5mM、
1mM、2mM、5mM、10mM、20mM,之後再依次遞減回 0mM,做
第四章 結果與討論
二極體是最常見的電子元件之一,它最重要就是具有整流特性, 如同開關的作用,即元件在順向偏壓下外加至大於導通電壓(turn-on voltage)元件電流則大幅增加;若在反向偏壓則只有很小的反向電 流,直到偏壓大於崩潰電壓(break-down voltage)才會使電流突然增 大。由氧化鎢/氧化銥的氧化還原反應式推論我們的感測元件在雙載 子注入的情況下也將會有二極體特性,其中氫離子的注入已被之前學 長發現是由薄膜內部自行產生[33],表示不需要依靠外界電解質提供, 因此我們稍微改變濺鍍薄膜的位置不再讓氧化鎢與氧化銥重疊,而在 兩薄膜間以白金電極相隔,結構由Pt-WO3-IrO2-Pt變為 Pt-WO3-Pt-IrO2-Pt。之後我們繼續沿用此結構來對不同的葡萄糖濃度 作解析,並希望能跟舊型元件相比較後獲得反應速度上的改進。
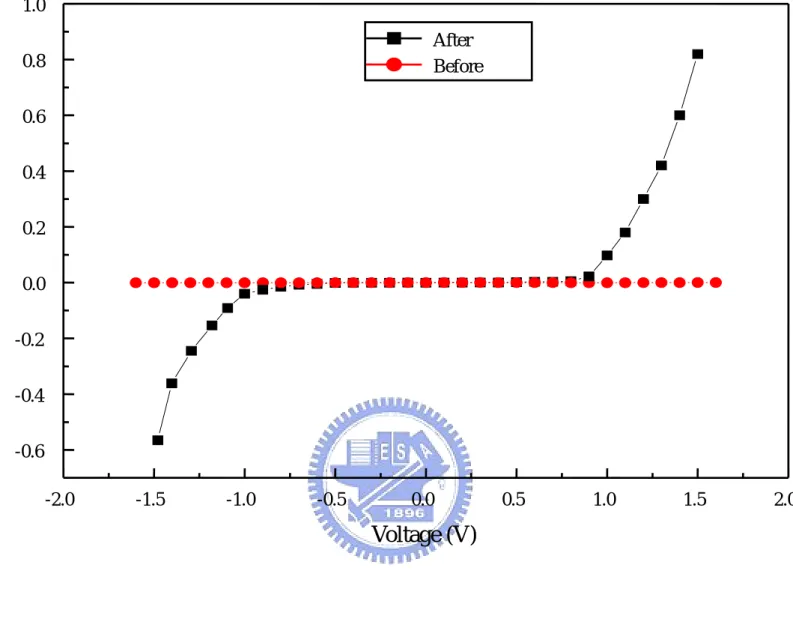
4.1 元件二極體特性曲線與雙載子注入證明
由元件結構來看,我們以白金電極來阻隔薄膜自身產生的氫離 子,因此當接上Keithley 236 量測 I-V 電性,看到無論是順向偏壓或 是逆向偏壓皆沒有大電流的產生無法使元件導通,而正常工作。接著 我們將硫酸電解質溶液(0.1M)滴在工作區再量測 I-V 電性,將元件分 別外加順向與逆向電壓,由Fig 4.1 可以看出,當元件順向偏壓達到 0.8V 時,電流會突然急速上升;當元件逆向偏壓達到-0.5V 時電流亦 突然急速上升,因此我們可以分別定義元件的導通電壓0.8V,崩潰 電壓-0.5V。與傳統介面二極體相同的是,傳統 P-N 接面二極體順向 偏壓與逆向偏壓的I-V 到性有顯著的不對稱性,而我們的氧化鎢/氧 化銥二極體感測元件也有不對稱性,差距約0.3V(這個值與當時元件 所處環境的pH 值有關)。 由這兩個實驗結果的圖作比較,可以證明了欲使氧化鎢/氧化銥二 極體感測元件正常操作的確存在著雙載子注入的必要性,表示之後和 葡萄糖感測相關的實驗都必須滿足此前提,元件才能順利地操作。4.2 元件對葡萄糖的 I-V 量測
在進行實驗前我們先將元件的工作區上塗佈固定化的葡萄糖氧化 脢薄膜,來量測葡萄糖被氧化產生的氫離子對元件電性的改變。此外
再利用不同葡萄糖濃度來證實濺鍍不同薄膜厚度將會改變元件二極 體特性的導通電流大小,我們分別改變鍍膜時間以得到膜厚(氧化鎢 160nm、氧化銥 110nm)與(氧化鎢 90nm、氧化銥 110nm)兩組來做比 較,量測用的溶液以醋酸緩衝液當作載體(carrier),混入不同濃度的 葡萄糖溶液,並滴入元件的工作區以此來量測不同葡萄糖濃度的I-V 特性曲線。
4.2.1 氧化鎢濺鍍薄膜 160nm
由於葡萄糖氧化脢薄膜可以催化葡萄糖氧化產生氫離子,元件的 外加偏壓則提供電子,如此便可以滿足雙載子注入的條件而表現出二 極體的整流特性。當元件接上CV-50 選定外加順向偏壓範圍,並滴入 0.2mM 的葡萄糖溶液,可以由圖看到元件在 1.2V 的地方導通且電流 大幅上升,與一般二極體具有相同的特性。接著我們固定量測的電壓 範圍依次增加葡萄糖濃度至20mM,量測結果由 Fig 4.2 可以看到電 性改變的趨勢當葡萄糖濃度增加,元件電流隨著增加,由於在0.2mM ~20mM 皆能表現出整流特性,此即是元件的可工作範圍。 另外我們討論元件在小功率(small power)的操作情形,在圖形 上固定電流4µA,以電壓及濃度作圖,並將濃度軸取對數可以看到如 Fig 4.3,圖形呈現線性關係,表示定電流下 Voltage 可線性反比於 log[Concentration],進一步分析圖形斜率為-0.0654,因此知道我們這 元件的感度(Sensitivity)為-0.0654 V/log[mM]。4.2.2 氧化鎢濺鍍薄膜 90nm
在改變薄膜厚度後,我們以相同的方法量測,我們可以看到完全 相反的電性趨勢,如Fig 4.4,當葡萄糖濃度由 0.2mM 增加到 20mM, 電流卻隨著減少。可以由圖看到元件仍是在1.2V 的地方導通且電流 大幅上升,與一般二極體具有相同的特性。其中可以看到元件電流值 在葡萄糖濃度10mM 以上已經減少很多,表示葡萄糖內的作用已趨近 飽和,無法再大量改變電流值,因此元件的可工作範圍在0.1mM~ 5mM。 我們仍是取定電流8µA,以電壓及濃度作圖 Fig 4.5,依舊可以看 到元件有不錯的線性量測範圍,Voltage 正比於 log[Concentration],斜 率為0.3173,元件的感度為 0.3173 V/log[mM]。 這種完全相反的電性可應証之前所推論的,薄膜比較厚的一方將可主導整個元件的電流變化,若氧化鎢厚度大於氧化銥,葡萄糖濃度 越高被氧化產生越多氫離子,則元件會由導電性佳的HxWO3主導電 性,因此電流值將隨濃度上升而上升。相反的,若氧化銥厚度大於氧 化鎢,氫離子濃度增加元件會由導電性不佳的Ir(OH)3主導電性,因此 電流值將隨濃度上升而下降。 另外可以看到,若是元件氧化銥薄膜厚的情況則濃度解析能力會 較佳,即感度較大較容易以電流值改變來分辨不同的葡萄糖濃度,這 是由於本身氧化銥的導電度比氧化鎢好,若以氧化銥主導整個元件, 則電流的改變量會相對較大,但是可解析的濃度範圍卻比較小,因此 我們之後仍決定以氧化鎢較厚的情況鍍膜,以得到大範圍葡萄糖濃度 量測。 在量測的過程中發現,元件上覆蓋的葡萄糖氧化脢薄膜厚度與感 測的電流值有很大的關係,如果薄膜太厚則產生的氫離子無法進入到 元件工作區則以致無法量得響應電流;薄膜太薄則產生的氫離子太 少,元件所感應的電流變化太小而無法辨識,因此膜厚的控制成為實 驗結果的一個相當重要的角色。
4.3 元件對單一葡萄糖濃度響應結果
要量測元件對葡萄糖與緩衝液切換的響應電流該先決定外加偏 壓的大小,在反覆的幾次實驗發現偏壓較大的時候,反應比較容易趨 於穩定,且量測過程中雜訊影響較小,但是響應電流的變化量卻比較 小。若施以較小偏壓,反應則不易趨於穩定,量測易受雜訊影響,但 是電流變化量較大。這是因為在大偏壓下氫離子受到較大的電場影 響,移動速度快,便能短時間在薄膜內達到平衡,但相對來說平衡時 的氧化鎢/氧化銥薄膜中的氫離子濃度就比較低,所以偏壓大的情況 下反應時間變快而電流的變化幅度會較小,在小偏壓的情況下則相 反。因此對每一個元件都應該先實驗出最適當的偏壓值,以我們這個 元件為例,選定2.0V 當作定偏壓。
在固定偏壓後分別量測7 組不同濃度葡萄糖溶液與緩衝液切換的 電流變化,如Fig 4.6 與 Fig 4.7,由結果可以看到元件在緩衝液環境 下,電流大致維持在2.78µA 的範圍,之後滴入含有葡萄糖的溶液則 電流會迅速上升,且葡萄糖濃度越高電流上升的幅度越大,這和之前 元件二極體的特性結果是相符合的。通過一段葡萄糖溶液後,我們再 注入緩衝液,使得工作區的溶液濃度恢復,可以看到元件的電流又回
到原本的大小,仍在2.78µA 的範圍,在經過反覆的 3 次切換後,元 件仍能清楚表現出隨濃度變化而改變的電流值,表示出感測器的能反 復量測的特性。其電流變化量如下表: 濃度切換 緩衝液下的電 流值 葡萄糖溶液下 的電流值 電流上升變化 量 0mM、0.2mM 2.786µA 2.871µA 3.07﹪ 0mM、0.5mM 2.779µA 2.938µA 5.72﹪ 0mM、1mM 2.783µA 2.967µA 6.60﹪ 0mM、2mM 2.782µA 2.998µA 7.78﹪ 0mM、5mM 2.779µA 3.048µA 9.66﹪ 0mM、10mM 2.772µA 3.091µA 11.50﹪ 0mM、20mM 2.786µA 3.134µA 12.48﹪ Table 4.1 濃度切換之電流變化量
雖然元件在感測葡萄糖時所響應的電流值都不相同,但由於覆蓋 在元件上的葡萄糖氧化脢活性大小都是一致的,所以響應電流對葡萄 糖濃度的對數值應該有相同的依賴性。因此我們再將響應電流與葡萄
糖濃度作圖並對濃度取對數值,即∆I 與 log[glucose]的圖形,如 Fig 4.8
所示。我們可以看到電流響應的確對葡萄糖濃度的對數呈現線性關 係,可見我們製作的葡萄糖感測元件具有對葡萄糖溶液濃度空間梯度 的解析能力,並且可以圖形斜率得到元件感度 0.1252µA/log[mM]。 以定電壓量測濃度切換的電流響應實驗,除了薄膜厚度另外對外 界雜訊的控制也是相當重要,當葡萄糖溶液滴入工作區時,溶液若與 工作區距離太遠則滴入時候會造成液面的擾動,則量測時會產生雜訊 影響結果,因此我們接在蠕動幫浦末端的針筒要盡量靠近工作區,保 持量測過程中葡萄糖溶液能持續不斷與葡萄糖氧化脢薄膜層作用,如 此在量測時才能減低雜訊的產生。
4.4 元件對不同葡萄糖濃度響應結果
在完成葡萄糖溶液與緩衝液之間切換的量測後,我們將量測過程 改變為連續性的葡萄糖溶液切換,依舊先實驗找出最適合這個元件的 偏壓,以便電訊號的量測,因此我們固定外加偏壓1.8V,先以緩衝 液注入,再換成濃度0.2mM 葡萄糖溶液並依次增加至 20mM,最後 濃度再由20mM 遞減回 0.2mM 與緩衝液。實驗結果如 Fig 4.9,電流
大幅改變即是濃度切換的同時,且由於圖中量測時間約為120 分鐘, 與濃度切換後電流達穩定態的時間相比較差了很多,因此若以巨觀角 度來看圖,電流切換是呈現步階(step)型。但若以微觀角度來看圖, 電流切換是呈現指數增加(exponential)型來達到電流的穩定值。另外 可以看到當葡萄糖濃度增加則相對響應的電流也增加;濃度減少則相 對響應的電流也減少,與之前推論的結果相同。其電流變化量如下表: 葡萄糖濃度 電流值 電流增量 增量百分比 20mM 2.227µA 0.326µA 17.14﹪ 10mM 2.192µA 0.291µA 15.32﹪ 5mM 2.169µA 0.268µA 14.11﹪ 2mM 2.093µA 0.192µA 10.09﹪ 1mM 2.033µA 0.132µA 6.94﹪ 0.5mM 1.997µA 0.095µA 5.01﹪ 0.2mM 1.958µA 0.057µA 2.99﹪ 0mM (Buffer) 1.901µA Table 4.2 葡萄糖濃度遞增之電流變化量 葡萄糖濃度 電流值 電流增量 增量百分比 20mM 2.227µA 0.326µA 17.13﹪ 10mM 2.191µA 0.290µA 15.23﹪ 5mM 2.167µA 0.266µA 14.00﹪ 2mM 2.082µA 0.181µA 9.52﹪ 1mM 2.034µA 0.133µA 7.00﹪ 0.5mM 1.997µA 0.096µA 5.03﹪ 0.2mM 1.939µA 0.038µA 1.99﹪ 0mM (Buffer) 1.901µA Table 4.3 葡萄糖濃度遞減之電流變化量
我們再將圖中的電流值 I 與濃度對數值 log[glucose]做圖,並分成 濃度遞增與濃度遞減兩部分如Fig 4.10,圖形的線性如同之前實驗所 推論,表示我們製作的葡萄糖感測元件具有對葡萄糖溶液濃度空間梯 度的解析能力,當濃度增加時的部分可由圖形斜率得到元件的感度 0.1436µA/log[mM],當濃度減少時,元件的感度 0.1491µA/log[mM],
除了可以看到這兩個值相當接近,另外再由這兩條線的近似重合更表 示元件對連續性的濃度變化響應可以有不錯的恢復特性。
第五章 結論
這種以氧化鎢/氧化銥為主要結構的葡萄糖感測器元件在實驗室 長久的努力下已經具備了相當高的可行性,而之所以能夠成功的主要 因素包括: (1)氧化鎢與氧化銥這兩種氧化物皆能有效地附著於晶片與白金電極 上而不會產生剝落,並且薄膜皆能在酸性溶液中穩定工作,維持 良好的感測特性。 (2)固定化成功地將葡萄糖氧化脢薄膜留在聚乙烯醇中,因此在感測 的過程中並不會溶解在溶液裡。 (3)在固化的過程中,葡萄糖氧化脢的活性並不會因為牛血清蛋白交 叉鏈結或紫外燈光照射的影響而喪失。 (4)緩衝液使用適當,由於選用緩衝能力比較弱的醋酸緩衝液,使得 產生的氫離子能輕易改變薄膜內層緩衝液的酸鹼度。
我們所製作的感測器起初為了證明雙載子的注入因而改變了電 極結構,並成功地證明雙載子注入的必要性。接著在葡萄糖濃度感測 實驗中其結果證明,我們的葡萄糖感測元件能以電流值精確的表現出 濃度上的改變,且元件能穩定工作於液態環境,有良好的可逆性及重 複性,元件於室溫下放置一星期後元件電流基線(base line)稍有變 化,但仍不會影響其感測能力。 和過去學長的實驗成果相比較,我們可以量測到低濃度的葡萄糖 溶液(1mM 以下),另外我們縮短量測過程中的反應時間,即是元件能 在更短的時間內達到穩定。但是相對的元件所感測出的電流值卻因為 多一白金電極阻隔,降低至僅有數個微安培大小的電流變化,這是元 件最需要改進的地方。為了改進上述缺點,應該可以朝幾個方向作討 論: (1)將元件結構做成陣列形狀,將薄膜及白金電極串接,利用多個薄 膜同時產生大量的氫離子,以提高氫離子的濃度,如此電流便可
大幅提昇。 (2)降低聚乙烯醇薄膜厚度,由於薄膜是以牙籤塗怖來完成,並無法 確實掌握薄膜的厚度,因此若可以降低薄膜厚度可使葡萄糖更容 易進入酵素層,亦能產生較多的氫離子使電流增加。
由於葡萄糖感測器二極體元件製作過程中,聚乙烯醇薄膜的製 備,濺鍍薄膜幾何形狀、與白金電極接觸面積、兩薄膜間相距距離並 無法精確控制,因此若能改進相關的元件製程精準,感測葡萄糖將具 有更好的效果。另外我們對於固化在薄膜內的葡萄糖氧化脢,其催化 過程的反應速率並不瞭解,由於酵素的活性對於元件的表現有著重要 的影響,若能對此更進一步探討對元件的實用價值極有幫助。 就未來的發展而言,這個結合酸鹼度感測器和酵素薄膜所構成的 元件,最大的優點即是利用酵素反應造成氫離子濃度變化,並能轉換 成電訊號讀取,因此我們只要改變酵素薄膜層便能感測其他溶液,像 是尿素感測器之類,都將是我們未來可以繼續研究的方向。
參考文獻
[1] Tran Minh Canh, “Biosensors” ,(1993), pp.17-19.
[2] T.Akiyama, E. Niki, Y. Okabe, T. Sugano and Y. Ujihara, “Ion sensitive field- effect transistors with inorganic gate oxide for pH sensing”, IEEE Trans. Electron. Devices, 1980.
[3]Wu, T. Z., 1999. Olfactory biochips,Science Monthly,Vol. 30(9) : pp.744-750. [4] 陳仲慕,「液態三氧化鎢/氧化銥二極體葡萄糖感測元件對葡萄糖濃度響應之 研究」, 國立交通大學, 碩士論文, 民國 87 年. [5] 林志強,「液態環境中以三氧化鎢/氧化銥二極體葡元件為基礎的陣列型葡萄 糖感測器之研究, 國立交通大學, 碩士論文, 民國 88 年. [6] 許閔壹 , “於液態環境中穩定工作之三氧化鎢 / 氧化銥二極體感測元件之研 究” , 國立交通大學 , 碩士論文 , 民國 86 年.
[7] S. Chao, “Electrical Characteristics of Glucose-Sensitive Diode Arrays Based on WO3 and IrO2 for Microsensor Applications”, Jpn. J. Appl. Phys. Vol. 42 (2003)
pp. L1337-L1339.
[8] M. O. Schloh, N. Leventis and M. S. Wrighton: J. Appl. Phys. Vol. 66(1989)965. [9] B. Scrosati: Application of Electroactive Polymer, ed. B. Scrosati (Chapman &
Hall, London, 1993) p.256.
[10] Y. Hanazato, M. NaKako, M. Maede and S. Shiono, Analytica Chimica Acta, 193 (1987) 87.
[11] Y. Miyahara, T. Moriizumi and K. Ichimura, Sensors and Actuators.,7 (1985) 1. [12] D. V. Sviridov and A. I. Kulark, Thin Solid Films., 198 (1991) 191.
[13] M. Nagasu and N. Koshida, Appl. Phys. Lett., 57 (1990) 1324. [14] M. Nagasu and N. Koshida, J. Appl. Phys.,71 (1992) 232. [15] 李崇, Opto. News & Lett., 49 (1994) 1.
[16] R. S. Crandall and B. W. Faugnan, Appl. Phys. Lett., 28 (1976) 95.
[17] R. B. Goldner, D. H. Mendelsohn, J. Alexander, W. R. Henderson, D. Fitzpatrick, T. E. Hass and H. H. Asmple, Appl. Phys. Lett. 43.
technol., 131 (1984) 857.
[19] O. Bohnke, M. Rezrazi, B. Vuillemin, C. Bohnke, P. A. Gillet and C. Rousselot, Solar Energy Materials and Solar Cell.
[20] R. Chen, J. Appl. Phys., 40 (1969) 570 [21] R. H. Dean, J. Appl. Phys., 40 (1969) 585 [22] R. H. Dean, J. Appl. Phys., 40 (1969) 596
[23] J. S. E. M. Svensson and C.G. Granqvist, Appl. Phys. Lett., 45 (1984) 828 [24] F. P. Koffyberg, K. Dwight and A. Wold, Solid State Coummun., 30 (1979) 422. [25] H. O. Finklea, Semiconductor Electrodes, (Wiley, New York, 1988) 225.
[26] R. S. Crandall and B. W. Faugnan, Appl. Phys. Lett., 39 (1977) 232.
[27] B. Reichman, A. J. Bard and D. Laser, J. Electrochem. Soc., 127 (1980) 647. [28] S. Gottesfeld, J. D. E. McIntyre, G. Beni and J. L. Shay, Appl. Phys. Lett., 33
(1978) 208.
[29] Mcintyre.J.D.E. , Basu S. , Peck W.F. , Brown W.L. , Augustyniak W.M. , “Cation insertion reactions of electrochromic iridium oxide films" , Solid state ionics , 5 , 1981 , p.359.
[30] Mcintyre.J.D.E. , Basu S. , Peck W.F. , Brown W.L. , Augustyniak W.M. , Phs.Rev.B , 25 ,1982 , p.7242.
[31] Shay J.L. , Beni G. , Schiavone L.M. , “Electrochromism of anodic iridium oxide films on transparent substrates" , Appl.Phys.Lett. , 33 , 1978 , p.942. [32] Y. Hanazato, M. NaKako, M. Maede and S. Shiono, IEEE Transactions on
Electron Devices, DE-33 (1986) 47.
[33] 陳慶昌,「三氧化鎢/氧化銥二極體元件無電解質的研究」, 國立交通大學, 碩 士論文, 民國 93 年.
[34] 莊達人,「VLSI 製造技術」, DEC 1994.
0.6 mm 0.4 mm 0.3 mm 0.6 mm 0.4 mm 0.4 mm 0.4 mm 0.6 mm 0.4 mm
(a)
0.5 mm(b)
N-type silicon Step1 Si3N4 (4000Å) SiO2 (2000Å) Step2 (+)PR Step3 Pt (1200Å)
Cr (50Å) Step4
Figure 3.2 Schematic side view of the summarized process for
the Pt lift-off process
Step1 以CVD 沈積SiO
2、Si
3N
4薄膜
Step2 微影成像
Step3 雙電子槍蒸鍍 Cr、Pt 電極
Step4 以 lift-off 剝離光阻層
Quartz cylinder shield Magnetron Sputter source
In line regulator RotaMeters Glass cylinder (ψ=21cm) Substrate Holder Cooling water in out Matching Box RF generator Vacuum Gauge Mechanical Pump Ar Gas ring Viton L-gasket O2 ThermoCouple Gauge Heater power Supply
Pt/Cr flag
IrO2 thin film WO3thin film Silicon substrate
(a)
(b)
(c)
Figure 3.4 Schematic side view and top view of the summarized
process flow for the fabrication of a sensor.
Ag epoxy
Epoxy
GOD
(d)
(e)
Figure 3.4 Schematic side view and top view of the summarized
process flow for the fabrication of a sensor.
PVA/GOD/BAM/H2O Step1 UV(365nm、100w) Insoluble PVA/GOD Step2 glutaraldehyde glycine PVA‧GOD
Figure 3.5 Preparation of enzyme layer on glucose-sensitive
diode by PVA insolubilization and GOD
Sense lo Output lo Sense hi Output hi
Keithley 236
Sense lo Output lo Sense hi Output hi
Keithley 236
Figure 3.6 The setup for measure I-V curve with 0.1M H
2SO
4(a) (b) Auxiliary electrode Reference electrode Working electrode CV-50 Different concentration of glucose in buffer solution
Different concentration of glucose in buffer solution
Different concentration of Auxiliary Reference electrode electrode Working electrode CV-50
glucose in buffer solution
Buffer solution
Figure 3.7 The setup for measure the different concentration
Glucose of I-V curve and I-T curve.
1.0 After Before 0.8 0.6 0.4
Current (µA)
0.2 0.0 -0.2 -0.4 -0.6 -2.0 -1.5 -1.0 -0.5 0.0 0.5 1.0 1.5 2.0Voltage (V)
Electrolyte solution : 0.1M H2SO4 Turn-on voltage : 0.8V Break-down voltage : -0.5V7 20mM 10mM 6 5mM 2mM 1mM 5 0.5mM 0.2mM 4
Current (µA)
3 2 1 0 -1 0.5 1.0 1.5 2.0 2.5 3.0Voltage (V)
WO3:160nm IrO2:110nmTurn-on voltage:1.2V Exp. Conditions:
Init E (mV) = 0 Final E (mV) = 2600 V (mV/sec) = 4 Quiet Time (sec) = 5 Sensitivity (A/V) = 1E-6
Figure 4.2 I-V characteristic of WO
3/IrO
2with different
2.76 0.2mM 0.1 1 10 2.60 2.62 2.64 2.66 2.68 2.70 2.72 2.74 2.76 V o ltage ( V ) C oncentration (m M ) 0.5mM 1mM 2mM 5mM 10mM
Constant current at 4µA
Sensitivity : -0.0654
[
]
log
V mM
Figure 4.3 The plot of the voltage vs glucose concentration(mM)
at constant current 4µA.
20mM 2.74 2.72 2.70
V
o
ltage (V)
2.68 2.66 2.64 2.62 2.60 0 5 10 15 20Concentration (mM)
1mM 0.1mM 0.2mM 5mM 0.5mM 2mM 10mM 20mM 10 8 6
Current (µA)
4 2 0 -2 0.0 0.5 1.0 1.5 2.0 2.5Voltage (V)
IrO2:110nm WO3:90nm Exp. Conditions: Init E (mV) = 0 Final E (mV) = 2500 V (mV/sec) = 4 Quiet Time (sec) = 5 Sensitivity (A/V) = 1E-6 Turn-on voltage 1.2VFigure 4.4 I-V characteristic of WO
3/IrO
2with different
0.1mM 0.2mM 0.5mM 1mM 2mM 0.1 1 10 1.6 1.7 1.8 1.9 2.0 2.1 2.2 V o lt ag e (V ) Concentration (mM) 2.2 5mM 2.1 2.0
V
o
ltage (V)
1.9 1.8 1.7 1.6 0 1 2 3 4 5Concentration (mM)
Constant current at 8µA
[
]
log
V mM
Sensitivity : 0.3173
Figure 4.5 The plot of the voltage vs glucose concentration(mM)
at constant current 8µA.
0 3 6 9 12 15 18 2.75 2.80 2.85 2.90 Buffer solution Current (uA ) Current (µA) Buffer solution 0.2mM glucose
Time (min)Time (min)
(a) 0.2mM Glucose / Buffer solution
0 3 6 9 12 15 18 2.75 2.80 2.85 2.90 2.95 Time (min) Buffer solution C u rr e n t (u A ) Current (µA) Buffer solution 0.5mM glucose
Time (min)Time (min)
0 3 6 9 12 15 18 2.75 2.80 2.85 2.90 2.95 3.00 Buffer solution Current (uA ) Current (µA) Buffer solution 1mM glucose
Time (min)Time (min)
(c) 1mM Glucose / Buffer solution
0 3 6 9 12 15 18 2.75 2.80 2.85 2.90 2.95 3.00 3.05 Buffer solution C u rr e n t (u A ) Current (µA) Buffer solution 2mM glucose
Time (min)Time (min)
Buffer solution 0 3 6 9 12 15 18 2.75 2.80 2.85 2.90 2.95 3.00 3.05 Current (uA ) Current (µA) Buffer solution 5mM glucose Time (min) Time (min)
(e) 5mM Glucose / Buffer solution
Buffer solution 0 3 6 9 12 15 18 2.75 2.80 2.85 2.90 2.95 3.00 3.05 3.10 C u rr e n t (u A ) Current (µA) Buffer solution 10mM glucose
Time (min)Time (min)
Buffer solution 0 3 6 9 12 15 18 2.75 2.80 2.85 2.90 2.95 3.00 3.05 3.10 3.15 Current (uA ) Current (µA) Buffer solution 20mM glucose
Time (min)Time (min)
(g) 20mM Glucose / Buffer solution
Figure 4.6 Glucose sensing experiment at a forward bias of
2.0V . The glucose concentration changed from
0.2mM to 20mM.
20mM 10mM 5mM 2mM 1mM 0.5mM 3.15 3.10 3.05
Current (µA
)
3.00 2.95 2.90 Buffer solution 0.2mM 2.85 2.80 2.75 0 3 6 9 12 15 18Time (min)
Exp. Conditions: Init E (mV) = 2000Sample Interval (msec) = 800 Sampling Time (sec) = 1200 Precondition E (mV) = 1800 Precondition Time (sec) = 10 Quiet Time (sec) = 10
Sensitivity (A/V) = 1E-6
Figure 4.7 Glucose sensing experiment at a forward bias of
2.0V . The glucose concentration changed from
0.2mM to 20mM.
20mM 10mM 5mM 2mM 1mM 0.5mM 0.2mM ΔΙ uA ) Glucose concentration (mM) 0.05 0.35 0.30 0.25 0.20 0.15 0.10 10 1 0.1 0.35 0.30
△
I
(µA)
0.25 0.20 0.15 0.10 0.05 0 5 10 15 20Glucose concentration (mM)
[
]
log A mM µ Sensitivity: 0.1252 For the peak 1Figure 4.8 The plot of the current change (ΔⅠ) vs glucose
concentration (mM).
10mM 10mM 20mM 5mM 2mM 1mM 0.5mM 0.2mM Buffer 5mM 2mM 1mM 0.5mM 0.2mM Buffer 2.20 2.15
Current (µA)
2.10 2.05 2.00 1.95 1.90 0 25 50 75 100 125Time (min)
Exp. Conditions: Init E (mV) = 1800Sample Interval (msec) = 1000 Sampling Time (sec) = 7300 Precondition E (mV) = 1600 Precondition Time (sec) = 10 Quiet Time (sec) = 10
Sensitivity (A/V) = 1E-6
Bias at 1.8V
Figure 4.9 Glucose sensing experiment at a forward bias of
1.8V . The glucose concentration changed continuous
from 0.2mM to 20mM by time.
20mM 10mM 0.2mM→20mM 20mM→0.2mM 0.2mM 0.5mM 1mM 2mM 5mM 2.25 2.20 2.15