國立交通大學
應用化學系所碩士班
碩 士 論 文
二倍頻成像及斑馬魚模型應用於「史達汀 (statin)」降
血脂藥物造成骨骼肌傷害之研究
In vivo Assessment of Statin-Induced Myopathy Using
Second-Harmonic Generation Microscopy
研 究 生: Shih-Hao Huang (黃士豪)
指導教授: Dr. Ian Liau (廖奕翰 博士)
二倍頻成像及斑馬魚模型應用於「史達汀 (statin)」降
血脂藥物造成骨骼肌傷害之研究
學生:黃士豪 指導教授:廖奕翰博士 摘要
斑馬魚 (Zebrafish, Danio rerio) 具有可利用光週期誘發產卵(卵的數量高達 數百顆)、體外受精、胚胎發育期短、器官形成的過程易觀察、可操控特定基因 表現等特性,除了被廣泛應用於研究脊椎動物的胚胎發育之外,也常做為藥物篩 選、毒物測試及癌症等疾病研究之模型動物。與老鼠等其他模型動物相較,斑馬 魚胚胎及幼魚體積小且透明,更適合應用光學顯微鏡技術為工具進行研究。過去 兩年的研究主要在建立簡易斑馬魚養殖系統,並應用實驗室自行開發之二倍頻顯 微影像系統對斑馬魚骨骼肌進行高解析、非侵入式、即時活體光學成像之研究。 我們精確量測出斑馬魚胚胎發育初期肌小節長度 隨發育時間之變化,發現斑馬 魚在受精後 24 小時後,頭部及尾部肌小節長度分別為 1.93 ± 0.06 及 0.99 ± 0.17 μm,而在受精後兩天,頭部跟尾部肌小節已經發育完成至約 1.87 ± 0.05 及 1.91 ± 0.07 μm。另外,我們也應用二倍頻成像技術探討「史達汀 (statin)」降血 脂藥物之肌肉毒性。過去文獻上提到降血脂藥物 lovastatin 會對某些人造成橫紋 肌 溶 解 之 嚴 重 副 作 用 。 我 們 應 用 二 倍 頻 成 像 發 現 在 斑 馬 魚 飼 養 環 境 加 入 lovastatin,隨浸泡濃度增加,斑馬魚肌小節長度會從 1.90 ± 0.12 μm 縮短至 1.53 ± 0.09 μm;而相同濃度時,隨浸泡時間增加,肌小節的長度也從 1.90 ± 0.12 μm 縮短到 1.39 ± 0.05 μm。我們的結果顯示肌小節長度縮短之可能原因是肌小節
中的 myosin rod 受到破壞。此外,lovastatin 引起的鈣離子濃度上升及肌肉收 縮,或是肌小節中其他蛋白質受到破壞,也可能為肌小節縮短的原因。我們的成 果顯示二倍頻顯微影像系統無須染色跟樣品前處理,便可對斑馬魚幼魚進行即 時、活體檢測,也展現斑馬魚配合光學成像技術應用於藥物開發先期研究以及環
In vivo Assessment of Statin-Induced Myopathy Using
Second-Harmonic Generation Microscopy
Student:Shih-Hao Huang Advisor:Dr. Ian Liau Department of Applied Chemistry National Chiao-Tung University
Abstract
Statins are among the most widely prescribed medications worldwide with proven records in reducing cardiovascular morbidity and mortality of patients with or without coronary artery diseases. Although statins are well tolerated by the majority of patients, they produce myopathy with varied symptoms ranging from mild myalgia to fatal rhabdomyolysis in some population of patients. The zebrafish is genetically accessible and possesses a rapidly developed muscle system comparing with higher vertebrates such as rodents. The small size and optical transparency from its embryo to larval stage further render it an exceptionally attractive model organism to assess myotoxicity of drugs in vivo using high-resolution optical microscopy. In this thesis, I report the employment of second-harmonic generation (SHG) microscopy to investigate statin-induced myotoxicity on living zebrafish. My study focuses on revealing the fine structure of sarcomeres, the fundamental contractile element of muscles. This approach derives an advantage of SHG imaging to visualize the striated muscle fibers based on myosin-specific SHG signal with no need to employ any stains. The ability to observe sarcomeres in living organisms further eliminates the possible concern of structural distortion caused by sample preparation. I discover that the treatment of statin to zebrafish embryos causes a significant decrease in sarcomere length while the morphological integrity of muscle cells remains largely intact: this change exhibits strong dependence on the concentration of statin and the duration of
sarcomeres, and to the hypercontraction of sarcomere induced by excessive calcium concentration. In contrast to conventional clinical biomarkers of muscle injury such as myoglobin, troponin, and creatine kinase that are released from disrupted muscle cells, the ability to observe subtle while unambiguous structural abnormality at the subcellular level permits early diagnosis of muscle injury before any clinical symptoms. In light of the increasing prevalence in the incidence of skeletal muscle injury caused by new therapies, our work consolidates the combined use of the zebrafish model and SHG imaging as an effective and sensitive mean to evaluate the safety profile of new therapeutic targets in vivo.
誌謝
兩年的研究生活總是過的特別快,充滿著各樣的酸甜苦辣,也遇見許多不同 的人,也在他們身上學習到許多的事情。首先,感謝指導教授廖奕翰博士無論在 研究方向或是為人處事上的指導,每個禮拜的進度報告,讓我學習到對自己負責 任的態度,讓我受益良多,並從中學習到規劃事情的方法,也學習到在面對問題 時,多方面的思考以及處理事情時的態度跟做事的條理,讓我更有信心的去面對 所遇到的問題,另外,感謝廖奕翰老師在論文跟實驗上的提點,讓碩士論文的內 容可以更加的豐富完整。 在碩士班兩年的研究過程中,總是得到許多人的幫助。在斑馬魚的研究過程 中,感謝清華大學生科系的周姽源老師,對我在設置斑馬魚養殖系統時的問題, 都熱心的回答,讓我可以學習到許多養殖的一些技巧。 感謝實驗室中過去以及現在的每一位工作夥伴,感謝小龜學長、Bush 學長 在二倍頻顯微影像系統的耐心教導跟幫助,也感謝逸群學長、小蔥學姊、嘉仁、 意玲、學翰、大衛的照顧,讓我可以很快的融入實驗室的生活,不論是在研究上 或是生活中都給予我很大的幫助與互相扶持的力量。此外,還有可愛的大學生們 大胖、10、老人、Erick、嘟嘟、小傑、土豆謝謝你們為實驗室帶來了歡樂的氣 氛,也很高興你們可以在實驗室學習到東西,有你們的陪伴讓我在碩士生活中, 充滿了溫馨跟熱趣。 最後,感謝我的家人,在這兩年裡,總是給予我關心與支持,讓我可以在研 究上更加專心。真的要謝謝以上的每一個人,讓我在這兩年中面對許多的挑戰, 讓我在這之中有所成長,謝謝你們。目錄
中文摘要 ... i 英文摘要 ... ii 致謝 ... iv 目錄 ... v 圖目錄 ... vii 第一章、簡介 1–1 降血脂藥物「史達汀 (statin)」造成肌肉傷害之副作用 ... 1 1–2 斑馬魚動物模型 ... 4 1–3 二倍頻顯微成像技術 ... 7 1–4 研究動機及目標 ... 11 第二章、實驗 2–1 實驗設計 ... 16 2–2 二倍頻顯微影像系統 ... 17 2–3 斑馬魚的飼養與繁殖方法 ... 19 2–4 樣品製備 (麻醉、固定、藥物添加方法) ... 21 2–5 影像分析方法 ... 22 第三章、結果 3–1 雷射極化方向對二倍頻顯微影像的影響 ... 29 3–2 雷射功率對二倍頻影像的影響 ... 30 3–3 斑馬魚影像 ... 313–4 肌小節細微結構之分析: Single band 與 Double band ... 32
3–5 肌小節長度隨著生長時間之變化 ... 33
3–6 Statin 對肌肉形貌上之影響 ... 35
3–8 浸泡時間長短之影響 ... 38 3–9 肌小節縮短機制的探討 ... 39 第四章、結論與未來展望 ... 56 附錄 附錄一 肌肉簡介 ... 57 附錄二 二倍頻原理簡介 ... 60 附錄三 專有名詞中英對照表 ... 63 附錄四 實驗相關儀器列表 ... 64 附錄五實驗相關藥品及養魚設備列表 ... 65 附錄六 2009 交通大學碩士班論文獎得獎海報 ... 66 第五章、文獻參考 ... 67
圖目錄
圖 1–1 降血脂藥物「史達汀 (statin)」降低膽固醇的機制 ... 12 圖 1–2 斑馬魚的圖片 ... 13 圖 1–3 斑馬魚胚胎發育的代表性階段 ... 14 圖 1–4 肌小節中二倍頻訊號之來源 ... 15 圖 2–1 實驗流程圖 ... 24 圖 2–2 二倍頻顯微影像系統光路圖 ... 25 圖 2–3 斑馬魚的飼養環境 ... 26 圖 2–4 樣品製備方法 ... 27 圖 2–5 肌小節細微結構之分析方法 ... 28 圖 3–1 老鼠尾巴組織切片的二倍頻影像及二倍頻訊號光譜 ... 42 圖 3–2 雷射功率對於肌小節長度分析之影響 ... 43 圖 3–3 斑馬魚幼魚的光學影像及骨骼肌二倍頻影像 ... 44圖 3–4 肌小節微結構分析:Single band 與 double band ... 45
圖 3–5 不同體節位置肌小節隨生長時間之變化 ... 46 圖 3–6 肌小節長度隨生長時間之變化 ... 47 圖 3–7 Statin 造成斑馬魚骨骼肌形貌之改變 ... 48 圖 3–8 不同 statin 濃度對肌小節長度之影響 ... 49 圖 3–9 不同浸泡時間對肌小節長度之影響 ... 50 圖 3–10 Dark length 之統計分析 ... 51 圖 3–11 Bare length 之統計分析 ... 52 圖 3–12 FWHM 之統計分析 ... 53 圖 3–13 浸泡時間對 FWHM 之統計分析 ... 54 圖 3–14 肌小節長度變化可能機制之示意圖 ... 55
第一章、簡介
1
–1 降血脂藥物「史達汀 (statin)」造成肌肉傷害之副作用
由於現代人飲食過度,高脂肪食物的攝取量增加,運動量減少,血液中的脂 肪無法消耗而堆積於血液中,導致高血脂病症出現。高血脂正是引起心血管疾病 包括:心臟病、高血壓、中風、心肌梗塞…等的最大因素之一。降血脂藥物例如 「史達汀 (statin)」的使用,早已普遍應用在心血管疾病的預防上。statin 降低膽 固醇之作用機制為透過抑制 HMG-CoA 還原酶的作用降低肝臟中固醇 (包括膽 固醇) 的生成 (圖 1 – 1)。HMG-CoA 還原酶負責將 HMG-CoA 轉換成一種固醇 (包括膽固醇) 的前驅物質- mevalonate。因此 statin 可抑制肝臟中膽固醇之合 成,進而刺激肝細胞表面的低密度脂蛋白受體數目增加,促進低密度脂蛋白的擷 取及分解代謝並抑制低密度脂蛋白在肝臟的合成,最終達到減少血液中低密度脂 蛋白粒子的總數,降低高血脂的症狀。 降血脂藥物為目前全球使用最大量的處方籤藥物,由於高血脂人口持續增 加,且病人需要長期服物藥物,預期未來降血脂藥物之用量會持續的升高。降血 脂藥物的副作用中以肌肉毒性是最值得關注的副作用。降血脂藥物造成的肌肉病 變包含肌肉痠痛、肌肉浮腫,甚至是致命的肌肉橫紋肌溶解症。肌肉疼痛典型呈 現近側對稱性肌肉虛弱和疼痛,可能會有肌肉柔軟和功能上損傷,例如:難以將 手臂高舉過頭、從位置上站起,或爬樓梯等;不對稱的不舒服甚及橫紋肌溶解症 則較小發生。降血脂藥物中以 statin 造成肌肉毒性發生機率最高。肌肉症狀的 出現通常是在使用 statins 治療開始後的數星期到數個月發生,但也可能在治療 的任何期間發生。 有科學家利用染色結合光學或是電子顯微鏡的技術,觀察肌肉組織病變。1995 年 Adams1 利用 Hematoxylin-Eosin 針對肌肉浮腫的病人切片組織進行染色,發現 到 muscle fiber 的大小改變,血管周圍有發炎的現象,有大量的巨噬細胞分布在 2解症的病人切片組織進行染色,發現骨骼肌有大量的空泡的現象跟巨噬細胞的聚
集。也有科學家開始探討 statin 造成肌肉毒性的機制。1990 Manoukian3 提到一
位病人在使用 statin 藥物後引發橫紋肌溶解症,造成病人的肌肉無力,且血液 中的 creatine kinase 跟 myoglobin 的濃度均有上升。作者利用光學跟電子顯微
鏡,發現到在骨骼肌上有空泡的產生跟肌肉細胞被破壞的情況。1995 年 Lopez4 利用細胞內微米電極量測到橫紋肌溶解症發生時,鈣離子濃度有上升的趨勢。作 者使用了 dentrolene 藥物抑制鈣離子從肌質網流出,使鈣離子濃度從 1.27 μM 下降到 0.22 μM 後,也加速病人的回復。因此作者推斷橫紋肌溶解症與鈣離子 濃度的上升有關。2002 年 Hodel5提出肌肉受到破壞的可能機制。作者提到當肌 肉纖維的原生質膜的完整性遭到破壞,可導致過多的鈣離子進入肌肉纖維,造成 過度收縮並破壞蛋白質合成和粒線體新陳代謝,進而導致肌肉細胞的死亡。2006 年 Velho6 量測從老鼠肝臟分離出來粒線體之膜電位。作者發現到在 statin 的藥 物下,粒線體的膜電位有改變的情形,老鼠骨骼肌粒線體也有相同的情形發生。 作者同時發現隨 statin 的濃度上升粒腺體會有膨脹的現象。作者認為 statin 改 變鈣離子的濃度及粒線體膜的通透性,進而可能導致細胞損傷或死亡。同年
Dirks7 提出 statin 會導致粒線體穿透度改變使細胞凋亡。作者認為 statin 抑制
mevalonate 的 生 成 , 讓 isoprenoid 耗 盡 , 使 得 geranylgeranylation 或 farnesylation 蛋白質減少造上鈣離子濃度上升,活化 calpain,導致粒腺體中的 cytochrome c 流出,使細胞啟動凋亡機制。在 2007 年 Marcoff8 提到 statin 會 抑制 farnesyl pyrophosphate,為合成 coenzyme Q10 的中間產物。由於 coenzyme
Q10 參與粒線體電子傳遞及對抗自由基造成之氧化壓力9。因此,作者推測 statin
會影響粒線體的功能。在 2009 年 Littarru10服用 statin 會降低 muscle coenzyme Q10 的濃度,進而降低粒線體的電子傳遞鏈之效率,而導致骨骼肌中粒線體的 數目減少導致肌肉毒性。
討 statin 肌肉毒性的機制有所困難。此外,過去檢測肌肉病變的方法主要是量 測血液中的creatine kinase、myoglobin 跟 troponin 的濃度。這些方法比較沒有 專一性,這可能是造成到現在為止,statin 造成肌肉毒性不明確的原因之一。
1
–2 斑馬魚動物模型
斑馬魚 (Zebrafish, Danio rerio) 產於東印度,為廣溫性魚類,與金魚、鯉魚 一樣屬於鯉科。成熟斑馬魚體長只有 3 至 4 公分,最長約 5 公分,體紋與真 正的斑馬相似,有藍白相間的條紋。斑馬魚的性別區分:母魚體型通常較大、腹 部較鼓脹,體色偏藍 (圖 1 – 2 a),公魚體型較小、腹部較平坦,體色呈現淡黃 色 (圖 1 – 2 b)。在適當的環境下,斑馬魚在攝氏 24 度以上極易產卵,同時產 卵無季節性,可利用人為調控光週期使雌魚產卵。由於斑馬魚卵易於取得且操作 方便,因此常做為胚胎實驗的對象。 斑馬魚為脊椎動物,相較於常見的動物模型:果蠅、線蟲,更貼近於人類, 為近年用來研究脊椎動物胚胎發育的重要動物模型11。應用斑馬魚做為動物模型 的優點包括:可利用光週期誘發產卵 (產卵的數量可以高達數百顆)、體外受精、 胚胎透明、胚胎發育期短 (2 至 3 天)、器官形成過程易於觀察、可利用物理及 化學方法產生變種斑馬魚、也可用分子生物學方法改變特定基因的表現及產生基 因轉殖魚等。 在 1995 年 Kimmel12 提出斑馬魚發育時間及形貌代表性階段 (從受精後 0.2 小時開始到受精後 3 天) 的示意圖 (圖 1 – 3)。文章提及幾個代表性階段發 育的時間分別為:受精後 10 小時第一個體節開始生成,受精後 19 小時眼睛水 晶體長出,24 小時心臟開始跳動、開始有黑色素堆積在視網膜,36 小時已經可 以游動…等。 目前文獻上提到斑馬魚肌小節長度量測的方法分別利用光學影像及染色技 術進行量測。在 2008 年 Dou13 利用光學影像量測到受精卵後 5 至 7 天的肌 小節長度約 2.15 μm。同年 Chen14 利用免疫染色技術對 α-actinin 染色,量測 到受精後 2、3 天的肌小節長度為 1.8 μm 左右。2008 年 Sanger15 利用了免疫 染色技術觀察斑馬魚肌肉組織的發生學,發現到斑馬魚在 24 小時,靠近頭部的 肌小節已經發育成熟,長度約 1.5 μm,但尾巴肌小節還在生長當中,長度約
1.0 μm。 近幾年來科學家開始利用斑馬魚進行環境毒害的研究,在環境中添加化學物 質浸泡處理斑馬魚胚胎,觀察器官發育及存活率的變化。1991 年 Dave16 在斑 馬魚環境中添加入銅、鉛、鎳金屬,發現到斑馬魚孵化時間受到環境金屬的影響 而 拉 長 及 存 活 率 下 降 的 情 形 。1997 年 Henry17 在 斑 馬 魚 環 境 上 添 加 2,3,7,8-Tetrachlorodibenzo-p-dioxin (TCDD) 從顯微鏡上觀察到斑馬魚的形貌受 到 TCDD 影響有破壞情形。也有科學家利用斑馬魚進行化學毒害的研究。2006 年 Parng18 在斑馬魚環境中加入酒精,利用免疫染色技術觀察到眼睛的神經及運 動神經均會受到酒精影響有破壞情形。2008 年 McGrath19 在斑馬魚環境中加入 pentylenetetrazole (PTZ),一種會引起抽搐的溶液,觀察到隨著藥物的添加斑馬 魚的移動能力增加。作者也在環境中加入酒精,觀察到運動神經受到酒精影響有 破壞情形。2008 年 Chen20 在斑馬魚環境中添加咖啡因,觀察到受到咖啡因的 影響形貌上受到破壞。 此外,也有科學家將斑馬魚應用在探討奈米粒子毒性。2007 年 Griffitt21 將 銅奈米粒子添加到斑馬魚的環境當中,觀察到當銅奈米粒子加入時,造成存活率 的下降及魚腮受到影響,作者從組織切片中發現到 somite 會受到奈米粒子的影 響有扭曲萎縮現像。2008 年 Zhu22 在斑馬魚環境當中分別添加入 3 種不同的
奈米粒子:zinc oxide, titanium dioxide, alumina,作者觀察到奈米粒子加入時,斑
馬魚的存活率會受到奈米粒子的影響而下降。作者從存活率提出zinc oxide 的毒
性最高可能性。
也有科學家將斑馬魚用於 statin 副作用的探討。2007 Hanai23 將 statin 應 用在斑馬魚身上,利用染色技術對 anti-myosin heavy chain antibody (F
-
59) 進行 染色,觀察到斑馬魚肌肉形貌受到 statin 的影響有所改變。作者對肌肉形貌改 變的描述有 blocked、gap formation、bowing、irregular、diffuse appearance、irregular somite boundaries 等。2009 Cao24 利用染色技術觀察到肌肉形貌受到 statin 的影影響有變短的情形。
從上面的文獻回顧可知,斑馬魚可用來從事藥物研究或環境毒害研究,例 如:藥物毒性、藥理及毒物基因學等研究,進一步做為人類疾病研究的動物模式。
1 – 3 二倍頻顯微成像技術
文獻上斑馬魚的觀察主要是利用染色及電子顯微鏡技術進行觀察,不僅不能 在活體上進行實驗,也有可能在製作樣品時造成人為誤差。在此我們利用自行架 設的二倍頻顯微技術對斑馬魚進行活體成像。 二倍頻顯微技術為非線性光學的應用之一。其它非線性光學顯微技術包括 25,例如:同調反史托克拉曼散射26、二倍頻27或三倍頻28、雙光子激發螢光28…等。2008 年 Xie29 開發出 Stimulated Raman Scattering (SRS) 顯微技術並搭配高 頻鎖像放大器提高靈敏度,與同調反史托克拉曼散射相比其背景訊號較低,可以 提供較佳的訊雜比。
此外,也有科學家以提高光學解析度做為研究的方向,例如:STED 30(Stimulated
emission depletion microscopy)、HR-SIM31 (High resolution structured illumination microscopy)…等技術。 多光子顯微技術具有許多優點32-36:使用近紅外光當作激發光源,相較於其 他較高光子能量的短波長光源,減少激發光源對組織的破壞。其較長波長的激發 光源也會減少非均勻組織中的散射,提高對樣品的穿透度。由於多光子顯微技術 為多光子誘發非線性光學現象,只有在聚焦焦點處才有足夠激發強度去產生非線 性光學,因此可做為光學斷層掃描得到空間解析度的三維影像。樣品製備相較於 免疫染色的繁複步驟簡單且快速,也減低了在製作樣品十人為因素的影響。由於 多光子顯微技術的訊號都來自於分子本身的訊號,因此不需對樣品外加螢光染 劑,就可以得到具有化學專一性的顯微影像。許多生物系統的成分在可見光波長 激發下會產生自體螢光,但是多光子激發顯微技術收取的訊號波長是較激發光源 波長短的區域,因此可以利用濾光片將自體螢光分開。多光子顯微影像技術結合 上述的優點,可以量測樣品內部的資訊,再搭配適當的平台後,便可將在體外進 行的細胞實驗或是利用染色技術,均可以移植到活體的動物進行實驗跟觀察,可 以更貼近真實活體情況並了解到生物體真實的反應。
有許多的文獻報導利用二倍頻技術進行生醫及材料上的成像。二倍頻由 1961 年 Franken37 在密西根大學所發現。1977 年 Sheppard38 展現二倍頻與光 學顯微鏡結合的技術。1998 年 Sheppard39 利用 Ti:sapphire 雷射光源產生二倍
頻訊號對 LBO 晶體進行三維呈像。2009 年 Recher40 提到生物組織中能產生二
倍頻為 collagen41-43、tubulin32, 44、,myosin45-47、starch48, 49、cellulose50, 51。1986 年
Freund52 首先將二倍頻技術應用在生物樣品上,利用二倍頻探討雷射極化方向與
膠原蛋白方向的關係。1988 年 Huang53、1993 年 Bouevitch54 將二倍頻技術應 用在細胞膜模型上。1996 年 Ben
-
Oren55、1999 年 Peleg56、1999 年 Lewis57 等人將二倍頻技術應用在觀察活細胞細胞膜的生理行為。1997 年 Guo58、1999 年 Kim59 利用 移動平台進行二倍頻影像掃瞄,不過完成一張影像需要花費好幾個 小時。2002 年 Campagnola60 發展雷射掃描穿透式顯微鏡,提高影像解析度 1 μm 左右,且只要幾秒鐘即可完成一張影像。 1997 年 Geo58 首次利用二倍頻影像系統對骨骼肌進行低解析度的觀察。之 後有科學家開始探討肌小節中哪個蛋白質會產生二倍頻的訊號。2003 年 Both61 提到 actomyosin 為二倍頻訊號的來源。2003 年 Mohler62 作者提到線蟲的肌肉
有兩種 myosin 相似構型分別為 myosin heavy chain A 與 myosin heavy chain B。作者探討這兩種構型會不會產生二倍頻訊號,作者對 myosin heavy chain A 轉 植綠色螢光蛋白,利用雙光子激發螢光跟二倍頻的訊號比較,發現到在二倍頻影 像最強的地方與雙光子激發螢光訊號並不能互相重疊。作者推測 myosin heavy chain B 為二倍頻訊號來源。2004 年 Boulesteix63 利用二倍頻技術量測心肌細胞 肌小節長度,作者在溶液中添加 STX,讓心肌細胞產生收縮,量測到 bare length 並不會隨著肌肉收縮而有所改變。當肌肉進行收縮時,肌小節中 myosin filament 不會隨肌肉收縮而長度有所變化,因此,作者推測產生二倍頻的來源為 myosin filament 或是 myosin head 的部分。2006 年 Plotnikov64 探討肌小節中產生二倍 頻訊號來源,作者將 actin filament 從肌小節中移除,發現到二倍頻的影像並沒
其他細胞中,二倍頻的影像沒有受到 actin filament 有所影響。因此,可以得知 二倍頻訊號的來源並不是 actin filament。接著,作者利用貝類與線蟲的 myosin head 的數量不同,量測雷射極化方向跟樣品角度的影響,發現到 myosin head 的 數量多寡並不會去影響二倍頻訊號,作者推測二倍頻訊號並不是來自於 myosin head。最後,作者對肌肉進行線掃描,發現到二倍頻訊號寬度並不會隨著肌肉收 縮而有所變化。作者推測肌小節產生二倍頻訊號來源為 myosin rod。2007 年
Schurmann65 作者對 actin 進行染色再將肌肉組織浸泡在高鹽類的溶液中,使
myosin filament 受到溶液的影響而析出66。作者發現到受到 myosin filament 析 出影響,二倍頻訊號強度大大降低,actin 部分並沒有受到影響。作者再利用 a
-
chymotrysin 將 myosin rod 從 myosin filament 分離出來 67,發現到 myosin rod 可以產生二倍頻的訊號。因此,作者推測二倍頻訊號來自於肌小節中 myosin rod 部分。由上面的文獻回顧可知,肌肉中產生二倍頻訊號來源為 myosin rod (圖 1 – 4)。目前檢測肌肉病變及心臟疾病缺乏高解析度,高專一性及非破壞性的技 術。開始有科學家利用二倍頻影像探討肌肉疾病及肌肉破壞二倍頻影像之變化。 2008 年 Ralston68 利用二倍頻跟雙光子激發螢光對龐貝氏症老鼠進行觀察,龐 貝氏症是溶小體缺少 α-葡萄糖,造成肝醣無法分解而堆積,進而影響細胞功能。 作者發現到龐貝氏症老鼠肌肉的二倍頻影像排列方式較不整齊,兩條肌原纖維中 間也有空洞的產生。2008 年 Plotnikov69 作者讓老鼠缺乏 mdx 蛋白質,缺少 mdx 會讓老鼠產生營養失調引起肌肉萎縮疾病。作者利用二倍頻顯微技術對老鼠 進行觀察,發現到老鼠肌肉二倍頻影像排列方式較不整齊,兩條肌原纖維中也有 空洞的產生。作者對肌小節長度進行分析,發現到肌肉萎縮疾病的肌小節平均長 度變短。作者提出二倍頻未來可應用在活組織切片或是內視鏡的診斷工具上。 2008 年 Llewellyn45 利用二倍頻影像搭配微米內視鏡,對人類直接進行二倍頻 影像掃描。未來可應用在診斷肌肉疾病肌肉的收縮動態變化,進而檢測肌肉疾病。
倍頻影像系統不僅可以提供活體上的實驗,訊號來源有專一性,可以更貼近真實 活體情況並了解到生物體真實的反應。
1
–4 研究動機及目標
降血脂藥物中,肌肉毒性是最值得關注的副作用。利用高等哺乳動物進行研 究例如:人類、老鼠,其發育時間太長,且尺寸太大不容易在顯微鏡下做觀察。 斑馬魚動物模型,特色是個體數高及胚胎透明,且生長快速,這幾個優點讓我們 可以更仔細的觀察 statin 在斑馬魚早期發育所造成的影響。 在文獻上研究肌肉毒性的方法是採用組織切片70技術進行研究,並不能對活 體動物進行即時觀察。此外,過去檢測肌肉疾病的方法主要是量測血液中的 myoglobin、troponin、creatine kinase 的濃度,這些方法都是費時且手續繁複的 工作,且不能即時觀察到肌肉毒害對於斑馬魚的影響。利用實驗室自行開發的二 倍頻影像系統進行肌肉毒性研究,可在活體上直接進行觀察並提供即時的訊息。 本研究目標是利用二倍頻影像系統針對斑馬魚的肌肉組織跟藥物毒害進行 研究。我們成功應用二倍頻成像精確量測出斑馬魚胚胎發育初期肌小節長度隨生 長時間之變化,發現斑馬魚在受精後 24 小時後,頭部及尾部肌小節長度分別為 1.93 ± 0.06 及 0.99 ± 0.17 μm,在受精後 2 天,頭部跟尾部肌小節已經發育完 成至約 1.87 ± 0.05 及 1.91 ± 0.07 μm。另外,我們也應用二倍頻成像技術探討 「史達汀 (statin)」降血脂藥物之肌肉毒性。我們應用二倍頻成像發現在斑馬魚 飼養環境加入 lovastatin,隨浸泡濃度增加,斑馬魚肌小節長度會從 1.90 ± 0.12 μm 縮短至 1.53 ± 0.09 μm;而相同濃度時,隨浸泡時間增加,肌小節的長 度也從 1.90 ± 0.12 μm 縮短到 1.39 ± 0.05 μm。我們的成果顯示二倍頻顯微影像 系統無須染色跟樣品前處理,便可對斑馬魚幼魚進行即時、活體檢測,也展現斑 馬魚配合光學成像技術應用於藥物開發先期研究評估之潛力。Acetate
Acetyl-CoA
Acetoacetyl-CoA
HMG-CoA
Mevalonate
Mevalonate 5 - p
Mevalonate 5 - pp
Isopentyl - pp
Geranyl - pp
Farnesyl - pp
Squalene
Lanosterol
Desmosterol
Cholesterol
Geranylgeranyl - pp
Co – enzyme Q
10Acetate
Acetyl-CoA
Acetoacetyl-CoA
HMG-CoA
Mevalonate
Mevalonate 5 - p
Mevalonate 5 - pp
Isopentyl - pp
Geranyl - pp
Farnesyl - pp
Squalene
Lanosterol
Desmosterol
Cholesterol
Farnesyl - pp
Squalene
Lanosterol
Desmosterol
Cholesterol
Geranylgeranyl - pp
Co – enzyme Q
10 圖 1– 1 降血脂藥物「史達汀 (statin)」降低膽固醇的機制HMG-CoA 還原酶可將 HMG-CoA 轉換成 mevalonate (一種固醇的前驅物)。 Statin 則是透過抑制 HMG-CoA 還原酶的作用降低固醇 (包括膽固醇) 的生成。
(a)
(a)
(b)
(b)
(b)
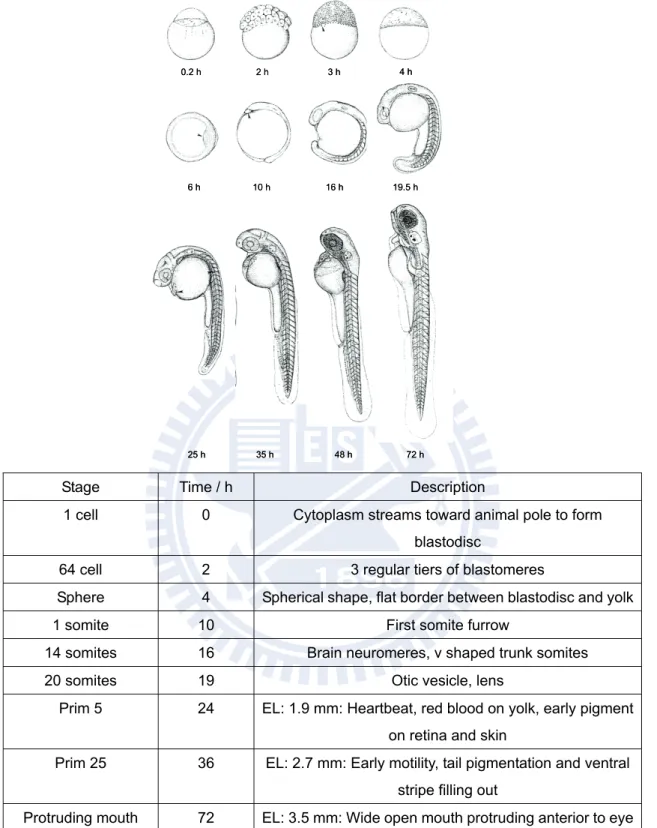
圖 1 – 2 斑馬魚的圖片 (a) 母魚體型通常較大約 5 公分,腹部較鼓脹,體色偏藍。(b) 公魚體型較小約 3 公分,腹部較平坦,體色呈現淡黃色。0.2 h 2 h 3 h 4 h 10 h 16 h 19.5 h 6 h 35 h 48 h 72 h 25 h 0.2 h 2 h 3 h 4 h 10 h 16 h 19.5 h 6 h 35 h 48 h 72 h 25 h
Stage Time / h Description
1 cell 0 Cytoplasm streams toward animal pole to form
blastodisc
64 cell 2 3 regular tiers of blastomeres
Sphere 4 Spherical shape, flat border between blastodisc and yolk
1 somite 10 First somite furrow
14 somites 16 Brain neuromeres, v shaped trunk somites
20 somites 19 Otic vesicle, lens
Prim 5 24 EL: 1.9 mm: Heartbeat, red blood on yolk, early pigment
on retina and skin
Prim 25 36 EL: 2.7 mm: Early motility, tail pigmentation and ventral
stripe filling out
Protruding mouth 72 EL: 3.5 mm: Wide open mouth protruding anterior to eye
圖 1 – 3 斑馬魚胚胎發育的代表性階段12
EL: embryo length: Prim stage: refer no. of the myotome to which the leading end of posterior lateral line.
圖 1 – 4 肌小節中二倍頻訊號之來源
上圖為肌小節的示意圖,下圖為二倍頻影像,二倍頻訊號產生的來源在肌小節中 的 myosin filament 中的 myosin rod 的部分。
第二章、實驗
2
–1 實驗設計
實驗的架構 (圖 2 – 1),主要將斑馬魚分成控制組跟對照組,控制組以正常 環境飼養,對照組為斑馬魚受精後 3 天在環境中添加 statin 來誘發肌肉毒性之 副作用。並浸泡 12 小時跟 120 小時,濃度分別為 0.05、0.5、50 μM,就預定 的時間將斑馬魚進行麻醉,利用二倍頻成像技術研究 statin 對肌肉形貌之影 響,並更進一步探討 statin 對於肌小節長度之影響。 此外,肌小節長度隨著生長時間之變化實驗,在斑馬魚受精後 24、30、36、 48、72 小時將斑馬魚進行麻醉,利用二倍頻成像技術對骨骼肌進行掃描並對二 倍頻影像進行肌小節長度之分析。2
–2 二倍頻顯微影像系統
首先,簡介二倍頻顯微影像系統的架設光路 (圖 2 – 2)。本實驗所使用的雷 射光源為 Nd:Vanadate 雷射 (picoTRAIN IC-1064-10000 ps Nd:VAN, HighQ Laser, Austria)。Nd:Vanadate 雷射出口在經過 85/15 分光鏡 (beamsplitter) 後, 此時的雷射強度為 1.20 W。然後,雷射光束通過一個光學阻斷器 (optical chopper, SR540, Stanford Reaserch Systems, U.S.A.) 的外圈,使其帶有頻率為 2.6 K 赫茲 的 載 頻 。 接 著 , 雷 射 光 束 通 過 一 個 二 分 之 ㄧ 位 相 差 板 (half-wave plate, ACWO-02-05-R10, Lattice Electro Optics, U.S.A.) 跟空間濾波器包含了兩片透鏡 焦距分別為100 mm 跟 30 mm (AC254-100-B 跟 AC254-30-B, Thorlabs, U.S.A.) 中間擺放高能量的針孔光圈 (25 μm, 900PH-25, Newport, U.S.A.) 用來放大雷射 光束以及得到更好的光束品質 (beam profile),使其得以填滿所使用的物鏡的 back aperture,得到最大的物鏡 N.A. 值。之後,雷射光束通過偏極板 (polarizer, PCGA-05, Lattice Electro Optics, U.S.A.) , 再 通 過 一 個 四 分 之 ㄧ 相 差 板 (quarter-wave plate, WPQ05M-1064, Thorlabs, U.S.A.) 且與偏極板相差四十五度 角,將雷射極化方向改變成圓形極化方向。如要確定雷射極化方向為圓形偏極 光,在四分之一相差板後面架設直線偏極板並旋轉其角度,雷射功率不會隨著角 度的變化有所改變,即為圓形極化方向。最後,雷射光束經由一片短波長穿透的 分光鏡 (780 DCSX, AHF, U.S.A.) 將其導入顯微鏡 (ECLIPSE Ti, Nikon, Japan) 中,並透過高N.A.值的物鏡 (CFI Plan Apo VC60WI, N.A. = 1.20, W.D. = 0.27 mm, Nikon, Japan) 將其聚焦至樣品上。所產生的二倍頻訊號為往前方向,經由 N.A. = 0.52 的聚光鏡 (air condenser)收集後,聚焦至光電倍增管 (photomultiplier tube, PMT, H7422-40, Hamamatsu, Japan),並將光電倍增管輸出訊號傳至鎖像放大器處 理 (lock-in amplifier, SR850, Stanford Reaserch Systems, U.S.A.),鎖相放大器對所 偵測到的訊號以不同頻率做解頻 (demodulation) 處理,以提高訊號的訊雜比 (single to noise ratio),再輸出至電腦中的訊號擷取卡 (data acquisition board,
PCI-6221, National Instruments, U.S.A.) 。 樣 品 的 掃 描 是 利 用 三 軸 移 動 平 台 (scanning stage),電腦將每個位置讀取之二倍頻訊號強度組合成影像。
接下來,解釋光路中幾個重要的元件。首先,為了能得到好的空間解析度以 及二倍頻的非線性效應的效率,必須選用具有高數值孔徑 (numerical aperture, N.A.) 的水鏡或油鏡,由於水鏡工作距離 (working distance) 較油鏡長約 100 μm,穿透樣品的深度較深,有助於取得樣品較內部的訊號,所以實驗上選用水 鏡。此外,為了提高訊號的訊雜比,在光路系統中放置一個光學遮斷器,分別在 雷射出口上外加不同的載頻 (modulation frequency),並配合鎖相放大器來解頻及 處理訊號。且為了避免所使用的雷射對生物組織造成破壞,所使用的雷射波長也 選擇在生物組織較無吸收的近紅外光波段。 在論文中,斑馬魚的實驗參數設定如下:雷射的極化方向調整為圓形偏極 光,雷射強度調整為 25 至 45 mW,此時光學遮斷器的頻率為 2.6 K 赫茲。進 行高解析二倍頻影像掃描時參數分別為:掃描範圍為 50 μm x 50 μm,step size:
0.2 μm,pixel time: 10 ms,sampling rate: 100 K 赫茲,光電倍增管放大倍率 105
2
–3 斑馬魚的飼養與繁殖方法
(一) 斑馬魚的飼養 實驗所使用的 AB strain 斑馬魚是從邰港科技公司購買。建立一個飼養斑馬 魚的環境用品包括:一個大魚缸 (兩呎) 跟兩個小魚缸、可以控溫的加熱器材 (溫 度大約攝氏 28 度左右)、外掛過濾器、跟電燈 (需搭配定時器開關)、和放在過 濾器裡的生化濾材 (圖 2– 3 a)。 在新設缸時,需要先將魚缸刷洗乾淨,且將器材都設置好,讓自來水循環 2 至 3 天以排除水中的氯氣,即可放入班馬魚飼養。小型魚缸適用沉水馬達加上 海棉組成的水中過濾器,促進水族箱的水適當交流淨化水質。水溫宜保持在攝氏 28 度 (25 至 31 度之間 )。如果使用去離子水或蒸餾水,則需要再額外添加鹽 類及礦物質到飼養環境中。 養殖的過程中因水質中殘留的食物、生物新陳代謝、個體死亡…等因素,會 造成水質的惡化,不好的水質會危害魚的健康,導致魚容易生病,使得生產能力 降低。故需要定期更換部份缸水,除了可常保水質潔淨清新外,對於斑馬魚成長 與健康更有促進的功能。每週至少以虹吸管清理水缸底部兩次,且至少更換 1/2 至 1/3 的水。大規模的清理工作,重點集中於濾材的更換、底部的清洗與缸面 的清潔工作。 成魚每天至少早、晚餵食人工飼料,早上餵食紅蟲,下午餵食豐年蝦,進可 能少量多餐,餵食的飼料能在 5 分鐘內吃完為標準,餵食的量要足夠,確保每 一隻魚都有吃到。產卵的前一天,種魚可餵食三餐,以供給足夠營養,所產的卵 品質會較好。 (二) 斑馬魚繁殖方法 人工繁殖斑馬魚時,要選擇體型較大、活動力強、母魚腹部飽滿、達到成熟 年齡的魚。通常斑馬魚在適當的環境下,可以天天產卵,但是為了有較佳卵的品 質,繁殖時機為距上次產卵一週後較佳。最重要的是製造一個適當的環境 (主要是光照及水溫並提供營養充足的食物),利用人為調控光週期 (日夜循環自動時 間裝置 14 小時白天,10 小時黑夜),使斑馬魚在孵化隔離盒內可以自然追尾交 配產卵。 產卵前必須先將小魚缸洗淨並注水打氣 2 至 3 天,在產卵的前一天傍晚, 利用產卵網將公魚與母魚分開隔離,並用黑盒子遮蓋住魚缸,避免魚受到驚嚇。 光週期黑夜 23:30 至 9:30,隔天早晨在黑暗的環境中將黑盒子打開並將公魚 母魚一起放到小魚缸中,使其適應環境。開燈的同時魚兒會急速互相追逐,身體 碰觸時同時排出精卵。產卵的活動可以一直延續到中午,但產卵多在產卵開始 30 分鐘內最多。 斑馬魚有鯉魚科特性,大都喜歡吃自己的卵與小魚,須使用產卵網,且水面 不可高於網面太多 (圖 2 – 3 b),好讓產下的卵能夠迅速的沉下穿過網底跟親魚 分開,這樣魚卵才不會被吃掉。產卵後一定要把親魚移回大魚缸,將受精卵收集 後,用清水洗淨後,放在長頸瓶裡等待孵化,每一天都要去挑起死亡的魚卵,從 立體顯微鏡上可以觀察到胚胎形成小小的白點是死亡的魚卵或是沒有受精的 卵,否則會細菌增長而影響到其他健康的魚卵。健康的魚卵 2 至 3 天即可孵 化,孵化後 3 天內因有卵黃囊提供營養,故不需餵食。魚苗孵化 3 至 4 天後, 消化系統已經發育完成,幼魚會開始游動吃食,普遍使用草履蟲當初期餌料 (水 族館買無節蟲也可以),兩週後改成餵食小豐年蝦,2、3 個月後就可改以人工飼 料餵食。
2
–4 樣品製備 (麻醉、固定、藥品添加方法)
(一) Statin 添加步驟如下 (圖 2– 4 a): 1. 配製含有 0.05 至 50 μM 的 statin (lovastatin) 曝氣水。 2. 受精後 20 至 24 小時,將原本環境中乾淨曝氣水換成含有 statin 曝氣 水,並持續浸泡到觀察時間。 (三) 斑馬魚樣品製備步驟如下 (圖 2– 4 b): 1. 將幼魚從長頸瓶裡取出放到培養皿上。 2. 加入適當的麻醉劑數滴麻醉其幼魚。 3. 將玻片用甲醇擦拭後,使用真空凡士林在玻片上圍成ㄧ個正方形。 4. 從溶液中取出幼魚,並放置在正方形裡。 5. 蓋上蓋玻片,並輕輕壓,使幼魚不會游動即可。實驗中使用麻醉藥劑為 Tricaine (3
-
amino benzoic acid ethyl ester),將 150 mg tricaine 粉末溶在 1000 ml 去離子水中,儲存在冰箱內備用。當麻醉時,則 添加數滴到取出的溶液中。安樂死依上述麻醉方法,以 tricaine 過量或過度麻 醉,以達到安樂死的目的。另外,要降低斑馬幼魚的黑色素形成,受精 1 天後 的幼魚浸泡在含有 0.003 (w/w) 1-
phenyl-
2thiourea 的曝氣水中去抑制黑色素生 成。2
–5 影像分析方法
利用二倍頻影像,量測肌小節的長度步驟如下: 1. 選用一張條紋亮暗分明的二倍頻影像 (圖 2– 5 a)。 2. 將影像載入 Image-Pro. 6.0 軟體。 3. 選用軟體裡面的 line profile 功能,此時會出現一條直線。 4. 將直線跟肌小節明暗條紋的方向調整成垂直方向。5. 在 line profile 裡的 file,選擇 Export data。
6. 並設定 X 軸的間距,取決於掃圖時的每一步圖素大小。 7. 利用 Origin Pro 8 做出強度對距離圖。
從強度對距離做圖中,無論二倍頻影像為 single band 還是 double band,都 可以利用波谷到波谷之間的距離算出一個肌小節長度。此外,在肌小節長度分析
當中,都是取平均當作肌小節之長度 (圖 2– 5 b)。
此外我們也利用其他的分析方法分析肌小節的細微結構: (一) Dark length 分析
選擇一張二倍頻影像中有 double band 的訊號,利用先前的方法做出強度對 距離圖,dark length 指的是相鄰兩個肌小節之間的距離,分析其 dare length 並 取平均 (圖 2– 5 c)。
(二) Bare length 分析
選擇一張二倍頻的影像中有 double band 的訊號,利用先前的方法做出強度 對距離圖,bare length 指的是一個肌小節中,峰對峰之間的距離,分析其 bare length 並取平均 (圖 2– 5 d)。
(三) FWHM 分析
選擇一張二倍頻的影像中有 single band 的訊號,利用先前的方法做出強度 對距離圖,找出一個峰的兩邊最低點並作圖,利用 Origin Pro 8 裡面的 analysis Æ fitting Æ nonlinear curve fit Æ 在 Function 的地方選用 Gauss Æ fit till cover Æ
對照組
麻醉
實驗組
浸泡含有
statin 溶
液
12、120 小時
二倍頻影像
肌小節長度分析
對照組
麻醉
實驗組
浸泡含有
statin 溶
液
12、120 小時
二倍頻影像
肌小節長度分析
圖 2– 1 實驗流程圖DM
TS
Lock-in
amplifier
CL
SHG
Nd:Vanadate Laser
= 1064 nm
Spatial
filter
Optical
chopper
OBJ
PMT
PL
Filter
HW
-SF
PMT
Filter
Reference in
Pre-amplifier
DM
TS
Lock-in
amplifier
CL
SHG
Nd:Vanadate Laser
= 1064 nm
Spatial
filter
Optical
chopper
OBJ
PMT
PL
Filter
HW
-SF
PMT
Filter
Reference in
Pre-amplifier
圖 2– 2 二倍頻顯微影像系統光路圖Hw: half
-
wave plate: PL: polarizer: DM: dichroic mirrors: OBJ: microscopic objective: TS: a transition stage: HM: hot mirror: OC: optical chopper: CL: condenser lens: SF: spatial filter(a) (b) 圖 2 – 3 斑馬魚的飼養環境 (a) 照片中為飼養斑馬魚所需要的器材跟環境包含:一個大魚缸 (兩呎)、可以控 溫的加熱器材 (溫度大約 28 度左右)、外掛過濾器、跟電燈 (需搭配定時器開 關)、和放在過濾器裡的生化濾材。(b) 公魚母魚產卵後會吃掉自己的魚卵,所以 須在小魚缸中用產卵網,並且水面不可高於網面太高。注意小魚缸中的溫度,水 溫宜保持在攝氏 28 度 (25 至 31 度之間)。
(a) 持續浸泡到觀察時間 添加statin 持續浸泡到觀察時間 添加statin (b) 真空凡士林 蓋上蓋玻片 放入斑馬魚 真空凡士林 真空凡士林 蓋上蓋玻片 蓋上蓋玻片 放入斑馬魚 圖 2– 4 樣品製備方法 (a) 受精後 20 至 24 小時,將乾淨的曝氣水換成含有 0.05 至 50 μM 的 statin 曝氣水,並持續浸泡到觀察時間。(b) 製作斑馬魚樣品時,須注意不要將魚的身 體形狀擠壓成扭曲變型,以免造成分析肌小節長度時的誤差。
(a) (b) 0 2 4 6 8 60 80 100 120 140 160 Inte nsit y / a .u. Distance / μm Sarcomere 0 2 4 6 8 60 80 100 120 140 160 Inte nsit y / a .u. Distance / μm Sarcomere 0 2 4 6 8 60 80 100 120 140 160 180 Inte ns ity / a.u. Distance / μm Sarcomere 0 2 4 6 8 60 80 100 120 140 160 180 Inte ns ity / a.u. Distance / μm Sarcomere (c) (d) (e) 0 2 4 6 8 60 80 100 120 140 160 180 Int ens ity / a .u. Distance / μm Dark length 0 2 4 6 8 60 80 100 120 140 160 180 Int ens ity / a .u. Distance / μm Dark length 0 2 4 6 8 60 80 100 120 140 160 180 In te nsit y / a .u. Distance / μm Bare length 0 2 4 6 8 60 80 100 120 140 160 180 In te nsit y / a .u. Distance / μm Bare length 1.5 2.0 2.5 3.0 3.5 4.0 50 100 150 200 250 In te n sit y / a.u . Distance / μm 圖 2– 5 肌小節細微結構之分析方法
(a) 受精後 3 天的二倍頻影像 (scan size: 50 x 50 μm;step size: 0.2 μm)。(b) 從 影像取一條垂直的線不論是 single band 還是 double band 都可以做出距離跟強 度的圖,可以利用波谷到波谷的距離算出肌小節的長度。(c) 從距離跟強度做圖
中,兩個相鄰的肌小節的距離稱為dark length。(d) 從距離跟強度做圖中,一個
肌小節中峰對峰的距離稱為 bare length。(e) 選擇一張二倍頻的影像有 single
band 的訊號畫一條垂直的線,利用先前的方法找出一個峰的兩邊最低點畫圖, 算出半高寬的數值。
第三章、結果
3
–1 雷射極化方向對二倍頻顯微影像影響
在生物組織中有幾個特定結構的蛋白質可以產生二倍頻訊號,例如: collagen、myosin filament、microtubules …,這些分子的排列方向跟雷射極化方 向的角度會影響二倍頻的訊號大小跟有無。由於老鼠尾巴富含豐富的膠原蛋白, 可以產生二倍頻訊號,因此,我們利用老鼠尾巴所做成的組織切片當作雷射極化 方向的樣品。 我們將雷射光的極化方向調整成直線偏極光及圓形偏極光進行二倍頻影像 掃描 (scan size: 150 X 150 μm;step size: 0.5 μm;laser power: 40 mW)。從影像 上可以看到直線偏極光呈現較暗的部分圓形偏極光有訊號產生,可以說明到選用圓形偏極光比直線偏極光可以對樣品獲取更完整的資訊 (圖 3 – 1 a)。往後斑馬
魚二倍頻的實驗都是選用圓形偏極光來激發樣品,以免在分析肌小節長度時產生 人為上的誤差。
我們也進行二倍頻訊號的放射光譜量測 (laser power: 25 mW;average: 5; exposure time: 1 second),在往前的方向量測放射光譜,可以看到在波長 532 nm
3
–2 雷射功率對二倍頻影像的影響
為了分析斑馬魚肌肉組織的肌小節長度,每一次進行二倍頻影像掃瞄必須選 用相同的條件,如使用的雷射、掃圖時的範圍大小、掃圖時每個 pixel 停留的時 間...等,排除實驗參數不同而造成的人為誤差。 首先,關於雷射功率的選擇,基本上以不破壞斑馬魚樣品及所產生的訊號的 訊雜比良好為準。雖然,高雷射功率會提供較好的訊雜比,但是我們必須探討雷 射功率是否會造成斑馬魚樣品有所破壞。 首先,將斑馬魚麻醉並置於光學顯微鏡上,雷射功率調整為 45 mW,進行 連續 3 張同一地方的二倍頻影像掃瞄 (scan size: 100 μm x 100 μm;step size: 0.5 μm)。從影像上發現到斑馬魚二倍頻影像上並沒有因為雷射功率的連續掃描而造 成任何肌肉形貌明顯的改變,且進行同一地方同一位置的肌小節長度分析,肌小 節長度也沒有受到雷射功率影響而長度改變 (圖 3– 2)。此外,從亮視野的觀察 下,使用 45 mW 的雷射功率停留在肌肉組織中同一位置 5 秒,肌肉組織的形 貌上並沒有造成任何明顯改變。由以上的實驗可知雷射功率調整為 45 mW 並不 會對斑馬魚肌肉組織造成影響,之後實驗上使用的雷射功率最高為 45 mW。3
–3 斑馬魚影像
將斑馬魚樣品放在顯微鏡上,選擇物鏡 (CFI Plan Apo 20X, N.A. = 0.75, W.D. = 1.00 mm, Nikon, Japan),利用接圖技術將斑馬幼魚完整呈現。圖上所示,最左 邊為眼睛,往右邊為內耳石,在左下邊為卵黃的部分,而中間貫穿斑馬魚全身為 脊索,心臟的位置介於卵黃跟眼睛的地方。從圖上可以發現,受精卵後三天的斑 馬魚,體色還是呈現透明狀態,並沒有多餘的黑色素產生而影響到實驗的進行 (圖 3– 3)。 接著,對受精後 8 天的活體斑馬魚背部骨骼肌進行二倍頻影像掃瞄 (scan size: 150 μm x 150 μm;step size: 0.3 μm;anterior to the left;dorsal up),得到二 倍頻影像 (圖 3– 3)。
3
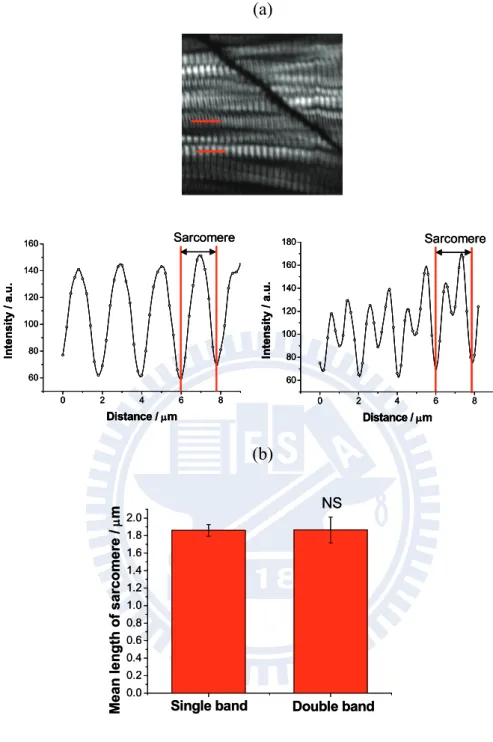
–4 肌小節細微結構分析: Single band 跟 Double band
由上述的實驗,我們確定雷射功率並不會對斑馬魚造成形貌上的破壞。我
們對受精後 72 小時頭部體節 (5
-
8 體節) 進行高解析度二倍頻影像掃瞄 (scansize: 50 x 50 μm;step size: 0.2 μm),影像中發現到有兩種不同的影像分為:雙峰 (double band) 與單一峰 (single band) 的影像 (圖 3 – 4 a)。首先,必須確定 single band 與 double band 並不會造成分析肌小節長度時的人為誤差。利用先前 分析肌小節長度的方法,分別對這兩個 band 進行肌小節長度分析,量測到 single band 肌小節長度約 1.86 ± 0.12 μm,但在分析 double band 的長度,發現 到 double band 的強度對於距離做圖中,二倍頻中間的訊號會減小,量測到 double band 肌小節長度約 1.86 ± 0.15 μm。在統計分析上 single band 跟 double band 長度並沒有顯著差異 (p = 0.93, n = 12),說明到無論從 single band 或是
double band 決定肌小節長度,其長度分析上並不會產生人為誤差 (圖 3– 4b)。
二倍頻中間的訊號會降低這個現象在 2006 年 Plotnikov64 曾在二倍頻影像
強度對距離分析中發現此情形,作者提出可能原因為肌小節中 M
-
line 為中心對稱分子,並不會產生二倍頻訊號,造成中間的訊號變小。2008 年 Prent71 作者
將 Drosophila melanogaster larva 一端固定在玻片上,拉扯另一端造成肌小節長 度拉長,發現到當肌小節被拉長時,強度對距離作圖會從 double band 變成 single band。作者認為二倍頻中間的訊號會減小,來自於肌肉收縮時,中間的區
域產生破壞性的干涉,造成中間訊號強度降低。2009 年 Recher40 提出可能原因
可能為肌小節中間的蛋白質在老化或新生的狀況下產生水解的情形,造成中間的 訊號變低。作者發現到二倍頻影像有 single band 與 double band 的差異並進行 肌小節長度分析,觀察到這兩個 band 的肌小節長度並沒有差異。這與我們量測 的結果相符。
到目前為止,二倍頻為什麼會出現 single band 跟 double band 的影像並不 清楚,但是,我們可以確定的是此現象並不會造成分析肌小節長度的人為誤差。
3
–5 肌小節長度隨著生長時間之變化
由上述的實驗可知,我們可以利用二倍頻影像量測肌小節長度,也從高解析 的二倍頻影像量測到 single band 跟 double band 長度上沒有顯著的差異。我們 將二倍頻技術更進一步的應用在觀察活體斑馬魚的肌小節長度隨著生長時間之 變化。
我們分別對受精後 24 小時、36 小時、72 小時斑馬魚頭部體節 (5
-
8 體節) 跟尾巴體節 (21-
24 體節) 進行二倍頻影像的掃描 (scan size: 50 x 50 μm;step size: 0.2 μm),發現到受精後 24 小時,頭部體節的部分已經有亮暗條紋的影像 出現,然而尾巴的二倍頻訊號非常的微弱,且沒有明顯亮暗條紋影像出現 (圖 3– 5)。 根據先前分析肌小節長度的方法,分別對 3 隻斑馬魚在不同時期所掃瞄到 的二倍頻影像進行統計分析。發現到受精後 24 小時,頭部體節肌小節長度約 1.93 ± 0.06 μm (n = 21),尾巴體節肌小節長度約 0.99 ± 0.17 μm (n = 21)。由分析 結果說明到斑馬魚肌肉的生長方向是從尾巴開始生成,其尾巴的肌小節長度較 短。我們更進一步的量測尾巴體節的肌小節長度隨著時間的變化,受精後 30 小 時尾巴的肌小節長度約 1.66 ± 0.08 μm (n = 21),受精後 36 小時尾巴體節肌小 節長度約 1.93 ± 0.09 μm (n = 21)。頭部體節從受精後 24 小時開始,肌小節長 度並沒有太大的改變,說明到頭部體節肌小節長度在受精後 24 小時內生長完 成。我們也分析受精後 12 天肌小節長度,頭部體節肌小節長度約 1.86 ± 0.12 μm (n = 21) 及尾部體節肌小節長度約 1.93 ± 0.12 μm (n = 21) 和受精後 36 小 時相比肌小節的長度差異不大,說明到斑馬魚在受精後 36 小時頭部體節跟尾部 體節的肌小節已生長成熟。這是第一次利用二倍頻影像在活體斑馬魚量測到肌小 節長度隨著生長時間之改變 (圖 3– 6)。 在 2008 年 Sanger15 利用了免疫染色方法觀察斑馬魚肌肉的發生學,發現 到受精後 24 小時,靠近頭部的肌肉發育較快,其肌小節的長度為 1.5 μm,尾巴肌肉還在生長當中,其肌小節的長度為 1.0 μm。文獻結果與實驗結果相同, 但是文獻提及頭部體節的肌小節長度與結果相比有較短的情形,推測的原因為利 用染色的方法需將樣品固定,使得形貌受到改變,產生人為上的誤差。2008 年 Dou13 利用光學影像的方法去量測出受精後 5 至 7 天的肌小節長度約 2.15 μm,肌小節長度與結果相比有較長的情形,推測原因可能為利用光學影像方法 量測肌小節長度,其對比太小進而造成量測上的誤差。 根據以上的分析結果,利用二倍頻影像量測到肌小節長度跟文獻上所提到的 長度差異不大。此外,二倍頻影像是非侵入性的研究技術,且利用二倍頻影像可 以省去文獻上繁複的技術並提供斑馬魚活體的肌肉生長過程即時觀察的工具。
3
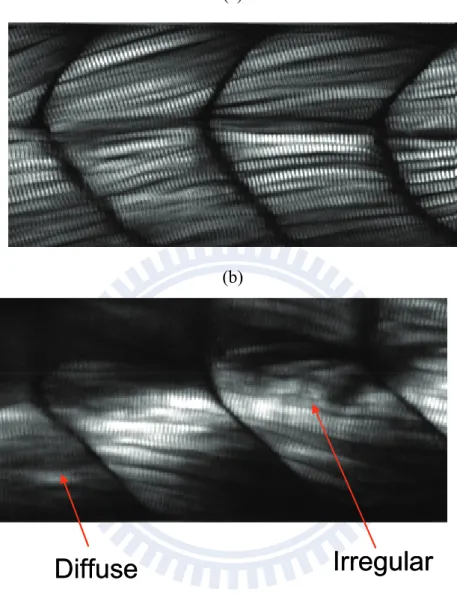
–6 statin 對肌肉形貌之影響
根據上述的實驗結果,我們可以成功利用二倍頻影像量測肌小節長度隨著生 長時間的變化。我們將二倍頻技術更進一步應用在 statin 引起肌肉毒性副作用 進行探討。 目前 statin 有很多種類如:lovastatin、atorvastatin、fluvastatin、pravastatin、 rosuvaststin、simvastatin、cerivaststin…,在實驗中我們選用 lovastatin 添加在斑 馬魚環境中。 我們將含有 statin 的溶液置換到斑馬魚環境中,探討受到 statin 藥物影響 肌肉形貌上的改變。我們對受精 84 小時與受精後 3 天浸泡 statin 12 小時斑馬 魚進行二倍頻影像掃瞄 (scan size: 200 x 100 μm;step size: 0.5 μm)。發現到正常斑馬魚二倍頻形貌,斑馬魚肌肉排列方式相當整齊 (圖 3 – 7 a),在環境中 statin
的影響下二倍頻影像肌肉形貌與正常相比有改變的情形,班馬魚肌肉形貌排列方 式扭曲、空洞產生,說明到 statin 會引起肌肉毒性副作用造成肌肉形貌上的改 變 (圖 3– 7 b)。
目前,利用斑馬魚動物模型探討 statin 引起肌肉毒性只有 2 篇文獻。2007 年 Hanai23 將 statin 種類中的 lovastatin 添加在斑馬魚環境中,利用染色的技 術對 anti
-
myosin heavy chain antibody (F-
59) 進行染色,發現到斑馬魚在 statin 環境中肌肉形貌上有所改變,作者所提及的肌肉形貌改變的現象有 blocked、gap formation、bowing、irregular、diffuse appearance、irregular somite boundaries。作者也統計出隨濃度上升,使斑馬魚形貌改變的個數上升。2009 年 Cao24 利用染 色的技術發現到斑馬魚在 statin 環境中肌肉形貌上有所改變,作者進一步量測 到斑馬魚肌纖維的直徑會隨著 statin 濃度上升而有變短的情形發生。 上述的實驗說明到利用二倍頻影像技術應用在活體斑馬魚上進行 statin 造 成肌肉毒性副作用探討是可行的。由於目前的文獻都只提及到肌肉形貌受到 statin 的影響有所改變,並沒有更進一步探討肌肉細微結構的改變,因此我們利
用上述提及的肌小節分析方法,進一步量測肌小節的長度會不會受到 statin 的 影響而有所改變。
3
–7 Statin 濃度之影響
根據上述的實驗,我們可以在活體斑馬魚觀察到 statin 引起的肌肉毒性副 作用。加上我們先前實驗說明到可以利用二倍頻影像量測活體斑馬魚肌小節的長 度。我們將此技術應用在斑馬魚受到 statin 影響肌小節長度之探討。 首先,將受精後 3 天的斑馬魚環境置換成含有不同濃度的 statin 藥物的曝 氣水,濃度分別為 0.05 μM、0.5 μM、50 μM,浸泡時間為 12 小時,然後使用 tricane 麻醉進行實驗。分別對 3 隻斑馬魚在頭部體節 (5-
8 體節) 進行二倍頻影像掃描 (scan size: 50 x 50 μm;step size: 0.2 μm)。利用取得的二倍頻影像進行
肌小節長度分析 (圖 3 – 8 a),發現到隨 statin 濃度上升平均肌小節長度越短, 從 (圖 3 – 8 b) 統計分析可以觀察到 0.05 μM 的 statin 濃度中,肌小節的長度 從原本的 1.90 ± 0.116 μm 縮短到 1.78 ± 0.06 μm,和正常肌小節長度相比顯著 變短的情形 (p = 2.70 X 10– 4, n = 21)。濃度增加為 0.5 μM 與 50 μM 肌小節的 長度分別縮短為 1.72 ± 0.05 μm, 1.53 ± 0.09 μm,和正常長度比較均有顯著變短 的情形 (p = 7.08 X 10– 7, p = 1.15 X 10– 13, n = 21)。表示 statin 會造成肌肉細微結 構的破壞導致肌小節長度變短的情形。 由上述的實驗,我們首次發現到肌小節的長度受到 statin 的影響變短的情 形,我們更進一步的量測隨 statin 濃度上升肌小節長度有顯著變短的趨勢。
3
–8 浸泡時間長短之影響
從上述的實驗中,我們首次發現在受到 statin 藥物影響下斑馬魚肌小節長 度有隨著濃度增加而變短的趨勢。我們更進一步將浸泡時間拉長,量測肌小節長 度受到浸泡時間拉長之影響。 首先,將受精後 3 天的斑馬魚將環境置換成含有不同濃度的 statin 藥物的 曝氣水,濃度分別為 0.05 μM、0.5 μM、50 μM,浸泡時間從 12 小時拉長到 120 小時。分別對 3 隻斑馬魚在頭部體節 (5-
8 體節) 進行二倍頻影像掃描 (scansize: 50 x 50 μm;step size: 0.2 μm)。從 (圖 3– 9) 統計分析中,我們發現到隨著 浸泡時間的拉長,浸泡 50 μM 濃度,肌小節的長度從 1.53 ± 0.09 μm 變短到 1.39 ± 0.05 μm,和浸泡 12 小時的肌小節長度相比有顯著變短的情形 (p = 3.15 X 10– 7, n = 21)。浸泡 0.5 μM 濃度,肌小節的長度從 1.72 ± 0.05 μm 變短到 1.61 ± 0.05 μm,和浸泡 12 小時的肌小節長度相比有顯著變短的情形 (p = 4.5 X
10
– 9, n = 21)。即使浸泡濃度只有 0.05 μM 的濃度,肌小節的長度從 1.78 ± 0.061 μm 變短到 1.74 ± 0.06 μm 浸泡時間的拉長肌小節的長度有也有顯著變短的情 形 (p = 0.044, n = 21)。可能是因為低濃度的關係,肌小節長度的改變量並沒有 很大。 由上述的實驗,我們更進一步的量測隨浸泡時間的拉長而肌小節長度有顯著 變短的趨勢。我們首次發現到在細胞壞死跟橫紋肌溶解症之前,斑馬魚肌小節長 度在受到 statin 的影響下有顯著變短的趨勢。3
–9 肌小節縮短機制之探討
從以上的實驗中,我們發現到加入 statin 藥物會造成斑馬魚肌小節的長度 變短,我們想更進一步了解 statin 與肌小節長度縮短之探討。
在 2004 年 Boulesteix63 針對二倍頻影像提出 dark length 與 bare length
說法。並利用 STX (saxitoxin) 溶液,造成心肌細胞收縮。觀察到心肌細胞產生
收縮時 dark length 變短,bare length 不變的情形。因此,我們利用文獻上提及 的分析方法提出 statin 造成肌小節變短的可能機制。
利用二倍頻影像 dark length 進行分析,比較正常與浸泡 statin 50 μM 藥物 120 小時。從 (圖 3– 10) 統計分析中,發現到正常斑馬魚 dark length 約 1.07 ± 0.15 μm,浸泡 statin 藥物下,dark length 約 0.81 ± 0.10 μm,跟正常肌小節長 度相比有顯著變短的情形 (p = 0.0063, n = 6)。
接著,對 bare length 進行分析,比較正常與浸泡 statin 50 μM 藥物 120 小 時。從 (圖 3– 11) 統計分析中,發現到正常斑馬魚 bare length 約 0.81 ± 0.05 μm,浸泡 statin 藥物 120 小時下,bare length 約 0.60 ± 0.07 μm,跟正常肌小 節長度相比有顯著變短的情形 (p = 2.2 X 10– 4, n = 6)。 另外,我們也利用高司函數對 single band 做擬合得到半高寬,比較正常與 浸泡 statin 50 μM 藥物 120 小時。從 (圖 3 – 12) 統計分析中,發現到正常斑 馬魚的半高寬約 1.04 ± 0.12 μm,浸泡 50 μM 120 小時下的半高寬約 0.75 ± 0.07 μm,跟正常的肌小節長度相比有顯著變短的情形 (p = 2.52 X
10
– 8, n = 15)。 我們更進一步分析浸泡 50 μM statin 不同時間之半高寬。從 (圖 3– 13) 統 計分析中,發現到浸泡 12 小時半高寬約 0.84 ± 0.11 μm,浸泡 120 小時半高 寬約 0.75 ± 0.07 μm,跟正常肌小節的長度相比均有顯著變短的情形 (p = 3.48 X 10– 5, p = 2.52 X 10– 8, n = 15)。從上述的分析發現在受到 statin 的影響下,bare length、dark length、半高 寬皆有變短的情形。
我們從 dark length 變短進行探討,在文獻上提到,statin 會引起鈣離子濃 度上升。推測原因為鈣離子濃度上升,造成肌肉產生收縮使 dark length 變短。 2006 年 Powers72 在圖式上描述鈣離子濃度上升會造成 titin 跟 z disk 受到破 壞進而造成肌小節分解。我們推測原因為 statin 引起鈣離子濃度上升進而肌小 節中其他的蛋白質例如:actin、titin、z disk,使其 dark length 變短。就目前為 止,我們不能明確的指出 dark length 受到 statin 的影響變短的原因。
接著,我們對 bare length 變短進行探討,先前的章節說明到肌小節中會產 生二倍頻訊號為 myosin rod 的部分。當肌肉進行收縮時,只有 actin 長度會改 變,myosin 並不會改變長度。因此,進行 bare length 分析時,長度並不會隨著 收縮有所改變。然而我們分析到受到 statin 的影響 bare length 長度變短的情 形。我們推測原因為 statin 會去破壞 myosin rod,使其 bare length 長度變短, 進而造成肌小節長度變短。我們也從二倍頻訊號半高寬變短驗證到 myosin rod
有受到破壞情形。此外,我們更進一步分析半高寬隨著天數的增加,myosin rod 受
到 statin 藥物破壞更嚴重,使半高寬更劇烈變短。
另外,2006 年 Craig73 利用電子顯微鏡算出 myosin head 的間距大約 43.5 nm,一條 myosin filament 總共有 11 個 myosin head。2009 年 Recher40 在文 中提到肌小節中間的 M 帶約 120 至 200 nm,我們估計 myosin rod 的長度約 1.1 μm,與二倍頻訊號半高寬相近。
從上述的幾個分析方法可以歸納出 statin 造成肌小節縮短的可能機制:從 bare length、半高寬可以確定的是 myosin rod 的部分是有受到 statin 的影響而 破壞的情形,因為 myosin rod 長度並不會受到收縮而有所變化。另外造成肌小 節縮短的另一原因為:浸泡在 statin 藥物環境中,引起鈣離子濃度增加,造成 肌肉收縮而肌小節長度變短,或是鈣離子濃度上升造成肌小節其他蛋白質 titin、actin、z disk 遭到破壞而變短。從 dark length 分析中,並不能明確的指出 是哪個原因。
明顯的破壞,透過高解析度之肌小節影響,我們也嘗試提出 statin 破壞肌小節 結構蛋白之假說,Myosin rod 破壞造成肌小節影像變化可能機制之示意圖 (圖 3– 14)。
(a)
Circular polarization
Linear polarization
Circular polarization
Linear polarization
(b) 520 530 540 550 1000 2000 3000 4000 5000 6000 In te n si ty / a .u . Wavelength / nm 圖 3– 1 老鼠尾巴組織切片的二倍頻影像及二倍頻訊號光譜
(a) 圓形偏極光跟直線偏極光所得到之老鼠尾巴切片的二倍頻影像 (Scan size: 150 x 150 μm;step size: 0.5 μm;laser power: 40 mW)。由結果可以看出影像上看 到直線偏極光較暗的部分圓形偏極光有訊號的產生,由此可以發現到圓形偏極光 可以對樣品獲取更完整的資訊,不會在分析肌小節長度時造成誤差。(b) 老鼠尾 巴組織切片的放射光譜 (laser power: 25 mW;average: 5;exposure time: 1 second)。
0 2 4 6 8 10 60 70 80 90 100 110 120 130 140 150 Inte n s ity / a .u. Distance / μm 0 2 4 6 8 10 60 70 80 90 100 110 120 130 140 150 Inte n s ity / a .u. Distance / μm : 2.00 μm : 1.88 μm : 2.00 μm L L L 0 2 4 6 8 10 60 70 80 90 100 110 120 130 140 Int ens ity / a. u. Distance / μm 0 2 4 6 8 10 60 70 80 90 100 110 120 130 140 150 Inte n s ity / a .u. Distance / μm 0 2 4 6 8 10 60 70 80 90 100 110 120 130 140 150 Inte n s ity / a .u. Distance / μm : 2.00 μm : 1.88 μm : 2.00 μm L L L 0 2 4 6 8 10 60 70 80 90 100 110 120 130 140 Int ens ity / a. u. Distance / μm 圖 3– 2 雷射功率對肌小節長度分析之影響 受精後 5 天的斑馬魚高雷射功 45 mw 下,相同部位相同地方下進行連續 3 張 影像掃瞄並分析其 3 張影像的肌小節長度 (L: Mean sarcomere length;scan size: 100 μm x 100 μm;step size: 0.5 μm),可以發現到從二倍頻影像的形貌上並沒有 造成任何明顯的變化,從同一地方的肌小節長度也沒有受到雷射功率的影響而長 度有變化的趨勢。
卵黃
心臟
眼睛
內耳石
脊柱
卵黃
心臟
眼睛
內耳石
脊柱
圖 3– 3 斑馬魚幼魚的光學影像及骨骼肌之二倍頻影像 下圖利用接圖將斑馬幼魚完整呈現,受精後三天的斑馬魚,體色還是呈現透明狀 態。斑馬幼魚在顯微鏡下的形貌。上圖為骨骼肌二倍頻影像 (scan size: 150 μm x 150 μm;step size: 0.3 μm;anterior to the left;dorsal up)。(a) 0 2 4 6 8 60 80 100 120 140 160 Int e nsit y / a.u. Distance / μm Sarcomere 0 2 4 6 8 60 80 100 120 140 160 180 Inten s ity / a. u. Distance / μm Sarcomere 0 2 4 6 8 60 80 100 120 140 160 Int e nsit y / a.u. Distance / μm Sarcomere 0 2 4 6 8 60 80 100 120 140 160 Int e nsit y / a.u. Distance / μm Sarcomere 0 2 4 6 8 60 80 100 120 140 160 180 Inten s ity / a. u. Distance / μm Sarcomere 0 2 4 6 8 60 80 100 120 140 160 180 Inten s ity / a. u. Distance / μm Sarcomere (b) 0.0 0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6 1.8 2.0 Double band Mean le n gth o f sarcomere / μ m Single band NS 0.0 0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6 1.8 2.0 Double band Mean le n gth o f sarcomere / μ m Single band NS
圖 3– 4 肌小節微結構分析:Single band 與 double band
(a) 受精後 72 小時在斑馬魚靠近頭部體節 (5
-
8 體節) 掃瞄的二倍頻影像(scan size: 50 x 50 μm;step size: 0.2 μm)。(b) Single band 跟 double band 肌小節 長度的統計 (n = 12),統計上顯示無論從 single band 跟 double band 決定肌小 節長度其並沒有顯著的差異。NS: non-significantly different from control (p >