SDS 對於 CNT/TiO
2複合光觸媒製備效能之影響
以雙酚 A 降解為例
袁菁1、莊博超2、張惟翔2、秦逸玲3 1高雄大學土木與環境工程學系 教授 2高雄大學土木與環境工程學系 碩士生 3高雄大學土木與環境工程學系 大專生 摘要 本研究利用添加界面活性劑(SDS)改良傳統 CNT/TiO2複合光觸媒的光催化效能,探討溶 膠-凝膠法(sol-gel)與水熱法(Hydrothermal)不同製備技術對於 CNT/TiO2 複合光觸媒表面結 晶、型態與光催化活性的影響(處理雙酚 A(bisphenol A;BPA)廢水之降解效率)。研究發現添 加界面活性劑(SDS)可導致 CNT 和 TiO2於製備過程中分散較均勻,可提升兩者的接觸面積使得 CNT/TiO2複合光觸媒有較佳的結合效果,經由 Sol-gel 法和 Hydrothermal 法製備複合光觸
媒之表面特徵分析呈現銳鈦礦晶型及具有孔洞特性,其粒徑約分別為 12、7.4 nm,比表面積 為 133、86 m2
/g。SEM 分析可發現 TiO2產生微粒團聚現象且均勻的分布於 CNT-COOH 的表
面,XPS 圖譜顯示,含有 Ti、O 及 C 等元素。利用 HNO3與 NaOH 調節 pH 值於 2-11 進行液
相光催化降解 BPA,其光催化結果顯示 Sol-gel 法 CNT/TiO2複合光觸媒於 pH 於酸性環境其
反應速率 K 大約在 7.6~9.5×10-3 1/min;偏鹼性的環境相較下 K=10.5~11.9×10-3 1/min 具有較 佳的降解效率由 60 %升至 76 %,增益劑方面以 PO43- 存在光催化系統中時能有效的提升電子-電洞對的分離以及促進電洞和水分子之間的電荷傳導使得氫鍵有效增加氫氧自由基形成,所 以選擇 PO43-當作光催化實驗之增益劑並不會破壞觸媒表面,同時可使光觸媒的量子效能提高 產生較多氫氧自由基,因此提高了處理效率,可高達 86.2%。本系統之光降解反應符合 Langmuir-Hinshelwood 動力學方程式。 關鍵詞:雙酚 A(BPA)、奈米碳管、複合光觸媒、二氧化鈦、界面活性劑 一、前言 奈米碳管擁有非常優異的物理性質,但由於奈米碳管間有凡得瓦爾力存在,易聚集一起, 不易分散在水溶液及有機溶劑中,限制了奈米碳管的應用性(Yuen et al., 2007),研究中也發現 要製造出具有優良性質的 CNTs/TiO2 複合光觸媒,有兩個主要問題:碳管與基材間的接合性和 碳管本身分散性不佳的問題,因此利用界面活性劑(SDS) 所具有的親疏水端點,藉由疏水基部 份與碳管管壁做吸附,親水端則進一步提昇碳管與 TiO2 溶膠的均勻性和分散性,使得兩者之 間結合性提高,因此有較良好表面特性以提升對污染物的吸附以降低電荷再結合速率,提升 TiO2 的光活性。 利用界面活性劑(CTAB)進行改質,由 XRD 分析中發現不同的鈦源皆可出現二氧化鈦的特 性波峰(θ=25.3°),當加入 CTAB 導致 CNTs 表面會產生較均勻的二氧化鈦薄膜,但是也因為 CTAB 的存在,會減慢表面的二氧化鈦結晶過程,並且產生無規則性的氧化層,導致銳鈦礦晶 相特徵波峰較不明顯,所以添加界面活性劑雖然可提升 CNTs 與 TiO2 結合均勻性,但也可能 導致電子傳遞受到阻礙降低光催化效能(Jitianu et al., 2004)。 目前液相 BPA 曾進行光催化技術、吸附、生物處理及超音波技術等研究,其中生物 處理需時較久且副產物變異性大,污染濃度不宜太高;超音波技術耗能大且礦化率不佳;吸附
處理成本雖低,但吸附劑再生難度高及耗損率高卻是不可忽略之問題;其中二氧化鈦具有高活 性、不溶性、可抵抗侵蝕、毒性低和成本相對較低等特性,所以利用二氧化鈦光觸媒分解水中 難處理之污染物之氧化作用為較有效的方法,因為這些有機汙染物幾乎都可藉由近紫外光範圍 的輻射能予以礦化,處理效率較佳故其吸引較多關注。 二、實驗材料及研究方法 2.1 實驗材料 2.1.1 雙酚 A(Bisphenol A)
雙酚 A(bisphenol A,簡稱 BPA)為具雌性激素作用之內分泌干擾物,其分子式為 C15H16O2,
其結構是由兩莫耳的苯酚和一莫耳的丙酮化合而成,log Kow 3.32 (20℃)表示具有很強之疏水
性質,水溶性極低,溶解值 120-300 mg/L;BPA 在 pH 10 主要以 BPA-或 BPA2-離子存在,由
於 BPA 的解離常數介於 pKa1 (pH 9.6)和 pKa2 (pH 10.2)之間,當 BPA 於 pH 值 9-11 左右的水
溶液中會解離形成陰離(kosky et al., 2002),另外指出由 pH 值影響 BPA 物種分佈發現於 pH =9
系統中會存 50% HBPA-及 50% 雙酚 A,於 pH= 12 時會完全解離為 100% BPA2-,說明 pH
值將影響光觸媒表面帶電性並決定吸附/脫附雙酚 A (Bautista-toledo et al., 2005),這將影響光 催化降解效能。不易被生物利用而降解,因此釋放至環境中除存在於水體外,亦容易濃縮於 底泥或土壤中。 2.1.2 官能基化奈米碳管 本實驗所用之奈米碳管由匡元生技公司購買之商業多層奈米碳(Multi-wall Carbon Nano-tubes, MWCNT),長度約 5 ~ 15μm,純度達 95 %以上,含碳量則<3 %、內徑約 0.34 nm, 且比表面積經量測為 145 m2 /g。 由於化學氣相沉積法合成的奈米碳管,可能會有大量雜質殘存在奈米碳管上,將其純化 移除,純化程序係參照(Yu et al., 2005),先秤取 0.5 g 之奈米碳管於燒杯中,加入 100 ml 硝酸 (68%)蓋上蒸發皿於 100℃進行加熱迴流 24 小時後,靜置至溫室,利用 0.2μm 濾膜過濾,反 覆以去離子水洗滌制 pH 值為中性,並置入烘箱以 100±5℃烘乾,即完成純化程序。 接著進行羧酸化碳米碳管表面改質,使其表面形成帶有 COOH-官能基,增加與高分 子基材間的反應性與均勻性,配置混合酸液,硫酸:硝酸=3:1(體積比) ,取 MWCNTs 若干克, 加入前述混合酸液,超音波震盪器中震盪數小時後,加入大量去離子水,稀釋殘餘酸液,並 利用 0.1 µm 濾膜過濾分離碳管與酸液,直到濾液 pH≒6~7 為止,50℃真空烘箱乾燥 24 小 時,即得到羧酸化奈米碳(CNT-COOH)。 2.1.3 複合光觸媒製備
CNTs/TiO2複合材料,以進行光催化反應。本實驗採取溶膠凝膠法 (Sol-gel method)和水
熱 法 (Hydrothermal method) 製 備 CNT/TiO2 複 合 光 觸 媒 , sol-gel method 以 titanium tetraisopropoxid (TTIP)作為鈦源,利用酸和醇進行酯化反應生成水分子,對鈦前驅物進行水解 和縮合反應,配置濃度約 2 CMC 之 SDS 溶液,加入定量之 CNT-COOH 混合,利用超音波 震盪 30 分鐘,以磁石攪拌旋轉 12 小時(溶液 A),接著取固定比例 TTIP 與硝酸置入異丙醇溶 液中,攪拌均勻(溶液 B),將溶液 B 加入溶液 A 後,在室溫下磁石攪拌旋轉持續 3 小時,最 後以0.45 μm 濾紙進行過濾。 過濾後將其置入 60 oC 真空烘箱乾燥後,再以 400 oC 高溫爐鍛燒,即為 SSCT1 光觸媒; hydrothermal method 將上述溶膠凝膠水溶液,置入自製不銹鋼壓力槽中,放入 200℃烘箱中進
行水熱反應,過濾後置入 60 o
C 真空烘箱乾燥,此時 HSCT1 光觸媒即形成(Yu et al., 2007; Gao et al., 2010)。
2.2 光催化反應實驗
本研究係在實驗室以批分式光催化反應器(batch photocatalytic reactor)(見圖 1),進行雙酚 A 的光催化分解試驗,反應器外圍平均設置四支 10 W 近紫外光燈管,此燈管之主要發射光主 要波長在 360 nm 左右,至於反應器中實際之光照強度,則以照度計(radiometer, UVX Digital Radiometer, UVX-36, CA, USA)來加以確定。
實驗中自製 CNTs/TiO2複合光觸媒粉末做為反應所需之光催化劑。將適量的光觸媒粉末 置於含雙酚 A 之人工配置廢水於反應器中,並以磁石攪拌以保持光觸媒粉末能均勻懸浮在反 應器中。測試不同操作條件對雙酚 A 去除效率之影響。擬定之操作條件為 BPA 初始濃度為 10 mg/L、光催化劑量為 50 mg/L、pH 值(2~11)、添加增益劑等因子,將量測雙酚 A 隨時間之 濃度變化情形。實驗步驟為將固定量光催化劑(TiO2/CNT 複合催化劑)置入 1 L 之雙酚 A 溶液 中,先置於暗處平衡 30 min 後再打開光源,在固定時間內取樣 2 mL,將懸浮液以 0.45 μm 之 濾紙過濾後接著萃取,再使用 HPLC 分析雙酚 A。 圖 1. 光分解反應槽示意圖 2.3 光觸媒催化反應速率 光催化反應有機物進行光觸媒分解,其通常為假(近)一階反應,皆遵循 Langmuir-Hinshewood 動力學反應機制[18],可利用下式得知反應速率。 C K KkC dt dc -r a (1)
式中 Ka為假一階反應速率常數(apparent pseudo-first order rate constant),經過積分,其反應速
率式為 t K C C ln 0 a ( 2 ) t K -ln lnC C0 a ( 3 ) 可藉由作 lnC vs. t 之迴歸曲線,可求得 Ka值。 式中,r:反應速率 K:反應速率常數 k:吸附平衡常數 C:反應物濃度 三、結果與討論 3.1 光觸媒特性分析
3.1.1 XRD 分析
由圖 2 繞射圖譜顯示,發現自製的復合光觸媒繞射波峰位置 2θ=25.3、37.8、48.2、54.0、 62.7˚分別為銳鈦礦(anatase)的(101)、(004)、(200)、(105)、(204)之晶格型態,應具有光催化活 性。利用 Scherrer eaution 計算出的觸媒粒徑大小,其粒徑大小分別為 12 nm(SSCT1)和 7.4 nm(HSCT1)。因為水熱法製備光觸媒有較大的 anatase 波峰半高寬,是因為利用低溫高壓環境
下,將無晶相 TiO2緩慢的轉變 anatase,所以可得到較小粒徑的光觸媒;相反的由於 Sol-gel 法
製備之觸媒需經過高溫鍛燒處理,晶相便會隨著溫度升高而改變,所以有足夠的能量使晶體 更為穩定,在波峰強度上也相對較為明顯,但由於必須藉由高溫鍛燒來形成晶相,所以會導 致觸媒燒結並產生較大的粒徑, 可是利用界面活性劑改質 CNT 之複合光觸媒不論是
Hydrothermal 法或 sol-gel 法皆可得到較小的粒徑,主要是因為 SDS 導致 CNT 與 TiO2均勻分
散於 sol 中增加兩者的接觸面積以降低 TiO2的團聚,並且提升熱能傳輸效率,使晶相變化增 快將導致 CNT 表面形成顆粒較小的 TiO2。 圖 2 (a)HSCT1;(b)SSCT1;(c)HT;(d)ST 之 XRD 圖譜 3.1.2 FEG-SEM-EDS 觀察 HSCT1 和 SSCT1 複合光觸媒表面型態,結果如圖 3 所示。SSCT1 放大 50000 倍之 SEM 圖,顯示表面球狀 TiO2粒子大小分布均勻並且覆蓋於 CNT 上;而水熱法製備光觸媒可 觀察到表面 TiO2顆粒較小並且有層層堆疊之現象,藉由進行掃描 EDS 對觸媒表面進行元素 分析,兩種製備技術所製備的複合光觸媒表面卻未發現碳元素,表示 SDS 能有效的使 CNT
和 TiO2均勻分散於溶膠水溶液中,導致 TiO2能均勻的包覆奈米碳管,故可生成粒徑較小 TiO2
顆粒。
圖 3 (a)SSCT1;(b)HSCT1 之 FEG-SEM-EDS 圖(× 50000)
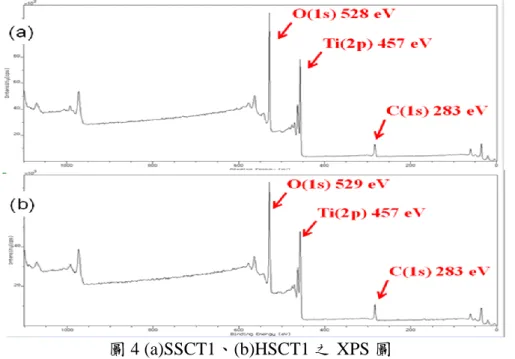
圖 4 為 XPS(ESCA)分析表面之化學環境,化學分析電子光譜在此主要是用來分析表面所 含有的化學元素種類,圖上 binding energy 為 283eV、457eV、528eV 分別是 C、Ti、O 等元
素訊號,TiO2的鈦元素 Ti2p 束縛能為 459eV,由此可推斷出在奈米碳管表面的顆粒為 TiO2,
並且可發現 SSCT1 及 HSCT1 複合光觸媒於 283 eV 之 C(1s) 束縛能有較小的 binding energy, 主要是藉由 SDS 使得 TiO2/CNT 複合較均勻所以導致表面有較少的 C 元素存在,此結果與 FEG-SEM-EDS 結果相同。 圖 4 (a)SSCT1、(b)HSCT1 之 XPS 圖 3.1.4 孔洞與比表面積 圖 5 顯示 sol-gel 法製備之 SSCT1 光觸媒可以觀察在氮氣吸脫附曲線中,發現 2 個較明顯 遲滯現象,原因是因為藉由界面活性劑(SDS)使 CNT 和 TiO2均勻結合,所以形成較整齊的堆 疊之現象,產生較佳之孔洞效應,故可產生更高的吸附能力;Hydrothermal 法製備光觸媒中 HSCT1 光觸媒的比表面積最小,主要是在 Hydrothermal 法製備技術不需高溫鍛燒,所以當添 加 SDS 於複合觸媒中會在表面形成界面活性劑之薄膜,降縱使具有孔洞特性也將導致比表面 積下,比表面積分別為 133 及 86 m2 /g。 圖 5 CNT/TiO2複合觸媒之 N2吸脫附曲線圖 3.2 pH 值對光催化反應之影響
圖 6 結果顯示可以發現 HSCT1 複合光觸媒於在 pH 7 時,降解效率大幅提升,經界達電 位測試結果發現,本身於溶液中的零電位點發生於 pH=5.6,當溶液的 pH 值>5.6 時,表面即 會帶負電,所以 pH 7 條件下會導致 HSCT1-82 複合觸媒易吸附帶電物質,因此較利於光解反 應之進行,降解效率達 68%,最後亦可發現 pH 值上升為鹼性時,降解效率與反應速率便不 再有明顯的變化,推測原因是因為製備過程缺少高溫鍛燒以至於表面界面活性劑(SDS)殘留並 隔絕 CNT 與 TiO2的電子傳遞效率以及中性環境下與 BPA 吸附作用導致有較高的反應速率, 可能會因為吸附過量的有機物或者可能有副產物的生成導致表面活化位置減少,以至於光催 化降解效能降低,縱使環境中有再多的氫氧根離子也無法有效的轉變為更多氫氧自由基,導 致反應達到穩定;但是 sol-gel 法製備複合觸媒 SSCT1 比 HSCT1 有較佳的降解效能及反應速 率,當溶液由 pH=2 提升至 pH=9,其降解效率從 60 %增加至 76 %,然當 pH 值再提升至 11 時,降解效率反而從略微下降至 72.7%,主要係因在鹼性環境下會產生氫氧根離子,其會與 複合觸媒表面的 TiO2所產生之表面電洞反應生成較多之氫氧自由基,所以當 pH 值愈高將導 致降解效率愈高,但卻在 pH = 11 時反而略降了ㄧ些,其可能原因推估應跟吸附作用有相關, 以表面界達電位測試發現,於水溶液中零電位點(pHzpc)為 pH=5.18,當溶液的 pH 值>pHzpc
時,複合光觸媒的表面即會帶負電,Kosky et al. (2002)指出 BPA 在 pH 10 主要以 BPA-或 BPA
2-離子存在,由於 BPA 的解離常數介於 pKa1 (pH 9.6)和 pKa2 (pH 10.2)之間,當 BPA 於 pH 值
9-11 左右的水溶液中會解離形成陰離子,所以在 pH 為 2 到 9 時吸附作用的效應小於氫氧自 由基的作用,故降解效率主要是和氫氧自由基之多寡有關,但 pH 11 鹼性環境中 BPA 和 SSCT1 複合光觸媒的表面是帶負電,導致光催化降解率下降,原因可能是由於它們之間的庫侖斥力 的影響大於氫氧自由基的作用,故導致降解效率降低。
圖 6. pH 值對於光催化降解 BPA 之反應常數及降解率之影響([BPA]0=10 mg/L;[catalyst]=50
mg/L;light=360 nm;IUV=0.34 mW/cm2;reaction time=120 min)
3.3 光觸媒劑量對光催化反應之影響 從圖 7 觀察到 HSCT1 複合光觸媒,當添加 PO43-濃度由 10-6 mmole/L 提升到 10-4 mmole/L 時降解效率可高達 77.3%,但是繼續增加至 10-3 mmole/L 便開始降低;相反的 SSCT1 複合光 觸媒本身具有較大吸附能力,便可同時有效率的反應複合觸媒表面之氫氧根離子產生氫氧自 由基以及吸附 PO43-延長電子-電洞對結合率,便可提高氫氧自由基之生成,當添加 PO43-濃度 提升到 10-3 mmole/L 時降解效率可高達 86.2%。
當水中存在不同種類之無機離子時,背景離子與有機物產生競爭氫氧自由基,或者無機
離子會被 TiO2觸媒所吸引吸附於表面形成外圍屏障阻礙有機物和 TiO2接觸機會,導致光催化
效能受影響,所以推估原因為光催化系統於 pH 9 時環境中產生過多的氫氧根離子與污染物,
此時再加入過量的 PO43-將會於 TiO2表面吸附產生遮蔽與競爭吸附,導致複合觸媒表面活化
位置(activated sites)被佔滿,因此會減緩對 BPA 之降解速率;所以當觸媒本身具有較大吸附能 力時便可提高氫氧自由基之生成(Pangarkar et al., 2004;Wong et al., 2003)。
圖 7 PO43-添加對於複合光觸媒光降解 BPA 之影響([BPA]0=10 mg/L;[catalyst]=50 mg/L;λ
=360 nm;IUV=0.34 mW/cm2;reaction time=120 min;pH 9) 四、結論與建議 本研究在探討溶膠凝膠法(sol-gel)與水熱法(hydrothermal)對於製備 CNTs/TiO2複合光觸媒 於不同 pH 值和添加增益劑條件下探討其光催化降解 BPA 廢水之可行性,也藉由 XRD、 FEG-SEM-EDS、BET、XPS 對光觸媒表面的晶相、表面結構與孔洞結構做探討,結論彙整如 下: 1. 本次實驗之 K 值皆採 20 min 至 80 min 之實驗數據,根據式 3 方程式來加以計算,發現 到所有實驗皆遵守 Langmuir-Hinshewood 方程式,其 R2值大部分皆高於 0.93 以上,為假 一階方程式。 2. 於 pH 2~11 下 HSCT1 光觸媒其 K 值為 5.4×10-3 ~7.1×10-3 1/min,其 120 分鐘之降解效率 分別為 48、51.8、54.7、62.7、60.5 及 57.3 %;SSCT1 光觸媒其 K 值為 7.6×10-3 ~10.8× 10-3 1/min,其 120 分鐘之降解效率分別為 60、63、68、71.6、76 及 72.7 %,可發現到 降解效率隨 pH 增高而增加,因為在鹼性條件下會產生 OH- ,其會與 TiO2 表面電洞反 應生成較多之.OH,但當 pH 增至 11 時降解效率反降了些,原因可能是由於它們之間 的庫侖斥力的影響大於氫氧自由基的作用,故降解效率就不單只依氫氧自由基之多寡而 定。 3. 在反應系統中添加 PO43-可有效提升光催化降解效能,以添加 10-6~10-3 mmole/L 不同 PO4 3-濃度來進行實驗,HSCT1 光觸媒其 K 值為 8.2×10-3 ~10.2×10-3 1/min,其 120 分鐘之降解 效率分別為 62.7、68、72.5、77.3 及 70.5%;SSCT1 光觸媒其 K 值為 11.9×10-3 ~16.5×10-3 1/min,其 120 分鐘之降解效率分別為 76、80.7、81.8、83 及 86.2%,因為 PO43-存在光催 化系統中時能有效的提升電子-電洞對的分離以及促進電洞和水分子之間的電荷傳導,使 得氫鍵能有效地增加氫氧自由基的形成;但是當添加過量則會被 TiO2觸媒所吸引,而吸 附於表面形成外圍屏障阻礙有機物和 TiO2接觸機會,使光催化效能受到影響。
4. 以界面活性劑(SDS)提升 CNT/TiO2複合光觸媒之研究中,以 sol-gel 法製備之光觸媒有較 佳之光催化效能,主要是由於藉由高溫鍛燒過程可把殘留於表面的 SDS 燃燒去除,另外 經由 SDS 作用使得 CNT 和 TiO2能夠均勻分散,使得兩者之間結合性提高,因此有較良 好表面特性以提升對污染物的吸附以降低電荷再結合速率,提升 TiO2的光活性。 綜合上述而言,於本實驗中發現以界面活性劑(SDS)提升 CNT/TiO2複合光觸媒對 BPA 廢 水有良好之降解效果,故利用其光觸媒催化方法處理廢水為可行且可繼續探討研究之技術。 五、 參考文獻
[1] Wen-Tien Tsai, Mei-Kuei Lee, Ting-Yi Su, Yuan-Ming Chang, “Photodegradation of bisphenol-A in a batch TiO2 suspension reactor,” Journal of Hazardous Materials, 168, 269–275(2009).
[2] Furhacker, M., Scharf, S., Weber, H., “Bisphenol A: emission from point sources“. Chemospherre 41, 751-756(2000).
[3] Lee, H.B., Peart, T.E., “Bisphenol A contamination in Canadian municipal and
industrialwastewater and sludge samples“.Water Quality Res. J. Canada 35, 283–289(2000). [4] Nasu, M., Goto, M., Kato, H., Oshima, Y., Tanaka, H., “Study on endocrine disrupting
chemicals in wastewater treatment plants “, Water Sci. Technol. 43, 101–108(2001). [5] Yamamoto, T., Yasuhara, A,. Shiraishi, H., Nakasugi, O. “Bisphenol A in hazardous waste
landfill leachates“, Chemosphere 42, 415–418(2001).
[6] J.H. Kang, D. Aasi, Y. Katayama, “Bisphenol-A in aquatic environment and its endocrine- disruptive effects on aquatic organisms,” Crit. Rev. Toxicol., 37, 607–625 (2007).
[7] Chen, M. Ike, M. Fujita, “Acute toxicity, mutagenicity, and estrogenicity of bisphenol-A and other bisphenols,” Environ. Toxicol., 17, 80–86 (2002).
[8] Gultekin, N.H. Ince, “Synthetic endocrine disruptors in the environment and water remediation by advanced oxidation processes,” J. Environ. Manage., 85, 816–832 (2007).
[9] Gao,B.,Lim,T.M.,Subagio,D.P.,Lim,T.T., “Zr-doped TiO2 for enhanced photocatalytic degradation of bisphenol A“. Applied Catalysis A: General 375,107–115(2010).
[10] Yu, Y., Yu, J.C., Chan, C.Y., Che, Y.K., Zhao, J.C., Ding, L., Ge, W.K. and Wong, P.K. “Enhancement ofadsorption and photocatalytic activity of TiO2 by using carbon nanotubes for the treatment of azo dye“. Appl. Catal., B, 61, 1/2, 1-11(2005).
[11] Sahoo,N.G.,Cheng,H.K.,Li,L.,Chan,S.H.,Judeh,Z.,and Zhao,J., “A novel approach to chemically functionalize multiwalled carbon nanotubes (MWCNTs) for making advanced polymericnanocomposites with liquid crystalline polymers (LCPs) is presented“,Adv. Funct.Mater19,3962-3971(2009).
[12] Gao,B., Chen,G.Z., Puma,G.L., “Carbon nanotubes/titanium dioxide (CNTs/TiO2)
nanocomposites prepared by conventional and novel surfactant wrapping sol–gel methods exhibiting enhanced photocatalytic activity“, Applied Catalysis B: Environmental
![圖 6. pH 值對於光催化降解 BPA 之反應常數及降解率之影響([BPA] 0 =10 mg/L;[catalyst]=50](https://thumb-ap.123doks.com/thumbv2/9libinfo/7417516.104811/6.892.192.695.560.915/圖6pH值對於光催化降解BPA之反應常數及降解率之影響BPA=1mgLcatalyst=.webp)
![圖 7 PO 4 3- 添加對於複合光觸媒光降解 BPA 之影響([BPA] 0 =10 mg/L;[catalyst]=50 mg/L;λ](https://thumb-ap.123doks.com/thumbv2/9libinfo/7417516.104811/7.892.267.620.250.486/圖7PO43添加對於複合光觸媒光降解BPA之影響BPA=1mgLcatalyst=5mgLλ.webp)