表現登革病毒2型PL046外膜蛋白以用於建構假型小鼠白血病病毒
全文
(2) 表現登革病毒 2 型 PL046 外膜蛋白以用於建構假型小鼠白血病病毒 Expressing dengue virus 2 E protein for pseudotype formation of murine leukemia virus with dengue virus envelope. 研究生:林柏吟. Student:Po-Yin Lin. 指導教授:楊昀良 博士. Advisor:Dr. Yun-Liang Yang. 國 立 交 通 大 學 生 化 工 程 研 究 所 碩 士 論 文. A Thesis Submitted to Institute of Biochemical Engineering National Chiao Tung University in partial Fulfillment of the Requirements for the Degree of Master of Scinence in Biochemical Engineering September 2005 Hsinchu, Taiwan, Republic of China. 中華民國九十四年九月.
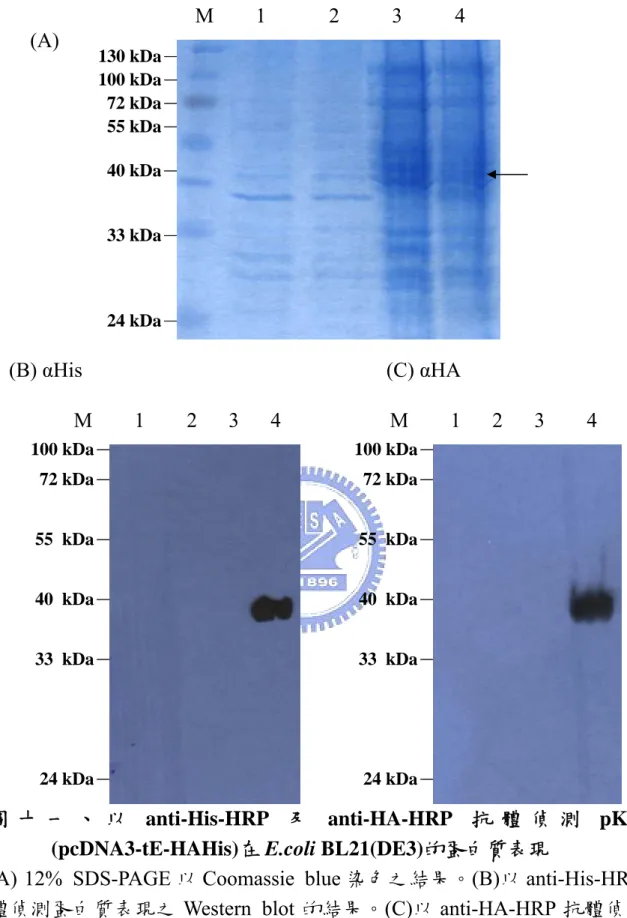
(3) 摘要 登革病毒(Dengue virus)屬於黃質病毒科(Flaviviridae) ,為一正向單 股(positive single stranded)的 RNA 病毒,並具有外膜蛋白(E:envelope protein),是引起登革熱與出血性登革熱的病原體,且有日趨嚴重的現象, 已漸漸成為世界性的公共衛生問題。研究顯示在登革病毒進入細胞的過程 當中,其外膜蛋白扮演了一個重要的角色。它是一個由四百九十五個胺基 酸所構成的醣蛋白,位於病毒脂質雙層膜的外側,是一個穿膜蛋白質。外 膜蛋白外露在病毒膜外的部分,被認為可以和其受體結合。由於登革病毒 感染細胞之後,細胞型態變化不大,因此對於感染成功與否與實驗的有效 性多半靠溶斑試驗(plaque assay)來確認,且被感染的細胞株並非每一種 細胞株都會產生溶斑(plaque),加上檢定 plaque 形成的時間需 5~7 天,造 成研究登革病毒的困難度。因此本研究的主要目的,其一為表現登革病毒 的外膜蛋白,其二為建立一帶有報導基因之假病毒(pseudotype virus)模式, 以應用於登革病毒感染過程的相關研究。將登革病毒外膜蛋白(E)表現質 體、外膜蛋白基因缺陷之小鼠白血病病毒(murine leukemia virus)複製及 結構表現質體以及帶有 β-galactosidase 之複製缺失基因組表現質體共同轉 染哺乳動物細胞株,使其組裝產生假病毒顆粒。本研究結果顯示:(一)登革 病毒二型的全長外膜蛋白(DV-2 full-length E protein)在 E.coli Novablue(DE3) 之表現,可使用 anti-His-HRP 抗體藉由 Western blot 偵測到 recombinant protein 的表現,惟在哺乳類 BHK21 細胞株中無法偵測。(二)由穩定細胞株 的細胞融合現象推測 E protein 會表現在細胞膜上。(三) 雖然在我目前的實 驗條件下,還無法成功的產生假型病毒顆粒,但根據前人研究證明:小鼠 白血病病毒(MLV)與 C 型肝炎病毒(HCV)組合成假型病毒顆粒是可行 的,而 C 型肝炎病毒屬於黃質病毒科,其與登革病毒有相同的結構及組成, 所以未來可繼續改善方法與技術以成功產生假型病毒顆粒。. i.
(4) Abstract Dengue virus (DV), a member of the family Flaviviridae, is an enveloped, single-stranded positive sense RNA virus. Dengue fever and dengue hemorrhagic fever (DF/DHF) are caused by the dengue viruses that represent a global public health problem. In the process of virus entry, the envelope protein (E protein) plays an important role. It is a glycoprotein of 495 amino acids, with a transmembrane domain at the C-terminal. The extracellular domain of E protein is thought to interact with the host cell receptor. There is no discernable change in the host cell that infected by dengue virus. In general, one can only use plaque assay to determine whether the propagation is successful. However, not every cell line infected can produce plaques and even if it can, the plaque formation needs 5~7 days. Those events make research in dengue virus difficult. The objectives of this study were to generate infectious pseudotyped-particles that were assembled by functional dengue virus E proteins onto retroviral core particles. In this assay, mammalian cells are cotransfected with 3 plasmids, one expressing the retroviral proteins—expect the envelope—from murine leukemia virus, another expressing the replication-defective retroviral genome with β-galactosidase gene marker, and the other expressing the E gene from dengue virus. In conclusion: First, the recombinant proteins of DV-2 E protein fused with His-tag can be detected in the E.coli expression system by Western blotting analysis but not in BHK21. Second, the DV E proteins can reach the cell surface because the stable cell lines transfected with the plasmid expressing DV E gene displayed syncytium. Third, in this study, no pseudotype viruses were detected. Further studies are required.. ii.
(5) 誌 謝 兩年餘的研究生活,感謝楊昀良老師的耐心指導與訓練,讓我的思緒 更富條理性以及邏輯性,亦使我在實驗與生活上受益匪淺,同時並感謝林 苕吟老師及岳嶽老師在口試與論文修改方面提供了諸多寶貴的建議,在此 致上最誠摯的謝意。 研究生活中,感謝實驗室每位成員的陪伴,使得我能順利完成論文。 謝謝美惠學姊在實驗上的經驗分享,雅文學姊與助理貴榮的適時鼓勵與實 驗上的幫助,同窗建斈、婷尹、馥嘉、宛真彼此的加油鼓勵互相扶持,研 究所學弟妹怡瑾、志豪、歐陽、杏枚、育穎、欣彬、金蓉與大學部學弟妹 逸修、政毅、虹綾、欣悟、曜禎、大馨、瀞云、佳叡、萍芳、柏伶、宗翰 愉快的相處,因為你們的存在,使我的研究生活中充滿了歡笑與美好的回 憶,謝謝你們。 從大學到現在,一路上需要感謝的人很多。感謝大學時代的曾哲明教 授、敬儀學姊、倩君學姊、國宏學長引領我這個新手進入生科的殿堂;感 謝研究助理時期的老闆──曾勝弘醫師與陳芸醫師給予我學習的機會,還 有讓我挖了不少寶的國峰學長,以及佳康、心怡、曉侖、淑惠、傳雯、書 瑋等同事一直以來的加油打氣。當然,還有高中好友心芸的加油祝福以及 一干大學好友──郁婷、喬雯、秀鈴、慧君、慶芳、立琇、惠萍、諺雅在 生活上彼此的分享激勵及憂喜與共,你們都是我生命中不可或缺的好朋友。 最後,要感謝非常關心我的爺爺奶奶、親愛的父母在生活上與精神上 給予我無限的包容與支持、姐姐不時的噓寒問暖及家族成員們一直以來的 關懷,讓我得以無後顧之憂的成長學習,有你們真好。. iii.
(6) 目 錄 中文摘要…………………………………………………………………….... i. 英文摘要…………………………………………………………………….... ii. 誌謝…………………………………………………………………………... iii 目錄…………………………………………………………………………... iv 圖目錄………………………………………………………………………... vii 附表圖目錄…………………………………………………………………... ix 縮寫表……………………………………………………………………….... x. 壹、緒論………………………………………………………………………. 1. 1.1 登革熱之簡介…………………..……………………………………... 1. 1.2 登革病毒的歷史與現況…………...………………………………….. 1. 1.3 登革病症的臨床病徵…………………………………………………. 2. 1.4 登革病毒之分子生物學背景…………………………………………. 3. 1.5 登革病毒外膜蛋白(E protein)的已知特性……………………….. 5. 1.6 假型病毒顆粒(pseudotyped viral particles)……………………….. 6. 貳、材料與方法………………………………………………………………. 8. 2.1 實驗材料………………………………………………………………. 8. 2.1.1 菌株……………………………………………………………….. 8. 2.1.2 細胞株…………………………………………………………….. 8. 2.1.3 病毒……………………………………………………………….. 8. 2.1.4 質體……………………………………………………………….. 8. 2.1.5 引子………………………………………………………………. 10 2.1.6 藥品試劑…………………………………………………………. 11 2.1.6.1 藥品………………………………………………………… 11 2.1.6.2 抗體………………………………………………………… 14 2.1.6.3 試劑………………………………………………………… 14 2.1.7 溶劑及緩衝液之配方……………………………………………. 15 2.1.8 主要儀器…………………………………………………………. 17 iv.
(7) 2.2 實驗方法……………………………………………………………… 18 2.2.1 大腸桿菌勝任細胞(competent cell)的製備…………………. 18. 2.2.2 大腸桿菌轉形作用(transformation)…………………………. 19 2.2.3 小量質體DNA萃取……………………………………………… 19 2.2.4 大量質體DNA萃取……………………………………………… 19 2.2.5 限制酵素反應……………………………………………………. 20 2.2.6 萃取洋菜膠內之DNA片段……………………………………… 20 2.2.7 重組E蛋白在大腸桿菌之誘導表現2.2.7 重組E蛋白在大腸桿 菌之誘導表現……………………………………………………... 21 2.2.8 大腸桿菌蛋白質之萃取…………………………………………. 21 2.2.9 哺乳動物細胞蛋白質之萃取……………………………………. 22 2.2.10 以SDS-PAGE分析並以Coomassie blue staining及西方轉漬分 析(Western blot analysis)偵測蛋白質表現……………………….. 22 2.2.10.1 SDS-PAGE電泳…………………………………..…...…… 22 2.2.10.2 Coomassie blue staining…………………………..………... 22 2.2.10.3西方轉漬分析(Western blot analysis)….…………..……… 23 2.2.11 細胞培養(cell culture)………………………………………. 23 2.2.12 細胞株轉染(transfection)…………………………………… 24 2.2.13 細胞株RNA萃取(RNA extraction)…………………………. 24 2.2.14 北方轉漬分析(Northern blot analysis)…...…………………… 25 2.2.14.1 製備DNA探針 (DNA probe labeling)………………… 25 2.2.14.2 轉漬RNA (transfer)……………………………………. 25 2.2.14.3 雜交反應(hybridization)……………………………….. 26 2.2.14.4 免疫偵測 (immunological detection). 26. 2.2.15 穩定轉染細胞的篩選(selection of stable transfected cells)…... 27 2.2.16 登革病毒的增殖(amplification of dengue virus)……………. 27 2.2.17 溶斑試驗(plaque assay)……………………………………….. 27 2.2.18 共同轉染(co-transfection)到哺乳動物細胞株……………….. 28 v.
(8) 2.2.19 測試假型病毒顆粒(pseudotyped viral particles)的效價……... 28 2.2.20 利用病毒提供外膜蛋白以產生假型病毒顆粒……………...… 29 2.2.21 X-gal staining……………………………………………………. 29 參、結果………………………………………………………………………. 30 3.1 pcDNA3-E14之定序及序列比對…………………………………….. 30 3.2 pET-30a(+)-E14質體之建構………………………………………….. 30 3.3 pcDNA3-His-E14質體之建構………………………………………... 31 3.4 pET-30a(+)△5T-E14質體之建構…………………………………….. 31. 3.5 pcDNA3-D3E質體之建構……………………………………………. 31 3.6 利用限制酵素以確認所建構之質體………………………………… 32 3.7 登革病毒外膜蛋白(E protein)在E.coli中的表現………………… 33 3.7.1 截短型外膜蛋白(truncated E protein)之表現……………….. 33 3.7.2 全長外膜蛋白(full-length E protein)之表現…………………. 34 3.8 登革病毒截短型外膜蛋白(truncated E protein)在mammalian cell 中的表現……………………………………………………………... 36 3.9 登革病毒外膜基因(E gene)之表現……………………………….. 37 3.10 穩定細胞株的細胞型態變化與溶斑試驗………………………….. 37 3.11 pMD.gagpol質體之gag-pol gene的表現……………………………. 38 3.12 共同轉染以產生假型病毒顆粒…………………………………….. 38 3.13 利用病毒提供外膜蛋白以產生假型病毒顆粒…………………….. 38 肆、討論……………………………………………………….…………….. 40 4.1 DNA序列比對結果…………………………………………………… 40 4.2 登革病毒截短型外膜蛋白( truncated E protein )的表現………….... 40. 4.3 登革病毒全長外膜蛋白( full-length E protein )的表現……..……… 41 4.4 穩定細胞株的細胞型態變化與溶斑試驗……..…………………….. 43 4.5 假型病毒顆粒………………………………………………………… 43 伍、結論……………………………………………………………………… 46 陸、參考文獻………………………………………………………………… 47 vi.
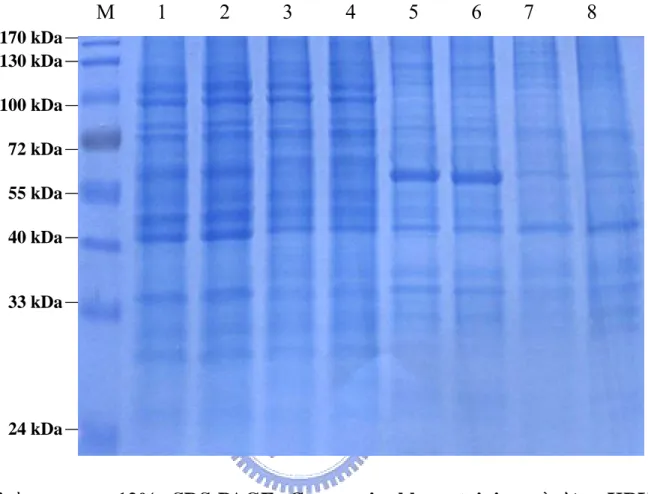
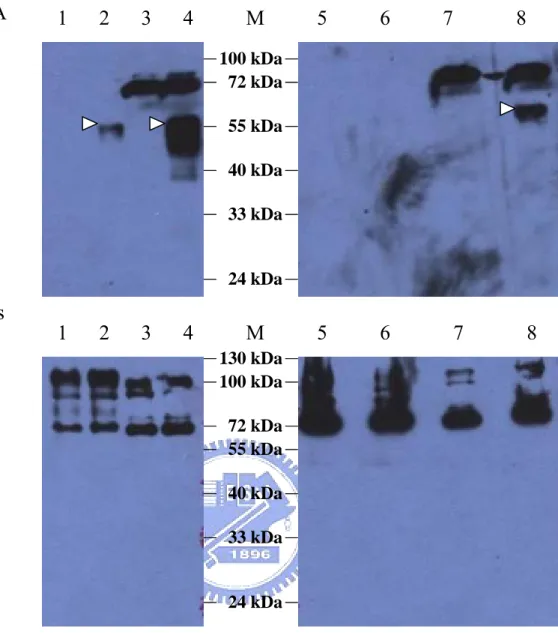
(9) 圖 目 錄 圖一、定序pcDNA3-E14質體上之insert (DV-2 E gene)序列與Taiwan local strain PL046及New Guinea-C(M29095)作序列比對………… 53 圖二、pET-30a(+)-E14質體建構之示意圖………..……………………….. 54 圖三、pcDNA3-His-E14質體建構之示意圖……………………………….. 55 圖四、pET-30a(+)△5T-E14質體建構之示意圖…………………………… 56 圖五、pcDNA3-D3E質體建構之示意圖…………………………………… 57 圖六、利用限制酵素確認pcDNA3-E14質體……………………………….. 58 圖七、利用限制酵素確認pET-30a(+)-E14質體……………………………. 59 圖八、利用限制酵素確認pcDNA3-His-E14質體………………………….. 60 圖九、利用限制酵素確認pET-30a(+)△5T-E14質體………………………. 61 圖十、利用限制酵素確認pcDNA3-D3E質體……………………………… 62 圖十一、以anti-His-HRP及anti-HA-HRP抗體偵測pKRY1 (pcDNA3- tEHAHis)在E.coli BL21(DE3)的蛋白質表現………………………… 63 圖十二、以anti-DV-2 domainⅢ抗體偵測pKRY1(pcDNA3-tE-HAHis)及 pcDNA3-E14在E.coli BL21(DE3)的蛋白質表現…………………... 64 圖十三、pET-30a(+)-E14質體轉譯蛋白質之示意圖……………………… 65 圖十四、以anti-His-HRP抗體偵測pET-30a(+)-E14在E.coli Novablue(DE3) 的蛋白質表現………………………………………………………... 66 圖十五、以anti-His-HRP抗體偵測pcDNA3-His-E14在E.coli Novablue (DE3)的蛋白質表現…………………………………………………. 67 圖十六、pET-30a(+)△5T-E14質體轉譯蛋白質之示意圖…………………. 68 圖十七、以anti-His-HRP抗體偵測pET-30a(+)△5T-E14在E.coli Novablue (DE3)的蛋白質表現…………………………………………………. 69 圖十八、以12% SDS-PAGE Coomassie blue staining 分析pKRY1 (pcDNA3-tE-HAHis)在BHK-21 cell與293T cell中的蛋白質表現… 70 圖十九、以anti-His-HRP及anti-HA-HRP抗體偵測pKRY1 (pcDNA3- tEvii.
(10) HAHis)在BHK-21 cell與293T cell中的蛋白質表現……………….. 71 圖二十、pcDNA3-E14在BHK-21 cell與293T cell表現mRNA的Northern blot結果……………………………………………………………… 72 圖二十一、pcDNA3-D3E在BHK-21 cell與293T cell表現mRNA的Northern blot結果……………………………………………………………… 73 圖二十二、穩定細胞株的細胞型態………………………………………… 74 圖二十三、各穩定細胞株之fusion index…………………………………… 75 圖二十四、穩定細胞株的溶斑試驗結果…………………………………… 76 圖二十五、pMD.gagpol在BHK-21 cell與293T cell表現mRNA的Northern blot結果……………………………………………………………… 77 圖二十六、產生假型病毒顆粒示意圖…………………………………….. 78 圖二十七、假型病毒顆粒的產生…………………………………………… 79 圖二十八、利用病毒提供外膜蛋白以產生假型病毒顆粒………………… 80 圖二十九、確認病毒感染共同轉染後之BHK21細胞……………………… 81 圖三十、recombinant DV-2 E protein之protease作用切位推測圖………. viii. 82.
(11) 附表圖目錄 附 表 一 、 DV-2 之 Taiwan local strain PL046 與 New Guinea-C strain (Accession No. M29095)的E gene (1-495 amino acids)序列比較 之變異處……………………………………………………………... 83 附圖一、1987至2004年台灣地區登革熱本土及境外移入確定病例分布…. 84 附圖二、Flavivirus life cycle………………………………………………… 85 附圖三、pBAG……………………………………………………………… 86 附圖四、pMD.gagpol………………………………………………………… 87 附圖五、pcDNA3-E14質體之示意圖………………………………………. 88 附圖六、pKRY1(pcDNA3-tE-HAHis)質體之示意圖……………………… 89 附錄一、ExcelPureTM Plasmid Miniprep Purification Kit(Premier)…….. 90 附錄二、PureLinkTM HiPure Plasmid DNA Maxiprep Purification kit (Invitrogen)……………………………………………………….. 91 附錄三、PCR Clean-up/Gel Extraction Kit(Premier)……………………. 93 附錄四、pET30a(+)質體之 map……………………………………………. 95 附錄五、pBluescript II SK(+/-)之 map……………………………………… 96. ix.
(12) 縮寫(Abbreviation). APS. Ammonium Persulfate. DF. Dengue fever. DHF. Dengue hemorrhagic fever. DMEM. Dulbecco’s Modified Eagle Medium. DMSO. Dimethyl sulfoxide. DSS. Dengue shock syndrome. EDTA. Ethylene diamine tetra-acetic acid. FBS. Fetal bovine serum. IPTG. Isopropyl-β-D-thiogalactoside. MEM. Minimum Essential Medium. MOI. Multiplicity of infection. MOPS. 3-(N-Morpholino propanesulfonic acid). MuLV. Moloney murine leukemia virus. PBS. Phosphate buffer saline. PMSF. Phenyl methyl sulfonyl fluoride. SDS. Sodium dodecyl sulfate. TEMED. N, N, N’, N’,-tetramethylenediamine. Tween-20 Polyoxyethene-sorbitan monolaurate X-gal. 5-bromo-4-chloro-3-indolyl-beta-D-galactopyranoside. x.
(13) 壹、緒 論. 1.1 登革熱之簡介 登革熱(dengue fever, DF)病症是一種感染登革病毒(dengue virus, DV) 所引起的傳染病。登革病毒可藉由埃及斑蚊(Aedes aegypti)及白線斑蚊 (Aedes albopictus)叮咬宿主的途徑進而傳播給人並引起疾病的發生,是現 今世界由節肢動物感染人類所造成最重要的病毒性疾病(Guha-Sapir and Schimmer, 2005)。流行病學的統計顯示登革病症好發於熱帶及亞熱帶地區 (Monath, 1994),氣候環境的關係使得這些區域傳播病毒的病媒蚊易於繁殖 因而增高了病毒傳播的機會,台灣隸屬亞熱帶國家,每年夏秋之際登革熱 的疫情頻傳。又登革病毒現階段並無有效疫苗可以運用,也無有效的治療 藥物,因此民眾的健康仍受到登革病毒傳染的威脅。. 1.2 登革病毒的歷史與現況 在近代西元歷史上,早在西元 1779 年到 1780 年,登革病毒就已在印 尼雅加達、埃及開羅以及北美的費城爆發流行(Ligon, 2005)。1950 年代,登 革病毒只在九個國家現蹤,到了今日,登革病毒已分布超過一百個國家 (Guha-Sapir and Schimmer, 2005) 。 根 據 世 界 衛 生 組 織 ( World Health Organization, WHO)的統計數據顯示,每年感染登革病毒的人口數都在增 加,據估計有超過二十五億的人口是生活在遭受登革病毒感染的威脅下, 雖然其中大部分的感染者無明顯症狀產生,但仍有為數不少的感染者會出 現 DF 症狀或是更嚴重的 DHF/DSS 症狀,其中 DHF/DSS 的致死率達 5 % (Guha-Sapir and Schimmer, 2005)。在台灣,曾在 1 9 1 5 、 1 9 3 1 、 1 9 4 2 年 發 生 三 次 全 島 性 登 革 熱 大 流 行 以 及 1981 年 屏 東 縣 琉 球 鄉 爆 發 第 二 型 登 革 病 毒 疫 情 ( Wu , 1 9 8 6 ) 。 根 據 行 政 院 衛 生 署 疾 病 管 制 1.
(14) 局的統計顯示,近年來每年或多或少都有登革熱的確定病例 ( 如 附 圖 一 所 示 ), 除 了 陸 陸 續 續 出 現 的 境 外 移 入 病 例 , 本 土 型 登 革 病 毒 感 染 的 病 例 也 有 週 期 性 增 加 的 趨 勢 (行 政 院 衛 生 署 疾 病 管 制 局 , 2004)。. 1.3 登革病症的臨床病徵 臨床上,登革病毒(dengue virus, DV)依其血清抗原的不同可分為四 個血清型(serotype),分別是DV-1、DV-2、DV-3及DV-4,根據台灣地區 的登革疫情統計,四型的病毒感染皆發生。當DV隨蚊子唾液進入人體內並 於血管內皮細胞中短暫增殖後(潛伏期 3 到 14 天,平均 4 到 7 天(Kao et al., 2005)),DV再釋放到血流中造成病毒血症(viremia)並破壞組織, 病患開始有臨床症狀出現。臨床症狀可能為無症狀(asymptomatic),或依 其嚴重程度可區分為三種:登革熱(dengue fever, DF)、登革出血熱(dengue hemorrhagic fever, DHF)以及登革休克症候群(dengue shock syndrome, DSS)。 感染登革病毒的病患初期只會引起輕微的 DF 病症,類似感冒的症 狀,如:發燒、頭痛、眼窩疼痛、肌肉關節痠痛、皮膚紅疹、淋巴結腫大 及白血球減少的病徵(Nimmannitya, 1987),在臨床實驗室的診斷上,亦發現 患 有 DF 的 病 患 有 嗜 中 性 白 血 球 較 低 ( neutropenia ) 與 血 小 板 較 少 (thrombocytopenia)的現象。多數病人的初次感染都可自然的痊癒,但有 些報導指出,在某些情況下,如遭受 DV 的二次感染(secondary infection) 且是不同血清型的交叉感染將造成嚴重的 DHF/DSS (Gubler, 1998; Guzman et al., 2000) , 此 一 派 理 論 認 為 這 是 因 為 發 生 ADE ( antibody-dependent enhancement)現象所造成的。DHF 的病徵初期與 DF 相同,即病患持續 二至七天發高燒,但在退燒後,DHF 病患由於血管內皮細胞受到影響,造 2.
(15) 成血管通透性(capillary permeability)增加,因此有血漿漏出(plasma leakage ) 的 現 象 發 生 , 血 漿 蛋 白 流 至 血 管 外 造 成 水 腫 , 紅 血 球 濃 縮 (hemoconcentration),胸腔液滲出(pleural effusion)及產生腹水等現象, 同時伴隨有 thrombocytopenia,所以 DHF 病患會在體表或內臟呈現出血現 象 。 DSS 的 病 徵 與 DHF 相 同 , 並 伴 隨 血 壓 下 降 而 發 生 休 克 的 現 象 (Kalayanarooj et al., 1997)。 在 某 些 病 例 中 可 以 觀 察 到 初 次 感 染 DV 的 情 況 下 , 患 者 亦 會 有 DHF/DSS 的病症發生,而前述因二次感染造成 DHF/DSS 的致病機轉之說 法無法解釋此現象,於是有另一說法認為病患因其所感染的病毒株毒性不 同,導致病症的嚴重程度不一,當感染到毒性較劇的病毒時就易造成嚴重 的 DHF/DSS 症狀(Vaughn et al., 1997; Vaughn et al., 2000; Libraty et al., 2002)。還有第三種說法指出 DV 會感染人類的內皮細胞(endothelial cells) 且會誘發 IL-6 與 IL-8 的產生而導致出現 DHF/DSS 病徵(Huang et al., 2000)。上述這三種理論可能說明了造成 DHF/DSS 的致病機轉是多因性的 (multi-factorial),但其詳細的致病機制至今仍未完全明瞭(Guha-Sapir and Schimmer, 2005)。. 1.4 登革病毒之分子生物學背景 登革病毒(DV)是一具有正向單股 RNA 的具膜病毒(enveloped virus ) , 在 分 類 學 上 屬 於 黃 質 病 毒 科 ( Flaviviridae ) 的 黃 質 病 毒 屬 (Flavivirus)。完整的病毒直徑大小為 50 nm (Henchal and Putnak, 1990)。 DV 的基因體(genome)全長 11 kb,在 5’端有 cap 結構,而 3’端則是缺乏 Poly A 序列。此基因體具有單一個 open reading frame,會在粗內質網(rough endoplasmic reticulum)先轉譯(translation)出一個聚蛋白質(polyprotein), 再經由病毒本身的蛋白質酵素(viral protease)及宿主細胞的訊息酵素 3.
(16) (signalase)作用,由聚蛋白質產生(process)出三個結構性蛋白(structural protein):衣殼蛋白(capsid protein, C)、前驅膜蛋白(precursor membrane protein, prM)及外膜蛋白(envelope protein, E),和七個非結構性蛋白 (non-structural protein)包括 NS1、NS2A、NS2B、NS3、NS4A、NS4B 及 NS5(Henchal and Putnak, 1990)。 衣殼蛋白(C)會包住病毒的核酸形成核衣殼核心(nucleocapsid core); 前驅膜蛋白(prM)會幫助外膜蛋白(E)摺疊與組裝,前驅膜蛋白經切割 後會形成 pr peptide 和膜蛋白(M) ,膜蛋白和外膜蛋白同為鑲嵌在病毒外 套上的蛋白質(Mukhopadhyay et al., 2005)。非結構性蛋白一般認為是參與病 毒複製、轉錄及轉譯病毒蛋白過程中的功能蛋白;NS1 是一個醣蛋白,它 參與病毒複製的功能未明(Henchal and Putnak, 1990);NS2A 對於 NS1 processing 扮演重要角色(Falgout et al., 1989);NS2B 在病毒前驅膜蛋白切割 過程中具有輔助的角色,可以幫助 NS3 作用於 NS2A/2B、NS2B/NS3、 NS3/NS4A 及 NS4B/NS5 等接合處進行切割(Falgout et al., 1991; Falgout et al., 1993)。NS4A 與 NS4B 功能未明;NS5 為一 RNA dependent RNA polymerase (Liu et al., 2002)。 在病毒複製的過程,目前最普遍的看法是:當病毒顆粒(virion)的外 膜蛋白與宿主細胞的受體(receptor)結合後,經由內胞飲作用(endocytosis) 進入宿主細胞。病毒顆粒被包在內體小泡(endosomal vesicle)的酸性環境 中,使得病毒顆粒的構形發生改變,病毒和細胞的細胞膜融合(fusion)在 一起,將病毒的 nucleocapsid 釋放到細胞質中,之後經由去外套蛋白 (uncoating)的程序使病毒的基因體(genome)釋出於細胞質中,基因體 進行轉錄、轉譯的工作,新合成的 RNA 及結構性蛋白進入到內質網的內腔 中,接著 RNA 及結構性蛋白在內質網的表面組合成未成熟且不具感染力的 病毒顆粒,細胞再將之運送到反式高爾基氏網(trans-Golgi network) ,經由 4.
(17) 宿主細胞蛋白酶修飾後,此時病毒顆粒已成熟並具感染力,此成熟的病毒 顆粒隨即經由細胞的胞泌作用(exocytosis)釋放到細胞外(Mukhopadhyay et al., 2005) (如附圖二所示) 。. 1.5 登革病毒外膜蛋白(E protein)的已知特性 E protein 有 495 個 胺 基 酸 , 分 子 量 約 60 kDa 。 它 是 一 醣 蛋 白 (glycoprotein) ,為成熟登革病毒顆粒表面上最主要的結構性蛋白,位於病 毒脂質雙層膜的外側,是一個穿膜蛋白質,在與細胞受體結合及與宿主細 胞膜融合皆扮演重要角色(Allison et al., 2001)。同時,它也是引起寄主保護 免疫的一級抗原且為病毒中和試驗中的主要抗原,故 E protein 直接地影響 著登革病毒的感染宿主範圍與細胞感染趨性(cellular tropism)(Heinz, 1986; Chiu and Yang, 2003)。 近年來,已有學者以 X-ray 繞射的方法解出登革病毒二型(DV-2)及 同為黃質病毒屬的 TBEV(tick-borne encephalitis virus)的 E protein 之結晶 結 構 , 此 解 出 的 E protein 結 構 只 包 含 位 在 脂 質 膜 外 的 蛋 白 質 部 分 (ectodomain : residues 1-395)(Rey et al., 1995; Modis et al., 2003; Zhang et al., 2004)。根據此結構,E protein 是以頭對尾(head-to-tail)的方式兩兩成 對成為雙體(dimer)模式,以一個單體(monomer)的 E protein 而言,其 膜外部分可分為三個區域(domain):domain I、domainⅡ及 domainⅢ。 Domain I 包含了第 1-51、132-192 及 280-295 的胺基酸,是 E proein 的中央 區域;domainⅡ包含了第 52-131 和 193-279 的胺基酸,負責和另外一個 E protein 形成雙體,domainⅡ的末端含有一個 fusion peptide(第 98-110 的胺 基酸)(Allison et al., 2001),fusion peptide 影響著病毒是否能夠成功感染宿 主細胞 ; 而 domain I 的另一端則與 domainⅢ接合,domainⅢ包含第 296-394 的胺基酸,是一個 immunoglobulin(Ig)-like domain,被認為是與宿主細胞 5.
(18) 之受體結合的位置,單株抗體可辨識 domainⅢ以中和病毒,阻礙病毒入侵 宿主細胞 (Thullier et al., 1999; Crill and Roehrig, 2001;Chiu and Yang, 2003; Mukhopadhyay et al., 2005)。 在中性酸鹼值的環境下,E protein 形成雙體結構,而當病毒顆粒進入 宿主細胞後,一開始病毒顆粒會被包在內體小泡(endosomal vesicle)的酸 性環境中,在酸性環境的催化下,E protein 的雙體結構(dimer)會分離成 單體(monomer)後,再聚集成三體結構(trimer)(Allison et al., 1995; Stiasny et al., 1996; Stiasny et al., 2001)。E protein 的 domainⅡ因為蛋白質構型的改 變,突出於 E protein 雙體原本構成的平面之上,促使病毒的外套膜和細胞 內膜進行膜融合。. 1.6 假型病毒顆粒(pseudotyped viral particles) 假型病毒顆粒(pseudotyped viral particles)簡言之就是其病毒顆粒成分 部分來源於一種病毒而其他部分來源於另一種病毒。因此若有相同的外膜 成分,假型病毒的感染過程和真病毒相同,故可模擬病毒感染的早期過程, 且假型病毒內可以重組基因方式使之攜帶報告基因(reporter gene) ,可以快 速方便的進行各種檢測和分析,所以假型病毒可用來研究病毒和宿主細胞 的關係。 過去的研究證明顯示反轉錄病毒(retroviruses)能夠混合組裝外來它種 病毒的醣蛋白(Ott, 1997; Sandrin et al., 2002)以及結合並表現來自無複製能 力病毒顆粒中之報告基因的能力(Negre et al., 2002),結合以上兩種特性,可 以產生能夠表現正常未修飾過之它種病毒的醣蛋白的假型病毒顆粒以利進 行生物體外的一些感染試驗分析(in vitro infection assay)(Bartosch et al., 2003)。 前人研究顯示將三個不同質體:一為帶有 HCV 外膜蛋白基因、二為帶有 6.
(19) MLV(murine leukemia virus)gag-pol 基因、三為能表現失去複製能力但帶 有 GFP 報告基因的 MLV genome 之質體──共同轉染至 293T 細胞株中可 產生出具有感染能力的假型顆粒(pseudotyped-particles)(Bartosch et al., 2003)。HCV 屬於黃質病毒科,而 MLV 屬於反轉錄病毒科,此研究證明了 不同科之病毒組合成假型病毒顆粒之可行性,又登革病毒(DV)與 HCV 同為黃質病毒科,因此本論文嘗試產生一帶有登革病毒二型外膜蛋白之小 鼠白血病病毒(MLV)。. 7.
(20) 貳、材料與方法. 2.1 實驗材料 2.1.1 菌株 Escherichia coli DH5α (Yang laboratory collection) Escherichia coli BL-21(DE3) (Yang laboratory collection) Escherichia coli NovaBlue(DE3) (Novagen). 2.1.2 細胞株 BHK-21(幼倉鼠腎臟纖維母細胞,baby hamster kidney cell) 293T(人類胚胎腎臟上皮細胞,human embryo kidney epithelial cell) C6/36(白線斑紋細胞,Aedes albopictus larva cell). 2.1.3 病毒 PL046 strain(Dengue virus type 2 Taiwan local strain) H87 strain(Dengue virus type 3 strain). 2.1.4 質體. Reference. 質體名稱. 特性. pcDNA3. 篩選標誌為 Ampicillin,並含 T7 promoter 及 Invitrogen CMV promoter. pBluescriptⅡSK(+) 篩選標誌為 Ampicillin,並含 lac promoter 及 Stratagene T7 promoter. 8.
(21) pET-30a(+). 篩選標誌為 Kanamycin,並含 T7 promoter、 Novagen His-tag 及 S-tag 序列. pET-30a(+)△5T. pET-30a(+)的 N-terminal His-tag 及 S-tag 序列 楊昀良 被切除. pcDNA3-E14. 實驗室. pcDNA3 上含 PL046 strain 的 full-length DV-2 楊昀良 E gene,其 5’端及 3’端 cloning site 為 Xho I. 實驗室. 及 Xba I pKRY1. pcDNA3 上含 PL046 strain 的 truncated DV-2. 楊昀良. (pcDNA3-tE-HAhis) E gene(a.a. 1~402),3’端並帶有 HAHis-tag, 實驗室 其 5’端及 3’端 cloning site 為 Xho I 及 Apa I pET-30a(+)-E14. pET-30a(+)上含 PL046 strain 的 full-length. 本研究. DV-2 E gene,其 5’端及 3’端 cloning site 皆為 Not I pcDNA3-His-E14. pcDNA3 上含 PL046 strain 的 full-length DV-2 本研究 E gene,5’端帶有 His-tag,其 5’端及 3’端 cloning site 皆為 Xba I. pET-30a(+)△5T-E14 pET-30a(+)△5T 上含 PL046 strain 的 full-. 本研究. length DV-2 E gene,3’端帶有 His-tag,其 5’ 端及 3’端 cloning site 為 Sac I 及 Xho I pcDNA3-D3E. pcDNA3 上含 H87 strain 的 full-length DV-3 E 本研究 gene,其 5’端及 3’端 cloning site 為 Bam H I 及 Xba I. pBAG. Retroviral vectorg 上含β-galactosidase gene. 楊昀良. 以作為 reporter gene 之用(如附圖三所示). 實驗室. 9.
(22) pMD.gagpol. 含 MuLV gag-pol gene(如附圖四所示). Ory et al., 1996. pAmpho gp85. 含 MLV amphotropic envelope gene. 楊昀良 實驗室. 2.1.5 引子. 序列 5’~3’. 引子 E14-A. TTCCTGTGTCATTTCCGACT. 位置 DV-2 (NGC; M29095) gene: 1386~1405. E14-B. TTGTGATAACACCTCACTCA. DV-2 (NGC; M29095) gene: 1352~1371. E14-C. TCTCCATGTAAGATCCCTTT. DV-2 (NGC; M29095) gene: 1927~1946. D3E-F. AAGGATCCATGAGATGTGTGGGAGTAGG AAAC. D3E-R. DV-3 (H87; M93139) gene: 935~958. GCTCTAGATTAAGCTTGCACCACGACCC. DV-3 (H87; M93130) gene: 2397~2413. E14His-F CGAGCTCATGCGTTGCATAGGAATA. DV-2 (NGC; M29095) Gene: 937~954. E14His-R TTCTCGAGGGCCTGCACCATAACT. DV-2 (NGC; M29095) gene: 2406~2421. 10.
(23) 2.1.6 藥品試劑 2.1.6.1 藥品 藥品名稱. 製造公司. 目錄編號. 應用. 1kb DNA ladder. SibEnzyme. SEM11C001. DNA 電泳. 2-propanol. Sigma. I 9516. 萃取 RNA. Acetic acid. Fluka. 33209. Western Blot. Acryl/Bis 37.5:1. AMRESCO. 0254. Western Blot. Agarose. VEGONIA. 9201-05. 核酸電泳. Ampicillin. Applichem. A0839. 細菌培養. Anti-DIG-Ab. Roche. 1 093 274. Northern Blot. APS. Bio-Rad. 161-0700. Western Blot. Blocking reagent. Roche. 1 096 176. Northern Blot. CaCl2. Riedel-de Haën. 31307. Transfection. Chloroform. Riedel-de Haën. 32211. 萃取 RNA. Coomassie Brilliant. J.T.Baker. F792-01. 蛋白質染色. Crystal Violet. Sigma. C-3886. Staining. CSPD. Roche. 1 655 884. Northern Blot. DEPC. Sigma. D 5758. Northern Blot. DIG DNA Labeling. Roche. 1 277 065. Northern Blot. DMEM. GIBCOBRL. 12800-017. 細胞培養. DMSO. Sigma. D-8418. 冷凍細胞. solution. Blue R-250. mix. 11.
(24) ECL substrate. PIERCE. 34079. Western Blot. EDTA. AMRESCO. 0105. 緩衝液. EtBr. Sigma. E-7637. Staining. Ex Tag polymerase. TaKaRa. RR001B. 質體構築. Fetal Bovine Serum. Biological. 04-001-1A. 細胞培養. 33220. 固定細胞. industries Formaldehyde. Riedel-de Haën. NorthernBlot Formamide. Riedel-de Haën. 33272. Northern Blot. G418(GENETICIN). GIBCO. 11811-031. 細胞培養. Glutaraldehyde. Fluka. 49630. 固定細胞. HEPES. J.T.Baker. 4018-01. Transfection. Hexanucleotide mix. Roche. 1 277 081. Northern Blot. IPTG. MDBio,Inc.. 105039. 細菌培養. K3Fe(CN)6. Sigma. P-3667. Staining. K4Fe(CN)6.3H2O. Sigma. P-3289. Staining. Kanamycin. Sigma. K4000. 細菌培養. Klenow enzyme. Roche. 1 008 404. Northern Blot. LB agar. Alpha Biosciences L12-111. 細菌培養. LB broth. Scharlau. 02-385. 細菌培養. Maleic acid. Fluka. 63190. Northern Blot. MEM. GIBCO. 41500-034. 細胞培養. Methanol. Mallinckrodt. 3016-08. Western Blot. 12.
(25) Methylcellulose. Sigma. M 0512. Plaque assay. MOPS. MERCK. 1.06126.0025. Northern Blot. NaCl. AMRESCO. 0241. 緩衝液. NaHCO3. Sigma. S-5761. 細胞培養. NaOH. Riedel-de Haën. 30620. 緩衝液. Nitrocellulose Transfer Schleicher&Schuell 10401396. Western Blot. Membrane PMSF. Fluka. 78830. Protein 製備. Polybrene. Sigma. H-9258. 細胞培養. Protein marker. TBB. 0901. SDS-PAGE. Restriction enzyme. TakaRa, Biolab. ─. 質體構築. SDS. Riedel-de Haën. 62862. Northern Blot Western Blot. T4 DNA ligase. Fermentas. 1812. 質體構築. TEMED. Sigma. T-9281. Western Blot. Tris(base). AMRESCO. 0826. Northern Blot Western Blot. Trypsin. GIBCO. 12605-010. 細胞培養. Tween-20. Sigma. P-1379. Northern Blot Western Blot. Urea. Fluka. SK-2644U. X-film. Midwest Scientific LA7111. Protein 製備 Northern Blot Western Blot. X-gal. MDBio,Inc.. 613049 13. Staining.
(26) β-mercaptoethanol. MERCK. 1.1543.0100. Protein 製備. 2.1.6.2 抗體 抗體名稱. 製造公司. 目錄編號. HA-probe(F-7)HRP. Santa Cruz. SC-7392. His-probe(H-3)HRP. Santa Cruz. SC-8036 HRP. BD Biosciences. 8916-1. Pierce. 31430. 6xHis Monoclonal Antibody Goat anti-mouse HRP Rabbit anti-DV-2 E domain Ⅲ polyclonal antibody. 張雯博士, 無 中研院分生所. 2.1.6.3 試劑 試劑名稱. 製造公司. 目錄編號. 應用. TRI reagent. Molecular. TR-118. 萃取 RNA. Invitrogen. K2100-07. 抽取大量質體. Premier. N-PM050. 抽取小量質體. Reseraarch Center,Inc. PureLinkTM HiPure Plasmid DNA Maxiprep Purification kit ExcelPureTM Plasmid Miniprep Purification Kit PCR Clean-up/Gel Extraction Kit Premier. 14. N-DCE050 純化 DNA.
(27) 2.1.7 溶劑及緩衝液之配方 z 0.25% Coomassive blue stain solution 2.5g Coomassive brilliant blue,50% methanol,10% acetic acid added dd H2O to 1000 ml z 0.5% crystal violet solution (500 ml) 2.5 g crystal violet,25 ml 37% formaldehyde,250 ml EtOH,4.25g NaCl z 0.5% glutaraldehyde 25% glutaraldehyde 以 1X PBS dilute z 10X MOPS Electrophoresis buffer 0.22 M MOPS (pH 7.0),20 mM sodium acetate,10 mM EDTA (pH 8.0) z 10X SDS-PAGE running buffer 0.25 M Tris base,1.92 M Glycine,1% SDS z 10X transfer buffer 39 mM Glycine,48 mM Tris base,10% SDS,20% methanol z 1X PBS (pH 7.4) 137 mM NaCl,10 mM Na2HPO4,2.7 mM KCl,1.8 mM KH2PO4 z 20X SSC buffer (pH 7.0) 3 M NaCl,300 mM sodium citrate z 2X HEPES-buffer saline (HeBS)solution (pH7.05~7.12) 0.28 M NaCl,0.05 M HEPES,1.5 mM Na2HPO4 z 2X SDS-PAGE loading buffer 0.5% bromphenol blue,0.5M Tris-HCl (pH 6.8) ,10% SDS ,100% glycerol z 5% Blocking buffer 2.5g nonfat powdered milk dissolved in 50ml 1X TBS buffer. 15.
(28) z 50X TAE buffer 48.4 g Tris base,0.5 M EDTA (pH 8.0) 20 ml,11.42 ml acetic acid added dd H2O to 200 ml z Blocking solution 1 % (w/v) blocking reagent dissolved in maleic acid buffer z Cell lysis buffer(RIPA buffer) 0.1% SDS,1% Triton X-100,1% NP-40,10 mM Tris-HCl (pH7.4),1 mM MgCl2,1 mM PMSF z Detection buffer (pH 9.5) 0.1 M Tris-Cl,0.1 M NaCl z LB (Luria-Bertani)/Ampicillin 培養基 1% tryptone,0.5% yeast extract,1% NaCl,1.5% agar,50 µg/ml Ampicillin z LB (Luria-Bertani)/Kanamycin 培養基 1% tryptone,0.5% yeast extract,1% NaCl,1.5% agar,50 µg/ml Kanamycin z LB (Luria-Bertani)培養液 1% tryptone,0.5% yeast extract,1% NaCl z Maleic acid buffer (pH 7.5) 0.1 M Maleic acid,0.15 M NaCl z Prehybridization/Hybridization solution (pH 7.0) 0.5 M sodium phosphate (pH 7.2),7% (w/v) SDS,1 mM EDTA z TBS buffer (Tris-buffered saline) 10mM Tris(pH 8.0),150 mM NaCl z TBST buffer 10mM Tris(pH 8.0),150 mM NaCl,0.05% Tween 20. 16.
(29) z Washing buffer (pH 7.5) (Northern Blot 之用) 0.1 M Maleic acid,0.15 M NaCl,0.3% (v/v) Tween 20 z X-gal staining buffer 5 mM K4Fe(CN)6.3H2O,5 mM K3Fe(CN)6,1 mM MgSO4.7H2O,1mg/ml X-gal. 2.1.8 主要儀器 -20℃直立冷凍櫃 (WHITE-WESTINGHOUSE) 4℃三門冰藏櫃 KS-101-MS (MINI KINGKON) -80℃超低溫冷凍櫃 925/926 (FORMA SCIENTIFIC) 二氧化碳培養箱 5420-0NEW (NAPCO) 水平式電泳槽 MJ-105 (MEDCLUB) 水平式震盪器 S-101 (FIRSTEK) 加熱攪拌器 PC-420 (CORNING) 半乾式電泳轉印槽 TRANS-BLOT○R SD CELL 221BR (BIO-RAD) 血球計數器(MARIEMFELD) 低溫培養箱 701 (WISOOM) 往復式恆溫水槽 B206-T1 (FIRSTEK SCIENTIFIC) 直立式電泳槽(Bio-Rad) 恆溫式震盪培養箱 S300R (FIRSTEK SCIENTIFIC) 倒立顯微鏡 CK40 (OLYMPUS) 核酸計算儀 GeneQuant pro (AMERSHAM PHARMACIA BIOTECH ) 桌上型低溫高速離心機 Centrifuge 5804 R (eppendorf) 桌上型高速離心機 5100 (KUBOTA CORPORATION) 乾燥加熱板 VH-01 (VIOLET BIO SCIENCE) 17.
(30) 無菌操作台(Laminar flow)VCM-420 (造鑫) 程式溫度控制儀 PTC-100TM (MJ RESEARCH INC.) 微量離心機 MICRO 240A (DENVILLE SCIENTIFIC INC.) 落地型高速離心機 Avanti○R J-E Centrifuge (BECKMAN) 電子天秤 PB153-S (METTLER TOLEDO) 電子防潮箱 DX106 (台灣防潮科技) 電泳影像處理系統 GEL DOC 2000 (BIO-RAD) 酸鹼值檢測計 Φ360 (BECKMAN) 數位相機 C-5050Z (OLYMPUS) 震盪器 VORTEX-GENIE2 G560 (SCIENTIFIC INDUSTRICS). 2.2 實驗方法. 2.2.1 大腸桿菌勝任細胞(Competent cell)的製備 首先取Escherichia coli 之單一菌落培養於 5 ml的LB培養液,於 37℃下 震盪培養(160 rpm/min)過夜後,取 2 ml的菌液轉養於 50 ml的LB培養液 中,繼續於 37℃下震盪培養(160 rpm/min),直到OD600nm 介於 0.4 到 0.6 之間。將培養好的菌液轉移至 50 ml離心管中,置於冰上 20 分鐘,之後在 4 ℃下以 3000 rpm離心 10 分鐘後倒去上清液,接著以 25 ml 4℃預冷的 0.1 M CaCl2懸浮菌體,置於冰上 30 分鐘,在 4℃下以 2000 rpm離心 10 分鐘後去 除上清液,以 5 ml 4℃預冷的 0.1 M CaCl2懸浮菌體,於 4℃靜置 18 小時, 在 4℃下以 2000 rpm離心 5 分鐘後去除上清液,以 5 ml預冷的 0.05 M CaCl2 (含 15% Glycerol)懸浮菌體。將菌液以每管 100 µl分裝至預冷好的微量離 心管中,迅速儲存於-80℃冰箱備用。 18.
(31) 2.2.2 大腸桿菌轉形作用(transformation) 將儲存於-80℃的勝任細胞取出置於冰上解凍後,加入0.1~1 µg的質體 DNA充分混合,置於冰上25分鐘,再置於42℃水浴中進行熱休克(heat shock)1分鐘,之後加入 500 µl 的LB培養液於37℃震盪培養(160 rpm/min) 1小時,取 100 µl 的菌液均勻塗布於含Ampicillin(50 µg/ml)之LB培養基 上,置於37℃恆溫箱中培養12~16小時。. 2.2.3 小量質體 DNA 萃取 使用ExcelPureTM Plasmid Miniprep Purification Kit (PREMIER)抽取並 純化E. coli之質體DNA。操作流程如下:先將菌接種於 5 ml 的LB培養液、 37℃培養 12~16 小時,於室溫 2500 rpm離心 12 分鐘以去除上清液,加入 200 µl SolutionⅠBuffer懸浮菌體並移置微量離心管中,取 200µl SolutionⅡ Buffer緩和地混合均勻後,加入 200 µl SolutionⅢBuffer再次緩和地混合均 勻,在室溫下以 13000 rpm離心 5 分鐘離下菌體,取上層液至Mini-MTM Column,在室溫下以 13000 rpm離心 1 分鐘,倒掉收集管內液體,加入 700 µl Washing buffer,在室溫下以 13000 rpm離心 1 分鐘,倒掉收集管內液體, 加入 700 µl Washing buffer,在室溫下以 13000 rpm離心 1 分鐘,倒掉收集管 內液體,再以室溫 13000 rpm離心 3 分鐘,將Mini-MTM Column移至新微量 離心管,於 60℃的烘箱中 5 分鐘把多餘的酒精去除,最後以 30~50 µl二次 無菌水加入Mini-MTM Column中,以室溫 13000 rpm離心 1 分鐘後,將製備 好的質體DNA儲存於-20℃。 【附錄一】 。. 2.2.4 大量質體 DNA 萃取 使 用 PureLinkTM HiPure Plasmid DNA Maxiprep Purification kit 19.
(32) (Invitrogen)抽取並純化E.coli之質體DNA。操作流程大致如下:先將菌接 種於 500 ml 的LB培養液、37℃培養至OD600nm 介於 1.0 到 1.5 之間,於室 溫 4000 rpm離心 10 分鐘以去除上清液,加入 10 ml Resuspension Buffer懸浮 菌體並移置高速離心管中,加入 10 ml Lysis Buffer緩和地混合均勻後,於室 溫下靜置 5 分鐘後,加入 10 ml Precipitation Buffer再次緩和地混合均勻,在 室溫下以 12000 g離心 10 分鐘離下菌體,取上層液至Equilibrated Column, 在室溫下利用重力讓溶液全部自然流下後,加入 60 ml Wash Buffer,利用重 力讓其慢慢自然流下,將Equilibrated Column移至新的離心管,加入 15 ml Elution Buffer,利用重力讓其自然流下後,加入 10.5 ml isopropanol至所得 之elute DNA溶液中並混合均勻,在 4℃下以 15000 g離心 30 分鐘,移除上 清液,加入 5 ml 70% ethanol懸浮pellet,在 4℃下以 14000 rpm離心 5 分鐘, 移除上清液,將離心管的蓋子打開,斜放置於室溫下 10 分鐘以去除多餘的 酒精,最後加入 500 µl TE Buffer懸浮pellet,將製備好的質體DNA儲存於 -20℃。 【附錄二】 。. 2.2.5 限制酵素反應 為製備實驗所需的 DNA 片段,取適量 DNA(約 0.5~10 µg;視反應需 要)到適量反應體積(20 µl)以限制酵素切割(Sambrook et al, 1989)(酵 素的用量及反應溫度、時間都依照廠商所提供的條件資料進行),反應完 後,利用洋菜膠體電泳分析。所需的 DNA 片段在經限制酵素切割後,視需 要以 PREMIER 之 Gel Extraction Kit 或 PCR Clean-up Kit 來純化 DNA 並去 除限制酵素及鹽類。. 2.2.6 萃取洋菜膠內之 DNA 片段 使用Gel Extraction Kit(PREMIER)萃取出洋菜膠內之DNA片段。操作流 20.
(33) 程如下:將切下之洋菜膠(約 50-200 mg),置於微量離心管內,加入 500 µl Binding Solution,60℃加熱至完全溶解後,將混合液移至Gel-MTM Column, 以室溫 13000 rpm離心 1 分鐘,倒掉收集管內液體,加入 700 µl Washing Buffer,以室溫 13000 rpm離心 1 分鐘,倒掉收集管內液體,再加入 700 µl Washing Buffer,以室溫 13000 rpm離心 1 分鐘,倒掉收集管內液體,再以 室溫 13000 rpm離心 3 分鐘,將Gel-MTM Column移至新微量離心管,於 55~60 ℃的烘箱中 5 分鐘把多餘的酒精去除,再加入 30 µl二次無菌水於Gel-MTM Column中,以室溫 13000 rpm離心 1 分鐘後,將萃取出之DNA儲存於-20℃。 【附錄三】。. 2.2.7 重組 E 蛋白在大腸桿菌之誘導表現 將 建 構 好 的 pcDNA3-E14 及 pET-30a(+)-E14 質 體 轉 形 於 大 腸 桿 菌 BL21(DE3) 或 NovaBlue(DE3) , 隔 天 挑 單 一 菌 落 於 含 有 Ampicillin 或 Kanamycin(50 µg/ml)之LB培養液中於 37℃培養箱震盪培養,隔夜後,取 1/100 之菌液於 5 ml的LB培養液並於 37℃培養箱震盪培養,至OD600nm介於 0.6 到 0.8 之間時,加入 1 mM IPTG誘導基因表現四小時。. 2.2.8 大腸桿菌蛋白質之萃取 大腸桿菌經 IPTG 誘導表現後,於室溫下以 2500 rpm 離心 12 分鐘後 去除上清液,接著取 200 µl 的 1M Tris-HCl(pH8.0)懸浮菌體並移置微量 離心管中,以 13000 rpm 離心 3 分鐘後去除上清液,將此菌體之微量離心 管於液態氮及 42℃恆溫水槽中來回反覆處理 5~6 次,每次 2 分鐘,以打破 細胞。然後再取 200 µl 1M Tris-HCl(pH8.0)懸浮,在 4℃下以 13000 rpm 離心 5 分鐘後,取上清液至另一微量離心管中。最後將 pellet 與上清液加入 適量的 2X SDS-PAGE loading dye(含 200 mM β-mercaptoethanol 及 8M 21.
(34) Urea)混合均勻,於室溫放置 30 分鐘以上後,即可用於 run gel 或儲存於-20 ℃備用。. 2.2.9 哺乳動物細胞蛋白質之萃取 將細胞的培養液移除,以 1X PBS 清洗細胞一次後,用細胞刮勺(cell scraper)刮下細胞後,用 1X PBS 沖洗細胞並將細胞懸浮液移至離心管,在 4℃下以 1000 rpm 離心 10 分鐘,去除上清液後,加入 100 ~ 200 µl 含有 1 mM PMSF 之 RIPA buffer(成分見 2.1.7)與細胞混合均勻以溶解細胞,接 著於 4℃下以 13000 rpm 離心 5 分鐘後,取上清液至另一微量離心管中。最 後將細胞殘骸與上清液加入適量的 2X SDS-PAGE loading dye (含 200 mM β-mercaptoethanol 及 8M Urea)混合均勻,於室溫放置 30 分鐘以上後,即 可用於 run gel 或儲存於-20℃備用。. 2.2.10 以 SDS-PAGE 分析並以 Coomassie blue staining 及西方轉漬分析 (Western blot analysis)偵測蛋白質表現. 2.2.10.1 SDS-PAGE 電泳 首先配製下層 12% resolving gel,室溫靜置 1 小時,膠凝後再配製上層 4% stacking gel,室溫靜置 30 分鐘,待膠體硬化後移至 Mini-Protein 電泳槽 (Bio-Rad) ,加入 SDS-PAGE running buffer,接著將樣品以微量吸管置入膠 體之孔洞中,先以 120 伏特 15 分鐘,待樣品均成一直線後,再以 100 伏特 電泳 2 小時,直到 protein marker 的 24 kDa 跑到底部位置。. 2.2.10.2 Coomassie blue staining 將 SDS-PAGE 膠體直接浸泡於 0.25% Coomassie blue staining solution 22.
(35) (0.25% Coomassive brilliant blue,50% methanol,10% acetic acid)染 1 小 時,再以 Destain solution(30% methanol,10% acetic acid)褪染膠體直到 結果顯現後,以清水清洗膠體數次,取玻璃紙濕貼於玻璃上,放上膠體, 蓋上玻璃紙,完全包裹並用夾子固定,待完全乾燥後即可保存。. 2.2.10.3 西方轉漬分析(Western blot analysis) SDS-PAGE膠體電泳完成後,利用TRANS-BLOT ○R SD CELL 221BR (Bio-Rad) 0.09 安培 40 分鐘,使膠體上的protein轉漬至醋酸纖維膜 (nitrocellulose membrane,PROTRAN,Schleicher& Schuell),把膜置入 20~25 ml Blocking buffer(5% skim milk in 1X TBS buffer)於室溫下平面震 盪 1 小時後,再加入稀釋 1/1000 倍的Anti-His 結合HRP之抗體(SC-8036 HRP,Santa Cruz)於 Blocking buffer 中於室溫下平面震盪 1 小時以偵測有 His標誌的蛋白,而Blocking buffer中Anti-His之抗體最終濃度為 0.2µg/ml, 之後再以 20 ml之 1X TBST buffer於室溫下平面震盪 5 分鐘 3 次,最後將 700 µl之 ECL substrate (PIERCE)均勻地加到膜上,在暗房內以X光底片進行壓 片,感光適當時間後,取出底片沖洗顯像。首先,用夾子將底片浸入顯影 液(developer)中搖晃約 30 秒後,將底片換到清水中漂洗底片約 30 秒, 接著將底片浸入定影液(fixer)中搖晃約 1 分鐘,最後以大量的流動水清洗 底片,將底片晾乾保存。. 2.2.11 細胞培養(cell culture) BHK-21 cell培養於添加 5%FBS(Fetal Bovine Serum)與0.22%碳酸氫鈉的 MEM(Minimum Essential Medium; Gibco)培養液中。 293T cell培養於添加 10%FBS 與 0.22%碳酸氫鈉的MEM培養液中。 C6/36 cell 培養於添加 10%FBS 與 0.22%碳酸氫鈉的 MEM 培養液中。 23.
(36) 以上這些細胞除了C6/36細胞株置於28℃培養箱外,其餘皆置於37℃、5% CO2及飽和溼度之恆溫培養箱中進行培養。並視該細胞株之生長速度,以不 同稀釋倍數,不同時間間隔做細胞繼代培養。. 2.2.12 細胞株轉染(Transfection) 本研究轉染方式採用碳酸鈣(Calcium Phosphate)法作細胞株轉染,將 細胞種於培養皿,使其達到約70%的滿度。以 3.5 cm 培養盤為例,將 4 µg 的質體DNA,加入25 µl 的2 M CaCl2,加滅菌二次水補至總體積250 µl,充 分 混 和 。 接 著 將 此 混 和 溶 液 逐 滴 慢 慢 加 入 裝 有 250 µl 2X HeBS (HEPES-buffered saline: 0.28 M NaCl,0.05 M HEPES,1.5 mM Na2HPO4) 溶液的試管中,在加入過程中,並以pasteur pipet在 2X HeBS 中打氣,最 後vortex 5秒鐘使其充分混合後,於室溫下靜置20分鐘。將上述DNA/磷酸鈣 複合物平均滴入細胞培養盤中,充分混合均勻後,於37℃細胞培養箱中培 養16~18小時後,更換新鮮的培養液,繼續於37℃細胞培養箱中培養,每2~3 天更換一次新鮮的培養液。. 2.2.13 細胞株 RNA 萃取(RNA extraction) 以 3.5 cm細胞培養盤為列,吸去細胞培養液,以1 X PBS清洗細胞一次 後,加入1 ml的TRI reagent,以pipette抽吸細胞數次,使細胞和TRI reagent 充分均質化,將溶液轉移至微量離心管內,於室溫下靜置 5 分鐘,然後在 室溫下加入 200 µl chloroform,以手搖方式充份混合均勻,於室溫下靜置15 分鐘後,在 4℃下以 12,000 rpm 離心 15 分鐘後,去除下層液,將上清液 吸取到另一乾淨微量離心管內,加入 600 µl isopropanol 及 40 µl 3 M sodium acetate(pH 5.2),於室溫下靜置 8 分鐘,此目的在於沉澱RNA。 然後於 4 ℃下以 12,000 rpm 離心 8 分鐘,吸去上清液後留下 RNA 沉澱 24.
(37) 物,加入 1 ml已於4℃預冷之75%冰乙醇充分懸浮RNA沉澱物後,於 4 ℃ 以 7500 rpm 離心 5 分鐘,用微量吸管吸掉上清液後,將微量離心管的蓋 子打開,斜放置於室溫下10分鐘以去除多餘的酒精,最後加入適量的 DEPC-treated ddH2O 將RNA沉澱物溶解,測定 OD260 及 OD280 吸光值, 確定 RNA 的濃度及純度。剩餘之 RNA 樣本儲存於 -80℃冰箱內保存。. 2.2.14 北方轉漬分析(Northern blot analysis) 2.2.14.1 製備 DNA 探針 (DNA probe labeling) 使用 Roche 廠商產品 DIG system(Cat.No.1175033),以 digoxigenin11-dUTP(DIG)標記 DNA,取欲標記的 DNA 15 µl(約 10-30 ng)置於微 量離心管中,於 95℃加熱 10 分鐘後迅速置於冰上 5 分鐘,然後加入 2 µl 的 hexanucleotide、2 µl 的 10X dNTP labeling mixture 及 1 µl 的 Klenow enzyme(100 unit/ml),在 37℃水浴槽中反應 20 小時後,最後加入 2 µl 的 0.2 M EDTA 並於 65℃加熱 10 分鐘作終止反應,製備完成之 DNA 探針儲存 於-20℃備用。. 2.2.14.2 轉漬 RNA (transfer) 首 先 進 行 1.2 % 洋 菜 膠 配 製 , 秤 取 0.6 g 的 agarose 於 36 ml 的 DEPC-treated H2O中,微波加熱溶解,待稍微冷卻後加入 5 ml 的 10X MOPS 及 9 ml的甲醛(formaldehyde)混合均勻並製成膠體。而RNA樣品進行電泳 前 之 處 理 : 將 12 µg 的 RNA 、 3.5 µl 的 10X MOPS 、 5 µl 的 37% formaldehyde、10 µl 的formamide、3 µl 的dye以及 1 µl 的 10 mg/liter ethidium bromide分別加入微量離心管內並充分混合均勻,於 65℃加熱 10 分鐘後置於冰上 5 分鐘。將處理好之RNA樣品以微量吸管置入洋菜膠之孔 洞中,以 50 伏特之電壓進行RNA電泳 70 分鐘,電泳結束後,在電泳影像 25.
(38) 處理系統照相,之後將膠體浸泡於 50ml的 10X SSC中 20 分鐘,接著進行轉 漬。主要原理為利用毛細現象之原理,引導 10X SSC溶液向上流動,進而 帶動膠體中的RNA脫離膠體,吸附於耐龍膜(nylon membrane)上進行轉漬。 其步驟如下:剪裁適當於膠體大小的Whatman 3MM濾紙及耐龍膜(先於 10X SSC溶液浸泡) ,依濾紙、洋菜膠、耐龍膜及Whatman 3MM濾紙之順序堆置, 並於最上層放置壓瓶。經 14-16 小時後,取出耐龍膜,於核酸快速固定儀中, 利用UV光(254 nm; 120 joules)照射二次作cross-link將RNA固定於耐龍膜 上。. 2.2.14.3 雜交反應(hybridization) 將耐龍膜放置在含 12 ml 的 prehybridization buffer 之培養皿,於 45℃ 平面震盪 3 小時,之後將耐龍膜移至含標記探針的 12 ml 的 hybridization buffer 之培養皿中(探針濃度 50 ng/ml) ,於 45℃平面震盪 18 小時後,將耐 龍膜以 50 ml 的 2X Washing solution(2X SSC buffer,0.1% SDS),於室溫 下平面震盪 20 分鐘,再以 50 ml 的 0.5X Washing solution(0.5X SSC buffer, 0.1% SDS),於 60℃平面震盪 20 分鐘。. 2.2.14.4 免疫偵測 (Immunological detection) 耐龍膜以 50 ml 的 Washing buffer 於室溫下平面震盪 20 分鐘兩次後, 以 25 ml 的 Blocking buffer(Roche Blocking reagent (Cat.No.1096176))平面 震 盪 30 分 鐘 後 , 以 15 ml 的 Antibody buffer ( Roche Anti-DIG-AP (Cat.No.1093274))平面震盪 30 分鐘,之後以 50 ml 的 Washing buffer 於室 溫下平面震盪 20 分鐘兩次,再以 30 ml 的 Detection buffer 於室溫下平面震 盪 5 分鐘,最後將耐龍膜放置於投影片夾層,取 10 µl 的 CSPD(Roche Cat.No.1655884)加入於 1 ml 的 Detection buffer 中,將混合液均勻地加到 26.
(39) 耐龍膜上,於 37℃避光反應 20 分鐘後,在暗房內以 X 光底片進行壓片, 經過適當時間曝光後,取出底片沖洗顯像。. 2.2.15 穩定轉染細胞的篩選(selection of stable transfected cells) 將 pcDNA3 與 pcDNA3-E14 質體分別轉染至 BHK-21 細胞株中,置於 37℃培養箱培養 48 小時後,吸去培養液,以胰蛋白酉每(trypsin)打下細胞, 留下 1/500 的細胞至 6 cm 細胞培養盤中培養,同時 BHK-21 之細胞培養基 置換為含有 600 µg/ml G418 的細胞培養液,如此培養十天後,若有轉染成 功的細胞會逐漸生長形成成簇的細胞落,如果沒有則是會逐漸萎縮死亡。 接著將單一細胞所形成的細胞落以胰蛋白酉每(trypsin)打下,置於 24 well 細 胞培養盤中,繼續於含有 600 µg/ml G418 的細胞培養液培養且平均每四天 更換一次培養液,直到細胞長滿整個 well 時,將細胞打下,移至 6 cm 細胞 培養盤進行擴增培養,G418 的濃度則降至 200 µg/ml 以維持篩選作用,篩 選所得之細胞株則可進行其他實驗。. 2.2.16 登革病毒的增殖(Amplification of Dengue virus) 將登革病毒 PL046 strain 以 MOI(multiplicity of infection)= 0.1感染 C6/36細胞。將適量的病毒與細胞均勻混合於 1 ml的培養液中,培養於 37 ℃培養箱,使病毒吸附細胞 2 小時後,充分使細胞懸浮後,將之移到 T75 flask(Falcon)中,再加入 9 ml 的培養液繼續培養於 28℃培養箱,於感 染後六至八天收集病毒上清液,將之通過 0.22 µm 的 filter 使細胞殘渣過 濾掉,最後將病毒上清液分裝到 1.5 ml 的eppendof 中,冷凍保存於 -80℃ 備用。. 2.2.17 溶斑試驗(plaque assay) 27.
(40) 待 6 well 細胞培養盤中之BHK-21細胞已長滿至約七~八分滿時,吸掉 培養液,以不含血清的培養液(serum-free MEM)清洗細胞一次後,分別 加入已經連續稀釋十倍的病毒懸浮液 450 µl,前後左右搖晃一下培養盤使 病毒均勻分布,將培養盤置入 37℃、5% CO2 細胞培養箱使病毒吸附 2 小 時之後,每個 well 加入 4 ml 含 1.1% 的methyl cellulose的維持培養基(含 5% FBS之MEM medium)後,再置入37℃、5% CO2 細胞培養箱培養五至六 天。經倒立顯微鏡觀察,確定溶斑已經形成後,吸去大部分培養基,加入 3.7% formaldehyde 固定15分鐘,然後吸去溶液,加入足可覆蓋的 0.5% 的 結晶紫溶液(crystal violet solution)染色一小時後,以水沖淨,待風乾即可 計算溶斑(plaque)的數目,換算病毒效價以 PFU/ml(plaque forming unit/ml) 來表示之。. 2.2.18 共同轉染(co-transfection)到哺乳動物細胞株 將含有gag-pol gene的pMD.gagpol質體、含有β-galactosidase gene的 pBAG 質 體 以 及 含 有 病 毒 外 膜 蛋 白 的 表 現 質 體 ( 如 : pcDNA3-E14 、 pcDNA3-D3E、pAmpho gp85)以calcium phosphate transfection的方法共同 轉染到 293T細胞株中。於轉染前一天,先培養 2.5×106 之 293T細胞於 10 cm 的細胞培養盤中,轉染當天,依前述 2.2.12 之方法將上述三種質體分別各 取 7 µg共同轉染至 293T細胞中,轉染 16 小時後,更換新鮮培養液,於開 始轉染 40 小時後,以針筒收集一半(4.5 ml)的細胞培養液,接著將所收集的 細胞培養液以 0.45 µm的filter過濾後備用,並同時補加入 4.5 ml的新鮮培養 液於原本的 10 cm細胞培養盤中,繼續於 37℃細胞培養箱中培養,於開始 轉染 64 小時、88 小時後分別同上述方法收集細胞培養液備用。. 2.2.19 測試假型病毒顆粒(pseudotyped viral particles)的效價 28.
(41) 將上述 2.2.18 方法中最後過濾好之細胞培養液分別取 1 ml ,並同時與 1 ml 的新鮮培養液混合均勻後加到 BHK21 的目標細胞(target cell)中,於 37℃二氧化碳培養箱中培養 48 小時後,進行 X-gal staining 以測試假型病毒 顆粒之效價(titer)。. 2.2.20 利用病毒提供外膜蛋白以產生假型病毒顆粒 將含有gag-pol gene的pMD.gagpol質體及含有β-galactosidase gene的 pBAG質體以calcium phosphate transfection的方法共同轉染到BHK21 或 293T細胞株中。於轉染前一天,先培養 3×105 之BHK21 細胞或 6×105之 293T 細胞於 3.5cm 的細胞培養盤中,轉染當天,依前述 2.2.12 之方法將上述兩 種質體各取 3 µg共同轉染至BHK21 或 293T細胞中,轉染 16 小時後,更換 新鮮培養液並分別感染MOI=0、1、3 之DV-2,於開始轉染 48、72、96 小 時後,以針筒收集細胞培養液,接著將所收集的細胞培養液以 0.45 µm的filter 過濾後,依上述 2.2.19 方法將過濾好之細胞培養液分別加到BHK21 的目標 細胞中,以測試效價。. 2.2.21 X-gal staining 將細胞的培養液移除,以 1X PBS 清洗細胞一次後,加入適量之 0.5% glutaraldehyde 於室溫下靜置 15 分鐘以將細胞固定,再以 1X PBS 清洗細胞 三次,每次 3~5 分鐘,最後加入適量新鮮配製的 X-gal staining solution(成 分見 2.1.7)於 37℃培養箱靜置 2~16 小時,即可觀察細胞染色結果。. 29.
(42) 參、結 果. 3.1 pcDNA3-E14 之定序及序列比對 將實驗室已建構好的質體 pcDNA3-E14【附圖五】定序。此質體為以 pcDNA3 為骨架,所含的 insert 為 Dengue virus 2 之 PL046 strain(DV-2 PL046)全長大小 1485 bp 之 E gene 片段。其 5’端及 3’端有藉由 PCR 引入 之 cloning sites:Xho I 及 Xba I。利用 T7 primer、SP6 primer 及實驗室設計 之 primer E14-A、E14-B 與 E14-C,將 insert 予以定序。將定序完之序列組 裝及分析,同時與 NCBI 所發表之 DV-2 New Guinea-C strain(M29095)序 列互相比對【圖一】,發現在 PL046 與 NGC 有九個鹼基不同,突變之鹼基 位置分別於 1075、1093、1099、1149、1255、1282、2140、2297 及 2356, 而鹼基對應的胺基酸位置分別為 E protein 的第 47、53、55、71、107、116、 402、454 及 474 個胺基酸,其中第 107 個胺基酸突變為 silent mutation,其 餘八個胺基酸突變則會造成胺基酸的改變。此結果與先前 2003 年期刊發表 之 Taiwan local strain PL046 的 E gene(Chiu and Yang, 2003)序列比對結果【附 表一】是相符合的。. 3.2 pET-30a(+)-E14 質體之建構 建構一在 pET-30a(+)上含 PL046 strain 的 full-length DV-2 E gene 之質 體,使其表達之 E protein 的 N 端帶有 His-tag。使用限制酵素 EcoRV、Xba I 將上述 DV-2 PL046 所含之 E gene 片段從 pcDNA3-E14 切出,再將此序列 選殖於 pBluescript II SK(+)載體上之 Eco RV、Xba I 切位,所得到之質體命 名為 pBluescript II SK(+)-E14,其 insert 的 5’端之 EcoRV 切位後面有一 Not I 切位,又 insert 的 3’尾端之 Xba I 切位後面為 pBluescript II SK(+) vector 上的 Not I 切位,接著使用限制酵素 Not I 將 E gene 片段從 pBluescript II 30.
(43) SK(+)-E14 載體切出,再將此序列選殖於 pET-30a(+)上,並以限制酵素 EcoRI 確 認 insert 為 正 接 方 向 【 圖 七 –(B) 】, 最 後 所 得 到 之 質 體 命 名 為 pET-30a(+)-E14,此質體建構之示意圖於【圖二】。. 3.3 pcDNA3-His-E14 質體之建構 建構一在 pcDNA3 上含 PL046 strain 的 full-length DV-2 E gene 之質體, 使其表達之 E protein 的 N 端帶有 His-tag。使用限制酵素 Xba I 將 5’端帶有 His-tag 之 DV-2 PL046 E gene 片段從 pET-30a(+)-E14 切出,再將此序列選殖 於 pcDNA3 上,並以限制酵素 HindⅢ確認 insert 為正接方向【圖八-(B)】 , 最後所得到之質體命名為 pcDNA3-His-E14,此質體建構之示意圖於【圖 三】 。. 3.4 pET-30a(+)△5T-E14 質體之建構 建構一 pET-30a(+)△5T 上含 PL046 strain 的 full- length DV-2 E gene 之 質體,使其表達之 E protein 的 C 端帶有 His-tag。利用 PCR 反應方法以實 驗室已有之 cDNA clones 為模板(template)得到 dengue virus 2 (DV-2) 之 full-length E gene 片段,並分別在 5’端引入 Sac I 切位及在 3’端引入 Xho I 切位,以協助之後 E gene 能選殖於 pET-30a(+)△5T 載體,最後所得到之質 體命名為 pET-30a(+)△5T-E14,此質體建構之示意圖於【圖四】。. 3.5 pcDNA3-D3E 質體之建構 建構一 pcDNA3 上含 H87 strain 的 full-length DV-3 E gene 之質體。利 用 PCR 反應方法以實驗室已有之 cDNA clones 為模板(template)得到 dengue virus 3 (DV-3)之 full-length E gene 片段,並分別在 5’端引入 BamH I 切位 及在 3’端引入 Xba I 切位及轉譯終止密碼 TAA,以協助之後 E gene 能選殖 31.
數據
相關文件
Initially, in closed shock tube, water column moves at u = 1 from left to right, yielding air compression at right. & air expansion
Murphy.Woodward.Stoltzfus.. 17) The pressure exerted by a column of liquid is equal to the product of the height of the column times the gravitational constant times the density of
The novel coronavirus outbreak has drawn increased international attention as the virus quickly spreads across the world..
In conclusion, we have shown that the ISHE is accompanied by the intrinsic orbital- angular-momentum Hall effect so that the total angular momenttum spin current is zero in a
Complete gauge invariant decomposition of the nucleon spin now available in QCD, even at the density level. OAM—Holy grail in
S15 Expectation value of the total spin-squared operator h ˆ S 2 i for the ground state of cationic n-PP as a function of the chain length, calculated using KS-DFT with various
of the spin polarisation L. Bocher et al. submitted (2011).. Mapping plasmons and EM fields Mapping plasmons and EM fields.. New possibilities for studying the low
Quantum point contacts & Spin injection. QPC spin injection through