天麻對kainic acid誘發Sprague-Dawley 大鼠癲癇發作的神經保護作用;The neuroprotection of Gastrodia elata on epileptic seizures induced by kainic acid in Sprague-Dawley rats
全文
(2) 目錄 第一章 前言 ·········································································· 1 1-1 癲癇的流行病學及病理·············································································1 1-2 癲癇的現況況及瓶頸·················································································1 1-3 kainic acid(KA, 紅藻胺酸)誘發大鼠癲癇發作模型之研究·················2 1-4 天麻(Gastrodia elata BL, GE)抗癲癇作用的研究 ·····································2 1-5 本研究的目的·····························································································3. 第二章 文獻探討 ·································································· 4 2-1 傳統中醫對癲癇的認識·············································································4 2-2 天麻的源流與運用·····················································································6 2-3 天麻抗癲癇的藥理研究·············································································7 2-4 KA 誘發神經損傷的研究 ···········································································8 2-5 神經損傷、壞死及細胞凋亡 ···································································10 2-6 神經細胞標記及凋亡指標 ·······································································13. 第三章 材料與方法 ···························································· 15 3-1 實驗動物 ··································································································15 3-2 藥物的製備及給藥方式···········································································15 3-2-1 天麻的製備及給藥方式···································································15 3-2-2 Valproic acid(VA)的製備及給藥方式········································16 3-3 實驗試劑及儀器·······················································································16 3-3-1 實驗藥物 ··························································································16 3-3-2 實驗試劑 ·························································································16 3-3-3 實驗抗體 ·························································································17 3-3-4 實驗儀器 ··························································································17 3-4 實驗分組 ··································································································18 3-5 KA 誘發癲癇發作動物模型之建立 ·························································18 3-5-1 KA 腦內注射注射············································································18 3-5-2 記錄電極之裝置··············································································19 3-5-3 腦波及肌電圖之記錄及行為觀察 ···················································19 3-6 腦組織之製備···························································································20 3-7 Hematoxylin-eosin staining(HE,蘇木素伊紅染色法) ·······················20 3-7-1 HE 染色之步驟 ················································································20 3-7-2 組織切片之觀察··············································································21 3-8 免疫組織化學染色(Immmunohistochemistry staining) ····························21 ii.
(3) 3-8-1 免疫組織化學染色之操作······························································21 3-8-2 免疫組織化學染色之觀察······························································22 3-9 Apoptotic cell 的觀察 ·············································································22 3-9-1 TUNEL 染色法(Terminal deoxynucleotidyl transferase -mediated dUTP-biotin nick end labeling)之操作 ····················································22 3-9-2 TUNEL 染色法之觀察····································································23 3-10 NeuN 免疫螢光染色 ···············································································24 3-10-1 免疫螢光染色(Immunofluoroscent staining)操作 ···················24 3-10-2 免疫螢光染色之觀察····································································24 3-11 Fluoro-Jade B 染色法 ·············································································24 3-12 統計分析方法··························································································25. 第四章 結果 ········································································ 26 4-1 KA 誘發大鼠癲癇發作行為及腦波的變化··········································26 4-2 天麻對 KA 誘發大鼠癲癇發作之海馬區病理變化之效應 ····················26 4-2-1 HE 染色下之觀察: ········································································26 4-2-2 TUNEL 染色下之觀察·····································································27 4-2-3 NeuN 染色下之觀察 ········································································27 4-2-4 FJB 染色下的觀察 ···········································································27. 第五章 討論 ········································································ 37 第六章 結論 ········································································ 39 參考文獻 ·················································································· 40 英文摘要 ·················································································· 46. iii.
(4) 圖目錄 圖 4-1-1 KA 誘發大鼠癲癇發作之行為與腦波的變化··················· 28 圖 4-2-1-1 Sprague-Dawley 大鼠正常海馬迴之 hematoxylin-eosin 染色 圖 ························································································ 29 圖 4-2-1-2 天麻對 KA 誘發癲癇發作大鼠海馬區域型態上的效用··· 30 圖 4-2-1-3 天麻對 KA 誘發癲癇發作大鼠海馬 CA3 神經細胞的效應 ················································································································ 31 圖 4-2-2-1 天麻對 KA 誘發癲癇發作大鼠海馬 CA3 區細胞凋亡之效應 ················································································································ 32 圖 4-2-2-2 天麻對 KA 誘發癲癇發作大鼠海馬 CA3 區細胞凋亡之效應 ················································································································ 33 圖 4-2-3-1 天麻對 KA 誘發癲癇發作大鼠海馬區 NeuN 免疫染色陽性 細胞之效應········································································· 34 圖 4-2-3-2 天麻對 KA 誘發癲癇發作大鼠海馬區 NeuN 及 FJB 免疫染 色陽性細胞之效應····························································· 35 圖 4-2-4-1 天麻對 KA 誘發癲癇發作大鼠海馬區 FJB 染色陽性細胞之 效應 ···················································································· 36. iv.
(5) 天麻對 kainic acid 誘發 Sprague-Dawley 大鼠癲癇發作的 神經保護作用 研究生:徐維聰 指導教授:謝慶良博士 單位:中國醫藥大學中國醫學研究所 我們實驗室先前研究的結果已知天麻(Gastrodia elata BL)在. Sprague-Dawley(SD)大鼠能減少 kainic acid (KA)誘發的癲癇發作, 以及減少細胞凋亡和抑制 microglia 的活化,天麻的抗癲癇作用與自 由基生成的抑制和清除有關。因此本研究的目的是探討天麻的神經保 護作用。我們於 SD 大鼠的海馬區注射 KA(0.5 μg/μl)誘發癲癇的發 作,利用行為觀察和及腦波肌電圖記錄確定癲癇發作。癲癇發作後的 4hrs 開始餵食天麻四天,並以 valproic acid(VA, 250 mg/kg)做對照。 最後將大鼠犧牲取腦做成切片,利用蘇木素伊紅染色、TUNEL 染色、 NeuN 免疫及 FJB 螢光染色觀察大鼠海馬區的變化。結果顯示發現天 麻和 VA 組比控制組海馬區的形態完整,TUNEL 染色陽性細胞較少。 天麻治療組 NeuN 免疫染色陽性細胞比控制組多。而 FJB 螢光染色陽 性細胞較少,但沒有達到統計上意義。 . KA 誘發癲癇發作後餵食天麻與控制組相較,海馬 CA3 形態. 較完整,細胞凋亡較少,神經細胞存活較多,因此推論天麻有神經保 護作用,至於機制需要進一步的研究。. 1.
(6) 關鍵字:天麻,kainic acid,海馬注射,NeuN 免疫染色,TUNEL 染 色, FJB 免疫染色. 2.
(7) 第一章 前言 1-1 癲癇的流行病學及病理 據統計癲癇的發生率在已開發國家中,每 10 萬人約 50 人,而盛行率為每千人約 4-10 人 1, 2,而老人與小孩族群有較高 的發生率及盛行率 3。此外,癲癇重積狀態(status epilepticus) 在美國維吉尼亞州大約每年每 10 萬人中有 41 人 4,在歐洲的德 國及瑞士的法語區大約 17.15 及 10.3 人 6。在英國,每年至少有 500 癲癇患者於癲癇發作中突然死亡 7。. 1-2 癲癇的現況況及瓶頸 目前癲癇的治療,是以抗癲癇藥物為主,大約 6~7 成 的癲癇患者服用 1 到 2 種抗癲癇藥後,可以有效控制癲癇發作, 過著正常的生活,但仍有 3 成的病人控制困難 9。對於服用抗癲 癇藥物仍無法有效控制癲癇發作的患者,只有少於 1 成的病人接 受外科手術治療 10,在頑固型顳葉性癲癇,接受顳葉切除手術 (temporal lobe ressection)的病患中,也只有 5 成 3 的病人獲得 改善 11, 12。雖然大部分的病人服用藥物可以獲得改善,但癲癇藥 物有許多的副作用 13, 14,因此在傳統中醫藥中尋求安全又有效的 抗癲癇的藥物,有其必要性。. 1.
(8) 1-3 kainic acid(KA, 紅藻胺酸)誘發大鼠癲癇發作模型之研究 許多的研究用 KA 來作為誘發動物癲癇發作模型的藥物 15-18. ,由於這個動物模型的臨床表現和病理變化很類似人類的精. 神運動性癲癇,所以在大鼠的腹腔注射或腦內注射 KA 誘發癲癇 發作,近 29-~30 年已被廣泛使用來顳葉性癲癇的模式. 15, 19-23. 。. 我們的實驗室過去利用腹腔注射或腦內注射 KA 誘發癲癇發作研 究中藥天麻及鉤藤的抗癲癇作用 24-26。雖然腦內注射 KA 會誘發 強烈的癲癇發作容易導致動物的死亡 27,但近年來由於製造 KA 的來源減少造成購買 KA 困難而且價錢昂貴,而由於這種造模方 式所需的 KA 的量極少,因此腦部注射 KA 來作為癲癇發作的動 物模型是研究的趨勢,本研究採用腦內海馬區注射 KA 誘發癲癇 的模型。. 1-4 天麻(Gastrodia elata BL, GE)抗癲癇作用的研究 我們實驗室曾經用氯化鐵於 Sprague-Dawley(SD)大 鼠的大腦皮質內(intracortical)誘發類似人類外傷後癲癇研究天 麻成分 vanillyl alcohol 的抗癲癇的作用,發現 vanillyl alcohol 的 抗癲癇作用與氧化自由基生成的抑制和清除有關。又 vanillyl alcohol 對於 KA 誘發癲癇發作的抗癲癇作用也得到相同的結論 25, 27, 28. 。An et al.的研究發現天麻透過抑制 Gamma-aminobutyric acid 2.
(9) (GABA)降解酶的作用,增強抑制性神經傳導物質,達到抗癲 癇作用 29。. 1-5 本研究的目的 我們先前的研究結果已知天麻對於 KA 誘發的癲癇發作 有抗癲癇作用,又天麻能減少氧化自由基、細胞凋亡和抑制 microglia 的活化,因此本研究進一步探討天麻的神經保護作用。 利用 KA 於 SD 大鼠的海馬區注射誘發癲癇發作,之後口服天麻 觀察海馬區神經細胞的效應。. 3.
(10) 第二章 文獻探討 2-1 傳統中醫對癲癇的認識 癲癇屬於傳統中醫的癇症,俗稱"羊癇風"。癲癇大發作時的 特徵為猝然昏倒,不省人事,手足搐搦,口吐涎沬,兩目上視,喉中 發出如豬、羊的叫聲,醒後疲乏無力、飲食起居一如常人,時發時止, 發病無定時;小發作的主要表現為瞬間的神志模瑚,目睛直視,短暫 性失神,或口角牽動、吮嘴等行為表現。中醫對癇症自黃帝內經開始 就有記載,茲將歷代典籍敘述如下: 一、內經時代 黃帝內經『素問.大奇論』中有"心脈滿大,癇瘛筋攣; 肝脈小急,癇瘛筋攣"的記載,又『素問.奇病論』提到「帝曰: 人生而有病巔疾者,病名曰何?安所得之?岐伯曰:病名為胎 病,此得之在母腹中時,其母有所大驚,氣上而不下,精氣并居, 故令子發為巔疾也」。說明癲癇與懷孕有密切關係 30。. 二、隋唐時代 巣元方在『諸病源候論』中提到「人有血氣少,則心虛 而精神離散,魂魄妄行,因為風邪所傷,故邪入於陰,則為癲疾」, 由此推論巢氏認為癲癇是由於本虛而風邪趁虛而入所致 31。王燾 的『外臺秘要』也持同樣的看法 32。 4.
(11) 三、宋元時期 劉完素在『素問玄機原病式』中提出「風熱甚而筋惕瘛 瘲,僵仆,口出涎沬,俗云風癇病也」的看法,認為風熱是癲癇 發作的病因之一 33;張子和在『儒門事親』中提到「嘗治驚風癇 病屢用汗下吐三法,隨治隨愈」,又「夫癇病不至於目瞪如愚者, 用三聖散投之,更用大盆一箇於暖室中,令汗下吐三法俱行,次 服通聖散百餘日則愈矣」。認為汗、吐、下三法並行可用來用治 療癲癇 34。朱丹溪在『丹溪心法.癲門』中提到「驚與痰宜吐, 大率行痰為主」,又「尋火尋痰分多分治之無不愈者,分痰與熱, 有熱者以涼藥清其心,有痰者必用吐藥」,以及「大法宜吐吐後 用平肝之劑隨愈」,由此可知朱丹溪認為癲癇與痰有關 35。. 四、明清時期 張景岳在『景岳全書』中說「癲病多由痰氣。凡氣有所 逆,痰有所滯,皆能壅閉經絡,格塞心竅,故發則旋暈僵仆,口 眼相引,目睛上視,手足搐搦,腰脊強直,食頃乃甦」 ,認為可 以用除痰、除火的方法來治療癲癇,但若是虛證則可用補法 36; 林佩琴在『類證治裁』中認為「癇症幼小為多,大人亦有之,經 久失調,遂成痼疾,一觸厥氣鼓風,涎沫升逆莫遏,痰在膈間則. 5.
(12) 眩微不仆,痰溢膈上則眩甚而倒,必待其氣反,吐去驚涎宿沫而 後甦,若元氣虛甚,乃屢發不止」又認為「雖分五癇,治要在火 與痰」,由此可知林佩琴認為癲癇在小孩較多,是屬於一種慢性 疾病,而治療以除痰、除火為主 37;王清任在醫林改錯中認為癲 癇發作是因「元氣一時不能上轉入腦髓」 ,所以用「每晚先服黃 耆赤風湯一付」來治療 38。. 2-2 天麻的源流與運用 天麻為蘭科植物天麻的乾燥塊莖,有野生或人工栽培兩 種。主要產於四川、貴州、雲南等地。在立冬後至隔年清明前採 集。春季出芽採集,則稱為春麻,質量較差;冬季莖枯挖出的稱 為冬麻,質量較佳 39。 《神農本草經》曰:天麻味辛,性溫,久服益氣力,長 陰肥健;《開寶本草》曰:主諸風濕痺,四肢拘攣,小兒風癇驚 氣,利腰膝,強筋力。《藥性賦》認為天麻能療大人風熱頭眩, 治小兒風癇驚悸,以及祛諸風麻痺不仁,主癱瘓語言不遂。 《本草綱目》認為天麻是肝經氣分之藥,入厥陰之經而 治諸病。羅天益云:眼黑頭旋,風虛內作,非天麻不能治。天麻 又稱定風草為治風之神藥;《本草經疏》曰:凡頭風眩暈,與夫. 6.
(13) 痰熱上壅,以致頭痛及眩,或四肢濕痺麻木,小兒風癇驚悸等證, 必須用天麻。《本草備要》說天麻入肝經氣分,故治諸風眩掉, 頭旋眼黑,語言不遂,風濕頑痺,小兒驚癇。諸風眩掉,皆屬肝 木。肝病不能榮筋,故見前證,天麻入厥陰而治諸疾,肝氣和平, 諸疾自瘳。. 2-3 天麻抗癲癇的藥理研究 天麻對於 ferric chloride、kainate、pentylenetetrazol、 amyloid-kindled 誘發癲癇發作的動物模型研究,認為天麻成分 vanillin、vanillyl alcohol、4-hydrobenzaldehyde 及其乙醚提取物都 具有抗癲癇作用。 本研究室發現腹腔注射 vanillyl alcohol 200 mg/kg 及 phenytoin 10 mg/kg 可以抑制氯化鐵所誘發的 wet dog shake,推 測 vanillyl alcohol 的抗癲癇與氧化自由基生成和脂質過氧化作用 的抑制有關 28。另外,我們發現口服天麻能抑制 KA 誘發的癲癇 發作包括癲癇發作次數和延長第一次發作時間 25。Kim 等發現於 腹腔注射 KA 前 14 天每日口服天麻乙醚提取物 200 或 500 mg/kg,可以有效延遲腦中神經細胞的變化及癲癇發作的嚴重程 度 40。Huh 等在 pentylenetetrazol 誘發癲癇發作動物模型中,發 現每日口服天麻的甲醇提取物 500 mg/kg,有減少癲癇發作回復 7.
(14) 時間及發作嚴重程度的作用 41。Wu 等利用雙側杏仁核連續性電 刺激誘發癲癇發作,發現天麻有效成分 vanillin 可以降低癲癇發 作的嚴重程度並縮短癲癇發作的時間 42。 . 許多的研究結論天麻抑制癲癇發作可能是來自其抗氧. 化作用 25, 28, 41, 43。有研究已證實天麻及其有效成分除了有抗氧化 作用外,也能對中樞神經抑制性神經傳導物 GABA 影響。Baek 等人利用天麻甲醇提取物 gastrodin 及 parishin 進行體外試驗,發 現它們主要作用於 succinic semialdehyde dehydrogenase (SSADH) 上,藉由抑制 SSADH 減少 GABA 的降解。An 等人每日從口餵 食沙鼠(gerbil) gastrodin 60 mg/kg 一個星期後,誘發癲癇發作, 發現 gastrodin 能有效抑制 GABA 的降解酶(GABA transaminase,GABA-T)、succinic semialdehyde reductase(SSR) 及 SSADH,而對於 GABA synthetic enzyme 及 GABA transporter 則沒有影響,因此天麻根部提取物 gastrodin 可能是透過影響 GABA 的降解達到增強 GABA 的目的 29。. 2-4 KA 誘發神經損傷的研究 KA 是神經傳導物質麩胺酸(glutamate)的類似物,最 早是從日本沿岸的海藻 Digenea simplex 中分離出來用於治療蛔. 8.
(15) 蟲病 44,1970 年代被發現在哺乳類動物具有神經興奮的作用 45, 及具有神經毒性 46,這個神經毒性可能是來自麩胺酸的神經支配 47. 。 KA 誘導的動物癲癇發作模型,會造成動物行為的改. 變、腦波的變化,神經的損傷、退化及神經元的流失 44。KA 可 能是透過三個興奮性麩胺酸離子通道接受器 N-methyl-d-aspartic acid(NMDA) 、α-amino-3-hydroxy-5-methyl -4-isoxazolepropionate (AMPA)及 kainate 接受器作用,但確實的機制未明。有研究認 為 KA 是透過 NMDA 接受器造成慢性癲癇發作 48-50,而另有研 究發現 AMPA 及 kainate 拮抗劑則可以抑制 KA 誘導的大鼠癲癇 發作 29, 51。Ben-ari 及 Cossar 認為 KA 主要作用在神經細胞中興 奮性麩胺酸接受器中的 kainate 接受器上,這些接受器可能是作 用在位於海馬中間神經元及錐狀細胞上:若作用在中間神經元 上,可能會增加 GABA 媒介的神經抑制作用;若是活化海馬 CA3 區的 mossy fiber sprouting synapse 及 glutamatergic recurrent collateral synapse,會產生高度同步的興奮性電氣反應,過度興奮 CA3 區的錐狀細胞,造成慢性癲癇的發作 43。 Nadlar 等(1978)將 0.8 μg/μl KA 注射在大鼠大腦的側 腦室成功誘發癲癇 20,Ben-Ari 等及 Schwob 等將 1μg KA 注射在. 9.
(16) 大腦皮質任一個區域,可以誘發邊緣系統的癲癇發作(limbic seizure)52, 53。Ben-Ari 等將 KA 注入杏仁核(amyloid),可以誘 發續發性癲癇大發作(secondary generalized epilepsy)15, 54, 55。此 外,將 KA 注入海馬會誘發邊緣系統癲癇發作。腹腔注射 KA 所 導致的神經細胞損傷比腦內注射輕,但可以得到相似的癲癇發作 44. 。Ben-Ari 等由大鼠腹腔注射 9 或 12 mg/kg 的 KA 發現在注射. 後 20 mins 內,會出現 wet dog shake,每分鐘 7~8 次持續 30-40 mins19。Lothman 和 Collins 注射 kainci acid 3~12 mg/kg 入大鼠的 血管,大鼠會依時間及注射劑量,出現固定不動(motionless) 及凝視(starring)、wet dog shake、myoclonic jerk、mild limbic convulsion、severe limbic convulsion 等行為 56-58。在 KA 誘發癲 癇發作的模型中,海馬 CA3 區錐狀細胞(pyramidal cell)是最容 易受到傷害的部位 18, 59,其次是 CA1 區 23, 60。不論是腦內注射或 腹腔注射 KA 海馬 CA3 區的神經細胞已被證實是最易受損的區 域 20, 61. 2-5 神經損傷、壞死及細胞凋亡 當細胞受到壓力(stress)或病理性刺激(pathologic stimuli),初期會先在生理及形態上作適應(adaption),如果刺. 10.
(17) 激持續或傷害的物質持續影響細胞,超過了細胞的適應,會導致 細胞的傷害(cell injury)。若儘速移除刺激及傷害的壓力,則細 胞傷害可以回復,但超過細胞可以負荷的程度,就會造成細胞死 亡(cell death)。細胞死死可分為細胞壞死及細胞凋亡。細胞受 到如缺血(ischemia)、化學傷害(chemical injury)等壓力,造 成細胞膜的損傷,導致溶解酵素釋放到細胞質,將細胞消化,導 致細胞的破裂,在形態學上會造成細胞的腫脹,細胞核會濃縮 (pyknosis)、破裂(karyorrhexis)及溶解(karyolysis),細胞膜則會 腫脹破裂(disrupted)、細胞質內容物受到消化裂解到細胞外, 即為細胞壞死,而細胞外也常伴隨發炎反應(imflammation)。 細胞凋亡是核內去氧核糖核酸(DNA)受到傷害,導致細胞核的 溶解,但是細胞膜形態沒有改變,在形態學可以觀察到細胞核裂 解到核小體的片段(necleosome size fragments),細胞膜完整, 細胞變小(shrinkage),形成凋亡小體(apoptotic bodies),不 會伴隨發炎反應 62。 許多的研究發現癲癇發作導致細胞傷害,造成細胞的壞 死或凋亡 63-67。Bengzon 等(1997)在海馬單次電刺激後 5hrs, 利用 TUNEL 染色法在齒狀迴(dentate gyrus)的顆粒下層,發現 TUNEL 染色陽性神經細胞。若用 propidium iodide DNA staining. 11.
(18) 法可以發現退化的細胞核呈現縮小及不規則形狀 68。Zang 等人 (1998)電刺激杏仁核的研究中發現單次及多次電刺激,可以造 成海馬中間神經元的 TUNEL 染色陽性細胞增加(30.4%及 82.5%),中間神經元失去抑制作用易導致癲癇發作 69。Pollard 等(1994)將 KA 注入杏仁核,發現動物在癲癇重積狀態發作後, 在杏仁核及海馬錐狀細胞都可以發現 TUNEL 染色及銀染色的陽 性細胞。系統性注射 KA70 或局部腦內注射 KA71 都可得到相同的 結果。許多研究說明不管是 pilocarpine 或 KA 所誘發的細胞傷 害,都同時發生細胞凋亡和細胞壞死。Covolan 等利用 pilocarpine 誘發癲癇重積狀態發作後,用電子顯微鏡觀察齒狀迴的顆粒細胞 (granule cell)時,發現細胞呈現凋亡和壞死,因此認為細胞壞 死及細胞凋亡可能同時存在 66。Fujikawa 等認為不管是 KA 或是 pilocarpine 腹腔注射,初期造成的細胞死亡,屬於 TUNEL 染色 陰性的細胞,在 HE 染色法下,看到嗜伊紅性細胞質及濃縮而有 完整核膜的染色質團塊,電子顯微鏡下細胞呈現深色、核濃縮、 小顆及破裂的染色質團塊,不管是在癲癇重積狀態發作後 24hrs 或是 72hrs 後,都可以發現 DNA laddering 的存在,但這時 TUNEL 染色還是呈現陰性反應 67。因此,動物發生癲癇重積狀態後導致 的神經傷害是細胞壞死和細胞凋亡同時存在,尤其是海馬 CA1. 12.
(19) 及 CA3 區錐狀細胞及齒狀迴的顆粒細胞最容易出現 72。. 2-6 神經細胞標記及凋亡指標 1. NeuN 神經細胞核專一性蛋白 Mullen et al.(1992)發現 mAb A60 這個單株抗體, 除了少數細胞以及神經膠細胞(glia cell)外,可以用來標記 從發展的早期持續到成年之中樞及周邊神經系統的細胞。它 也可以利用色層分析法與 DNA 結合標記組織培養的神經細 胞及擬神經細胞(retinoic acid stimulated P19 cells)。由於 mAb A60 無法與其他神經細胞以外的組織產生免疫反應,這 種核專一性的神經細胞標記抗體(neuron-specific nuclear protein),被命名為 NeuN (Neuronal Nuclei),廣泛地運用 於標記動物神經細胞 73-77。本研究利用 mAb A60 的專一性來 標記正常的神經細胞,藉以瞭解在 KA 誘發大鼠癲癇發作後 海馬 CA3 區的細胞存活的狀況。. 2. TUNEL 染色法(Terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling) 細胞凋亡的過程中,細胞的遺傳物質去氧核糖核酸會破 碎成很多含有 180-200 個鹼基的小片段,TUNEL 染色法會在破碎 13.
(20) 的去氧核糖核酸碎片的 3’OH 端接上長鍊的 dUTP,而呈色劑會接 上此端,就可以被放大表現出來,因此常用 TUNEL 染色法來監 測細胞凋亡。本實驗利用 TUNEL 染色法,標記 KA 在大鼠誘發 癲癇發作後觀察海馬 CA3 區細胞凋亡的情形。. 3. Fluoro-jade B 染色法 Fluro-Jade B 染色法是一種用於標記正在進行細胞退化 (degeneration)的神經細胞螢光染劑。它對於退化的神經細胞具 有高親和力及很少的背景染色。除了對細胞本體外,它也可以偵 測到細胞樹突、軸突及其末端。Fluro-Jade B 染色法是一個快速、 簡單及可信賴的螢光染色方法,它的激發光約在 FITC 的激發範 圍,在螢光顯微鏡的藍光刺激下,呈現黃綠色螢光 78。本實驗利 用 Fluro-Jade B 染色法瞭解 KA 在大鼠誘發癲癇發作後,海馬 CA3 區神經退化的情形。 . 14.
(21) 第三章 材料與方法 3-1 實驗動物 本研究之實驗動物購自於樂思科公司繁殖之 Sprague–Dawley (SD) 雄性大鼠,體重介於 280-320 公克,總共 24 隻,飼養於本校實驗動物中心,每日提供足夠水分及飼料, 採 12 hrs 明暗控制及中央空調系統調節系統,溫度 25±1℃,濕 度 55±5%,整個實驗過程遵守實驗動物倫理規範,並經中國醫藥 大學動物中心委員會審查通過。. 3-2 藥物的製備及給藥方式 3-2-1 天麻的製備及給藥方式 天麻的製作是委託科達公司(桃園,台灣)。將 5 公斤 的天麻經基源鑑定後,用 35 公升和 25 公升水分別煎煮 1 h 和 50 min 後過濾、冷凍乾燥,最後產物為 944.22 克(18.88%)。以天 麻的成分 vanillyl alcohol(香莢籣醇)為標準品,以高效液相層 析儀(high performance liquid chromatography))進行鑑定。給藥 劑量根據中藥藥理研究方法學 79 及本實驗室先前的研究結果,使 用天麻 1.0 克/公斤。天麻 1.0 克以 PBS(phosphate buffred saline) 溶劑稀釋四倍,給藥方式為經由餵食管口服餵食。每日 1 次,共 4 日。 15.
(22) 3-2-2 Valproic acid(VA)的製備及給藥方式 VA 購自 Sigma 公司(p-6273, Sigma-Aldrich, USA),根 據本實驗室先前的研究結果 VA 250 mg/kg 可以減少 KA 誘發的 癲癇發作,因此本研究陽性對照組給予 VA 250 mg/kg,每日 1 次, 共 4 日。. 3-3 實驗試劑及儀器 3-3-1 實驗藥物 Kainic acid (Sigma, USA) Valrpoic acid (Sigma-Aldrich, USA) 3-3-2 實驗試劑 Chloral hydrate (Merck, Germany) Isopentane (Wako, Japan) Acetone (UCW, Taiwan) Dab substrate kit (Zymed, USA) Hematoxylin solution (Merck, Germany) 30 % H2O2 (Wako, Japan) Triton X-100 (Wako, Japan) Tween 20 (Plusone , EC) 16.
(23) Dulbecco’s phosphate buffered saline(DPBS, Sigma-Aldrich, USA) Phosphate buffred saline (PBS, Sigma, USA) 3-3-3 實驗抗體 Mouse anti-rat NeuN antibody (Chemicon, USA) Goat anti-rat IgG-FITC antibody (Santa Cruz, USA) FLUORO-JADE B (Chemicon, UA & CA) Histostain NBA kit (Zymed, USA) TUNEL stain kit (Calbiochem, Germany). 3-3-4 實驗儀器 腦部立體定位儀(No. 51603, Stoelting, Illinois, USA) 顯微注射器 (ITO , corporation , FUJI , Japan) 腦波記錄器 (MP 100 WSW Biopac systems, Inc,California, USA) 冷凍切片機(Thermo, U.S.A) 光學顯微鏡 (Olympus, Japan) 直立式螢光顯微鏡 (Olympus, Japan). 17.
(24) 3-4 實驗分組 本實驗將總共 24 隻 SD 雄性大鼠隨機分成 4 組,每組 6 隻如下: 1. 空白組(sham) :海馬注射 PBS 0.5 μl,供給足夠水分及飼料, 第 4 天犧牲取腦。 2. 控制組(control):海馬注射 KA 0.5 μg/μl,供給足夠水分及 飼料,第 4 天將大鼠犧牲取腦。 3. 天麻組(GE):海馬注射 KA 0.5 μg/μl,4hrs 後給予第 1 次給 予口服天麻 1.0 g/kg,而每日給予口服天麻 1.0 g/kg 及供給足 夠水分及飼料,第 4 天將大鼠犧牲取腦。 4. 對照組(VA):同 3 天麻組,但服用 valproic acid 250 mg/kg。. 3-5 KA 誘發癲癇發作動物模型之建立 3-5-1 KA 腦內注射注射 首先將 SD 雄性大鼠秤重,接著腹腔注射氯化水醛 (Chloral hydrate. 400 mg/kg)將大鼠麻醉,之後將大鼠頭部固. 定在立體定位儀(stereotaxic frame),以剪刀剪去頭部正中央毛 髮,接著以手術刀劃開頭部中線之頭皮,前後約 3 cm 左右,剝 開頭皮,分離骨頭上骨膜,找到人字縫尖(lambda),以此為座 標起點,往前 3.5 mm,往外 1.5 mm,作個記號。以鑽孔機輕輕. 18.
(25) 在記號上穿孔。將裝有 KA 的顯微注射器(microsyringe)固定在 立體定位儀上的操作手臂上,緩慢下移顯微注射器至頭骨下 4 mm 處(約背側海馬上方) ,停留 10 mins 後,緩慢打入 KA(0.1 μl / 2 mins),共 0.5 μg/μl,停留 10 mins 後,將顯微注射器緩慢 移出。. 3-5-2 記錄電極之裝置 以前囪門(bregma)為起點,雙側往外 3 mm,往前 0.2 mm,將不銹鋼螺絲鎖入頭骨中,約放置在運動皮質外的硬腦膜 (epidura)上,另一個螺絲鎖在前囪門前 7 mm 處為參考電極, 將電極線固定到這三個螺絲。此外,將頭皮往後剪開,分離出項 後肌,將另兩條電極線,前後綁住項後肌,另一條電極線放在頭 骨外骨膜上當作參考電極。所有電極線都是出自一個連結塑膠 墊,以牙粉將此連接墊固定在大鼠頭上。. 3-5-3 腦波及肌電圖之記錄及行為觀察 待大鼠清醒後,將大鼠放置到一個透明行為觀察箱中, 並用電極線將大鼠頭上電極連結到腦波肌電圖記錄器上,並將所 有記錄貯存於個人電腦上。癲癇發作是腦的判定是根據大鼠行為 和相腦波肌電圖記錄。癲癇發作行為依據 Zhang et al.(1997)的 19.
(26) 分類 80,當腦波及行為達到 stage II 出現 wet dog shake 確定癲癇 發作時,則進行如上述所述給藥治療。大鼠犧牲取腦前,再記錄 2hrs 腦波及行為觀察。. 3-6 腦組織之製備 大鼠犧牲取腦前,將大鼠秤重並以兩倍麻醉劑量的氯化 水醛水溶液於大鼠腹腔注射,當大鼠深度麻醉時,將其放置在水 槽上,呈仰臥式,並用剪刀剪開肚皮,找到劍突,剪開左右肋骨, 翻開肋骨找到心臟,剪開右心房放出鮮血,以 23 號注射空針刺 入大鼠左心房,在幇浦運轉下將 200 ml normal saline 緩慢進行心 臟灌流,待右心房出血淡清,剪開頭部連接墊,以骨剪移除頭骨, 將鼠腦取出,隨即放入裝有-30℃ isopentane 的燒杯中,靜置 3 mins,將鼠腦取出用 OCT 包埋,放在乾冰上,待其凝固,放到 cryostat 架上,以 15 μm 的厚度,切取 KA 下針處的海馬總共 40 片,並將切片固定到玻片上,放置在玻片盒,保存於-80 ℃冰櫃 中。. 3-7 Hematoxylin-eosin staining(HE,蘇木素伊紅染色法) 3-7-1 HE 染色之步驟 冷凍切片從-80 ℃冰櫃取出後,先在室溫下放置 10 mins 20.
(27) 使其乾燥,接著使用 4% paraforaldehyde 固定 5 mins,將切片置 於流動自來水中,沖洗 5 mins,將切片浸泡到蘇木素染缸中 1 min,接著將切片取出於流動自來水中沖洗 10 mins,沖洗完將切 片浸泡在伊紅素染缸中染色 1 min。之後以漸增酒精濃度方式 ( 75%→95%→100% ) 脫水,經二甲苯浸潤組織三次後後,以封 片膠濕潤封片。 3-7-2 組織切片之觀察 . 在光學顯微鏡 20 倍下,觀察下針處海馬的完整性,並. 在光學顯微鏡 400 倍下觀察同側及對側海馬 CA3 區的錐狀細胞。. 3-8 免疫組織化學染色(Immmunohistochemistry staining) 3-8-1 免疫組織化學染色之操作 將-80 ℃冰櫃取出的冷凍組織切片靜置在室溫下 15 mins,等檢體回到室溫並乾燥後,將玻片浸潤到裝有-20 ℃的 acetone 染缸中 30 秒,取出玻片於室溫下晾乾 15 mins。接著將 不銹鋼匣浸潤到 0.05% Tween 20/ PBS 溶液中清洗三次(以下除 了加入第一抗體前不用外,每個步驟中間均用此溶液清洗三 次) ,每次 3 mins。清洗完,將不銹鋼匣放入 0.3% H2O2/PBS 溶 液中,靜置 15 mins,以消除內生性過氧化酶。同樣的,待時間. 21.
(28) 到後,取出清洗。清洗完,將玻片一片一片取出,檢體周圍擦拭 乾淨,放上染色盒,將 serum blocking solution 加到濕潤的檢體 上,將染色盒蓋上外蓋,室溫下靜置 20 mins。時間到了後,將 serum blocking solution 輕輕敲掉,再加入第一抗體 (NeuN, 1000X, chemicon),將染色盒蓋上外蓋後,放置在 37 ℃乾燥機中 30 mins。取出清洗後,玻片擦拭乾淨,加入鍵結 FITC 的第二抗體, 室溫下靜置 10 mins,接著加入鍵結 HRP 的第三抗體,室溫下靜 置 10 mins,取出清洗乾淨後,加入 DAB 呈色劑 2 mins,接著用 流動的自來水清洗玻片 3 mins,取出再加上背景染色劑蘇木素 10 秒,一樣放入流動的自來水清洗 3 mins,取出放入 37 ℃乾燥 機 10 mins,等玻片乾燥,取出用蓋玻片壓片。 3-8-2 免疫組織化學染色之觀察 在光學顯微鏡下觀察於同側海馬 CA3 區,低倍 100X 下,觀察並拍照,400X 下觀察並計數染色陽性細胞數。. 3-9 Apoptotic cell 的觀察 3-9-1 TUNEL 染色法(Terminal deoxynucleotidyl transferase -mediated dUTP-biotin nick end labeling)之操作 將冷凍組織切片從冰櫃中取出,室溫下放置 20 mins,. 22.
(29) 將玻片放入-20 ℃的丙酮(acetone)中 30 秒,固定我們的檢體, 取出室溫下放置 20 mins,接著將玻片放入 0.05% Tween 20/PBS 緩衝液(以下凡有清洗皆是指此步驟)浸泡 5 mins,共 3 次。接 著將檢體外擦拭乾淨,加入 0.2%的 Triton-X 100/PBS 溶液 20 mins,取出清洗後擦拭乾淨,加入 20 μg/ml Proteinase K 於室溫 中放置 10 mins,取出輕輕浸潤清洗玻片。再浸置於 3% H2O2/ methanol 中 5 mins,去除內生性過氧化酶干擾,接著再清洗過玻 片。之後加入已配置的 1X terminal deoxynucleotidyl transferase (TdT) Equilibration Buffer,放置 30 mins;接著將切片上的 TdT Equilibration Bufferfu.輕敲掉,加入含 TdT 酵素的反應混合試劑 於 37 ℃反應 90 mins,之後將玻片上試劑敲掉清洗。接著加入已 37 ℃回溫的 Stop Solution 於室溫下反應 5 mins,清洗完後。加入 blocking buffer 室溫下 10 mins,清敲後後加入 conjugate buffer, 室溫下反應 30 misn 後,加入 DAB 呈色劑,反應 5 mins,再以 自來水緩和沖洗 5 mins。methyl green 室溫反應 3 mins,作背景 染色。組織烘乾後,以封片膠封片,於光學顯微鏡下觀察並照相。 3-9-2 TUNEL 染色法之觀察 將玻片置於光學顯微鏡下, 20X 下找到海馬 CA3 區, 接物鏡轉到 40 倍,於 400X 下觀察拍照並計數大鼠海馬 CA3 區. 23.
(30) 之 TUNEL 染色陽性細胞數。. 3-10 NeuN 免疫螢光染色 3-10-1 免疫螢光染色(Immunofluoroscent staining)操作 將冷凍組織切片於室溫下靜置 10 mins,加入-20 ℃ acetone 中,靜置 1 min,取出室溫下靜置待乾。將玻片用 0.05% Tween 20/PBS 潤絲後,加入 blocking solution (2% skim milk),於 室溫下反應 30 mins,以減少抗體非特異性結合,接著加入以的 一級抗體(以 0.02% Triton-X 100/PBS 溶液稀釋)(mouse anti-NeuN antibody:400X),陰性對照組加 PBS 緩衝液,於 37℃ 中反應 30 mins。時間到後,取出清洗乾淨,加入二級抗體(Goat anti-mouse FITC:100X)37 ℃ 30 hrs,接著清洗乾淨後,在玻片 上滴上水性封片膠封片,將玻片上多餘水漬擦拭乾淨 3-10-2 免疫螢光染色之觀察 在暗房,將玻片置於螢光顯微鏡下,先在低倍下(100X) 找到海馬 CA3 區,再放到高倍(400X),於高倍下,觀察拍照。. 3-11 Fluoro-Jade B 染色法 將大白鼠腦部冷凍切片自冰櫃取出,室溫下放置 10 mins,接著放入-20 ℃ acetone 中,靜置 1 min,取出於室溫下靜 24.
(31) 置待乾,接著以 0.01% Tween20/PBS 溶液潤絲後,加入 0.0004% FJB 溶液 (0.04% FJB 溶於 0.1% acetic acid)室溫下反應 20 mins, 取出後於 0.01% Tween20/PBS 緩衝液清洗三次,每次 3 mins,取 出不待乾,即在玻片上滴入 30 μl PBS:甘油(1:1)溶液後封片, 用擦手紙將玻片上多餘的水漬擦乾,螢光顯微鏡(Olympus)高倍 (400X)下觀察拍照並計數 FJB 螢光染色陽性細胞數。. 3-12 統計分析方法 我們使用單因子分析方法(ANOVA)中的 scheffe test 來分析各組間的差異,P 值以小於 0.05 為有統計意義. 25.
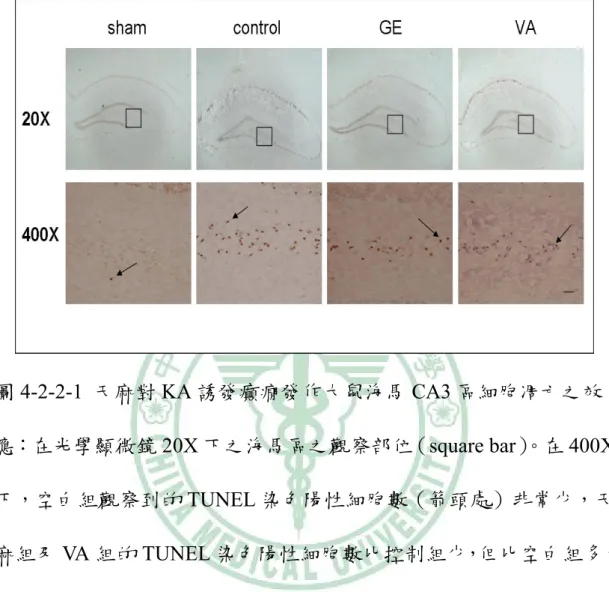
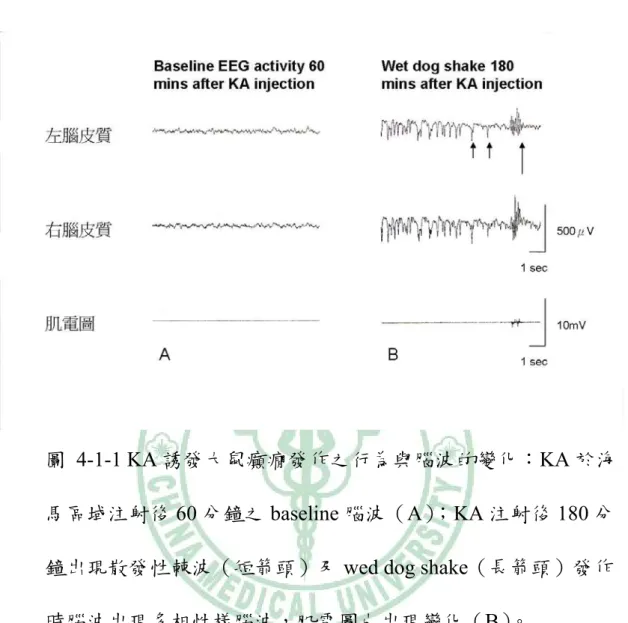
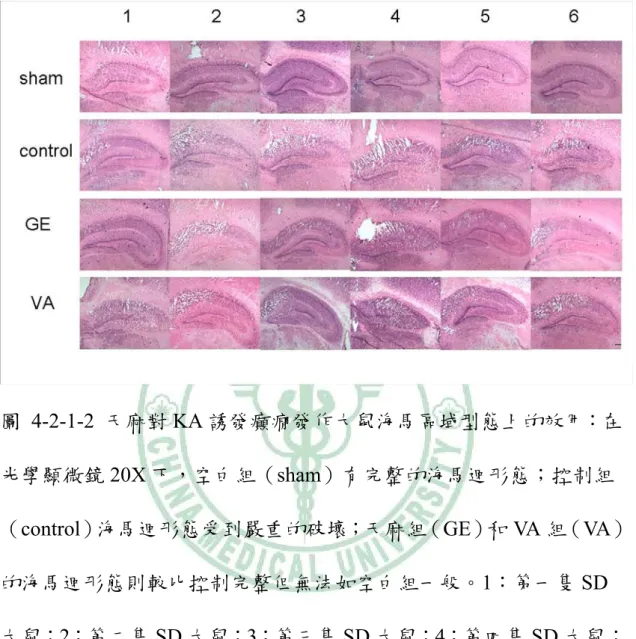
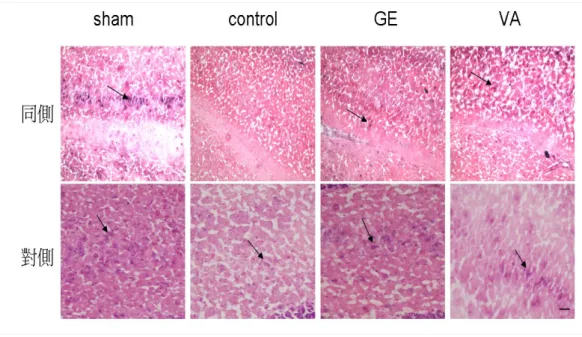
(32) 第四章 結果 4-1 KA 誘發大鼠癲癇發作行為及腦波的變化 用 KA(0.5 μg/μl)於大鼠海馬區域注射後 2~3hrs,大鼠出 現凝視及固定不動現象,隨著出現 wet dog shake 及輕微 facial myotonia 行為,此時腦波出現散發性的癲癇放電棘波,當大鼠出現 wet dog shakes 時腦波則出現 polyphasic 樣的波及肌電圖變化(圖 4-1-1) 。. 4-2 天麻對 KA 誘發大鼠癲癇發作之海馬區病理變化之效應 4-2-1 HE 染色下之觀察: KA 誘發大鼠癲癇發作後,餵食天麻(1.0 g/kg)和 VA (250 mg/kg) 4 日,在 20X 顯微鏡觀察下於海馬 CA1 區域的組織型態較 控制組完整(圖 4-2-1-1、圖 4-2-1-2)。在光學顯微鏡 400X 下觀 察,KA 注射之同側海馬 CA3 區域,GE 組、VA 組和控制組都呈 現細胞變性如細胞質呈嗜伊紅性,細胞核縮小等的變化,但 sham 組則沒有出現相似的變化。KA 注射之對側海馬 CA3 區域,GE 組 和 VA 組的變化較控制組接近 sham 組,出現較多的正常細胞(圖 4-2-1-3)。. 26.
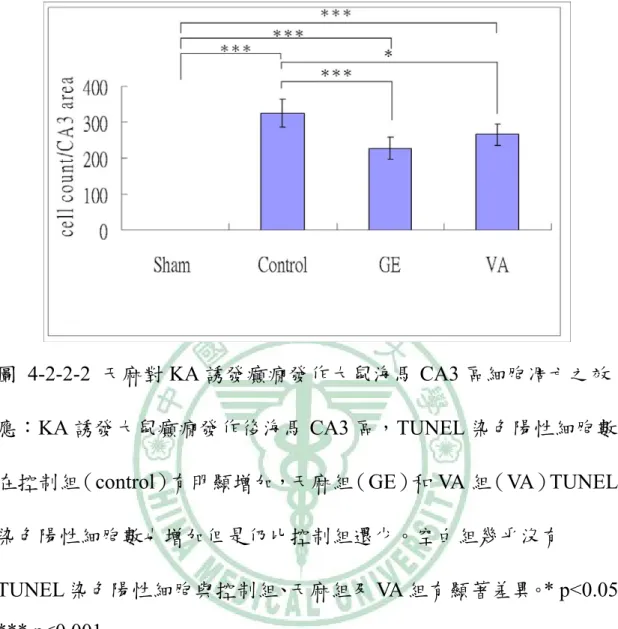
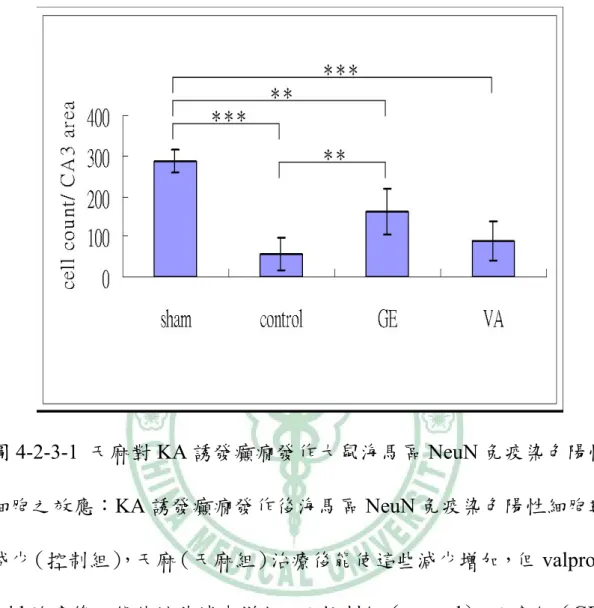
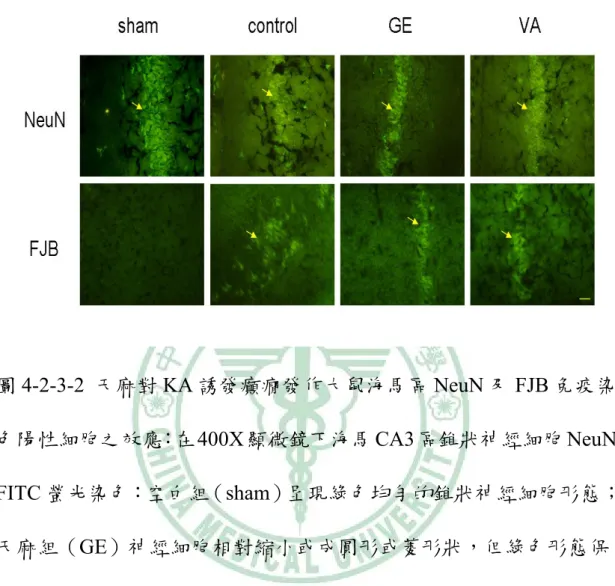
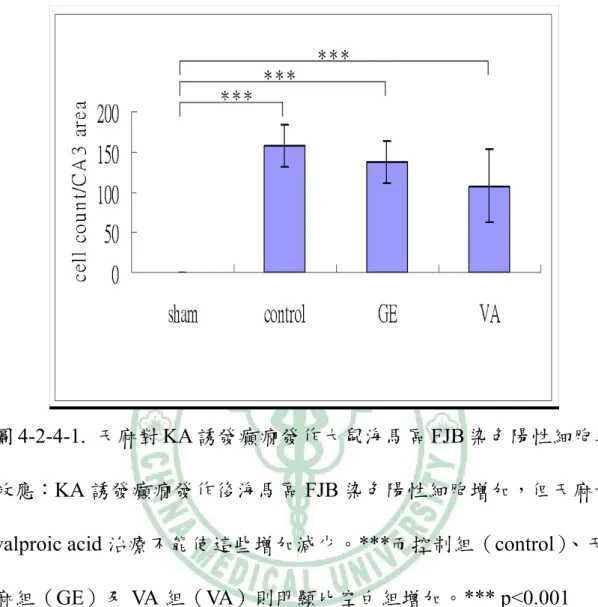
(33) 4-2-2 TUNEL 染色下之觀察 在 400X 顯微鏡觀察下,GE 組和 VA 組在 KA 注射之同側 海馬 CA3 區域的 TUNEL 染色陽性細胞數分別是 228.2±31.1 及 265.7±28.4 比控制組 324.5±38.2 低(p < 0.001;p < 0.05:圖 4-2-2-1, 圖 4-2-2-2)。. 4-2-3 NeuN 染色下之觀察 在 400X 顯微鏡觀察下,KA 注射同側海馬 CA3 區域 NeuN 陽性細胞數 GE 組是 161.33±55.31 高於控制組的 57.83±40.03(p < 0.01),而 VA 組是 88.16±47.88 與控制組相似(p > 0.05;圖 4-2-3-1, 圖 4-2-3-2)。. 4-2-4 FJB 染色下的觀察 在 400X 螢光顯微鏡下,KA 注射同測海馬 CA3 區 FJB 染 色陽性細胞數,GE 組是 137.16±27.05、VA 組 107.83±46.06,而控 制組是 157.16±26.11,三者間相似(p > 0.05;圖 4-2-3-2 圖,4-2-4-1) 。. 27.
(34) 圖 4-1-1 KA 誘發大鼠癲癇發作之行為與腦波的變化:KA 於海 馬區域注射後 60 分鐘之 baseline 腦波(A) ;KA 注射後 180 分 鐘出現散發性棘波(短箭頭)及 wed dog shake(長箭頭)發作 時腦波出現多相性樣腦波,肌電圖也出現變化(B)。. 28.
(35) 圖 4-2-1-1 Sprague-Dawley 大鼠正常海馬迴之 hematoxylin-eosin 染色 圖:CA1:海馬迴之 CA1 區;CA2:海馬迴之 CA2 區;CA3:還碼 迴之 CA3 區;DG:海馬迴之 denatate gyrus。(Scale bar=200 μm). 29.
(36) 圖 4-2-1-2 天麻對 KA 誘發癲癇發作大鼠海馬區域型態上的效用:在 光學顯微鏡 20X 下,空白組(sham)有完整的海馬迴形態;控制組 (control)海馬迴形態受到嚴重的破壞;天麻組(GE)和 VA 組(VA) 的海馬迴形態則較比控制完整但無法如空白組一般。1:第一隻 SD 大鼠;2:第二隻 SD 大鼠;3:第三隻 SD 大鼠;4:第四隻 SD 大鼠; 5:第五隻 SD 大鼠;6:第六隻 SD 大鼠。20X:目鏡 10X,物鏡 2X。 (Scale bar=200 μm). 30.
(37) 圖 4-2-1-3 天麻對 KA 誘發癲癇發作大鼠海馬 CA3 神經細胞的效 應::在 400X 光學顯微鏡下,KA 注射之同側海馬 CA3 區神經細胞: 空白組(sham 同側)的細胞呈現圓形大顆紫色濃染核及淡紅色細胞 質,而 VA 組(VA 同側)及天麻組(GE 同側)可以看到圓大紫色濃染的 細胞核縮小,細胞質呈現深粉紅色(嗜伊紅性) ,而控制組(control 同 側)則幾乎看不到存活的細胞。在 KA 注射之對側海馬 CA3 區神經細 胞,則控空白組(sham 對側)、VA 組(VA 對側)和天麻組(GE 對側),則 看到正常形態色質的神經細胞,但是控制組(control 對側)則只能看到 縮小濃染的細胞核。(Scale bar=5 μm). 31.
(38) 圖 4-2-2-1 天麻對 KA 誘發癲癇發作大鼠海馬 CA3 區細胞凋亡之效 應:在光學顯微鏡 20X 下之海馬區之觀察部位(square bar) 。在 400X 下,空白組觀察到的 TUNEL 染色陽性細胞數(箭頭處)非常少,天 麻組及 VA 組的 TUNEL 染色陽性細胞數比控制組少,但比空白組多, 而天麻組和 VA 組兩組間相似。20X:目鏡 10X,物鏡 2X;400X: 目鏡 10X,物鏡 40X。(scale bar=5 μm). 32.
(39) 圖 4-2-2-2 天麻對 KA 誘發癲癇發作大鼠海馬 CA3 區細胞凋亡之效 應:KA 誘發大鼠癲癇發作後海馬 CA3 區,TUNEL 染色陽性細胞數 在控制組(control)有明顯增加,天麻組(GE)和 VA 組(VA)TUNEL 染色陽性細胞數也增加但是仍比控制組還少。空白組幾乎沒有 TUNEL 染色陽性細胞與控制組、天麻組及 VA 組有顯著差異。* p<0.05, *** p<0.001. 33.
(40) 圖 4-2-3-1 天麻對 KA 誘發癲癇發作大鼠海馬區 NeuN 免疫染色陽性 細胞之效應:KA 誘發癲癇發作後海馬區 NeuN 免疫染色陽性細胞數 減少(控制組) ,天麻(天麻組)治療後能使這些減少增加,但 valproic acid 治療後不能使這些減少增加。而控制組(control) 、天麻組(GE) 及 VA 組(VA)NeuN 染色陽性細胞則明顯比空白組減少。** p<0.01, *** p<0.001. 34.
(41) 圖 4-2-3-2 天麻對 KA 誘發癲癇發作大鼠海馬區 NeuN 及 FJB 免疫染 色陽性細胞之效應:在 400X 顯微鏡下海馬 CA3 區錐狀神經細胞 NeuN FITC 螢光染色:空白組(sham)呈現綠色均勻的錐狀神經細胞形態; 天麻組(GE)神經細胞相對縮小或成圓形或菱形狀,但綠色形態保 存;VA 組(VA)及控制組(control)則僅隱約可以看到細胞形態, FITC 的染色形成同心圓狀,綠色的染色相對褪色許多。在 FJB 螢光 染色下,空白組(sham)幾乎沒有陽性細胞,控制組、天麻組及 VA 組,都可以觀察到 FJB 染色陽性細胞。NeuN:neuron nuclear specific protein;FJB:fluoro-jade B。(scale bar=5 μm). 35.
(42) 圖 4-2-4-1. 天麻對 KA 誘發癲癇發作大鼠海馬區 FJB 染色陽性細胞之 效應:KA 誘發癲癇發作後海馬區 FJB 染色陽性細胞增加,但天麻和 valproic acid 治療不能使這些增加減少。***而控制組(control) 、天 麻組(GE)及 VA 組(VA)則明顯比空白組增加。*** p<0.001. 36.
(43) 第五章 討論 本研究的結果顯示 SD 大鼠於海馬區注射 KA 5 μg/μl 後 2~3hrs 發展大鼠癲癇發作。本研究選擇 Zhang et al.80 分類之 stage II 癲癇發作大鼠為研究對象,癲癇發作的確定是根據大鼠行為和腦波肌 電圖記錄,因此本研究的結果是可以信賴的。 本研究的結果發現 HE 染色下,KA 誘發癲癇發作後第四天, 海馬 CA1 及 CA3 區之錐狀細胞的變性、壞死,核濃縮,這些結果與 一些研究報告類似 67。雖然本研究的結果顯示 KA 誘發癲癇發作後餵 食天麻四天,在 KA 注射同側海馬 CA3 區,仍可見到細胞核濃縮, 細胞質呈現深紅色蛋白質變性的表現,說明天麻無法完全阻止細胞變 性的發生,但相較於控制組細胞變性較為輕微,因此我們認為天麻對 於 KA 誘發癲癇發作後的神經細胞保護作用(neuroprotection)仍有 正面意義。 我們的結果顯示 KA 誘發癲癇發作後海馬 CA1 及 CA3 區域 出現細胞凋亡及壞死,這個結果與一些研究報告一致 67。TUNEL 染 色陽性細胞是表示細胞凋亡,本研究的結果顯示天麻和 VA 治療可以 減少 TUNEL 染色陽性細胞,即天麻和 VA 可以減少 KA 誘發的細胞 凋亡,這個結果與天麻在 KA 誘發癲癇發作前給藥,可以減少細胞凋 亡 27, 81 及天麻的乙醚萃取物能降低 β-amyloid 誘發的神經細胞損傷 82. 37.
數據
Outline
相關文件
6 《中論·觀因緣品》,《佛藏要籍選刊》第 9 冊,上海古籍出版社 1994 年版,第 1
In particular, we present a linear-time algorithm for the k-tuple total domination problem for graphs in which each block is a clique, a cycle or a complete bipartite graph,
Based on [BL], by checking the strong pseudoconvexity and the transmission conditions in a neighborhood of a fixed point at the interface, we can derive a Car- leman estimate for
• The order of nucleotides on a nucleic acid chain specifies the order of amino acids in the primary protein structure. • A sequence of three
The nanostructure with anisotropic transmission characteristics on ITO films induced by fs laser can be used for the alignment layer , polarizer and conducting layer in LCD cell.
On the other hand, the pre-Lunar New Year Sale on clothing, falling price in fresh pork and a waiver of welfare housing rentals by the Housing Institute for the first quarter of
On the other hand, rising prices in new arrivals of summer clothing, men’s and women’s footwear and the expiry of waiver of welfare housing rentals by the Housing Institute after
• elearning pilot scheme (Four True Light Schools): WIFI construction, iPad procurement, elearning school visit and teacher training, English starts the elearning lesson.. 2012 •