國立臺灣大學理學院化學研究所 博士論文
Department of Chemistry College of Science
National Taiwan University Doctoral Dissertation
探討人類端粒四股結構的結構轉換機制
Elucidation of the Mechanism of Structure Conversion in Human Telomeric G-quadruplexes
王咨富 Zi-Fu Wang
指導教授:張大釗 博士 Advisor: Ta-Chau Chang, Ph.D.
中華民國 102 年 1 月
January 2013
i
中文摘要
由於 G-四股結構(G-quadruplex)有潛力干擾端粒酶延長端粒的功能,因此設 計小分子穩定四股結構抑制端粒酶過度表現的癌細胞,有機會可以成為有效的抗 癌藥物。但由於人類端粒四股結構具有多樣性,導致研究四股結構生物上活性或 設計藥物增加複雜性。本篇論文主要探討人類端粒四股結構與結構轉換的機制,
研究離子與溶劑造成的效應。第一部分探討人類端粒四股結構在鈉、鉀離子交換 的結構轉換機制,利用 NMR 與 site-specific isotope (15N) labeling 的方法,我們定 出了人類端粒序列 d[TAG3(T2AG3)3] (TA-HT21)在鈉離子溶液的四股結構,與文 獻中報導的在鉀離子溶液的結構相同,因此光譜快速轉換的主要原因,並非因為 大幅的結構改變,而是由於離子交換的結果,我們進而提出了鈉/鉀離子交換的 機制。第二部分是觀察 PEG (polyethylene glycol)所產生的溶劑效應,利用分子設 計,經由四股結構穩定劑 BMVC,合成出其衍生物 BMVC-8C3O,可以有效轉 換人類端粒 DNA G-四股結構,從不同的非平行結構轉為平行螺旋型的結構,使 複雜的結構歸一化,同時能夠大幅提升端粒 DNA G-四股結構的解旋溫度 (melting temperature)。成功的將溶劑效應轉換到區域化的效應,不僅支持了 PEG 誘導結構轉換並非是經由分子擁擠效應(molecular crowding effect),而是經由脫 水效應(dehydration effect)的結果,此外也提供四股結構周邊化的水分子的環境可 以成為分子設計影響端粒四股結構。第三部分利用 DSC、CD、 Time-resolved NMR 等方法,探討端粒非平行四股結構經由 BMVC-8C3O 作用,轉換成平行螺 旋型四股結構的轉換機制,發現轉換過程中間存在 intermediate,並嘗試建立其 動力學機制,進而了解不同四股結構的動力學與熱力學在結構轉換中的關係。
關鍵字: 人類端粒四股結構、結構轉換、離子效應、四股結構嵌合劑、去水合效 應
ii
Abstract:
Human telomere G-quadruplexes (G4) is a promising target for cancer therapy by telomerase inhibition. Thus, designing and synthesizing of a small molecule that can bind to G4 and inhibit telomerase has been a popular research topic. However, G-quadruplex has a variety of structures and it is not known which of these structures are likely to be present in living cells. Therefore, a rational design of selective ligands to G4 is challenging. Here, we synthesized a novel ligand and apply the technique of ITC, DSC, and NMR with site-specific isotope (15N) labeling to discuss the diversity of G4 structure and to find out the mechanism of structure conversion. The first part of my thesis discusses the mechanism of structure conversion of Human telomere G-quadruplex by sodium- potassium exchange. By solving the structure of Human telomere G-quadruplex (HT23) under sodium form, we find the structure is the same as the potassium form. Instead of involving large conformation change, the process is mainly through the ion sequential exchange. The second part is applying the idea of solvent effect of PEG (polyethylene glycol) to ligand design where we optimized the fluorescence probe of 3,6-Bis(1-methyl-4-vinylpyridium) carbazole diiodide (BMVC) molecule by substituting a tetraethylene glycol in the N-9 position with a methyl-piperidinium cation to produce a new G4 stabilizer called BMVC-8C3O. The design principle based on solvent effect of PEG can induce structural change from non-parallel to parallel G4 and further stabilize the G4 structure for Human telomere G4 sequences. This provided a basis for the design of novel G4 ligands. The results show the modification of G4 ligand with the oxygen atom plays a crucial role for inducing parallel G4s, and provide evidence of the local dehydration effect from PEG where the local water structure is the key for induce conformational change of human telomere.
iii
The final part is applying the ligand to study the G4 strucutre conversion from hybrid to parallel. By NMR result, we discover the intermediate state and provide the kinetic pathway of structure conversion. The mechanism of G4 structure conversion can be further applied to the G4 biological function and G4 ligand design.
Key word: Human telomere G-quadruplex 、 Struture conversion 、 Ion effect 、 G-quadruplex ligand、Dehydration effect
iv
第一章 前言... - 1 -
1.1G-四股結構 (G-QUADRUPLEX ) ... -2-
1.2 端粒與端粒酶 ... -5-
1.3 人類端粒 G-四股結構 (G-QUADRUPLEX )及其結構多樣性 ... -7-
1.4 G-四股結構穩定劑 G-QUADRUPLEX STABILIZER... -13-
第二章 實驗方法... - 17 -
第三章 人類端粒四股結構在鈉/鉀離子的結構轉換機制 ... - 31 -
3.1 簡介 ... -32-
3.2 研究動機: ... -38-
3.3 結果與討論: ... -39-
TA-HT21 四股結構在鈉離子與鉀離子條件之比較... - 39 -
利用 NMR 決定 TA-HT21 在鈉離子條件下的結構 ... - 41 -
TA-HT21 四股結構的鈉、鉀離子轉換過程... - 48 -
3.4 結論... -50-
第四章 利用 PEG 溶劑效應設計新型小分子四股結構轉換劑 ... - 55 -
4.1 簡介... -56-
分子擁擠效應(MOLECULAR CROWDING EFFECT)在四股結構的研究 ... -56-
4.2 研究動機... -61-
4.3 結果與討論: ... -63-
BMVC-8C3O 與人類端粒四股結構 HT24 作用... - 63 -
BMVC-8C3O 與不同端粒四股結構作用 ... - 64 -
PEG 的溶劑效應與 BMVC-8C3O 小分子區域化效應 ... - 67 -
BMVC-8C3O 與較長的人類端粒序列 HT48 作用... - 74 -
以不同 BMVC 小分子討論 BMVC-8C3O side-chain TEG 的影響 ... - 76 -
4.3 結論... -83-
第五章 人類端粒四股結構 TA-HT21 結構轉換的機制... - 85 -
5.1 研究動機... - 86 -
5.2 結果與討論... -87-
從熱力學的角度來看結構轉換的機制... - 87 -
從建立動力學角度來看結構轉換的機制... - 90 -
利用 NMR 討論 TA-HT21 與 BMVC-8C3O 的結構轉換機制 ... - 96 -
利用 Time-resolved NMR 研究 TA-HT21 與 BMVC-8C3O 作用結構轉換過程 ... - 102 -
利用 NMR 的結果建立結構轉換的動力學能階 (energy diagram) ... - 107 -
5.3 結論: ... -108-
v
第六章 總結... - 115 - 參考資料..………..-119- 附錄………..-124-
- 1 -
第一章
前言
- 2 -
1.1 G-四股結構 ( G-Quadruplex )
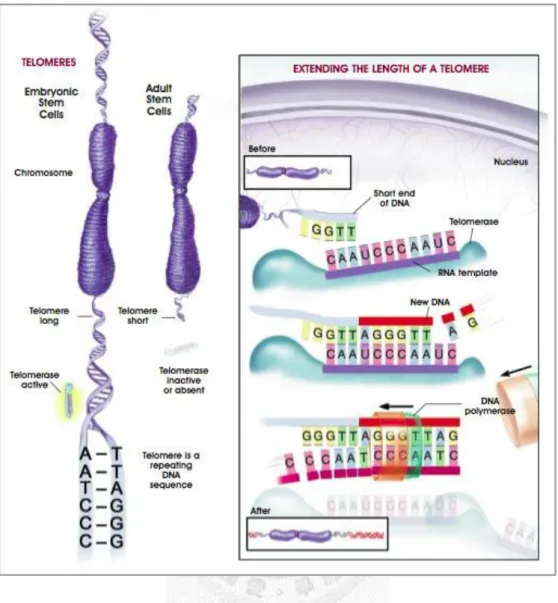
核酸 (nucleic acid)序列富含鳥糞嘌呤 (G base),所形成的四股結構稱之為 G-quadruplex (也稱 G4 DNA)。在 1962 年由 Davies1等人發現以單體
guanylic
acid (GMP)溶液會形成凝膠 gel,進一步用 X-ray 發現這凝膠存在者特殊的繞射圖形,所以他們假設一個平面結構由四個 G 鳥糞嘌呤單體藉 Hoogsteen 氫鍵2形成的 Helix (圖 1.1)。
圖 1.1 G-Helix
由於一開始相關的富含鳥糞嘌呤序列並沒有在生物體內被發現,直到 1970 末期以後,Blackburn 團隊首先發現單細胞原生動物 Tetrahymena 其染色體端粒 DNA 存在著重複的序列 d(TTGGGG)43,之後陸續許多物種的端粒序列被發現,
且大多都是富含鳥糞嘌呤序列 G-rich sequence,但與先前 Davies 等人所發現結構 的關聯性尚未發現,直到 1987 年 Tinoco 與 Blackburn 等人利用 NMR 發現端粒 DNA (TTGGGG)4有存在著某種二級結構,並推測可能是 hairpin dimer4,1988 年 Sen 與 Gilbert 等人利用 PAGE 電泳的實驗發現先前所發現的端粒序列會形成四 聚體,提出端粒會形成 G4 complex model 的概念5,1989 年 Williamson 與 Cech 利用 Tetrahymen 端粒 DNA (TTGGGG)4 的 PAGE 實驗結果提出 G-quartet
- 3 -
model6(圖 1.2),並說明與先前 Davies 等人所發現 G-Helix 結構之關聯性,發現 在單價陽離子 Na+、 K+ 、Cs+等能形成 G4 complex 結構,而 Li+無法形成 G4 complex,進一步解釋陽離子 Na+、 K+等可能必須要卡在 G-quartet 中間與 Guanine 6 號位置的氧鍵結(圖 1.2),,而 Li+無法形成是由於 ion size 太小的關係,同年 Klug7等人實驗發現與 Williamson 相同結果,同時利用理論計算發現 G-quartet 之 間約 3.4 埃而鉀離子直徑約 2.75 埃,與 6 號位置的氧鍵結合之後可以剛好卡在 G-quartet 之間(圖 1.2),提出與 Williamson 類似的 model。
圖 1.2 G-quartet model
1992 年 Rich 團隊8與 Fegion 團隊9分別用 X-ray 與 NMR 解出了 Oxytricha telomere(G4T4G4)2 dimer 的 G-四股結構,證實了 quartet model 且清楚的理解 G 四股結構,因此之後有了 G-tetraplex 或 G-quadruplex 的名稱。除了端粒之外 , Hurley10等人首先發現 C-myc oncogene promoter 也會形成 G-四股結構,同時提 出可以利用 promoter 四股結構的形成進而影響下游蛋白質的表現 。
2001 年人類的基因計畫草圖完成 11,人類染色體的序列被定出。Huppert12 與 Todd13 分別設計程式搭配生物資訊,從染色體的序列定出 PQS (potential of quadruplex-forming sequence),推測可能形成形成的序列條件 G3 NL1 G3 NL2 G3
- 4 -
NL3 G3,NL1-3是指 loop,一般而言,base 數目可以是一到七個,更長也有可能超
過十個14,15,通常三個 G-quartet 形成四股結構,其實兩個 G-quartet 就可以形成
穩定的四股結構如 TBA16, Huppert 等人利用這個序列經由生物資訊的方式找出 人類基因體中有~375,000 個的 PQS,目前許多 oncogene promoter 已經被發現會 形成四股結構如 C-kit17、K-ras18、VEGF19等等,另外 mRNA 5’-UTR 不轉譯區 域也會形成四股結構並抑制下游 protein 生成20,因此 G-四股結構有可能作為設 計標靶。
從 50 年前 Davies 等人發現 G-Helix 結構到現在,G-四股結構 (G-quadruplex) 相關的研究越來越重要,不僅在 drug-discovery21-23也跨足了 material science24,25 , 目前 G-四股結構 biological function26-28也引起研究很多的討論,G-四股結構在生 命科學或藥物醫學肯定扮演重要的角色。
- 5 -
1.2 端粒與端粒酶
端粒(telomere)位於真核細胞的染色體末端,用來保護染色體的完整性及防 止染色體重組 29。通常端粒 DNA 由富含鳥糞嘌呤 (guanine) 的核苷酸重複序列 所組成;以人類為例,正常細胞中的端粒約有 5-20 kbp TTAGGG/CCCTAA 的雙 股部分,再接上一段 50-200 bp 的單股核苷酸序列(TTAGGG)n30,31。在細胞分裂 的過程中端粒無法完全複製,因此每經過一次細胞分裂,染色體的長度約會減少 50 bp32。當正常細胞分裂 50-100 次後 32,端粒持續縮短到某一長度後將失去保 護作用,細胞開始進入衰老期(senescence),最終走向凋亡 (apoptosis)。這種複製 性衰老機制,一般認為是正常細胞的自我防衛機制33。另外,端粒可經由端粒酶 (telomerase)作用(圖 1.3) ,維持端粒長度的恆定。端粒酶由做為模版的 RNA 片 段與反轉錄酶組成。在人類的正常細胞中,只有生殖器官和造血組織等增生能力 強的組織才具有有活性的端粒酶34。然而,85%的癌細胞,都能觀察到端粒酶有 過度表現的現象,使得癌細胞能無限制地不斷分裂、複製。因此,抑制端粒酶活 性可以作為抗癌藥物之標的物35。
- 6 -
圖 1.3 端粒在染色體尾端位置以及端粒酶作用之示意圖
- 7 -
1.3 人類端粒 G-四股結構 ( G-Quadruplex )及其結構多樣性
先前提到在人類染色體尾端粒的 3’端,有一段 50-200 bp 富含鳥糞嘌呤
的
單 股核苷酸序列(TTAGGG)n30。 In vitro 的實驗證明在有適當的單價陽離子存在時,G-鹼基會藉由 Hoogsteen 氫鍵鍵結,形成穩定的 G-quartet6 ,由 G-quartet 堆疊形 成 G-四股結構。Zahler 與 Williamson 提出此結構可以抑制端粒酶36 (圖 1.4),使 得端粒酶的 RNA 模版不易與之鍵結,阻斷端粒酶作用而無法延長端粒長度,可 能調控端粒的長度,而且與末端保護的作用有關27,29,除了推測 G 四股結構可能 的生物調控作用之外,由於先前提到大多數的癌細胞,都能觀察到端粒酶有過度 表現的現象,使得端粒酶可以做為抗癌藥物之標的物 35,Mergny 等人進一步提 出針對 G-四股結構設計藥物,用來穩定 G 四股結構抑制端粒酶37(圖 1.4)。
圖 1.4 G 四股結構抑制端粒酶示意圖
- 8 -
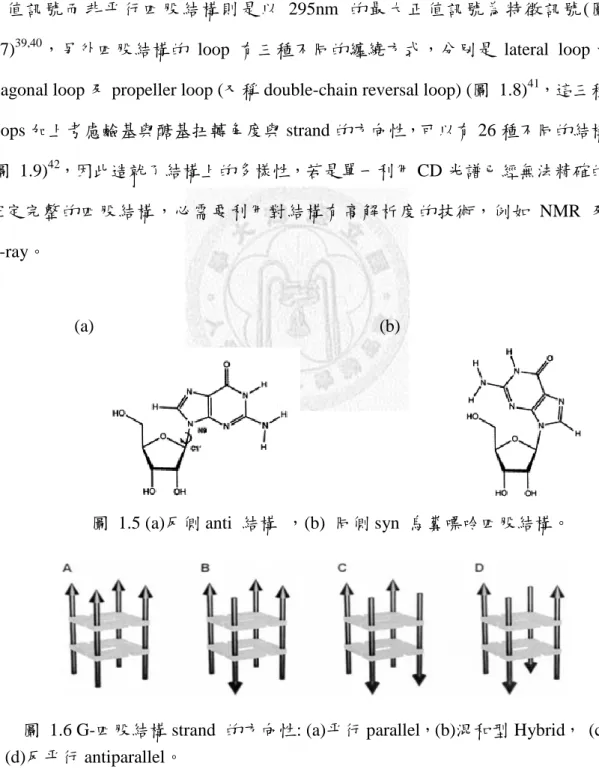
由於富含 G 的序列可能形成不同構型的四股結構,尤其在不同的條件下,
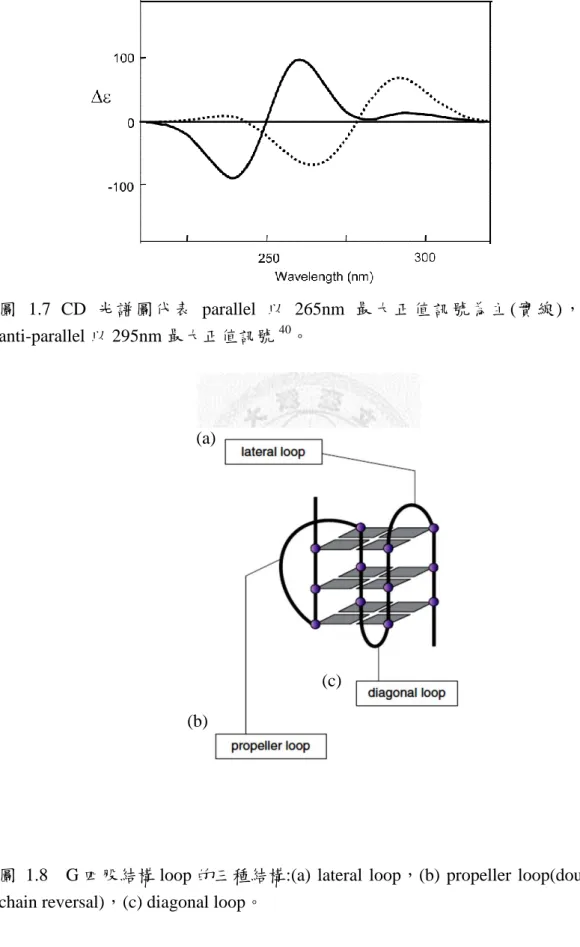
例如: 鈉或鉀離子的離子直徑不同,另外 G 的鹼基與醣基扭轉角度有反側 (anti) 和同側 (syn) (圖 1.5)兩種可能性38,strand 的方向性分成平行與非平行,非平行 包含混和型 (hybrid) 及反平行 (antiparallel) (圖 1.6),通常會利用 CD 光譜作為 區分平行與非平行四股結構的訊號,平行四股結構的特徵訊號為 265nm 的最大 正值訊號而非平行四股結構則是以 295nm 的最大正值訊號為特徵訊號 (圖
1.7)39,40,另外四股結構的 loop 有三種不同的纏繞方式,分別是 lateral loop、
diagonal loop 及 propeller loop (又稱 double-chain reversal loop) (圖 1.8)41,這三種 loops 加上考慮鹼基與醣基扭轉角度與 strand 的方向性,可以有 26 種不同的結構 (圖 1.9)42,因此造就了結構上的多樣性,若是單一利用 CD 光譜已經無法精確的 確定完整的四股結構,必需要利用對結構有高解析度的技術,例如 NMR 及 X-ray。
圖 1.6 G-四股結構 strand 的方向性: (a)平行 parallel,(b)混和型 Hybrid, (c)
& (d)反平行 antiparallel。
(a) (b)
圖 1.5 (a)反側 anti 結構 ,(b) 同側 syn 鳥糞嘌呤四股結構。
- 9 -
圖 1.7 CD 光譜圖代表 parallel 以 265nm 最大正值訊號為主(實線),代表 anti-parallel 以 295nm 最大正值訊號40。
(a)
(c) (b)
圖 1.8 G 四股結構 loop 的三種結構:(a) lateral loop,(b) propeller loop(double – chain reversal),(c) diagonal loop。
- 10 -
圖 1.9 26 種不同 G 四股結構以 lateral loop、propeller loop(double –chain reversal) loop 及 diagonal loop 做環繞方式。
- 11 -
在 1993 年, Patel 團隊利用核磁共振光譜(nuclear magnetic resonance, NMR)
解出第一個人類端粒 d(AGGGTTAGGGTTAGGGTTAGGG) (A-HT21)在鈉離子 溶液中的四股結構,為一反平行籃型構型(anti-parallel basket type)43(圖 1.10a)。
到了 2002 年,Neidle 團隊利用 X-ray 解出 A-HT21 在鉀離子單晶中為一平行螺 旋型四股結構 (parallel propeller type)44 (圖 1.10b)。然而從 CD 光譜顯示 A-HT21 在鉀離子的四股結構不完全類似於平行的四股結構 45,之後 Chaires 團隊用 sedimentation 及螢光實驗發現鉀離子溶液中的 A-HT21 結構與 X-ray 解出來的似 乎不同46。直到 2006 年及 2007 年, Patel 團隊利用 NMR 光譜分別解出在鉀離 子溶液下 d(TAGGGTTAGGGTTAGGGTTAGGG) (TA-HT21)47 為 hybrid-I (圖 1.10c) 和 d(TAGGGTTAGGGTTAGGGTTAGGGTT) (TA-HT21-TT)48 為 hybrid-II(圖 1.10d),都是混合型的平行構型,同時間 Yang 團隊49與 Sugiyama 團 隊 50 分別也提出 hybrid-II 的構型,從結構上來看,hybrid-I 與 hybrid-II 兩者的 差別在於雙重鏈 (double chain reversal) 與橫鏈 (lateral loop)的順序不同,這些結 果證實 X-ray 單晶結構與溶液中結構的確不同。
2009 年,Phan 與 Patel 團隊解出了 d(GGGTTAGGGTTAGGGTTAGGGT) (HT21-T)為反平行籃型 (anti-parallel basket type) (圖 1.10e),但只有兩層 G-quartet 平 面 51, 同 年 , Phan 團 隊 又 解 出 了 變 異 人 類 端 粒 序 列 CTAGGG , (AGGGCTAGGGCTAGGGCTAGGG) (CTA22) 為反平行椅型四股結構 52 (圖 1.10f),結果顯示在鉀離子溶液中,人類端粒序列可能存在的複雜四股構型。G- 四股結構的構型也會影響到本身的穩定性 53,54。因此,若能研發出有機小分子 (ligand),無論是加強在原構型的穩定性,或是誘導促使四股結構轉變成較穩定 的構型都可以增加 G-四股結構更穩定性 37,進而抑制端粒酶作用,都有機會成 為頗具潛力的抗癌藥物,但人類端粒四股結構的多樣性55,56,增加對四股結構為 目標的藥物設計之難度,所以如何設計小分子針對多種端粒結構成為設計四股結 構穩定劑的一個重要議題。
- 12 -
(a) (b) (c)
(d) (e) (f)
圖 1.10 (a) 反平行籃型 (b) 平行螺旋槳型 (c) 第一種混合型 (d) 第二種混合型(e) 反平行籃型(兩層 G-quartet) (f) 反平行椅型之 G-四股結構。
- 13 -
1.4 G-四股結構穩定劑 G-quadruplex stabilizer
Zahler 等人 36,37提出四股結構可以用來抑制端粒酶之後,Hurley 與 Neidle 等人進一步設計第一個 2,6-diamidoanthraquinone 小分子57 (圖 1.11),以穩定端 粒四股結構為出發點來抑制端粒酶延長,使得人類端粒四股結構可以成功作為一 個癌症的標靶,陸續地一直到最近都許多具有療效的四股穩定劑被設計出,其中 有一些是比較常來被拿來做研究(圖 1.11),例如以 photodynamic therapy 的藥物 Porphyrin 為主要結構 TMPYP458 除了可以作用端粒的四股結構,對 c-myc oncogene promoter 的四股結構10也有很好的作用性質可以抑制其下游表現。第一 個 用 模 擬 預 測 與 四 股 結 構 作 用 的 Perylene 隨 後 設 計 出 的 Perylene 衍 生 物 PIPER(perylene diimide)59利用 NMR 證實作用在四股結構 G-quartet 平面上。從鏈 菌類 Streptomyces anulatus 3533-SV4 中分離得到的天然物 Telomestatin60,對端粒 四股結構有專一的作用結構可以提升解旋溫度 30℃且具有良好的端粒酶抑制果 效。 Neidle 團隊根據 2,6-diamidoanthraquinone 後續設計出的 Braco-1961, Braco-19 進一步被 X-ray 解出與端粒四股結構形成 complex62,Braco-19 利用 end-stacking mode 在 G-quartet 平面上,且能使四股結構大幅提升解旋溫度 27.5
℃。 Mergny 團隊設計以 quinacridine dimer 為衍生物的 BOQ3 可以提升四股結 構解旋溫度 28℃63。 Balasubramanian 團隊設計出以 pyridostatin 為 core 的 Tel 1 小分子更可以提升 35℃,且進一步抑制端粒酶活性,影響端粒周邊的 protein Pot1 (protect of telomeres 1 )造成癌細胞產生 DNA damage signal64。 我們實驗室是以 小分子 carbazole 為 core 合成出 3,6-bis(1-methyl-4-vinylpyridinium) carbazole diiodide (BMVC)有機小分子65,與 DNA 作用後其螢光會增強 100 倍66成為重要 的螢光探針分子,而且同時具有穩定 G 四股結構的能力也可以抑制端粒酶的活 性67。
除了上述提到的之外,還有很多小分子路續被設計出作為四股結構穩定劑
68,69但大部分主要的作用是與 G-quadruplex 外側的 G-quartet 平面以- interaction
- 14 -
Telomestatin
Tel1
NH
N N
I I
BMVC
為主要的 end-stacking 作用模式(圖 1.12) 68,69;同時,兩端的正電荷會和 DNA 帶 負電的磷酸根骨架藉由正負電荷的庫倫作用力,讓分子嵌在 G-quadruplex68,69。 從早期研究中發現,此類分子大多能增加 G-quadruplex 的熱穩定性37。
圖 1.11 G-四股結構穩定劑 (G-quadruplex stabilizer) 68,69 2,6-diamidoanthraquinone
- 15 -
圖 1.12 G-四股結構穩定劑 BSU6039 與四股結構作用 end-stacking 作用之 X-ray 結構68,69
- 16 -
- 17 -
第二章
實驗方法
- 18 -
Chemical synthesis
圖 2.1 BMVC 衍 生 物 合 成 流 程 圖
2a= -CCOCCOCCOCC- 2b= -CCOCCOCC- 2c= -CCCCCCCC- NH
Br Br
N Br R
Br Br
N N R
Br Br
N N R
N N
N N+R
N+ N+
I-
I- I-
BMVC-8C3O= -CCOCCOCCOCC- BMVC-6C2O= -CCOCCOCC- BMVC-8C= -CCCCCCCC- tetraethyl dibromide
NaH,THF piperidine,NaH
DMF
CH3I Acetone
Pd(OAc)2 tri-o-tolylphosphine
4-vinylpyridine
MeCN/Et3N
3a= -CCOCCOCCOCC- 3b= -CCOCCOCC- 3c= -CCCCCCCC-
4a= -CCOCCOCCOCC- 4b= -CCOCCOCC- 4c= -CCCCCCCC-
- 19 -
BMVC-8C3O 的 合 成
首 先,於 氮 氣 環 境 下 利 用 在 DMF( 20 m L)中 的 氫 化 鈉( 0.295 g,
12.3 mmol e , 購 自 Aldrich ) 對 3,6 -dibromocarbozle 1 ( 2 g , 6.15 mmole , Aldri ch ) 之 N9 進 行 取 代 反 應 , 而 合 成 化 合 物 2a。 之 後 加 入 Br-R -Br( 100 mmole,R=-CCOCCOCCOCC-),使 其 混 合 物 回 流( reflux)
12 小 時 。 以 甲 醇 對 廢 棄 的 氫 化 鈉 進 行 冷 卻 及 淬 冷 (直 接 將 甲 醇 慢 慢 加 入 反 應 系 統 ,是 為 了 將 混 合 反 應 中 剩 餘 的 氫 化 鈉 進 行 處 理 然 後 接 下 步 驟 萃 取 , 之 後 以 H2O/乙 酸 乙 酯 (比 例 1: 1) 對 溶 液 進 行 兩 次 萃 取 , 經 萃 取 後 的 有 機 層 以 MgSO4 乾 燥 之 , 所 得 產 物 以 快 速 矽 膠 管 柱 silica gel 層 析 加 以 純 化 , 並 收 集 純 化 後 的 產 物 2a, 其 沖 提 液 為 己 烷 /乙 酸 乙 酯
( 2/1,v/v)。將 B2b( 5.0 mmole)(乾 燥 的 粉 末 )、哌 啶( piperidine)
( 0.5 mL,Aldrich) 及 微 量 1.25mmole NaH(氫 化 鈉 )在 THF( 20 mL)
中 回 流 6 小 時,即 可 得 出 末 端 接 有 哌 啶 的 化 合 物 B3b。 使 溶 劑 真 空 蒸 發 , 並 將 殘 餘 物 透 過 矽 膠 管 柱 (同 上 ) ( 為 自 製 管 柱 成 分 為 矽 膠 silica gel )) )層 析 純 化 並 收 集 黃 色 產 物 3a,其 沖 提 液 為 己 烷 / 乙 酸 乙 酯( 2/ 1,
v/v) 。
在 高 壓 系 統 中 , 使 3 a 與 4-乙 烯 吡 啶 ( 4 -vi n yl p yridi ne ) 於 乙 酸 鈀 (II)/三 鄰 甲 苯 基 膦 ( tri-o- tolylphosphine) 混 合 粉 末 在 三 乙 基 胺 /乙 腈 溶 劑 對( solvent pair)中 進 行 偶 合 (混 合 粉 末 包 含 乙 酸 鈀 (II)/三 鄰 甲 苯 基 膦( tri-o- tolylphosphine)加 上 B3b 與 4-乙 烯 吡 啶 溶 於 三 乙 基 胺 /乙 腈 溶 劑 對 ( s olvent pai r ) ), 並 使 該 系 統 保 持 在 大 約 105
C 的 溫 度
下 兩 天 的 時 間 。 之 後 收 集 沉 澱 物 , 並 以 H2O/C H2Cl2(比 例 為 1:1)萃 取 兩 次 。 過 濾 並 收 集 無 法 溶 於 CH2Cl2層 的 固 體 , 以 THF 熱 溶 液 清 洗 兩 次 , 之 後 以 MgSO4 進 行 乾 燥 。 以 快 速 管 柱 silica gel 進 行 層 析 純 化 , 即 得 粗 產 物 B4b 粉 末 , 其 沖 提 液 為 丙 酮 / 正 己 烷 的 梯 度 溶 液 (比 例 為- 20 -
1:3)。 將 4 a 與 過 量 的 C H3I 在 DMF 中 一 同 回 流 後 , 所 得 橘 紅 色 粉 末 即 為 目 標 產 物,即 N-9 位 置 經 取 代 之 BMVC 衍 生 物 BMVC-8C3O,其 產 率 及 NMR 資 料 如 下 :
BMVC-8C3O:
3,6-Bis(1-methyl-4-vinylpyridium iodide)-9-(1-(1-methyl-piperidinium iodide)-3, 6,9-trioxaundecane) carbazole (Yield: 86%, mp > 300℃),
1H NMR (400 MHz, DMSO-d6) δ: 8.80 (d, J = 6Hz, 4H), 8.68 (s, 2H), 8.23 (d, J = 16Hz, 2H), 8.20 (d, J = 7.2Hz, 4H), 7.90 (d, J = 8.8Hz, 2H), 7.76 (d, J = 8.4Hz, 2H), 7.59 (d, J = 16Hz, 2H), 4.64 (t, 2H), 4.24 (s, 6H), 3.82 (t, 2H), 3.71 (t, 2H), 3.47 (m, 4H), 3.38 (m, 10H), 2.97 (s, 3H), 1.67 (m, 4H), 1.43 (m, 2H).13C NMR (400 MHz, DMSO-d6) δ : 153.32, 145.24, 142.68, 142.28, 127.63, 127.21, 123.37, 123.14, 121.58, 121.04, 111.47, 70.48, 70.05, 69.87, 69.83, 63.87, 61.24, 47.21, 20.88, 19.71
另 一 個 N-9 位 置 經 取 代 之 BMVC 衍 生 物 BMVC-6C2O 和 BMVC -8C 亦 可 使 用 上 述 流 程 得 出 , 但 其 製 程 中 的 反 應 物 Br-R -Br 中 的 R=-CCOCCOCC-。 BMVC-6C2O 之 產 率 及 NMR 資 料 如 下 :
BMVC-6C2O:
3,6-Bis(1-methyl-4-vinylpyridium iodide)-9-(1-(1-methyl-piperidinium iodide)-3,
6-dioxaoctane) carbazole (Yield: 83%, mp > 300 ℃ ),
1H NMR (400 MHz, DMSO-d6) δ: 8.81 (d, J = 6Hz, 4H), 8.68 (s, 2H), 8.23 (d, J = 16Hz, 2H), 8.21 (d, J = 7.2Hz, 4H), 7.92 (d, J = 8.8Hz, 2H), 7.76 (d, J = 8.4Hz, 2H), 7.58 (d, J = 16Hz, 2H), 4.68 (t, 2H), 4.33 (s, 6H), 3.85 (t, 2H), 3.68 (t, 2H), 3.51 (m, 2H), 3.42 (m, 6H), 2.99- 21 -
(s, 3H), 1.67 (m, 4H), 1.43 (m, 2H).
13C NMR (400 MHz, DMSO-d6) δ : 153.32, 145.30, 142.45, 142.38, 127.58, 127.21, 123.32, 123.52, 121.68, 122.44, 111.47, 70.38, 70.25, 69.97, 69.88, 63.92, 61.35, 48.20, , 20.71, 19.66
BMVC-8C:
3,6-Bis(1-methyl-4-vinylpyridium iodide)-9-(1-(1-methyl-piperidinium iodide) octyl) carbazole (Yield: 90%, mp > 300℃),
1H NMR (400 MHz, DMSO-d6) δ:8.82 (d, J = 6.4Hz, 4H), 8.63 (s, 2H), 8.20 (d, J = 6.4Hz, 4H), 8.19 (d, J = 16Hz, 2H), 7.92 (d, J = 8.4Hz, 2H), 7.77 (d, J = 8.4Hz, 2H), 7.55 (d, J = 16Hz, 2H) 4.48 (t, 2H), 4.24 (s, 6H), 3.25 (m, 6H), 2.94 (s, 3H),1.80 (m, 2H), 1.73 (m, 4H), 1.59 (m, 2H), 1.50 (m, 2H), 1.30 (m, 4H), 1.24 (m, 4H).
13C NMR (400 MHz, DMSO-d6) δ : 153.29, 145.26, 142.35, 142.28, 127.53, 127.30, 123.34, 123.07, 121.66, 121.02, 111.12, 60.32, 47.18, 28.98, 28.84, 26.75, 26.16, 21.27, 21.07, 19.66
Br-R-Br 的 合 成
HO-R-OH( 0.5mol e, R =-CCOC COCC OCC -or-CC OCCOC C -) 在 4℃
冰 浴 慢慢加入 0.5mole PBr3 (in CHCl3 20ml) 1 小時之後 混和物加熱至 50-60 °C 12 小時之後降至室溫加入 CH2Cl2 (40 ml)再慢慢小心加入 NaHCO3 0.1M 10ml 中 和過量的 PBr3 用等量的水與 CH2Cl2萃取 取有機層加入之 後 以 MgSO4 進 行 乾 燥 過 濾 後 將 其 迴 旋 濃 縮 以 快 速 管 柱 silica gel 進 行 層 析 純 化 沖 提 液 其 沖 提 液 為 正 己 烷 濃 縮 得到 10ml 無色液體 yield 80-90%.
3, 6-dioxaoctane-1,8-dibromide ( n = 2),
1H NMR (400 MHz, CDCl3) δ: 3.47 (t, 4H), 3.68 (s, 4H), 3.85 (t, 4H).- 22 -
DNA sample
實驗所用 DNA sample 由 Bio Basic Inc.訂購。配置 DNA 使用的緩衝溶液為 10 mM Tris-HCl,150 mM KCl(pH 7.5)。寡核苷酸混合緩衝溶液後,於 95℃加 熱五分鐘後緩慢降於室溫,保存在 4℃冰箱隔夜後再使用。DNA 濃度利用吸收 光譜儀測量 260 nm 吸收值(O.D.)定出 DNA 濃度。本實驗所用 DNA 序列如下。
DNA 序列 縮寫
5’-G3TTAG3TTAG3TTAG3 HT21 5’-G3TTAG3TTAG3TTAG3T HT21-T 5’-AG3TTAG3TTAG3TTAG3 A-HT21 5’-TAG3TTAG3TTAG3TTAG3 TA-HT21 5’-AG3CTAG3CTAG3CTAG3 CTA22
5’-(TTAGGG)4 HT24
5’-(TTAGGG)8 HT48
含有15N isotope labeling 的 DNA 是利用
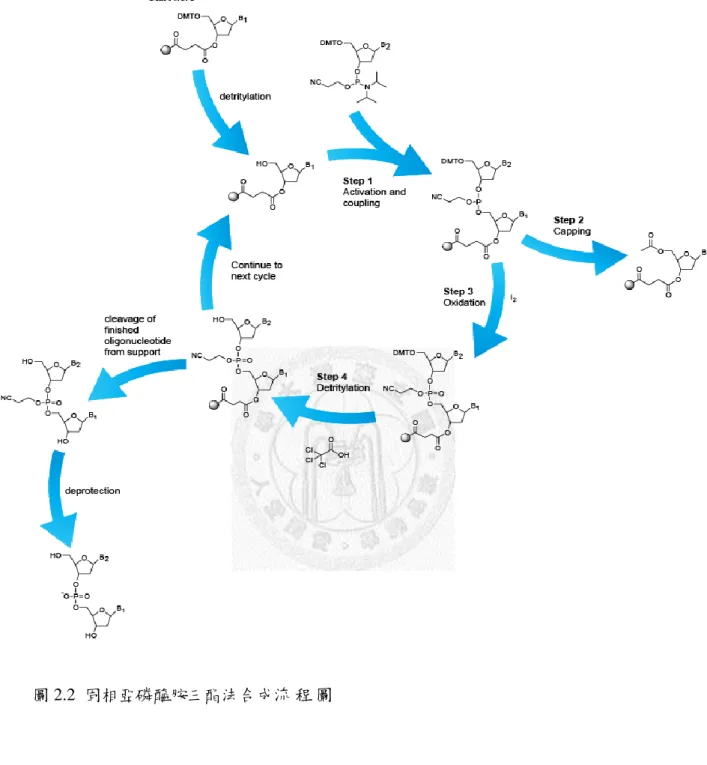
Dr. Oligo® -96(Azco Biotech, Inc. USA) 採用固相亞磷醯胺三酯法合成(
Solid phase phosphoramidite DNA synthesis)。亞磷醯 胺三酯法合成(
phosphoramidite DNA synthesis)70,將 DNA
核苷酸(
nucleoside)固 定在固相載體 CPG (
controlled pore glass)上完成 DNA 鏈的合成的,合成的方向是 由待合成引子的 3' 端向 5' 端合成的,相鄰的 DNA 核苷酸
nucleoside通過 3' → 5' 磷酸二酯鍵(phospordiester)連接,具體反應步驟如圖 2.2。
第一步:Detritylation
將預先連接在固相載體 CPG
(
controlled pore glass)
上的活性基團被保護的核苷 酸(
nucleoside) 與三氯乙酸(DMT)反應,脫去其 5'- OH 基團的保護基團三氯乙酸- 23 -
(DMT) ,獲得游離的 5'- 羥基。
第二步:Activation and Coupling
亞磷醯胺(phosphite-triester) 保護的核苷酸(nucleoside)單體,與活化劑四氮唑 (tetrazole)混合,得到核苷亞磷酸活化中間體,它的 3' 端被活化,與 CPG 載體 上連接鹼基的 5'- OH 基團發生縮合反應。
第三步:Capping
縮合反應中會有少量 5'- OH 基團沒有參加反應,用乙酸酐和 1- 甲基咪唑封閉 5'- OH 基團,使其不能再繼續發生反應,這種短片段在純化時可以分離去除。
第四步:Oxidation
在氧化劑碘的作用下,亞磷醯形式轉變為更穩定的磷酸三酯。
經過以上四個步驟,一個去氧核苷酸被連接到固相載體的核苷酸上。再以三氯乙 酸脫去它的 5'- OH 基團上的保護基團三氯乙酸(DMT),重複以上步驟,直到所 有要求合成的鹼基被接上去,再把去氧核苷酸從固相載體切下。
- 24 -
圖 2.2 固相亞磷醯胺三酯法合成
流 程 圖- 25 -
帶有(95%以上)的
15N isotope labeling G亞磷醯胺
核苷酸(dG- phosphoramidite),與不含15N isotope G
亞磷醯胺
核苷酸(dG- phosphoramidite),配置成 6%15N isotope labeling G亞磷醯胺
核苷酸(dG- phosphoramidite),再選擇的 DNA 序列作標定合 成的序列如下: (*代表有 6% 15N isotope 的 G 鹼基)DNA 序列 縮寫
5’-TAG*GGTTAGGGTTAGGGTTAGGG TA-HT21-G3 5’-TAGG*GTTAGGGTTAGGGTTAGGG TA-HT21-G4 5’-TAGGG*TTAGGGTTAGGGTTAGGG TA-HT21-G5 5’-TAGGGTTAG*GGTTAGGGTTAGGG TA-HT21-G9 5’-TAGGGTTAGG*GTTAGGGTTAGGG TA-HT21-G10 5’-TAGGGTTAGGG*TTAGGGTTAGGG TA-HT21-G11 5’-TAGGGTTAGGGTTAG*GGTTAGGG TA-HT21-G15 5’-TAGGGTTAGGGTTAGG*GTTAGGG TA-HT21-G16 5’-TAGGGTTAGGGTTAGGG*TTAGGG TA-HT21-G17 5’-TAGGGTTAGGGTTAGGGTTAG*GG TA-HT21-G21 5’-TAGGGTTAGGGTTAGGGTTAGG*G TA-HT21-G22
- 26 -
吸收、螢光光譜儀.
吸收光譜儀(HELIOSα, Thermo Fisher Scientific, USA)測得吸收光譜,另外 DNA 可藉由 260 nm 吸收定出濃度。螢光光譜儀(LS-55, PerkinElmer, USA)with 2 nm band-pass,室溫下,以一公分石英比色管測得螢光光譜。
CD 光譜儀
旋光光譜儀(Jasco J-815 spectro-polarimeter, Japan),室溫下 bandwith 2nm,
掃瞄速度 50 nm/min,step resolution 為 0.2 nm,設定量測十次取平均,利用旋光 光譜儀可得 CD 光譜(210 ~ 350 nm,for DNA structure),melting temperature
(10 ~ 95℃)。Kinetic experiment 條件在 30-60℃不同溫度 10 或 30min 隨時間 測光譜取 265 nm 及 295 nm intensity 對時間作圖。
聚丙烯醯胺電泳 (PAGE)
凝膠配置成分如下:
丙烯醯胺(Acrylamide)40% 50mL DDwater 40mL 5xTBE Buffer 10mL TEMED 70μL APS(ammonium persulfate) 700μL
電泳在 4℃下以 250 伏特電壓跑 4~6 小時,跑膠使用的 DNA 濃度 40uM 前染膠
(pre-stained gels)為跑電泳前,將 BMVC-8C3O 和不同濃度的 DNA 混合 over night 後,再進行跑膠,之後以 254 nm UV 燈照射下拍照。
- 27 -
NMR spectra
1D-1H NMR的實驗是利用Bruker 800MHz Avian 與600MHz 搭配cryoprobe 設備所測量 1D imino-proton的實驗條件是在25℃或37℃下,溶劑使用H2O/D2O (90%/10%) 利用 Watergate techniques (p3-9-19) or a jump and return sequence 脈 衝序列做solvent suppression71,而1H-15N 的1D NMR光譜是用SOFAST-HMQC 脈衝序列72,作H1-N1或H8與N7激發( through bond coupling),2D- NOESY是利用 jump and return sequence 脈衝序列做solvent suppression71。DNA的條件1D-1H NMR光譜是 0.1-1mM之間,2D- NOESY是0.5-1mM,buffer條件在 Tris-HCl 10mM (pH7.5) 、 KCl 150mM , 內 加 光 譜 標 準 品 濃 度 0.1 mM DSS (Sodium4,4-Dimethyl-4-silapentane-1-sulfonate)。
- 28 -
示差熱掃描熱微量卡計Differential scanning calorimetry (DSC)
DSC 實驗是利用熱微量卡計 Nano-DSC III calorimeter (New Castle, DE)所 測得實驗裝置cell分成reference與sample cell,伴隨溫度升高產生吸收或釋放的熱 量會導致reference cell 與sample cell的熱改變,兩槽的熱差將由即時進行功率偵 測,因此我們可以觀測到樣品槽中熱訊號的變化,扣除reference cell所產生的熱 可以得到biomolecule的所產生的熱73(圖2.2)。實驗所使用的DNA濃度是150-200 μM,在pH 7.5緩衝溶液Tris-HCl 10 mM, KCl 150 mM下,外加相對5當量的小分 子或在40% PEG條件下,
掃描範圍10℃-120℃、外加3大氣壓73,74 與掃描速率1℃/min進行實驗,data 分析是利用built-in software (NDSC Run version 3.6 and NanoAnalyze version 2.0),
實驗結果相對扣除buffer對buffer scan 取得Cp 對溫度作圖。△Hcal = ∫Cp(T) dT,
△Scal = ∫Cp(T)/T dT以及△Gο= △Hcal-T△Scal,推出37℃下的unfolding free energy (△G37
ο)。
圖 2.3 DSC 實驗原理示意圖
- 29 -
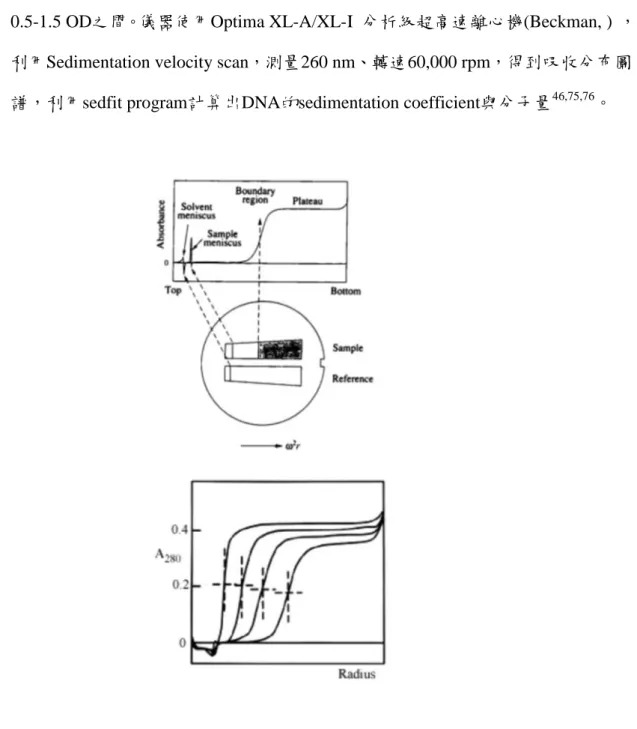
超高速離心 analytical ultracentrifuge
a
nalytical ultracentrifuge簡稱為AUC,它的原理是在外加固定重力埸情況下,測量樣品分子在溶液中sedimentation (沉降)方式,進而計算分子的native分子量。
一般使用Sedimentation velocity方法,使用的離心力高到足以使均勻溶液中的分 子沉降到石英槽底,在離心過程中會產生明顯的界面,下層是沉降分子形成的均 勻濃度,而上層是去除樣品分子部份,上下層之間有明顯的界面, 測量這個界 面移動的速率,可以計算出分子的沉降係數(sedimentation coefficient)。這個係數 與分子的質量有關,同時與frictional coefficient倒數成正比,且與分子的體積(形 狀)有關。圖2.4表示不同沉降速度時界面移動的情形,所對應之吸收光譜。
)
)
Svedberg equation上式表示該係數以dr/dt表之r為距離,而t為時間。f為摩擦係 數。Mw為分子量, v為partial specificvolume,,ω為radial velocity of the rotor in radians per second , NA為Avogadro’s number , 而 溶 液 的 密 度 為 ρ 。 rate of sedimentation與分子量Mw,離心力ω2r,density difference between molecule and the solvent, 有 關 。 , frictional coefficient. 值 愈 高 , 沉 降 速 率 愈 低 。 分 子 的 sedimentation coefficient(s) 定義為指定離心重力埸(dr/dt) (1/ ω2r)中的沉降速率,
而s的單位為10-13 s (Svedberg unit) sedimentation coefficient為分子在重力埸中的 沉降速率,而測量該係數可以得知分子在溶液中的水合動態 (hydrodynamic)特性 及計算出分子量推得分子狀態。
實驗條件DNA sample 1-3 µM之間,體積1000 µL,分別與BMVC-8C3O、
BMVC-6C2O、BMVC-8C五倍當量加熱至95℃到25℃之後,測量sample吸光值約
- 30 -
0.5-1.5 OD之間。儀器使用Optima XL-A/XL-I 分析級超高速離心機(Beckman, ) , 利用Sedimentation velocity scan,測量260 nm、轉速60,000 rpm,得到吸收分布圖 譜,利用sedfit program計算出DNA的sedimentation coefficient與分子量46,75,76。
圖 2.3
Sedimentation velocity scan 實驗所測得之吸收分布圖譜- 31 -
第三章
人類端粒四股結構在鈉/鉀離子的結構轉換機制
- 32 -
3.1 簡介
人類端粒四股結構在鈉、鉀離子中的結構轉換
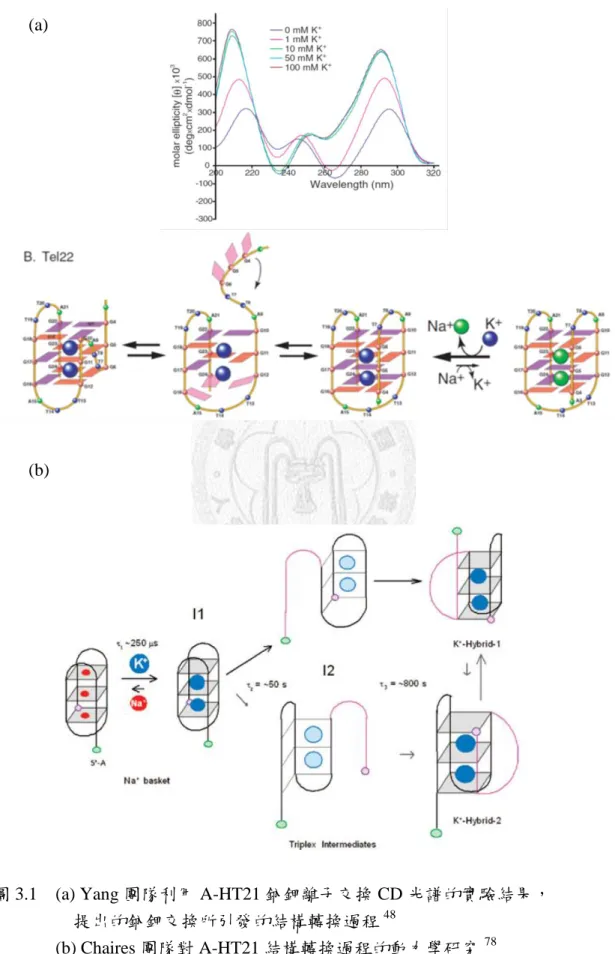
人類端粒四股結構的多樣性,使得許多研究團隊對不同結構之間的關聯特別 有興趣,由於四股結構對離子有不同的選擇性,所以對於離子交換的過程與結構 之間的變化有更多的可能性,1990 年 Sen 說明了鈉、鉀離子影響端粒四股結構 的轉換,並且推測在生理條件下可能會發生77,所以人類端粒四股結構的轉換在 生物活性上或設計四股穩定劑相當具有重要性。先前提到到人類端粒四股結構最 早是在鈉離子溶液下利用 NMR 所解出,為反平行籃型的結構 43。隨後在 2006 年 Yang、Patel 與 Sugiyama 團隊分別解出了人類端粒四股結構在鉀離子溶液的 NMR 結構 46,48-49,由於需要定出完整結構,所以他們分別擷取 5 端與 3 端鹼基 序列或是利用變異的序列來解結構,而他們三個團隊的結果都得到在鉀離子溶液 的 NMR 結構為混和型結構。因此根據 NMR 的結果,人類端粒四股結構在鈉、
鉀離子條件下的結構相當不一樣,又已知鉀離子又比鈉離子對四股結構穩定性較 好,所以 Yang 進一步提出了結構轉換的模型(圖 3.1 a)49,說明了在鈉離子的反 平行籃型四股結構在加入鉀離子後會發生結構轉變,對應 CD 光譜與 NMR 光譜 的光譜轉變的結果。由於鈉/鉀離子交換所誘導的光譜轉變相當快,Chaires 團隊 根據先前 Yang 團隊所提出的模型,進一步利用 CD 光譜的 291 nm 訊號與 265 nm 訊號從事動力學的量測,推測開始是離子在數百微秒之間先行交換,接者有結構 的解開,然後才有重新摺疊的過程,根據 fitting CD 訊號的結果提出結構轉換發 生時間約在數十秒至數百秒 (圖 3.1 b) 78。
- 33 -
(a)
(b)
圖 3.1 (a) Yang 團隊利用 A-HT21 鈉鉀離子交換 CD 光譜的實驗結果,
提出的鈉鉀交換所引發的結構轉換過程48
(b) Chaires 團隊對 A-HT21 結構轉換過程的動力學研究78
- 34 -
根據 Yang 等人提出的模型,認為人類端粒四股結構在鈉、鉀離子的不同所 造成的光譜轉變是由於結構上的轉變,因此轉換過程中會引發原本的四股結構解 開並再摺疊成新的混合型四股結構。 Fegion 團隊 79 所報導的草履蟲端粒序列 (G4T4G4)2 的四股結構在鈉/鉀離子交換過程中,只有引發離子交換,並沒有結構 上的大幅變動。 其中(G4T4G4)2 在鈉離子跟鉀離子條件下都是反平行籃型結構 (圖 3.2 ),雖然這兩個的條件下的 CD 與 NMR 光譜不同,但在鈉離子條件下一加 入鉀離子,馬上就變成鉀離子條件的光譜,他們認為這麼快的轉換,只有離子交 換與 loop 的結構小幅變動,而不是經由大幅結構變化;如果有發生結構轉變,
解開的過程需要跨越一定的能障,導致轉換的時間變長。另外,Vorlickova 團隊
80發現不同人類端粒序列會有 CD 訊號上的差異,特別是 5 端與 3 端增加鹼基會 造成 CD 265 nm 訊號上升,但結構卻沒有太大差異,而類似的四股結構在 CD 光譜訊號也會不同,說明 CD 光譜的改變不一定是由於結構的改變。
圖 3.2 Fegion 團隊所報導的草履蟲端粒(G4T4G4)2 四股結構在鈉鉀交換的結構 與光譜圖
- 35 -
(a)
(b)
圖 3.3 本實驗室所報導的人類端粒四股結構在鈉鉀交換的過程,(a)利用 BMVC 小分子來討論 HT24 (T2AG3)4 鈉鉀交換的過程81。(b)利用單分子實驗觀察人類 端粒四股結構在鈉鉀交換的過程82。
- 36 -
2007 年,我們利用實驗室研發的端粒四股結構的穩定試劑,BMVC 探針小 分子來追蹤結構轉換過程 81,Yang 等人所推測的模型是由在鈉離子中的反平行 籃型四股結構轉變成在鉀離子中混合型四股結構,從構型上來看結構應會有很大 的變動,因此光譜上明顯的變化是否代表者結構轉換的過程呢? 特別是經由反平 行籃型四股結構變成混合型結構,推測會經由結構大幅解開的過程。若果真是經 由結構大幅解開的過程,我們可以經由 BMVC 作用在四股結構的訊號變化得到 驗證。圖 3.3 是人類端粒四股結構 d(T2AG3)4 (HT24)在鈉離子條件下混合等量的 BMVC,加入不同濃度的鉀離子,發現 BMVC 的誘導 CD 光譜沒有變動,但四 股結構的 CD 光譜卻從鈉離子轉變成鉀離子的訊號,由於 BMVC 在交換過程都 是貼附在四股平面上,所以推測整個過程沒有發生大幅結構的變化。
考量轉變過程極可能是非同步的,在整體平均下訊號被抵銷掉了,而單分子 的技術可以避免整體平均的影響,能夠觀察每一個單一的變化,所以我們進一步 利用單分子 tethered particle motion (TPM)的技術,確認鈉/鉀轉換過程沒有大幅的 結構解旋過程 (圖 3.3 b)82,所以轉換的過程只有離子交換和 loop 結構小幅變化,
呼應先前在 Fegion 團隊的結果。2009 年,Phan 與 Patel 團隊用 NMR 解出 d(GGGTTAGGGTTAGGGTTAGGGT) ( HT21-T) 51 為反平行籃型(anti-parallel basket type),類似 1993 年人類端粒四股結構在鈉離子的結構,但只有兩層 G-quartet 平面,所以轉換過程有可能沒有大幅的結構變化只是有離子交換與結構 小幅改變。然而,Yang 團隊隨後進一步用 Inosine 取代 A-H21-T 序列其中的一個 Guanine 鹼基,解出兩層 G-quartet 平面的反平行籃型,並說明此結構的穩定性較 差,推測此結構可能是中間態,進而提出了新的結構轉換模型(圖 3.4)83。 因此在討論鈉/鉀轉換過程有兩個模型,一個是在離子交換的過程中,由於 鈉與鉀的結構不同,結構會先解開,而後再重新折疊,可以從鈉/鉀的光譜轉換 說明結構交換的過程;另一個主張結構沒有大幅改變,光譜的改變是由於離子交
- 37 -
換的結果,考量四股結構相對穩定,而快速的光譜轉換過程,也不支持大幅結構 的改變,所以至今都還沒有明確的解釋。
圖 3.4 Yang 團隊所提出的進一步鈉/鉀交換機制,經過結構為兩層 G-quartet 反 平行籃型四股結構的中間態83。
- 38 -
3.2 研究動機:
先前所研究的四股結構在鈉離子溶液中的序列為 A-HT21,而在鉀離子溶液 中的 A-HT21 卻因同時具有多種結構而無法解出,取而代之的是其他序列被解出,
例 如 在 鉀 離 子 溶 液 中 的 TA-HT21 主 要 結 構 是 第 一 種 混 合 型 (hybrid-I) , 而 TA-HT21-TT 主 要結 構是 第 二 種 混合 型 (hybrid-II) , 另外 HA21-T 卻是 兩層 G-quartet 平面的反平行籃型,而這些序列差異使得在鉀離子溶液中的結構至少有 三種類型。因此在探討人類端粒四股結構的鈉/鉀離子結構轉換過程,必須要確 認同一條序列在鈉離子或鉀離子的四股結構,這樣才能完整說明的鈉/鉀交換機 制,否則序列的差異非常有可能造成四股結構在不同離子溶液中的結構多樣性,
另外鈉、鉀離子交換所造成 CD 光譜的改變是否可以直接推測結構上的變化呢?
我們嘗試利用 NMR 的方法來定出 TA-HT21 序列在鈉離子溶液中的結構,
再配合已知鉀離子中 TA-HT21 的結構是第一種混合型 (hybrid-I),或許有機會驗 證端粒四股結構鈉/鉀離子轉換過程的機制。
- 39 -
3.3 結果與討論:
TA-HT21 四股結構在鈉離子與鉀離子條件之比較
我們利用 CD 光譜,來量測 TA-HT21 分別在鈉離子與鉀離子溶液中的訊號,
圖 3.5a 主要都有 CD 295nm 正值的訊號,但鉀離子條件的訊號較強,而主要差 異在 CD 265nm 的訊號,在鈉離子條件下為負值、而鉀離子條件下為正值。在 25℃,加入不同濃度的鉀離子之後,可以發現 CD 的訊號隨加入鉀離子濃度上 升,最後光譜與單純鉀離子條件下的相同,符合先前 HT24 與 A-HT21 序列的結 果,利用 CD 光譜可以確認 TA-HT21 鈉離子條件下變成鉀離子條件。我們利用 變溫 CD 光譜來比較離子之間的穩定性,圖 3.5b 在鈉離子條件下解旋溫度約為 59.3℃,而在鉀離子下解旋溫度約為 68.9℃,相差約近十度;另外鈉離子條件中 加入等量的鉀離子,其解旋溫度也提高到與鉀離子相同,動力學跟熱力學的結果 都顯示四股結構在鉀離子中比在鈉離子中穩定。
圖 3.5c 是 TA-HT21 序列分別在鈉與鉀離子中的 imino-proton NMR 光譜 (imino-proton 位於 G 鹼基的 1 號位置)。NMR 光譜顯示 TA-HT21 在鈉離子與鉀 離子中的 imino-proton 完全不同,可能是由於 G-quartet 的 imino-proton 在鈉離子 與鉀離子中感受到的化學環境不同所造成的差異。在鉀離子中的 TA-HT21 已經 由所對應 G 鹼基上的 imino-proton 定出結構47,雖然在鈉離子中尚未定出結構,
但 TA-HT21 在鈉離子中有明確的 imino-proton 訊號
- 40 -
(a) (b)
(c)
圖 3.5 (a) TA-HT21 端粒四股結構 CD 光譜,在 Na+ 150 mM 條件 25℃下(黑線),
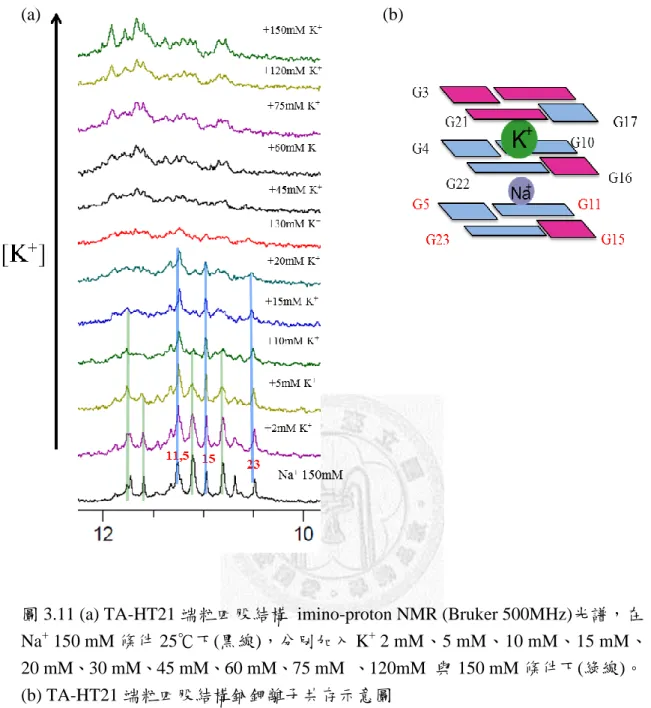
分別加入 K+ 15 mM、30 mM、60 mM、90 mM、120 mM 、150 mM 與 K+ 150 mM 條件下(紫線), (b) 利用在 295 nm CD 的變溫訊號,量測 TA-HT21 在 Na+ 150 mM 溶液中(黑線)、Na+ 150 mM 加 K+ 150 mM(紅線)、與 K+ 150 mM 溶液中(藍線) 的 Tm,(c) Imino-proton NMR 光譜(Bruker 800MHz),TA-HT21 在 K+ 150 mM 溶液 中(上圖)、在 Na+ 150 mM 溶液中(下圖)。
200 240 280 320 360
0 10 20
CD (medg)
Wavelength
TA-HT21 Na+ 150mM +K+ 15mM +K+ 30mM +K+ 60mM +K+ 90mM +K+ 120mM +K+ 150mM K+ 150mM
20 40 60 80 100
0.0 0.5 1.0
Nomalized CD 295nm intensity
Temperature
TA-HT21 Na+ 150mM
Na+ 150mM+K+ 150mM K+ 150mM
59.3℃ 68.9℃
- 41 -
利用 NMR 決定 TA-HT21 在鈉離子條件下的結構
由於 TA-HT21 有 12 個 G 鹼基,每個 G 的化學結構相同,所以難以直接從 NMR 光譜作判定,。我們利用 site-specific 15N isotope labeling 的方法70,分別標 定 TA-HT21 中 11 個 G 鹼基,才能得知 12 根 imino-proton 所對應的訊號,增加 標定的 G 鹼基 6% 15N 同位素含量,再同時激發 N 原子與 H 原子的所測得15N- filter imino-proton 光譜,由於15N 自然界含量只有 0.37% ,而我們用 6% 可以 區分有標定 G 鹼基的 imino-proton 位置,由圖 3.6a 可知道,TA-HT21 在鈉離子 條件下的 imino-proton H1 的對應,另外利用同樣方法找出 H8 aromatic-proton 所 對應的位置(圖 3.6b)。
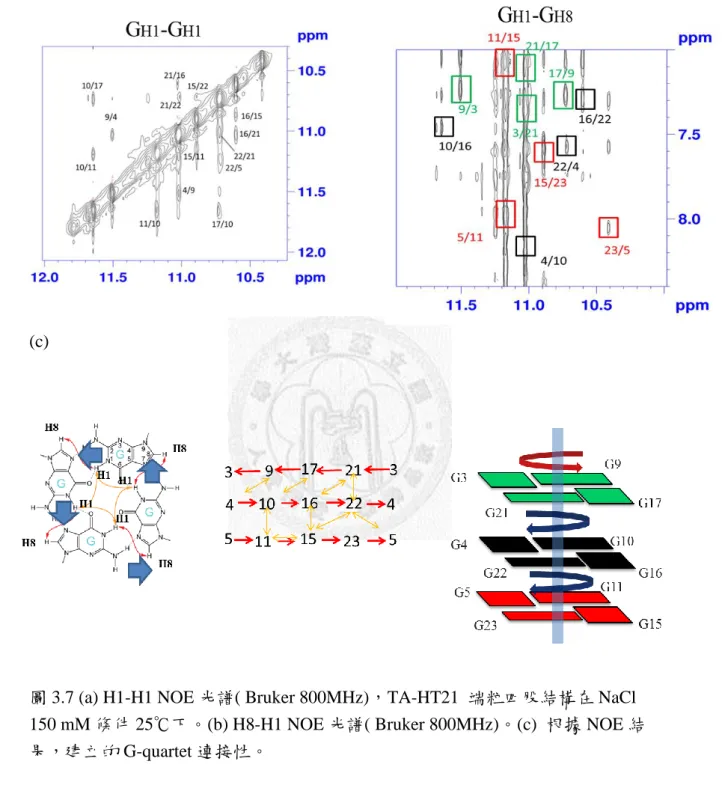
G-quartet 是由四個鹼基利用氫鍵連結,所以在空間上靠得很近,所以利用 NMR 的 2D-NOESY 可以得知空間上靠近的 spin,圖 3.7a 顯示相鄰 G 鹼基 H1 與 H1 的 NOESY ,可以發現 G 鹼基跟周圍都會有訊號,例如 G10-G17、G9-G4,
G22-G5 等等。但由於接近 diagonal peak 和有些 H1-H1 的 NOE 效應較弱,因此 我們只利用 H1-H1 的 NOE 在判讀 G-quartet 連結有模糊的地帶,所以必須利用 G 鹼基 H1 與下一個 G 鹼基 H8 的空間靠近的 NOESY 比較能清楚的得到 G-quartet 的連接71。
根據(圖 3.7b) G 鹼基的 H1 H8 NOE 作用方向,第一層 G-quartet 依序為 G3-H1 對 G21-H8 、接者 G21-H1 對 G17H8、G17-H1 對 G9-H8、G9-H1 對 G3H1,
另外根據連接可知道 G-quartet 氫鍵方向(圖 3.7c),所以第一層 G3 G21 G17 G9 為 逆 時 針 , 而 第 二 層 順 序 G4 G10 G16 G22 為 順 時 針 , 第 三 層 G5 G11 G15 G23 也為順時針,這個連接順序與先前文獻報導在在鉀離子條 件相同47,依據這個連接順序與目前三種 loop 纏繞的方式可以推測 TA-HT21 在 鈉離子溶液中有可能是第一種混合型,但混和型四股結構具有不對稱的鹼基結構,
所以進一步我們利用鹼基的 H8 與醣基 H’1 的 NOE 光譜,來觀察鹼基的連接性 和與醣基的空間關係是同向 (Syn)或是反向(Anti)。
- 42 -
圖 3.8a 可知道同向(Syn)的 H8-H’1 空間排列較近,所以 NOE 訊號較強,而 反向(Anti)空間距離遠,所以訊號相對同向(Syn)弱。 由圖 3.8b H8-H’1 的 NOE 光譜可知道大部的鹼基與醣基空間排列都是反向(Anti),但 G3、G9、G15、G16 與 G21 為同向(Syn),另外 H8-H’1 的 NOE 可以觀察鹼基之間的連接(圖 3.8c),
由於空間上鹼基是由醣基連接,所以上面的鹼基 H’1n 會與下一個鹼基的 H8n+1 有 NOE 效應,出現 cross peak 訊號。因為鹼基與醣基分成同向(Syn)還是反向(Anti),
所以 H’1n 與 H8n+1 NOE 效應也不同組合,出現 cross peak 訊號最強為上下皆為 相反向(Anti)鹼基,而同向(Syn)鹼基中的醣基 H’1 與上下鹼基的 H8 NOE 訊號較 弱71。
根據 H1-H1、H8-H1、H8-H’1 的 NOE 光譜的結果來看,我們定出了 TA-HT21 在 鈉 離 子 條 件 下 是 第 一 種 混 合 型 四 股 結 構 。 比 較 1993 年 解 出 的 d(AGGGTTAGGGTTAGGGTTAGGG) (A-HT21)在鈉離子條件下為反平行籃型 四 股 結 構 43, G-quartet 的 順 序 為 第 一 層 G2 G10 G22 G14 、 第 二 層 G3 G21 G15 G9、第三層 G4 G8 G20 G16,所以 G-quartet 氫鍵方向 A-HT21 是第一層順時針、第二層逆時針和第三層順時針,比較與 TA-H21 的結果,
TA-HT21 的 G-quartet 氫鍵方向,第一層為逆時針、第二層順時針、第三層也為 順時針,而且空間上 strand 的順序與方向性也不同,A-HT21 的結構第一條 strand (G2-G3-G4)與第二條(G8-G9-G10)、第三條 strand (G14-G15-G16)相鄰,方向性為 兩條同向、兩條反向。TA-HT21 的結構在第一條 strand (G3-G4-G5)與第二條 (G9-G10-G11)、第四條 strand (G21-G22-G23)相鄰,。在鹼基與醣基同向(Syn)的 部分,TA-HT21 有五個同向(Syn) G 鹼基 分別為 G3、G9、G15、G16 與 G21,
而 A-HT21 有六個同向(Syn) G 鹼基分別為 G3、G8、G10、G15、G20 與 G22,
這六個 G 鹼基是兩兩相對,所以從結構來看,TA-HT21 與 A-HT21 序列上僅僅 只差一個鹼基,但卻造成兩者的結構有相當大的差異,因此序列對四股結構的影 響相當大。
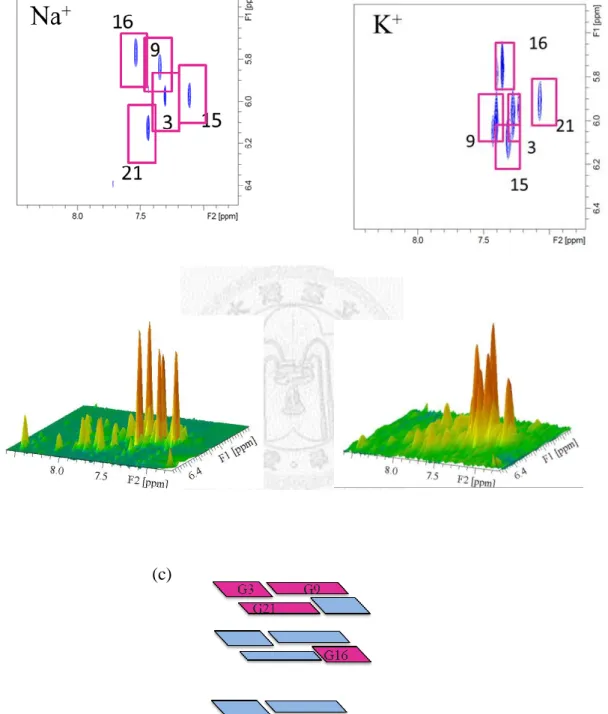
- 43 -
接者進一步比較在 TA-HT21 鉀離子結構與鈉離子結構的差異,在鉀離子結 構同向的有五個同向(Syn) G 鹼基46 分別為 G3、G9、G15、G16 與 G21,而在 鈉離子結構也為五個同向(Syn) G 鹼基 分別為 G3、G9、G15、G16 與 G21(圖 3.9),
所以鉀離子與鈉離子結構在鹼基與醣基的空間關係也相同。根據 NMR 的結果來 看,TA-HT21 在鈉離子條件下是第一種混合型四股結構,證明了與在鉀離子條 件下結構相同,在討論鈉/鉀轉換過程,我們定出了同一條序列在鉀離子中與鈉 離子中的四股結構,知道了鈉/鉀轉換過程的起點與終點,對釐清整個轉換過程 有相當的助益,排除了不同序列的四股結構作為轉換過程的起點與終點所造成的 複雜度。
- 44 -
(a)
(b)
圖 3.6 Site-specific 15N (6%) isotope labeling NMR (Bruker 800MHz)光譜,
TA-HT21 端粒四股結構在 NaCl 150 mM 條件 25℃下。(a) imino-proton H1 位置 (b) aromatic-proton H8 位置。
- 45 -
(a) (b)
(c)
圖 3.7 (a) H1-H1 NOE 光譜( Bruker 800MHz),TA-HT21 端粒四股結構在 NaCl 150 mM 條件 25℃下。(b) H8-H1 NOE 光譜( Bruker 800MHz)。(c) 根據 NOE 結 果,建立的 G-quartet 連接性。
- 46 -
(a) (b)
(c)
圖 3.8 (a) 鹼基和與醣基的空間關係,同向(Syn)與反向(Anti)。
(b) H8-H’1 NOE 光譜 ( Bruker 800MHz),TA-HT21 端粒四股結構在 Na+ 150 mM 條件 25℃下。 (c) 根據 NOE 結果,建立 TA-HT21 在鈉離子條件下四股結構的 連接性。
- 47 -
(a) (b)
(c)
圖 3.9 H8-H’1 NOE 光譜( Bruker 800MHz) 25℃下,(a)在 Na+ 150 mM 條件下。
(b)在 K+ 150 mM 條件下。(c) TA-HT21 端粒四股結構 G-quartet 同向(Syn)鹼基(紅) 對。
- 48 -
TA-HT21 四股結構的鈉、鉀離子轉換過程
圖 3.10a 將等量鉀離子加入 TA-HT21 在鈉離子 150mM 條件下,比較加入 30 分鐘、放置 overnight 及將 sample 加熱 95℃ 回溫,可以發現這三種條件的 NMR 光譜沒有太大差異,而且都與在 TA-HT21 在鉀離子 150mM 條件下光譜類 似,所以整個鈉鉀轉換的時間相當快就完成,另外 TA-HT21 鈉離子 150mM 條 件加入鉀離子之後,imino-proton 訊號有 down-field 現象,代表氫鍵強度變強,
也符合鉀離子對 G-quartet 作用較好。
圖 3.10b 從結構空間上來比較,加入 30 分鐘等量鉀離子與鉀離子 150mM 條件下,鹼基的 H8 與醣基 H’1 的 NOE 光譜,可以發現原本鈉離子與鉀離子條 件對應的訊號位置不同,一旦加入鉀離子之後,鹼基的 H8 與醣基 H’1 的訊號就 與鉀離子條件下相同,所以 TA-HT21 四股結構鈉鉀轉換過程是很快就變成鉀離 子條件下的結構,根據先前 NMR 的結果 TA-HT21 在鈉離子條件下是第一種混 合型四股結構,與在鉀離子條件下結構相同,所以整個過程在一加入之後就很快 改變,但因結構類似只有離子不同,因此過程不需要太大的結構變動只需要離子 交換就可以完成。
TA-HT21 四股結構有三層 G-quartet,所以 quartet 中至少有兩個離子結合,
考量在鈉/鉀離子交換過程中,有可能是一次就換完鈉離子,也可能是一個一個 鈉離子被置換掉,但如果是不是一次交換完,或許有機會觀察到鈉鉀離子共存的 狀態。
NMR 的結果知道 TA-HT21 四股結構在鈉離子及鉀離子的三層 G-quartet 分 別 對 應 的 imino-proton 訊 號 , 因 此 慢 慢加 入 不 同 量 的 鉀 離 子濃 度 來 觀 察 imino-proton 的對應訊號,從鈉離子的狀態變化成鉀離子狀態。圖 3.11 可知慢慢 加入鉀離子可以發現訊號有寬化的現象,觀察三層 G-quartet 訊號變化,可以知 道下層的訊號 G5-G11-G15-G23 變化相較另外兩層慢,所以交換的過程可能是一 個一個鈉離子被置換掉,而且是從上層先被換掉,再換掉下層,有鈉、鉀共存在
- 49 -
同一個四股結構的可能(圖 3.11b),根據 Wu 團隊84利用固態及液態23Na NMR,
觀察草履蟲端粒 G4T4G4 四股結構在鈉鉀條件交換中,確實有鈉鉀共存的 23Na NMR 訊號,說明了一個一個鈉離子被置換的可能性。因此 TA-HT21 四股結構 的鈉、鉀離子轉換過程,是很快離子交換過程且為一步一步的非連續置換。
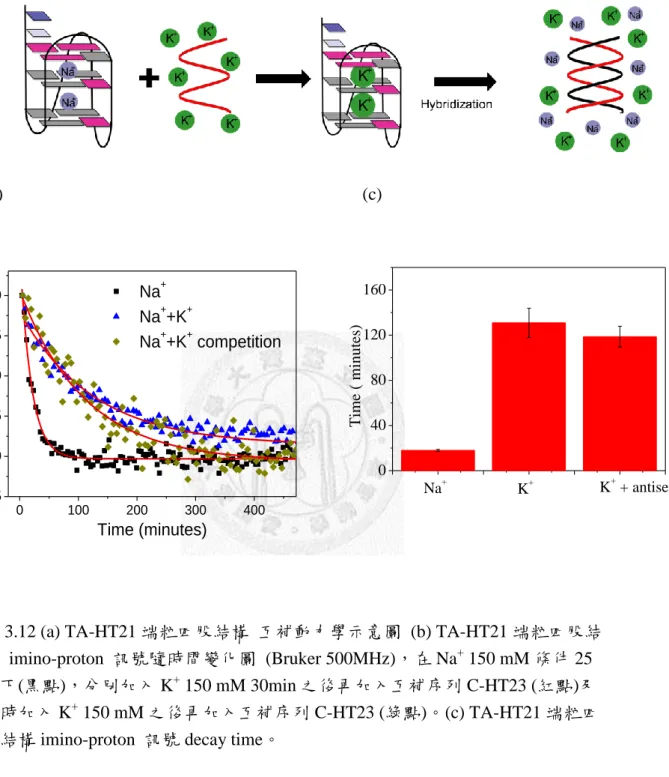
我們證明了鈉、鉀離子轉換過程,主要是很快的離子交換過程,約幾十到 幾百毫秒之間80,也證明了同一條序列在鈉、鉀離子主要是同一種結構,所以在 轉換過程的似乎不需要經過解開的過程,先前的研究結果指出解開的過程需要花 比較久的時間,不會在快速光譜轉換的過程發生,但 Yang 的人所推測的解開的 狀態,到底需要多少時間呢? 進一步我們利用互補 DNA 的實驗(圖 3.12a)來研究 鈉離子與鉀離子四股結構動力學解旋的時間,我們分別可以得到鈉離子跟鉀離子 的解旋時間(圖 3.12b),在鈉離子下為 20 分鐘,而鉀離子為 120 分鐘,四股結構 鉀離子比鈉離子穩定,這於先前熱力學結果一致,進一步我們比較加入鉀離子 30 分鐘之後,再加入互補 DNA 與同時加入互補 DNA 及等量鉀離子比較,可以 發現一旦加入之後,鉀離子馬上就交換完成,而且動力學穩定性也與先加入鉀離 子相同,競爭實驗的解旋時間沒有抓到鈉離子的解旋時間,結果呼應交換時間比 離子解旋時間還快, 而且一旦鉀離子交換,結構的穩定性就大幅提升,這個結 果沒有發現先前 Chaires 團隊提出的動力學模型,鉀離子交換完後,才開始有結 構的解開再重新的形成。 此外從鈉離子的解旋時間與鈉、鉀離子交換過程的時 間比較,可以發現解旋時間是至少需要 20 分鐘,而鈉、鉀離子交換過程是十到 幾百毫秒,即使是 CD 光譜轉換只需要數十秒(測量時間),這說明鈉、鉀離子交 換從一個鈉離子的結構解旋到另一個鉀離子結構是不可能這麼快速的解開。所以 從動力學角度來看,鈉、鉀離子轉換過程也不需要經過解開結構的過程,而且經 過鉀離子交換,結構馬上大幅穩定。
- 50 -
3.4 結論
我們利用 site-specific
15N isotope labeling 的方法搭配 NMR 技術,定出了 TA-HT21 在鈉離子條件下結構為第一種混合型四股結構,與在鉀離子條件下結 構相同,進一步鈉、鉀轉換過程主要是離子交換,其中交換機制是因此一步一步 的置換過程,而且是從上層先被換掉,再換掉下層(圖 3.13),另外由動力學及熱 力學方法,說明了一但加入鉀離子,不論是動力學或熱力學穩定性都鉀離子相同。結果顯示,在鈉、鉀轉換過程所造成的光譜轉換,不能代表結構結構轉換,而且 CD 光譜 295nm 與 265nm 的訊號是如何對應四股結構的位置或特徵,目前仍不 能完整的解釋,因此不能由 CD 光譜上的改變去說明鈉/鉀轉換的過程。
另外我們利用互補 DNA 的實驗測量解旋的時間,發現不論在鈉或鉀離子 中解旋時間都需要數十分鐘至數百分鐘。即使是從平衡狀態的角度來看,四股結 構在鈉離子條件下,大幅解旋的時間至少需要 20 分鐘,所以鈉/鉀離子在 A-HT21 中的快速轉換過程,應該不會是經由一個大幅解開四股結構的過程,這個結果解 釋了先前我們實驗室所觀察到的現象,即 BMVC 的 induced CD 光譜並沒有在離 子轉換過程中有改變 81,另外也呼應了 Fegion 團隊的觀點 79,這項研究指出人 類端粒序列的選取在結構上的影響是相當大的,可,由於人類端粒四股結構是相 當複雜,利用不同序列或變異的序列來推測其他序列的四股結構是需要格外謹慎 的,否則極有可能誤導端粒四股結構在不同環境下的動力學研究。
我們的結果提供了人類端粒四股結構鈉/鉀轉換主要的機制,是由於鈉/鉀離 子逐一的置換過程,未來可以應用四股結構在生物上活性的解釋85,另外也可以 進一步在材料上的應用例如人造 ion Channel24,25。
- 51 -
(a) (b)
圖 3.10 (a) TA-HT21 端粒四股結構的 imino-proton NMR ( Bruker 800MHz)光譜 25℃,在 Na+ 150 mM 條件下(下圖) 、加入 K+ 150mM 後 30min、放置 overnight (24hr、加熱後回溫與在 K+ 150 mM 條件下(上圖)。(b)TA-HT21 端粒四股結構 H8-H’1 NOE 光譜 25℃,在 Na+ 150 mM 條件加入 K+ 150mM 後 30min(藍線)、
在 KCl 150 mM 條件下(紅線)。
- 52 -
(a) (b)
圖 3.11 (a) TA-HT21 端粒四股結構 imino-proton NMR (Bruker 500MHz)光譜,在 Na+ 150 mM 條件 25℃下(黑線),分別加入 K+ 2 mM、5 mM、10 mM、15 mM、
20 mM、30 mM、45 mM、60 mM、75 mM 、120mM 與 150 mM 條件下(綠線)。
(b) TA-HT21 端粒四股結構鈉鉀離子共存示意圖
- 53 -
0 100 200 300 400
-0.25 0.00 0.25 0.50 0.75 1.00
Normalized Intensity
Time (minutes) Na
+Na
++K
+Na
++K
+competition
(a)(b) (c)
圖 3.12 (a) TA-HT21 端粒四股結構 互補動力學示意圖 (b) TA-HT21 端粒四股結 構 imino-proton 訊號隨時間變化圖 (Bruker 500MHz),在 Na+ 150 mM 條件 25
℃下(黑點),分別加入 K+ 150 mM 30min 之後再加入互補序列 C-HT23 (紅點)及 同時加入 K+ 150 mM 之後再加入互補序列 C-HT23 (綠點)。(c) TA-HT21 端粒四 股結構 imino-proton 訊號 decay time。
0 40 80 120 160
K+ + antisense K+
Time ( minutes)
Na+
- 54 -
圖 3.13 TA-HT21 端粒四股結構 鈉、鉀離子交換機制示意圖。
- 55 -