行政院國家科學委員會專題研究計畫 期中進度報告
以反應性蒸餾法分離醇類水溶液共沸物的基礎研究(2/3)
計畫類別: 個別型計畫
計畫編號: NSC91-2214-E-011-006-
執行期間: 91 年 08 月 01 日至 92 年 07 月 31 日 執行單位: 國立臺灣科技大學化學工程系
計畫主持人: 李明哲
計畫參與人員: 洪桂彬, 吳弦聰, 周珮琳, 簡銘泰
報告類型: 精簡報告
處理方式: 本計畫可公開查詢
中 華 民 國 92 年 5 月 30 日
以反應性蒸餾法分離醇類水溶液共沸物的基礎研究
(2/3) Fundamental Studies on Separation of Azeotropic Alcohol Aqueous
Solutions with Reactive Distillation (2/3)
計畫編號:NSC91-2214-E011-006 執行期限:91/8/1-92/7/31
主持人:李明哲 台灣科技大學化工系 教授
一、 中文摘要 (關鍵詞:反應性蒸餾、吸附、
相平衡、反應動力、醇類水溶液共沸物) 本計畫為反應性蒸餾法分離醇類水溶液共沸 物的基礎研究,酸性離子交換樹脂在此方法中擔 任吸附劑與酯類水解反應之觸媒的角色。親水性 樹脂的選擇性吸附與水解反應可共同克服醇類水 溶液共沸點的純化操作障礙。本專題計畫的主要 研究項目包括吸附、汽-液、汽-液-液、固-液相 平衡、反應動力以及反應性蒸餾等。以乙醇水溶 液共沸物的分離為示範例,上列之研究主題將在 三年內完成。從以上之一系列的實驗結果,將可 提供開發此一反應性蒸餾技術所需的基礎資料。
本報告為第二年的進度報告,本年度已完成含乙 醇、水、苯甲酸乙酯、苯甲酸之雙成分與三成分 混合物的汽-液以及汽-液-液相平衡量測,所得之 相平衡數據分別以 NRTL 與 UNIQUAC 模式擬 合,並用以檢驗兩種版本之 UNIFAC 模式,預測 水-乙醇-苯甲酸乙酯系統之汽-液-液相平衡性質的 合適性。
Abstract (Keywords: reactive distillation, adsorption, phase equilibria, kinetics, azeotropic alcohol aqueous solution)
This project is an integrated fundamental study on the separation of azeotropic alcohol aqueous solutions with reactive distillation method. An acidic ion-exchange resin is used as an absorbent and a catalyst for the hydration of an ester. Not only the selective adsorption of the hydrophilic resin but also the hydration of the ester can help the alcohol solutions overcome the azeotropic barrier of purification. The main items of this project include
equilibrium (VLLE) data were measured for binary and ternary mixtures containing ethanol, water, ethyl benzoate, and benzoic acid. The VLE and VLLE data were correlated with the NRTL and UNIQUAC models, respectively, and were also used to test the validity of two versions of the UNIFAC model for predicting the phase properties of water-ethanol- ethyl benzoate system.
二、緣由與目的
在化工製造程序中,常有傳統蒸餾法無法分離 的共沸混合物,處理此類混合物可能採行的替代 法相當多,如:結晶、萃取、薄膜分離、壓變蒸 餾法、均相(homogenous)共沸蒸餾法(或為廣義的 萃取蒸餾法)、異相(heterogeneous)共沸蒸餾法、吸 附、反應性蒸餾等。這些替代方法的主要原理不 外在於破除共沸物(如:萃取蒸餾)、使用不以汽液 平衡為主宰的分離法直接進行混合物的分離(如:
結晶、薄膜分離、萃取、吸附)、使用特殊方法跨 過共沸的分離障礙(異相共沸蒸餾法、反應性蒸 餾)。以由乙醇水溶液共沸物製造無水酒精為例,
商業化製程中已有多種不同的方法,其中採用異 相(heterogeneous)共沸蒸餾法的水-乙醇-苯(挾帶 劑)系統是此生產技術第一個成功的案例。本研究 提出一種新的分離方法,此法結合選擇性吸附與 反應性蒸餾的特性,使醇類水溶液共沸物脫離共 沸的障礙。
本研究計畫為期三年,各年度的研究重點如 下:第一年已完成乙醇水溶液在不同之酸性離子 交換樹脂中的吸附行為的研究,第二年將進行由 水、乙醇、苯酸乙酯或苯酸等配製而得之混合物 的 VLE 與 VLLE 相平衡研究,第三年則探討固液
purification. The main items of this project include the studies on adsorption, vapor-liquid, vapor-liquid-liquid, and solid-liquid phase equilibria, kinetics of hydration, and reactive distillation.
While the separation of azeotropic ethanol aqueous solution is taken as an illustrative example, the studies on the main topics mentioned above will be done within three years. The results of this series of experimental works are capable of providing useful fundamental information, which is essentially needed for the process development of the reactive distillation system. This is the progress report of the second year. In this year, the vapor-liquid equilibrium (VLE) and vapor-liquid-liquid
成,將液相溶液以一液體泵(2)循環,汽相混合物 以一磁動泵(11)循環。平衡壓力由一壓力傳送器(6) 讀取,平衡溫度由一精密溫度計(5)量取。當系統 達平衡後,有機相樣品從液相循環迴路中的取樣 閥(7)截取,再送至氣相層析儀中分析液相組成;
循環迴路中之切換閥(9)可選擇任一共存的液相,
進行液相循環。水相樣品將經由取樣口(12)收集於 取樣瓶中,加入適當的溶劑使樣品均相化後,以 注射針將樣品打入氣相層析儀進行組成分析。汽 相樣品則由汽相循環迴路中的汽相取樣閥(10)截 取,再送至氣相層析儀中分析汽相的組成,循環 迴路在進入平衡釜前均裝設一預熱蛇管(8),以上 諸配件大都浸於恆溫槽(4)中。本實驗裝置將用於 含低熔點成分(water,ethanol,ethyl benzoate)所組 成之雙成分與三成分系統的汽液與汽液液相平衡 數據。
3-2 高熔點混合物之 VLE 相平衡量測裝置
圖 2 為本研究用於量測高熔點混合物之 VLE 相平衡數據,圖中的右下方為除氣-進料單元(2),
係由一圓底燒瓶、抽真空管路、進料管與電磁攪 拌加熱板所構成,該單元可將調配好的進料混合 物熔為液體,藉由加熱、攪拌與抽真空,將藥品 中微溶的不凝結氣體及燒瓶中的空氣移除,圓底 燒瓶可儲存除氣後的混合液,以待後續的進料移 送。除氣-進料單元的進料管和平衡釜(1)相連,而 平衡釜沉浸於高溫油浴槽(5, Model EX-251HT, Neslab, USA)中,槽溫可控制於±0.03oC 內。一具
相平衡、水解反應動力與反應性蒸餾的行為。
三、研究方法及成果 研究方法
3-1 低熔點混合物之相平衡量測裝置
圖 1 為本研究用於量測低熔點混合物之 VLE 與 VLLE 相平衡數據的裝置示意圖,此一裝置的 主要單元包括除氣-進料、平衡-循環及樣品收集 等。混合溶液調配後裝於除氣-進料單元(1),此單 元與一具有視窗的平衡釜(3)連接,待測溶液藉壓 差及液體泵(2)移入平衡釜中,為加速平衡的達
本研究將使用此裝置量取 benzoic acid + ethyl benzoate 與 benzoic acid + water 等系統的汽液平衡 數據。由於苯甲酸的熔點高至約 120oC,樣品極易 固化,汽相組成之苯酸的含量非常低,而且取樣 也非常困難。對於這些混合物系統,本實驗將以 量測平衡壓力、平衡溫度,以及液相組成為主,
亦即 P-T-xi的汽液相平衡數據。
3-3 相平衡數據關聯與多相平衡計算
由實驗所量取的雙成分 VLE 數據(包括 ethyl benzoate + ethanol, benzoic acid + water, benzoic acid + ethyl benzoate),將以法關聯,以求得最 適化模式參數值。當系統達於 VLE 時,必需遵守 各成分之逸壓相等的關係式。由於平衡壓力低,
汽相可假設為理想氣體混合物;液相中成份 i 的逸 壓,則由一活性係數模式(如 NRTL [1], UNIQUAC [2]等)計算。各模式的雙成份參數最適值可經由泡 點-壓力計算訂之。經此最適化的計算可獲取各模 式的雙成份參數值,如:NRTL 模式中之 aij,aji,
;UNIQUAC 模式中之 bij與 bji等。
由實驗所量取的雙成分 VLLE 相平衡數據 (ethyl benzoate + water),將使用法經驟沸計 算,以平衡壓力之平均偏差為目標函數,求得 NRTL 與 UNIQUAC 之最適化模式參數值。
將已訂定的雙成分模式參數值帶入溶液理論 模式,可估算三成分系統之 VLE 與 VLLE 性質,
並用實驗所量取的相平衡數據,檢驗模式的可靠 性。兩種版本的 UNIFAC 基團貢獻模式[3, 4]也一 併檢測。
Neslab, USA)中,槽溫可控制於±0.03oC 內。一具 耐高溫(200oC)的液體循環泵(6),經由一穿透恆溫 槽的管線與平衡釜下端之出口相連,以進行液相 循環,此一循環裝置可加速相平衡的達成,也可 用來汲取液相樣品。液體循環泵出口管路上,連 接一三向閥(10),可控制液體循環的路徑,以便選 擇液相循環或液相取樣。回流液體在進入平衡釜 前,先經一蛇管(9)加熱,以確保平衡釜中溫度的 穩定。
平衡壓力由一壓力傳送器(4, Model PDCR- 912, 0-1 bar, Druck, UK)與一數位顯示器(Model 261, Druck, UK)量取,經校正其讀值可準確至
±0.1%。平衡溫度由一白金 RTD 感測器與數位溫 度顯示器(3, Model 1560, Hart Scientific, USA)讀 取,可準確至±0.02oC。外露於恆溫槽外之管路均 纏以加熱帶與保溫材料,以減低管路阻塞及干擾 系統平衡狀態的可能性。
樣品的組成分析均使用氣相層析儀(Model:
8700,TCD 感測器,中國層析公司),分析用的載 氣為氦氣。進行組成分析之前,每一雙成份系統 需先求取氣相層析檢量線(calibration curve),方法 為配製不同濃度之雙成份標準溶液,注入層析儀 以得取面積比與莫耳比間的關係。如樣品在常溫 下為固相時,須在樣品中加入溶劑,使樣品成為 一均勻液相。
表之。圖 5 與圖 6 分別為 water + ethanol + ethyl benzoate 在 333.15 K 與 353.15 K 下的 VLLE 與 VLE 相平衡圖。此三成分系統屬於 type I LLE,兩 液相共存區域隨溫度升高而縮小。實驗結果也顯 示汽相幾乎偵測不到 ethyl benzoate 的存在,亦即 ethyl benzoate 均留存於液相中。兩液相縛線 (tie-line)兩端之組成可用 Othmer-Tobias 半經驗式 關聯:
n x )
x log(1 m x )
x
log(1 I
3 I 3 II
1 II
1
(2) 關聯之結果示於圖 7。
4-2 VLE 與 VLLE 相平衡計算
本研究依據所量取的 ethyl benzoate + ethanol VLE 數據,訂定 NRTL 與 UNIQUAC 模式參數值,
VLE 計算為泡點壓力法,汽相假設為理想氣體,
由於此系統的 VLE 數據為 P-T-xi,故目標函數定 義為
n
k P
t exp k calc
k P
P
1
2
1
(3)
P為壓力量測的標準差,計算時此值設定為 0.05 kPa。圖 3 中之曲線即為使用 NRTL 模式的計算結 果,汽相組成的計算值也示於圖中。
對於一 VLLE 系統,在給定之溫度與進料組成 (zi)下,各相組成與各相所佔之分率,可從 VLLE 驟沸(flash)計算求得。驟沸計算的公式為:
現階段成果
1. 完成 ethyl benzoate + ethanol 與 water + ethanol + ethyl benzoate 在 313.15 K-373.15 K 下之等溫 VLE 數據量測。
2. 完成 ethyl benzoate + water 在 313.15 K-373.15 K 下之等溫 VLE 數據,以及 water + ethanol + ethyl benzoate 在 333.15 K 與 353.15 K 下的 VLLE 數 據量測。
3. 完成部分 benzoic acid + water 與 benzoic acid + ethyl benzoate 的 VLE 數據量測。
4. 完成雙成分相平衡數據的關聯,並訂定模式參數 最適值。完成三成分系統的 VLE 與 VLLE 性質 的預測與模式預測能力的檢測。
四、結果與討論
4-1 VLE 與 VLLE 數據量測
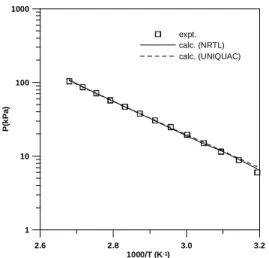
圖 3 為 ethyl benzoate + ethanol 的 VLE 相平衡 圖,此圖顯示此混合物系統無共沸物存在。圖 4 為 water + ethyl benzoate 之 VLLE 三相共存之平衡 壓力與溫度的關係圖,其間的關係可用 Antoine 式 對於 ethyl benzoate + water 系統,將 NRTL 與 UNIQUAC 模式參數設為溫度的線性關係時,此兩 溶液理論模式均可準確描述其三相共存壓力,計 算結果示於圖 4。
一旦混合物中各配對之模式參數確定後,即可 利用熱力模式估算該混合物系統的相平衡性質。
為了改進計算相互溶解度的準確性,本研究也嘗 試以三成分系統的 VLLE 數據,訂定各配對的模 式參數值。至於,基團貢獻法之模式(如:UNIFAC 模式 [3, 4]),只要相關基團間的交互作用參數已 經確定,也可將這類模式應用於相平衡性質的估 算。圖 5 與圖 6 比較由各種溶液理論模式計算 water + ethanol + ethyl benzoate 之 VLE 與 VLLE 性質的 結果。使用由雙成分數據訂定的模式參數,直接 預測三成分系統之 VLLE 性質的準確度仍有改進 的空間。如改以三成分系統之 VLLE 數據進行模 式關聯,可有效提高 VLLE 計算的準確度,此法
1
1 K /K
0K
z 1 K
nc
1 i
II i I i I
i
i I
i
(4)
1
K /K
1
0K
z 1 K
nc
1 i
II i I i II
i
i II
i
(5)
式中與分別為汽相與有機相所佔的分率。在汽 相假設為理想氣體且 Ponyting 壓力修正項視為 1 的情況下,Ki可分別由下列諸式求得:
P / P x / y
KiI i iIiI iS (6) P
/ P x / y
KiII i IIi IIi iS (7) 式中 P 為平衡壓力,可由下式計算之:
c c nc
1 i
S i II i II i n
1 i
S i I i I i n
1 i
iP x P x P
y
P (8) 本研究分別使用 NRTL,UNIQUAC,以及 UNIFAC 模式求取各液相成分的活性係數。ethyl benzoate + water 的 VLLE 數據,經由上述的驟沸計算,求取 此一配對之模式參數最適值,其目標函數為
n
k
t exp k
t exp k calc k
P P P
1
2 (9)
1 equilibrium cell 2 degassing unit 3 thermometer 4 pressure transducer 5 thermostated bath 6 circulation pump 7 liquid sample vail 8 vapor sampling valve 9 preheater 10 three-way valve
.
4 P
3 T
6
1
to vac.
5 2
.
8
to vac.
. .
7 .
to vac.
10
. 9
圖 2 高熔點混合物 VLE 量測裝置示意圖
所訂定的 water + ethanol 模式參數,也能準確地表 示共沸物的存在。對於本研究所探討之兩種版本 的 UNIFAC 基團貢獻模式中,以 UNIFAC-LLE [3]
的預測結果較佳。
五、參考文獻
1. Renon, H.; Prausnitz, J. M., AIChE J., 14, 135 (1968).
2. Abrams, D. S.; Prausnitz, J. M., AIChE J., 21, 116 (1975).
3. Magnussen, T.; Rasmussen, P.; Fredenslund, A., Ind. Eng. Chem. Process Des. Dev., 20, 331 (1981).
4. Gmehling, J.; Li, J.; Schiller, M., Ind. Eng. Chem.
Res., 32, 178 (1993).
六、圖表
T P
3
1
2 9
6 5
10
7 8
1 degassing/feeding unit
3 equilibrium cell 2 circulation pump
9 switch valve 6 pressure guage
5 thermometer
7 liquid sampling valve
10 vapor sampling valve
4 thermostated bath to vac.
4
8 pre-heater
8 11
1
12 sampling vial 12
11 magnetic pump
圖 1 低熔點混合物 VLE 與 VLLE 量測裝置示意圖
0.0 0.2 0.4 0.6 0.8 1.0 x1 , y1
0 80 160 240
0 40 80 120
P (kPa)
0 16 32 48
333.15 K expt. (liquid phase) calc. (NRTL) 353.15 K
expt. (liquid phase) calc. (NRTL) 373.15 K
expt. (liquid phase) calc. (NRTL)
圖 3 Ethyl benzoate + ethanol 的 VLE 相平衡圖
2.6 2.8 3.0 3.2
1000/T (K-1) 1
10 100 1000
P(kPa)
expt.
calc. (NRTL) calc. (UNIQUAC)
圖 4 Water + ethyl benzoate 之 VLLE 三相共存之 平衡壓力與溫度的關係圖
ethyl benzoate
0.0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0
ethanol
0.0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0
water
0.0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0
x x
x xx
xx
+ +
+ ++++
UNIFAC-TD prediction liquid phase vapor phase
UNIQUAC correlation (liquid phase) UNIQUAC correlation (vapor phase) x
UNIQUAC prediction (liquid phase) UNIQUAC prediction (vapor phase) +
expt. tie-lines
UNIFAC-LLE prediction
圖 5 Water + ethanol + ethyl benzoate 在 333.15 K 下的 VLLE 與 VLE 相平衡圖
ethyl benzoate
0.0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0
ethanol
0.0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0
water
0.0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0
x x
x xxxx
+ +
+ ++++
UNIQUAC correlation (liquid phase) UNIQUAC correlation (vapor phase) x
UNIQUAC prediction (vapor phase) +
UNIFAC-TD prediction UNIFAC-LLE prediction liquid phase vapor phase
UNIQUAC prediction (liquid phase) expt. tie-lines
圖 6 Water + ethanol + ethyl benzoate 在 353.15 K 下的 VLLE 與 VLE 相平衡圖
0.01 0.1 1 10 Log ((1-x3I) / x3I)
0.001 0.01 0.1 1
Log ((1-x1II) / x1II)
333.15 K (m = 0.86, n = -0.91) 353.15 K (m = 0.88, n = -0.90) calc. (eq. 1)
圖 7 Water + ethanol + ethyl benzoate 系統的 Othmer-Tobias 關聯式