國 立 交 通 大 學
環 境 工 程 研 究 所
碩士論文
PVA 固定化硫酸還原菌體顆粒處理含銅廢水之
研究
Immobilization of SRB on PVA (Polyvinyl Alcohol)
for the Removal of Copper in Wastewater
研 究 生:卓裕盛
指導教授:林志高 博士
Immobilization of SRB on PVA (Polyvinyl Alcohol)
for the Removal of Copper in Wastewater
Student:Yu-Sheng Jhuo
Advisor:Dr. Jih-Gaw Lin
A Thesis
Submitted to Institute of Environmental Engineering
College of Engineering
National Chiao Tung University
In Partial Fulfillment of the Requirements
For a Degree of
Master of Science
In
Environmental Engineering
October 2008
PVA 固定化硫酸還原菌體顆粒處理含銅廢水之研究
研究生:卓裕盛 指導教授:林志高 國立交通大學環境工程研究所 摘要 近數十年來,生物沉澱 (bio-precipitation) 技術利用硫酸還原菌 (sulfate reducing bacteria, SRB) 處理含高硫酸鹽及高重金屬濃度的酸礦廢水,為一具相 當發展潛力的生物處理技術。但在實際應用上仍有多方面需改進之處,如降低添 加碳源成本、增加SRB 活性或減少對 SRB 毒性及抑制作用以增加重金屬處理效 率等。本研究以聚乙烯醇 (polyvinyl alcohol, PVA) 包覆馴養 SRB 製成 PVA 固定化 菌體顆粒,探討在含不同銅離子濃度及微生物含量 (PVA 包覆微生物量) 的條件
下,對 SRB 生長抑制的影響,及探討生物沉澱處理含銅廢水的效率,並藉由中
央合成設計法 (central composite design, CCD) 規劃實驗組數及實驗條件進行實 驗。PVA 包覆微生物量以測定 PVA 固定化菌體顆粒之蛋白質含量為參數,實驗 規劃 SRB 含量介於 19-235 mg VSS/L,即 PVA 之蛋白質添加量介於 0.16-1.94 mg,設計銅離子濃度範圍介於 10-100 mg/L。以批次實驗比較 PVA 固定化菌體
顆粒及PVA 空白顆粒之差異,於固定時間分析各試驗組之 pH、ORP、硫酸鹽、
硫離子及銅離子濃度之變化。以反應曲面法 (response surface method, RSM) 分 析找出最適的評估指標及最佳的操作條件。 實驗結果顯示所有 PVA 固定化菌體顆粒試驗組在第 168 小時,硫酸鹽還原 率在 99% 以上,而銅離子濃度則小於 1 mg/L,與 PVA 空白顆粒之對照組實驗 結果有明顯差異。以 PVA 固定化菌體顆粒進行生物沉澱實驗,其去除重金屬機 制包括物理化學沉澱 (含吸附作用) 及生物沉澱兩大部分。結果顯示銅離子之物 理化學沉澱 (含吸附作用) 量介於 17.0-64.6%,而生物沉澱量介於 35.4-83%,由 此可知重金屬銅離子去除途徑除了生物沉澱之外還包括物化作用的影響。針對試
驗組之硫質量平衡計算得知,其回收率介於59.4-79.9%,推測可能原因有 (1) 硫 離子與培養基內鐵離子形成硫化鐵沉澱,(2) 形成硫化氫揮發及 (3) 在採樣時硫 離子暴露在空氣而造成損失有關。 由 CCD 實驗結果經 ANOVA 分析結果顯示 R4評估指標為顯著。而RSM 分 析結果顯示其反應曲面呈收斂之趨勢,有最佳值存在,即當微生物濃度 136 mg VSS/L (相當蛋白質添加量 1.12 mg),銅離子濃度 57.9 mg/L,且反應溫度 30±2oC 時,有最高硫酸鹽還原之反應速率常數0.0423 h-1。經由廻歸係數分析得知硫酸 鹽還原之反應速率常數配適二階反應模型,其R2值為85.1%。 關鍵字:生物沉澱、PVA 固定化菌體顆粒、硫酸還原菌、中央合成設計、反應 曲面法、重金屬。
Immobilization of SRB on PVA (Polyvinyl Alcohol) for the Removal
Copper in Wastewater
Student: Yu-Sheng Jhuo Advisor: Dr. Jih-Gaw Lin
Institute of Environmental Engineering National Chiao Tung University
Abstract
Heavy metals are present in wastewaters released from battery, paint and chemical manufacturing industries. Also, considerable portion of heavy metal containing wastewater is discharged from mining industry i.e. acid mine drainage. Heavy metal disposal problems require urgent solution to avoid serious environmental contamination. The activity of sulfate reducing bacteria (SRB) offers interesting potentials for metal removal and recovery. In the present work, utilization of PVA as a gel matrix for immobilization of SRB was investigated. This study was also focused on the optimization of bio-precipitation process using a statistical method to provide information concerning the effect of amount of SRB immobilized on PVA and copper concentration in biotic experiments. A central composite (CCD) was used to develop a model for the responses. Response surface methodology (RSM) was used to optimize the amount of SRB immobilized (19-235 mg VSS/L), and copper concentrations (10-100 mg/L).
The objective of this research consists of two parts. In the first part, the amount of SRB immobilized on PVA and the copper concentration are considered study their effect on SRB during bioprecipitation experiments as designed by CCD. In the second part, the four responses such as biological copper removal (R1), chemical precipitation and adsorption (R2), specific sulfate reduction (R3) and reaction rate constant (R4) are considered to optimize the amount of SRB immobilized on PVA and copper concentration using RSM.
The bioprecipitation experimental results showed that the sulfate removal was more than 99% and residual copper concentration was less than 1 mg/L in a11 experimental runs within 7 days. The results demonstrated that the copper removal was by bioprecipitation and adsorption on PVA beads. The blank PVA adsorption experiments indicated that the blank PVA and SRB immobilized PVA have copper adsorption capacities of 0.355 and 0.363 mg-Cu2+/g PVA beads, respectively. According to the results of RSM, R1 and R2 responses were not significant but R3 and R4 responses were significant. Result of R4 showed better convergence in the contour plot. The optimal quantity of SRB immobilized on PVA and copper concentration were observed these as 136 mg VSS/L (equivalent to 1.12 mg protein) and 57.9 mg/L, respectively. At there conditions the highest sulfate reaction rate constant (k) as per first-order kinetic was observed as 0.0423 h-1 in 30±2oC.
Keywords: Bioprecipitation, Immobilization, SRB, Central composite design,
目錄
中文摘要 ...II 英文摘要 ... IV 目錄... VI 圖目錄 ... IX 表目錄 ...X 第一章 緒論 ...1 1.1 研究緣起 ...1 1.2 研究目的 ...2 第二章 文獻回顧 ...3 2.1 重金屬廢水來源及特性 ...3 2.1.1 重金屬污染源 ...3 2.1.2 重金屬處理程序 ...3 2.2 生物沉澱法去除重金屬之機制 ...9 2.3 硫酸還原菌之簡介及應用 ...10 2.4 固定化生物顆粒技術 ...12 2.4.1 固定化方法種類 ...12 2.4.2 人工固定化之優點 ...15 2.4.3 人工固定化之材料 ...16 2.4.4 PVA 固定化技術應用於廢水處理之研究...16 2.5 實驗設計法 ...192.5.1 中央合成設計 (Central composite design, CCD) ...19
2.5.2 反應曲面法 (Response surface method, RSM)...20
第三章 實驗材料與方法 ...21
3.2 藥品...23 3.3 植種污泥來源及馴養 ...23 3.3.1 培養基成分 ...23 3.3.2 厭氧污泥之批次馴養 ...24 3.4 PVA 固定化菌體顆粒製備方法...24 3.5 PVA 固定化菌體顆粒量及銅離子濃度對硫酸還原效率之實驗...25 3.5.1 以中央合成設計法建立實驗組數 ...25 3.5.2 實驗條件...27 3.6 分析項目及方法 ...28 3.6.1 pH 及 ORP...28 3.6.2 硫酸鹽離子、硫離子及銅離子 ...28 3.6.3 PVA 固定化菌體顆粒菌體量測定 ...28 第四章 結果與討論 ...31 4.1 中央合成設計實驗結果 ...31 4.1.1 pH 及 ORP 變化...31 4.1.2 硫酸鹽濃度變化 ...34 4.1.3 PVA 固定化菌體顆粒之菌體量變化...37 4.1.4 銅離子濃度變化 ...39 4.1.5 吸附作用與沉澱作用的探討 ...41 4.1.6 硫離子濃度變化及硫質量平衡計算 ...42 4.2 中央合成設計實驗最佳化分析 ...50 4.2.1 評估指標...50 4.2.2 配適二階模型之設計 ...56 4.2.3 模型適當性與常態性假設檢驗 ...58
5-2 建議 ...60
圖目錄
Figure 2-1 General diagram of a CCD for two factors...20
Figure 3-1 Flowchart of experiment...22
Figure 3-2 Preparation of immobilized SRB by phosphorylated PVA method....25
Figure 3-3 Relationship of protein concentration and absorbance at 600 nm ...29
Figure 3-4 Relationship of protein and VSS ...30
Figure 4-1 Variation of pH in CCD experiment. ...32
Figure 4-2 Variation of ORP in CCD experiment. ...33
Figure 4-3 Variation of sulfate concentration in CCD experiment. ...35
Figure 4-4 Variation of sulfate reduction efficiency in CCD experiment. ...36
Figure 4-5 Variation of total VSS calculated from the protein concentration in CCD experiment. ...38
Figure 4-6 Variation of specific sulfate reduction rate in CCD experiment. ...39
Figure 4-7 Variation of copper concentration in CCD experiment. ...40
Figure 4-8 Variation of biological copper removal in CCD experiment. ...44
Figure 4-9 Comparisons of variation of copper concentration with adsorption study and bioprecipition study (Run 5)...45
Figure 4-10 Variation of sulfide production in CCD experiment. ...48
Figure 4-11 Response surface for specific sulfate reduction rate using RSM ...54
Figure 4-12 Contour plots for specific sulfate reduction rate using RSM. ...55
Figure 4-13 Response surface for reaction rate constant using RSM. ...55
Figure 4-15 Residuals versus the fitted values for reaction rate constant ...58 Figure 4-16 Normal probability plot of the residuals for reaction rate constant .59
表目錄
Table 2-1 Characteristics of some passive bioreactors reported in the literature..7
Table 2-1 Metal removal in some passive bioreactors reported in the literature (Continued)...8
Table 2-2 Heavy metal toxicity to SRB... 11
Table 2-3 A comparison between the different methods for the artificial immobilization of microorganisms to bedding material ...14
Table 2-4 Cell immobilizations within PVA carriers...18
Table 3-1 Composition of SRB1 medium...23
Table 3-3 Sequence of runs for the central composite design ...26
Table 3-4 Composition of modified SRB1 medium for CCD runs ...27
Table 3-5 Samples analysis and instruments ...28
Table 4-1 Experimental and theoretical (stoichiometric) comparisons of sulfate reduction concentration in CCD experiments ...46
Table 4-2 Experimental and theoretical comparisons of theoretical sulfide and measured sulfide in experiments ...49
Table 4-3 experimental results of the central composite design ...53
Table 4-4 Results of ANOVA analysis in CCD experiment ...54
Table 4-5 Coefficient estimates by the regression for optimization study ...57
第一章 緒論
1.1 研究緣起
重金屬對生物毒性及環境的公害,使得廢水中重金屬對環境污染一直廣受大 眾重視,重金屬離子主要的污染來源為電鍍、電池、半導體、冶金、印刷電路板 及化學工業製造所產生之廢水 (Azabou et al., 2007),以往對重金屬廢水之處理包 括物理化學等眾多方式,常用之處理技術主要有:氧化還原、化學混凝沉澱、離 子交換、電解、吸附及薄膜分離等 (Malik, 2004),這些技術各有其優缺點,不過 具回收價值之高濃度重金屬廢水處理方法大部分以電化學回收,其成效較佳;對 中低濃度之重金屬廢水則大都以傳統化學混凝沉澱為主要處理方式,除高處理成 本外,產生大量有害化學污泥,在現今最終處理場址有限及民眾環保意識抬頭 下,難以成效,其處理處置成為重要研究課題。 生 物 沉 澱 (bio-precipitation) 技 術 是 近 十 年 來 利 用 硫 酸 還 原 菌 (sulfate reducing bacteria, SRB) 處理含高硫酸鹽及高重金屬濃度的酸礦廢水 (acid mine drainage, AMD),為一具相當發展潛力的生物處理技術 (White et al., 1997; El Bayoumy et al., 1999; Chuichulcherm et al., 2001; Diels et al., 2003)。研究結果顯
示,此技術對於水中銅、鋅、鎳的去除率均高達97.5%,砷及鐵的去除率則分別
為77.5% 及 82% (Jong and Parry, 2003)。然而利用 SRB 進行各項重金屬處理時, 仍有多處需改進,例如:添加各種不同單一或混合之工業或農業有機廢棄物做為 SRB 之碳源,降低添加碳源成本;改變操作因子 (pH、水力停留時間) 或條件 (重 金屬濃度),增加 SRB 活性或減少對硫酸還原菌毒性及抑制作用等,以增進重金 屬處理效率。
方 式 將 具 活 性 之 微 生 物 細 胞 固 定 於 擔 體 材 料 之 人 工 固 定 化 (artificial immobilization) 兩種方法。其具有固液分離容易、微生物菌群不易流失,使得處 理系統內可維持較高的菌群濃度,可以大幅減少反應器體積提高效率,同時對於 處理系統中水質條件之變化,具有較高的忍受負荷能力等優點 (林,1993)。 多位學者研究以無毒及低成本之聚乙烯醇 (polyvinyl alcohol, PVA) 為固定 主要材料並採用不同固定化方法 (Chang et. al., 1998; Chen et al., 1998; Chen and Lin, 1994; Long et al., 2004; Rostron et al., 2001),其固定方法包括將 PVA 加入至 硼酸、磷酸鹽或硝酸鹽固定液或冷凍回溫等方式。Chen and Lin (1994) 研究以 PVA 包覆脫硝菌處理合成硝酸鹽廢水,結果顯示硝酸鹽去除率可達 99%。此法
不僅固定化程序簡單且固定化菌體活性高,強度佳,因此本研究以 PVA 磷酸酯
化法製作PVA 固定化菌體顆粒。
1.2 研究目的
本研究係以 PVA 磷酸酯化法 (Chen and Lin, 1994) 包覆硫酸還原菌製成 PVA 固定化菌體顆粒。為瞭解 PVA 固定化菌體顆粒應用在生物沉澱技術之操作 條件,探討在含不同濃度銅離子及微生物含量 (PVA 固定化菌體顆粒量) 的條件 下,對硫酸還原菌生長抑制的影響,及探討生物沉澱處理含銅廢水的效率,並藉 由中央合成設計 (central composite designs, CCD),及搭配反應曲面法 (response surface method, RSM),分析其對 SRB 產生毒性及抑制效應最小的操作條件。
第二章 文獻回顧
2.1 重金屬廢水來源及特性
2.1.1 重金屬污染源
現今常見的重金屬污染源,包括工業廢水及酸礦廢水 (acid mine drainage, AMD),工業廢水包括有電子電鍍、製革業、冶金、研磨廢水及金屬表面處理工 廠之廢水等,其製程中所產生含高濃度之重金屬廢液,若未經處理擅自加以排 放,對於人體健康及自然環境造成極大的危害 (Azabou et al., 2007)。 AMD 是指在礦業活動發展的過程中,常會製造出大量無法再提煉或利用之 廢礦堆,由於廢礦石中通常富含許多如黃鐵礦等硫化鐵礦物,這些硫化鐵礦物暴 露於空氣及有地下水流的環境中,經化學及生物氧化作用而產生亞鐵離子、硫酸 鹽離子及氫離子,同時此種作用更因鐵氧化菌的催化作用而加速反應的進行,進 而產生高酸度及高濁度之廢水,其中亦含有高濃度的重金屬及硫酸鹽 (Neculita et al., 2007),直接與間接引起環境問題值得加以重視。 2.1.2 重金屬處理程序 對於重金屬廢水處理的方法包括:化學混凝沉澱、離子交換、擴散透析、電 解沈積、薄膜過濾、生物吸附及生物沉澱等處理技術,其主要敘述如下: (1) 化學混凝沉澱 化學混凝沉澱法主要利用金屬氫氧化物低溶解性的性質,配合適當的酸鹼值 控制以沉澱或浮除方式將重金屬去除;有時也添加助凝劑,強化膠羽強度提昇固 液分離的效能。但此處理方法在過程中必須加入大量的藥劑,如:鹼劑、酸劑、 混凝劑、助凝劑甚至重金屬捕捉劑,不但耗費藥劑成本,並產生大量有害性的重
用,而須直接排放至承受水體,造成水資源浪費 (朱,2000)。 (2) 離子交換 離子交換技術應用於重金屬廢水處理日益普遍,主要係利用樹脂顆粒具有超 大面積的陰離子、陽離子接觸面之特性,使溶液中的離子與樹脂顆粒上帶相同電 荷之離子達到交換效果,且於進行離子交換後不會改變樹脂之結構,乃是一個可 逆化學反應。傳統離子交換的缺點是,大部分樹脂不具選擇性,所以應用的樹脂 會吸收相同電荷的金屬離子,以致於某些雜質無法利用離子交換樹脂去除;而且 樹脂再生所得的再生液,有時候不足以直接回收供製程使用,更增加一道處理程 序,提高處理成本 (侯,2003)。 (3) 擴散透析 擴散透析乃是結合離子交換膜的處理技術,主要利用溶質之濃度差使其由高 濃度往低濃度方向移動,且藉由離子交換膜對不同溶質之選透性而使其穿透薄 膜。此技術通常用於廢酸液中回收金屬及酸液,由於陰離子交換膜只能允許陰離 子通過,故會將重金屬離子截留在溶液的另一邊。一般擴散透析法於廢酸液中的 重金屬回收約可達60-85%,主要缺點為薄膜會堵塞 (fouling) 及結垢 (scaling), 需定期更換 (侯,2003)。 (4) 電解沈積 電解沈積乃是一種電化學處理程序,藉由直流電將重金屬離子沈積於陰極板 上,且反應極板通常由惰性材所做成,為了達到較高回收率一般都用於高濃度的 重金屬廢水處理,其回收效率可達 90-95%。此技術之主要缺點在於控制處理液 之酸鹼值,以防止過低酸鹼值之酸溶液將沈積於陰極之重金屬又重新溶出 (侯, 2003)。 (5) 薄膜過濾 薄膜過濾在重金屬廢水處理的主要功能為:替代傳統沉澱或浮除單元,提昇 固液分離效率,可濃縮水中固體物含量達 2-5%;或做為排放水的修飾單元去除 懸浮固體與有機物,使處理後水質符合直接排放或回收再利用的標準。通常薄膜
過濾的設置與操作成本都較傳統方式為高,因此多用於含高量重金屬螯合劑廢 水;唯需注意廢水中不可含有油脂,造成薄膜阻塞。通常薄膜單元每週須進行一 次化學清洗,每次兩小時;且需特別注意避免薄膜破裂,造成放流水質超出排放 標準 (王,2004)。 (6) 生物吸附 生物吸附法是利用生物體的代謝產物去除胞內或胞外的重金屬,這些代謝產 物可為細胞內的酵素或蛋白。但由於過量的重金屬常對生物體造成負面的影響, 生物吸附對高濃度重金屬廢水的處理效果不易提昇;另一方面由於生物體對特定 重金屬具專一性與高親和性的特質,且生成污泥毒性低、易於處理,因此相較於 物化方法,生物吸附法對於特殊重金屬廢水如含螯合劑廢水或低濃度 (10 mg/L) 廢水的處理,或特殊貴重金屬如鉑,金、銀等回收大有利基。Vargas et al. (2004) 使用 D. desulfuricans、D. fructosivorans 及 D. vulgaris 三株不同族群的 SRB 在不
同的pH 下進行鈀和鉑的吸附實驗,研究結果顯示,當使用 D. desulfuricans 且反
應條件控制在pH = 3,在 5-15 分鐘內鈀和鉑的最佳去除率可達 90%,且鈀和鉑
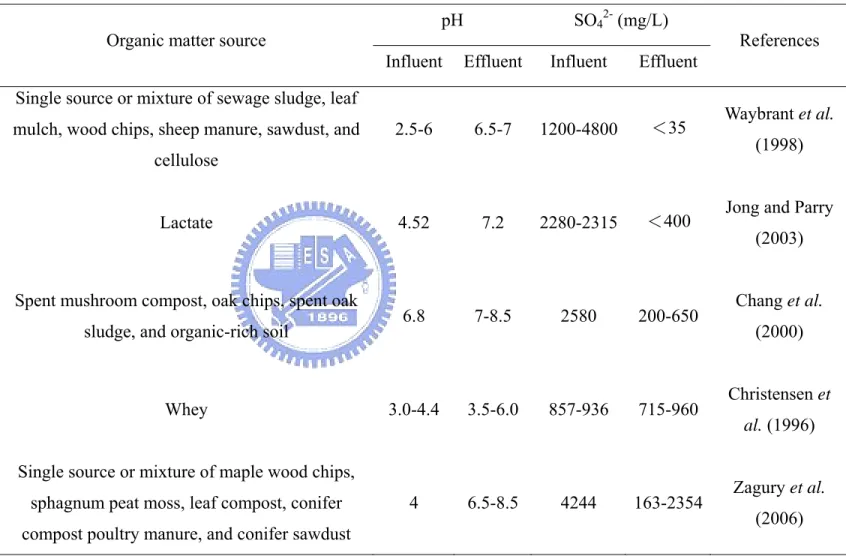
的最大單位吸附量分別為190 mg/g dry biomass 和 90 mg/g dry biomass。 (7) 生物沉澱 最廣泛被使用於AMD 之處理,由於 AMD 中存在高濃度硫酸鹽,符合 SRB 生長環境之要求,其還原作用產生之硫離子亦可與廢水中溶解性重金屬生成金屬 硫化物沉澱,可藉此特性去除廢水中之重金屬,故此部份之議題早在多年前即有 多位學者進行相關研究。然而利用 SRB 進行各項重金屬處理作業時,碳源的選 擇亦扮演重要的角色,使用不同的碳源對 SRB 也有不同的效果,且若水溶液中 同時存在多種碳源時,相較於單一種碳源之使用,多種碳源可促進 SRB 進行硫 酸鹽還原作用之活性,在過去曾有多位學者針對 SRB 碳源之使用做過許多研
液中含有高濃度的硫酸鹽 (5000 mg/L) 且同時存在五種有機物質時 (下水污 泥、腐植質、木屑、羊糞及鋸木屑),在反應時間 20 天內硫酸鹽去除率將近 100%;
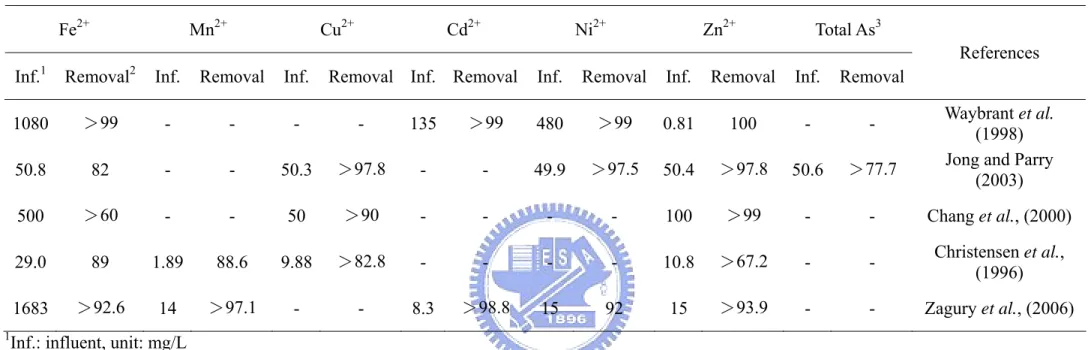
而 Chang et al. (2000) 研究也顯示出類似的結果。至於去除之重金屬種類包括
Fe2+、Mn2+、Cu2+、Cd2+、Ni2+、Zn2+及 As3+等,去除率依各實驗條件不同,介 於60-100%。
Table 2-1 Characteristics of some passive bioreactors reported in the literature
pH SO42- (mg/L)
Reactor scale
Total
volume (L) Organic matter source Influent Effluent Influent Effluent References
Batch 0.5-1
Single source or mixture of sewage sludge, leaf mulch, wood chips, sheep manure, sawdust, and
cellulose
2.5-6 6.5-7 1200-4800 <35 Waybrant et al.
(1998) Laboratory
bioreactor 4.8 Lactate 4.52 7.2 2280-2315 <400
Jong and Parry (2003)
Column 0.25 Spent mushroom compost, oak chips, spent oak
sludge, and organic-rich soil 6.8 7-8.5 2580 200-650
Chang et al. (2000)
Batch 31 Whey 3.0-4.4 3.5-6.0 857-936 715-960 Christensen et
al. (1996)
Batch 2
Single source or mixture of maple wood chips, sphagnum peat moss, leaf compost, conifer compost poultry manure, and conifer sawdust
4 6.5-8.5 4244 163-2354 Zagury et al.
(2006)
Table 2-1 Metal removal in some passive bioreactors reported in the literature (Continued)
Fe2+ Mn2+ Cu2+ Cd2+ Ni2+ Zn2+ Total As3
Inf.1 Removal2 Inf. Removal Inf. Removal Inf. Removal Inf. Removal Inf. Removal Inf. Removal
References
1080 >99 - - - - 135 >99 480 >99 0.81 100 - - Waybrant et al.
(1998)
50.8 82 - - 50.3 >97.8 - - 49.9 >97.5 50.4 >97.8 50.6 >77.7 Jong and Parry
(2003)
500 >60 - - 50 >90 - - - - 100 >99 - - Chang et al., (2000)
29.0 89 1.89 88.6 9.88 >82.8 - - - - 10.8 >67.2 - - Christensen et al., (1996)
1683 >92.6 14 >97.1 - - 8.3 >98.8 15 92 15 >93.9 - - Zagury et al., (2006)
1Inf.: influent, unit: mg/L 2Removal, unit: %
3Total As including As3+ and As5+
2.2 生物沉澱法去除重金屬之機制
生物沉澱法去除重金屬乃利用 SRB 為一絕對厭氧菌,以硫酸鹽作為電子接 受者,並廣泛利用多種含碳有機物作為生長所需的碳源。在厭氧狀態下以異營的 方式將硫酸鹽還原成硫離子,與重金屬結合形成金屬硫化物,由於金屬硫化物的 溶 解 度 極 低 容 易 沉 澱 , 可 藉 此 特 性 去 除 水 中 的 重 金 屬 離 子 (Liamleam and Annachhatre, 2007)。根據文獻指出以生物沉澱去除重金屬,Fe2+、Co2+、Cd2+、Cu2+、Ni2+、Fe2+、
Zn2+等重金屬的主要去除機制為與硫離子形成金屬硫化物沈殿,而 Fe3+、Cr3+和
Al3+則與氫氧根離子形成金屬氫氧化物沉澱,最後Fe2+和Mn2+則與碳酸鹽離子結
合而沉澱 (Neculita et al., 2007)。然而除了生物沉澱之外,重金屬離子可能伴隨 著吸附機制 (如微生物吸附作用、表面沈澱和無機物之聚合反應) 的發生而去 除。
Chen et al. (2000) 研究顯示硫酸還原菌之生物吸附 (biosorption) 可分成: (1) 與代謝無關
無論是活或是死的細菌,其細胞壁或細胞膜通常具有帶陰電性的羧基 (carboxyl)、羥基 (hydroxyl)、磷酸基 (phosphoryl)、硫醇基 (sulfhydryl) 等官能 基,可與金屬陽離子鍵結,因此微生物會將金屬鍵結在細胞壁或細胞膜上。 (2) 與代謝相關 與代謝相關的機制有生物轉換 (transport) 及胞外 (extracellular) 累積。生物 轉換乃因自然界在某些含有高濃度重金屬離子的環境下,仍存有微生物,由此可 見某些微生物具有精巧的抵抗重金屬的能力。對某些重金屬如 Ag+、As5+、Cd2+ 等,細菌的金屬抵抗系統,只在於吸附和傳送金屬。但對另外的重金屬如Hg2+、 As2+、Cr6+等而言,則會被菌體的酵素起生化作用 (如還原、氧化、甲基化、去 甲基化等) 而轉換成毒性較輕或較易揮發的另一種化學型態。胞外累積主要是由 於重金屬與菌體生成的體外高分子聚合物之帶電部分結合成複合物所致。另外, 重金屬亦能與微生物排出體外之代謝物 (metabolism) 鍵結成沉澱物,而達到同 樣的效果。
2.3 硫酸還原菌之簡介及應用
硫酸還原菌外型因年齡及存在環境不同而不同,文獻中大部分描述的族群有 屬於中溫菌的 Desulfovibrio、Desulfobacterium、Desulfobacter 及 Desulfobulbus
其適合生長之溫度範圍在25-37oC,最適溫度為 33oC,而最適合生長之 pH 為中
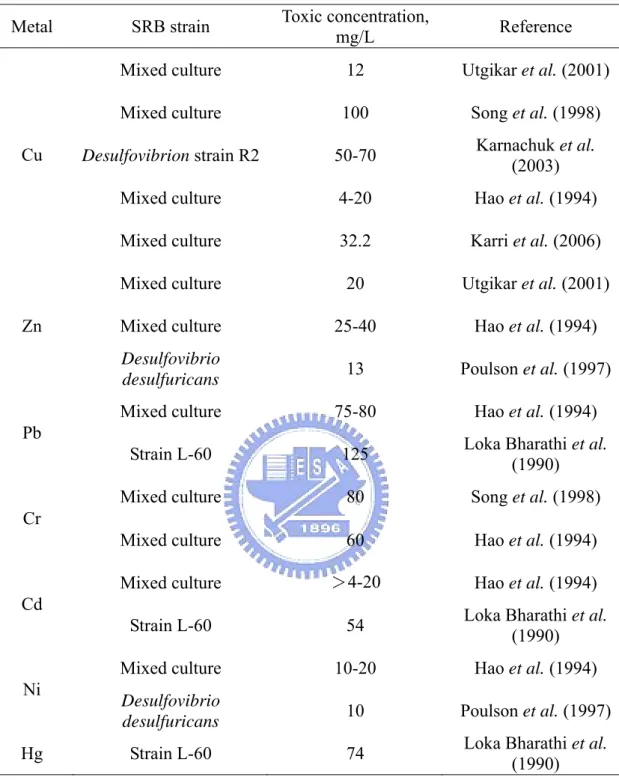
性,其次為屬於嗜熱菌的 Thermodesulfovibrio 其生長溫度範圍在 30-70oC,最適 溫度為55oC,其它菌屬如:Desulfotomaculum 和 Archaeoglobus 等 (Thauer et al., 2007),這些菌廣泛的分布在各種厭氧環境中,例如:湖泊沈積物、海洋沈積物、 地下水、沼澤等厭氧環境中,除前述天然環境外,也可在工業消化槽、礦業廢水、 儲油槽及廢水處理場中發現硫酸還原菌 (楊,2005)。 硫酸還原菌是一種異營菌 (heterotrophy) 需在嚴格的厭氧條件 (Eh<-200 mV) 下才能生存,且需利用低分子量有機化合物如乙酸、甲醇、乙醇或乳酸等 為主要之電子提供者,於厭氧環境下將有機碳分解過程產生的電子,進入電子傳 遞鏈,以硫酸鹽離子為電子接受者,產生能量 ATP 和生成硫離子,經由硫離子 與重金屬形成金屬硫化物沉澱,可藉此去除水中重金屬 (White et al., 1997)。 然而利用硫酸還原菌處理重金屬必須考量到重金屬對硫酸還原菌造成的毒 性效應,因為重金屬的毒性若超過硫酸還原菌的忍受程度,對硫酸還原菌造成抑 制甚至死亡,降低硫酸還原效率,使得重金屬處理效果不彰。 因此,有多位學者研究硫酸還原菌對各種常見的重金屬可容忍之毒性效應濃 度 (Hao et al., 1994; Karnachuk et al., 2003; Karri et al., 2006; Loka Bharathi et al., 1990; Poulson et al., 1997; Song et al., 1998; Utgikar et al., 2001) ,以利各種反應槽
之設計,並提昇處理效率,其可容忍毒性效應濃度如Table 2-2 所示,不同重金
屬對不同族群的硫酸還原菌毒性效應濃度各不同。Utgikar et al. (2001) 研究銅離
子對混合培養之硫酸還原菌產生毒性效應濃度為12 mg/L,此與 Song et al. (1998)
研究結果有差異,Song et al. (1998) 研究銅離子對混合硫酸還原菌產生毒性效應
濃度高達 100 mg/L,其他學者研究銅離子對硫酸還原菌產生毒性效應濃度則介
於4-32.2 mg/L。Karnachuk et al. (2003) 研究銅離子對純菌 Desulfovibrion strain R2 產生毒性效應濃度則介於 50-70 mg/L。因此本研究根據文獻資料選擇實驗之 銅離子濃度範圍介於10-100 mg/L。
Table 2-2 Heavy metal toxicity to SRB
Metal SRB strain Toxic concentration,
mg/L Reference
Mixed culture 12 Utgikar et al. (2001)
Mixed culture 100 Song et al. (1998)
Desulfovibrion strain R2 50-70 Karnachuk et al.
(2003)
Mixed culture 4-20 Hao et al. (1994)
Cu
Mixed culture 32.2 Karri et al. (2006) Mixed culture 20 Utgikar et al. (2001)
Mixed culture 25-40 Hao et al. (1994)
Zn
Desulfovibrio
desulfuricans 13 Poulson et al. (1997)
Mixed culture 75-80 Hao et al. (1994)
Pb
Strain L-60 125 Loka Bharathi et al. (1990)
Mixed culture 80 Song et al. (1998)
Cr
Mixed culture 60 Hao et al. (1994)
Mixed culture >4-20 Hao et al. (1994)
Cd
Strain L-60 54 Loka Bharathi et al.
(1990)
Mixed culture 10-20 Hao et al. (1994)
Ni
Desulfovibrio
desulfuricans 10 Poulson et al. (1997)
2.4 固定化生物顆粒技術
近年來,國內環境污染日益嚴重,對於一些難分解性的工業廢水,例如高分 子化合物、農藥、芳香族化合物以及染料等製造業所產生的難分解性物質;或家 庭污水及地下水中的氨氮、硝酸鹽之去除等等,利用傳統生物處理法仍有不少困 難點及效率不彰等問題。因此,利用生物技術開發新型廢水處理程序來有效決解 環保問題已成為一項熱門的研究課題。固定化生物顆粒技術 (immobilization technology) 提供解決增加廢水生物處理效率的重要替代方案,主要原因為固定 化生物顆粒具有維持處理系統高微生物濃度的特點,提升處理效率,因此近年來 已被積極應用至各種廢水生物處理系統。微生物或酵素固定化之應用,早在 80 年代即已普遍應用於生物技術之相關 產業上,如 L-胺基酸、L-門冬胺酸及果糖等不少生化產品的大規模生產上,皆 有固定化技術應用之實例 (吳等,1996)。80 年代後,固定化技術應用於廢水處 理方面的研究已開始萌芽,歐、美及日本等國家認為固定化生物顆粒技術為廢水 生物處理程序中頗具發展潛力的重要技術之一。 2.4.1 固定化方法種類 固定化微生物細胞生長系統是將微生物細胞限制在固定的空間,使微生物細 胞附著於擔體表面形成生物膜 (biofilm) 或將微生物包埋於擔體內而成的生化觸 媒 (biocatalysts)。固定化微生物系統大致可分為自然固定化 (self-attachment immobilization) 及人工固定化 (artificial immobilization) 兩種不同型態 (Cohen
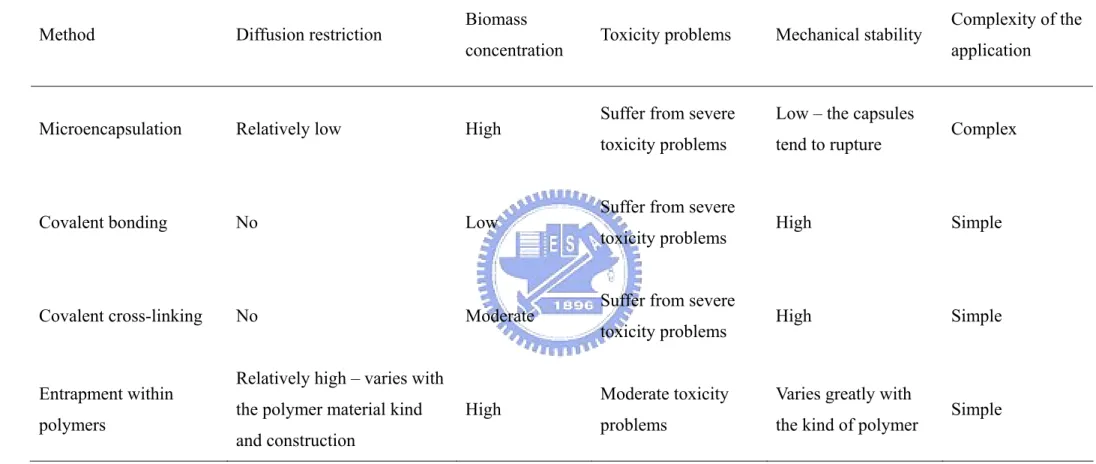
et al., 2001)。 (1) 自然固定化 (self-attachment immobilization) 自然固定化法是指在人為提供的適當環境之下,微生物細胞自然附著 (attachment) 或凝集 (aggregation) 於支持物或擔體表面或多孔性擔體內部成長 而形成的生物膜。 (2) 人工固定化 (artificial immobilization) 人工固定化係指利用人工方式將具活性之微生物細胞固定於擔體材料之表 面或內部而形成的生化觸媒。目前已被廣泛應用的固定化方法有:微膠囊包覆法 (microencapsulation) 、 共 價 鍵 結 法 (covalent bonding) 、 交 聯 法 (covalent crosslinking) 及包埋法 (entrapment)。其中又以包埋法最為常見。Table 2-3 為不
同人工固定化法之比較 (Cohen et al., 2001),並分述如下。 (A) 微膠囊包覆法是以殼材將微生物包覆起來,所製成微小囊狀容器的一種技 術,微膠囊直徑約為 10-100 µm。而該微生物可在微膠囊內自由移動,並利 用透過殼材滲透進來的基質進行生長。此方法雖然有高微生物濃度及低擴散 限制的優點,但其製作過程手續繁雜且某些殼材對微生物會造成毒性,使菌 體活性降低,其次所製成之微膠囊機械強度低,當微生物生長、細胞分裂或 產生氣體時可能導致微膠囊破裂。 (B) 共價鍵結法是利用載體本身所具有不同的特殊官能基,或鍵結於其上之化合 物所提供的特殊官能基,與生化物質形成共價鍵結,進而固定生化物質。此 法所獲得的固定化菌體顆粒雖然機械強度高,但在共價鍵結時牽涉到劇烈的 化學反應,導致菌體的活性降低。 (C) 交聯法是透過雙或三官能基反應劑之協助,將個別生物觸媒單元 (酵素或細 胞) 相結合在一起,以形成不溶狀高分子量凝聚物。其中一種便是以 UV 光 照射,利用苯甲酸作為感光劑,進行載體的光交聯反應,以製備膜狀的固定 化菌體顆粒,此法雖可獲得高強度之固定化菌體顆粒,但卻不易形成顆粒形 狀,且在數小時UV 光照射下,會導致微生物之死滅。 (D) 包埋法是將生化物質與膠體原料均勻混合後再製成薄膜或粒狀膠體,大分子 的生化物質被包埋在膠體內不易流失,而小分子的待測物仍可進入膠體內與 生化物質反應。且膠體的包埋屬於溫和的固定化方法,不但製作程序簡單且 固定化菌體顆粒活性高、機械強度佳,使其成為最常見的固定化方法之ㄧ。 因此本研究選擇包埋法進行菌體固定化之方法。
Table 2-3 A comparison between the different methods for the artificial immobilization of microorganisms to bedding material
Method Diffusion restriction Biomass
concentration Toxicity problems Mechanical stability
Complexity of the application
Microencapsulation Relatively low High Suffer from severe
toxicity problems
Low – the capsules
tend to rupture Complex
Covalent bonding No Low Suffer from severe
toxicity problems High Simple
Covalent cross-linking No Moderate Suffer from severe
toxicity problems High Simple
Entrapment within polymers
Relatively high – varies with the polymer material kind and construction
High Moderate toxicity
problems
Varies greatly with
the kind of polymer Simple Reference: Cohen et al., 2001.
2.4.2 人工固定化之優點 人工固定化技術應用於廢水處理的領域已多年,在歐美、日本等國家,認為 人工固定化技術,為廢水處理程序中,頗具發展潛力之重要技術,其優點如下 (陳,2000): (1) 人工固定化技術,主要將濃縮微生物,藉由聚合材料包覆,將微生物截留在 反應槽中,以維持處理系統之高微生物濃度。 (2) 處理系統之高微生物濃度,可提高反應槽之系統容積負荷,縮短水力停留時 間,減少反應槽容積,而大幅減少用地面積及建設之成本。 (3) 處理系統之高微生物濃度,對水力停留時間或有機負荷之突增或遽變,具有 較高的忍受能力,使操作具有緩衝水質、水量變化之彈性。 (4) 可藉由加大擔體顆粒外型尺寸及比重,容易與廢水分離,微生物不易流失, 提高微生物利用價值。 (5) 擔體具保護作用,可增加菌體抵抗外來毒性物質傷害之能力,有利於系統之 穩定操作。 (6) 可大幅減少污泥產量,理論上僅有傳統活性污泥法剩餘污泥產量之 20- 30%,利於程序減廢之目標。 (7) 不必如同自然固定化生物膜系統必須實施週期性逆洗 (back-washing),且不 易發生生物膜剝落,進而影響系統操作之問題。 (8) 被固定的微生物種類,可根據廢水性質而選擇不同的優勢菌群或特殊菌株來 分解特定的廢水成分,以提高處理效率。 雖然人工固定化技術具上述多項優點,但在實際應用上仍有些缺點及限制必 須加以慎重考量: (1) 微生物經過人工固定化後,可能造成代謝、生理狀況之改變。 (2) 擔體內微生物老化後,孔洞易阻塞,菌體再活化不易。 (3) 擔體內屬於大型生物的原生動物不易存活,可能影響整體淨化機能。 (4) 固定化擔體材料之機械強度,微生物相容性、成本及固定化方法等,宜作長 期性觀察及大量生產可行性之研究。 (5) 長期使用後,廢棄菌體顆粒之處理問題。
2.4.3 人工固定化之材料 人工固定化材料為微生物固定化技術成敗之重要關鍵,因此在選擇材料時, 應 考 慮 下 列 之 條 件 , 以 做 為 選 擇 最 佳 固 定 化 材 質 時 , 重 要 的 參 考 依 據 (林,1993;吳等,1996)。 (1) 擔體材料可配製成水溶性溶液,並能在室溫下固化膠凝。 (2) 價格低廉。 (3) 固定化方法簡單,容易量產。 (4) 結構性質強韌,耐久性佳。 (5) 需對微生物不具毒性。 (6) 具擔體內部質傳阻力小之特性。 (7) 可有效截留微生物於擔體內。 以一般最常見人工固定化方法包埋法而言,其固定化材料可分為天然和人工 合成的高分子聚合物兩類。天然的材料如褐藻膠鈣 (Ca-alginate)、瓊脂 (agar) 及 鹿角藻膠 (carrageenan),其機械強度脆弱,膠體顆粒易破裂,在使用上一直被限 制;人工合成的高分子聚合物材料以聚丙烯醯胺 (polyacrylamide)、脲酯聚合物 (urethane prepolymer)、三醋酸纖維 (cellulose triacetate)、聚乙烯醇 (polyvinyl alcohol, PVA)、聚乙二醇 (polyethylene glycol, PEG) 等高分子聚合物質為主,其 中聚丙烯醯胺 (polyacrylamide) 及脲酯聚合物 (urethane prepolymer) 對微生物 之毒性較大,而三醋酸纖維 (cellulose triacetate) 則不易成形顆粒,亦是無法普 遍用於固定化之主因。而PVA 則是價格便宜,無生物毒性,固定化菌體活性高, 強度佳及固定化程序簡單、為目前固定化微生物擔體最常被應用的種類 (林, 1993;吳等,1996)。因此本研究選擇 PVA 為固定化微生物擔體之材料。 2.4.4 PVA 固定化技術應用於廢水處理之研究 固定化技術應用於廢水處理方面,以 PVA 為固定化主要材料之相關國內外 研究頗為豐富 (Chang and Tseng, 1998; Chen et al., 1998; Chen and Lin, 1994; Long et al., 2004; Rostron et al., 2001),其固定化方式可分為四種:主要將 PVA 浸 漬於不同溶液中固定,如硼酸、磷酸鹽、硝酸鹽固定液及冷凍回溫之固定化方式, Table 2-4 整理,4 種固定化方法及應用分述如下。
3% 硼酸及 2% 氯化鈣溶液,在 4oC 下維持 24 小時,主要包覆硫氧化菌
Acidithiobacillus ferrooxidans,並使用固定床反應槽 (packed-bed reactor) 處理
含亞鐵離子廢水,結果發現當稀釋率達0.38 h-1,亞鐵離子氧化速率增加至1.89
g/L/h,有效增加其處理效率。但由於此固定化方法在硼酸溶液中浸泡長達 24 小時,對微生物傷害頗大。
(2) PVA 磷酸酯化法:Chen et al. (1994) 研究以 4-22% (w/v) PVA 溶液,滴入飽和
硼酸溶液0.5 小時,以形成顆粒,再置入 0.5 M 磷酸鹽溶液硬化 1 小時,主
要包覆脫硝菌處理合成硝酸鹽廢水,結果顯示實驗進行32 天後,硝酸鹽去除
率達99%。此法不僅固定化程序簡單且固定化菌體顆粒活性高,強度佳,因
此本研究以PVA 磷酸酯化法製作 PVA 固定化菌體顆粒。
(3) PVA 硝酸固定化法:Chang and Tseng (1998) 研究以 8% (w/v) PVA 溶液,滴
入含有50% (w/v) 硝酸鈉及 1% 氯化鈣溶液 1 小時,包覆脫硝菌處理合成硝
酸鹽廢水,結果顯示實驗運行3 天後,硝酸鹽去除率達 90%以上。
(4) PVA 冷凍回溫固定化法:Rostron et al. (2001) 研究以 20% (w/v) PVA 溶液, 包覆硝化菌 (2.5 g VSS/L ),置入 -20oC 之冷凍庫 39 小時,然後取出於室溫 下回溫24 小時,並切成 0.8 公分的小立方體顆粒,處理合成氨氮廢水,結果 顯示硝化作用之容積負荷率由0.36 提升至 0.70 Kg/Nm3/d 。但此固定方法在 製作過程需連續地冷凍回溫,不僅費時甚久,手續繁雜,且耗費能源較不具 經濟效益。
Table 2-4 Cell immobilizations within PVA carriers
Reactor Cell culture PVA carriers Wastewater Efficiency Reference
Packed-bed reactor Acidithiobacillus
ferrooxidans PVA-boric acid beads
Synthetic ferrous iron wastewater Fe2+ oxidation rate of 1.89 g/L/h was achieved at dilution rate 0.38 h-1 Long et al., 2004 CSTR1 Denitrifying
bacteria Phosphorylated PVA beads
Synthetic nitrate wastewater
Run for 32 days, nitrate removal of more than 99%
Chen and Lin, 1994
CSTR1 Sludge Phosphorylated PVA beads Synthetic municipal
wastewater
More than 90% COD removal in COD
loading rate lower 2.0 g COD/L/d
Chen et al., 1998
Batch reactor Alcaligenes
eutrophus PVA-sodium nitrate beads
Synthetic nitrate wastewater
Run for 32 days, nitrate
removal over 90% Chang and Tseng, 1998
CSTR1 Nitrifying bacteria PVA-freeze-thawing beads Synthetic ammonia wastewater Volumetric nitrification rates added from 0.36 to 0.70 Kg/Nm3/d
Rostron et al., 2001
1CSTR: continuously stirred tank reactor
2.5 實驗設計法
2.5.1 中央合成設計 (Central composite design, CCD)
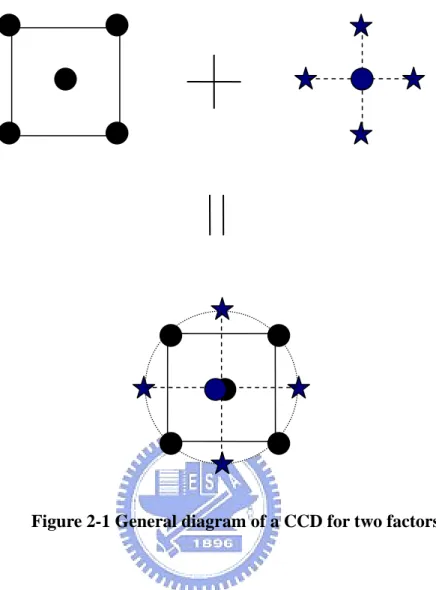
為了要聯繫相關和獨立變數 (dependent and independent) 並使用最少實驗組 數,採用二因子的中央合成設計,這種實驗設計方法可以建構獨立變數的二階多 項式並判定變數的顯著性。 二因子的中央合成設計概念如 Figure 2-1 所示,CCD 包含了一個 2K因子設 計 (實心點),2K個軸點實驗 (星形點),和 Nc個中心點實驗使得可以估計出曲率。 如果對於每個因子來說,中心點到各因子頂點的距離是 ±1 個單位,則中心點到 星形點的距離是 ± α,在此|α|>1。CCD 通常含有因數兩倍的星形點,星形 點代表設計中每個因子的極限值 (高和低)。為了維持旋轉性,α 值與 CCD 因子 部分的實驗組數有關,如果此因子是全因子設計則α 值一般定義為 α = (2K)1/4。 以二因子設計為例,K = 2 則 α = 1.414 (Techapun et al., 2002)。 CCD 實驗所需組數為 N = 2K + 2K + 1,其中 K 代表獨立因子變數個數,以 兩個獨立因子變數為例,K = 2 故所需的實驗組數為九組 (Diaz et al., 2003),再 加上中心點取三重覆,則實驗組數共為11 組。 為了促進比較係數和形象化 (visualization) 獨立變數在反映變數上,獨立因 子變數的水準範圍經由式 2-1 正規化 (normalized) 從-1.414 到 1.414,此正規化 過程更能精準估計回歸係數且降低線性和二次項之間的交換關係。 2 / min) max (X X X X Xn − − = (式 2-1) X :獨立變數的絕對值 X :變數平均值 max X :變數最大值 min X :變數最小值
Figure 2-1 General diagram of a CCD for two factors.
2.5.2 反應曲面法 (Response surface method, RSM)
反應曲面法 (RSM) 搭配著中央合成設計,可更有效對於我們有興趣的反應 及變數之影響達到最佳化的目標。假設反應槽中硫酸鹽還原之反應速率常數為 (Y),操作因子為 PVA 固定化菌體顆粒量 (蛋白質添加量) (X1) 及銅離子濃度 (X2),則反應槽中硫酸鹽還原之反應速率常數為 PVA 固定化菌體顆粒量 (蛋白質 添加量) 及銅離子濃度的函數,如式 2-2 所示: ε + = f(X1,X2) Y (式 2-2) 其中 ε 代表硫酸鹽還原之反應速率常數 Y 中所觀察到的誤差。如果將上式簡化 成Y = f(X1,X2),則此方程式所代表的曲面就稱為反應曲面。利用RSM 以及等 高線圖可以決定因子最佳操作條件或範圍。
第三章 實驗材料與方法
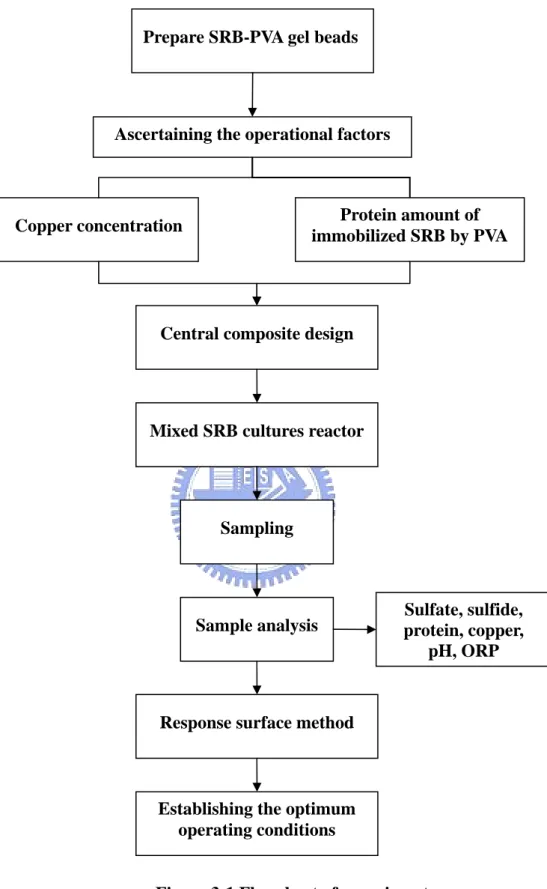
3.1 實驗流程與架構
本實驗之流程架構如 Figure 3-1 所示,首先利用 PVA 磷酸酯化法 (Chen and Lin, 1994) 包覆硫酸還原菌製成 PVA 固定化菌體顆粒,為了解 PVA 固定化菌體 顆粒之包覆微生物受廢水重金屬銅離子濃度對其微生物活性 (硫酸鹽還原率)
之影響,依文獻資料選定銅離子濃度及PVA 固定化菌體顆粒量 (蛋白質添加量)
兩個實驗因子,以實驗設計之中央合成設計 (central composite design, CCD) 進 行實驗,於不同反應時間採樣分析各項水質參數,以瞭解生物沉澱過程銅離子去 除效率及微生物生長狀況。最後將實驗結果以反應曲面法 (response surface method, RSM) 分析,並藉由 Minitab 統計軟體回歸分析找出最適合用於 PVA 固 定化菌體顆粒受廢水重金屬銅離子濃度對其微生物活性之影響的評估指標,並找
Figure 3-1 Flowchart of experiment Ascertaining the operational factors
Protein amount of immobilized SRB by PVA Copper concentration
Mixed SRB cultures reactor
Sampling
Central composite design
Sample analysis
Establishing the optimum operating conditions Response surface method
Sulfate, sulfide, protein, copper,
pH, ORP Prepare SRB-PVA gel beads
3.2 藥品
本研究以聚乙烯醇 (polyvinyl alcohol, PVA) 為固定化材料包覆硫酸還原菌
製成PVA 固定化菌體顆粒,PVA 是由長春石化公司所提供,其鹼化度 (hydrolysis)
在99.4-99.8 mole%;NaH2PO4‧H2O、Na2HPO4‧7H2O 皆購自德國的 Merk 公司;
HBO3則購自美國Panreac 公司,而其它藥品規格皆為試藥級以上。
3.3 植種污泥來源及馴養
3.3.1 培養基成分
污泥馴養所使用之培養基為文獻中提到利於硫酸還原菌生長之 SRB1 medium (White and Gadd, 1996),其主要組成為:乳酸鈉 (Lactate)、Yeast extract、 Na2SO4、NaHCO3、KH2PO4、NH4Cl、CaCl2‧6H2O、FeCl3‧6H2O,其中乳酸鈉
為其生長所需之碳源,其成分濃度如Table 3-1 所示。培養基需以滅菌釜 (EA-635,
EASTERN MEDICAL) 121oC,1.5 Kg/cm2滅菌15 分鐘後,以供馴養硫酸還原菌 使用。
Table 3-1 Composition of SRB1 medium
Composition Concentration (g/L) Lactate (70%) 3.5 Yeast extract 0.1 Na2SO4 2.66 NaHCO3 2.52 NH4Cl 1.0 KH2PO4 0.25 CaCl2‧6H2O 0.06 FeCl3‧6H2O 0.04
3.3.2 厭氧污泥之批次馴養 本研究所使用硫酸還原菌菌種來源採自新竹市養猪廢水的厭氧污泥,經由調 配利於硫酸還原菌生長之培養基SRB1 medium 進行長期批次馴養,每批次馴養 14 天,利用水浴循環將溫度控制在 30oC,以進行下一批次培養。首先需將滅完 菌之培養基以HCl 調整 pH 至 7.5 ± 0.1,接著曝氮氣約 30 分鐘再倒入反應槽中, 並以磁石攪拌的方式進行培養,培養其間亦進行 pH 及 ORP 之即時監控,以確 保pH 介於 7.0-7.5 及 ORP 低於 -350 mV。
3.4 PVA 固定化菌體顆粒製備方法
本研究依循 Chen and Lin (1994) PVA 磷酸酯化法製作固定化菌體顆粒,其製
備流程如 Figure 3-2 所示。首先將 PVA 加熱溶於水中,製成 PVA 溶液 (20%,
w/v);待其冷卻至 30-40oC 後,再與濃縮的硫酸還原菌污泥液 (20 g VSS/L) 以體
積比1:1 混合,並攪拌均勻。以注射針筒將此 PVA-菌體混合液,在室溫下緩緩
滴入飽和硼酸溶液中,以形成顆粒。經30 分鐘後將 PVA 顆粒以篩網過濾取出,
用去離子水洗去殘餘硼酸。隨後,再將顆粒浸漬於pH 值約 5 的磷酸鹽溶液 (0.5
M Na2HPO3 : 0.5 M NaH2PO3 = 1 : 1) 中 1 小時,進行 PVA 磷酸酯化之凝膠作用。
最後將顆粒取出以去離子水沖洗,製成粒徑約為 3-4 mm 的 PVA 固定化菌體顆
粒。備製好之PVA 固定化菌體顆粒置於新鮮培養基內,並保持厭氧狀態,並於 8
Figure 3-2 Preparation of immobilized SRB by phosphorylated PVA method
3.5 PVA 固定化菌體顆粒量及銅離子濃度對硫酸還原效率之實驗
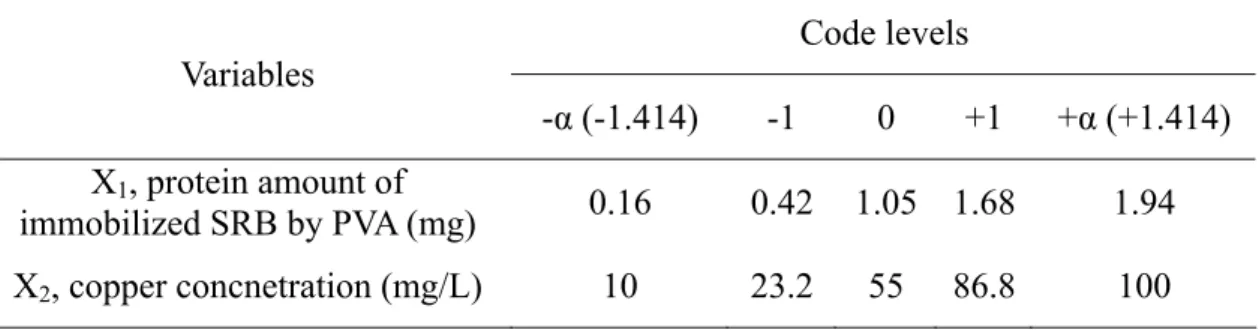
3.5.1 以中央合成設計法建立實驗組數 Utgikar et al. (2001) 研究重金屬濃度對硫酸還原菌有明顯抑制作用,從數 mg/L 至數百 mg/L 不等,不同重金屬對硫酸還原菌毒性不同,其中以銅離子的 毒性最強,依據研究重金屬銅離子對硫酸還原菌產生毒性的濃度介於 10-100 mg/L。以 PVA 固定硫酸還原菌主要增加反應槽中微生物量,並增加硫酸還原的 效率,且 PVA 固定化菌體顆粒具保護作用,可增加硫酸還原菌抵抗重金屬之毒 性影響,並提升重金屬的去除率。為瞭解重金屬銅離子濃度及 PVA 固定化菌體 顆粒量對生物沉澱系統中硫酸還原效率及重金屬去除之影響,本研究選用 2k因 子 (k=2) 之中央合成設計法(CCD)規劃設計實驗組數。 每個獨立因子變數具有 5 個水準範圍,並依文獻資料,設計 PVA 固定化菌 體顆粒包覆硫酸還原菌,設計硫酸還原菌菌體量介於19-235 mg VSS/L,即試驗 Mixed SRB culture (20 g VSS/L)Mix of volume ratio of 1:1
PVA aqueous solution (20%, w/v)
Rinse with tap water
Allow to harden in phosphate solution for 1 h (pH 5) Drop into saturated boric acid for 30 min
其所對應的自然變數 (natural levels) 及編碼變數 (coded levels) 如 Table 3-2 所 示。經由統計軟體 Minitab 的中央合成設計亂數執行出來的組數及順序,中心
點取三重覆共11 組實驗,其批次實驗序列如 Table 3-3 所示。
Table 3-2 The CCD experimental range and levels of the independent variables
Code levels Variables -α (-1.414) -1 0 +1 +α (+1.414) X1, protein amount of immobilized SRB by PVA (mg) 0.16 0.42 1.05 1.68 1.94 X2, copper concnetration (mg/L) 10 23.2 55 86.8 100
Table 3-3 Sequence of runs for the central composite design
Coded
variable Operated condition
Experiment run
X1 X2 Protein amount of immobilized SRB by PVA (mg) Copper concnetration(mg/L)
1 -1 -1 0.42 23.2 2 0 -1.414 1.05 10 3 -1 1 0.42 86.8 4 -1.414 0 0.16 55 5 1 1 1.68 86.8 6 0 0 1.05 55 7 0 1.414 1.05 100 8 0 0 1.05 55 9 1.414 0 1.94 55 10 0 0 1.05 55 11 1 -1 1.68 23.2
3.5.2 實驗條件 本實驗使用 250 mL 之磨口三角燒瓶為反應槽,在每組實驗依 Table 3-4 濃度 配製8 瓶 SRB1 medium,經滅菌釜滅菌後配製相同條件的混合液,並將 pH 值調 整至7.5 ± 0.1,添加不同重金屬銅離子 (濃度如 Table 3-3 所示) 配製 150 mL 之 人工合成廢水。實驗前測定單位重PVA 固定化菌體顆粒中蛋白質之含量,依 Table 3-3 設計蛋白質添加量計算每瓶需加入之 PVA 固定化菌體顆粒的重量,加入 PVA 固定化菌體顆粒後以氮氣曝氣10 分鐘將燒瓶維持在厭氧狀態。隨後,將瓶口密 封,置於恆溫震盪培養箱進行反應,反應溫度控制在30 ± 2oC,反應震盪速率為 100 rpm。然後分別於反應時間 0、2、6、12、24、48、96 及 168 小時,各拿一 瓶進行分析,為避免空氣中氧氣的影響,瓶口開啟後立即進行pH、ORP 測定, 水樣以0.2 µm 濾膜過濾後依硫酸鹽離子、硫離子、銅離子濃度分析之保存方法 保存水樣,PVA 固定化菌體顆粒則進行蛋白質濃度分析。每組實驗同時以 PVA 空白顆粒以相同實驗條件作為對照組之實驗。
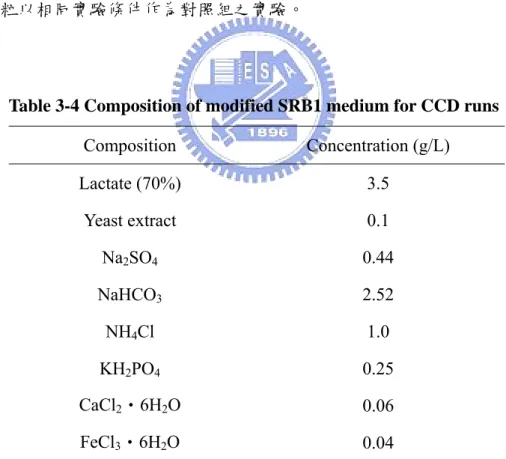
Table 3-4 Composition of modified SRB1 medium for CCD runs
Composition Concentration (g/L) Lactate (70%) 3.5 Yeast extract 0.1 Na2SO4 0.44 NaHCO3 2.52 NH4Cl 1.0 KH2PO4 0.25 CaCl2‧6H2O 0.06 FeCl3‧6H2O 0.04
3.6 分析項目及方法
3.6.1 pH 及 ORP
pH 及 ORP 的測定分別使用 pH 電極 (SUNREX,台灣) 及 ORP 電極 (SUNTEX,台灣) 在瓶口開啟後立即進行測量。
3.6.2 硫酸鹽離子、硫離子及銅離子
本實驗的硫酸鹽離子、硫離子及銅離子分析方法皆為 Standard Methods (APHA et al., 2005) 及環檢所公告之標準方法,其各項分析方法及使用儀器如 Table 3-5 所示。而所有的樣品在分析前均使用 0.2 µm 的濾膜 (Advantec, Japan) 過濾後才進行分析。
Table 3-5 Samples analysis and instruments
Items Unit Methodology Instruments
Sulfate mg/L Trubidimetric method Spectrophotometer (HITACHI, U3210) Sulfide mg/L Methylene blue method Spectrophotometer (HITACHI, U3210) Copper mg/L Flame Atomic Absorption Spectrometric Method spectrophotometer (HITACHI, Z-8100) Flame atomic absorption
3.6.3 PVA 固定化菌體顆粒菌體量測定
PVA 固定化菌體顆粒菌體量之測定係利用蛋白質測定法,藉由蛋白質與菌 體量之檢量線得知菌體量大小值。
(1) 蛋白質測定方法
本試驗蛋白質測定採 Bradford 測定法 (Bradford Protein Assay) (Bradford, 1976)。其藥品與分析方法如下所述:
(A) 藥品:蛋白質染劑 (protein assay dye) 及蛋白質標準品 (bovine serum albumin standard;蛋白質濃度 10 mg/mL),購自美國 Bio-Rad 公司。
(B) 分析方法:以二次水 (distilled, deionized water) 將蛋白質染劑稀釋五倍,取
後,於室溫下靜置5 分鐘再以分光光度計 (Packard SpectraCount, BS 1000) 於 波長600 nm 下測其吸光度。以蛋白質濃度對吸光度作圖,線性迴歸即得蛋白 質濃度對吸光度之檢量線 (如 Figure 3-3 所示)。 y = 0.001x + 0.0017 R2 = 0.9975
0
0.1
0.2
0.3
0.4
0.5
0.6
0
100
200
300
400
500
600
Protein concentration (mg/L)
A
bs
or
ba
nc
e (
600 nm
)
Figure 3-3 Relationship of protein concentration and absorbance at 600 nm
(2) 懸浮菌體之測定及檢量線之制定
配製不同濃度之馴養污泥並測其 VSS 濃度後,取 1.5 mL 的菌體溶液,以
12470 × g,4oC,離心 10 分鐘,除去上澄液;再加入無菌水清洗後,再度離心倒
出上澄液,如此反覆進行清洗3 次後,加入適量 sodium dodecyl sulfate (SDS),
再加入二次水使其體積與離心前相同,並保持最終濃度為含有 1% 的 SDS,將 此樣品置於超音波震盪 2 小時,藉由 SDS 溶解細胞壁及細胞膜,以萃取出細胞 內蛋白質。其次以12470 × g,4oC,離心 20 分鐘,取上澄液並將體積定量至 1.5 mL,再利用上述 Bradford 法決定上澄液中蛋白質的濃度,而上澄液中蛋白質總 量為上澄液體積乘以上澄液中蛋白質濃度,以mg protein 表示。另外,將菌體濃 度乘以菌體樣本體積 (1.5 mL) 即為實驗樣本中的菌體量。取不同濃度的污泥溶 液重覆此實驗,可得不同污泥量 (mg VSS) 與所含蛋白質量 (mg protein) 之檢量
y = 0.0549x + 0.0027 R2 = 0.9923
0
0.05
0.1
0.15
0.2
0
0.5
1
1.5
2
2.5
3
3.5
VSS (mg)
pr
ot
ei
n (
m
g)
Figure 3-4 Relationship of protein and VSS
(3) PVA 固定化菌體顆粒蛋白質測定方法 取約 0.3 g 的 PVA 固定化菌體顆粒,以少量的二次水輕輕沖掉表面之培養基 後,置放於玻璃皿上,以刀片將顆粒切碎,把顆粒碎片放入1.5 mL 的試管中。 以少量的二次水清洗刀片及玻璃皿,並將此洗液一併加入試管中。另添加二次水 及SDS 溶液,使最後試管中之液體體積約為 1.5 mL,且含 1% SDS。依前述方 法測定其蛋白質濃度。最後將上澄液體積乘以上澄液之蛋白質濃度即為0.3 g 的
PVA 固定化菌體顆粒所含的蛋白質量 (mg protein),由此可得單位重 PVA 固定化 菌體顆粒中的蛋白質含量 (mg protein/g PVA beads)。
(4) PVA 固定化菌體顆粒菌體量之估算
由計算所得之單位重 PVA 固定化菌體顆粒中的蛋白質含量 (mg protein/g PVA beads) 乘 以 添 加 PVA 固 定 化 菌 體 顆 粒 的 重 量 可 得 蛋 白 質 總 量 (mg protein),再以 Figure 3-4 不同污泥量 (mg VSS) 與蛋白質量 (mg protein) 之關係 式,計算PVA 固定化菌體顆粒之菌體含量 (mg VSS/g PVA beads)。
第四章 結果與討論
4.1 中央合成設計實驗結果
本實驗主要探討 PVA 固定化菌體顆粒之添加量及銅離子濃度對硫酸還原效 率之影響,其實驗結果之 pH、ORP、硫酸鹽、硫離子、銅離子及蛋白質濃度各 參數變化情形描述如下。 4.1.1 pH 及 ORP 變化 各組實驗 pH 之變化如 Figure 4-1 所示,實驗初始的 pH 均調整至 7.5 ± 0.1, 由結果顯示各組 pH 都有先升後降的趨勢,pH 值上升可能原因為維持厭氧條件 以氮氣進行曝氣10 分鐘,使得因添加作為緩衝溶液的 HCO3-,產生CO2逸散而 導致pH 上升至 8.0 左右,但隨著硫酸還原菌的生長產生 HS-,之後pH 便逐漸下 降並因緩衝作用而維持穩定。除了最低PVA 固定化菌體顆粒量 (第 4 組,protein: 0.16 mg) 和最高銅離子濃度 (第 7 組,Cu: 100 mg/L) 兩組試驗組之 pH,分別因 添加 PVA 固定化菌體顆粒量少及高濃度銅離子的抑制作用,其生物生長有較長 的遲滯期 (lag phase),pH 下降趨勢緩慢外,其餘各試驗組之 pH 分別於反應 12-24 小時間後隨即開始下降並因緩衝作用而維持在7.5-6.8,這與文獻指出一般適宜硫酸還原菌生長的pH 約介於 5-9 的範圍一致 (Zagury et al., 2006)。而對 PVA 空白
顆粒之對照組之pH,也因曝氮氣後,導致 pH 上升至 8.0 左右,但所添加之 PVA 空白顆粒因沒有包覆硫酸還原菌亦沒有生物還原反應發生,故反應期間pH 均維 持在7.8-8.0 之間。 Figure 4-2 為各組之 ORP 變化情形,所有試驗組 (除了第 4 組及第 7 組之外) 之ORP,最晚在反應第 48 小時內下降至 -400 mV 左右,之後便維持在 -370 至 -450 mV 之間至反應結束,顯示硫酸還原菌快速地生長及沉澱銅離子,並維持在 絕對厭氧狀態。而第4 組及第 7 組之 ORP 分別於 168 及 96 小時才下降至 -399 及 -403 mV,推測原因亦為因添加的 PVA 固定化菌體顆粒量少及高銅離子濃度 的抑制作用而延遲生長。其他試驗組隨著操作條件不同,ORP 變化亦有不同的 遲滯期,但所有組別的 ORP 均下降超過 -200 mV,之後便維持在 -370 mV 至
Radhika et al., 2006)。而 PVA 空白顆粒之對照組因所添加 PVA 空白顆粒沒有包 覆硫酸還原菌亦沒有生化反應,所以在整個實驗中ORP 均介於 121-136 mV,沒 有顯著的變化。 Cu: 10 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 pH 6.0 6.5 7.0 7.5 8.0 8.5 Run 2 (protein: 1.05 mg) Blank Cu: 23.2 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 pH 6.0 6.5 7.0 7.5 8.0 8.5 Run 1 (protein: 0.42 mg) Run 11 (protein: 1.68 mg) Blank Cu: 55 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 pH 6.0 6.5 7.0 7.5 8.0 8.5 Run 4 (protein: 0.16 mg) Run 9 (protein: 1.94 mg) Central point (protein: 1.05 mg) Blank Cu: 86.8 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 pH 6.0 6.5 7.0 7.5 8.0 8.5 Run 3 (protein: 0.42 mg) Run 5 (protein: 1.68 mg) Blank Cu: 100 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 pH 6.0 6.5 7.0 7.5 8.0 8.5 Run 7 (protein: 1.05 mg) Blank
Cu: 10 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 ORP (m V) -500 -400 -300 -200 -100 0 100 200 Run 2 (protein: 1.05 mg) Blank Cu: 23.2 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 ORP (m V) -500 -400 -300 -200 -100 0 100 200 Run 1 (protein: 0.42 mg) Run 11 (protein: 1.68 mg) Blank Cu: 55 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 OR P (mV) -500 -400 -300 -200 -100 0 100 200 Run 4 (protein: 0.16 mg) Run 9 (protein: 1.94 mg) Central point (protein: 1.05 mg) Blank Cu: 86.8 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 OR P (mV) -500 -400 -300 -200 -100 0 100 200 Run 3 (protein: 0.42 mg) Run 5 (protein: 1.68 mg) Blank Cu: 100 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 ORP (mv) -500 -400 -300 -200 -100 0 100 200 Run 7 (protein: 1.05 mg) Blank
4.1.2 硫酸鹽濃度變化
硫酸鹽還原率 (sulfate reduction efficiency, SRE) 對於評估硫酸還原菌活性 是相當重要的指標,Utgikar et al. (2001) 曾提出溶液中之溶解性重金屬對於硫酸 還原菌之毒性效應可間接藉由分析硫酸還原率加以得知。Figure 4-3 及 Figure 4-4 分別為各實驗之硫酸鹽濃度及硫酸還原率變化之情形,結果顯示除了第4 第 7 組 之外之其他各試驗組在反應48 小時內,硫酸鹽濃度從 304.2 ± 2.8 mg/L 下降至 1.3-23.4 mg/L,硫酸還原率介於 92.3-99.6%。並在第 168 小時,所有試驗組硫酸 鹽還原率在99% 以上。其中第 4 組硫酸鹽濃度於 48 小時後才緩慢從 289.6 mg/L 下降,於第96 小時下降至 264.6 mg/L,惟一旦硫酸還原菌開始生長產生硫離子, 與廢水中銅離子作用後,其硫酸還原作用即不再受抑制而急速增加,第168 小時 之硫酸還原率達 99.6%;而第 7 組其硫酸鹽濃度亦於 48 小時後才緩慢從 276.2 mg/L 下降,於第 96 小時下降至 72.1 mg/L,相同地只要硫酸還原菌開始生長產 生硫離子與銅離子作用後,其硫酸還原作用即不再受抑制而急速增加,第168 小
時之硫酸還原率達98.7%。這與 Utgikar et al. (2002) 的研究結果一致,Utgikar et
al. (2002) 指出利用硫酸還原菌處理含重金屬之酸礦廢水,水中溶解性重金屬可
和生物作用產生的硫離子結合形成金屬硫化物沉澱,當溶液中含微量之重金屬時 有助於硫酸還原菌促進生物還原作用,反之高濃度重金屬則會對硫酸還原菌產生 抑制甚至毒性效應。
Cu: 10 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Sulfate con centratio n (mg/L) 0 50 100 150 200 250 300 350 Run 2 (protein: 1.05 mg) Blank Cu: 23.2 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Sulfate con centratio n (mg/L) 0 50 100 150 200 250 300 350 Run 1 (protein: 0.42 mg) Run 11 (protein: 1.68 mg) Blank Cu: 55 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Su lfate co ncen tratio n (m g/L) 0 50 100 150 200 250 300 350 Run 4 (protein: 0.16 mg) Run 9 (protein: 1.94 mg) Central point (protein: 1.05 mg) Blank Cu: 86.8 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Sulfate con centratio n (mg/L) 0 50 100 150 200 250 300 350 Run 3 (protein: 0.42 mg) Run 5 (protein: 1.68 mg) Blank Cu: 100 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Sulfate con centratio n (mg/L) 0 50 100 150 200 250 300 350 Run 7 (protein: 1.05 mg) Blank
Cu: 10 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Su lfate redu ction efficiency (%) 0 20 40 60 80 100 120 Run 2 (protein: 1.05 mg) Blank Cu: 23.2 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Su lfate redu ction efficiency (%) 0 20 40 60 80 100 120 Run 1 (protein: 0.42 mg) Run 11 (protein: 1.68 mg) Blank Cu: 55 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Su lfate red uctio n efficien cy (% ) 0 20 40 60 80 100 120 Run 4 (protein: 0.16 mg) Run 9 (protein: 1.94 mg) Central point (protein: 1.05 mg) Blank Cu: 86.8 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Su lfate redu ction efficiency (%) 0 20 40 60 80 100 120 Run 3 (protein: 0.42 mg) Run 5 (protein: 1.68 mg) Blank Cu: 100 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Su lfate redu ction efficiency (%) 0 20 40 60 80 100 120 Run 7 (protein: 1.05 mg) Blank
4.1.3 PVA 固定化菌體顆粒之菌體量變化
Figure 4-5 為測定各組之蛋白質含量換算成揮發性固體物 (volatile suspended solids, VSS) 之變化,綜觀 11 組結果顯示,隨著硫酸還原菌利用硫酸鹽為電子接 受者進行生長,反應槽內的 VSS 都有增加的趨勢,不過由第 1、2、3、4、7 及 中心點的組別來看,在密閉系統內,硫酸還原菌在反應槽中生長至硫酸鹽或碳源 用盡後,便趨緩而維持穩定;但第5、9 組由於添加的 PVA 固定化菌體顆粒量較 多 (protein: 1.68 mg),總 VSS 在實驗最後結束時,有略呈下降之趨勢,這是因 為此實驗為密閉系統,硫酸還原菌生長所需的營養鹽無法維持較多 PVA 固定化 菌體顆粒量的生長,而導致略呈下降之結果。
比硫酸鹽還原率 (specific sulfate reduction rate) 定義為單位時間內硫酸鹽消 耗的總質量與微生物總質量之比值,其類似活性污泥之食微比,主要用於控制微 生物生長狀況及基質的利用。適當的食微比可使微生物生長代謝指數達到最大; 另一方面,較低的食微比讓微生物處於飢餓的狀態,使微生物處於內呼吸期及代 謝不活潑的狀態。其計算方式如式4-1: 比硫酸鹽還原率 (mg SO42-/mg VSS/h) 2 / ) )( ( ) ( t t t t t t t t t C t t VS VS V C C tX CV ∆ + ∆ + ∆ + + − − = ∆ ∆ = (式 4-1) C ∆ :在∆t時段內硫酸鹽濃度之變化 (mg/L)。 V :反應槽體積 (L)。 t ∆ :時間的變化量 (h)。 C X :在∆t時段內平均微生物量 (mg VSS)。 Figure 4-6 為各組之比硫酸還原率之比較,結果顯示在相同的銅離子濃度條 件下,微生物量 (蛋白質添加量) 會對比硫酸還原率造成影響,如第 1 組及第 11 組之銅離子濃度同為23.2 mg/L,而蛋白質添加量分別為 0.42 及 1.68 mg,其比 硫酸還原率最高分別達到 0.171 及 0.065 mg SO42-/mg VSS/h,意即微生物量愈 大,則比硫酸還原率愈小,其它各組亦然;另一方面,在相同的微生物量下,銅 1 組及第 3 組之蛋白質添加
分別達到0.171 及 0.142 mg SO42-/mg VSS/h,這表示重金屬銅離子會對硫酸還原 菌產生不利生長之影響,意即重金屬銅離子濃度愈高,則比硫酸還原率愈小,其 它各組也有上述之現象。 Cu: 10 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 To tal V S S (m g) 0 10 20 30 40 Run 2 (protein: 1.05 mg) Blank Cu: 23.2 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 To tal V S S (m g) 0 10 20 30 40 50 60 70 Run 1 (protein: 0.42 mg) Run 11 (protein: 1.68 mg) Blank Cu: 55 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 T ot al VSS (m g) 0 20 40 60 80 100 120 Run 4 (protein: 0.16 mg) Run 9 (protein: 1.94 mg) Central point (protein: 1.05 mg) Blank Cu: 86.8 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 To tal V S S (m g) 0 10 20 30 40 50 60 70 80 90 100 Run 3 (protein: 0.42 mg) Run 5 (protein: 1.68 mg) Blank Cu: 100 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 To tal VSS (mg ) 0 10 20 30 40 Run 7 (protein: 1.05 mg) Blank
Figure 4-5 Variation of total VSS calculated from the protein concentration in CCD experimen.
Cu: 10 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Speci fi c sulfate reducti on rate (mg SO 4 2-/m g VSS/h) 0.00 0.05 0.10 0.15 0.20 Run 2 (protein: 1.05 mg) Blank Cu: 23.2 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Specific sulfate reduction rate (mg SO 4 2-/m g V SS/ h) 0.00 0.05 0.10 0.15 0.20 Run 1 (protein: 0.42 mg) Run 11 (protein: 1.68 mg) Blank Cu: 55 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Specifi c s ulfate reducti on r at e (m g SO 4 2- /m g VS S/h ) 0.00 0.05 0.10 0.15 0.20 Run 4 (protein: 0.16 mg) Run 9 (protein: 1.94 mg) Central point (protein: 1.05 mg) Blank Cu: 86.8 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Sp ec ific sulfa te reduction rate (mg S O4 2- /mg VSS /h) 0.00 0.05 0.10 0.15 0.20 Run 3 (protein: 0.42 mg) Run 5 (protein: 1.68 mg) Blank Cu: 100 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Speci fi c sulfate reducti on rate (mg SO 4 2-/m g VSS/h) 0.00 0.01 0.02 0.03 0.04 0.05 Run 7 (protein: 1.05 mg) Blank
Figure 4-6 Variation of specific sulfate reduction rate in CCD experiment.
4.1.4 銅離子濃度變化
重金屬對於硫酸還原菌的生長具有毒性及抑制效應,其造成的影響舉凡如降 低或阻斷硫酸還原菌的生物活性,此結果會對利用硫酸還原菌進行重金屬之生物
必要的。 Figure 4-7 為各試驗組銅離子濃度變化,結果顯示除了第 4 組及第 7 組之外, 其它試驗組在48 小時內銅離子濃度均小於 1 mg/L 以下,可見硫酸還原菌在這些 試驗組中能迅速地適應環境而生長。而第4 組及第 7 組在反應 48 小時內銅離子 濃度變化較為平緩,而在第48 小時後銅離子濃度迅速減少,推測在此階段硫酸 還原菌開始生長大幅產生硫離子,與廢水中銅離子發生反應形成不溶性金屬硫化 物沉澱而導致此現象。其結果與硫酸鹽濃度變化趨勢亦同。 Cu: 10 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Copp er co ncentration (mg /L) 0 2 4 6 8 10 12 14 Run 2 (protein: 1.05 mg) Blank Cu: 23.2 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Co pper concen trat ion (m g / L ) 0 10 20 30 Run 1 (protein: 0.42 mg) Run 11 (protein: 1.68 mg) Blank Cu: 55 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Cop per co ncentratio n (mg /L) 0 10 20 30 40 50 60 Run 4 (protein: 0.16 mg) Run 9 (protein: 1.94 mg) Central point (protein: 1.05 mg) Blank Cu: 86.8 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Cop per c oncent ra tion (mg / L ) 0 10 20 30 40 50 60 70 80 Run 3 (protein: 0.42 mg) Run 5 (protein: 1.68 mg) Blank Cu: 100 mg/L Time (h) 0 20 40 60 80 100 120 140 160 180 Copp er co ncentration (mg /L) 0 20 40 60 80 100 Run 7 (protein: 1.05 mg) Blank