1
行政院國家科學委員會專題研究計畫成果報告
以毛細管電泳儀定量分析膠原蛋白(II)
Quantitative Analysis of Collagen by Capillar y Electr ophor esis (II)
計畫編號:NSC 87-2314-B-002-311-M08
執行期限:86 年 8 月 1 日至 87 年 7 月 31 日
主持人:黃玲惠 國立台灣大學醫學院 醫學工程研究中心
一、中文摘要 膠原蛋白為細胞外基質的主要組成 份,也是構成結締組織的主要蛋白質。許 多疾病的因果與組織中膠原蛋白的種類、 含量變化有密切的關聯性,因此尋求方便 的定性定量方法有其需要性。毛細管電泳 分析儀結合電泳與高效率液相層析法的優 點,具有偵測上快速、精確、靈敏的優點。 本年度的研究根據第一年建立的膠原蛋白 分析條件,分離並比較不同種類膠原蛋白 的毛細管電泳分析圖譜,結果發現各個種 類膠原蛋白的胺基酸組成之同質性太高, 缺乏有效的荷質比差異,因此完整的膠原 蛋白分子樣品無法達成同步定量分離的理 想,所以我們進一步建立膠原蛋白溴化氰 胜 (CNBr peptide)之最佳分析條件,試圖 找出個別種類膠原蛋白的差異性,以有效 分離定量不同種類的膠原蛋白。 關鍵詞:毛細管電泳分析、膠原蛋白、溴 化氰胜 。 Abstr actCollagen is the major component of extracellular matrix, and is also the major protein of connective tissues. Many diseases are associated with the changes of collagen typing and their contents. To establish a more rapid, sensitive, and accurate method, capillary electrophoresis was chosen which combines the advantages of electrophoresis and high performance liquid chromatography. It is difficult to differentiate various types of collagen using previously established method
due to similarity on the amino acid composition. Variation on certain peptide for different types of collagen exists after CNBr digestion treatment. An optimal analytical condition for CNBr peptides of collagen was established in the current study.
Keywor ds: capillary electrophoresis, collagen, CNBr peptides
二、
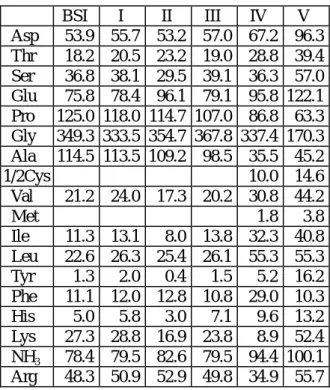
緣由與目的 膠 原 蛋 白 (collagen) 為 細 胞 外 基 質 (extracellular matrix)的主要成分之一,亦是 構成結締組織(connective tissue)的主要蛋 白質。目前已知至少有 18 種之多的膠原蛋 白[1],由於體內各組織的功能不同,所含 的膠原蛋白種類亦不盡相同,例如:第一種 膠原蛋白存於皮膚、硬骨、血管、齒質、肌 腱等組織,第二種膠原蛋白存於軟骨、眼球 內的玻璃體(vitreous body),第三種膠原蛋 白存於皮膚、子宮、血管、肉芽組織,第四 種膠原蛋白存於腎絲球、水晶體包膜(lens capsule) 、 角 膜 後 界 膜 (Descement’s membrane)、所有上皮及內皮細胞的基底 膜,第五種膠原蛋白少量存於血管、平滑肌 細胞的基底膜、及間葉細胞外等[2,3]。病 變時,膠原蛋白會產生質與量的變化,譬 如:透明軟骨發生病變或缺損時,修復部位 的膠 原蛋 白由 原來 的第 二種 變為 第一 種 [4],使得缺損的關節部位無法完全自行修 復,而產生骨關節炎(osteoarthritis);另外, 如一般皮膚傷口的癒合過程中,於不同的時 間,亦會分泌不等量不同種類的膠原蛋白 [5];此外,角膜病變[6,7]、或各種膠原蛋2 白 疾 病 , 如 systemic lupus erythematosis [8],scleroderma [9],dematomyositis 等, 不只其膠原蛋白的構造纖維產生改變,甚至 其膠原蛋白的種類及量都產生相當大的變 化。 毛細管電泳分析儀結合電泳與高效率 液相層析法的優點,具有偵測上快速、精 確、靈敏的優點。於第一年的研究中,我 們已找尋出以毛細管電泳儀分析完整膠原 蛋白分子的方法,且建立定量膠原蛋白的 標準曲線。本年度的研究主要比較各種類 膠原蛋白的胺基酸組成及毛細管電泳分析 圖譜,並進而建立以毛細管電泳儀分析膠 原蛋白溴化氰胜 (CNBr peptide)之最佳分 析條件。 三、結果與討論 由第一年的研究成果,我們已建立以毛 細管電泳儀分析膠原蛋白的最佳條件。如圖 一,試樣緩衝液為 0.05 M acetic acid 及 25 mM SDS,溶離緩衝液為 50 mM Na2B4O7, 0.1mM tetramethylammonium bromide,25 mM SDS,pH 9.29,分析個別膠原蛋白分子 之種類,結果發現其吸收峰所出現的位置相 近。圖二為相同條件下分析各種類膠原蛋白 混合物之毛細管電泳儀分析圖譜,數支吸收 峰相並連,無法有效分辨個別種類膠原蛋白 分子之含量。 毛細管電泳分析儀的分離原理乃根據 物質的荷/質比差異的特性。探討各種類膠 原蛋白的分子特性如下,¬第一、二、三種 類膠原蛋白有相近分子量,Á各種類膠原蛋 白的分子結構皆為三股螺旋鍊,Â各種類膠 原蛋白分子的胺基酸序列主要為-Gly-X-Y-之三元重覆排列,其中 glycine 約佔總胺基 酸含量的 1/3,並由 Table 1 的胺基酸組成 份分析得知,各種類膠原蛋白其含量較多的 組成胺基酸有很高的相似性,其中第一與第 三種類膠原蛋白含量較多的前 6 種組成胺 基酸竟有相同的排列順序,即為 Gly,Pro, Ala,Glu,Asp,Arg;支鏈(side chain)帶有 電荷的組成胺基酸為第二、四、五種類膠原 蛋白的 Glu,第四、五種類膠原蛋白的 Asp、 Lys,第四種類膠原蛋白的 Arg,第五種類 膠原蛋白的 His 等,其中支鏈帶有電荷的組 成胺基酸其含量比例在各種類膠原蛋白間 差異微小;而第四、五種類膠原蛋白其含量 較高的組成胺基酸不似第一、三種類膠原蛋 白 彼 此 間 有 如 此 高 的 相 似 性 (homologous),但它們與第一、二、三種類 膠原蛋白及彼此間仍有高度的相似性,因此 它們雖然分子量與結構(非三股螺旋鍊部分 non-helix,domain structure)有較大差異性, 卻仍不足以使之有良好的分離。綜合以上之 分析因素,可知各種類膠原蛋白完整分子彼 此間有相似的荷/質比,故上述的最佳緩衝 液分析條件尚未能有效分離不同種類的膠 原蛋白。 為提高各種類膠原蛋白之荷/質比差 異,使達到有效分離的目的,我們以溴化氰 處理膠原蛋白使成為具個別特定分子量大 小之溴化氰胜 [10],再進一步以毛細管電 泳儀分析。如圖三,比較不同的緩衝液條件 下以毛細管電泳儀分離第一種膠原蛋白的 溴化氰胜 ,為使這些溴化氰胜 彼此間具 有良好的解析度,於試樣緩衝液中添加 5 M urea,因為 urea 已知能提高分析物的溶解度 [11~14],且破壞分子間的氫鍵作用。圖三 (A)為第一種膠原蛋白的溴化氰胜 於試樣 緩衝液為 5 M urea 及 0.5 mM SDS,溶離緩 衝液為 25 mM Na2B4O7,0.5 mM SDS,pH 10.56 之分析圖譜;圖三(B)為第一種膠原蛋 白的溴化氰胜 於試樣緩衝液為 5 M urea 及 10 mM SDS,溶離緩衝液為 25 mM Na2B4O7,10 mM SDS,pH 10.56 之分析圖 譜。雖然兩圖譜間具非常高的相似性,但仍 有差異之處,即圖三(A)在時間第 5 到第 8 分鐘之間和圖三(B)在時間第 9 到第 14 分鐘 之間出現一個寬闊(broad)不陡峭且峰形不 定、不對稱的分析峰。就溴化氰胜 之解析 條件而言,以圖三(A)的分析條件較佳。 圖四為以圖三(A)的緩衝液條件分析各 種類膠原蛋白溴化氰胜 之圖譜,結果發現 圖譜間具非常高的相似性。五種不同種類膠 原蛋白的組成αchain 之胺基酸序列雖然不 同,但由 Table 1 胺基酸組成份分析得知它 們彼此間擁有多量相似之胺基酸,如 Gly, Pro,Ala,Glu 等,所以不同種類膠原蛋白 之溴化氰胜 仍有多數具有相似之荷/質
3 比,仔細比較則可以找出各種類膠原蛋白之 特異分析峰。 若擬以毛細管電泳儀同時分離定量多 種類膠原蛋白溴化氰胜 ,將因為太高量的 分析峰於短時間內出現,而無法達到鑑定的 目的,因此有待進一步的研究。 四、計畫成果自評 本年度完成以毛細管電泳儀分析各種 類膠原蛋白完整分子及溴化氰 圖譜之 比較。由於胺基酸組成的高度相似性,使 得同時分離定量不同種類膠原蛋白高度困 難,可待進一步努力。 五、參考文獻
[1] Hulmes, D.J.S. (1992) The collagen superfamily-diverse structures and assemblies. Essays Biochem. 27, 49-67. [2] 黃玲惠、楊台鴻(1996)第三章:生醫材料篇。於 醫學工程原理與應用。正中書局,台北,台灣 省,中華民國。 [3] 李建雄、端木梁、翁郁嘉、黃淑姿(1991)第五 十六章:收縮性與結構性蛋白質。生物化學。藝 軒圖書出版社,台北,台灣省,中華民國。 [4] Barr, A.R., Duance, V.C., Wotton, S.F.,
Waterman, A.E. and Holt, P.E. Quantitative analysis of cyanogen bromide-cleaved peptides for the assessment of type I: type II collagen rations in equine articular repair tissue. Equine Vet. J. 26:29-23, 1994.
[5] Talwar, H.S., Griffiths, C.E., Fisher, G.J., Humilton, T.A. and Voorhees, J.J. Reduced type I and type III procollagens in photodamaged adult human skin. J. Invest. Dermatol. 105:285-290, 1995.
[6] Delaigue, O., Arbeille, B., Lemesle, M. and Roingeard P. Quantitative analysis of imunogold labellings of collagens types I, III, IV, and VI in health and pathological human cormeas. Graefes Arch Clin. Exp. Ophthalmol. 233:331-338, 1995.
[7] Leonardi, A., Abatangelo, G., Cortivo, and Secchi, A.G. Collagens type I, III in giant papillae of vermal keratoconjunctivitis. Br. J. Ophthalmol. 79:482-485. 1995.
[8] Yell, J.A., Wojnarowska, F., Allen, J. and Burge, S.M. Bullous systemic lupus erythematosus – a variable disease. Lupus. 2:383-385, 1993. [9] Callen, J.P., Tuffanelli, D.L. and Provost, T.T.
Collagen-vascular disease: on up date. J. Am. Acad Dermatol. 28:477-484, 1993.
[10] Chan, D. and Cole, W.G. Quantitation of type I and III collagens using electrophoresis of alpha chains and cyanogen bromide peptides. Anal. Biochem. 139:322-328, 1983.
[11] Terabe, S., Ishihama, Y., Nishi, H., Fukuyama, T. and Otsuka, K. Effect of urea addition in micellar electrokinetic chromatography. J. Chromatogr. 545:359-368, 1991.
[12] Otsuka, K. and Terabe, S. Effects of methanol and urea on optical resolution of phenylthiohydantoin-DL-amino acids by micellar electrokinetic chromatography with sodium N-dodecanoyl-L-valinate. Electrophoresis. 11:982-980, 1990.
[13] Terabe, S., Ishihama, Y., Nishi, H, Fukuyama, T. and Otsuka, K. Effect of urea addition in micellar electrokinetic chromatography. J. Chromatogr. 545:359-368, 1991.
[14] Josic, D., Zeilinger, K., and Reutter, W. Highperformance capillary electrophoresis of hydrophobic membrane proteins. J. Chromatogr. 516:89-98, 1990.
Table 1. Amino acid compositions of purified bovine skin type I collagen (BSI) and commercial type I , II , III , IV , V collagensa
BSI I II III IV V Asp 53.9 55.7 53.2 57.0 67.2 96.3 Thr 18.2 20.5 23.2 19.0 28.8 39.4 Ser 36.8 38.1 29.5 39.1 36.3 57.0 Glu 75.8 78.4 96.1 79.1 95.8 122.1 Pro 125.0 118.0 114.7 107.0 86.8 63.3 Gly 349.3 333.5 354.7 367.8 337.4 170.3 Ala 114.5 113.5 109.2 98.5 35.5 45.2 1/2Cys 10.0 14.6 Val 21.2 24.0 17.3 20.2 30.8 44.2 Met 1.8 3.8 Ile 11.3 13.1 8.0 13.8 32.3 40.8 Leu 22.6 26.3 25.4 26.1 55.3 55.3 Tyr 1.3 2.0 0.4 1.5 5.2 16.2 Phe 11.1 12.0 12.8 10.8 29.0 10.3 His 5.0 5.8 3.0 7.1 9.6 13.2 Lys 27.3 28.8 16.9 23.8 8.9 52.4 NH3 78.4 79.5 82.6 79.5 94.4 100.1 Arg 48.3 50.9 52.9 49.8 34.9 55.7
aValues are expressed as residues / 1000 total amino acid residues
(A) (B)
4
Fig. 1. Capillary electrograph of commercial collagens in sample buffer with 0.05 M acetic acid, 25 mM SDS; running buffer: 50 mM Na2B4O7, 0.1 mM tetramethylammonium bromide, 25 mM SDS, pH 9.29. Collagen type (A) I (B) III (C) IV (D) V.
Fig. 2. Capillary electrograph of mixture of commercial collagen type I, III, IV, V in sample buffer with 0.05 M acetic acid, 25 mM SDS; running buffer: 50 mM Na2B4O7, 0.1 mM tetramethylammonium bromide, 25 mM SDS, pH 9.29.
(A)
(B)
Fig. 3. Capillary electrograph of CNBr peptides of type I collagen in sample buffer with 5 M urea and (A) 0.5 mM, (B) 10 mM SDS; running buffer: pH 10.56 with 25 mM Na2B4O7, (A) 0.5 mM SDS (B) 10 mM SDS. (A) (B) (C) (D) (E)
Fig. 4. Capillary electrograph of CNBr peptides of collagen type (A) I (B) II (C) III (D) IV (E) V in sample buffer with 5 M urea and 0.5 mM SDS; running buffer: pH 10.56 with 25 mM Na2B4O7,