國 立 交 通 大 學
應 用 化 學 系 暨 研 究 所
碩士論文
碳、氮摻雜之二氧化鈦奈米管應用於分解水及染料敏化
太陽能電池
C,N-doped TiO2 nanotubes used in water photoelectrolysis and
dye-sensitized
solar cells
研究生 : 朱雅玲
指導教授 : 林明璋 院士
碳氮摻雜之二氧化鈦奈米管應用於分解水及染料敏化太陽能電池
C,N-doped TiO2 nanotubes used in water photoelectrolysis and
dye-sensitized solar cells
研 究 生 : 朱雅玲 Student : Ya-Ling Chu 指導教授 : 林明璋 Advisor : M. C. Lin
國 立 交 通 大 學 應 用 化 學 研 究 所
碩 士 論 文
A Thesis
Submitted to Department of Applied Chemistry National Chiao Tung University
In partial Fulfillment of the Requirements for the Degree of Master
in
Applied Chemistry January 2010
Hsinchu, Taiwan, Republic of China
碳、氮攙雜之二氧化鈦奈米管應用於分解水及染料敏化太陽能電池 學生: 朱雅玲 指導教授 : 林明璋 國立交通大學應用化學暨研究所 摘要 本實驗主要研究利用電化學方法合成二氧化鈦奈米管,並摻雜了碳、 氮元素在二氧化鈦奈米管中,藉由光催化分解實驗可以發現具有摻雜之二 氧化鈦奈米管對於光的捕獲容易,光催化分解的效果較沒有摻雜的二氧化 鈦佳。經由水分解系統分別量測可見光及紫外光效率,發現此高密度排列 的奈米管可以明顯的增加反應效率,且紫外光區電流及水分解效率都較可 見光區好,而我們也經由SEM 圖譜、XRD 圖譜、及不同條件的二氧化鈦 奈米管的水分解效率了解一些二氧化鈦奈米管的物理特性,可以發現奈米 管電解液組成為 5%的 DI water + 0.55wt% NH4F + 95%的 formamide,鍛燒 溫度為500℃,水分解的電解液為 1M KOH 效果最佳,水分解效率在 UV 光區可達21%,可見光區則為 0.38%。最後我們也利用 XPS、IPCE 及反射 式吸收光譜對可見光部分作詳細討論,也對此二氧化鈦奈米管進行染料敏 化的測試,並以氮化銦奈米粒子修飾,對於效率提升有所幫助。
C,N-doped TiO2 nanotubes used in water photoelectrolysis and
dye-sensitized solar cell
Student : Ya-Ling Chu Advisor : M. C. Lin
Department of Applied Chemistry National Chiao Tung University
ABSTRACT
In this research, we study the fabrication of vertically grown TiO2
nanotube arrays with high aspect ratios by potentiostatic anodization of Ti foil in fluoride ion containing baths in combination with non-aqueous organic polar electrolyte like formamide, and the application of the nanotubes for dye-sensitized solar cells and hydrogen production by water photoelectrolysis system in the visible and ultraviolet light regions. The ultraviolet light region showed a better efficiency than the visible region. The properties of the synthesized TiO2 nanotubes have been characterized with the SEM, XRD, the
photocatalytic degradation of Methyl Red Dye, and the water splitting efficiency using different electrolytes. We learn the best anodization electrolyte condition is 5% DI water + 0.55wt %NH4F + 95% formamide, the best
annealing temperature is 500℃, and the best water splitting electrolyte is KOH. We have also observed a significant enhancement effect of InN nanoparticles deposited on the C,N-doped TiO2 nanotubes on the efficiency of N3 dye for
誌 謝
在交大的碩士生生涯終於到了結束的時候,真的投入研究後才發現原 來科學真的不是一件簡單的事,這時間受到很多人的照顧,首先要感謝林 明璋教授在實驗上的指導,讓我可以完成我的碩士學位。 實驗室要感謝強者偉哥,老王還有在實驗上幫助我很多的馬哥,以及 一起努力做TiO2 nanotubes同甘共苦的阿布和偉智學長,可愛學弟妹(小強, 汐容,娘娘,玳瑾,雯傑,冠霖)帶來歡笑,和我同屆的科余以及王念夏教 授實驗室的巨砲,鴻菊,Alonso約定一起努力完成碩士學位,感謝大家在 這段時間的陪伴及互相勉勵,口試委員王念夏老師和李積琛老師、還有最 善良的秀琴,非常謝謝你們在這段期間給予的協助,在此由衷的感謝。 家人的支持讓我可以無後顧之憂的完成我的學業,最後還是要說想感 謝的人太多了,只有深深的一句感謝大家,感謝大家的陪伴及對我的幫助。目錄
中文摘要………Ⅰ 英文摘要………Ⅱ 致謝………Ⅲ 目錄………Ⅳ 表目錄………Ⅵ 圖目錄………Ⅶ第一章 緒論………1
1-1 前言 ………2 1-2 歷史回顧與研究動機 ………2第二章 理論基礎 ………3
2-1 二氧化鈦特性 ………3 2-2 二氧化鈦陽極氧化化反應 ………4 2-3 光觸媒原理………7 2-3-1 光觸媒的催化原理 ………9 2-3-2 光水分解的原理 ………11 2-4 染料敏化太陽能電池工作原理 ………13第三章 實驗方法與步驟………16
3-1 藥品與設備………163-2 實驗方法………19 3-2-1 二氧化鈦奈米管製備………19 3-2-2 光催化分解甲基紅………20 3-2-3 光電化學裝置與分析之水分解系統………21 3-2-4 使用於染料敏化太陽能電池………23 3-2-4-1 染料敏化太陽能電池之電極製備………23 3-2-4-2 染料敏化太陽能電池鉑電極製備………23 3-2-4-3 電解液的配置………23 3-2-4-4 染料敏化太陽能電池之封裝………24 3-2-4-5 氮化銦修飾染料敏化太陽能電池………25 3-3 分析儀器簡述………25 3-3-1 X 光繞射儀(XRD)...25 3-3-2 掃描式電子顯微鏡(SEM)………...………26 3-3-3 紫外光/可見光吸收光譜儀(UV/Visible Absorption Spectrometer) ………27 3-3-4 X 射線光電子能譜儀(XPS) ……… 27 3-3-5 太陽光模擬器(Solar Simulator AM 1.5) ……… 28
第四章 結果與討論
………31 4-1 陽極化結果與分析 ………314-2 光催化分解甲基紅染料結果………37 4-3 水裂解效率結果………39 4-4 染料敏化太陽能電池………49
第五章 總結論………57
參考文獻………58
表目錄
表(3-1) 化學藥品………16 表(3-2) 儀器與設備………18 表(4-1) 拋光鈦片 EDS 元素分析………31 表(4-2) 碳氮摻雜之二氧化鈦奈米管 EDS 元素分析………36表(4-3) 摻雜碳氮之 TiO2 nanotube/N3 dye 其光伏參數列表………49
表(4-4) 泡 TiCl4後的TiO2 nanotube/N3 dye 其光伏參數列表………50
表(4-5) 陽極氧化 4 小時之 TiO2 nanotube/N3 dye/InN 其光伏參數列表…52 表(4-6) InN 奈米粒子修飾 TiO2 EDS 元素分析………55
圖目錄
圖(2-1-1) Rutile 和 Anatase 二氧化鈦的晶格結構 ………..4 圖(2-2-1) 電鍍鈦基材的反應圖 (a) 無氟離子 (產生平坦表面) (b) 存在氟 離子 (管狀結構產生) ………..………..……6 圖(2-2-2) 在常壓下二氧化鈦奈米管形成的概略圖 (a) 緻密氧化層, (b) 孔 洞形成並慢慢加深, (c) 管狀物旁形成小孔洞, (d) 管狀層完全成形前,(e) 理 想的管狀層生成 ………7 圖(2-3-1) 本多-藤嶋效果實驗裝置圖 ………...………..…8 圖(2-3-2) 光觸媒反應類型 ………...………8 圖(2-3-3) 常見的半導體能隙圖………9 圖( 2 - 3 - 4 ) 光 激 發 半 導 體 能 隙 過 程 中 , 電 子 電 洞 對 可 能 進 行 的 途 徑 ………..………10 圖(2-3-5) PEC cell 電荷傳遞示意圖………12 圖(2-3-6) 使用二氧化鈦奈米管電極分解水之示意圖………13 圖(2-4-1) 染料敏化太陽能電池的工作原理示意圖 ………14 圖(2-4-2) 染料敏化太陽能電池中產生電子再結合的機制………15 圖(3-2-1) 陽極氧化製作二氧化鈦奈米管使用超聲波實驗裝置圖 ……… 20 圖(3-2-2) 光催化分解染料實驗示意圖 ………21 圖(3-2-3) 光電化學反應裝置圖 ………22圖(3-2-4) 染料敏化太陽能電池封裝步驟 ………24 圖(3-2-5) 太陽光譜圖(solar spectrum)。AM1.5G:單位入射強度定義為 100mW/cm2,AM1.5:考慮環境因素的干擾,強度較 AM1.5G 低…………28 圖(3-2-6) 空氣質量(air mass)示意圖,依序是 AM 0、AM 1、AM 2 ………30 圖(4-1-1) 鈦片拋光圖 ………31
圖(4-1-2) SEM 影像顯示定電壓 20V TiO2奈米管結構變化;(a)1 min (b)10
min (c)15 min (d) 20 min (e) 30 min (f) 60 min ………32 圖(4-1-3) 陽極氧化時間對奈米管造成的變化 ………33 圖(4-1-4) 電壓對(a)奈米管孔洞半徑(b)管璧厚度造成的變化 ………34 圖(4-1-5) C1s XPS 圖 Pk1 is for graphitized carbon, and Pk2 is for doped carbon ………35 圖(4-1-6) N1s XPS 圖 ………35 圖(4-1-7) 碳氮摻雜之二氧化鈦奈米管 EDS 圖………..36 圖(4-2-1) 以 0.55wt% NH4F 之 95% formamide,20V,改變陽極處理時間 20~120 min,光催化分解甲基紅 ………37 圖(4-2-2) 摻雜之二氧化鈦奈米管與未摻雜之奈米管比較 ………38 圖(4-3-1) UV 與 VIS filter 波長穿透率圖 ………40 圖(4-3-2) 含碳氮(formamide)與不含碳(H3PO4)的二氧化鈦奈米管光解水在 UV 區之效率比較圖 ………41 圖(4-3-3) 1M KOH 不同溫度奈米管光解水效率圖(a)UV 區(320±70nm)效率
(b)Vis 區 (520±30nm) 效率 ………43 圖(4-3-4) 不同退火溫度二氧化鈦晶格 XRD 圖 ………44 圖(4-3-5) 水裂解在 UV/Vis 光區的 IV 圖(a)20V(b)30V(c)35V(d)15V ……45 圖(4-3-6) 使用陽極氧化處理 1h 的 20V,95% formamide 二氧化鈦奈米管在 不同電解液下的水分解效率………46 圖(4-3-7) 二氧化鈦奈米管 IPCE 效率圖 ………48 圖(4-3-8) 二氧化鈦奈米管反射式吸收光譜圖 ………48
圖(4-4-1) 摻雜碳氮之 TiO2 nanotube/N3 dye I-V 曲線圖 ………50
圖(4-4-2) 泡 TiCl4後的摻雜碳氮之TiO2 nanotube/N3 dye I-V 曲線圖……51
圖(4-4-3) 陽極氧化4小時之TiO2 nanotube/N3 dye/InN I-V曲線圖……52
圖(4-4-4) 修飾之二氧化鈦奈米管反射式吸收光譜圖………53
第一章
緒論
1-1 前言
自從歐洲工業革命以來,人類為了追求科技的蓬勃發展以及生活品質 的提升,能源的需求量也逐漸提升。1970 年代爆發了第一次能源危機,各 國開始思考對於石化燃料的過度使用問題,並致力於尋找新的能源。2005 年京都議定書的生效,簽約國必須抑制二氧化碳的排放量,使傳統的石化 燃料發電系統成本提高,因此發展再生能源和綠色能源已經成為全球共同 追求的趨勢。 美國前總統布希於 2001 年 5 月發布「國家能源政策」[1],闡述美國 國內能源供應與國內能源需求之間嚴重不平衡乃其所面臨最根本之能源挑 戰。美國能源部於同年11 月在華府舉辦氫能會議,目標為尋找更安全與更 乾淨的能源,結果一致認為氫氣為未來重要能源之ㄧ。 氫被廣泛的認為具有成為未來取代石化燃料能源的地位,其原因有: (1)氫是乾淨的能源且對於環境無汙染;(2)石化燃料的存量有限;(3)石油價 格的飆漲。宇宙約有 75%由氫構成,於自然界含量豐富,有關於氫的來源, 包括礦物燃料、硼氫化鈉水解、水之光電分解、光觸媒分解水、生物體等。 在所有獲取氫來源的方法中,又以光電化學法(photoelectrochemical method, PEC method) 最受科學界之重視,原因主要是利用太陽光做為分解水之能 量來源,具有無污染,且製程安全,並且可以結合H2-O2燃料電池的應用,是未來綠色能源中,被看好的發展技術。
1-2 歷史回顧與研究動機
近幾十年來二氧化鈦半導體材料由於具備物裡化學穩地性,無毒性, 高的光催化特性[2-4],和各種形式,因此被廣泛的應用於修飾太陽能電池 上。又近幾年來,奈米管柱型材料較任意排列的奈米粒子更容易吸收太陽 光,所以結合了這兩項優點,合成二氧化鈦奈米管柱。 在 2007 年 Mano Misra 等[5]提出利用有機溶液乙二醇和氟化胺溶液以 陽極氧化法製備出垂直於鈦基質上的二氧化鈦奈米管,此種二氧化鈦,摻 雜了碳元素(TiO2-xCx),可以大幅的提升二氧化鈦運用於光電化學電池(PEC Cell)的分解水效率。此結果使用三電極式電化學儀器,以 1M 的氫氧化鉀 作為電解液,在紫外光區(330 ± 70nm,13.9 mW/cm2)的光轉換效率可達 13.3%,可見光區(520 ± 46nm,5.27 mW/cm2)的光轉換效率為 8.5%,這個 結果令人注意。此外為了要使二氧化鈦得到更好的效率,利用染料、或摻 雜碳、磷、氮[22]或者金屬元素來修飾二氧化鈦奈米管柱,如 Schmuki[6,7] 團隊製備出摻雜氮的二氧化鈦(TiO2-xNx)奈米管柱,可以增加光催化性。 因此,本研究選擇了含有碳及氮元素的甲醯胺和氟化銨溶液,利用陽 極氧化法,做出共摻雜碳氮的二氧化鈦,期望能在可見光區有良好的吸收, 並達到較好的光電轉換效率。第二章 理論基礎
2-1 二氧化鈦特性
鈦金屬於自然環境中易生成二氧化鈦氧化膜,其氧化膜厚度的改變可 經由陽極處理的外加電壓而增加,鈦之陽極處理條件若經過特別的處理, 則可製出高品質或高附加價值之產品,如光觸媒感應器、奈米模板、太陽 能電池、光觸媒劑等。 二氧化鈦是一種陶瓷原料,在一般情況下與大部分化學試劑不會發生 反應,它無毒性,也不溶於水、稀酸、有機溶劑和弱無機酸,但微溶於鹼 及熱硝酸,可視為化學及物理性質相當穩定的物質,二氧化鈦過去被當為 白色顏料,俗稱「鈦白」,廣泛運用於塗料、化妝品、瓷器原料等方面。 二氧化鈦常見的晶體結構有銳鈦型(Anatase)、金紅石型(Rutile)和板太 型(Brookite)三種,Brookite 晶相由於極不穩定,因此實用上較少,而 Rutile晶相為最穩定晶型,在高溫下,Brookite 晶相和 Anatase 晶相會轉換成 Rutile
晶相結構。這三種結構中,以 Anatase 晶相和 Rutile 晶相應用性較廣泛,
具 有 光 催 化 的 能 力 , Rutile 晶 相 和 Anatase 晶 相 皆 為 正 方 晶 型 (tetragonal)[1],但兩者晶體結構不同,鈦原子之間的距離在 Anatase 晶相中
較Rutile 晶相中長,而鈦氧之間的距離,則是 Rutile 晶相大於 Anatase 晶相
圖(2-1-1) Rutile 和 Anatase 二氧化鈦的晶格結構[1] 在光催化的研究中,以 Anatase 晶相較 Rutile 晶相佳,主要有三個原 因:(1) Anatase 晶相有較大的能隙,當能隙增加時,傳導帶邊緣會移到更 高的能量,還原位能會移到更大的負值,因此增加光催化活性。(2)Rutile 晶相的電子電洞結合速度較 Anatase 晶相快(3)Rutile 晶相的 OH 基數較少, 在光觸媒分解中,主要是利用 OH 和反應物進行氧化分解,若是 OH 基數 少,則降低了反應的速率,因此太陽能電極通常為 Anatase 晶相為主。
2-2 二氧化鈦陽極氧化反應
從 1991 年 Iijima[8]報導奈米碳管與 1992 年 Tenne[9]報導無機奈米管 WS2以來,具有中空管狀結構的材料被廣泛的研究。目前為止,合成的無(1)過渡金屬的硫化合物:MoS2、MoSe2、WS2 (2)氧化物:TiO2、ZnO、V2O5 (3)過渡金屬的鹵化物:NiCl (4)混相或摻雜金屬:MO1-xWS2及 Ag-WS2 (5)硼或矽組成:BN、BCN 及 Si (6)金屬:Au、Cu、Ni 其中,以 TiO2是良好的光觸媒及光觸媒擔體,因此近年來有很多團隊學者 爭相研究。 目前文獻報導,製作氧化鈦奈米管的方法主要有三種:模板法(template method)[11]、陽極氧化法(anodic oxidation)[5],以及化學方法[12]。目前由 於陽極氧化法簡單,可以製備出大面積且整齊排列並垂直於基材的二氧化 鈦奈米管,因此近年來受到研究學者喜愛。 陽極氧化法屬於電化學方法的一種,可藉由電化學條件控制調整二氧 化鈦奈米管的型態與功能性,例如利用改變反應電位、反應時間、電解液 種類等參數來生成不同的奈米管徑大小及長度。二氧化鈦陽極氧化法所使 用的電解液主要分為四類,第一類為含有氫氟酸的水溶液,第二類為含氟 離子與不同種類的無機酸去搭配作為電解液,主要以硫酸、磷酸為主,第 三類為含氟離子的緩衝溶液,第四類為含氟離子的有機溶液,皆含有氟離 子是以上四種電解液的共同特性,這是由於鈦的材料特性,氟離子可與鈦
基板表面的二氧化鈦層反應形成錯合物而溶解至電解液中,從圖(2-2-1)可 以看到當電解時電解液不含氟離子,鈦基材表面將會產生一個平坦的表 面,當含有氟離子時則會形成[TiF6]2-,離開鈦基材到電解液中,此化學溶 解使奈米管結構可在反應中生成,其他如氯、溴、碘離子卻無此效果[13]。 而整個反應過程可以以反應式(1)(2)(3)來表示[14],而反應式(1)(2)其實幾乎 是同時發生的,而當鈦基材表面形成一緻密層後,最後反應式(3)就會接著 產生,圖(2-2-2)就是詳細的管狀物產生過程[15]。 (1) 2H2O → O2 + 4H+ + 4e -(2) Ti + O2 →TiO2 (3) 6F- + TiO2 + 4H+ → [TiF6]2- + 2H2O 圖(2-2-1) 電鍍鈦基材的反應圖 (a) 無氟離子 (產生平坦表面) (b) 存在氟 離子 (管狀結構產生) [13]
圖(2-2-2) 在常壓下二氧化鈦奈米管形成的概略圖 (a) 緻密氧化層, (b) 孔 洞形成並慢慢加深, (c) 管狀物旁形成小孔洞, (d) 管狀層完全成形前,(e) 理 想的管狀層生成
2-3 光觸媒原理
光觸媒於 1967 年被東京大學的藤嶋招教授發現,當時利用二氧化鈦單 晶和鉑作為電極,放至於水中,形成迴路,並使用汞燈照射紫外光,發現 在不通電的情況下,兩個電極均有氣體產生,分別收集為氧氣和氫氣,如 圖(2-3-1)[19]所示,二氧化鈦在此就是扮演著光觸媒角色。圖(2-3-1) 本多-藤嶋效果實驗裝置圖[19] 光觸媒反應可分為兩種類型:down-hill 和 up-hill 反應,如圖(2-3-2)。 圖(2-3-2) 光觸媒反應類型 一般光觸媒催化分解反應,如有機化合的光分解反應,是屬於 down-hill 型的光致反應。相反的,水分解成氫氣和氧氣的反應,是伴隨著自由能正 值的改變(大於零)且是一個 up-hill 反應。在此反應中,光子能量轉換成化 學能,算是一種光合作用。
2-3-1 光觸媒的催化原理
光觸媒通常使用金屬半導體,主要有磷化鎵、砷化鎵、硫化鎘、鈦酸 鍶、二氧化鈦、氧化鋅等,提供足夠能量的光子,可以使半導體的電子從 價帶(VB)躍遷至傳導帶(CB),成為具有氧化還原能力的光活性物質,常見 的半導體能隙圖如圖 2-3-3[16]。 圖(2-3-3) 常見的半導體能隙圖.[16] 半導體在接受較大能量的光子後,會被激發形成電子電洞對,路徑可 為(A)表面再結合(Surface Recombination):電子電洞傳遞到光觸媒表面,但未與表面的吸附物或環境中的溶劑進行電子電洞轉移,即產生再結合。(B) 晶體結構內再結合(Volume Recombination):電子電洞在未傳遞到表面時, 在晶格內部缺陷位置,發生再結合。(C)和(D)途徑分別為光激發產生的電 子電洞順利傳遞到表面並與電子施體(electron donor)或電子授體(electron accepter)進行氧化還原反應,如圖 2-3-4[17]所示。 圖(2-3-4) 光激發半導體能隙過程中,電子電洞對可能進行的途徑[17] 半導體受光激發後,除了上述四種可能的途徑之外,光催化反應過程 通常會伴隨著高反應性的自由基,如H2O 和 O2,而產生∙O2-、H+、OH∙ 和·HO2自由基和離子,這些自由基和負氧離子具有強氧化和還原能力,是 光催化反應中主要的活性物質,才是真正主導光觸媒催化反應的因素。Ollis
在文獻裡提出下列證據[18]:
1. ESR(Electron Spin Resonance)之分析確認 UV 光所照射的 TiO2溶液中含
有大量的氫氧自由基。
2.溶液中的二氧化鈦高度水化,表面的氫氧根會氧化形成氫氧自由基。 3.類似於氫氧自由基之反應終會產生許多氫氧化之中間產物。
4.含有氧及非水溶液狀況下,只有極少之反應發生或甚至不發生反應。 5.由同位素動力效應(Kinetic isotope effect)顯示氫氧自由基的形成,是反應 動力之重要步驟。
2-3-2 光分解水的原理
製造一莫耳氫氣所需的自由能是 237.2kJ,如反應式(4),因此氫氣與氧 氣形成水的逆反應非常容易發生,光分解的困難度較一般的光觸媒催化反 應更高。 H2O → H2 + O2 ΔG0 = 273.2 kJ/mol (4) 當半導體材料受到一個大於此半導體能隙 Eg 的 hν 能量的光子激發, 一個電子會被從價帶激發到導帶上,當半導體的能帶結構,導帶位置低於 水的還原電位(0V, vs, NHE),且價帶能位置高於水的氧化電位(+1.23V, vs. NHE),則光激發半導體生成電子電洞對會對水造成氧化還原反應,類似於 電解反應,電子由導帶還原水分子,電洞則由價帶氧化水分子,完成了光分解水,如圖2-3-5 所示[20]。 圖(2-3-5) PEC cell電荷傳遞示意圖[20] 圖2-3-6所示為二氧化鈦奈米管分解水的反應機制[21]。二氧化鈦奈米 管照射光後,會導致其價帶的電子電洞分離,當奈米管柱吸收足夠能量使 電子從價帶激發至導帶的光子後,電子會流向外部電路,達到陰極;同時 電洞會與奈米管柱表面的電解質水溶液氧化產生氫離子(H+),在這個過程 中,氧氣會逐漸在陽極形成,而外部使用電位計用來幫助氫離子移動至陰 極表面,並與電子結合產生氫氣。
圖(2-3-6).使用二氧化鈦奈米管電極分解水之示意圖[21]
2-4 染料敏化太陽能電池工作原理
染料敏化太陽能電池的基本結構包括透明的導電玻璃(TCO)、多孔性 奈米二氧化鈦電極、光敏染料(Photosensitizer) 、電解質(Electrolyte)以及鉑 對電極(Pt-counter electrode)等。工作原理如圖2-4-1所示[16]。
圖(2-4-1) 染料敏化太陽能電池的工作原理示意圖[16] 染料分子(Dye)吸收光能後,染料分子從基態躍升成激發態(S*),染料 分子與二氧化鈦以化學鍵鍵結,激發態染料分子的電子迅速注入相鄰的二 氧化鈦半導體之導帶,並形成氧化態的染料正離子(S+),導帶電子傳遞至透 明導電玻璃(Conducting glass),對外電路負載作功;染料正離子則從電解液 中的氧化反應得到電子而還原成基態,電解質在獲得電子的對電極表面藉 由鉑電極的催化進行還原反應。以下為簡單的運作反應式(5)-(8)[16]: Dye + hν → Dye* (5) Dye* → Dye+ + e¯ (6)
3I¯ + Dye+ → I3¯ + Dye (8) 在整個迴路中,有三個途徑會降低染料敏化太陽能電池的整理效率, 如圖2-4-2所示[23-27]: 圖(2-4-2) 染料敏化太陽能電池中產生電子再結合的機制 (1) 為半導體層導帶中的電子被氧化的電解質攔截(interception),而無法傳 回電極:2e¯ + I3¯ → 3I¯,此反應時間約為10-3秒,與電子在二氧化鈦層有 效電荷傳遞過程互相競爭,電子反向回電解液產生反向電流,稱為暗電流 (Dark current)。 (2) 為電荷重組(Charge recombination),注入半導體的電子與氧化態的染料 離子再結合。 (3) 為染料分子自身的電子–電洞對再結合(non-radiative relaxation),激發態 染料分子藉由釋放光或熱的過程回到基態,無法將電子注入半導體中。
第三章 實驗方法與步驟
3-1 藥品與儀器
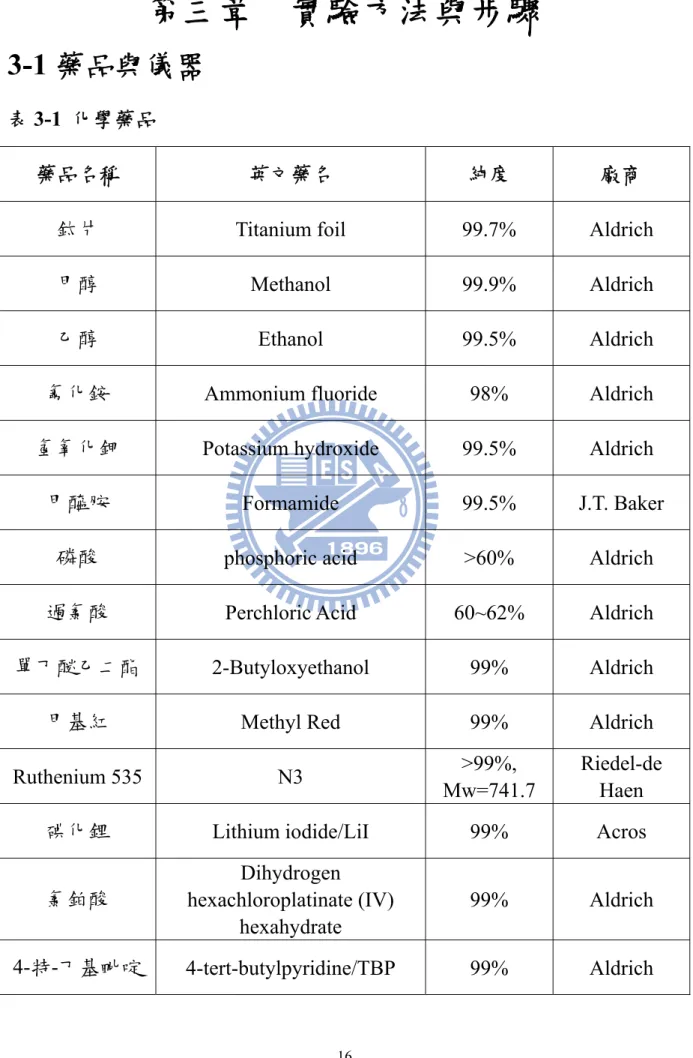
表3-1 化學藥品
藥品名稱 英文藥名 純度 廠商
鈦片 Titanium foil 99.7% Aldrich
甲醇 Methanol 99.9% Aldrich
乙醇 Ethanol 99.5% Aldrich
氟化銨 Ammonium fluoride 98% Aldrich
氫氧化鉀 Potassium hydroxide 99.5% Aldrich
甲醯胺 Formamide 99.5% J.T. Baker
磷酸 phosphoric acid >60% Aldrich
過氯酸 Perchloric Acid 60~62% Aldrich
單丁醚乙二酯 2-Butyloxyethanol 99% Aldrich
甲基紅 Methyl Red 99% Aldrich
Ruthenium 535 N3 >99%,
Mw=741.7
Riedel-de Haen
碘化鋰 Lithium iodide/LiI 99% Acros
氯鉑酸 Dihydrogen hexachloroplatinate (IV) hexahydrate 99% Aldrich 4-特-丁基毗啶 4-tert-butylpyridine/TBP 99% Aldrich
3-丁基-3-甲基 咪唑啉碘
3-Butyl-3-methylimidazolium
iodide 98% Aldrich
碳酸丙烯 Propylene carbonate/PC 99.70% Aldrich
碘 Iodine/I2 99.80% Acros
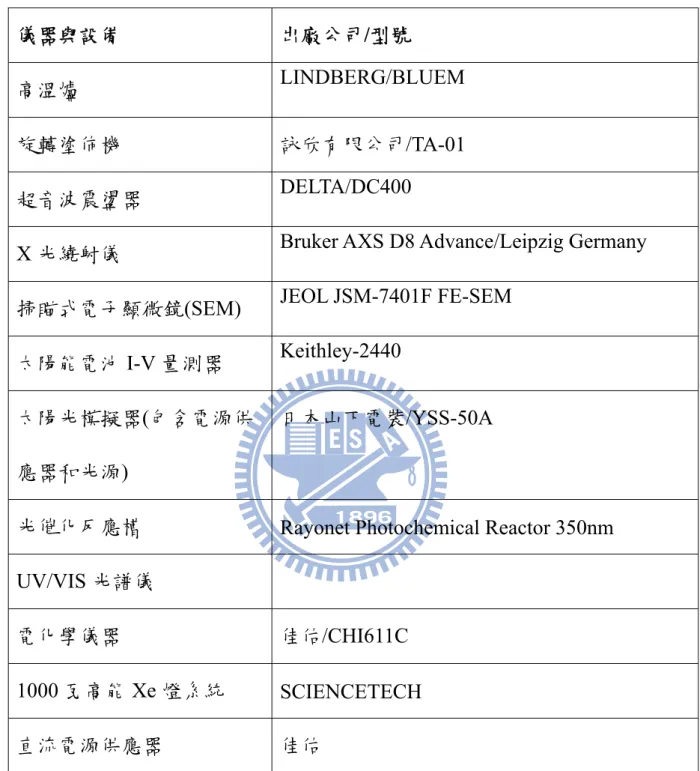
表3-2 儀器與設備
儀器與設備 出廠公司/型號
高溫爐 LINDBERG/BLUEM
旋轉塗佈機 詠欣有限公司/TA-01
超音波震盪器 DELTA/DC400
X 光繞射儀 Bruker AXS D8 Advance/Leipzig Germany
掃瞄式電子顯微鏡(SEM) JEOL JSM-7401F FE-SEM
太陽能電池I-V 量測器 Keithley-2440
太陽光模擬器(包含電源供 應器和光源)
日本山下電裝/YSS-50A
光催化反應槽 Rayonet Photochemical Reactor 350nm
UV/VIS 光譜儀
電化學儀器 佳佑/CHI611C
1000 瓦高能 Xe 燈系統 SCIENCETECH
3-2 實驗方法
3-2-1 二氧化鈦奈米管製備 本實驗之高純度鈦片(99.7% Ti foil, 0.2mm),一開始需使用乙醇與丙酮 清洗表面,之後用氮氣吹乾,但是此時鈦片表面是粗糙不平的,所以我們 必須先經電解拋光後,可使鈦片表面具有光學級之平整度。鈦片的電解拋 光液主要成份為過氯酸(HClO4 )、甲醇(CH3OH) 、單丁醚乙二酯 (HOCH2CH2OC4H9)等三種溶液,本研究中純鈦之電解拋光液比例為 5 % 過 氯酸 + 53 %單丁醚乙二酯 + 42 % 甲醇,外加電壓為 31V,拋光時間為 6 分鐘,實驗溫度控制在1℃,拋光完成後鈦片表面就會有銀亮色。 拋光完鈦片將會開始第二階段的電化學實驗,而本研究中使用了兩種 電解液,第一種電解液組成為5%的 DI water + 0.55wt%的 NH4F + 95%的 Formamide[28]其作用為摻雜碳和氮元素在奈米管中,第二種不會攙雜碳原 子於奈米管電解液為體積比 8:2 的 0.14M NaF:0.5M H3PO4[5],但將會含有 少量的磷。之後將要實驗的電解液置於超音波震盪器中,如圖3-2-1[29], 定電壓為20V,溫度控制在 20℃,實驗完成後以去離水沖洗,再用氮氣吹 乾,然後在500℃高溫爐中退火三小時即可完成,退火完後的二氧化鈦奈 米管需放在乙醇中以超音波震盪器震盪30 秒來清除二氧化鈦奈米管表面 上的沉澱氧化物。圖(3-2-1) 陽極氧化製作二氧化鈦奈米管使用超聲波實驗裝置圖 3-2-2 光催化分解甲基紅 利用二氧化鈦來光催化試驗來分解含氮之染料,使用 Rayonet 350 nm 的光源照射催化,實驗裝置如圖 3-2-2[32]。將陽極處理好的二氧化鈦奈米 管柱(面積為 1 cm2 )放置於內含 10 毫升 8.607×10-5M 之甲基紅溶液石英管 裡,光反應過程中使用磁石攪拌器,不加任何冷卻,並每隔一段時間將分 解的甲基紅溶液取出並紀錄其 UV-VIS 吸收光譜。
圖(3-2-2) 光催化分解染料實驗示意圖 3-2-3 光電化學裝置與分析之水分解系統 光電化學分析是利用 CHI611C 電化學儀器以三極式系統進行,分別以 二氧化鈦奈米管為工作電極,鉑電極為相對電極,Ag/AgCl 為參考電極; 電解液為1M KOH 水溶液,光照光源為 1000W 的高能 Xe 燈,並搭配使用 UV(330±70nm,光源強度到達二氧化鈦奈米管為 13.9 mW/cm2)與 Visible(520±46nm,光源強度到達二氧化鈦奈米管為 5.27 mW/cm2) filter, 光電化學反應槽以側面照光,照光面材質為石英玻璃,其餘為PYREX 玻 璃,實驗裝置為圖(3-2-3)。
1 8 7 6 5 4 3 2 1. CHI611C 電化學儀器 2.1000 瓦高能 Xe 燈系統 3. 光電化學槽 4. 工作電極 5. 參考電極 Ag/AgCl 6. 相對電極(Pt 鉑薄片) 7. 光強度偵測器(Power meter) 8. 升降台(Support jack) 圖(3-2-3) 光電化學反應裝置圖
3-2-4 使用於染料敏化太陽能電池 3-2-4-1 染料敏化太陽能電池之電極製備 二氧化鈦奈米管藉由陽極氧化法在 0.55wt% NH4F 之 95% Formamide 電解質中以20V 反應成長 1~24 小時,所得到的奈米管柱退火 500℃3 小時, 乙醇中震盪清洗30 秒,以去除表面沉澱物。之後再將此奈米管先浸泡在 50℃0.2M 的 TiCl4溶液中1 小時並以去離子水清洗接著退火 300℃30 分鐘。 再浸泡於 50℃0.1M 的 TiCl4溶液中半小時清洗表面後退火450℃30 分鐘, 並在溫度降至 100℃時浸泡於 1×10-3 M 的 N3 染料溶液 12 小時。 3-2-4-2 染料敏化太陽能電池鉑電極製備 利用0.7mm之FTO導電玻璃,利用旋轉塗佈機塗佈氯鉑酸(H2PtCl6),並 放置於烤箱退火400℃15分鐘,此步驟重複2次即完成鉑電極之製備。 3-2-4-3 電解液的配置
取若干克的LiI、I2、3-Butyl-3-methylimidazolium iodide、
4-tert-butylpyridine(TBP)溶於5毫升的碳酸丙烯中,使用超音波震盪機震盪 後得到此電解液:
0.1M LiI + 0.05M I2 + 0.5M TBP + 0.6M 3-Butyl-3-methylimidazolium iodide
3-2-4-4 染料敏化太陽能電池之封裝 (1) 將製備好的二氧化鈦奈米管與旋轉塗佈好氯鉑酸之 0.7mm FTO 電極組 成電池元件。 (2) 首先裁切0.16cm2的3M Scotch膠帶置於二氧化鈦片上,作為墊片 (spacer),再蓋上鉑電極,目的是避免讓鉑電極和二氧化鈦奈米管相接觸, 以免短路情況發生。 (3) 最後再以燕尾夾固定之,由於電極間的夾縫非常狹小,可利用虹吸現 象以電解液填滿空隙後即算完成,步驟可參考圖(3-2-4)。 圖(3-2-4) 染料敏化太陽能電池封裝步驟
3-2-4-5 氮化銦修飾染料敏化太陽能電池
將陽極處理好的二氧化鈦奈米管,以電漿增強式-化學氣相沈積系統 Plasma Enhance Chemical Vapor Deposition (PECVD)生成氮化銦,根據本實 驗室志偉[43]及稚偉[44]學長的合成氮化銦奈米粒子步驟,成長 InN 溫度為 85℃,時間 20 分鐘,濃度比為 NH3 : In(CH3)3 = 20 : 6 sccm,最後將成長完
之 InN/TiO2浸泡在 N3 dye 12 小時後,再將 InN/TiO2浸泡於0.1M 的 TiCl4
置於冰箱中5~7 小時,取出退火 150℃30 分鐘,即完成氮化銦之修飾。
3-3 分析儀器簡述
3-3-1 X 光繞射儀(X-ray Diffraction Spectrometer,XRD)
X 射線是一種波長很短的電磁輻射,範圍介於 0.1~100Å 之間。當 X 射線被晶體內有規則的環境散射時,散射的光線間會發生干涉現象(同時發 生建設性干涉與破壞性干涉),因此產生了繞射。我們可以利用布拉格方程 式(Bragg’s law),計算其晶格間的距離,同時也可以由繞射峰的半高寬計算 出結晶區塊的大小。 布拉格方程式(Bragg’s law): 2dsinθ=nλ 其中,n :為整數值 θ : 繞射波峰的布拉格角(Bragg Angle)
λ: X 光的波長(1.5405Å) d : 結晶面間的距離 此外,XRD 亦可用來量測樣品結晶顆粒的大小,依據 Debye-Scherrer equation 求出平均之二氧化鈦的結晶粒子大小,其計算公式如下: D=0.9λ/B cosθ 其中,D :平均晶粒大小 λ: X 光的波長(1.5405Å) B : 繞射峰的半高寬 θ : 繞射波峰的布拉格角(Bragg Angle)
3-3-2 掃描式電子顯微鏡(Scanning Electron Microscope,SEM)
利用電子槍產生電子束後,以約 0.2~40kV 電壓予以加速,經過柵極聚 焦及電磁透鏡,匯聚成電子束,接著聚焦於試片表面。在末端電磁透鏡上 裝有掃描線圈,可偏折電子束,使其在試片表面作二度空間掃描。當電子 束撞擊試片表面時,會產生向後散射的墊子及自材料中被激發射出的二次 電子(secondary electron) 。這些電子產生的狀態與材料表面的凹凸、物質 種類及電位有關。將這些電子訊號利用檢測器(detector)接收並經放大器放 大,再送到顯示螢幕上成像。由於掃描線圈上的電流與螢幕上的電流同步 變化,所以試片表面之任意點所產生的訊號與顯示螢幕的亮點會逐一對
3-3-3 紫外光/可見光吸收光譜儀(UV/Visible Absorption Spectrometer)
偵測光波長在 190~1100nm 範圍內化合物分子外層軌道電子躍遷的能 量,一般可做定性、定量分析、光的吸收量與偵測物物濃度之間的關係, 可用藍伯特-比爾定律(Lambert-Beer Law)表示,如下式 :
A= log (Io/I)=εbc
其中A 為吸收度,I0為入射光強度,I 為透射光(transmitted light)強度,ε
為吸收光係數(extinction coefficient),b 為光路徑長度(light path),通常以 cm 為單位,c 為待測物的莫耳濃度(molar concentration)。待測物的吸光係數 ε 在特定波長時為定值,因此根據藍伯特-比爾定律,可由吸收強度 A 推測待 測物的濃度。
3-3-4 X 射線光電子能譜儀(X-ray Photoelectron Spectrometer,XPS)
其原理為一束 X 光射線打到樣品上,藉由光電效應將某一能階的電子 激發出來成為光電子,然後再分析這些光電子的能量,可以獲得關於表面 元素組成以及元素的化學環境。當數個原子鍵結成一化合物時,其在化合 物中的結合能明顯與純原子時不同,其內核層電子的束縛能也會有不同的 變化,及一般的化學位移(Chemical Shift) ,分析束縛能的變化,便可獲得 材料中的電子結構與化學鍵結的訊息。其所造成的能譜位移可用來區來不 同氧化態之元素。偵測深度約為5nm(除氫元素外皆可偵測) 。
3-3-5 太陽光模擬器(Solar Simulator AM 1.5) 太陽的能量是來自太陽內部中心(溫度約1500~2000萬K),此處充滿著 高速運動的原子核和自由電子,當高速的原子核互相碰撞時,它們產生融 合反應而釋放出極大的能量產生高溫。但這並非太陽表面的黑體(black body)輻射溫度,因為大部分的電磁輻射會被太陽表面的氫原子層再吸收, 所以太陽的表面溫度會比內部溫度低許多,大約在6000 K 左右。圖(3-2-5) 為太陽光譜圖,其中包括6000K 黑體輻射光譜,以及AM 0、AM 1.5 太陽 光譜[30]。 圖(3-2-5) 太陽光譜圖(solar spectrum)。AM1.5G:單位入射強度定義為
首先必須介紹空氣質量(air mass,AM)的意義,當太陽光入射到地表 時,會受到大氣層中空氣分子和塵埃的散射,以及氣體分子的吸收,所以 太陽光會隨著在大氣層中行經路徑之長短而有不同的衰減。
空氣質量(air mass,AM)定義為:
Air Mass = 1/cosθ
其中θ為入射太陽光和垂直地表的法線之夾角,如圖(3-2-6)所示。簡單的 說,空氣質量可定義為:太陽光入射到海平面在大氣層經過的距離,與垂 直入射至海平面在大氣層所經過的距離之比值。 對於太空中使用的太陽能電池,我們常使用AM 0的照光條件進行測 試,以模擬在外太空使用的狀況,而在地表使用的太陽能電池,則多用AM 1.5(入射角θ=48.19o)的照光條件。
第四章 結果與討論
4-1 陽極化結果與分析
圖(4-1-1)為電化學拋光完後的鈦片表面,從 EDS 的元素分析表(4-1)可 以知道此時的鈦片表面已經有一層平坦且緻密的氧化鈦了,而且因為拋光 液中成分的關係也使得內部含有一些碳的成分。 圖(4-1-1) 鈦片拋光圖 表(4-1) 拋光鈦片 EDS 元素分析Element Weight% Atomic%
C K 0.85 2.28 O K 23.6 47.22 TiK 75.55 50.50 我們固定電壓 20V,電解液使用 5%的 DI water + 0.55wt%的 NH4F + 95%的 Formamide,溫度控制在 20℃,我們可以從 SEM 影像圖(4-1-2)觀察 到隨著陽極化時間增加,鈦片表面開始產生奈米孔洞的變化,可以發現在
20 分鐘後才有明顯的奈米管陣列出現。
(a) (b)
(c) (d)
(e) (f)
當陽極化時間持續增加,奈米管表面其實並不會有太大變化而只是會 增加二氧化鈦奈米管之長度,如圖(4-1-3)。除此之外我們也針對陽極化電 壓對奈米管孔洞半徑以及管璧厚度做一系列的測試與紀錄。測試時我們使 用固定的電解液為5%的 DI water + 0.55wt%的 NH4F + 95%的 formamide, 溫度控制在 20℃,從圖(4-1-4)可以明顯發現當電壓伏特數加大時,孔洞半 徑會隨著增大但是管璧厚度卻沒有特別明顯的影響[31]。
Anodization Time (min)
0 100 200 300 400 500 600 Tube Le ngt h (um ) 2 4 6 8 10 12 14 圖(4-1-3) 陽極氧化時間對奈米管造成的變化
Anodization Potential (V)
15 20 25 30 35 40 45
A
v
erage Tube Diamet
er and wall t h ickness (nm) 0 20 40 60 80 100 120 inner diamater (nm) thickness (nm) (a) (b) 圖(4-1-4) 電壓對(a)奈米管孔洞半徑(b)管璧厚度造成的變化 再來我們將製作完成後的二氧化鈦奈米管做XPS資料分析,圖(4-1-5) 為C1s的XPS圖,我們將它積分後可以發現有兩根peak,我們從XPS database[33]先列出幾根peaks,C-C(285.3eV)、C-O(286.5eV)、 C-O-O(289eV)、C-Ti(281.9eV) ,再對照我們的XPS圖可發現peak1是 graphitized carbon(C-C),peak2應為doped carbon(C-O),相對含量比例接近 2:1,而在281ev的位置卻無C-Ti的peak出現。
N1s的XPS資料,在文獻上可在396eV這個峰為原子β-N state之鍵結和 400eV,405eV為末端鍵結(terminally bonded) γ-N2 state[34,45]。圖(4-1-6)為
292 290 288 286 284 282 280 0 500 1000 1500 2000 Background Fit Pk2=286.1 60.4% Pk1=285.4 39.6% Count s
Binding Energy (eV)
圖(4-1-5) C1s XPS 圖 Pk1 是 graphitized carbon,Pk2 是 doped carbon
408 406 404 402 400 398 396 394 680 700 720 740 760 780 800 820 840 860 880 Count s
Binding Energy (eV)
除了 XPS 的數據證明利用 formamide 所製作出的二氧化鈦奈米管具有
共摻雜碳和氮元素外,我們也利用了 EDS 來證明具有共摻雜,如圖(4-1-7)
所示,表(4-2)則為利用 5keV 之電壓能量來做 EDS 掃描結果。
表(4-2) 碳氮摻雜之二氧化鈦奈米管 EDS 元素分析
Element Weight% Atomic%
C K 6.09 7.76
N K 18.11 19.77
O K 75.80 72.74
4-2 光催化分解甲基紅染料結果
將陽極處理好的二氧化鈦奈米管柱(0.55wt% NH4F,5% H2O,95% formamide,20V)來分解甲基紅溶液,比較不同管柱長度對於分解效果的好 壞,圖(4-2-1)為比較圖,分別使用陽極處理時間為 20min,40min,60min 和 120min 的二氧化鈦奈米管來進行光催化分解反應,C0為甲基紅初始濃 度,C 為反應一段時間後的濃度,可以發現當管柱從 20min 增長至 60min 時,光分解的效果隨管柱增長而提昇,且在60min 時有最好的光催化分解 效果,我們推論當管長增加時,管柱的表面積增加,可以吸附更多的甲基 紅染料分子,有利於光的捕捉,產生電子並加以降解,因此光催化效果增 加[36],但當成長管柱時間到 120min 則分解效果降低,但仍比過短的奈米 管柱好。 Decomposition time (h) 0 2 4 6 8 log 10 C/ C0 (Met hy l Red ) 0.1 1 20 min 40 min 60 min 120 min 圖(4-2-1) 以 0.55wt% NH4F 之 95% formamide,20V,改變陽極處理時間 20~120 min,光催化分解甲基紅除了比較奈米管柱長短對於光催化分解的效果之外,我們也比較只摻 雜碳元素或是沒有摻雜的二氧化鈦奈米管,對於光催化分解的好壞,結果 如圖(4-2-2)。 Decomposition time (h) 0 2 4 6 8 log 10 C/ C 0 (Met hyl Red) 0.1 1 C,N dope nanotube C dope nanotube TiO2 nanotube 圖(4-2-2) 摻雜之二氧化鈦奈米管與未摻雜之奈米管比較 從圖(4-2-2)中可以看出,當二氧化鈦奈米管柱不含任何摻雜時(以 0.14M NaF/0.5M H3PO4陽極處理製成),對於光催化的效果最差,而只摻雜 碳元素的奈米管(以 90% ethylene glycol 之溶液陽極處理製成[35])為次之, 同時共摻雜碳和氮的二氧化鈦奈米管(95% formamide)有最好的光催化分解 效果。從此可推論,有摻雜的二氧化鈦會有比較好的光催化效果,是因為 這些摻雜的元素,會使二氧化鈦的能隙變小,更利於電子的傳遞。
4-3 水裂解效率結果
本實驗所做的水裂解效率實驗主要是參考 Misra 的論文[5], The photoconversion efficiency (
η
) of the photoanodeη (%) = [ (total power output − electrical power input) / light power input ] × 100= Jp [ E0rev − Eapp ) / I0 ] × 100
Jp = photocurrent density (mA/cm2)
JpE0rev = total power output JpEapp = electrical power input
I0 = power density of incident light (mW/cm2)
η (%) = Jp [E0rev − Eapp ) / I0 ] × 100 E0rev = 1.23 VNHE, standard rev. potential Eapp = Emeas − Eaoc
Emeas = electrode potential ( vs Ag/AgCl) of the working electrode Eaoc = electrode potential ( vs Ag/AgCl) of the working electrode at open circuit condition 而在水裂解實驗中,因為實際上全光譜光源的水分解效率仍然偏低,所以 我們分為 UV 區與 Vis 區來量測,UV 區是大家已知二氧化鈦本來就會吸收 的區域,而Vis 區是因為要測試摻雜碳氮的二氧化鈦是否真的會紅位移至 可見光區以增加我們水分解效率,圖(4-3-1)為我們選擇的 UV (330nm ± 70) 與Vis (520nm ± 46) filter 的穿透率,本實驗的光源為 1000W 的 Xe 燈,在
Wavelength(nm) 100 200 300 400 500 600 700 800 900 T% -20 0 20 40 60 80 100 UV filter Wavelength(nm) 100 200 300 400 500 600 700 800 900 T% -20 0 20 40 60 80 100 VIS filter 圖(4-3-1) UV 與 VIS filter 波長穿透率圖
當有了一些基本資料後,我們先比較當二氧化鈦奈米管有摻雜跟沒有 摻雜時效率的關係圖,攙雜的二氧化碳奈米管電解液主要為Formamide, 不含碳的主要為 H3PO4,實驗溫度控制在 20℃,時間為 20min,實驗完成 後以去離子水沖洗並退火3 小時,從圖(4-3-2)可以知道摻雜碳、氮的二氧 化鈦奈米管在分解水系統中UV 區效率大於不摻雜任何元素的,摻雜的奈 米管效率變高可知道是因為這些摻雜的元素與二氧化鈦晶格會產生一些鍵 結,使得二氧化鈦本身之能階變的更小,讓電子更容易傳遞出去,這邊的 結果可以與光催化分解反應的結果如圖(4-2-2)互相對照,具有相同的趨勢。
Applied Potential V(Ag/AgCl)
-1.0 -0.8 -0.6 -0.4 -0.2 0.0 0.2 0.4 0.6 P hot ocurrent Densit y (mA /c m 2 ) 0 1 2 3 4 C,N nanotube-UV TiO2 nanotubes-UV C,N nanotube-Vis TiO2 nanotube-Vis 圖(4-3-2) 含碳氮(formamide)與不含碳(H3PO4)的二氧化鈦奈米管光解水在 UV 區之效率比較圖
當知道含碳、氮摻雜之二氧化鈦奈米管的確對水分解效率有幫助後, 我們便測試不同溫度鍛燒的奈米管效率,希望可以比較不同晶形的二氧化 鈦與摻雜元素鍵結反應後是否會有更好的效率。所以我們便將電壓控制在 20V,電解液主體一樣為 Formamide,實驗溫度控制在 20℃,實驗完成以 去離子水沖洗後退火3 小時,從圖(4-3-3)可以發現,不管實驗長度多久的 UV 區效率遠遠高於 VIS 區,不同溫度鍛燒的 VIS 區,效率幾乎集中在 0.1~0.4%,而在 UV 區就可以明顯看出退火 500oC 效率比較高,從圖(4-3-4) 的 XRD 圖可以知道二氧化鈦在不同退火溫度時的晶格變化, 500℃時 Anatase 晶格相當明顯效率也扮隨著增加,之後隨著溫度再升高 Rutile 的晶 格也慢慢增加,可以發現當二氧化鈦結構有較多 Anatase 時,效率是會比 Rutile 好許多,另外可以從圖(4-3-3)得知長成二氧化鈦奈米管的時間在超過 20 分鐘後普遍效率都是下降的,且當奈米管成長時間只有 15 分鐘時,鈦 片上的二氧化鈦為孔洞狀,奈米管尚未形成,此時測得的效率也是降低。 我們知道反應時間越長奈米管長度也越長,一般半導體在水分解系統中會 吸收低於能階波長的光進而產生電子電洞對,電洞會被擴散到近奈米管表 面跟水反應,而這擴散的距離是很小的(在二氧化鈦中不超過 200nm) [37,38,39],所以可以說光子幾乎都是在接近表面附近就被吸收了,我們可 以推論為奈米管越長在水分解系統中反而會增加電子電洞對重新結合的機 會,且從水分解原理可以得知我們並不需要像敏化染料太陽能電池一樣需
要大表面積來吸附染料,所以我們並不需要做太長的二氧化鈦奈米管,因
此我們可以說水分解實驗中最適合的反應時間為20 分鐘。
Anodization time (min)
10 20 30 40 50 60 70 P hotoconversio n eff ie ncy 0 5 10 15 20 25 FA-4750C FA-5000C FA-5500C FA-5750C FA-6000C (a)
Anodization time (min)
10 20 30 40 50 60 70 Photoc onvers ion Effienc y (%) 0.0 0.1 0.2 0.3 0.4 FA-4750C FA-5000C FA-5500C FA-5750C FA-6000C (b) 圖(4-3-3) 1M KOH 不同溫度奈米管光解水效率圖(a)UV 區(320±70nm)效率 (b)Vis 區 (520±30nm) 效率
20
25
30
35
40
45
50
55
60
2θ
A R
600oC 575oC 550oC 500oC 圖(4-3-4) 不同退火溫度二氧化鈦晶格 XRD 圖除此之外,我們還改變了陽極處理時施加的電壓,圖(4-3-5),分別為 15V、20V、30V 和 35V,可以看到當我們在 20V 時有著較佳的光電流,當 施加電壓越大時(30V,35V),在奈米管與鈦片中間的氧化層會越厚,造成 電阻上升,故而影響到光電流,進而影響到效率,而施加電壓為 15V 時, 生成的二氧化鈦表面為孔洞狀,使得分解水的效率大為降低,這和尚未形 成奈米管柱的結果一致,孔洞狀的二氧化鈦效率皆比奈米管狀低。
Applied Voltage V (Ag/AgCl)
-1.0 -0.8 -0.6 -0.4 -0.2 0.0 0.2 0.4 0.6 P h ot ocur rent Densit y (mA/ cm 2 ) 0.0 0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6 1.8 2.0 20V 30V 35V 15V (a) (b) (c) (d) 圖(4-3-5) 水裂解在 UV/Vis 光區的 IV 圖(a)20V(b)30V(c)35V(d)15V
從圖(4-3-3)可知在水分解中有最好效率的退火溫度為 500℃,奈米管生 成時間為 20 分鐘,陽極氧化處理施加的電壓為 20V,而這些測試所使用的 電解液全都是 1M 的 KOH,所以最後我們改變新的電解液看看是否會有更 高的效率。而我們測試的電解液分別為(1)1M 的 KOH、(2) 0.2M Na2SO4 (3) 0.24M Na2S.XH2O + 0.35MNa2SO3及(4) 1M KCl。圖(4-3-6)中可以發現當使 用 1M 的 KOH 當電解液效率會優於其他三種,合理推論為 1M KOH pH 值 為 12.6,電解液中離子性較強使得反應較好。 Different electrolytes 0 1 2 3 4 5 Photocurr ent effic ienc y 0 2 4 6 8 10 12 UV VIS 圖(4-3-6) 使用陽極氧化處理1h的20V,95% formamide二氧化鈦奈米管在不 同電解液下的水分解效率圖
從以上的實驗結果與Misra之實驗結果比較,Misra的結果是在紫外光 區效率為13.3%,可見光區效率為8.5%。我們測試的紫外光區效率則為 21%,可見光區效率為0.38%左右,相較起來可見光區的效率低於Misra的 結果很多,這與原本為了要提高可見光之光電轉換效率的初衷相違背,因 此我們尋找了相關的文獻資料。Murphy[40]團隊也對Misra的可見光區結果 有所質疑,認為應該要多加一些實驗的結果如IPCE,來對於原本的公式做 修正。此外Misra在往後發表的期刊中[41,42],也未再提出在這些摻雜碳的 二氧化鈦奈米管可以在水分解可見光區有如此高的效率。 我們測得二氧化鈦奈米管的IPCE,結果如圖(4-3-7)。在紫外光區的 IPCE有共摻雜碳氮的效率的確會比未摻雜還來的高,且相較於只有摻雜碳 的奈米管,碳氮共摻雜之奈米管略為紅位移,但是皆在400nm之後光電轉 換效率幾乎為零因此我們可以推論,這就是使水分解在可見光區效率很低 的原因。除此之外,在反射式吸收光譜中,如圖(4-3-8)也可以證實在400nm 時吸收度大幅下降,雖然在大約400nm有一個突起的小峰,會稍微提升可 見光吸收,但整體來說,吸收度下降很多,這也是說明了在可見光區即使 是有摻雜的二氧化鈦,對於水分解效率的提升也是很有限的。
Wavelength (nm) 200 300 400 500 600 700 800 IP C E (%) -5 0 5 10 15 20 25 30 35 C,N doping nanotube TiO2 nanotube C doping nanotube 圖(4-3-7) 二氧化鈦奈米管 IPCE 效率圖 Wavelength (nm) 200 400 600 800 Absorption (a.u.) 0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6 1.8 2.0 C,N doping nanotube TiO2 nanotube C doping nanotube
4-4 染料敏化太陽能電池
此外我們也利用共攙雜碳、氮的二氧化碳奈米管(0.55wt% NH4F,95% Formamide)吸附 N3 染料後測量光電轉換效率,測量的是以陽極氧化法長 成之二氧化鈦奈米管時間為 1 到 5 小時,以及長時間 24 小時。結果如圖 (4-4-1)為不同陽極處理時間的二氧化鈦奈米管再吸附 N3 dye 12 小時後的 I-V 曲線圖,電壓都維持在 0.6 到 0.8V 之間,當奈米管柱加長,效率也隨 著提升,在 5 小時可達 4%左右,我們試著加長了陽極氧化處理時間至 24 小時,期望可以得到更長的奈米管柱,以吸附更多的染料分子,然而結果 發現效率提高不多,經由SEM 得知因為二氧化鈦奈米管的長度過長但是強 度不夠導致管柱的斷裂,使得表面會形成一些氧化物堆積造成電子傳導不 佳。表(4-3) 摻雜碳氮之 TiO2 nanotube/N3 dye 其光伏參數列表
Time(hr)* 1h 2h 3h 4h 5h 24h
Jsc(mA/ cm2) 5.32 7.70 9.37 10.9 12.1 13.4
Voc(volt) 0.712 0.69 0.688 0.691 0.654 0.6
η(%) 1.93 2.75 3.60 4.23 4.31 4.41
Voltage (V) 0.0 0.2 0.4 0.6 0.8 1.0 I(mA/c m 2 ) 0 2 4 6 8 10 12 14 1h 2h 3h 4h 5h 24h
圖(4-4-1) 摻雜碳氮之 TiO2 nanotube/N3 dye I-V 曲線圖
*Time: 二氧化鈦奈米管的實驗時間
接著我們試著在浸泡染料之前先將二氧化鈦奈米管浸泡於 TiCl4的溶
液裡,從圖(4-4-2)可以得知浸泡 TiCl4溶液對效率的確有明顯的效率增加,
主要是因為在退火時附著在奈米管表面的 TiCl4會氧化變成小顆粒的TiO2
粒子,如此一來會增加染料吸附的表面積,因此效率就提高了。
表(4-4) 泡 TiCl4後的摻雜碳氮之TiO2 nanotube/N3 dye 其光伏參數列表
Time(hr)* 1h 2h 3h 4h 5h 24h
Jsc(mA/ cm2) 5.6 8.10 9.76 11.2 12.6 13.4
Voc(volt) 0.742 0.711 0.724 0.72 0.674 0.67
η(%) 2.12 2.98 3.83 4.53 4.62 4.83
Voltage (V) 0.0 0.2 0.4 0.6 0.8 I (m A/cm 2 ) 0 2 4 6 8 10 12 14 1h 2h 3h 4h 5h 24h
圖(4-4-2) 泡 TiCl4後的摻雜碳氮之TiO2 nanotube/N3 dye I-V 曲線圖
*Time: 二氧化鈦奈米管的實驗時間
使用陽極處理4小時(0.55wt% NH4F,95% Formamide)之奈米管並利用
電漿增強式-化學氣相沈積法Plasma Enhance Chemical Vapor Deposition
(PECVD)來成長氮化銦(InN)奈米粒子來修飾TiO2奈米管表面,可以發現
NT/InN/Dye相較於只有NT/Dye的開路電壓和短路電流增加了,圖(4-4-3)為 實驗的結果。我們由圖(4-4-4)的反射式吸收光譜可以看出InN奈米粒子能夠 增加在可見光範圍的吸收,因此也稍微提高了二氧化鈦奈米管的效率。
表(4-5)陽極氧化 4 小時之 TiO2 nanotube/N3 dye/InN 其光伏參數列表
不同修飾 NT/InN NT/Dye NT/InN/Dye
Jsc(mA/ cm2) 0.0253 12.4 14.0 Voc(volt) 0.158 6.56 6.64 η(%) 0.0015 4.37 4.90 Voltage (V) 0.0 0.2 0.4 0.6 0.8 I( mA/c m 2 ) 0 2 4 6 8 10 12 14 Dye/NT InN/NT Dye/InN/NT
Wavelength (nm) 200 400 600 800 Abs orp tion (a.u.) 0.4 0.6 0.8 1.0 1.2 1.4 1.6 1.8 NT NT/InN NT/InN/Dye NT/Dye 圖(4-4-4) 修飾之二氧化鈦奈米管反射式吸收光譜圖
我們利用 EDS 來得知經過 InN 奈米粒子修飾過的 TiO2表面含量的分
布,表(4-6)為使用 5keV 電壓掃描表面 InN 奈米粒子修飾 TiO2之元素分析
表。圖(4-4-5)為成長 InN 粒子覆蓋於 TiO2表面圖,可看見 InN 奈米粒子附
著於二氧化鈦奈米管口上,而非填入奈米管內,因此只能稍微提升效率, 在應用於奈米管上的效果並不明顯。
表(4-6) InN奈米粒子修飾TiO2元素分析表
Element Weight% *Atomic%
C K 1.45 4.28 N K 0.10 0.26 O K 18.77 42.72 Ti K 67.15 49.85 In L 12.54 3.88 *此為PECVD短時間成長InN奈米粒子,因為N和Ti的peak位置接近,不易 測出N的確實數據,表(4-7)為PECVD長時間成長InN奈米粒子EDS元素分析 表,可看出N與In比例較為接近。
表(4-7) 長時間成長InN奈米粒子修飾TiO2元素分析
Element Weight% *Atomic%
C K 2.79 3.90
N K 7.75 30.27
O K 6.54 22.36
Ti K 5.96 6.81
第五章 結論
在許多生成二氧化鈦奈米管的方法中,以陽極氧化法為最方便簡單, 只要找出電解液的最佳成分比例確定後,控制我們實驗的施加電壓、陽極 反應溫度及陽極處理時間便可調整我們所需要的物理特性,如奈米管半 徑、管璧厚度、管子長度,相較於其他製程為簡單,但是由於電解液的成 分需控制得宜才能成長出好的二氧化鈦奈米管,這也造成了一個缺點就是 在同一種電解液裡無法改變奈米管之摻雜元素比例,因此如果要比較不同 含量的摻雜元素則必須要改變另外的電解液才行。 而摻雜碳氮元素的二氧化鈦奈米管的確在紫外光區會有很明顯的效率 增加,但是對可見光區還是沒有幫助,從IPCE 與反射式吸收圖譜可以看 到雖然含碳的二氧化鈦奈米管的確會有紅位移,但是在 400nm 之後就幾乎 為零了,因此造成在提升可見光區的效率並不明顯。 由 PECVD 成長之 InN 用來修飾二氧化鈦奈米管,就整個實驗而言效 率雖然有增加但是 InN 的影響目前似乎還沒有很明顯,NT/InN 的效率並不 如NT/Dye,這可能由於 InN 可能與二氧化鈦奈米管沒有產生很好的鍵結, 但若NT/Dye 有 InN 的修飾,在吸收光譜則可看出吸收度增加,因此效率 也會提高。參考文獻
[1] http://usinfo.org/zhtw/E-JOURNAL/EJ_Energy/abraham.htm
[2] A.L. Linsebigler, G. Lu, J.T. Yate. Jr., Chem. Rev. 1995, 95,735-758. [3] A. Fujishima, K. Honda, Nature 1972, 238, 37-38.
[4] A. J Bard, Science 1980, 207, 139-144.
[5] S. K. Mohapatra, M. Misra, V. K. Magajan, K. S. Raja. J. Phys. Chem. C
2007,111, 8677-8685.
[6] Macak, J. M.; Tsuchiya, H.; Ghicov, A.; Schmuki, P. Electrochem. Commun.
2005, 7, 1133-1137.
[7] R. P.Vitiello, J. M. Macak, A. Ghicov, H. Tsuchiya, L. F. P.Dick, P. Schmuki, Electrochem. Commun. 2006, 8, 544-548.
[8] S. Iijima. Nature, 1991, 354, 56.
[9] R. Tenne, L. Margulis, M. Genut and G. Hodes. Nature,1992, 360 444. [10] M. Remskar. “Inorganic nanotubes.” Adv.Mater. 2004, 16, 1497.
[11] M. Adachi, Y. Murata, M. Harada M, S. Yoshikawa. Chem. Lett. 2000, 942. [12] T. Kasuga, M. Hiramatsu, A. Hoson, T. Sekino and K. Niihara. Langmuir,
1998, 14, 3160.
[13] J. M. Macak, H. Tsuchiya, A. Ghicov, K. Yasuda, R. Hahn, S. Bauer, P. Schmuki, Current Opinion in Solid State and Materials Science, 2007, 11, 3-18. [14] Jinliang Tao, New J. Chem. 2008, 32, 2164-2168.
[15] G.K. Mor, O.K. Varghese J. Mater. Res. 2003, 18, 2588-2593. [16] M. Grätzel, Nature, 2001, 414,338-344.
[17] A.L. Linsebigler, G. Lu, J.T. Yates, Jr. Chem. Rev. 1995, 95, 735-758. [18] D.F. Ollis, E. Pelizzetti, N. Serpone, Environ. Sci. Technol. 1991, 25, 1522-1529.
[19] 張立群譯,光清淨革命-活躍的二氧化鈦光觸媒,協志工業叢書印行, 台北(2000).
[20] J. Nowotny, C.C. Sorrell, T. Bak, L.R. Sheppard, Solar Energy, 2005, 78, 593-602.
Journal of Power Sources, 2006, 161,1450-1457
[23] A. Hagfeldt, M. Grätzel, Chem. Rev. 1995, 95, 49–68.
[24] K. Kalyanasundaram, M. Grätzel, Coord. Chem. Rev. 1998, 177, 347–414.
[25] M. Grätzel, Current Opinion in Colloid and Interface Science
1999, 4, 314–321.
[26] Cahen et al., J.Phys.Chem. B 2000, 104, 2053–2059.
[27[ A. Fujishima et al., Sol. Energy Mater. Sol. Cells 2004, 81, 197–203. [28] K. Shankar, G.K. Mor, A. Fitzgerald, C.A. Grimes., J. Phys. Chem. C,
2007, 111, 21-26
[29] S.K. Mohapatra, M. Misra, V.K. Mahajan, K.S. Raja, Journal of Catalysis,
2007, 246, 362-369
[30] http://rredc.nrel.gov/solar/
[31] Q. Cai, M. Palose, J. Mater. , 2005, 20, 230
[32] S.K. Mohapatra, N. Kondamudi, S. Banerjee, M. Misra., Langmuir, 2008,
24, 11276-11281
[33] G. K. Mor, Oomman K., Solar Energy Material
&
Solar Cells, 90, 2006,2011~2075
[34] R. Asahi, T. Morikawa, T. Ohwaki, K. Aoki, Y. Taga., Science, 2001, 293, 269-271
[35] Z. Liu, B. Pesic, K.S. Raja, R.R. Rangaraju, M. Misra. International
Journal of Hydrogen Energy, 2009, 34, 3250-3257
[36] Z. Liu, X. Zhang, S. Nishimoto, M. Jin, D.A. Tryk, T. Murakami, A. Fujishima., J. Phys. Chem. C 2008, 112, 253-259
[37] A. B. Murphy, Hydrogen Energy, 2006, 31, 1999
[38] M. F. Weber, M.J. Dignam, J. Electrochem Soc. , 1984, 131, 1258~1265 [39] J. R. Bolton, S.J. Strickler, J.S. Connolly, Nature, 1985, 316, 495~500 [40] A. B. Murphy, Solar Energy Materials
&
Solar Cells, 2008, 92, 363~367[41] V. Mahajan, S. Mohapatra, M. Misra. International Journal of Hydrogen
Energy 2008, 33, 5369
[42] R. Sharma, P. Das, M. Misra, V. Mahajan, J. Bock, S. Trigwell, A. Biris, M. Mazumder, Nanotechnology 2009, 20, 075704.
[43] 呂志偉,敏化InN/TiO2太陽能電池材料之研究博士論文