國 立 交 通 大 學
材 料 科 學 與 工 程 學 系
碩 士 論 文
氮化鈦的鋁化反應與氧化行為
Aluminization and Oxidation Behavior of Titanium Nitride
研 究 生:顏永達
指導教授:林健正 博士
氮化鈦的鋁化反應與氧化行為
Aluminization and Oxidation Behavior of Titanium Nitride
研 究 生:顏永達 Student : Young-Da Yen 指導教授:林健正 教授 Advisor:Chien-Cheng Lin
國 立 交 通 大 學 材料科學與工程學系
碩 士 論 文
A Thesis
Submitted to Department of Material Science and Engineering College of Engineering
National Chiao Tung University in partial Fulfillment of the Requirements
for the Degree of Master in Material Science and Engineering
July 2009
Hsinchu, Taiwan, Republic of China
I
氮化鈦的鋁化反應與氧化行為
研究生 : 顏永達 指導教授 : 林健正 國立交通大學材料科學與工程研究所
摘要
氮化鈦(Titanium Nitride, TiN)在 1atm 氬氣(Ar) 保護氣氛下,利用 粉末擴散法(pack cementation method)進行 850~1150℃持溫 10 hr 之 鋁化反應,利用X 光繞射(x-ray diffraction, XRD) 與掃描式電子顯微 鏡 (scanning electron microscopy/energy dispersive spectroscopy,
SEM/EDS),分析反應後之顯微結構。TiN 在 850 oC/10hr 之鋁化反應
後,鋁化層內的生成物為TiAl3 (tetragonal)與 AlN(hexagonal)。然而,
TiN 在 1150 oC/10hr 之鋁化反應後,鋁化層內的生成物多了 TiN (cubic)。接著將鋁化後之試片暴露在 1000 oC 的空氣中進行長時間(250 hrs)的氧化實驗,經過氧化反應後,發現經 850 oC/10 hr 鋁化處理之試 片,其抗氧化性明顯較佳的主要原因是有較多的AlN,氧化時形成連 續的Al2O3保護層。相反地, 和經 1000 oC~1150 oC/10 hr 鋁化處理之 試片相較之下,其抗氧化性都較未經鋁化處理的TiN 更差,推測是因 為氧化行為受到鋁化層中的AlN 與 TiAl3之相對比例及分佈情況所影 響。TiAl3氧化形成TiO2/ Al2O3混合層並無法提供保護的效果;而少 量的AlN 氧化時也無法形成連續的 Al2O3層。
II
Aluminization and Oxidation Behavior of Titanium Nitride Student : Young-Da Yen Advisor : Chien-Cheng Lin
Department of Material Science and Engineering National Chiao Tung University
Abstract
In this work, the aluminization and oxidation reactions of Titanium Nitride (TiN) were investigated. TiN samples were annealed by using the pack cementation method at temperatures ranging from 850 to 1150℃ in argon atmosphere for 10hours. The microstructures of the reaction interface were characterized using x-ray diffraction (XRD) and scanning electron microscopy (SEM). Phases of AlN(hexagonal) and TiAl3 (tetragonal) were observed in the aluminized layer after reaction at 850℃ for 10hrs. However, Phase of TiN(cubic) was addationally formed in the aluminized layer after reaction at 1150℃ for 10hrs. After the optimum pack cementation treatment, the coated specimens were oxidized at 1000℃ up to 250 hrs in air. After oxidation, the TiN which was aluminization- treated at 850℃had batter oxidation resistance than the untreated TiN because of more AlN proportions relative to TiAl3 so as to form a continuous and dense Al2O3 protection layer. On the contrary, the TiN which was aluminized at 1000 or 1150℃ had poor oxidation resistance than the untreated TiN. On the one hand, this is because TiAl3 would be oxidized to form TiO2/ Al2O3 mixed layers without offering better oxidation resistance. On the other hand, less amount of AlN would not be able to form a continuous Al2O3 protection layer.
III 致謝 這本論文能夠完成,絕對不是靠一己之力就能達成,回首研究所的生 活,心中充滿了感動。首先要感謝的就是我的指導教授 林健正老師, 在我的研究過程中給予啟發與鼓勵,讓我能夠有獨立思考的精神與分 析判斷的能力,並指導我實驗的方向,糾正我的錯誤。 感謝實驗室的學長桓德、耀文、宏達與紳紘,在實驗技巧與觀念上釐 清幫忙,在此一併致謝。還有實驗室的同學仲民,學弟淵愈與然翔, 陪我度過忙碌且充實的研究生涯。 最後,僅將本論文獻給我的父母、家人與摯友,謝謝大家陪我渡過這 些充滿歡樂與汗水的日子。你們對我精神上的支持,是我一路上走來 也將是我未來的路上的最大原動力,在此致上最誠摯的感謝與祝福。
IV 目錄 中文摘要………...Ⅰ 英文摘要………...Ⅱ 致謝………..…Ⅲ 目錄………..Ⅳ 表目錄………..Ⅵ 圖目錄………...…...Ⅶ 第一章 前言………1 第二章 文獻回顧………4 2.1 鋁化原理與種類特性………..………4 2.2 氧化機制………..………9 2.3 二元平衡相圖………13 2.4 Ti-Al-N 三元平衡相圖………14 2.5 擴散反應之簡介………14 2.6 界面反應動力學………18 第三章 實驗步驟………..23 3.1 鋁化粉末之製備………….…………..……….23 3.2 氮化鈦的鋁化反應………...……….23 3.3 鋁化試片製備………24 3.4 氧化試驗………..………..24
V 3.5 X-射線繞射分析(XRD)………..25 3.6 掃瞄式電子顯微鏡(SEM)&能量散射分析儀(EDS)…………26 3.7 電子探針微區分析儀(EPMA)…….………..26 第四章 結果與討論………..27 4.1 鋁化前之 TiN 試片……….27 4.2 TiN 在 850 oC 下之鋁化反應……..……….27 4.3 TiN 在 1000 oC 下之鋁化反應…….………28 4.4 TiN 在 1150 oC 下之鋁化反應…….………30 4.5 鋁化反應機構………..……….…….32 4.6 氧化試驗………..………..37 4.7 氧化機制…………..………..43 第五章 結論………..46 參考文獻………..47
VI 表目錄 Table 1 Ti-Al 系統內各相之組成範圍、晶體結構及晶格常數…..……50 Table 2 Ti-N 系統內各相之組成範圍、晶體結構及晶格常數…..…….51 Table 3 Ti-Al-N 系統內各相之晶體結構及晶格常數………52 Table 4 TiN 的化學組成……….………..53 Table 5 鋁化粉末的化學組成…………...……….…………53 Table 6 鋁化實驗條件………54 Table 7 鋁化實驗條件………54 Table 8 氧化試驗條件………54
Table 9 TiN 在 850oC/10 hr 鋁化反應之 SEM/EDS 成份表………..…..55
Table 10 TiN 在 1000oC/10 hr 鋁化反應之 SEM/EDS 成份表…..……..55
VII
圖目錄
Fig. 2-1. Ti-Al 之二元平衡相圖…….……….56
Fig. 2-2. Ti-N 之二元平衡相圖……….………...56
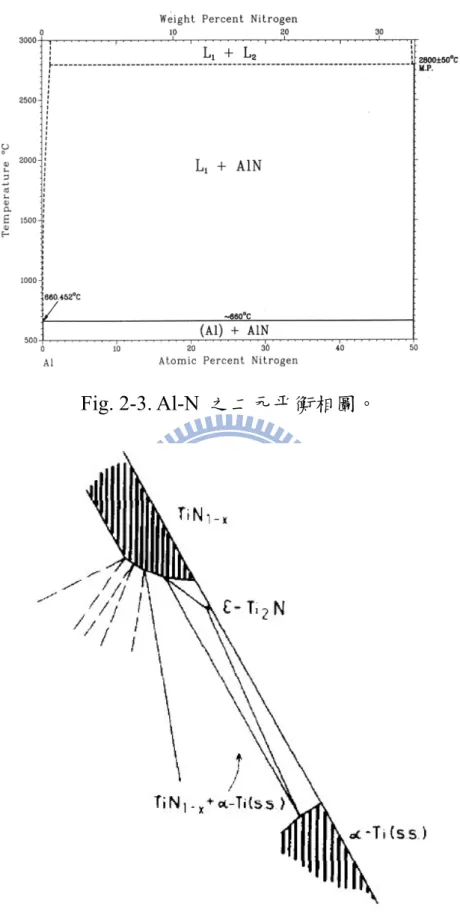
Fig. 2-3. Al-N 之二元平衡相圖………...57
Fig. 2-4. 1000℃ Ti-Al-N 三元平衡相圖在組成接近二元 Ti-N 系統的 相平衡圖示………..57 Fig. 2-5. Ti-Al-N 三元相圖在 1000℃時的等溫截面圖…….………….58 Fig. 2-6. Ti-Al-N 三元相圖在 1200℃時的等溫截面圖…….………….59 Fig. 2-7. Ti-Al-N 三元相圖在 1300℃時的等溫截面圖………..59 Fig. 2-8. 原子擴散機制圖……….………..60 Fig. 2-9. 定溫下 α、β 及 γ 相的自由能對組成之曲線圖……….61 Fig. 2-10. 由 A 與 B 所組成的擴散偶,再某一固定溫度下界面處會 呈現出層狀結構。圖中曲線代表界面中元素B 的組成變化。…….…..61 Fig. 2-11. Matano 界面之位置……….62 Fig. 2-12. 假想之擴散數據曲線……….………62 Fig. 3-1. 實驗流程圖……….………..63 Fig. 3-2. 鋁化試片製備流程圖……….………..64 Fig. 4-1. 反應前 TiN 的 XRD 繞射光譜圖………..………65
VIII
Fig. 4-3. TiN 在 850℃/10 hr 鋁化反應後之 XRD 繞射光譜圖…...……66 Fig. 4-4. (a)為 TiN 在 850℃/10 hr 鋁化反應後之微觀結構圖(BEI)(b)為 鋁化層局部放大圖(BEI)……….67 Fig. 4-5. (a)為 TiN 在 850℃/10 hr 鋁化反應腐蝕後之微觀結構圖 (BEI)(b)為鋁化層局部放大圖(SEI)………68 Fig. 4-6. TiN 在 1000℃/10 hr 鋁化反應後之 XRD 繞射光譜圖。……...69 Fig. 4-7. TiN 在 1000℃持溫不同時間鋁化反應後之微觀結構圖(BEI) (a)0.5 hr;(b)3 hr;(c)10 hr;(d)36 hr;(e)36 hr 局部放大圖。………..…..70 Fig. 4-8 TiN 在 1000℃持溫不同時間鋁化反應後的 Al 含量隨距離分佈
之結果。………..………..71
Fig. 4-9. TiN 在 1000℃持溫不同時間鋁化反應腐蝕後之微觀結構圖 (BEI)(a)0.5 hr;(b)3 hr;(c)10 hr;(d)36 hr;(e)為 10 hr 局部放大圖(SEI); (f)為 36hr 的局部放大圖(SEI)……….………72 Fig. 4-10. TiN 在 1150℃/10 hr 鋁化反應後之 XRD 繞射光譜圖。…….73 Fig. 4-11. (a)為 TiN 在 1150℃/10 hr 鋁化反應後之微觀結構圖;(b)為 鋁化層局部放大圖(BEI)。………..……….74 Fig. 4-12. (a)為 TiN 在 1150℃/10 hr 鋁化反應後之微觀結構圖(BEI); (b)為鋁化層局部放大圖(SEI) (試片經 Kroll reagent 腐蝕)。……...….75 Fig. 4-13. Ti-Al 二元介金屬化合物的生成能與溫度的關係。….……76
IX Fig. 4-14. TiN 在 850℃/10 hr 鋁化反應的示意圖。…………...……….77 Fig. 4-15. 在 Ti-Al-N 三元相圖表示 850℃/10 hr 鋁化反應之擴散路 徑。………..………..78 Fig. 4-16. TiN 在 1000℃/10 hr 鋁化反應的示意圖。………..…………79 Fig. 4-17. 在 Ti-Al-N 三元相圖表示 1000℃/10 hr 鋁化反應之擴散路 徑。………..………..80 Fig. 4-18. TiN 在 1150℃/10 hr 鋁化反應的示意圖。……...………81 Fig. 4-19. 在 Ti-Al-N 三元相圖表示 1150℃/10 hr 鋁化反應之擴散路 徑。……….………...82 Fig. 4-20. 各試片在 1000oC 氧化前的外觀(a)純氮化鈦;(b)850℃鋁 化;(c)1000℃鋁化;(d)1150℃鋁化。……….………..83 Fig. 4-21. 各試片在 1000oC 氧化 50 hr 後的外觀(a)純氮化鈦;(b)850℃ 鋁化;(c)1000℃鋁化;(d)1150℃鋁化。……….………..83 Fig. 4-22. 不同條件下經鋁化處理的 TiN 試片,在 1000℃氧化溫度 下,單位表面積重量改變與氧化時間關係曲線。………..84 Fig. 4-23. 不同條件下經鋁化處理的 TiN 試片,在 1000℃氧化溫度 下,單位表面積重量改變平方與氧化時間關係曲線。………..85 Fig. 4-24. 純 TiN 在 1000℃/50 hr 氧化前後之 XRD 繞射光譜圖。…...86 Fig. 4-25. 純 TiN 在 1000℃/50 hr 氧化實驗後之微觀結構圖(BEI)。....87
X Fig. 4-26. TiN 經 850℃鋁化的試片,在 1000℃/50 hr 氧化前後之 XRD 繞射光譜圖。………..………..88 Fig. 4-27. TiN 經 850℃鋁化處理的試片,在 1000℃/50 hr 氧化後之微 觀結構圖(BEI)。………..……….89 Fig. 4-28. TiN 經 1000℃鋁化處理的試片,在 1000℃/50 hr 氧化後之 XRD 繞射光譜圖。………..……….90 Fig. 4-29. TiN 經 1000℃鋁化處理的試片,在 1000℃/50 hr 氧化後之微 觀結構圖(BEI)。………..……….91 Fig. 4-30. TiN 經 1150℃鋁化處理的試片,在 1000℃/50 hr 氧化後之 XRD 繞射光譜圖。………..……….92 Fig. 4-31. TiN 經 1150℃鋁化處理的試片,在 1000℃/50 hr 氧化後之微 觀結構圖(BEI)。………..……….93 Fig. 4-32. TiN 經 850℃/10 hr 鋁化處理後之試片氧化反應示意圖。..94 Fig. 4-33. TiN 經 1000 和 1150℃/10 hr 鋁化處理後之試片氧化反應示 意圖。………95
1 第一章 前言 氮化鈦,此種過渡金屬氮化物均具備金屬的某些特徵,例如高熱傳導 率( 29.1 W/m•k )、高電導性(體電阻率 25 μΩ•cm),並具有金黃色光 澤,但相對於金屬而言,這些氮化物均有極高的硬度且呈現脆性,此 外,TiN 還擁有高熔點(~2960℃)、高硬度(Hv~25GPa)、低密度(理論 密度5.40mg/m3)、高抗腐蝕性、高熱穩定性、抗擴散能力強、化學穩 定 性 佳 、 以 及 具 有 跟 鐵 相 似 的 熱 膨 脹 係 數(α=9.35×10-6/K)等特性 [1,2]。因此是極佳的耐磨耗塗層材料,在不同切削條件下可延長刀具 壽命 3~10 倍左右。在半導體技術上,氮化鈦可作為擴散障礙層使 用,此障礙層主要是避免半導體與其表面的金屬化層間的化學反應。 許多研究報告[1,2,3]指出鋁化基材的表面,可提高其材料的抗腐蝕跟 抗氧化能力。 本實驗室過去已研究氮化鋁與鈦金屬在高溫熱處理(1000~1500oC)後 之界面微觀結構反應,其中TiN 是最先生成的反應層,當其生成後, Ti、Al 與 N 在 AlN/Ti 界面處所扮演的角色是如何、對後續反應層影 響如何是重要的,之後再根據氮化鈦之鋁化反應,並與Ti-Al-N 三元 相圖互相配合,進而建立起 Al 與 TiN 反應生成機制。經由實驗室建 立 Ti 與 AlN 接合的基礎文獻可將至應用層面擴大到微電子及半導體
2 之接合應用以及切削刀具塗層上。 以往關於鋁化的相關研究上,大多著重在超合金或是鋼鐵材料上,但 對於陶瓷材料方面的鋁化卻甚少探討,假如我們能了解氮化鈦鋁化中 生成相間的相互關係及鋁化溫度對鋁化反應層之影響,經由掃瞄式電 子顯微鏡(SEM/EDS)、電子微探分析儀(EPMA)及X-射線繞射儀(XRD) 分析界面反應的微觀結構與反應機制,便可對陶瓷材料的鋁化反應機 制有進一步的了解。 此外,一般在預防高溫氧化或熱腐蝕的方法,就是在材料表面上先形 成連續的氧化層,以保護其內部結構;最常見的氧化層有氧化鉻、氧 化鋁或氧化矽之保護膜。通常溫度在 1000oC 以下使用的抗氧化層是 氧化鉻,但是當所使用的環境溫度達到 1000oC 以上時,氧化鉻的蒸 氣壓太高已經不太適用。氧化鋁及氧化矽相對較氧化鉻穩定,所以當 環境的溫度低於1400 oC 時,通常會用選擇氧化鋁來擔任抗高溫氧化 之保護層的角色,如渦輪葉片則是常見之應用。若環境溫度高達 1500oC 以上時,最佳的保護膜就是氧化矽,廣泛應用在高熔點的金 屬,如鉬、鎢等之保護膜上。同樣地,倘若我們能了解經鋁化處理之 氮化鈦氧化後生成相間的相互關係及鋁化溫度對氧化行為之影響,藉 由掃瞄式電子顯微鏡(SEM/EDS)、電子微探分析儀(EPMA)及 X-射線
3
繞射儀(XRD)之分析,研究在 1000 oC 的氧化反應之微觀結構與反應
機制,期望藉由本實驗的結果,除了對陶瓷鋁/氧化有進一步的認識 外,對於往後鋁化的應用能更加多元化。
4
第二章 文獻回顧
2.1鋁化原理與種類特性
Mevrel et al. [2] 製 作 塗 層 有 很 多 方 法 , 其 中 粉 末 擴 散 法 (pack cementation method)是一個相當方便又簡單的技術,類似化學氣相沈 積(CVD),將試片埋入粉末中並放入密閉容器裡,將此容器放入高溫 爐管中,在有保護氣氛下加熱到適當溫度使塗層形成。 粉末中包含塗層原料、活化劑(通常是鹵化物)、惰性填料(通常是 Al2O3),在鋁化製程中,塗層原料是鋁粉或者是鋁合金粉,取決於粉 末中需要的鋁活性多寡而定。塗層元素傳輸的驅動力是基材表面跟鍍 層元素的活性差異,使得塗層元素往內部擴散。活化劑在高溫與鋁粉 反應形成鹵化鋁(aluminium halides)[3]
2Al(s) + AlF3 → 3AlF(g) Al(s) + 2AlF3(s) → 3AlF2(g)
AlF3(s) → AlF3(g) 2AlF3(s) → Al2F6(g)
當粉末中鋁的活性高於基材表面,鹵化鋁(AlF、AlF2、AlF3、Al2F6) 朝基材表面傳輸,在表面形成塗層,當鹵化鋁與基材反應,釋出鋁原 子,伴隨著鋁化物的生成,因此又降低了基材表面鋁的活性,使反應
5 繼續進行。 此外,粉末擴散法有許多好處[2]: (1)製程容易進行,對於相同的基材,以相同的參數(溫度、時間、粉 末組成等),便可得到相同的披覆層,而且可調整控制參數以得到不 同的披覆層成分及厚度。 (2)試片形狀不受限制,對於外型複雜的基材,可在表面形成一均勻的 披覆層。對於孔洞或凹陷處,只要將粉末填入充滿其中,亦可形成披 覆層。 (3)製程成本低廉,而且可同時處理大量工件。粉末擴散法的製程費用 比 起 CVD(Chemical Vapor Deposition) 、 PVD(Physical Vapor Deposition)、或 LPPS(Low-pressure Plasma Spraying)等製程都便宜許 多。 一般而言,鎳基超合金鋁化最為常見,根據粉末中鋁濃度,主要可分 三類: (1) 高鋁鋁化塗層,利用鋁原子活性較高的粉末,先在較低溫度 (700~800℃) 下 熱 處 理 , 主 要 機 制 為 鋁的 向 內 擴 散 , 在 表 面 形 成 δ-Ni2Al3(脆)的單層結構,接下來在較高溫度下(1000~1100℃)進行第 二階段熱處理,主要機制為鋁的向內和鎳的向外擴散,使δ-Ni2Al3轉
6
變成三層結構的β-NiAl 相。
(2) 中鋁鋁化塗層,利用鋁原子活性居中的粉末,此鋁化塗層之機制
是鋁的向內和鎳的向外擴散而形成β-NiAl ,外層為 Al-rich 的 NiAl,
內層為Ni-rich 的 NiAl 。
(3) 低鋁鋁化塗層,利用鋁原子活性較低的粉末,和高鋁鋁化相比, 在相對較高的溫度(約 1050℃)下直接熱處理,反應機制為鎳的向外擴
散,形成β-NiAl 的塗層,內外層均為 Ni-rich NiAl 。
Xiang et al. [4] 在鐵或鋼的的鋁化中,塗層形成的機制皆是鋁的向內 擴散,並且與粉末的組成、熱處理的條件(溫度時間)有關。 Haynes et al. [5] 指出在超合金鋁化中,保護性金屬塗層內部鋁的減少 是因為鋁的向內擴散,鋁傳輸到超合金表面的驅動力是鋁在塗層跟超 合金基材中的濃度梯度差,因此鋁化粉末中鋁濃度的高低,決定了鋁 化層的厚度與形成速率,另一個影響界面擴散的是超合金中的元素也 擴散到塗層中(鎳的向外擴散)。鋁化塗層鋁含量的減少將導致1.無法 重新形成保護性氧化鋁層 2.氧化物成長快速 3.塗層強度的減少 4. 塗層的相變化 5.塗層的分解。
7
Levin et al. [6] 對 鐵 的 鋁 化 (pack aluminization) 製 程 中 , 富 鋁 的
FeAl3、Fe2Al5會使鍍層變脆並降低抗氧化能力,相對來說,形成富鐵
的 FeAl 會增加機械性質並具有強抗氧化能力。對鐵的鋁化來說,影
響塗層的相成份、性質的因素與1.鋁化粉末的成份 2.溫度 3. 熱處理
時間有關。
Liu et al. [7] 在 Ti-Al-N 薄膜中,Al 原子進入 TiN 晶格中取代部分 Ti
原子,強化了TiN 薄膜,並在表面形成了緻密穩定的氧化鋁提增加氧
化效果。
Jiang wei et al. [8] 在 Ti/Al 擴散接合中,指出在 Ti/Al 界面區,不同
比例的 Ti、Al 會形成不同的介金屬化合物,當 Al 含量到 36.03%時
生成TiAl (γ phase) ,當 Al 含量到 60-64%時生成 TiAl3,當Ti 含量
達到 0.15%時,Ti 固溶到 Al,然而 Ti 固溶到 Al 中的固溶率很低,
由Fig. 2-1 Ti-Al 之二元平衡相圖中可知,在 665℃下,Ti 在 Al 中的
最大固溶率為0.26-0.28%。擴散時間也會影響反應生成物,在擴散溫
度680 oC,持溫時間 25 及 30 分時分別生成 TiAl 與 TiAl3。
Deqing et al. [9] 對純鈦做 hot-dip 鋁化製程,Al 在 γ-TiAl 中的擴散速
8 決於鋁原子的擴散速率,並隨著時間和溫度增加。當持溫900 oC 、4 小時後,發現在內層的TiAl3轉變成TiAl2,而當在 1000 oC 、12 小時 後,TiAl2轉變成TiAl,並發現鋁的擴散層厚度在 800 oC 時隨著持溫 時間增加而增加,但900oC 時 o,持溫時間6 小時已達最大厚度,之 後隨著持溫時間增加而厚度持續減少
Chang et al. [10] 指出在積體電路元件中Si基板與鋁膜兩者之間必須 沈積一層適當的薄膜材料以抑制擴散行為的發生,而此薄膜通常稱之 為擴散阻礙層。一般常用的阻障層為δ-TiN,δ-TiN和Al在550℃時因
熱應力變得不穩定,造成δ-TiN的分解,進而和Al反應生成TiAl3和
AlN,導致阻障層的功能衰退。
Kloosterman et al. [11] 使用HRTEM觀察在雷射氮化鈦金屬中生成的 δ-TiN相,指出在δ-TiN中含有六方晶相(α-Ti)的區域,是因為隨著溫 度從2350℃降到1050℃,δ-TiN對氮的最小固溶量從28 at %增加到30 at%,而α-Ti對氮的最大固溶量從20.5 at %增加到23 at %,氮的固溶量 太低而使單相的δ-TiN無法穩定存在,而造成α-Ti(N)固溶體析出,如 Fig. 2-2所示。
9
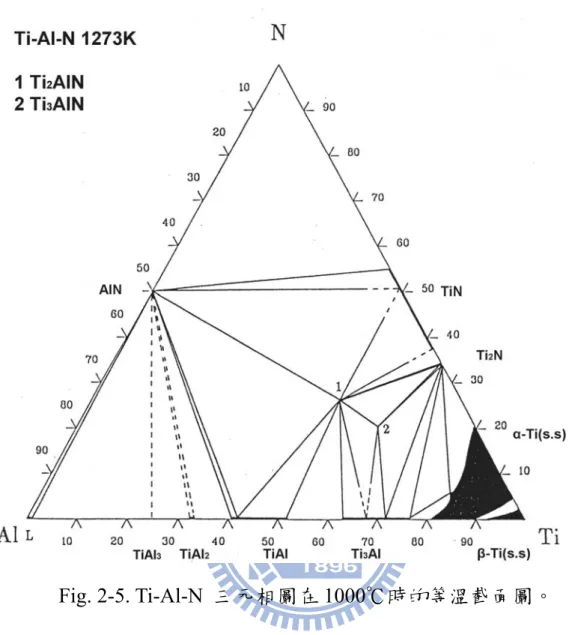
Schuster et al. [12] 研究 Ti-Al-N 三元相圖(如 Fig. 2-5)在 1273K 熱處
理240-800 hr,以 XRD 及電子顯微鏡分析,得到 τ1-Ti3AlN 的晶格常
數a = 0.411 nm;τ2-Ti2AlN 的晶格常數 a = 0.299 nm、c = 1.36 nm; Ti3Al 的晶格常數 a =0.296 nm c = 0.476 nm;指出 AlN 對 Ti 的固溶量
甚低,在 Ti-N 二元系統中,TiN1-x有很大的變化範圍,但 δ-TiN 對
Al 的固溶量極低(<2 at.%),當 Al 在 δ-TiN 的含量超過 2 at %,δ-TiN
並不會以單相存在,如Fig.2-4 所示。
Chungen et al. [13] 在鋁化一開始,活性鋁原子與 TiAl 合金反應並擴
散,TiAl3 薄膜生成後,成長速率是由鋁原子的擴散速率來控制。接
下來在TiAl 與 TiAl3間發生界面擴散,將形成 TiAl2。其中鋁在 TiAl3
的擴散速率比在TiAl2中快。 2.2 氧化機制 以離子擴散路徑來區分,氧化膜的生長方式主要有兩種 1.p-type:陽離子向外擴散和氧結合,為了維持電中性,正孔洞變向 合金內擴散。氧化物表面的氧分解成氧原子並與自合金基材中擴散出 來的陽離子作用生成氧化物,同時產生空位和正空洞向合金內擴散, 正孔洞會和金屬作用,而陽離子空位可能沈積於氧化膜、金屬/氧化
10
Fe3O4及NiO 等。
2.n-type:陰離子向內擴散,即氧分子解離成氧原子後取得電子,隨 後穿過氧化物向合金內擴散,並與氧分子或氧原子作用。屬於此類氧 化物有MnO2、Fe2O3、NiFe2O4、SiO2及 Al2O3等。
氧化動力學
材料在高溫環境下的氧化速率與速度、時間、氧分壓、及其表面狀況 有關。材料的氧化行為,可用以下三種氧化速率方程式分類:
1. 直線型(linear rate law)
當材料表面或相界之界面反應過程為速率決定因素時,氧化速率不隨 時間改變,此時 =K1 上式積分得X=K1*t+ C1 其中K1:速率常數 t:時間 C1:積分常數 X:氧化膜的厚度或單位面積所增加的重量 一般認為,直線型速率方程式適用在界面化學反應控制下的反應。即 在氧化環境中,有應力存在使氧化皮膜發生破裂,或表面之氧化物為
11
多孔狀有裂縫時,表面不斷有 flesh 的表面存在,使得材料可直接接
觸反應生成氧化物。此時的氧化行為即可能符合直線型的速率方程 式。
2. 拋物線型(parabolic rate law)
當反應速率之決定因素為擴散反應過程時,隨著氧化膜厚度增加,氧 化速率將遵守拋物線型速率方程式。此時離子擴散流反比於氧化膜的 厚度(X),而氧化膜的增厚之速率又正比於離子擴散流,既: α= 或 = 上式積分得X2=Kp*t+ C 其中Kp:拋物線速率常數 K’:常數 C:積分常數 大多數材料在高溫下氧化時,若有附著性良好的氧化皮膜於材料表面 生成,其氧化行為通常符合拋物線型速率方程式,當皮膜產生孔洞、 隙縫或剝落時其氧化行為可能會有偏離拋物線型速率方程式的現象 發生。
12
3. 對數型(logarithmic rate law)
於氧化初期或氧化皮膜很薄或氧化於較低溫度時,我們可以以下面的 對數型方程式來表現氧化行為: X=klog 其中,klog:對數速率常數 C,A:常數 對數型速率方程式所對應之氧化機構至今仍不是很清楚。不過,一般 認為這可能與薄膜間存在有一電位梯度促使離子在氧化膜間移動所 致。 且當氧化環境的氧分壓固定時,由上述三種氧化速率方程式所決定的 速率常數和溫度的關係遵守Arrhenius 方程式: k=K0*exp( ) 其中K:恆溫下的速率常數 K0:常數 Q:活化能(activation energy) R:氣體常數 T:絕對溫度
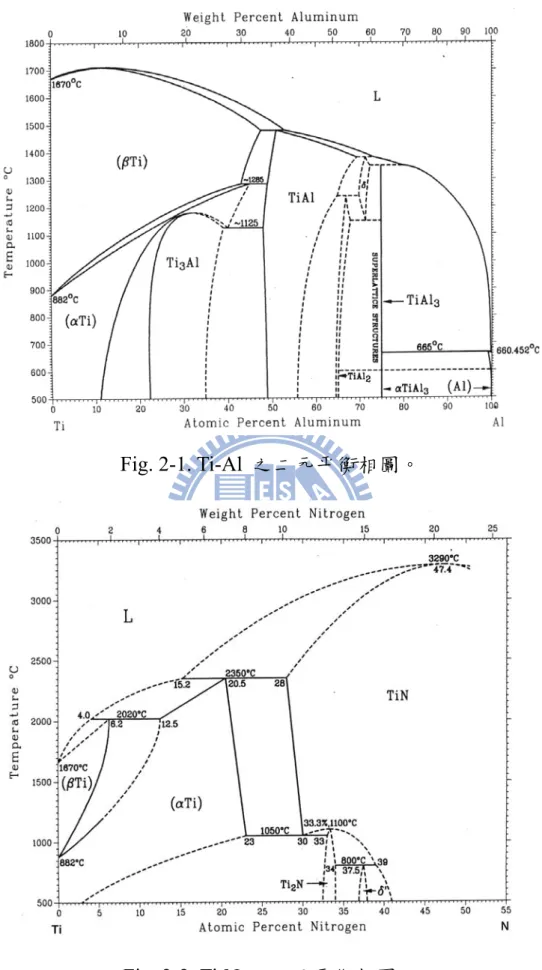
13 2.3 二元平衡相圖 相圖是熱力學中簡潔表達相平衡的工具,相圖不僅可以顯示相與相之 間是否可達到熱力學平衡,也可以由相圖中得知兩個不平衡相反應時 之最終產物。此外也用來解釋擴散反應中所觀察到的微結構及許多現 象發生的熱力學原因。因此相圖成為材料科學研究中不可或缺的工 具。在開始研究三元相圖之前,先對Al-N、Al-Ti、Ti-N 三個平衡相 圖資料作回顧,分別討論如下: 2-3-1 Ti-Al 二元平衡相圖 Murray 等人於 1987 年曾對此系統做過整理,所歸納之 Ti-Al 二元平 衡相圖,如Fig. 2-1 所示[14]。在 Ti-Al 系統之平衡相分別敘述如下:
(1)液相;(2)高溫 bcc 結構之 β-Ti 與低溫 hexagonal 結構之 α-Ti;(3) hexagonal 結構之 Ti3Al;(4)tetragonal 結構之 TiAl;(5)tetragonal 結構 之 TiAl3;(6)orthorhombic 結構之 TiAl2;(7)cubic 結構之 Al。此系統
內各相之組成範圍、晶體結構及晶格常數如Table 1 所示。
2-3-2 Ti-N 二元平衡相圖
Murray 等人於 1987 年曾對此系統做過整理,所歸納之 Ti-N 二元平衡
相圖,如Fig. 2-2 所示[14]。在 Ti-N 系統之平衡相分別敘述如下:(1)
14
結構之TiN;(4) tetragonal 結構之 Ti2N。此系統內各相之組成範圍、
晶體結構及晶格常數如Table 2 所示。 2-3-3 Al-N 二元平衡相圖 Murray 等人於 1987 年曾對此系統做過整理,所歸納之 Al-N 二元平 衡相圖,如Fig. 2-3 所示[14]。Al-N 系統之平衡相分別敘述如下:(1) 低溫 hexagonal 結構的 AlN; (2)當溫度達 660.452℃時,開始有 Al 液相產生,為hexagonal 結構的 AlN 及液態鋁共存;(3)當溫度達 2700℃ 時為液相。 2.4 Ti-Al-N 三元平衡相圖 文獻中Ti-Al-N 之平衡相圖,之前只有 Schuster[12]在 1984 年所提出 的Ti-Al-N 三元相圖資料較為完整,直到 1996 年 Pietzkz[16]提出更為
完整的資料,如Fig. 2-5,Fig. 2-6,Fig. 2-7 所示。三元系統之平衡相分 別敘述如下:(1)hexagonal 結構的 Ti2AlN;(2)cubic 結構的 Ti3AlN; (3)hexagonal 結構的 Ti3Al2N2。此系統內各三元平衡相之晶體結構及
晶格常數整理如Table 3 所示。
2.5 擴散反應之簡介
擴散是物質的傳遞最主要的方式之一。由熱力學的觀點來看,當擴散 發生時也同時趨向平衡的狀態,其主要為降低系統內自由能(Gibbs
15
free energy),自由能調降的程度,取決於原子在系統內的亂度,及原 子間的鍵能。以下針對有關擴散機制及交互擴散反應作簡要之回顧。
2.5.1 擴散機制之探討
原子的擴散機制可概分成三類,如 Fig. 2-8 所示第分別為(1)Vacancy
機制;(2)Interstitialacy 機制;(3)Direct exchange/Ring exchange 機制簡 述如下: (1) Vacancy 機制: 所謂空缺(vacancy),就是晶格中存在許多未填滿的空位。原子移動就 必須仰賴鄰近的空缺。當動能增加時,隨之晶格內擺盪振幅也增加, 使原子就較容易跳入鄰近的空缺之中,便造成擴散,金屬間的交互擴 散多半是利用此擴散機制來進行的。 (2) Interstitialacy 機制: 所謂間隙(interstitial),是指原子在原子間的間隙移動,從某一間隙到 另一個間隙。此機制發生於原子半徑差異較大時,由於小原子可以在 大原子的間隙移動,主要利用熱振動的能量將大原子所造成的能量障 礙克服,以便使原子以極快速度達到間隙擴散。 (3) Direct exchange 機制: 直接交換(direct exchange)機制,是相鄰原子同時移動交換位置。由於 兩個原子需同時躍遷而交換彼此之間的位置,所需動能較大,發生的
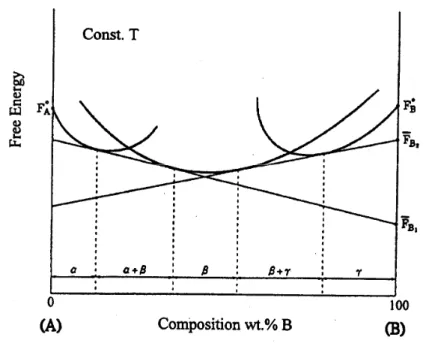
16 機率極低,故並非金屬擴散的重要機制。 (4) Ring exchange 機制: 由 Zener 於 1951 年所提出之的理論,N 個原子在同時間交換位置, 此機制所需的活化能較direct exchange 稍低,但發生機會依然很低。 2.5.2 交互擴散反應 當不同材質或組成不同的材料接和在一起時,為降低自由能,擴散就 會開始發生,最後可能會形成中間相,也有可能以不同組成存在,但 都是以達到最低總和自由能為目標。 根據相律,在定溫定壓下,自由度(F)=元素個數(C)-相數(P)。以二元 系統為例其二相區的自由度F 等於零(C=2,P=2)。自由度為零使得兩 相區中沒有多餘的自由度來提供平衡相在組成上的變化,僅有相的相 對質量的變化。所以在兩相混和區中,雖有平均組成的變化,但是各 相的組成卻是相同的。因此兩相中個組成元素所具有之偏莫爾自由能 (Gi)是維持一固定值,即各組成元素所具有之偏莫爾自由能梯度(ΔGi) 為零。如Fig. 2-9 所示。 二元擴散反應的組成貫穿曲線(penetration curve),可藉由實驗以及參
17 考擴散反應溫度截過相圖而得到,每一個單相區域都有其寬度,而兩 相區則是厚度為零的介面,如Fig. 2-10 乃是擴散發生時,因有濃度梯 度(或是活性梯度 Δai)的存在。根據材料熱力學的溶液行為理論 ) ln( i o i i i G G RT a G = − = Δ ,活性與部分莫爾自由能在擴散界面間的變化 是一致的。由於兩相區自由能梯度為零,為獲得活性梯度的唯一途徑 只有兩相區的厚度為零,如果不為此則擴散作用將會完全停止,所以 在二元擴散偶中,兩相混和區的厚度必為零。 在三元系統中,兩相混和區內至少有一多餘自由度可供組成變化,提 供擴散所需的活性梯度。因此在三元擴散反應中,兩相混和區是存在 的。另外三元擴散實驗中所得的組成值,可描繪於三元相圖中,因此 可得其擴散路徑。 在交互擴散相關研究中,對於擴散偶中交互擴散係數決定也是相當重 要 的 。 絕 大 部 分 的 擴 散 係 數 為 濃 度 的 函 數 , 因 此 採 用 Boltzmann-Matano Method 來 進 行 分 析 。 所 謂 Boltzmann-Matano Method 法就是利用圖形法來求擴散係數。此法可分為兩個步驟:第 一是取適當之參考點(例如擴散偶之端點)劃濃度對於距離之曲線。第
二步是決定Matano 界面,所謂 Matano 界面是指兩種原子(A 及 B)之
18 置。一旦 Matano 界面確定之後,將視為 x 軸之原點。在界面右邊的 距離取正號,而在左邊的取負號。確定原點後,由下式即可求出濃度 X 處之D~x: D~x =-t 2 1
∫
∞ ∂ ∂ X X xdX X x (2-1) 上式中,t 是擴散時間,X 是離開 Matano 界面距離 x 處濃度(at.%), 而 X 是擴散偶一邊遠離界面處之濃度,其為常數不受擴散過程之影 響。 Fig. 2-12 所示為根據實驗數據所繪做濃度-距離數據之穿透取線。藉 由Fig. 2-12 可決定上式中之 X x ∂ ∂ ,亦即穿透曲線C 點之斜率(即圖中線 E 之斜率)的倒數,亦可決定式中之積分值∫
∞ x x xdX (由 X=0 積分至 X 即 Fig. 2-12 中之斜線面積 F)。經由上式即可求得任一特別濃度 X 之擴 散係數。 2.6 界面反應動力學 當兩種成分不同的材料相互結合時,由於此時系統的總自由能大於平 衡時的總自由能,故在界面處會發生原子擴散或反應物生成反應以降 低自由能,若相圖顯示這兩個材料並無反應物存在,則僅發生原子擴 散來降低系統總自由能;若相圖顯示有其他反應物存在,則在系統除 了擴散外,亦在界面處生成反應物來降低自由能,不論是固-固反應19 或是固-液反應,界面生成物的成長是包含了幾個連續的反應步驟, 如原子間的相互擴散,界面上的化學反應及界面介金屬的孕核與成長 等,而在一個包含了幾個連續反應步驟的反應中,只要其中有一個步 驟很慢,則會影響整個反應速度,因此此步驟稱為反應控制步驟 (controlling step)。原子必須先向界面擴散,然後才能越過界面,當原 子越過界面所需的時間很長時,反應是受限於界面反應的生長,此時 是界面控制反應。反之,若是原子擴散至界面時間遠大於原子越過界 面時間時,反應則是由擴散機構所控制。由於在析出或是成長反應 時,界面控制反應的生長速率都遠小於擴散控制反應之生長速率,因 此不同的控制機構將會影響界面介金屬層所能成長的厚度。欲了解一 反應是由擴散機構或是界面機構所控制,可以量測反應層的厚度 (X),並將其對時間(t)做圖,若此 X-t 圖內之曲線呈線性關係,則反應 為界面機構所控制,若曲線成拋物線關係,則反應為擴散所控制。通 常固-固反應,其界面生成物通常以平坦的層狀結構生長,此時反應 層的厚度可直接量測,但固-液反應,其界面生成物型態並不固定, 可能為扇貝狀(scallop interface)或任何形狀。因此其厚度量測需藉由 定量金相法中的平均厚度法或影像處理算出生成物所佔之面積方可 換算出生成物之成長厚度。
20 由於一般的界面反應通常不是擴散控制即為界面控制,以下即分別就 上述兩種不同機構之動力學分析及活化能計算方式作一說明: 2.6.1 界面控制反應 一般而言,界面反應生成厚度(ΔX)與反應時間(Δt)的關係式為 n t k X = 0 Δ 其中k0為比例常數,當n 趨近於 0.5 或 1 時,其物理意義如下所示: 當 n=1,線性生長代表反應的速率決定步驟為界面控制(interface controlled),表示原子相互擴散極快,整個反應主要受制於原子反應 生成介金屬所需的時間。在界面控制的反應中,生成物厚度與反應時 間將成線性關係,亦即 X = at +b (2-2) 其中X 為生成物成長厚度,t 為反應時間,a 與 b 則為常數。 此時可以定義反應常數或生成物生長係數k 值: k = t x (2-3) 此k 值即為圖中各溫度直線之斜率值。 對於一反應之反應常數值,Arrhenius 於 1889 年提出一經驗公式: k = k0exp( RT Q − ) (2-4) 其中k 為反應常數,k0為反應常數係數或頻率因子(frequency factor),
21 Q 為反應活化能,R 為氣體常數(8.314 J/mol-degree),T 則為絕對溫度 值。 因此將Arrhenius 方程式兩邊取 ln 值後可得到下式: ln k = ln k0 -R Q( T 1) (2-5) 因此在實驗數據的處理上,可將各溫度對應活化能之k 值作 Arrhenius 圖後,即可算出整個線性反應之活化能值。 2.6.2 擴散控制反應 當 n=0.5,拋物線生長表示原子擴散到界面的速率較慢,當原子一抵 達界面即可立刻反應生成介金屬相,故其反應決定步驟為擴散控制, 通常隨著介金屬層厚度的增加,原子擴散路徑跟著變長,故介金屬層 的成長厚度平方與時間成正比,界面生成物之厚度(X)反應(擴散)時間 (t)有下列關係: X = A ×(Dt)0.5 (2-6) 其中,X 為反應層厚度,A 為常數,D 為擴散係數而 t 為反應時間。 而且由擴散係數公式: D = D0exp( RT Q − ) (2-7) 其中 D0為擴散係數常數,Q 為反應活化能,R 為氣體常數,而 T 為 反應溫度(K)。 因此,在擴散控制反應中,我們可以假設拋物線係數為Kp:
22 Kp = t X2 (2-8) 則將2-8 是代入 2-6 式與 2-7 式中可得到: ln Kp = lnA2D - RT Q (2-9)
因為lnA2D 為一常數,故以 lnKp 對 1/T 作圖(Arrhenius Plot)所得之斜 率即為-Q/R,由此即可算出整個反應的活化能。
除活化能之外,在固-固反應中之交互擴散係數D~(inter-diffusivity),
23
第三章 實驗步驟
實驗說明
本實驗是利用粉末擴散法(pack cementation method)來製備氮化鈦 (TiN)的鋁化塗層(Aluminide coating)在不同溫度下的鋁化反應與氧化 試驗,其中氮化鈦詳細成份如Table 4 所示,實驗流程如 Fig. 3-1 所示, 包 含 試 片 製 備 、 鋁 化 反 應 、 氧 化 試 驗 、 界 面 試 片 製 作 及 XRD/SEM/EPMA 微觀結構分析觀察與成份分析。 3.1 鋁化粉末之製備 粉末是由Al (鍍層元素)、AlF3(活化劑) 及 Al2O3(惰性填充物)所組成 的,成份為Al = 10 wt %,AlF3 = 1.5 wt %,α-Al2O3 = 88.5 wt %,其 中各別的化學組成如 Table 5 所示。以精密天秤量取所需粉末之重 量,依序裝入乾淨的塑膠瓶中,加入數十顆直徑 4mm 的不鏽鋼珠, 以丙酮及超音波清洗去油脂,再以球磨機使粉末均勻混合。 3.2 氮化鈦的鋁化反應 盛裝鋁化粉末的氧化鋁坩堝於850℃保護氣氛 Ar 中持溫 10hr,目的 為將保護氣氛爐內壁及氧化鋁坩堝先充分鋁化,避免影響實驗結果 (調質處理)。其後,將 TiN 切割成 10×10×4 mm 大小,經過研磨拋光
24
之後,將鋁化粉末填滿氧化鋁坩堝,將TiN 埋入,置於管形爐中,管
形爐經過三次重複抽真空和通入氬氣,當管形爐被加熱到目標溫度, 經過長時間持溫熱處理後,使爐冷至室溫;再佐以儀器分析觀察其界 面微觀結構。實驗參數如Table 6,Table 7,Table 8 所示。
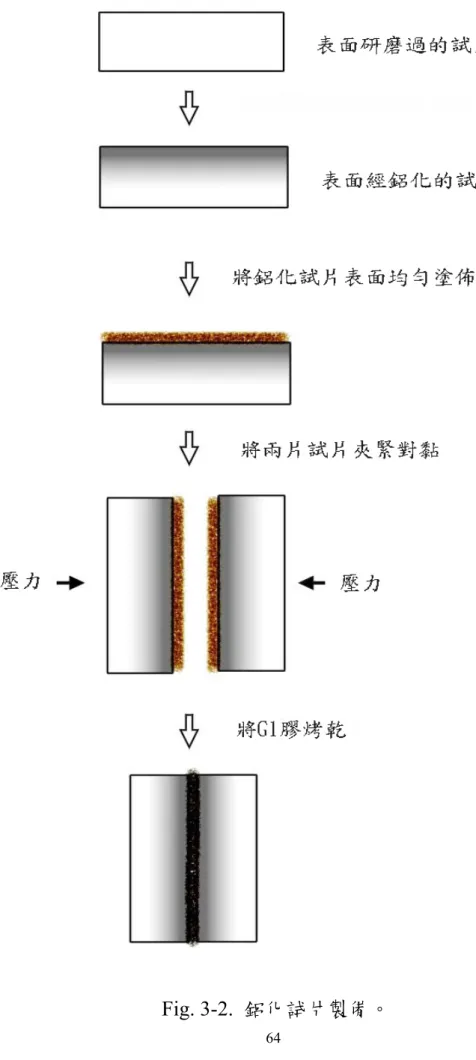
3.3 鋁化試片製備
如Fig. 3-2 所示在經過鋁化反應試片的表面均勻塗佈 G1 膠,使用夾
子將其夾緊,在100℃下加熱 4 hr,使其對黏,以慢速切割機沿著垂
直於氮化鈦/鋁化層界面的方向切取試片,再經由研磨拋光處理,最 後,使用Kroll reagent(成分為 60ml H2O + 30ml HNO3 + 10ml HF)腐蝕
金相試片,腐蝕時間為10 ~ 15 秒。TEM 試片製備流程如 Fig. 3-3 所 示。 3.4 氧化試驗 3.4.1 氧化前的準備 氧化前先利用游標卡尺(精確度+0.001mm)測量試片的尺寸並計算其 表面積, 再將試片用丙酮為清潔劑,用超音波洗淨試片,放入烘箱 150℃乾燥 48 小時,冷卻後以電子天秤(Model R200D, Satorius AG, Goettingen, Germany)測量其氧化前的重量。
25 3.4.2 氧化實驗
將高溫爐(Model 51333, Lingberg, WI)以每分鐘 5℃的升溫速率升溫至 欲氧化的溫度(1000℃)後,將試片置於氧化鋁坩堝後放入爐內,置入 試片時爐體溫度約下降 20~30℃,待回升至所設定的溫度時,在開 始計算時間;氧化時間分別為 2、5、12、25、50、100、200 及 250 個小時,達到設定的氧化時間後,將試片由爐內取出。實驗參數如 Table 8 所示。 3.4.3 單位表面積之重量變化(△W/A)分析 由爐內取出的試片,待其冷卻後,以電子天秤(Model R200D, Satorius AG, Goettingen, Germany) 測量其重量,把氧化前後的重量變化除以 試片的表面積,即可作為氧化速率的表示方法。 3.5 X-射線繞射分析(XRD) 利用X-射線繞射儀(Siemens Model 5000),對界面試片表面作繞射分 析,以鑑定結晶相之相別。設定電壓為 50KV、電流為 200mA,以 Cu 靶 Cu Kα(λ=1.5406A°)產生之射線經 Ni-filter 濾波後,在試片表面 進行 10°至 90°之掃瞄,掃瞄為速度每分鐘 2°,每隔 2θ=0.02°自動記 錄 X-ray 的強度。掃瞄出來的圖形再與 JCPDS 卡相互比對,以判定 相別。
26
3.6 掃瞄式電子顯微鏡(SEM)&能量散射分析儀(EDS)
利用掃瞄式電子顯微鏡(Model JSM-6500, JOEL, Tokyo, Japan )之二次
電子成像,觀察的界面微觀組織並以EDS 鑑定各個相的組成元素,
以line scan 或 mapping 模式進行成分半定性分析。SEM 操作電壓為
15kV。使用 Ion coater 在試片上鍍上一層 Pt,以避免在觀察試片時, 產生電荷累積放電( charging )的現象,設定電流為 20mA,濺鍍時間 為90sec。
3.7 電子探針微區分析儀(EPMA)
利用電子探針微區分析儀(JXA-8200, JEOL, Tokyo, Japan)透過對試樣
放射出來的 X-射線的量測與分析,可從事試樣極微體積內化學成分
的定性與定量的鑑定。工作原理實際上與掃描式電子顯微鏡相似,經
由偵測器分別接收不同之放射信號,藉以分析試片之成分含量,以line
scan 或 x-ray mapping 模式進行成分定性分析及波長散佈分析儀 (WDS)對試片進行定量分析。在 EPMA 分析前試片需研磨拋光至 1 μm 以下,且除非必要避免腐蝕以確保其表面之平整。分析前鍍上碳膜, 避免放電的現象。在分析盡量遠離坑洞且避免分析相之邊緣,以避免 雜訊之干擾。
27
第四章 結果與討論
4.1 鋁化前之 TiN 試片
Fig. 4-1 為鋁化反應前的 TiN 試片之 XRD 繞射光譜圖,顯示其結構為 cubic 的 TiN。Fig. 4-2 為 TiN 在鋁化反應前之 SEM 微觀結構圖(經研 磨拋光再以kroll reagent 腐蝕),TiN 之 SEM/EDS 定量分析結果為 52.3 at.% Ti、 0.8 at.% Al 及 46.9 at.% N。
4.2 TiN 在 850 oC 下之鋁化反應 4.2.1 XRD 分析 Fig. 4-3. 為 TiN 在 850oC/10 hr 鋁化反應後之 XRD 繞射光譜圖,由圖 中可發現除了原本的主相TiN(cubic)之外,還有生成相 TiAl3 (tetragonal)與 AlN(hexagonal)。 4.2.2 SEM/EDS 分析
Fig. 4-4. (a)為 TiN 經過 850oC/10 hr 鋁化反應後,研磨拋光之橫截面
微觀結構圖,圖中間黑色的部份是G1 膠,向右依序為鋁化層、擴散
層與氮化鈦。鋁化層厚度約為 30~35μm,包含 TiAl3與 AlN,擴散層
厚度約為10μm,主要相為 TiN 和 TiAl3。Fig. 4-4. (b) 為鋁化層的放
28
靠近 TiN 的擴散區。Table 9 為 TiN 在 850oC/10 hr 鋁化反應之 SEM/EDS 成份表,A 點之 SEM/EDS 定量分析結果為 55.32 at.% Ti、 1.24 at.% Al 及 43.44 at.% N,成份為 TiN;B 點之 SEM/EDS 定量分 析結果為26.66 at.% Ti、68.24 at.% Al 及 5.1 at.% N,成份為 TiAl3;C 點之SEM/EDS 定量分析結果為 3.3 at.% Ti、 55.8 at.% Al 及 40.9 at.% N,成份為 AlN。
Fig. 4-5. (a)為 TiN 經過 850oC/10 hr 鋁化反應後,研磨拋光再以 kroll
reagent 腐蝕之橫截面微觀結構圖,因為 TiAl3為介金屬相容易腐蝕,
AlN 為陶瓷相不易腐蝕,所以腐蝕後可在鋁化層中看出條狀的組織,
經SEM/EDS 鑑定為 AlN。由 Fig. 4-5. (b) 的鋁化層局部放大圖,發
現腐蝕後鋁化層中有方向性的長條狀析出,這些析出物為 hexagonal 之AlN,可發現當條狀析出物延伸至碰觸另一不同方向的條狀析出物 即停止,這是典型的平面成長機構,當析出物生長碰觸晶界、自由表 面或另一析出物時,plate growth 就會停止。 4.3 TiN 在 1000 oC 下之鋁化反應 4.3.1 XRD 分析 Fig. 4-6. 為 TiN 在 1000oC/10 hr 鋁化反應後之 XRD 繞射光譜圖,由 圖 中 可 發 現 除 了 原 本 的 主 相 TiN(cubic)之外,還有生成相 TiAl3
29
(tetragonal)與 AlN(hexagonal)。
4.3.2 SEM/EDS 分析
Fig. 4-7. (a) ~ (d)分別為 TiN 在 1000℃持溫不同時間(0.5 hr、3 hr、10 hr、36 hr)鋁化反應後,研磨拋光之橫截面微觀結構圖,左側黑色的
部份是 G1 膠,向右依序為鋁化層、擴散層與 TiN。鋁化層中主要相
為 TiAl3與 AlN。在圖中可以發現較暗的條狀組織,經 SEM/EDS 鑑
定為 AlN,被周圍較亮的區域包圍,較量的則為 TiAl3。擴散層厚度
約為10μm。Fig. 4-7. (e)為(d)之局部放大圖,可發現鋁化層中有少量
白色長條狀TiN 生成,夾雜在較深的 AlN 與較顯淺的 TiAl3中,推測
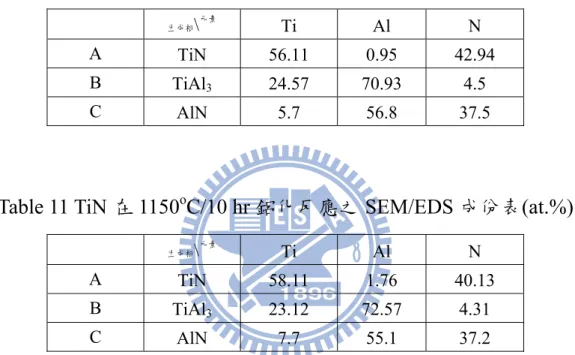
是因為AlN 和 TiAl3進一步發生反應所致。Table 10 為 TiN 在 1000oC/ 10 hr 鋁化反應之 SEM/EDS 成份表,A 點之 SEM/EDS 定量分析結果 為56.11 at.% Ti、0.95 at.% Al 及 42.94 at.% N,成份為 TiN;B 點之 SEM/EDS 定量分析結果為 24.57 at.% Ti、70.93 at.% Al 及 4.5 at.% N, 成份為TiAl3;C 點之 SEM/EDS 定量分析結果為 5.7 at.% Ti、 56.8 at.% Al 及 37.5 at.% N,成份為 AlN。
因為Al 在 TiN 中的溶解度只有 2%,可藉由 Fig. 4-8. Al 元素的分佈
v.s.距離,對照 Fig.4-7. 的 SEM 圖,可大致推算出鋁化層厚度:(a)0.5 hr 的鋁化層厚度約 40μm,(b)3 hr 的鋁化層厚度約 44μm,(c)10 hr 的
30
鋁化層厚度約52μm,(d)36 hr 的鋁化層厚度約 54μm。因此可發現鋁
化層厚度隨反應時間增加而增加的趨勢。
Fig. 4-9. (a) ~ (d)分別為 TiN 在 1000℃持溫不同時間(0.5 hr、3 hr、10 hr、36 hr)鋁化反應後,研磨拋光以 kroll reagent 腐蝕之橫截面微觀結
構圖,腐蝕後可以明顯看出條狀的AlN 在 TiAl3中析出,短小且不連
續的析出物。(e)與(f)分別為 10 hr 與 36 hr 鋁化層的局部放大,可發
現條狀的 AlN 有的在 TiAl3中形成,但是卻不像 850℃鋁化中的 AlN
有長條狀的連續析出,反而是散佈在TiAl3晶粒中。 4.4 TiN 在 1150 oC 下之鋁化反應 4.4.1 XRD 分析 Fig. 4-10. 為 TiN 在 1150oC/10 hr 鋁化反應後之 XRD 繞射光譜圖,由 圖 中 可 發 現 除 了 原 本 的 主 相 TiN(cubic) 之 外 , 還 有 生 成 相 TiAl3(tetragonal)與 AlN(hexagonal)。 4.4.2 SEM/EDS 分析
Fig. 4-11. (a)為 TiN 在 1150℃/10 hr 鋁化反應後,研磨拋光之橫截面微
觀結構圖,圖中間為G1 膠,依序為左側鋁化層、擴散層、最右側為
31
散層厚度約為 10μm,主要相為 TiN 和 TiAl3。Table 11 為 TiN 在
1150oC/10 hr 鋁化反應之 SEM/EDS 成份表,A 點之 SEM/EDS 定量分 析結果為58.11 at.% Ti、1.76 at.% Al 及 40.13 at.% N,成份為 TiN;B 點之SEM/EDS 定量分析結果為 23.12 at.% Ti、72.57 at.% Al 及 4.31 at.% N,成份為 TiAl3;C 點之 SEM/EDS 定量分析結果為 7.7 at.% Ti、 55.1 at.% Al 及 37.2 at.% N,成份為 AlN。
Fig. 4-11. (b)為鋁化層局部放大圖,右側較亮的相為 TiAl3,而晶粒中
有較暗的條狀物為AlN 分佈,屬於較短的析出相。左側除了有 TiAl3
中除了AlN 外,還多了白色條狀的 TiN 散佈在 TiAl3與 AlN 之間。
Fig. 4-12. (a)為 TiN 在 1150℃/10 hr 鋁化反應腐蝕後之微觀結構圖,與
Fig. 4-11. (a)比較可發現鋁化層的左側與 TiAl3都被腐蝕,條狀的AlN
與周圍的TiAl3基材有明顯區別,Fig. 4-12. (b)為鋁化層局部放大圖可
32 4.5 鋁化反應機構 TiN與Al在高溫下反應,TiN呈現不穩定狀態,易分解成Ti與N原子, 如反應方程式所示[10]: TiN→ Ti+N (4-1) 而易與鋁化層形成AlN與Ti-Al的介金屬化合物,可能形成的Ti-Al的介 金屬化合物有TiAl3、Ti2Al5、TiAl2、TiAl和TiAl3,熱處理過程中,過
多鋁原子的存在導致一些富鈦的化合物,如Ti3Al和TiAl,在反應中無
法生成,且由於TiAl2和Ti2Al5的生成為透過以γ-TiAl為起始相的一連
串固態/液態反應,排除TiAl2和Ti2Al5的生成的可能性,另外,從熱力
學觀點,與Ti3Al和TiAl相較之下,TiAl3有較低的自由能,如Fig. 4-13.
所示,由以上可以了解在Ti與Al的反應中優先形成TiAl3 [15] 。如反
應方程式(4-2) (4-3)所示:
Ti+3Al→TiAl3 (4-2)
33 TiN和Al間的反應自由能如下: 這裡的T 單位是 K。在溫度 850℃下, =-6.23kJ、 =-20.31kJ; 在溫度1000℃下, =-4.48kJ、 =-18.65kJ;在溫度 1150℃下, =-2.73kJ 、 =-16.99kJ , 的 自 由 能 較 低 , 由 此 可 知 在 850~1150℃時 TiN 和 Al 的主要反應生成物為 TiAl3和 AlN。
4.5.1 在 850 oC 之鋁化反應
TiN 在 850 oC 鋁化反應時,因 Al 在 TiN 中溶解度相當低(最多 2at.%),
不易擴散進 TiN 內部,Al 只能沿著 TiN 晶界或結構上的缺陷作為其
擴散路徑,所以會於TiN 晶界或其他缺陷處形成析出物或偏析雜質原
子,在晶界上形成有大量和Al 的析出物,如 AlN 或 TiAl3。擴散區產
生的原因是由於 TiN 晶界部份在高溫下會發生分解反應所致,因 Al
與Ti 的活性大於 Al 與 N 的活性,且 TiAl3間的金屬鍵比 AlN 間的共
價鍵較易形成,故 TiN 分解時,Ti 與 Al 會優先形成 TiAl3,而 N 則
因為在TiN 中有極高的溶解度,大量固溶在 TiN 中而降低了 N 與 Al
34 新生成的鋁化層,由上述可知,初期是 TiAl3的成核與成長,成核是 利 用 TiN 表 面 上 的 缺 陷 或 晶 界 處 發 生 異 質 成 核 (heterogeneous nucleation),此種成核方式所需的驅動力較小,容易產生新相之核, 然後在成長。而在 TiN 中,N 固溶到飽和時,N 漸漸往生成的 TiAl3 方向擴散,由Fig. 2-1. 得知 TiAl3為劑量型化合物,只能固溶微量的
N 原子,所以過量的 N 則與 Al 形成 AlN 在 TiAl3中析出。AlN 的晶
格常數 a=0.311nm、c=0.498nm,其 c/a 的比值為 1.6,故其析出物
為條狀或針狀,與Fig. 4-5. (b)觀察相符合,而且析出物沿著 TiAl3晶
體的特殊晶面或方向成長,生長碰觸晶界、自由表面或另一析出物時
才停止,形成連續的析出物。其中TiN 在 850℃/10 hr 鋁化反應的示
意圖,如Fig. 4-14. 所示。Fig. 4-15. 在 Ti-Al-N 三元相圖表示 850/10
hr 鋁化反應之擴散路徑。在基材表面的 Al,與 Ti 反應生成 TiAl3,之 後N 擴散到鋁化層的 TiAl3中,與 Al 反應析出 AlN。 4.5.2 在 1000℃之鋁化反應 1000℃之鋁化反應,初期的生成機制與 850oC 相同,TiAl3利用 TiN 表面上的缺陷或晶界處異質成核(heterogeneous nucleation)成核與成 長。而在TiN 中,N 固溶到飽和時,N 漸漸往生成的 TiAl3方向擴散,
35 TiAl3晶體的特殊晶面或方向成長,短小、分散的針狀析出。Fig. 4-16. 為TiN 在 1000℃/10 hr 鋁化反應的示意圖。 然而,當持溫時間達36 hr 時,因長時間下 Ti+3Al→TiAl3發生放熱反 應,因而提供足夠的能量使Ti 與 AlN 產生反應,反應式如下: Ti (s) + AlN→TiN(s) + Al(s) (4-4) 因此,在850℃或 1000℃短時間下,可能因為反應驅動力不足或擴散 時間過短,導致上述反應無法進行。可發現鋁化層有部份 TiAl3中的
Ti ,將 AlN 還原成 TiN,此 TiN 主要散佈在靠近鋁化層的外側。而
多餘的Al 則與之後擴散過來的 Ti 產生反應生成 TiAl3。
Fig. 4-17. 在 Ti-Al-N 三元相圖表示 1000℃/10 hr 鋁化反應之擴散路
徑。對於 1000℃/0.5~10 hr 的鋁化反應來說,在基材表面的 Al,與
Ti 反應生成 TiAl3,之後 N 擴散到鋁化層的 TiAl3中,與Al 反應析出 AlN。然而 1000℃/36 hr 的鋁化反應,基材表面的 Al,與 Ti 反應生 成TiAl3,之後N 擴散到鋁化層的 TiAl3中,與 Al 反應析出 AlN。而 部份的TiAl3分解出Ti,將 AlN 還原成 TiN。
36
4.5.3 在 1150 oC 之鋁化反應
1150℃之鋁化反應,生成機制與 1000o
C 相同,TiAl3利用TiN 表面上
的缺陷或晶界處成核與成長。而在TiN 中,N 固溶到飽和時,N 漸漸
往生成的 TiAl3方向擴散,過量的 N 則與 Al 形成 AlN 在 TiAl3中析
出。AlN 在析出時會沿著 TiAl3晶體的特殊晶面或方向成長,短小、
分散的針狀析出。由 Fig. 4-11. (b)右側可發現 TiAl3晶粒中有條狀AlN
形成。
當溫度到達1150℃,有足夠的能量使 Ti 與 AlN 產生反應,反應式如
下:
Ti (s) + AlN →TiN(s) + Al(s) (4-4)
因此,在850℃或 1000℃短時間下,可能因為反應驅動力不足或擴散
時間過短,導致上述反應無法進行。可發現鋁化層有部份 TiAl3中的
Ti ,將 AlN 還原成 TiN,此 TiN 主要散佈在靠近鋁化層的外側。由 Fig. 4-11. (b)可發現鋁化層中有 TiN 相的出現,為白色長條狀生成物。 Fig. 4-18. 為 TiN 在 1150℃/10 hr 鋁化反應的示意圖。
Fig. 4-19. 在 Ti-Al-N 三元相圖表示 1150℃/10 hr 鋁化反應之擴散路
37
TiAl3中,與Al 反應析出 AlN。而部份的 TiAl3分解出Ti,將 AlN 還 原成TiN。 4.6 氧化試驗 將上述經過鋁化處理之試片進行高溫氧化後,試片外觀皆產生顏色的 改變,甚至有撓曲及破裂的現象。Fig. 4-20. 為各試片在 1000oC 氧化 前的外觀,Fig. 4-21 為各試片在 1000oC 氧化 50 hr 後的外觀。比較氧 化前後可發現各試片表面接產生米白色氧化物。其中由 Fig. 4-20.(b) 發現850℃鋁化的試片表面仍看得到基材 TiN 部份,表示其氧化速率 較其他條件慢,顯示其生成鋁化層鋁化層有抗氧化效果。 4.6.1 以單位表面積重量變化表示氧化速率 TiN、AlN 及 TiAl3在高溫氧化的反應式如下: TiN(S)+O2(g)→TiO2(s)+1/2N2(g) (4-5) 4AlN(s)+3O2(g)→2Al2O3(s)+2N2(g) (4-6) 2TiAl3(s)+5O2(s)→2TiO2(s)+3Al2O3(s) (4-7) 由上述反應式中,氧來源主要來自大氣,氧化後產物 N2則向外逸散
38
到大氣中,其中TiO2 (79.88g/mol)的分子量高於 TiN(61.89g/mol)的分 子量;Al2O3 (101.96g/mol)的分子量高於 AlN(40.99g/mol)的分子量; TiO2(79.88g/mol) 的 分 子 量 與 Al2O3(101.96g/mol) 的 和 高 於 TiAl3(128.82g/mol)的分子量。氧化後試片重量會增加,藉此現象可以 用來判斷氧化速率快慢的一種依據,但在體積不同的前提下,通常會 改以氧化後的重量增加量除以試片表面積做為氧化速率的表示方法。 氧化速率和氧化時間的關係 Fig. 4-22. 為各種鋁化反應的 TiN 試片,在 1000℃氧化溫度下,單位 表面積重量改變與氧化時間關係曲線。圖中顯示,其中除了850℃鋁 化試片外,重量增加的值隨著氧化時間的增加而增加,持續至 50 hr 左右時,趨向穩定態。在相同氧化時間下,鋁化溫度越高重量增加的 值就越大,表示氧化速率較快。 就850℃鋁化試片而言,初期重量增加的量明顯比其他試片少很多, 其氧化速率比較慢,表示抗氧化性較好;後期氧化速度加快,推測應 該是試片鋁化層性質隨時間拉長而逐漸劣化,進而產生孔洞、縫隙或 剝落等現象,使其氧化反應加速進行。 然而,就純TiN、1000℃及 1150℃鋁化試片而言,重量增加的量明顯
39 加快,表示抗氧化性較差,可能是應力存在使氧化膜發生破裂,或表 面之氧化物為多孔狀有裂縫時,使得氧氣可直接接觸反應生成氧化 物。 氧化速率和氧化時間平方根的關係 Fig. 4-23. 為各種鋁化反應的 TiN 試片,在 1000℃氧化溫度下,單位 表面積重量改變平方與氧化時間關係曲線。圖中曲線的斜率為 rate constant,同樣的如 Fig. 4-22 所示,其中除了 850℃鋁化試片外,皆 呈現隨氧化時間而增加的趨勢,持續至50 hr 左右時,趨向穩定態, 試片可能完全氧化。 此外,就850℃鋁化試片來說,其氧化曲線大致可分為兩階段,第一
段曲線遵守parabolic rate law,氧化速率由擴散機構控制,rate constant =19.40μg2mm-4hr-1。第二段則偏離拋物線型,不遵守 parabolic rate law。當氧化時間 200hr 後,weight gain 增加緩慢,推測是試片已完 全氧化,可由之後試片的橫截面觀察得知。
純TiN、1000℃及 1150℃鋁化試片其曲線遵守 linear rate law,氧化速
率是由界面反應過程所控制,氧化速率不隨時間改變,rate constant 分
40
50 hr 之後,試片重量增加緩慢,推測是已完全氧化,由之後試片的 橫截面觀察得知。
4.6.2 純氮化鈦的氧化
Fig. 4-24. 為純 TiN 在 1000℃/50hr 氧化前後之 XRD 繞射光譜圖,由
圖中氧化前後比較可以看出原本的TiN (cubic)相已消失,氧化成 TiO2
相。TiN 高溫氧化後的反應式如下[22]:
TiN(S)+O2(g)→TiO2(s)+1/2N2(g) (4-5)
一般來說TiN 的氧化速度是由 O2擴散穿過TiO2的速率來決定的,可
是在 1000℃以上或單晶 TiO2中,Ti 在 TiO2的擴散速率比 O2在 TiO2
的擴散速率來的快,此時氧化速度由 Ti 在 TiO2 的擴散速率決定 [24,25,26]。Ti 不斷向外擴散使得內部的 TiN 產生許多空位,這些空 位累積起來就變成空洞。氧化後產生的TiO2,並非保護性氧化物,無 法阻擋 O 的向內擴散或 Ti 的向外擴散,此氧化物不能形成保護層, 故 TiN 的氧化反應速率由界面反應所控制,即由 Ti 的向外擴散速率 決定。
41
Fig. 4-25. 為純 TiN 在 1000℃/50hr 氧化後之微觀結構圖,圖中可看到
右側的 TiN 基材部份也都氧化成 TiO2,並在靠近 TiN 表面殘留許多
小孔,這些小孔是氧化反應中 Ti 向外擴散造成的,而左側這氧化層
約 400μm,由 SEM/EDS 鑑定其成份為 TiO2,定量分析結果為 36.38
at.% Ti 及 63.62 at.% O,兩者間有條裂縫,可能是因氧化反應下體積 膨脹收縮所產生的熱應力所造成的。
4.6.3 TiN 經 850℃/10hr 鋁化反應之氧化
Fig. 4-26. 為 TiN 經 850℃鋁化的試片,在 1000℃/50hr 氧化前後之 XRD 繞射光譜圖,由圖中可發現除了原本的主相 TiN 外,另外有生 成相TiO2(rutile)和 Al2O3(corundum),推測應該是由 TiAl3與 AlN 氧化 後所生成。
Fig. 4-27. 為 TiN 經 850℃鋁化的試片,在 1000℃/50hr 氧化後之之微
觀結構圖,由圖的左側依次為 G1 膠、氧化層以及基材 TiN。圖中氧
化層中深色部份經由SEM/EDS 鑑定為 Al2O3,定量分析結果為41.58
at.% Al 及 58.42 at.% O,較淺色的部份為 TiO2,定量分析結果為34.62 at.% Ti 及 65.38 at.% O。因右側有未氧化的 TiN,因此可以判定氧化
層的厚度約為70μm,與純 TiN 的氧化層厚度 400μm 相距甚遠,因此
42 另外,由Fig. 4-27. 可看到氧化層外側有一連續且緻密的 Al2O3層, 具有擴散阻障層的效果,能抑制 O 向內擴散或者 Ti 的向外擴散,使 得氧化速率變慢,因此在1000℃/50 hr 氧化反應下,TiN 內部上發生 未氧化。 4.6.4 TiN 經 1000℃/10hr 鋁化反應之氧化 Fig. 4-28. 為 TiN 經 1000℃鋁化的試片,在 1000℃/50hr 氧化前後之 XRD 繞射光譜圖,和 850℃鋁化結果相似,由圖中可發現除了原本的 主相TiN 外,另外有生成相 TiO2(rutile)、Al2O3(corundum),推測應該 是由TiAl3與AlN 氧化後所生成,TiO2與Al2O3。
Fig. 4-29. 為 TiN 經 1000℃鋁化的試片,在 1000℃/50hr 氧化後之之
微觀結構圖,由圖的左側依次為G1 膠、氧化層與 TiN 基材。氧化層
中深色部份經由SEM/EDS 鑑定為 Al2O3,定量分析結果為40.72 at.%
Al 及 59.28 at.% O,較淺色的部份為 TiO2,定量分析結果為33.42 at.% Ti 及 66.58 at.% O。氧化層的厚度約 380μm,與 850℃鋁化試片的氧
化層厚度70μm 差距頗大。氧化層中,有一層 Al2O3與TiO2混合區,
此區是由 TiAl3氧化而成,其氧化物沒有辦法形成保護層,故氧化速
率較快,氧化層較厚。圖片右側為基材 TiN 氧化後的 TiO2,在其內
43 Ti 的向外擴散所導致。 4.6.5 TiN 經 1150℃/10hr 鋁化反應之氧化 Fig. 4-30. 為 TiN 經 1150℃鋁化的試片,在 1000℃/50hr 氧化前後之 XRD 繞射光譜圖,和 850℃與 1000℃鋁化試片結果相似,同樣只有 TiO2與Al2O3兩種生成相存在。 Fig. 4-31. 為 TiN 經 1150℃鋁化的試片,在 1000℃/50hr 氧化後之之 微觀結構圖,由圖的左側依次為 G1 膠、氧化層及基材 TiN。經
SEM/EDS 鑑定後,圖中深色部份為 Al2O3,定量分析結果為42.38 at.%
Al 及 57.62 at.% O,較淺色的部份為 TiO2,定量分析結果為34.66 at.% Ti 及 65.34 at.% O。氧化層的厚度約 400μm,氧化層中,有一層 Al2O3
與TiO2混合區,此區是由TiAl3氧化而成,因其氧化物沒有辦法形成 保護層,故在氧化速率較快,氧化層較厚。圖片右側為基材TiN 氧化 後的TiO2,在其內部及邊界發現很多小孔,這些孔洞是氧化後產生的 N2殘留的或是因Ti 的向外擴散所導致。 4.7 氧化機制 AlN 高溫氧化後的反應式如下: 4AlN(s)+3O2(g)→2Al2O3(s)+2N2(g) (4-6)
44
Yuan et al. [23]指出 AlN 在 800℃以上溫度,開始與空氣中的氧產生
反應生成 Al2O3,Al2O3形成一保護層在 AlN 表面,阻擋 O 與內部的
AlN 產生氧化反應。一般而言,氧化溫度在 1000℃以下,AlN 的氧
化反應仍不顯著,是因氧化後的產物Al2O3產生保護的作用。
TiAl3高溫氧化後的反應式如下:
2TiAl3(s)+5O2(s)→2TiO2(s)+3Al2O3(s) (4-7)
Chu et al. [27]指出 γ-TiAl 在 800℃以上氧化時,並無法在表面形成保 護性的 Al2O3-rich 層,反而是形成非保護性的 TiO2與 TiO2/ Al2O3混
合層,使得 γ-TiAl 在抗氧化性質差。然而在上 γ-TiAl 上鍍上一層 TiAl3
薄膜,在800℃氧化時,因 TiAl3為Al-rich 鈦鋁化和物,能夠在氧化 反應中生成保護性的Al2O3-rich 層,進而提高 γ-TiAl 抗氧化性。但在 氧化溫度1000 ℃以上,TiAl3無法再形成保護性的Al2O3層,反而是 生成TiO2/ Al2O3混合層,在氧化反應中,無法提供保護作用。 TiN 經 850℃/10 hr 鋁化反應之氧化試片,鋁化層為 TiAl3 中析出 AlN,但因為 AlN 為長條狀大量析出,所以氧化反應時,可提供連續 且緻密的Al2O3層,抑制 O 向內擴散,少量的 O 擴散到內部與 TiAl3
45
反應,生成 TiO2/ Al2O3混合層;再加上 AlN 本身抗氧化性佳,就算
在 1000℃下受到氧化的影響也不顯著,所以也降低鋁化層的氧化速
率。而 Ti 的向外擴散,則因 Ti 在 Al2O3中的擴散速率小,只有極少
量 Ti 擴散通過 Al2O3與外面的氧形成 TiO2,因此抑制氧化反應的進
行。Fig. 4-32. TiN 經 850℃/10 hr 鋁化試片之氧化反應示意圖。由 Fig. 4-22. 可看出提高的抗氧化效果可以持續到 30 hr。
TiN 經 1000℃/10 hr 與 1150℃/10 hr 鋁化反應之氧化試片,因鋁化層
內由主要是TiAl3基底,但AlN 在其中析出物較短小,進行氧化反應
下,少量且不連續的AlN 無法氧化成緻密的 Al2O3層來保護內部。然
而TiAl3氧化下產生TiO2/ Al2O3混合層,此層可由 Fig. 4-29. 及 Fig. 4-31.中,發現中間有一層 TiO2/ Al2O3混合區。部份的 Ti 與此 TiO2/ Al2O3層產生反應,生成 Ti-O 化合物及 Al2O3,使得部份的 Ti 與 Al 往外擴散,與外面的氧反應生成 TiO2與 Al2O3。故 O 的向內擴散及 Ti 和 Al 的向外擴散都可經由 TiO2/ Al2O3通過,無法抑制接下來的氧 化反應,導致反應持續不斷的進行。Fig. 4-33. 為 TiN 經 1000 和 1150℃/10 hr 鋁化試片之氧化反應示意圖。
46 第五章 結論 1. TiN 經 850 oC/10 hr 鋁 化 反 應 後 , 鋁 化 層 內 的 生 成 物 為 TiAl3(tetragonal)與 AlN(hexagonal)。 2. TiN 在 1000 oC 下經 0.5~36 hr 鋁化反應後,鋁化層內的生成物為 TiAl3(tetragonal)與 AlN(hexagonal),隨著熱處理時間增加,鋁化層 厚度也隨之增加。 3. TiN 經 1150 oC/10 hr 下之鋁化反應,鋁化層內的生成物除了 TiAl3 (tetragonal)與 AlN(hexagonal) 外,還有少量 TiN(cubic)生成散佈在 鋁化層外側。 4. 在氧化實驗中,經 850 oC 鋁化處理後之 TiN 試片,相較於未經鋁 化處理之TiN,提供了較佳之抗氧化性,因為其鋁化層中有較多的 AlN,氧化形成連續且緻密的 Al2O3保護層。 5. 在氧化實驗中,經 1000 oC 及 1150 oC 鋁化處理之 TiN,其抗氧化 性都很差,因為鋁化層中的 AlN 含量較少,無法提供緻密連續
47
參考文獻
[1] Shingo Nakane, Sho Hikawa, Takaya Endo, Masaki Kato, Ken Hirota, Hiroya Miyauchi, and Tadashi Hioki, "Fabrication of Al-Added TiN Materials by the Combination of Double Self-Propagating High-Temperature Synthesis and Pulsed Electric-Current Pressure Sintering," Int. J. Appl. Ceram. Technol., 4 [2] 175-183 (2007).
[2] R. mevrel, C. Duret, R. Pichoir, "Pack cementation processes," Master Sci. Technol., 2 201-206 (1986).
[3] S. C. kung and R. A. Rapp, "Kinrtic Study of Aluminization of Iron by Using the Pack Cementation Technique," J. Electrochem. Soc.,
135 731-741 (1988).
[4] Z. D. Xiang, P. K. Datta, "Relationship between pack chemistry and aluminide coating formation for low-temperation aluminisation of alloy steels," Acta Materialla, 54 4453-4463 (2006).
[5] J. A. Hayns, Y. Zhang, K. M. Cooley, L. Walker, K. S. Reeves, and B. A. Pint, "High-temperature diffusion barriers for protective coating," Surf. Coat. Technol., 188-189 153-157 (2004).
[6] L. Levin, A. Ginzburg, L. Klinger, T. Werber, A. Katsman, and P. Schaaf, "Controlled formation of surface layers by pack aluminization," Surf. Coat. Technol., 106 209-213 (1998).
[7] Z. J. Liu, and Y. G. Shen, "Effects of Al content on grain growth of solid solution (Ti,Al)N Films," J. Vac. Sci. Technol., A24(1), Jan/Feb (2006).
[8] Ren Jiangwei, Li Yajiang, Feng Tao, "Microstructure characteristics in the interface zone of Ti/Al diffusion bonding," Materials Letters,
56 647-652 (2002).
[9] Wang Deqing, Shi Ziyuan, Teng Tingli, "Microstructure and oxidation of hot-dip aluminized titanium at high temperature," Applied Surface Science, 250 238-246(2005).
48
[10] L. Chang Holin Chang, Fu-Rong Chen, J. J. Kai, Eugene Tzov, Jianming Fu, Zheng Xu, J. Egermeier and Fu-Sen Chen, "High Resolution And Energy Filtering TEM Study Of Interfacial Structure And Reaction In Advanced Materials Processing," Acta Material., 46 2431-39 (1998).
[11] Annejan Bernard Kloosterman, "Surface modification of titanium with lasers," chapter 4 Laser nitriding of titanium, 13 (1998).
[12] J. C. Schuster and J. Bauer, "The Ternary System Titanium- Aluminum-Nitrogen," J. Solid State Chem., 53 [2] 260-65 (1984). [13] Chungen Zhou, Huibin Xu, Shengkai Gong, Kyoo Young Kim, "A
study of aluminide coatings on TiAl alloys by the pack cementation method," Materials Science and Engineering, A341 169-173 (2003). [14] J. L. Murray, "Phase Diagrams of Binary Titanium Alloys,"
ASM-International, Metals Park, Ohio, (1990).
[15] J.H. Wang L.M. Peng, H. Li, J.H. Zhao, L.H. He, "Synthesis and microstructural characterization of Ti–Al3Ti metal–intermetallic laminate (MIL) composites," Scripta Materialia, 52 243-48 (2005). [16] M. A. Pietzka, J. C. Schuster, "Phase Equilibria in the Quaternary
System Ti-Al-C-N," J. Am. Ceram. Soc., 79 [9] 2321 (1996).
[17] Y. Teng, S. Zhu, F. Zhang, M. Li, F. Wang, and W. Wu, "Electronic Structure, Lattice Constant, Optical and Mechanical Properties for NaCl-structured Ti-Al-N by Density Functional Theory," Physica,
B358 77-85 (2005).
[18] G.P. Cammarotw, A. Casagrande, G. Sambogna, "Effect of Ni, Si and Cr in the structural formation of diffusion aluminide coatings on commercial-purity titanium," Surface & Coatings Technology, 201 230-242 (2006).
49
[19] L. Hultman, "Thermal stability of nitride thin films," Vacuum, 57 1-30 (2000).
[20] P. Villars, A. Prince, H. Okamoto, "Handbook of ternary alloy phase diagrams," (1995).
[21] Y. M. Paransky, A. I. Berner, I. Y. Gotman, and E. Y. Gutmanas, "Phase Recognition in AlN-Ti System by Energy Dispersive
Spectroscopy and Electron Backscatter Diffraction," Mikrochim.
Acta., 134 171-177 (2000).
[22] F. Deschaux-Beaume, N. Fre´ty, T. Cutard, C. Colin, "Oxidation modelling of a Si3N4–TiN ceramic: Microstructure and kinetic laws," Ceramics International, 33 1331–1339 (2007).
[23] Yuan Qian Li, Tai Qiu and Jie Xu, "Effect of thermal oxidation treatment in air on the hydrolysis of AlN powder," Materials Research Bulletin, 32 [9] 1173-1179 (1997).
[24] D.P. Butt, D. Albert, T.N. Taylor, "Kinetics of thermal oxidation of silicon nitride powders," J. Am. Ceram. Soc., 79 [11] 2809–2814 (1996).
[25] F. Peni, J. Crampon, R. Duclos, "On the morphology and composition of the oxidized layer in Si3N4-based materials," Mater. Sci. Eng., A163 5–7 (1993).
[26] P. Kofstad, "High temperature corrosion," Elsevier Applied Science, 289–298 (1988).
[27] M. S. Chu and S. K. Wu, "Oxidation Behavior of Ti–50Al Intermetallic with Thin TiAl3 Film at 1000 oC," Oxidation of Metals,

![Table 3 Ti-Al-N 系統內各相之晶體結構及晶格常數 [32] 。 Phase Structure](https://thumb-ap.123doks.com/thumbv2/9libinfo/8559975.188456/64.1263.291.971.176.557/Table3TiAlN系統內各相之晶體結構及晶格常數32PhaseStructure.webp)
![Fig. 2-6. Ti-Al-N 三元相圖在 1200℃時的等溫截面圖[19]。](https://thumb-ap.123doks.com/thumbv2/9libinfo/8559975.188456/71.892.146.705.127.1052/Fig26TiAlN三元相圖在12℃時的等溫截面圖19.webp)