發藍光高分子材料的合成與性質研究及其在有機發光二極體的應用
136
0
0
全文
(2) 發藍光高分子材料的合成與性質研究及其在有機發光 二極體的應用 Synthesis and Characterization of Blue-Light-Emitting Polymers and their Applications in Organic Light-Emitting Diodes 研 究 生:陳 冠 宇. Student: Guan Yu Chen. 指導教授:許 慶 豐 博士. Advisor:Dr.Ching-Fong Shu. 國立交通大學 應用化學所 碩士論文. A Thesis Submitted to Department of Applied Chemistry College of Science National Chiao-Tung University in Partial Fulfillment of the Requirements for the Degree of Master in Applied Chemistry June 2005 Hsinchu, Taiwan, Republic of China. 中華民國 九十四 年 六 月.
(3) 發藍光高分子材料的合成與性質研究及其在有機發光二極體的應用. 研究生:陳 冠 宇. 指導教授:許 慶 豐. 博士. 國立交通大學應用化學研究所. 摘. 要. 本論文分為兩部分,分別針對兩種不同的聚茀高分子發光材料之合 成、性質與元件做討論。 在A 部分中, 我們合成出一具有螺結結構之poly(terfluorene), PTF.。在 螺結雙茀結構中,相互垂直的雙茀共軛部分藉由一個四級碳原子連接,因 此可有效地控制高分子的共軛長度。螺結結構的導入,使PTF具有良好的熱 穩定性,且有效抑制分子堆疊與激發複合體的產生。此處利用化合物B5掺混 入PTF中來調整元件光色,其元件之EL光譜圖在不同電壓下具有良好的穩 定性。 在B部分中,我們利用Suzuki coupling聚合反應,將含triphenylamine之 單體(化合物B3) 、 2,7-bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolane-2-yl)- 9,9 -dioctyl-fluorene (化合物B4)與2,7-dibromo-9,9-dioctylfluorene以不同比例合 成出一系列的高分支狀聚茀高分子衍生物。此處所合成出的高分支狀聚茀 高分子衍生物,對於一般有機溶劑具有良好的溶解度且易成膜。隨著化合 物B3導入的比例越高時,玻璃轉移溫度(Tg)由114℃提升至248℃,其Tg皆明 顯較POF(Tg = 75℃)高。此處所合成的高分支狀高分子,無論在光激發光或 電激發光皆具有良好的光色穩定性。. i.
(4) Synthesis and Characterization of Polymers for Organic Blue-Light-Emitting Polymers and their Application in Organic Light-Emitting Diodes. Student:Guan-Yu Chen. Advisor:Dr. Ching-Fong Shu. Department of Applied Chemistry National Chiao-Tung University. Abstract In part A, we have synthesized a spiro-linked poly(terfluorene), PTF. In the spiro-fused bifluorene segment, the two mutually perpendicular fluorene rings were connected via a common tetracoordinated carbon atom, which served as a conjugation interrupt to effectively control the conjugation length of the polymer. Attributed to the spiro structure, the polymer exhibited a very good thermal stability and suppress the formation of aggregating/excimers. B5 was doped into PTF to tune device color and the device exhibits stable EL spectra which are independent of applied voltages. In part B, a series of hyperbranched polyfluorene derivatives were prepared by Suzuki coupling copolymerization of a rigid triphenylamine-containing B3 monomer、2,7-bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolane-2-yl)-9,9-dioctylfluorene , or with 2,7-dibromo-9,9-dioctylfluorene. These hyperbranched polymers exhibited good solubility in common organic solvents as well as facile film forming properties. The glass transition temperature (Tg) of the hyperbranched polymer increases as the content of B3 monomer is increased, increased from 114 ℃ to 248 ℃,which are significantly higher than Tg of ii.
(5) polyfluorene homopolymer. The emissions of these hyperbranched polymers show good spectral stability upon either optical or electrical excitation.. iii.
(6) 謝誌. 時間過得很快,碩士班兩年的時間一轉眼就結束了,這些日子酸甜苦澀,有歡笑 也有淚水,如今一切都過去了,回想起來這兩年也出現了許多對我來說很重要的人。首 先,是我的指導教授許慶豐老師,雖然老師看起來很嚴肅,但這兩年來他教導我許多事 情,不管是實驗或是處事上,我都獲益良多。兩年過去了,在此要跟老師說聲:老師謝 謝您。同時,也感謝口試委員陳錦地教授與徐秀福教授在百忙之中費心審查此論文,也 給了我很多建議與指導。 在實驗室方面,感謝芳奕、惠真、弓箭手(桂如)、康哥等學長姐的幫助,每次遇到 問題請教學長姐,你們都熱心地給予指導與建議。也感謝我的同學大餅,每次我心情不 好的時候或遇到挫折,都能不斷鼓勵、安慰我,雖然大部分的時間,你好像都是在吐槽 我,我沒說錯吧!哈!。雅嫺同學也謝謝妳這兩年的幫助與扶持。接著是本實驗室最可愛 的學弟學妹們,不時提醒我要小心變胖而且會和我共鳴的冷翰、愛搞笑的川哥、貼心的 阿嚕咪,謝謝你們這些日子對我耍白痴舉動的包容,有你們真好。 除了實驗室的夥伴外,也謝謝樓上與隔壁實驗室的周小棟和月杏,感謝你們的包容 與不斷的鼓勵,和你們認識真的是一件很快樂的事,當然還有劍子仙竹(俊竹)、俊宏哥、 可愛的Tamama吳大、不愛參與團體活動所以實驗做不出來的老人、JC、跟我同鄉的淑媺、 自稱是張柏芝的淑慧學姐,每次都帶香噴噴牛角麵包來的立民。因為有你們讓我的研究 生活更加多彩多姿。 最後要感謝我的家人給予我的支持,不斷地給我鼓勵,讓我更有信心繼續走下去。 當然還有我的超強加油團隊,阿桂、玉容、鏗鏘、芬蕙師姑、穎駿師伯、慈青全體夥伴 們,在我最低潮的時候,謝謝你們陪我走過難過的時光,在此我要大聲的跟你們說," 我愛你們 "~~~~~在此僅以此論文獻給各位。. iv.
(7) 目. 錄. 中文摘要 ............................................................................................................................i 英文摘要 .......................................................................................................................... ii 謝誌 ..................................................................................................................................iv 目錄 ...................................................................................................................................v 圖目錄 ........................................................................................................................... viii 表目錄 ...............................................................................................................................x 附圖目錄 ..........................................................................................................................xi. A 部份 第一章. 序論 .............................................................................................................1. 1-1. 前言................................................................................................................1 1-2. 有機發光二極體的發光原理及元件結構....................................................1 1-3. 高分子有機發光二極體的發展....................................................................3 1-3-1. 有機發光二極體的起源與發展.......................................................4 1-3-2. 高分子發光材料簡介.......................................................................5 1.4. 研究動機 ......................................................................................................10. 第二章. 實驗 ...........................................................................................................11. 2-1. 藥品..............................................................................................................11 2-2.. 使用儀器.....................................................................................................13. 2-3. 合成部份......................................................................................................15 第三章. 結果與討論 ...............................................................................................25. 3-1.. 合成部份 ....................................................................................................25. 3-2.. 物理性質 ....................................................................................................27 3-2-1.. GPC測量..........................................................................................27. 3-2-2.. DSC和TGA測量..............................................................................27 v.
(8) 3-2-3. 3-3.. 溶解度測試......................................................................................29. 光學性質 ....................................................................................................31 3-3-1.. PTF之UV-vis吸收光譜與PL放射光譜 ..........................................31. 3-3-2.. 量子效率測量..................................................................................32. 3-4.. 電化學性質-氧化還原電位量測...............................................................33. 3-5.. 薄膜熱穩定性測量 ....................................................................................36. 3-6.. 元件電激發光性質 ....................................................................................37. 第四章. 3-6-1.. PTF元件電激發光性質...................................................................37. 3-6-2.. B5掺混在PTF中(5wt.%)元件電激發光性質 .................................39. 結論 ...........................................................................................................44. B 部份 第一章. 序論 ...........................................................................................................45. 1-1. 前言..............................................................................................................45 1-2. 高分支狀高分子之簡介..............................................................................45 1-2-1. 高分支狀高分子於高分子發光材料之應用..............................47 1-3. 研究動機......................................................................................................48 第二章. 實驗 ...........................................................................................................50. 2-1. 藥品..............................................................................................................50 2-2. 合成部份......................................................................................................51 第三章. 結果與討論 ...............................................................................................58. 3-1.. 合成部份 ....................................................................................................58. 3-2.. 物理性質 ....................................................................................................60. 3-3.. 3-2-1.. GPC測量..........................................................................................60. 3-2-2.. DSC和TGA測量..............................................................................60. 3-2-3.. 溶解度測試......................................................................................65. 光學性質 ....................................................................................................66 3-3-1. Hy-10、Hy-20與Hy-50之UV-vis吸收光譜與PL放射光譜 ..........64 3-3-2.. 量子效率測量..................................................................................69 vi.
(9) 3-4.. 電化學性質-氧化還原電位量測...............................................................70. 3-5.. 薄膜熱穩定性測量 ....................................................................................74. 3-6. 元件電激發光性質......................................................................................77 第四章. 結論 .............................................................................................................82. 參考文獻 .........................................................................................................................83. vii.
(10) 圖. 目. 錄. 圖 A-1. 光激發光原理示意圖 .........................................................................................2 圖 A-2. 有機光二極體元件結構 .....................................................................................3 圖 A-3. 電激發光原理示意圖 .........................................................................................3 圖 A-4. PPV衍生物及其發光範圍..................................................................................6 圖 A-5. PTs衍生物及其發光範圍 ...................................................................................7 圖 A-6. PPP之結構圖 ......................................................................................................7 圖 A-7. PF之結構圖.........................................................................................................8 圖 A-8. PF之共聚物及其發光範圍.................................................................................9 圖 A-9.含螺結結構之聚茀高分子衍生物 ....................................................................10 圖 A-10. PTF之DSC圖 ..................................................................................................28 圖 A-11. PTF之TGA圖..................................................................................................29 圖 A-12. PTF其薄膜與溶劑狀態之吸收及放射光譜 ..................................................31 圖 A-13. PTF溶液態之CV圖 ........................................................................................35 圖 A-14. PTF薄膜熱穩定性比較 ..................................................................................36 圖 A-15. PT製成元件之L-V-I圖,內插:電壓為7V下之EL圖 .................................38 圖 A-16. B5、PF與PTF的吸收/放射光譜....................................................................40 圖 A-17. B5以5wt.%掺雜在PTF與PF中之EL光譜圖..................................................41 圖 A-18. 不同電壓下之EL圖 .......................................................................................42 圖 A-19. 分別以PTF及PF當作主發光體所製成元件的效率與亮度對電流密度 作圖 ...................................................................................................................43 圖 B-1. 三次元結構的高支鏈聚合物其分子型態 ......................................................46 圖 B-2. Hyperbranch polymer之反應流程圖 ................................................................48 圖 B-3.薄膜熱穩定性測試 ............................................................................................48 圖 B-4. Hy-10之DSC圖 .................................................................................................62 圖 B-5. Hy-20之DSC圖 .................................................................................................62 圖 B-6. Hy-50之DSC圖 .................................................................................................63 圖 B-7. Hy-10之TGA圖.................................................................................................63 viii.
(11) 圖 B-8. Hy-20之TGA圖.................................................................................................64 圖 B-9. Hy-50之TGA圖.................................................................................................64 圖 B-10. Hy-10其薄膜與溶液狀態之吸收及放射光譜 ...............................................67 圖 B-11. Hy-20其薄膜與溶液狀態之吸收及放射光譜 ...............................................68 圖 B-12. Hy-50其薄膜與溶液狀態之吸收及放射光譜 ...............................................68 圖 B-13. Hy-10之CV圖 .................................................................................................72 圖 B-14. Hy-20之CV圖 .................................................................................................72 圖 B-15. Hy-50之CV圖 .................................................................................................73 圖 B-16. POF薄膜熱穩定性比較..................................................................................75 圖 B-17. Hy-10薄膜熱穩定性比較 ...............................................................................75 圖 B-18. Hy-20薄膜熱穩定性比較 ...............................................................................76 圖 B-19. Hy-50薄膜熱穩定性比較 ...............................................................................76 圖 B-20. Device I在不同電壓下之EL圖.......................................................................78 圖 B-21. Device II在不同電壓下之EL圖 .....................................................................79 圖 B-22. Device III在不同電壓下之EL圖 ....................................................................79 圖 B-23. Device I之L-V-I圖 ..........................................................................................80 圖 B-24. Device II之L-V-I圖.........................................................................................80 圖 B-25. Device III之L-V-I圖........................................................................................81. ix.
(12) 表. 目. 錄. 表 A-1. PTF之分子量 ....................................................................................................27 表 A-2. PTF之DSC與TGA的數據分析表 ....................................................................28 表 A-3. PTF之溶解度測試 ............................................................................................30 表 A-4. PTF之量子效率 ................................................................................................32 表 A-5. PTF的氧化還原電位及HOMO、LUMO ........................................................34 表 A-6. ITO/PEDOT/PTF(50~70nm)/TPBI/Mg:Ag(1:10)/Ag在電流密度20mA/cm2 與100mA/cm2的元件效率................................................................................38 表 B-1. Hy-10、Hy-20與Hy-50之分子量 ....................................................................60 表 B-2. Hy-10、Hy-20與Hy-50之DSC與TGA的數據分析表.....................................61 表 B-3. Hy-10、Hy-20與Hy-50之溶解度測試.............................................................65 表 B-4. Hy-10、Hy-20與Hy-50之UV-vis吸收與PL放射量測表 ................................67 表 B-5. Hy-10、Hy-20與Hy-50之量子效率.................................................................69 表 B-6. Hy-10、Hy-20與Hy-50薄膜態的氧化還原電位及HOMO、LUMO.............71 表 B-7. Device I、Device II與Device III之元件特性 ..................................................81. x.
(13) 附. 圖. 目. 錄. 附圖 1. 2-Iodobiphenyl,化合物1的1H-NMR光譜圖..................................................87 附圖 2. 2-Iodobiphenyl,化合物1的13C-NMR光譜圖.................................................88 附圖 3. 2-Iodobiphenyl,化合物1的Mass圖 ................................................................89 附圖 4. 9,9’-Spirobifluorene,化合物2的1H-NMR光譜圖..........................................90 附圖 5. 9,9’-Spirobifluorene,化合物2的13C-NMR光譜圖.........................................91 附圖 6. 9,9’-Spirobifluorene,化合物2的HRMS圖 .....................................................92 附圖 7. 2,2-di(2-ethylhexanoyl)-9,9’-spirobifluorene,化合物3的1H-NMR光譜圖 ...........................................................................................................................93 附圖 8. 2,2-di(2-ethylhexanoyl)-9,9’-spirobifluorene,化合物3的13C -NMR光譜圖 ...........................................................................................................................94 附圖 9. 2,2-di(2-ethylhexanoyl)-9,9’-spirobifluorene,化合物3的HRMS光譜圖 ...........................................................................................................................95 附圖 10. 2,2-di(2-ethylhexyl)-9,9’-spirobifluorene,化合物4的1H-NMR光譜圖 ...........................................................................................................................96 附圖 11. 2,2-di(2-ethylhexyl)-9,9’-spirobifluorene,化合物4的13C -NMR光譜圖 ...........................................................................................................................97 附圖 12. 2,2-di(2-ethylhexyl)-9,9’-spirobifluorene,化合物4的HRMS光譜圖 ...........................................................................................................................98 附圖 13. 2,2’-dibormo-7,7-di(2-ethylhexyl)-9,9’-spirobifluorene,化合物5 的1H-NMR光譜圖 ............................................................................................99 附圖 14. 2,2’-dibormo-7,7-di(2-ethylhexyl)-9,9’-spirobifluorene,化合物5 的13C -NMR光譜圖 ........................................................................................100 附圖 15. 2,2’-dibormo-7,7-di(2-ethylhexyl)-9,9’-spirobifluorene,化合物5 的HRMS光譜圖..............................................................................................101. xi.
(14) 附圖 16. 2,2’-bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-7,7-di(2-ethyl -hexyl)-9,9’-spirobifluorene,化合物6的1H-NMR光譜圖 ......................... 102. 附圖 17. 2,2’-bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-7,7-di(2-ethyl -hexyl)-9,9’-spirobifluorene,化合物6的13C-NMR光譜圖 ..........................103 附圖 18. 2,7-dibromo-9,9’-spirobifluorene,化合物7的1H-NMR光譜圖 .................104 附圖 19. 2,7-dibromo-9,9’-spirobifluorene,化合物7的13C-NMR光譜圖 ................105 附圖 20. 2,7-dibromo-9,9’-spirobifluorene,化合物7的Mass光譜圖 .......................106 附圖 21. PTF的1H-NMR光譜圖..................................................................................107 附圖 22. PTF的13C-NMR光譜圖 ................................................................................108 附圖 23. 2-bromofluorenone,化合物B1的1H-NMR光譜圖.....................................109 附圖 24. 2-bromofluorenone,化合物B1的13C-NMR光譜圖....................................110 附圖 25. 2-bromofluorenone,化合物B1的Mass圖 ...................................................111 附圖 26. 2-bromo-9-phenyl-9H-fluoren-9-ol,化合物B2的1H-NMR光譜圖............112 附圖 27. 2-bromo-9-phenyl-9H-fluoren-9-ol,化合物B2的13C-NMR光譜圖...........113 附圖 28. 2-bromo-9-phenyl-9H-fluoren-9-ol,化合物B2的Mass圖..........................114 附圖 29. Tris-[4-(2-bromo-9-phenyl-9H-fluoren-9-yl)-phenyl]-amine,化合物B3 的1H-NMR光譜圖.........................................................................................115 附圖 30. Tris-[4-(2-bromo-9-phenyl-9H-fluoren-9-yl)-phenyl]-amine,化合物B3 的13C-NMR光譜圖 .......................................................................................116 附圖 31. Hy-10的1H-NMR光譜圖..............................................................................117 附圖 32. Hy-10的13C-NMR光譜圖 ............................................................................118 附圖 33. Hy-20的1H-NMR光譜圖..............................................................................119 附圖 34. Hy-20的13C-NMR光譜圖 ............................................................................120 附圖 35. Hy-50的1H-NMR光譜圖..............................................................................121 附圖 36. Hy-50的13C-NMR光譜圖 ............................................................................122. xii.
(15) A 部分 含 9,9’-螺結雙茀結構的高分子發光材料之合成 與元件性質的研究. 第一章. 序論. 1-1. 前言 隨著人類生活水準的不斷提升,許多的高科技產品例如:手機、 電腦、電視等幾乎是我們日常生活中不可或缺的物品。市場的需求量 也因此相對地提高,而許多電子產品都需透過顯示器來做為操作這些 物件的界面,消費者對於顯示器的要求也隨著時代的進步而更加嚴 苛。為此,許多的科技公司或學術研究人員也積極地在做相關的研究 與開發,尤其是近年來相當熱門的有機電激發光二極體(Organic Light Emitting Diodes;簡稱 OLED)。 有機電激發光二極體發展十分迅速,主要是因為有許多大廠商投 入研究開發,另一個原因則是有機電激發光二極體具有高應答速度、 省電、無視角限制、可全彩化及廣泛的使用溫度等優點。. 1-2. 有機發光二極體的發光原理及元件結構 分子經由照光而吸收能量後,位於最高填滿軌域(highest occupied molecular orbital, HOMO) 的 電 子 躍 遷 至 最 低 未 填 滿 軌 域 (Lowest 1.
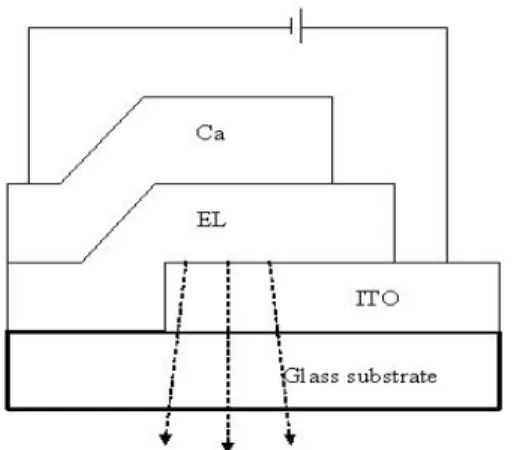
(16) unoccupied molecular orbital, LUMO)形成單態激子。當電子從 LUMO 回 到 HOMO 以 光 之 形 式 釋 放 出 能 量 , 此 稱 為 光 激 發 光 (Photoluminescence, PL)。. 圖 A-1. 光激發光原理示意圖 常見的有機電激發光二極體的結構為一類似三明治之型態,如圖 A-1.所示,正負極間夾有一層或是多層的有機發光材料,在操作電壓 的驅動下,從正極(一般使用具高功函數的 ITO,即 Indium Tin Oxide 或導電玻璃)注入電洞到有機發光材料之 HOMO 能階中,而負極(一 般為具低功函數的金屬,如:Al、Mg、Ca)則注入電子到有機發光材 料之 LUMO 能階中,電子、電洞在發光層中相向移動,當 LUMO 能 階上的電子遇上 HOMO 能階上的電洞時,電子與電洞在發光層中再 結合,其能量以光的形式釋放出來,且此能差大小正好在可見光範圍 內,人眼即可透過透明的 ITO 玻璃看到此有機發光材料的螢光放射行 為,此即稱為電激發光(Electroluminescence, EL)。 2.
(17) 圖 A-2. 有機發光二極體元件結構. 圖 A-3. 電激發光原理示意圖. 1-3. 高分子有機發光二極體的發展 發光二極體(LED)的研究主要分為兩種,以小分子為主的稱為 OLED (Organic Light-Emitting Diode)1-4;而以共軛高分子為主則稱為 PLED (Polymer Light-Emitting Diode)5-8,兩者各有其優缺點。有機小 分子易純化、易製備,其螢光效率也較高,但由於小分子導電性較差, 3.
(18) 因此需使用較高的操作電壓,且部分具結晶性的小分子容易因為高操 作電壓而產生結晶,加速元件衰敗。共軛高分子具良好的成膜性,高 熱穩定性、可大面積化及可撓曲特性等優點,且元件所發之光色可透 過化學方法改質高分子材料之結構及取代基之選擇來調整,可涵蓋整 個可見光範圍。小分子的成膜方式主要以熱蒸鍍的方式形成薄膜,但 對於部分熱穩定性較差之材料是相當不利的,而共軛高分子主要是以 旋轉塗佈(spin coating)或浸塗法(dip coating)來製作高分子薄膜,與小 分子的成膜方式相較之下,高分子的成膜製程較簡易、快速且成本也 較低。. 1-3-1.有機發光二極體的起源與發展 1963 年 9:有機發光二極體的研究主要是源自於 1963 年 Pope 等人以 anthracence 為發光材料製成半導體,但因它所需的驅動電壓太高,因 此當時發表時並未受到重視。. 1987 年. 10. :Tang 和 Van Slyke 發表了利用 tri(8-hydroxyquinoline). aluminum (AlQ3)真空蒸鍍並製成結構為 ITO/diamine/AlQ3/Mg:Ag 之 元件,其在低於 10 V 的電壓下操作可達 1000 cd/cm2 的亮度,且元件 效能有大幅的改進,因此有機發光二極體從此開始才逐漸受到重視。. 1990 年 11:英國劍橋大學發表了其 PLED 的研究,利用 PPV 作為發 4.
(19) 光材料,並製成結構為 ITO/PPV/Ca 的元件,外部量子效率為 0.05%, 此研究也帶動了 PLED 的研究熱潮。. n. PPV 1991 年 5:Heeger 等人合成出 MEH-PPV,主要是在高分子側鏈上增 加立體阻礙而解決原本 PPV 溶解度不佳的問題,也使得其在元件製 程上獲得改善,進而提升應用性。. O. n MeO. MEH-PPV 1-3-2. 高分子發光材料簡介 由於 PLED 可應用在較大面積的平面顯示器上,因此它的發展與 研究相當受囑目。要發展一個全彩的平面顯示器,勢必需要使用紅、 藍、綠三種發光材料,目前紅光與綠光高分子材料製成元件後都有不 錯的效率,而藍光高分子材料由於其能階差較大,需要較高的驅動電 壓,所以要得到一個高穩定度、高亮度及量子效率佳的藍光高分子仍. 5.
(20) 是一個挑戰。以下就幾種較常見的高分子發光材料來作簡單的介紹: 1-3-2-1. Poly(p-phenylene vinylenes);PPV PPV 是第一個被應用在電激發光的高分子材料 11,但沒取代基的 PPV 溶解度差,造成在製程上的不便,因此利用側鏈的導入來改善其 溶解度不佳的問題。此外,導入的側鏈基團也可用來改變其有效共軛 長度,進而得到不同光色的 PPV 衍生物 12-20。. CH3. n. OC8H17. n. yellow green (550nm). H3C. green (520nm). n X. X=Cl or Br red (610-620nm). OCH3. X O. n H3CO. n. yellow-green (535-580nm). MeO. yellow-orange (580nm). n X. X=F (600nm) X=Cl (580nm) X=Br (560nm). 圖 A-4. PPV 衍生物及其發光範圍 1-3-2-2. Polythiophenes;PTs PTs 之衍生物其光色範圍比 PPV 還要寬,可由藍光到紅光,但由 於它的螢光效率不佳,因此限制了其應用性。其相關衍生物及其光色 表現如圖 A-5.所示 21-26。. 6.
(21) C8H17. C8H17. S. H3C. S. n. blue (460nm). n. blue (460nm). C8H17. S S S. n. n C8H17. green. green. (555nm). (530nm) C8 H17 R. S. S. n. red. n. R=C22 H45 R=C8H17 R=C6H13. R=C10 H20OMe R=CO2H6H13 R=CO2H8H17. red. yellow-orange. 圖 A-5. PTs 衍生物及其發光範圍 1-3-2-3. Poly(p-phenylene);PPP PPP 擁有較大的能階差,因此早期被用來作為一藍光高分子材 料,其結構主要以苯環為重複單位所構成的高分子如圖 A-6.所示。 R. n. n R. (a). (b). 圖 A-6. PPP 之結構圖. 7.
(22) 但是它的溶解度不佳,因此為了能增進溶解度,便在苯環上導入側鏈 基,確實也改善其溶解度不佳的問題,但是部分 PPP 高分子之衍生 物也因側鏈基團的導入,使得其共軛主鏈產生嚴重扭曲,造成共軛度 降低而使發光效率不佳 27。 1-3-2-4. Polyfluorene;PF PF 的結構如圖 A-7.所示,由於其擁有較大的能階差,因此可用 於藍光發光材料之應用。. n. 圖 A-7. PF 之結構圖 polyfluorene 屬於一種堅硬棒狀(rigid-rod)的高分子。其重覆單位的結 構是由共平面的雙苯環(biphenyl)所構成,且經由碳-9 的位置連接此 雙苯環結構,確保雙苯環間之高度共軛. 28. 。PF 具有良好的溶解度、. 熱穩定性且量子效率佳等優點,也可與其他的高分子形成共聚物,發 展出不同光色的高分子材料,其衍生物 29 如圖 A-8.所示. 8.
(23) C8H17. C8H17 S S. n. green (548nm). NC. C8H17. CN. C8H17. n. OR. RO. R=(CH2 )11CH3 red (641nm). 圖 A-8. PF 之共聚物及其發光範圍 雖然 PF 具有許多優點,但是當它在高電壓或高溫下操作,會產 生一較長波長之放射,此現象主要是因為分子在高壓或高溫時,易發 生分子堆疊或形成激發複合體。為解決此缺點,許多學者開始投入相 關之研究,而主要則是對於茀的碳-9 位置上進行修飾。 文獻中已發表許多利用螺結結構來對高分子進行修飾 30-31。如圖 A-9.所示,為 Heeger 所發表之文獻 31,主要是利用含雙茀螺結結構 之單體與茀進行共聚反應。其結果顯示螺結結構之導入確實可抑制在 較長波長之放光產生,且由於螺結結構導入,使高分子材料之結構較 為剛硬,並有效提升其熱穩定性。. 9.
(24) n. R. R. R= C6H13 C8H 17. 圖 A-9. 含螺結結構之聚茀高分子衍生物. 1-4. 研究動機 雖然 polyfluorene 具高螢光量子效率,也有不錯的化學穩定性, 但當它在高電壓或是高溫下操作,會產生一較長波長之放射,主要是 因為分子在高電壓或高溫時,發生分子堆疊(aggregate)或形成激發複 合體(excimer)的現象,因而影響光色純度。在本篇論文研究中,我們 在 fluorene 碳-9 位置引入一 9,9’-螺結雙茀結構;在此螺結結構中,雙 茀共軛的部分被一個四級碳以 σ 鍵連結而相互垂直。此種分子構造, 可以降低分子鏈間的交互作用,而高分子的共軛也因此四級碳的 σ 鍵 中斷,使得分子的共軛長度可有效被控制 32。此外,也可加強其分子 鏈的剛硬度,提升高分子的熱穩定性。而這種相互垂直的結構,亦可 抑制分子鏈的堆疊,減少激發複合體的形成。為了使高分子具良好的 溶解度,我們則在碳-7 的位置導入 2-ethylhexyl 的長碳鏈,以提升高 分子之溶解度。. 10.
(25) 第二章 實驗 2-1.藥品. 2-Aminobiphenyl. 購自. TCI. Sodium nitrite. 購自. SHOWA. Sodium iodide. 購自. SHOWA. Sodium thiosulfate. 購自. SHOWA. Magnesium. 購自. Aldrich. 9-fluorenone. 購自. Across. Aluminium chloride. 購自. Merk. Hydrazine hydrate. 購自. Lancaster. Diethylene glycol. 購自. Across. Iron chloride. 購自. Lancaster. Aliquat®336. 購自. Lancaster. Tetrakis(triphenylphosphine) Palladium. 購自. Lancaster. Benzeneboronic acid. 購自. Lancaster. Bromobenzene. 購自. Lancaster. 上述所列藥品,不純化直接使用。THF 及乙醚經過鈉、鉀合金及. 11.
(26) benzophenone 的 除 水 蒸 餾 , 其 餘 皆 購 自 於 Merck 、 Aldrich 、 Mallickrodt、Fisher Scientific、聯工等公司。. 12.
(27) 2-2. 使用儀器 2-2-1. 核磁共振光譜儀 (NMR) 使用 Varian Unity-300 MHz 核磁共振光譜儀、Bruker-DRX-300 MHz 核磁共振光譜儀。 2-2-2. 質 譜 儀 (Mass Spectroscopy) 與 元 素 分 析 儀 (Elemental Analysis) 使用交大貴儀的 T-200 GC-Mass,以 EI 或 FAB 為游離方法。以 及清大貴儀中心的 JEOL JMS-HX 110 Mass Spectrometer (高效能質譜 儀)。元素分析儀 ( EA )為交大的 HERAEUS CHN-OS RAPID。 2-2-3. 薄層色層分析法 (TLC) 使用 Merck 製造的 5554 DC Silica Gel 60 F254 型鋁製薄片。 2-2-4. 管柱層析法 使用 Merck 製造的 7734 Kieselgel 60 (60~230 mesh ASTM) 型矽 膠。 2-2-5. 微差掃描卡計(Differential Scanning Calorimetry, DSC) 使用 Du Pont TA 2000 及 Computer/Thermal Analyzer。測試方式 為:量取 5~10 毫克的樣品裝入鋁製的 cell 中,在通入氮氣為 50 mL/min 下,做數階段式升溫 DSC 測試。 2-2-6. 熱重量分析儀(Thermogravimetric Analysis, TGA). 13.
(28) 使用 Du Pont Instrument TGA 2950 儀器,測試方法為取 5~10 毫 克的樣品裝入鉑製的 cell 中,在通入氮氣流速為 60 mL/min 下,由 30 ℃至 900 ℃以每分鐘 10 ℃升溫速率,來分析裂解之情形。 2-2-7. 凝膠滲透層析儀(GPC) 使 用 Waters 410 Differential Refractometer , Waters 600 Controller,和 Waters 610 Fluid Unit,管柱為 Waters Styragel Column, 以 Polystyrene 當標準品,THF 為沖提液,樣品濃度為 2 mg/1 mL THF, 流速為 1 mL/min,column 溫度設定為 45 ℃。 2-2-8. 吸收光譜儀 (UV/vis) 使用 HP-8453 光譜分析儀。 2-2-9. 螢光儀 (Fluroescence Spectroscopy) 使用 Hitachi F-4599 的螢光儀。 2-2-10. 循環伏特安培計 (CV) 使用美國 Bioanalytical Systems Inc. 電化學分析儀,型號 100B,序 號 930。 2-2-11. 真空薄膜蒸鍍機 ( Vacuum Coater ) TRC 18 吋旋轉式 coater,含六個機板,兩個機動光罩,八個電熱 坩鍋,五個震盪感應器,IC-5 膜厚控制儀及 diffusion pump。. 14.
(29) 2-3 合成部分 1. 2-Iodobiphenyl,化合物 A1 在冰浴下,將鹽酸(48 mL)、蒸餾水(240 mL)、與 2-aminobiphenyl (30.0 g, 177 mmol)加入燒杯中攪拌溶解。將亞硝酸鈉(13.5 g, 193 mmol)溶於蒸餾水(240 mL)中,並置入加液漏斗中,使其緩緩滴入反 應燒杯,在室溫下攪拌反應 1 小時。將碘化鉀(58.8 g, 354 mmol)溶解 在蒸餾水(600 mL)中,置入加液漏斗後,使其緩緩滴入反應燒杯,攪 拌反應 24 小時。以乙酸乙酯(200 mL x 3)萃取反應液,取有機層,以 硫代硫酸鈉水溶液清洗,萃取,再收集有機層。加入硫酸鎂除水、過 濾、濃縮。以減壓蒸餾的方式純化,得 29.3 g,產率 59%。. I. A1 1. H NMR(300 MHz, CDCl3):δ 7.94 (dd, 1H, J = 8.0, 1.4 Hz), 7.28~7.44. (m, 7H), 7.0 2(td, 1H, J = 7.3, 1.8 Hz) (附圖 1) 13. C NMR(75 MHz, CDCl3):δ 140.6, 144.1, 139.4, 130.0, 129.2, 128.7,. 128.1, 127.9, 127.6, 98.6 (附圖 2) GC-MS(m/e):280(M+) (附圖 3). 15.
(30) 2. 9,9’-Spirobifluorene,化合物 A2 取鎂片(2.87 g, 118 mmol)置入三頸瓶,在氮氣系統下,加入無水 乙醚(75 mL)。將化合物 A1 (31.5 g, 113 mmol)以無水乙醚(50 mL)稀釋 後置入加液漏斗中,並使其緩緩滴入反應,在室溫下攪拌反應 1 小 時。將 9-fluorenone (19.3 g, 107 mmol)置入固態加料漏斗,並緩緩加 入反應中,待完全加入後,再加入無水乙醚(180 mL)。將反應溫度升 至 50℃,攪拌反應 12 小時後,加入氯化氨水溶液中和,以乙醚(50 ml x 3)萃取,取有機層,加入硫酸鎂除水、過濾、濃縮。以正己烷清洗 固體,過濾得白色固體。將形成之產物及醋酸(100 mL)置入三頸瓶 中,加熱至 135℃使固體完全溶解,攪拌 10 分鐘後移去熱源,滴入 2~3 滴濃鹽酸於反應瓶後,再將反應繼續加熱至沸騰,攪拌反應 30 分鐘。移去熱源,使反應靜置並將反應溫度回至室溫後,會有白色固 體析出,過濾得固體,以正己烷沖洗,抽乾,得產物 18.9 g,產率 97%。. A2 1. H NMR(300 MHz, CDCl3):δ 7.84 (dd, 4H, J = 7.7, 1.1 Hz), 7.35 (td,. 4H, J = 7.6, 1.0 Hz), 7.09 (td, 4H, J = 7.4, 1.0Hz ), 6.72 (dt, 4H, J = 7.6,. 16.
(31) 0.9 Hz) (附圖 4) 13. C NMR(75 MHz, CDCl3):δ 148.7, 141.7, 127.8, 127.7, 124.01, 120.0,. 65.9 (附圖 5) HRMS[M++H] calcd. for C25H16 316.1252;found 316.1250. (附圖 6) Anal. Calcd for C25H16: C, 94.90; H, 5.10. Found: C, 94.70; H, 5.27.. 3. 2,2-di(2-ethylhexanoyl)-9,9’-spirobifluorene,化合物 A3 取 AlCl3 (5.60 g, 42.0 mmol)、化合物 A2(2.00 g, 6.32 mmol)、CS2 (30 mL) 置 入 三 頸 瓶 中 , 在 氮 氣 系 統 下 攪 拌 10 分 鐘 。 再 取 2-ethylhexanoyl chloride (2.40 ml, 13.9 mmol)置入加液漏斗,以 CS2(12 mL)稀釋後緩緩滴加入反應中。攪拌反應 2 小時後,以冰浴將反應溫 度降至 0℃並加入水(40 mL)與 6N 鹽酸水溶液(10 mL)攪拌 5 分鐘。以 二氯甲烷(50 mL x 3)萃取,取有機層,加入硫酸鎂除水,過濾,濃縮, 以三氯甲烷及正己烷進行再結晶,得白色固體 2.10 g,產率 58%。. O O. A3 17.
(32) 1. H NMR(300 MHz, CDCl3):δ 8.00 (dd, 2H, J = 6.8, 1.2 Hz), 7.90 (dd,. 4H, J = 8.0, 3.2 Hz), 7.39 (tt, 2H, J = 7.5, 0.9 Hz), 7.30 (s, 2H), 7.15 (tt, 2H, J = 7.5, 0.9 Hz), 6.71 (d, 2H, J = 7.5 Hz), 3.14~3.18 (m, 2H), 1.59~1.66 (m,. 4H), 1.31~1.46 (m, 4H), 1.07~1.94 (m, 8H), 0.71~0.66. (m,6H) (附圖 7) 13. C NMR(75 MHz, CDCl3):δ 203.7, 149.2, 148.5, 146.4, 140.5, 137.1,. 129.1, 128.8, 128.2, 124.1, 123.9, 121.0, 120.0, 65.9, 47.4, 31.7, 29.6, 25.2, 22.8, 13.8, 11.8 (附圖 8) HRMS[M++H] calcd. for C41H44O2 568.3341;found 568.3342 (附圖 9) Anal. Calcd for C41H44O2: C, 86.58; H, 7.80. Found: C, 86.97; H, 7.84.. 4. 2,2-di(2-ethylhexyl)-9,9’-spirobifluorene,化合物 A4 取化合物 A3(2.00 g, 3.52 mmol), diethylene glycol (80 mL),氫 氧化鉀(4.74 g, 84.5 mmol),N2H4 (4.28 mL, 137 mmol)。在氮氣系統 下,加熱至 190℃,攪拌反應 36 小時。降溫後,加入蒸餾水(50 ml) 並以二氯甲烷(50 mL x 4)萃取,取有機層,加入硫酸鎂除水,過濾, 濃縮。以正己烷進行管柱層析,得 1.64 g,產率 86%。. 18.
(33) A4 1. H NMR(300 MHz, CDCl3):δ 7.78 (d, 2H, J = 7.8Hz), 7.72 (d, 2H, J =. 7.8 Hz), 7.31 (t, 2H, J = 7.2 Hz), 7.13 (d, 2H, J = 8.1 Hz), 7.03 (t, 2H, J = 7.5 Hz), 6.67 (d, 2H, J = 7.8 Hz), 6.49 (s, 2H), 2.29~2.39 (m, 4H), 1.36~1.38 (m, 2H), 1.07~1.17 (m, 16H), 0.69~0.75 (m, 12H) (附圖 10) 13. C NMR(75 MHz, CDCl3):δ 149.4, 149.2, 142.1, 142.0, 139.6, 128.9,. 127.7,127.5, 125.0, 124.2, 119.8, 119.7, 66.0, 41.3, 40.4, 32.3, 28.9, 25.8, 23.1, 14.3, 11.0 (附圖 11) HRMS[M++H] calcd. for C41H48 540.3756;found 540.3759 (附圖 12) Anal. Calcd for C41H48: C, 91.05; H, 8.95. Found: C, 91.29; H, 8.95.. 5. 2,2’-dibormo-7,7-di(2-ethylhexyl)-9,9’-spirobifluorene,化合物 A5 取化合物 A4(1.20 g, 2.22 mmol)置入三頸瓶中,並加入二氯甲烷 (30 mL)與氯化鐵(37 mg) 。將反應瓶置入冰浴中,另抽取溴水(0.23 mL, 4.55 mmol)以二氯甲烷(20 mL)稀釋置入加液漏斗中,使其緩緩滴. 19.
(34) 加入反應,待完全滴入後,移去冰浴。攪拌反應 4 小時後,加入硫代 硫酸鈉水溶液(50 mL),攪拌反應 30 分鐘。以乙酸乙酯(50 mL x 3)萃 取,取有機層,加入硫酸鎂除水,過濾,濃縮。以正己烷進行管柱層 析,得 1.12 g,產率 72%。. Br. Br. A5 1. H NMR(300 MHz, CDCl3):δ 7.68 (dd, 2H, J = 7.5, 1.2 Hz), 7.63(d, 2H,. J = 8.1 Hz), 7.45 (dd, 2H, J = 8.3, 2.0 Hz), 7.15 (dt, 2H, J = 7.8, 1.4 Hz), 6.77 (d, 2H, J = 1.8Hz), 6.46 (s, 2H), 2.90~3.43 (m, 4H), 1.37 (s, 2H), 1.08~1.18 (m, 16H), 0.70~0.75 (m,6H) (附圖 13) 13. C NMR(75 MHz, CDCl3):δ 150.3, 147.9, 142.7, 140.8, 138.2, 130.9,. 129.2, 127.1, 124.8, 121.0, 120.8, 119.7, 65.4, 41.0, 40.1, 32.1, 28.6, 25.6, 22.9, 14.0, 10.8 (附圖 14) HRMS[M++H] calcd. for C41H46Br2 696.1966;found 696.1973 (附圖 15). 6. 2,2’-bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-7,7-di(2-ethyl -hexyl)-9,9’-spirobifluorene,化合物 A6 20.
(35) 將化合物 A5(370 mg, 0.53 mmol)置入三頸瓶中,以氮氣系統與真 空系統抽灌三次,加入無水 THF(10 mL),另取 n-BuLi(0.82 mL, 2.45 mmol)置入加液漏斗中。將反應溫度降至-78℃後,將 n-BuLi 緩緩滴 入反應,待完全滴入後使反應自然回溫,攪拌反應 30 分鐘。再將反 應溫度降至-78℃,取 B(OBu)3(0.33 mL, 1.22 mmol)快速加入反應中, 自然回溫下攪拌反應 12 小時。將反應液倒入 2M 鹽酸水溶液(30 mL),於室溫下攪拌 4 小時。以乙醚(50 mL x 3)萃取,加入硫酸鎂除 水,過濾,濃縮。將所得之混合物置入 50 mL 三頸瓶中,並加入 pinacol(188 mg, 1.59 mmol)與苯(17 mL)以 Dean-stark trap 裝置加熱迴 流 12 小時。將反應液以減壓濃縮機移除溶劑,以正己烷進行再結晶, 得 226 mg,產率 54%。. O B O O B O. A6 1. H NMR(300 MHz, CDCl3):δ 7.81 (d, 2H, J = 7.8 Hz), 7.77 (d, 2H, J =. 7.5 Hz), 7.73 (d, 2H, J = 7.8Hz), 7.09~7.11 (m, 4H), 6.40 (s, 2H), 2.33 (d, 4H, J = 6.3 Hz), 1.28~1.33 (m, 26H), 1.12~1.05 (m, 16H), 0.66~0.71 (m, 21.
(36) 12H) (附圖 16) 13. C NMR(75 MHz, CDCl3):δ 149.8, 147.8, 145.2, 142.4, 139.0, 134.5,. 130.3, 130.3, 128.5, 124.8, 119.9, 118.9, 83.5, 65.7, 40.9, 40.1, 32.0, 28.5, 25.5, 24.8, 22.9, 14.0, 10.8, 10.7 (附圖 17) Anal. Calcd for C53H70B2O4: C, 80.30; H, 8.90. Found: C, 80.27; H, 8.79. HRMS[M++H] calcd. for C53H70B2O4 792.5460;found 792.5474. 7. 2,7-dibromo-9,9’-spirobifluorene,化合物 A7 取鎂片(1.98 g, 82.5 mmol)置入三頸瓶,在氮氣系統下,加入無水 乙醚(75 mL)。將化合物 A1(18.2 g, 65.1 mmol)以無水乙醚(50 mL)稀釋 後置入加液漏斗中,使其緩緩滴入反應,在室溫下攪拌反應 1 小時。 將 2,7-dibromofluorenone(20.0 g, 590 mmol)置入固態加料漏斗中,並 緩緩加入反應中,待完全加入後,再加入無水乙醚(100 mL)。將反應 溫度升至 50℃,攪拌反應 12 小時後,使反應溫度回至室溫,加入氯 化氨水溶液中和,以乙醚(50 mL x 3)萃取,取有機層,加入硫酸鎂除 水、過濾、濃縮。以正己烷清洗固體,過濾得白色固體。將所得產物 及醋酸(300 mL)置入三頸瓶中,加熱至 135℃使固體完全溶解,攪拌 10 分鐘後移去熱源,滴入 2~3 滴濃鹽酸於反應瓶後,將反應繼續加 熱至沸騰,攪拌反應 30 分鐘。移去熱源,使反應靜置並使反應溫度 回至室溫候有白色固體析出,過濾得固體,以正己烷沖洗,抽乾,得 22.
(37) 產物 17.0 g,產率 65%。. Br. Br. A7 1. H NMR(300 MHz, CDCl3):δ 7.83 (d, 2H, J = 7.8 Hz), 7.65 (d, 2H, J =. 8.4 Hz), 7.4 7(dd, 2H, J = 8.1, 1.8 Hz), 7.58 (td, 2H, J = 7.8, 1.1 Hz), 7.13 (td, 2H, J = 7.6, 1.1 Hz), 6.82 (d, 2H, J = 1.8 Hz), 6.71 (dd, 2H, J = 7.5, 1.8 Hz) (附圖 18) 13. C NMR(75 MHz, CDCl3):δ 150.5, 147.0, 141.7, 139.6, 131.1, 128.3,. 128.1, 127.3, 124.0, 121.9, 121.4, 120.3, 65.6 (附圖 19) GC-MS(m/e):474 (M+) (附圖 20). 8. PTF 將化合物 A6(150 mg, 0.19 mmol)、化合物 A7(90.0 mg, 0.19 mmol)、Aliquate®336(15.0 mg)、甲苯(1.84 mL)及 2M K2CO3 水溶液 (0.24 mL),升溫至 60℃攪拌 10 分鐘,並以氮氣排出反應瓶內的氣體。 冷卻後加入 Pd(PPh3)4(~ 4 mg),並將反應升溫至 110℃。攪拌 72 小時 後,加入 benzeneboronic acid(48.0 mg, 0.39 mmol)攪拌反應 12 小時 後,再加入 bromobenzene(62.0 mg, 0.39 mmol),持續攪拌 12 小時。. 23.
(38) 將反應降至室溫,滴入甲醇中再沉澱,過濾,烘乾。將粗產物溶於三 氯甲烷後,過濾,並以甲醇(100 mL)進行 2 次再沉澱,最後用連續萃 取裝置,以熱丙酮清洗 72 小時,烘乾,得產物 92.0 mg,產率 52%。. n. PTF 1. H NMR(300 MHz, CDCl3):δ 7.75~7.79 (m, 2H), 7.56~7.63 (m, 5H),. 7.22~7.31 (m, 8H), 6.98~7.31 (m, 4H), 6.62~6.74 (m, 5H), 6.36 (s, 2H), 2.29 (s, 4H), 1.23~1.59 (m, 2H), 1.01 (m, 16H), 0.62~0.64 (m, 12H) (附 圖 21) 13. C NMR(75 MHz, CDCl3):δ 149.4, 149.3, 141.8, 141.7, 141.0, 140.8,. 140.3, 140.1, 138.7, 128.5, 127.8, 127.6, 124.7, 124.2, 122.5, 122.2, 120.0, 119.5, 65.9, 65.7, 40.9, 40.7, 40.0, 32.0, 31.8, 28.5, 28.1, 25.5, 25.2, 22.8, 22.7, 13.9, 10.8, 10.6 (附圖 22) Anal. Calcd for C66H60: C, 92.91; H, 7.09. Found: C, 91.26; H, 7.19.. 24.
(39) 第三章 結果與討論 3-1. 合成部分 3-1-1 化合物 A6 的合成 反應流程如 Scheme1 所示,由 2-iodobiphenyl(化合物 A1)與鎂片 作用形成 Grignard reagent,再和 9-fluorenone 進行 Grignard reaction, 生成之產物再經環化後形成 9,9’-spirobifluorene,即化合物 A2。 化合物 A2 在氯化鋁的催化下,與 2-ethylhexanoyl chloride 反應 形成化合物 A3,接著在鹼性條件下,與 hydrazine hydrate 進行還原反 應形成化合物 A4。再利用氯化鐵為催化劑,使化合物 A4 與溴水反 應產生化合物 A5。將化合物 A5 在無水的狀態下先後與 n-BuLi 及 B(OBu)3 反應最後再和 pinacol 在 Dean-stark trap 裝置中加熱迴流反應 形成化合物 A6。 3-1-2 化合物 A7 的合成 反應流程如 Scheme2 所示,由 2-idobiphenyl(化合物 A1)與鎂片作 用形成 Grignard reagent,再和 2,7-dibromofluorenone 進行 Grignard reaction,生成之產物經環化後形成 2,7-dibromo-9,9'-spirobifluorene ,即化合物 A7。 3-1-3 聚合反應 高分子 PTF 的合成如 Scheme3 所示,在 Pd(PPh3)4 催化下進行 25.
(40) Suzuki Coupling 反應。並於反應結束前,分別加入 Benzeneboronic acid 與 bromobenzene 以消去末端尚未反應之官能基。再沉澱純化後,放 入 Soxhlet extraction 裝置,以熱丙酮連續萃取 PTF 三天,除去寡聚物 (oligomer)及其他不純物。 Scheme1. NH 2. I. A1. O + I. A1. A2. Br O. O Br A3. A2. A4. A5. O B O O B O A6. Scheme2. O + I. Br. Br. Br. A1. Br A7. Scheme3. O B O. + O B O A6. Br. Br. n. A7 PTF. 26.
(41) 3-2. 物理性質 3-2-1. GPC 量測 高分子的物理性質和分子量大小有關,因此透過 GPC 的測量可以 得到一個相對於標準品的相對分子量。此處所使用之標準品為 polystyrene,沖堤液為 THF,流速為 1mL/min,分子量訊號由標準品 內插得相對值,測試的結果如表 A-1 所示。 表 A-1. PTF 之分子量 PTF. Mn(Daltons) Mw(Daltons) 11415 18892. Mw/Mn 1.65. Mn:數目平均分子量 Mw:重量平均分子量 Mw/Mn(polydispersity):用以表示分子量分佈的寬度。. 3-2-2. DSC 和 TGA 測量 DSC 和 TGA 主要用來觀察化合物的熱性質,DSC 可測量玻璃轉 移溫度;TGA 可測量重量隨溫度變化和裂解溫度,由其重量損失百 分率可觀察高分子的熱穩定性。 我 們 可 藉 由. Differential. Scanning. Calorimetry(DSC) 和. Thermogravimetric Analysis(TGA),來觀察此高分子的熱性質,結果 如表 A-2.及圖 A-10.、圖 A-11.所示。DSC 的升溫速率為 20 ℃/min, 27.
(42) 範圍為 30~300 ℃,降溫速率為 40 ℃/min。在重覆的升溫過程中,可 以觀察到 PTF 在 250℃的位置有明顯的玻璃轉移現象,PTF 的 Tg 高 於 POF (Tg ~ 75 ℃),表示 9,9’-螺結雙茀結構的導入提升了高分子的 剛硬度,並限制分子鏈的擾動,因此對於高分子熱穩定性有很大的幫 助。 表 A-2. PTF 之 DSC 與 TGA 的數據分析表. PTF. Tg(℃). Td(-5%)(℃). Td(-10%)(℃). 250. 410. 443. Tg:玻璃轉移溫度。 Td(%):樣品重量損失百分率的溫度。. o. Tg=253 C. Endothermic. third time. o. Tg=250 C. second time. o. Tg=250 C first time. 50. 100. 150. 200. 250. 300. o. Temperature ( C). 圖 A-10.. PTF 之 DSC 圖 28. 350.
(43) 100 90 o. 80. Td(-5%)=410 C o Td(-10%)=443 C. Weight loss (%). 70 60 50 40 30 20 10 0 0. 200. 400 600 o Temperature ( C). 800. 1000. 圖 A-11. PTF 之 TGA 圖. 3-2-3.溶解度測試 在高分子有機發光二極體的元件製程中,高分子發光材料一般都 利用旋轉塗佈的方式來製備高分子薄膜,因此高分子的溶解度優劣也 是影響製程的一大要素,在此我們對於本論文中所合成出的 PTF 進 行溶解度測試。PTF 對於一般有機溶劑之溶解度測試結果如表 A-3. 所示,PTF 對於大部分的溶劑都有相當不錯的溶解度,主要是因為在 碳-7 的位置上導入了 2-ethylhexyl 的長碳鏈,使得所合成出的 PTF 擁 有相當良好的溶解度。. 29.
(44) 表 A-3. PTF 之溶解度測試 Solvent Toluene Chlorobenzene CHCl3 1,2-Dichloroethane PTF ++ ++ ++ ++ + +:溶解. 30. THF ++.
(45) 3-3. 光學性質 3-3-1. PTF 之 UV-vis 吸收光譜與 PL 放射光譜 PTF 的吸收和放射光譜如圖 A-12.所示。在 THF 溶液狀態下,最 大 UV-vis 吸收峰主要來自 π-π*電子躍遷,PTF 的最大吸收峰 λmax 在 352 nm,PTF 之薄膜態其吸收峰位置與溶液態的吸收峰相同。 在 THF 溶液狀態下,PTF 的最大放射峰為 398 nm(在 418 nm 處 有 shoulder),在薄膜狀態最大放射峰在 408 nm(在 428 nm 處有 shoulder),薄膜態較溶液態紅位移了 10 nm,主要原因是因為形成薄 膜態之 PTF,其分子間的距離較近,會有分子間作用力,而產生堆疊 和激發複合體(excimer)的現象,分子間的交互作用力較溶液態時大, 所以其放射波長會有些許紅位移的現象。. PTF SOLUTION-UV PTF SOLUTION-PL PTF FILM-UV PTF FILM-PL. Abs./Emission Intensity(a.u.) Normalized. 1.0. 0.8. 0.6. 0.4. 0.2. 0.0. 250. 300. 350. 400. 450. 500. 550. 600. 650. Wavelength(nm). 圖 A-12. PTF 其薄膜與溶液狀態之吸收及放射光譜 31.
(46) 3-3-2. 量子效率的量測 量子效率(quantum yield,Φ)為物質放出光子數與吸收光子數之 比,可表示為: Φ=(number of emitting photon)/(number of absorbed photon) 為了得知化合物的量子效率,在此取用一已知且光色相近的化合 物做為標準品,在儀器各參數皆相同的情況下,測量待測物與標準品 的螢光光譜,並將測得的放射光譜之積分面積及激發波長的吸收度代 入下列公式中,即可求出待測物的相對量子效率。 Φs /Φr =(Ar / As) ×(Is / Ir)×(Qr / Qs)(式一) s :待測樣品(sample) r :標準參考品(standard) Φ:量子效率 A:激發波長處的吸收度 I:螢光放光強度的積分面積 Q:螢光激發光源所提供光的量子。 表 A-4. PTF 之量子效率. PTF a b. Quantum Yield Solution Film a (in cyclohexane) 0.73 0.37. 9,10-diphenylanthracene(DPA)在 cyclohexane 中的量子效率為 0.9。 以 poly(9, 9’-dioctykfluorene)(POF)為標準品,POF 的薄膜態量子效率為 0.55。. 32.
(47) 3-4. 電化學性質—氧化還原電位測量 為了探討用於元件的有機材料,我們先建立能階圖,來得知我們 選用的材料特性,預測電子與電洞結合的位置及能量轉移的效果。 在此使用循環伏安法(cyclic voltammetry,簡稱 CV ),當外加電 位達到待測物的反應電位時,氧化或還原反應隨即發生,此時電流將 隨著電位的變化而改變。而電流的大小是由物質到電極表面的擴散速 率所控制,所以當擴散速率遠小於外加電位的變化速率,且電極表面 的反應已趨完全時,此時電流即衰減下來。 在測量氧化還原電位之中,須先配置 10-3 M 樣品及 0.1 M tetrabutylammonium hexafluorophosphate(TBAHF6)的二氯甲烷為電解 液 10 mL,通入氮氣 10 分鐘,而在還原電位的測量中,以無水的 THF 為電解液,配製相同濃度的樣品及電解質。以 Ag/Ag+為參考電極, 並以 ferrocene/ferrocenium (Fc/Fc+)為內參考電極,白金絲為導電電 極,測量氧化電位時,以白金電極作為工作電極,測量還原電位時, 則改以表面覆蓋著汞之金電極為工作電極,掃瞄速度為 50mV/S,範 圍 0~2000mV 與 0~-2000mV。 red 從 CV 圖中可讀取氧化起始電位(E oxonset )、還原起始電位(E onset ),. 藉此來建立元件分子電子能階圖。 我們利用下列公式來計算 HOMO、LUMO 值,其中氧化起始電. 33.
(48) 位(E oxonset )採用伏特為單位(vs. Fc/Fc+),常數為 4.8 為 ferrocene 相對於 真空狀態時之能階。 HOMO = -4.8 - E oxonset red LUMO = -4.8 - E onset. 化合物 PTF,經過 ferrocene 標準品校正後所得 E oxonset 為 0.73 eV、 red E onset 為-2.56 eV 利用公式求得 HOMO = -5.53 eV、LUMO = -2.24 eV. 表 A-5. PTF 的氧化還原電位及 HOMO、LUMO d el a red E opt ,(eV) E onset , (V) a E ox HOMO, (eV)b LUMO, (eV) c E g , (eV) g onset , (V). PTF a. 3.17. -2.56. 0.73. - 5.53. Potential values are versus Fc/Fc+.. b. HOMO determined from onset oxidation.. c. LUMO determined from onset reduction.. d. Electrochemical bandgap E elg = LUMO - HOMO.. 34. -2.24. 3.29.
(49) 0.004 polyspiro(solution) red. onset=-2.56 LUMO=-2.24 eV oxid. onset=0.73 HOMO=-5.53 eV HOMO-LUMO=3.29. 0.003 -2.66. Current (mA). 0.002 -2.56 0.001. 0.77. 0.000 -2.56 0.73. -0.001. 0.88 -0.002. -0.003 -3.0. -2.5. -2.0. -1.5. -1.0. -0.5. 0.0. 0.5. 1.0. 1.5. +. Potential (V vs. Fc/Fc ). 圖 A-13. PTF 溶液態之 CV 圖 由 CV 圖及可得知,PTF 在陰極部份呈現可逆性(reversible)還原, 而陽極部份亦為可逆性(reversible)氧化。. 35.
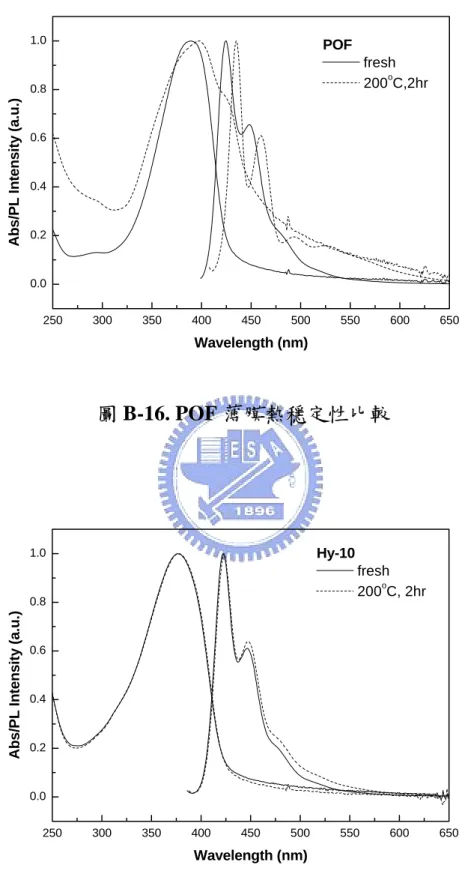
(50) 3-5 薄膜熱穩定性測量 為了探討 PTF 的薄膜熱穩定性,可透過不同溫度條件下,觀察 高分子在吸收/放射光譜上的變化。 測量方式: (1) 配置樣品濃度在甲苯溶液中的濃度為 1.0%(w/w),以 2.5x2.5x0.15 cm3 的石英玻璃作為基質,以轉速 3000rpm 旋轉 40sec,旋轉塗佈 於石英玻璃上。 (2)將所製成之薄膜至於灌滿氮氣之烘箱內,將溫度設定為 150 ℃, 持續加熱 12 小時,測量其加熱前後的吸收/放射光譜,並觀察其變 化。. fresh (absorption) fresh (emssion) o 150 C,12h (absorption) o 150 C,12h (emssion). Abs/Emission Intensity(a.u.) Normalized. 1.0. 0.8. 0.6. 0.4. 0.2. 0.0. 300. 400. 500. Wavelength (nm). 圖 A-14. PTF 薄膜熱穩定性比較 36. 600.
(51) 由圖 A-14.觀察熱處理前後之吸收與放射光譜可發現,在加熱前 後吸收/放射光譜波型並沒有明顯的改變,由此可知具有較高 Tg 的 PTF,其分子鏈較不易擾動,也證明 9,9’-螺結雙茀結構的導入有助於 熱穩定性的提升,同時抑制了堆疊效應與激發複合體的放光產生。. 3-6. 元件電激發光性質 3-6-1. PTF 元件電激發光性質 為了研究 PTF 的電激發光性質,我們以 PTF 作為發光層製成元 件,其元件結構如下: ITO/PEDOT/PTF(50~70nm)/TPBI/Mg:Ag(1:10)/Ag 為了修飾 ITO 玻璃的平整度並降低電洞注入的能障,因此在 ITO 上旋轉塗佈一層 PEDOT,作為電洞注入層,將 PTF 溶於 chlorobenzene 後旋轉塗佈於 PEDOT,在真空下除去溶劑,再鍍上 TPBI 與鎂銀合 金,此元件驅動電壓為 7V (1 cd/m2),最大外部量子效率為 0.91%。 其 EL 的最大放射波長在 407 nm,與薄膜狀態下之 PL 光譜幾乎一樣, 表示 PL 與 EL 都是透過單重態激子的幅射性緩解過程發光。在操作 電壓為 7 V 時,CIE 座標為(0.18, 0.12)。 此元件能達到的最大外部量子效率與最大亮度分別為 0.91%及 600 cd/m2。在電流密度為 20 mA/cm2 時的亮度為 128 cd/m2,luminance efficiency 為 0.21 cd/A,外部量子效率為 0.72%;在電流密度為 100 37.
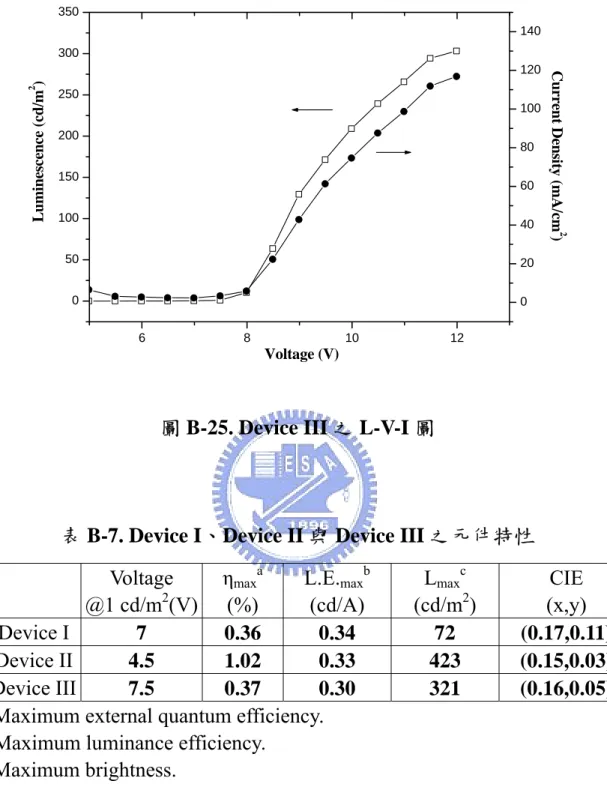
(52) mA/cm2 時的亮度為 493 cd/m2,luminance efficiency 為 0.21 cd/A,外 部量子效率為 0.63%。. 800 250. 700 2500. 2000. 600. 500. 0. 2. Luminescene (cd/m ). 500. 200. 1000. 300. 400. 500. 600. 700. 150. 800. Wavelength (nm). 400 300. 100. 200 50. 2. 100. Current Density (mA/cm ). EL Intensity. 1500. 0 0. 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. Bais (V). 圖 A-15. PTF 製成元件之 L-V-I 圖,內插:電壓為 7V 下的 EL 圖. 表 A-6. ITO/PEDOT/PTF(50~70nm)/TPBI/Mg:Ag(1:10)/Ag 在電 流密度 20 mA/cm2 與 100mA/cm2 的元件效率 100 mA/cm2 20 mA/cm2 8.24 9.86 128 493 0.56 0.50 0.72 0.63 0.21 0.16 x=0.18, y=0.12. Voltage (V) Brightness (cd/m2) Luminance efficiency (cd/A) External quantum efficiency (%) Max power efficiency (lm/W) CIE coordinates, x and y. 3-6-2. B5 掺混在 PTF 中(5wt.%)元件電激發光性質 38.
(53) 我們將本實驗室施秉彝同學所合成出的藍光小分子(B5)摻雜在 PTF 與 PF 中,來研究以 PTF 做為主發光體的電激發光性質,元件結 構下: ITO/PEDOT/B5:Polymeric Host /TPBI/Mg:Ag. N. N. N. N. N. N. TPBI. N. N. n. B5. PTF. n. PF. 化合物 B5 主要的吸收位置在 355 及 415nm,355nm 之吸收主要 39.
(54) 來 自 其 結 構 中 terfluorene 部 份 之 吸 收 , 415nm 則 是 來 自 bis[4-(diphenylamino)styryl]fluorene 部份之吸收。此處我們所合成出 的主發光體 PTF 其放射位置在 408 nm,而 PF 其放光位置則是在 424nm。 由圖 A-16.我們分別比較 B5、PF 與 PTF 薄膜態的吸收/放射光譜 後發現,PF 和 PTF 的放射光譜與 B5 的吸收光譜有所重疊,尤其是 PTF 與 B5 的光譜重疊性更佳,根據 Förster 能量轉移機制,以 B5 當 作客發光體摻雜在 PTF 中應該會有較佳的能量轉移效率。. 408nm. 424nm. 355. 467nm. Abs./Emission Intensity(a.u.). 1.0. UV of B5 PL of B5 PL of PTF PL of PF. 0.8. 0.6. 0.4. 0.2. 0.0. 350. 400. 450. 500. 550. 600. 650. 700. Wavelength(nm). 圖 A-16. B5、PF 與 PTF 薄膜態之吸收/放射光譜. 40.
(55) EL Intensity (a.u.). B5:PTF B5:PF. 400. 500. 600. 700. Wavelength (nm). 圖 A-17. B5 以 5wt.%掺雜在 PTF 與 PF 中之 EL 光譜圖. 我們選擇以 5wt.%的 B5 分別掺雜在 PTF 和 PF 中製成元件,並 比較元件性能之差異。如圖 A-17.所示,其掺雜在 PTF 之 EL 光譜幾 乎沒有 PTF 的放光出現,反觀掺雜於 PF 之 EL 光譜,仍可觀察到 PF 的放光存在,主要是因為 PTF 之放射光譜與 B5 的吸收光譜與 PF 相較 之下有較佳的重疊性,因此在前者中有相當不錯的能量轉移,且由圖 A-18.可以發現其 EL 光譜圖幾乎不會隨著電壓上升而改變,為一光色 穩定的藍光元件,其 CIE 座標為 (0.13, 0.22)。. 41.
(56) 1.0. 5V 7V 9V 11V 13V. EL Intensity (a.u.). 0.8. 0.6. 0.4. 0.2. 0.0. 300. 400. 500. 600. 700. 800. Wavelength (nm). 圖 A-18. 不同電壓下之 EL 圖 此外,比較元件的效率可發現,以 PTF 作為主發光體時可得到 較佳的元件效率,如圖 A-19.所示,最大 luminance efficiency 可達到 2.63 cd/A (1.66%),亮度為 1928 cd/m2(@12.5V),在電流密度為 100 mA/cm2 時,其亮度為 1911 cd/m2;反觀以 PF 為主發光體時,其最大 luminance efficiency 僅有 1.93 cd/A,在相同電流密度時,其亮度也較 前者小。由元件結果得知,藉由主客發光體間有效的能量轉移機制, 使得 B5 掺雜到 PTF 時,能得到較佳的元件效率。. 42.
(57) 2000. 2. Luminescence (cd/m ). Luminescence efficiency (cd/A). 3. 1500 2. 1000. 1 500. B5(5%):PF B5(5%):PTF 0 0. 20. 40. 60. 80. 100. 2. Current Density (mA/cm ). 圖 A-19. 分別以 PTF 及 PF 當作主發光體所製成元件的效率與亮度 對電流密度作圖. 43.
(58) 第四章. 結. 論. 我們成功合成出一具良好熱穩定性的藍光高分子,PTF;藉由導 入螺結結構,來抑制高分子的結晶現象,亦可提升其玻璃轉移溫度至 250 ℃。由薄膜熱穩定性之量測,其薄膜在加熱 150 ℃經 12 小時後 的螢光光譜無明顯變化,證明螺結結構的引入,確實抑制了堆疊效應 與激發複合體的放光產生。以 PTF 為發光層製成 PLED 元件,其驅 動電壓為 7V,最大外部量子效率為 0.91%,最大亮度可達 600 cd/m2。 我們進一步以 PTF 為主發光體掺雜入藍光客發光體 B5(5wt.%)製成 PLED 元件,成功得到一高效率且光色穩定的藍光元件,藉由主客發 光體間有效的能量轉移機制,外部量子效率由 0.91%提升至 1.66%, 而 Luminance efficiency 由 0.62 cd/A 提升至 2.63 cd/A,光色由藍紫光 位移至人眼較敏感的藍光區域,因此 PTF 可作為一個不錯的藍光主 發光體材料。. 44.
(59) B 部分 高分支狀藍光高分子材料之合成與研究. 第一章. 序論. 1-1. 前言 藍光高分子發光材料中,目前仍以聚茀高分子(polyfluorene)之研 究最為廣泛,主要是因為其具有熱穩定性佳、高化學穩定性及優越的 螢光量子效率,但由於 polyfluorene 在高溫或高壓下,會因分子堆疊 或激發複合體而影響光色穩定度。為改善此缺點,許多學者進行相關 之研究例如在碳 9 的位置上進行修飾、共聚物的導入等方法,但大部 分所合成出的皆為線性的高分子材料。近年來,也開始有學者將非線 性的高分支狀高分子應用在發光材料上來進行相關研究。. 1-2. 高分支狀高分子之簡介 具有高分支成長特性的三次元結構的高分子,在近來受到相當廣 泛的研究。三次結構的高分子型態可分為梳狀、星狀及樹枝狀結構, 如圖 B-1.所示。而樹枝型態之高分子則可分為兩類:樹枝狀 (dendritic)33-36 高分子及高分支狀(hyperbranch)37-41 高分子。此二者的 差別主要在於其分支次序,樹枝狀高分子具較高的規則性及較完美的. 45.
(60) 結構,每一個單體單位含一個分支點,而高分支狀高分子的分支結構 較不規則,除分支結構外並包含線性的部分。. 梳狀(comb-like). 星狀(star-like). hyperbranch. dendrimer. 圖 B-1. 三次元結構的高支鏈聚合物其分子型態 三次元高分子其分子結構和一般線性高分子有所不同。一般線性 高分子每條高分子鏈僅含兩個末端官能基,因此主幹上的重複結構及 高分子鏈彼此之間較易互相糾結纏繞,進而影響其物理及化學性質。 三次元高分子具有大量末端的高支鏈結構及大量的末端基延伸至分 子表面。此外,因其三次元的固定分支結構,使得鏈與鏈之間不易糾. 46.
(61) 纏。 在 1952 年,Flory42 提出一具有一個官能基 A 及兩個或兩個以上 的官能基 B 的單體,進行分子間的縮合反應,以得到高分支狀高分 子,但當時並未受到注意,直到 1990 年,Kim 和 Webster43 以 AB2 型式的單體合成出高分支狀的 polyphenylene 後,才使得高分支狀高 分子受到重視。. 1-2-1. 高分支狀高分子於高分子發光材料之應用 近年來,高分支狀高分子亦在高分子有機發光材料上有相關之研 究 44--45。在此列舉一簡單的例子。 此文獻 46 將化合物 1 與化合物 2 進行共聚,形成高分支狀的聚茀 高分子,並以化合物 2 作為此高分支狀聚茀高分子的分支點,分別以 化合物 1:化合物 2 為 100:5、100、15 及 100:40 三種不同莫耳比 例進行聚合形成 P5、P15 與 P40,其反應流程如圖 B-2.所示。 由其薄膜熱穩定性之測試可得知,當導入的化合物 2 比例越高 時,高分子薄膜抑制分子堆疊與激發複合體之發光的效果也隨之提 升,主要是因為高分支狀高分子,其分支點增加時,其結構也變得更 剛硬,且不易擾動與堆疊,故當分支點的比例提升,能有助於高分支 狀高分子之薄膜熱穩定性(圖 B-3.),由此可知將高分支狀高分子之結 構特性應用在有機發光材料上,確實能增加其熱穩定性等效能。 47.
(62) n. Br. m. Br. OH B OH. Br. Br. Br. + B. Br z x. OH. y. HO. SPC. 1. 2. HO B. OH. 圖 B-2. Hyperbranch polymer 之反應流程圖 46. 圖 B-3. 薄膜熱穩定性測試 46. 1-3. 研究動機 在藍光高分子材料中,目前最常被使用的主要是聚茀 (polyfluorene)。Polyfluorene 具有高化學穩定度及優越的螢光量子效 48.
(63) 率,但其 Tg 只有 75 ℃,且在高電壓或高溫操作下,在光譜上會因為 產生分子堆疊效應(aggreagation)或形成激發複合體(excimer)而出現 拖尾的現象,因而影響光純度和光色穩定度。在本篇論文中,我們選 擇在本身具有三次元結構之 triphenylamine (TPA)為核心分子,主要是 因為 TPA 具有非平面性的三次元結構,故導入高分子中,能使高分子 鏈較不易擾動,且亦能增加高分子的立體阻礙性,希望藉此來提升高 分子的熱穩定性,而導入 TPA 也有助於電洞之注入。此外,在核心分 子 TPA 的碳-4 位置接上剛硬的茀基團,並構成一個 3D-cardo 結構, 再共聚形成高分支狀(hyperbranch)的高分子。高分支狀之高分子具有 三次元的立體組態再透過 cardo 結構的導入進而增加其立體阻礙效 應,此結構有機會減少鏈與鏈之間的作用力,使得堆疊效應和激發複 合體的放光減弱,且對於熱性質也有很大的提升。. 49.
(64) 第二章 實驗 2-1. 藥品 Chromium(6+) oxide. 購自. Riedel-deHaën. Magnesium. 購自. Aldrich. Triphenylamine. 購自. Lancaster. Trifluoromethanesulphonic acid. 購自. Lancaster. Ammonium chloride. 購自. SHOWA. Sodium hydrogen carbonate. 購自. SHOWA. Aliquat®336. 購自. Lancaster. Tetrakis(triphenylphosphine) Palladium. 購自. Lancaster. Benzeneboronic acid. 購自. Lancaster. Bromobenzene. 購自. Lancaster. 上述所列藥品,不純化直接使用。乙醚經過鈉、鉀合金及 benzophenone 的 除 水 蒸 餾 , 其 餘 皆 購 自 於 Merck 、 Aldrich 、 Mallickrodt、Fisher Scientific、聯工等公司。. 50.
(65) 2-2. 合成部分 1. 2-bromofluorenone,化合物 B1 將 2-bromofluorene (6.00 g, 24.5 mmol)置入一單頸瓶中,並加入 醋酸酐(110 mL)攪拌溶解。使用冰浴將反應溫度降至 0℃,將 CrO3(4.90 g, 49.0 mol)分多次緩緩加入反應中,待完全加入後,使反應在室溫下 攪拌反應 12 小時。將反應液倒入蒸餾水(200 mL)中,並緩緩滴入數 滴濃鹽酸使其產生沉澱,過濾後,再以大量蒸餾水清洗所得固體。烘 乾後以 THF 進行再結晶,得 3.41 g。產率為 54%。 O. Br. B1 1. H NMR(300 MHz, CDCl3):δ 7.75 (s, 1H), 7.64 (d, 1H, J = 7.2Hz), 7.59. (dd, 1H, J = 8.0, 1.8 Hz), 7.48~7.50 (m, 2H), 7.38 (d, 1H, J=8.1 Hz), 7.28~7.33 (m, 1H)(附圖 23) 13. C NMR(75 MHz, CDCl3):δ 192.3, 143.6, 142.9, 137.0, 135.7, 135.0,. 133.6, 129.4, 127.5, 124.5, 122.9, 121.7, 120.4(附圖 24) GC-MS(m/e):260 (M+)(附圖 25). 2. 2-bromo-9-phenyl-9H-fluoren-9-ol,化合物 B2 取鎂片(56.3 mg, 2.32 mmole)置入三頸瓶,在氮氣系統下,加入. 51.
(66) 無水乙醚(5 mL)。將 bromobenzene (0.28 mL, 2.90 mmole)以無水乙醚 (15 mL)稀釋後置入加液漏斗中,使其緩緩滴入反應中,在室溫下攪 拌反應 1 小時。將化合物 B1 (500 mg, 1.93 mmole)置入固態加料漏斗 中,並緩緩加入反應中,待完全加入後攪拌反應 10 分鐘。將反應溫 度升至 50℃,攪拌反應 12 小時。加入氯化氨水溶液中和,以乙醚(50 mL x 3)萃取,取有機層,加入硫酸鎂除水、過濾、濃縮。以乙酸乙 酯:正己烷為 1:9 進行管柱層析,得 448 mg,產率 68%. HO. Br. B2 1. H NMR(300 MHz, CDCl3):δ 7.63 (d, 1H, J = 7.2 Hz), 7.52 (d, 1H, J =. 7.8 Hz), 7.47 (dd, 1H, J = 8.1, 1.8 Hz), 7.44 (d, 1H, J = 1.8 Hz), 7.31~7.41 (m, 3H), 7.25~7.30 (m, 4H), 7.22~7.23 (m, 1H) (附圖 26) 13. C NMR(75 MHz, CDCl3):δ 152.4, 150.0, 142.3, 138.6, 132.1, 129.3,. 128.8, 128.3, 128.2, 128.1, 127.4, 126.9, 125.8, 125.2, 124.8, 122.1, 121.5, 120.1, 83.41(附圖 27) GC-MS(m/e):337 (M+)(附圖 28). 3. Tris-[4-(2-bromo-9-phenyl-9H-fluoren-9-yl)-phenyl]-amine,化合物 B3 將 triphenylamine(180mg, 0.73 mmol 與化合物 B2(816mg, 2.42 52.
(67) mmol)置入雙頸瓶中,並加入 1,4-dioxane(10mL)攪拌溶解。在室溫下 快速加入 trifluoromethanesulphonic acid(0.29mL, 3.30 mmol)攪拌反應 1 小時。將反應溫度升至 80℃持續攪拌 4 小時。使反應冷卻至室溫後 倒入蒸餾水(100mL)中,並加入碳酸氫鈉水溶液調整其至弱鹼性,過 濾收集固體,並以二氯甲烷:正己烷為 2:3 進行管柱層析,得白色 固體 603mg,產率 68%. Br. Br N. Br. B3 1. H NMR(300 MHz, CDCl3):δ 7.68 (d, 3H, J = 7.2 Hz), 7.58 (d, 3H, J =. 7.8 Hz), 7.42~7.49 (m, 6H), 7.27~7.35 (m, 7H), 7.11~7.24 (m, 17H), 6.97 (d, 6H, J = 9.0Hz), 6.86 (d, 6H, J = 9.0 Hz) (附圖 29) 13. C NMR(75 MHz, CDCl3):δ 153.4, 151.1, 146.0, 145.1, 139.1, 139.0,. 138.9, 130.6, 129.3, 128.8, 128.3, 128.1, 128.0, 127.6, 126.8, 126.2, 123.7, 121.4, 121.3, 120.1, 65.1(附圖 30) Anal. Calcd for C75H48Br3N: C, 74.89; H, 4.02; N,1.16 Found: C, 74.53; H, 3.92; N,0.84. 4. 2,7-Bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolane-2-yl)- 9,9-dioctyl53.
(68) fluorene,化合物 B4 由本實驗室根據文獻 41 合成所得。 C8H17. C8H17. O B O. O B O. B4 5. Hy-10 將化合物 B3(37.4 mg, 0.03 mmol) 、2,7-dibromo-9,9- dioctyl -fluorene (59.7 mg, 0.11 mmol)、化合物 B4(100 mg, 0.16 mmol)、 Aliquate®336(15.0 mg)、甲苯(1.50 mL)及 2M K2CO3 水溶液(0.75 mL),升溫至 60℃攪拌 10 分鐘,並以氮氣排出反應瓶內的氣體。冷 卻後加入 Pd(PPh3)4(~ 4 mg),並將反應升溫至 110℃。攪拌 72 小時後, 加入 benzeneboronic acid(85.3 mg, 0.70 mmol)攪拌反應 12 小時後,再 加入 bromobenzene(48.9 mg, 0.31 mmol),持續攪拌 12 小時。將反應 降至室溫,滴入甲醇:蒸餾水為 7:3 之溶液中再沉澱,過濾,烘乾。 將粗產物溶於三氯甲烷後,過濾,並以甲醇(50 mL)進行 2 次再沉澱, 最後用連續萃取裝置,以熱丙酮清洗 72 小時,烘乾,得產物 86.0 mg, 產率 65%。 1. H NMR(300 MHz, CDCl3):δ 7.59~7.82 (m, 7H), 7.38~7.51 (m, 3H),. 7.10 (s, 2H), 6.94 (s, 1H), 2.10 (s, 4H), 1.06~1.13 (m, 20H), 0.79~0.81 (m, 10H) (附圖 31). 54.
(69) 13. C NMR(75 MHz, CDCl3):δ 152.0, 151.8, 151.7, 145.9, 141.1, 140.5,. 140.0, 139.8, 139.3, 132.2, 132.1, 128.9, 128.8, 128.5, 128.4, 128.3, 127.5, 127.2, 126.6, 126.1, 123.6, 121.5, 120.0, 77.2, 65.2, 55.4, 55.3, 40.4, 31.8, 31.7, 30.0. 29.2, 29.1, 23.9, 22.6, 14.0 (附圖 32) 6. Hy-20 將化合物 B3(74.9 mg, 0.06 mmol) 、2,7-dibromo-9,9-dioctylfluorene(34.1 mg, 0.06 mmol)、化合物 B4(100 mg, 0.16 mmol)、 Aliquate®336(15.0 mg)、甲苯(1.60 mL)及 2M K2CO3 水溶液(0.80 mL),升溫至 60℃攪拌 10 分鐘,並以氮氣排出反應瓶內的氣體。冷 卻後加入 Pd(PPh3)4(~ 4 mg),並將反應升溫至 110℃。攪拌 72 小時後, 加入 benzeneboronic acid(75.8 mg, 0.62 mmol)攪拌反應 12 小時後,再 加入 bromobenzene(48.9 mg, 0.31 mmol),持續攪拌 12 小時。將反應 降至室溫,滴入甲醇:蒸餾水為 7:3 之溶液中再沉澱,過濾,烘乾。 將粗產物溶於三氯甲烷後,過濾,並以甲醇(50 mL)進行 2 次再沉澱, 最後用連續萃取裝置,以熱丙酮清洗 72 小時,烘乾,得產物 105 mg, 產率 73%。 1. H NMR(300 MHz, CDCl3):δ 7.67~7.81 (m, 8H), 7.50~7.58 (m, 3H),. 7.36 (s, 3H), 7.09 (s, 4H), 6.93 (s, 2H), 1.98~2.10 (m, 4H), 1.05~1.12 (m, 20H), 0.75~0.80 (m, 10H) (附圖 33) 13. C NMR(75 MHz, CDCl3):δ 152.0, 151.8, 151.7, 145.9, 141.1, 140.5, 55.
(70) 140.0, 139.7, 139.3, 128.9, 128.8, 128.2, 127.6, 127.5, 127.2, 126.6, 126.1, 124.7, 123.6, 121.4, 120.4, 120.3, 120.0, 77.2, 65.1, 55.3, 55.2, 40.4, 31.8, 31.7, 30.0, 29.9, 29.2, 29.1, 23.8, 22.6, 14.0 (附圖 34). 7. Hy-50 將化合物 B3(50 mg, 0.04 mmol) 、化合物 B4(26.7 mg, 0.04 mmol)、Aliquate®336(15.0 mg)、甲苯(0.80 mL)及 2M K2CO3 水溶液 (0.40 mL),升溫至 60℃攪拌 10 分鐘,並以氮氣排出反應瓶內的氣體。 冷卻後加入 Pd(PPh3)4(~ 4 mg),並將反應升溫至 110℃。攪拌 72 小時 後,加入 benzeneboronic acid(50.0 mg, 0.12 mmol)攪拌反應 12 小時 後,再加入 bromobenzene(13 mg, 0.08 mmol),持續攪拌 12 小時。將 反應降至室溫,滴入甲醇:蒸餾水為 7:3 之溶液中再沉澱,過濾, 烘乾。將粗產物溶於三氯甲烷後,過濾,並以甲醇(50 mL)進行 2 次 再沉澱,最後用連續萃取裝置,以熱丙酮清洗 72 小時,烘乾,得產 物 31 mg,產率 55%。 1. H NMR(300 MHz, CDCl3):δ 7.67~7.74 (m, 11H), 7.48~7.58 (m, 6H),. 7.35 (s, 9H), 6.99~7.20 (m, 15H), 6.88 (s, 6H), 1.89 (s, 4H), 1.26 (s, 2H), 0.99 (s, 18H), 0.70 (s, 10H) (附圖 35) 13. C NMR(75 MHz, CDCl3):δ 152.0, 151.7, 151.3, 145.9, 141.1, 140.6,. 140.0, 139.9, 139.7, 139.2, 136.1, 132.1, 131.9, 128.9, 128.7, 128.4, 128.2, 128.1, 127.6, 127.4, 127.1, 126.6, 126.1, 124.7, 123.4 , 121.4, 56.
(71) 120.3, 120.1, 119.9, 77.2, 65.1, 65.0, 55.2, 40.1, 31.6, 29.8, 29.1, 23.8, 22.7, 22.5, 14.0 (附圖 36). 57.
數據



+6
相關文件
包括具有藥理活性的高分子和低分子藥物高分子化或
接枝共聚合反應是材料改質的主要技術之ㄧ,已廣泛應用於高分子材料及生
為降低藥品安全性與有效性試驗的成本與其耗費的時間, 合併第一期
紅外線發光二極體的發射強度因發射方向而異
發射電路:為利用 PT2248 (U1,Infrared Remote Control Transmitter)及其週 邊元件、紅外線二極體(D4,IR Diode)與按鍵,共同組合成一紅外線發
1.4 Exponential and Logarithmic Functions 1.5 Finding Limits Graphically and Numerically 1.6 Evaluating Limits Analytically.. 1.7 Continuity and One-Sided Limits 1.8
分類法,以此分類法評價高中數學教師的數學教學知識,探討其所展現的 SOTO 認知層次及其 發展的主要特徵。本研究採用質為主、量為輔的個案研究法,並參照自 Learning
在與 WINS 有關的研究之中,除了研發感測器硬體這個領域之外,其它的領域均需要