行政院國家科學委員會專題研究計畫 成果報告
以新型觸媒合成側鏈液晶聚乙炔(3/3)
計畫類別: 個別型計畫 計畫編號: NSC91-2216-E-009-016- 執行期間: 91 年 08 月 01 日至 93 年 05 月 31 日 執行單位: 國立交通大學應用化學系 計畫主持人: 許千樹 報告類型: 完整報告 報告附件: 出席國際會議研究心得報告及發表論文 處理方式: 本計畫可公開查詢中 華 民 國 93 年 5 月 3 日
行政院國家科學委員會補助專題研究計畫
■ 成 果 報 告 □期中進度報告以新型觸媒合成側鏈液晶聚乙炔
計畫類別:■ 個別型計畫 □ 整合型計畫
計畫編號:NSC 91-2216-E-009-016
執行期間: 91 年 08 月 01 日至 93 年 05 月 31 日
計畫主持人:許千樹 教授
共同主持人:
計畫參與人員:
成果報告類型(依經費核定清單規定繳交):□精簡報告 ■完整報告
本成果報告包括以下應繳交之附件:
□赴國外出差或研習心得報告一份
□赴大陸地區出差或研習心得報告一份
■出席國際學術會議心得報告及發表之論文各一份
□國際合作研究計畫國外研究報告書一份
處理方式:除產學合作研究計畫、提升產業技術及人才培育研究計畫、列管計畫 及下列情形者外,得立即公開查詢 □涉及專利或其他智慧財產權,□一年□二年後可公開查詢執行單位:國立交通大學 應用化學系
中 華 民 國 九十二 年 九 月 三十 日壹、中英文摘要 關鍵詞:聚乙炔、側鏈液晶聚合物、光電高分子、導電高分子。 聚乙炔是一種被廣泛研究之導電性高分子,本研究擬合成側鏈液晶聚乙炔, 探討聚乙炔主鏈對於液晶相之影響,也探討液晶側鏈對於聚乙炔導電性之影響。 整個研究分三年進行,第一年將合成數系列含有單一液晶基取代之側鏈液晶聚乙 炔;第二年將合成數系列含有苯基及液晶基取代之側鏈液晶聚乙炔;第三年將合 成含有雙液晶基取代之側鏈液晶聚乙炔,在聚合反應方面,將視單體種類之不 同,分別以 WCl6, WCl6-Ph4Sn, MoCl5, MoCl5-Ph4Sn 或[Rh(nbd)Cl]2為聚合反應觸 媒,所合成之聚合物以 NMR、IR 及元素分析鑑定其化學結構,以 DSC 及偏光 顯微鏡探討其液晶相,最後並探討所合成側鏈液晶聚乙炔之排列特性及光電特 性。
Keywords : polyacetylene, side-chain LCP, electroptical polymers, conducting polymers.
Polyacetylene is a most widely studied conducting polymer. The goal of this proposal is mainly focused on the synthesis of side-chain liquid crystalline polyacetylenes. The effect of polyacetylene backbone on the mesomorphic properties of the obtained polymers is studied. The effect of mesogenic side groups on the conductivity of the obtained polyacetylene is also studied. This project is underwent for three years. In the first year, several series of side-chain LC polyacetylenes containing a mesogenic side group are synthesized. In the second year, several series of side-chain LC polyacetylene containing a phenyl and a mesogenic side group are prepared. In the third year, several series of side-chain LC polyacetylenes containing two mesogenic side groups are synthesized. In this study, WCl6, WCl6-Ph4Sn, MoCl5, MoCl5-Ph4Sn or [Rh(nbd)Cl]2 are used as polymerization
catalysts. The obtained side-chain LC polyacetylenes are characterized by IR, NMR and elemental analysis. DSC and OM characterize their mesomorphic properties. The alignment behavior as well as electroptical properties of the synthesized side-chain LC polyacetylene are also evaluated.
貳、報告內容 一、前言 具剛硬主鏈之側鏈液晶聚合物擁有更多的應用範圍,尤其在主鏈為聚乙炔 ( polyacetylene )之側鏈液晶聚合物方面。就聚乙炔本身的共軛結構而言,其原本 就可做為良好的導電高分子( conducting polymer ),但其因溶解度太差及穩定性 不佳而限制了可應用的範圍,所以一般研究的方向是著重於合成具有取代的聚乙 炔衍生物,且藉由適當取代基的導入,不但可提高其聚合物之可加工性及穩定 性,更可衍生出許多原本聚乙炔並不具有的光電性質,包括 photoconductivity、 optical nonlinearity、photoluminescence、及 chiral recognizability 等。
聚乙炔之光電應用方面,就其主鏈共軛雙鍵結構而言,如同前面提到過的, 理論上不但可以具有導電性,亦可以成為電激發光( electroluminescence )的材 料。但事實上聚乙炔必須具備反式主鏈共軛結構且經摻雜後才能顯示出良好的導 電性,相反的,也只有具順式共軛主鏈構形之聚乙炔才能在紅外光區發生微弱的 光激發光( photoluminescence )。根據文獻的報導,即使是單取代之聚乙炔衍生 物,其光激發光效應還是非常微弱,但由 UV-Vis 吸收光譜可發現,其吸收波長 可隨取代基的不同而形成大範圍的分佈,即放射波長亦能包含各種不同的光色。 因其聚合物之光激發光效率太差或甚至量測不到,這類單取代聚乙炔衍生物 欲應用在發光二極體( light-emitting diode )的製做上幾乎是不可能的。直到 2000 年,B. Z. Tang 等人將具有雙苯環( biphenyl )結構之末端炔基液晶單體聚合為單 取代側鏈液晶聚乙炔後,發現其聚合物之光激發光強度可較一般單取代聚乙炔衍 生物提升許多,即液晶基的導入可有效改善單取代聚乙炔衍生物之光電特性,但 其聚合物之放射波長低於 400 nm,已進入紫外光範圍,故亦無法直接利用。 綜觀以上的敘述可以瞭解,在具有剛硬聚乙炔主鏈結構的側鏈液晶聚合物方 面,不管是聚合反應本身或光電應用部份,都仍有許多值得研究的方向,因此本 計畫分為三年進行:第一年將著重於單取代之側鏈液晶聚乙炔衍生物的合成,第 二年將著重於雙取代之側鏈液晶聚乙炔衍生物的合成,第三年則著重於雙取代聚 乙炔之改質,每年度所合成之聚合物亦將深入的探討其光電性質。 二、研究目的與方法 (一)計畫之第一年部份 第一年以單取代聚乙炔衍生物之合成為主,其單體的設計上因炔基狀態不同 而可分為兩類,一是 phenylacetylene 衍生物,另一則是 alkylacetylene 衍生物。 各液晶單體之結構鑑定及熱性質分析如下列各表所示:
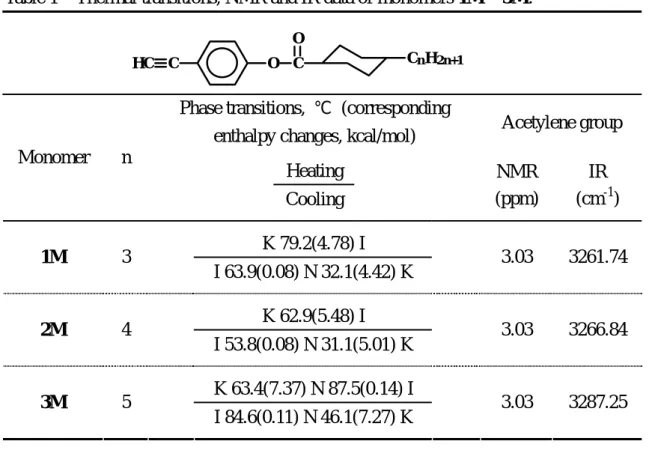
Table 1 Thermal transitions, NMR and IR data of monomers 1M ~ 3M.
Phase transitions, ℃ (corresponding
enthalpy changes, kcal/mol) Acetylene group Heating Monomer n Cooling NMR (ppm) IR (cm-1) K 79.2(4.78) I 1M 3 I 63.9(0.08) N 32.1(4.42) K 3.03 3261.74 K 62.9(5.48) I 2M 4 I 53.8(0.08) N 31.1(5.01) K 3.03 3266.84 K 63.4(7.37) N 87.5(0.14) I 3M 5 I 84.6(0.11) N 46.1(7.27) K 3.03 3287.25
Table 2 Thermal transitions, NMR and IR data of monomers 4M ~ 6M.
Phase transitions, ℃ (corresponding
enthalpy changes, kcal/mol) Acetylene group Heating Monomer n Cooling NMR (ppm) IR (cm-1) K 112.9(4.56) N [ 221.3 I ] 4M 3 [ I 177.8 N - ] 3.26 3272.83 K 119(5.08) N [ 220.3 I ] 5M 4 [ I 187.5 N - ] 3.26 3276.76 K 106.6(5.99) N [ 212.8 I ] 6M 5 [ I 198 N - ] 3.26 3283.36 C H C O O C HC n 2n+1 n 2n+1 C H C O O O C O C HC
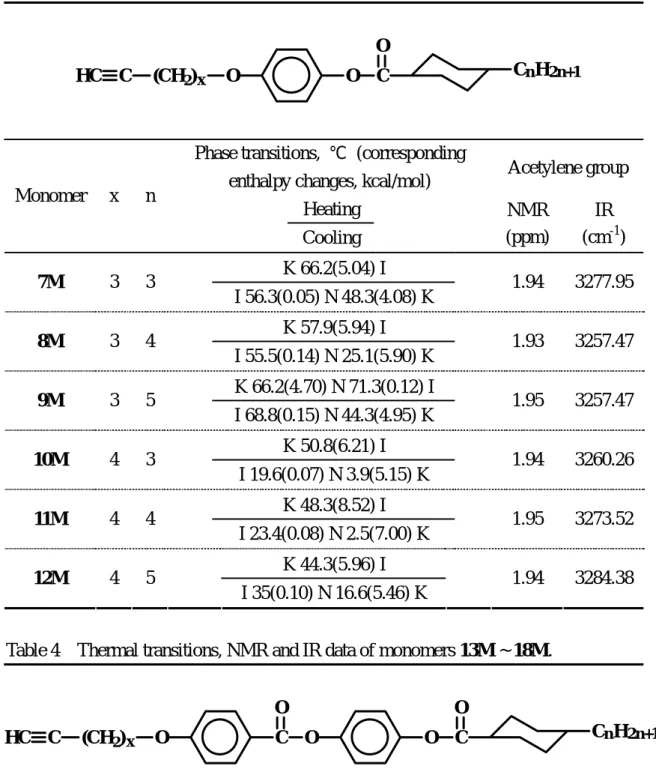
Table 3 Thermal transitions, NMR and IR data of monomers 7M ~ 12M.
Phase transitions, ℃ (corresponding
enthalpy changes, kcal/mol) Acetylene group Heating Monomer x n Cooling NMR (ppm) IR (cm-1) K 66.2(5.04) I 7M 3 3 I 56.3(0.05) N 48.3(4.08) K 1.94 3277.95 K 57.9(5.94) I 8M 3 4 I 55.5(0.14) N 25.1(5.90) K 1.93 3257.47 K 66.2(4.70) N 71.3(0.12) I 9M 3 5 I 68.8(0.15) N 44.3(4.95) K 1.95 3257.47 K 50.8(6.21) I 10M 4 3 I 19.6(0.07) N 3.9(5.15) K 1.94 3260.26 K 48.3(8.52) I 11M 4 4 I 23.4(0.08) N 2.5(7.00) K 1.95 3273.52 K 44.3(5.96) I 12M 4 5 I 35(0.10) N 16.6(5.46) K 1.94 3284.38
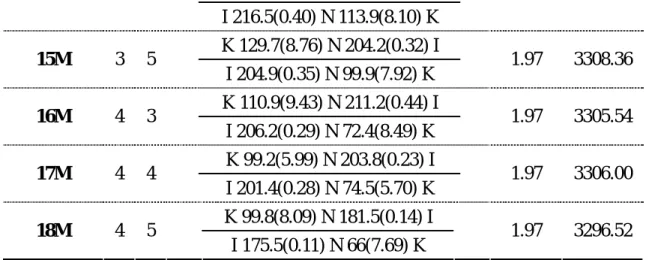
Table 4 Thermal transitions, NMR and IR data of monomers 13M ~ 18M.
Phase transitions, ℃ (corresponding
enthalpy changes, kcal/mol) Acetylene group Heating Monomer x n Cooling NMR (ppm) IR (cm-1) K 150.5(8.55) N 225.5(0.47) I 13M 3 3 I 223.3(0.44) N 107.3(7.77) K 1.97 3305.31 14M 3 4 K 150.9(8.63) N 219.2(0.24) I 1.97 3305.05 n 2n+1 C H C O O O (CH2) C HC x x C C H O O O C O O (CH2) C HC n 2n+1
I 216.5(0.40) N 113.9(8.10) K K 129.7(8.76) N 204.2(0.32) I 15M 3 5 I 204.9(0.35) N 99.9(7.92) K 1.97 3308.36 K 110.9(9.43) N 211.2(0.44) I 16M 4 3 I 206.2(0.29) N 72.4(8.49) K 1.97 3305.54 K 99.2(5.99) N 203.8(0.23) I 17M 4 4 I 201.4(0.28) N 74.5(5.70) K 1.97 3306.00 K 99.8(8.09) N 181.5(0.14) I 18M 4 5 I 175.5(0.11) N 66(7.69) K 1.97 3296.52 聚合反應之結果如下表:
Table 5 Polymerization results of monomers 1M ~ 3M.
Polymer Yield (%) Mw Mn Mw/Mn Cis %
1P 78.4 82900 18700 4.433 83.84
2P 86.6 111500 30900 3.608 87.97
3P 72.4 95700 25600 3.738 83.60
Table 6 Polymerization results of monomers 4M ~ 6M.
Polymer Catalyst Solvent Reaction
Temp. (℃) Yield (%)
4P [Rh(nbd)Cl]2 DMF/Et3N r.t. 80.5
5P [Rh(nbd)Cl]2 DMF/Et3N r.t. 84.8
6P [Rh(nbd)Cl]2 DMF/Et3N r.t. 77.7
Table 7 Polymerization results of monomers 7M ~ 12M.
Molecular weight Polymer Yield (%) Mw Mw/Mn 7P 51.6 30300 1.629 8P 54.9 28500 2.317 9P 69.6 98500 1.589 10P 59.5 77800 1.390 11P 59.2 90400 1.395 12P 70.1 145000 1.642
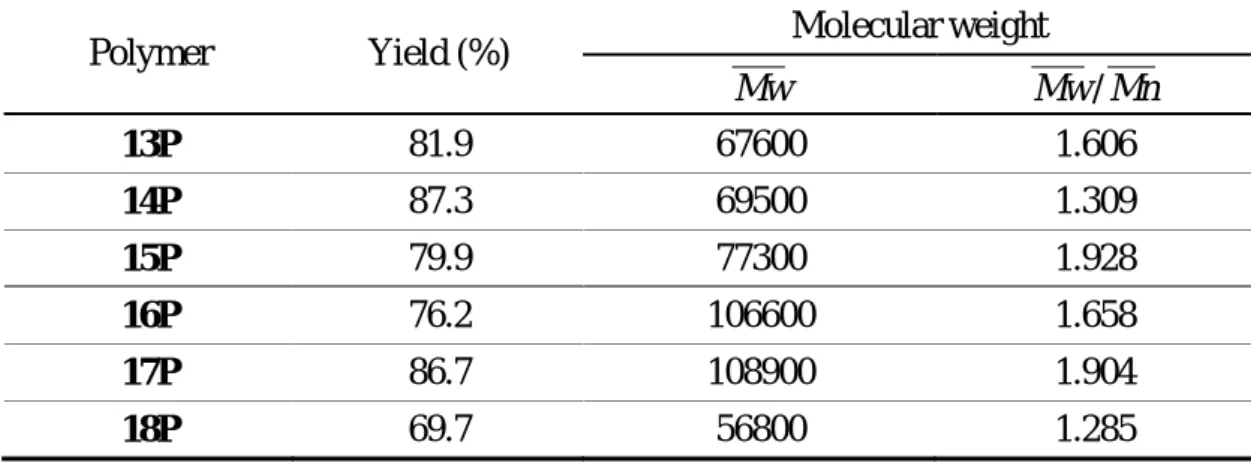
Table 8 Polymerization results of monomers 13M ~ 18M. Molecular weight Polymer Yield (%) Mw Mw/Mn 13P 81.9 67600 1.606 14P 87.3 69500 1.309 15P 79.9 77300 1.928 16P 76.2 106600 1.658 17P 86.7 108900 1.904 18P 69.7 56800 1.285 各聚合物之熱分析如下表:
Table 9 Thermal transitions of polymers 7P ~ 12P.
Phase transitions, ℃ (corresponding enthalpy changes, kcal/mol) Heating Polymer Cooling G 67.3 SC 138.4(0.31) SA 167.3(0.98) I 7P I 150.3(0.88) SA 86.4(0.15) SC 49.6 G G 58.8 SC 147.5(0.39) SA 182.6(0.98) I 8P I 151.5(0.83) SA 89.5(0.11) SC 52.9 G G 71.9 SC 166.1(0.17) SA 194.9(0.92) I 9P I 185.3(0.98) SA 106.6(0.29) SC 67.8 G G 53.8 SC 118.7(0.16) SA 149.1(0.83) I 10P I 138.0(0.80) SA 85.3(0.09) SC 50.1 G G 63.3 SC 108.7(0.23) SA 150.2(0.81) I 11P I 139.2(0.79) SA 87.8(0.14) SC 48.5 G G 62.5 SC 126.3(0.19) SA 179.3(0.79) I 12P I 152.7(0.77) SA 97.2(0.10) SC 50.4 G
Table 10 Thermal transitions of polymers 13P ~ 18P. Polymer Phase transitions, ℃
13P G 58.4 SC 216.2 SA ( 285 N 291 I ) 309.8 decomposed 14P G 62.3 SC 202.0 SA ( 298 N 310 I ) 328.3 decomposed 15P G 63.3 SC 188.7 SA ( 297 N 302 I ) 322.0 decomposed 16P G 59.3 SC 161.5 SA ( 277 N 290 I ) 299.9 decomposed 17P G 62.3 SC 171.0 SA ( 275 N 284 I ) 294.6 decomposed 18P G 56.0 SC 137.4 SA ( 290 N 310 I ) 311.3 decomposed
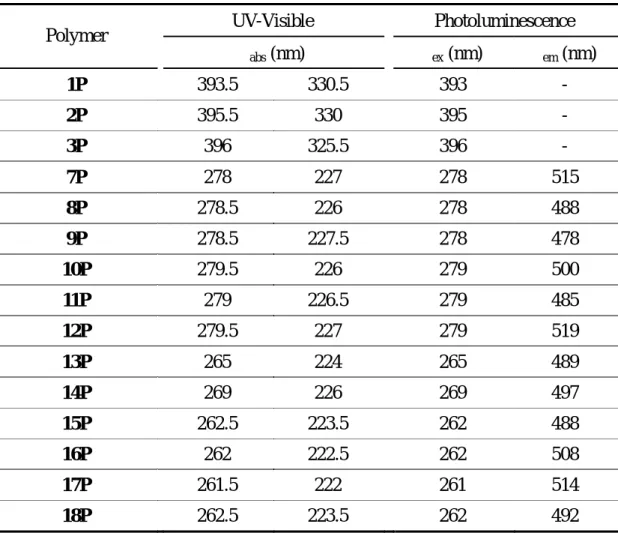
所合成各聚合物之光學特性分析如下:
Table 11 Optical properties of polymers 1P ~ 3P and 7P ~ 18P.
UV-Visible Photoluminescence Polymer λabs (nm) λex (nm) λem (nm) 1P 393.5 330.5 393 - 2P 395.5 330 395 - 3P 396 325.5 396 - 7P 278 227 278 515 8P 278.5 226 278 488 9P 278.5 227.5 278 478 10P 279.5 226 279 500 11P 279 226.5 279 485 12P 279.5 227 279 519 13P 265 224 265 489 14P 269 226 269 497 15P 262.5 223.5 262 488 16P 262 222.5 262 508 17P 261.5 222 261 514 18P 262.5 223.5 262 492 由以上數據得知,單取代聚乙炔衍生物經導入側鏈液晶基後並無法有效提升 其材料的發光效率至實用階段。 (二)計畫之第二年部份 炔基上取代基的不同而可造成其材料放射光色的改變,此外,當我們將液晶 基導入高分子側鏈後,若能得到具有液晶相的液晶聚合物,則我們便可結合高分 子之成膜性及液晶化合物之排列性質,以簡單的旋轉塗佈技術及配向方法來得到 具有方向性排列高分子鏈的元件發光層,如此即可製做出能放射偏極化光的 polarized PLED,此部份可應用於液晶顯示器( liquid crystal display,LCD )的背光 源上,以減少 LCD 結構中一片偏光板的使用,不但可以節省材料成本,更可增 加 LCD 光源的有效利用率,以大幅提昇其亮度。
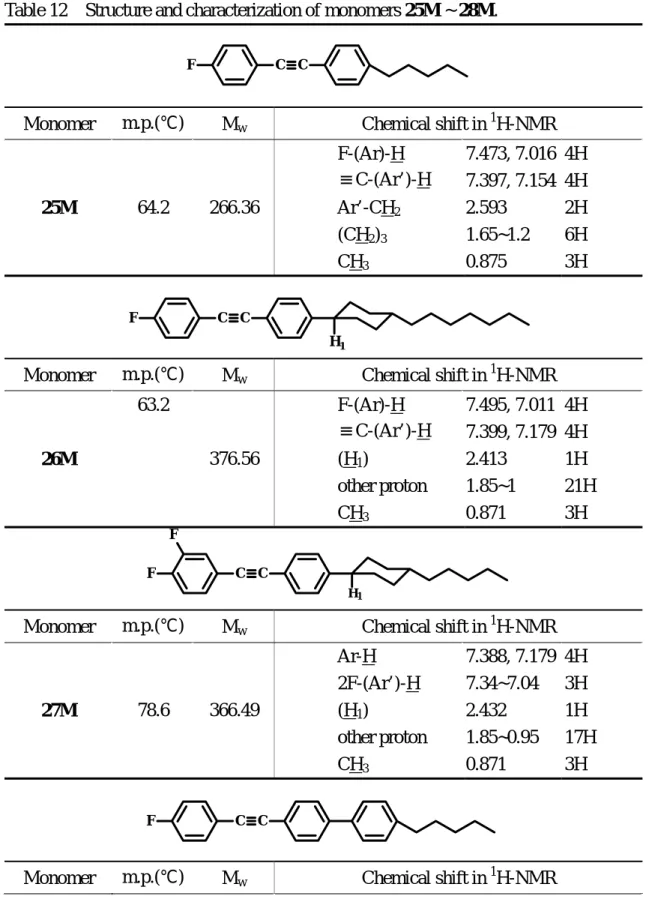
Table 12 Structure and characterization of monomers 25M ~ 28M.
Monomer m.p.(℃) Mw Chemical shift in 1H-NMR
25M 64.2 266.36 F-(Ar)-H ≡C-(Ar’)-H Ar’-CH2 (CH2)3 CH3 7.473, 7.016 7.397, 7.154 2.593 1.65~1.2 0.875 4H 4H 2H 6H 3H
Monomer m.p.(℃) Mw Chemical shift in 1H-NMR
26M 63.2 376.56 F-(Ar)-H ≡C-(Ar’)-H (H1) other proton CH3 7.495, 7.011 7.399, 7.179 2.413 1.85~1 0.871 4H 4H 1H 21H 3H
Monomer m.p.(℃) Mw Chemical shift in 1H-NMR
27M 78.6 366.49 Ar-H 2F-(Ar’)-H (H1) other proton CH3 7.388, 7.179 7.34~7.04 2.432 1.85~0.95 0.871 4H 3H 1H 17H 3H
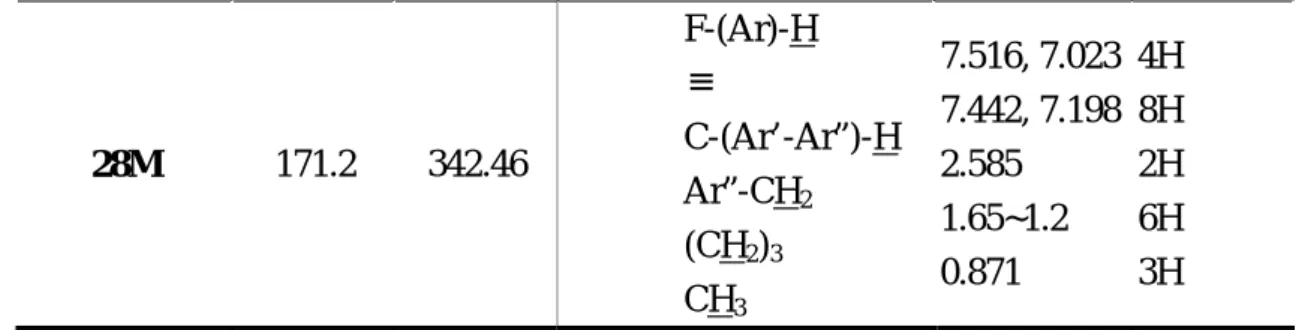
Monomer m.p.(℃) Mw Chemical shift in 1H-NMR
F C C F C C C C F H1 C C F F H1
28M 171.2 342.46 F-(Ar)-H ≡ C-(Ar’-Ar”)-H Ar”-CH2 (CH2)3 CH3 7.516, 7.023 7.442, 7.198 2.585 1.65~1.2 0.871 4H 8H 2H 6H 3H 其熱性質分析則如下表:
Table 13 Thermal transitions of monomers 25M ~ 28M. Phase transitions, ℃
(corresponding enthalpy changes, kcal/mol) Heating Monomer Cooling K 64.2(6.12) I 25M I 54.7(5.30) K K 63.2(6.99) SA 89.4(0.75) N 185.7(0.17) I 26M I 181.9(0.33) N 85.2(0.69) SA -4.9(1.09) K K 78.6(5.49) N 152.8(0.37) I 27M I 150.3(0.33) N 40.7(5.20) K K 171.2(2.56) I 28M I 165.3(2.22) K 聚合反應之結果如下:
Table 14 Polymerization results of monomers 25M ~ 28M.
Polymer Yield (%) Solvent Mw Mw/Mn Tg (℃)
25P 22.6 toluene 770400 1.477 233.7
26P 92.4 toluene 878300 1.225 219.8
27P 97.9 toluene 774300 1.270 232.8
28P 79.5 dichloroethane/
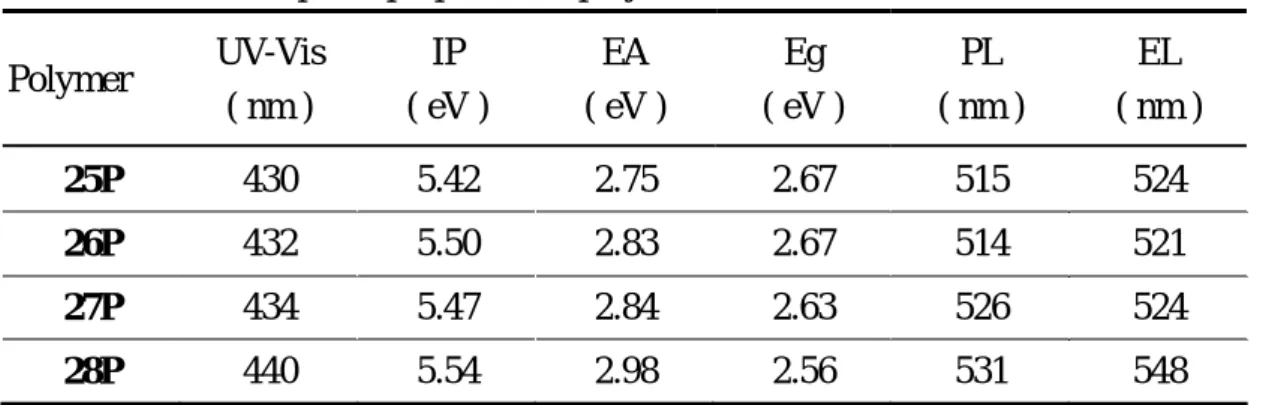
各聚合物之光電性質下表:
Table 15 Electro-optical properties of polymers 25P ~ 28P. Polymer UV-Vis ( nm ) IP ( eV ) EA ( eV ) Eg ( eV ) PL ( nm ) EL ( nm ) 25P 430 5.42 2.75 2.67 515 524 26P 432 5.50 2.83 2.67 514 521 27P 434 5.47 2.84 2.63 526 524 28P 440 5.54 2.98 2.56 531 548 其中 27P 具有聚乙炔衍生物中所知最強的電激發光亮度,於 12 V 下之亮度 約為 850 cd/m2。經由添加不同電洞或電子傳輸層,我們可以再提高發光元件之 亮度,同時也可有效降低驅動電壓。如以下各圖所示: 0 2 4 6 8 10 12 14 16 -100 0 100 200 300 400 500 600 700 800 900 Lum inanc e (c d/ m^ 2) Voltage (V) 27P + 5% PBD 27P 0 2 4 6 8 10 12 14 16 -200 0 200 400 600 800 1000 1200 1400 1600 1800 2000 2200 2400 1950 nm Lumin anc e ( c d/ m^ 2 ) Voltage (V) 27P 27P + 5% TPD (1000rps) 27P + 5% TPD (4000rps) 0 2 4 6 8 10 12 14 16 0 200 400 600 800 1000 1200 1400 Lum inanc e (c d/ m ^2) Voltage (V) 27P + 5% TPD 27P + 10% TPD 27P + 20% TPD
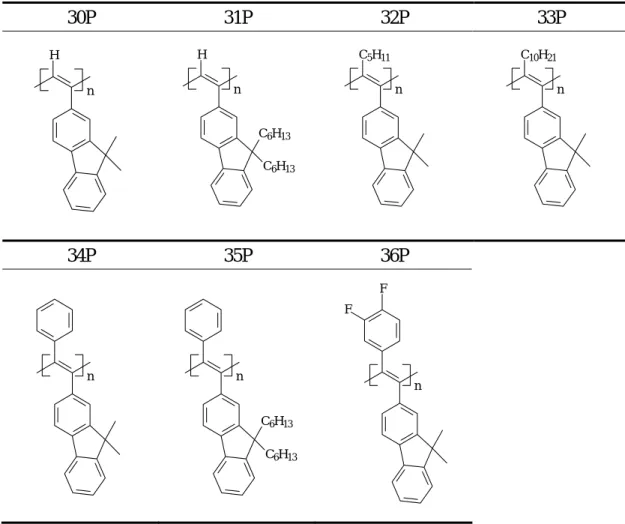
另合成聚合物 29P,此結構雖為雙取代聚乙炔衍生物,但取代基結構明顯不同於 前者,其 PL 及 EL 發光波長也由綠光範圍位移至藍光範圍,如下圖所示: (三)計畫之第三年部份 於第三年之計畫中,我們嘗試於雙取代之乙炔基單體上導入 fluorene 基團, 欲利用芴基本身的發光性質及導電性質來改善所合成聚乙炔衍生物的光電特 性。所合成含芴基之雙取代聚乙炔化合物結構如下圖: n C C C4H9 C4H9
]
[
300 350 400 450 500 550 600 0.010 0.011 0.012 0.013 0.014 0.015 0.016 0.017 0.018 0.019 425 nm 345 nm UV (29P) PL (29P) Wavelength (nm) Absorbance 0 2000 4000 6000 8000 10000 12000 14000 16000 In te n s ity ( a .u .)各聚合物之聚合反應條件及結果如下表:
Table 16 Polymerization results of polymers 30P ~ 35P.
Polymer Cat. Cocat. Solvent Temp.(℃) Yield(%) Mw Mw/Mn
30P [Rh(nbd)Cl]2 Et3N THF 80 48.6 56830 2.24
31P [Rh(nbd)Cl]2 Et3N THF 80 35.7 60340 1.73
32P TaCl5 n-Bu4Sn Toluene 80 10.2 2108 1.61
33P TaCl5 n-Bu4Sn Toluene 80 85.9 8597 1.22
34P TaCl5 n-Bu4Sn Toluene 80 51.3 315700 3.12
35P TaCl5 n-Bu4Sn Toluene 80 11.5 8385 1.84
各聚合物由於主鏈共軛系統的差異,表現出來的 PL 亦有較大的不同,波長 範圍可由紫外光區至黃光範圍,如下圖: 30P 31P 32P 33P 34P 35P 36P H n H C6H13 C6H13 n C5H11 n C10H21 n n C6H13 C6H13 n F F n
其中以 34P 之聚合效果最佳,將其製作成 EL 元件後量測電激發光性質,如下圖, 為黃光材料。 此外,我們亦將 36P 製作為 LED 元件,此結構之設計主要基於第二年計畫 中已合成的數種聚合物中,含雙氟苯基之 27P 具有超乎尋常的高亮度,因此亦於 本年的含芴基聚合物中導入一雙氟苯基,並探討其深入的光電性質。36P 的 EL 量測結果如下: 350 400 450 500 550 600 650 700 0.0 0.2 0.4 0.6 0.8 1.0 1.2 548nm 512nm 486nm 402nm Intensity (a.u.) Wavelength(nm) 30P 31P 32P 33P 34P 35P 0 1 2 3 4 5 6 7 8 9 0 20 40 60 80 100 120 140 160 180 n PFA5 Current Density Luminance Voltage (V) Curre nt Den s ity (mA/cm^ 2 ) 0 20 40 60 80 100 120 140 Lum ina n ce (cd/m ^ 2) 400 500 600 700 800 0.0000 0.0005 0.0010 0.0015 0.0020 0.0025 0.0030 0.0035 @ 8V 576 nm In te ns ity (a .u .) Voltage (V) EL
有光譜圖中可得知,此材料之光色紅位移至橘光偏紅的範圍,這樣的結果在 PA 衍生物中極少出現。 三、結果與討論 於三年計畫過程中,本實驗室合成出各種不同系列之炔類聚合物,其聚合或 光電性質結果亦已逐年發表於國際期刊中。由三年來綜合的結果可歸納出 PA 的 一般性質,就單取代之 PA 衍生物而言,其雖只具有微弱的 PL 效應,但聚合物 可保存有液晶相,加工後可得到具排列性質的高分子膜,適合應用於平面顯示器 的光學膜上。雙取代 PA 衍生物則視取代基的不同而可得到藍光、綠光、黃光及 橘紅光等不同性質的材料,這些不同的聚合物皆可進一步應用於 LED 元件的發 光層中,僅需使用高分子元件特有的塗佈方式即可輕易加工,成本較目前常用的 小分子蒸鍍方式降低許多,未來在顯示器工業上將具有極佳的競爭力。 四、已發表論文
1. C. H. Ting, C. S. Hsu, Jpn. J. Appl. Phys. 40, 2001, 5342 2. C. H. Ting, C. S. Hsu, J. Polym. Res. 8, 2001, 159
3. C. H. Ting, J. T. Chen, C. S. Hsu, Macromolecules, 35, 2002, 1180
0 2 4 6 8 0 50 100 150 200 250 300 350 400 450 500 Current Density Luminance Voltage (V) Current D e nsity (mA/cm^2) 0 10 20 30 40 50 60 70 80 90 Lumina nc e (c d/ m^ 2) 400 500 600 700 800 0.0 0.2 0.4 0.6 0.8 1.0 1.2 602 nm In te nsi ty (a .u. ) Wavelwngth(nm) EL at 4V F F n