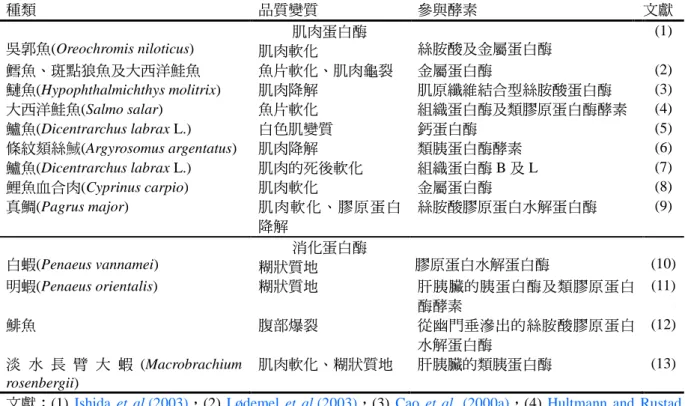
魚類肌肉的構造及組成與其死後蛋白質水解引起的變化 The Muscle Structure and Composition of Fish and Their
Changes Caused by Postmortem Proteolysis
邱思魁 Tze-Kuei Chiou
國立臺灣海洋大學生命科學院食品科學系名譽教授
Received 11 Februbary 2020; revised 12 May 2020; accepted 27 May 2020; available online 24 June 2020
摘 要
本文介紹魚類肌肉的構造與組成,以及死後蛋白質水解引起在消費及加工利用上重 要的品質變化。內容重點:(1)肌肉組織與構造,包括海產食品的肌肉組織、肌肉的本 質、結締組織、魚類肌肉構造與蛋白質、海產食品的蛋白質分類等項,(2)主要肌肉組 成分的生化性質,包括肌纖維、肌內結締組織、肌內脂等項,(3)魚類死後的肌肉代謝 與肌肉收縮,(4)魚類死後肌肉構造的變化,包括早期細胞內事件引起肌原纖維的斷片 化、內源性肌肉蛋白酶的活化、肌肉中主要的構造變化等項,(5)蛋白質水解與其引起 的肌肉變化,包括蛋白質水解、魚肉中觀察到的蛋白質水解、魚類和貝類的軟化、肌肉 龜裂、熱加工過程中魚肉膠體的脆弱化/軟化、肌肉的質地變化等項,(6)水生動物的蛋 白質水解酵素,(7)蛋白酶的貢獻角色,包括對死後自家消化變化的貢獻、在魚貝類肌 肉軟化上所扮演的角色等項。
關鍵字:魚類肌肉、肌肉蛋白質、肌肉構造變化、蛋白質水解、肌肉軟化、蛋白酶。
一、前言
魚類和貝類出現柔軟的(soft)或糊狀 的(mushy)質地似乎是嚴重的問題,因為限 縮貯藏期限,繼而影響市場銷售。在死後 處置(postmortem handling)和儲藏過程中,
*作者電子信箱:chioutk@mail.ntou.edu.tw
肌肉蛋白質會被內源性或微生物的蛋白 酶降解(Shigemura et al., 2004; Sriket et al.,
2011c),尤其時間長的貯藏甚且不當的條
件下,包括核苷酸以及含氮化合物的自家 消 化 (autolysis) 等 的 變 化 也 更 為 明 顯 (Selvakumar et al., 2002;Aubourg et al., 2007)。
通常,魚貝類在地區流通上大都冰
藏,這會造成容易出現質地的問題,即稱 為軟化(softening)或糊狀(mushiness),這樣 的變質(deterioration)經常是在貯藏期間受 到 消化酵 素 (digestive enzyme) 活性 的 作 用,從而縮短貯藏壽命可達一週(Pornrat et
al., 2007; Sriket et al., 2010)。冰冷藏的
(ice-chilled)魚貝類發生糊狀肉質,乃肌肉 組 織 逐 漸 且 連 續 地 降 解 , 包 括 肌 束 膜 (perimysium)和內肌膜 (endomysium)的結 締組織(connective tissue)、以及位於 Z-線 (Z-line)和 H-區(H-zones)等的蛋白質,受到 消化酵素或肝胰臟酵素(hepatopancreatic enzymes)的作用(Papadopoulos et al., 1989;Pornrat et al., 2007; Sriket et al., 2010)。魚
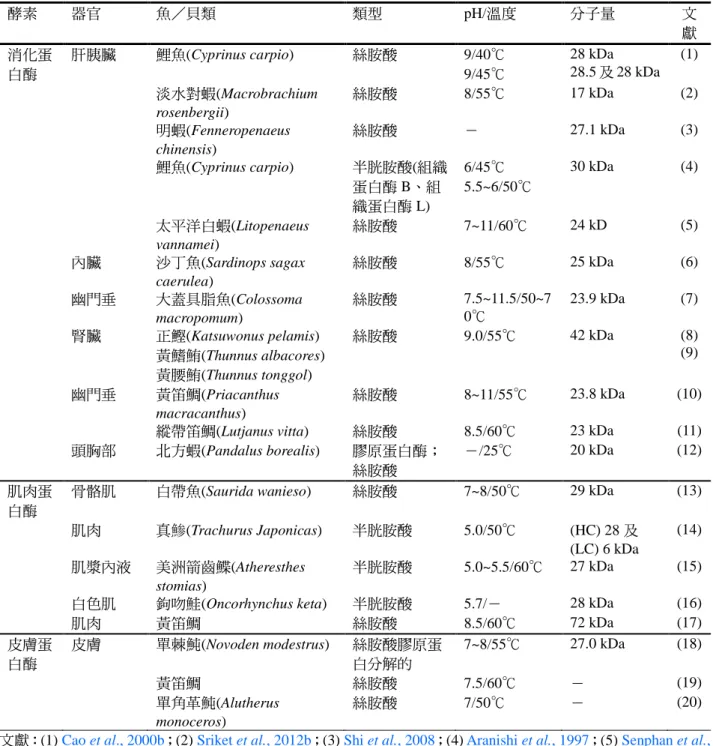
貝類的消化器官例如肝胰臟同時具有胜 肽 酶 〔 或 肽 酶 〕 (peptidase) 和 蛋 白 酶 (protease) 活 性 , 例 如 胺 基 肽 酶 (aminopeptidase) 、 明 膠 分 解 蛋 白 酶 (gelatinolytic protease)、胰蛋白酶(trypsin) 和胰凝乳蛋白酶(chymotrypsin)、以及膠原 蛋白分解蛋白酶(collagenolytic protease)等 (Cao et al., 2000b; Aoki et al., 2003;Sriket et al., 2011a),其中的膠原蛋白分解酵素對
肌肉軟化的影響很大(Brauer et al., 2003;Sriket et al., 2011c) , 膠 原 蛋 白 酶
(collagenases)定義為:在生理條件下,能 夠降解膠原蛋白的天然三重螺旋構造之 蛋白酶(Aoki et al., 2003)。此外,肌肉中原 有 的 蛋 白 酶 也 參 與 質 地 軟 化 等 作 用 (Yoshida et al., 2009;Felberg et al., 2010;
Sriket et al., 2011a),這些內源性肌肉蛋白
酶包括:細胞溶質的鈣蛋白酶(cytosoliccalpains)、溶酶體的組織蛋白酶(lysosomal cathepsins)和包含彈性蛋白酶(elastase)及 膠原蛋白酶組成的結締組織蛋白酶。在死 後貯藏初期魚類組織的質地變質,特別重 要的酵素包括鈣蛋白酶(μ-及 m-鈣蛋白 酶;活性所需的鈣離子濃度不同,前者在 μmole 而後者在 mmole 範圍)及組織蛋白 酶 B/H/L,以及天門冬胺酸組織蛋白酶 D (aspartic cathepsin D)等。
因此在肌肉軟化的現象上,瞭解蛋白 酶如何地作用,尤其具有膠原蛋白水解活 性的酵素,有助於漁民或業者面對在死後 處置或儲存期間,去預防或延遲那些蛋白 酶所涉及的品質損失,盡可能維持魚類和 貝類原有品質的高市場價值。蛋白酶的作 用基質對象為蛋白質,亦即魚貝類的肌 肉,基本上包括肌肉的組織構造與其構成 的各種肌肉蛋白質(muscle proteins)等。換 言之,捕撈後漁獲物除非立即凍結貯藏,
在冰藏或低溫冷藏的流通時,即通常在貯 藏中後期微生物活性開始發揮明顯的腐 敗作用之前,內源性酵素催化的各種反應 包括蛋白質水解(proteolysis)等仍主導死 後貯藏的變化,這終將修飾甚至破壞組織 結構與其構成蛋白質,肌肉的質地連帶也 受到影響,因而可能發生肉質的軟化、龜 裂(gapping)等問題。如上所述,這些即為 本文內容的重點。
二、肌肉組織與構造
1.海產食品的肌肉組織(Tahergorabi et al.,
2011)
肌肉組織是利用於加工處理而製成 各種食品產品的魚類可食用部分,這些肌 肉在結構、組成和功能上通常都與陸生動 物相似。海產食品(seafood)包含兩種肌肉 類 型 : 橫 條 紋 為 特 徵 的 橫 紋 肌 (striated muscle) , 無 此 特 徵 者 為 平 滑 肌 (smooth muscle) (Torres et al., 2007),橫紋肌再分為 白 [ 色 ] 肌 (white muscle) 和 暗 色 肌 (dark muscle),白色肉即普通肉(ordinary muscle) 分布於所有的部位,暗色肉包括位於魚體 表層(任何的魚類)、特別在側線下方附近 更多(海洋表層洄游魚類)的表層血合肉 (superficial dark muscle),以及在脊骨周圍 深部的真血合肉(true dark muscle) (鰹魚、
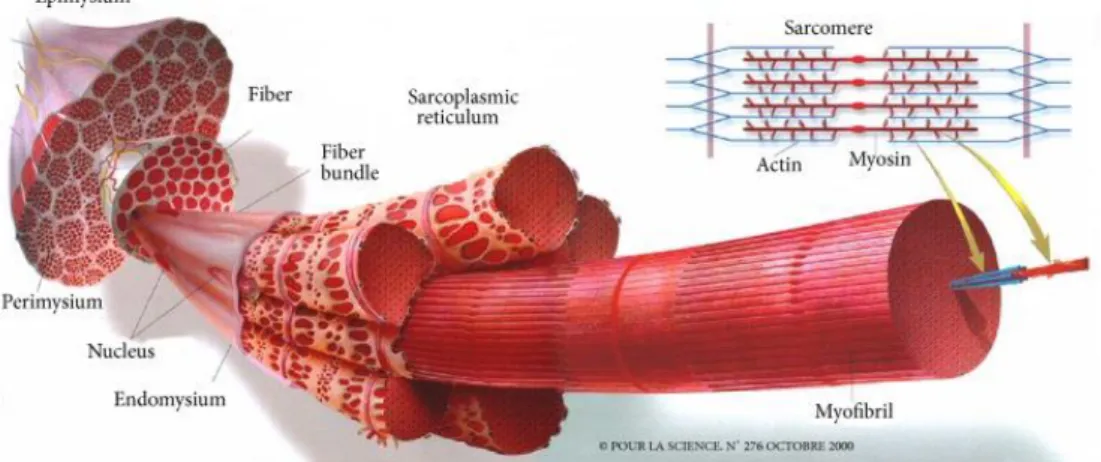
鮪魚等外洋洄游性中型及大型魚),含量因 魚種而異。普通肉是由分隔的肉塊(稱為生 肌節 myotome/myomere)組成(圖 1),這些 肉塊被結締組織(connective tissue)之肌隔 (myocommata/myosepta)包圍。
未 烹 煮 的 生 鮮 肌 肉 大 抵 是 半 透 明 的,由許多的纖維(fibers)組成(
Brown,
圖 1. 魚類肌肉(上圖)和單一的魚類肌肉塊(生肌 節;下圖)表示生肌節的折疊(生肌節被結締 組織的肌隔分隔)。來源:Tahergorabi et al.
(2011)。
1986),肌纖維(muscle fibers)為肌肉構造的
較小構成單元,透過結締組織的內肌膜集 合成束,並覆蓋著肌隔。肌纖維由許多彼 此平行的肌原纖維(myofibrils)組成,肌原 纖 維 之 間 的 間 隙 被 肌 漿 蛋 白 質 (sarcoplasmic proteins) 所 充 滿 (Suzuki,1981; Lanier et al., 2005)。
2.肌肉的本質(Eskin et al., 2013;
Listrat et al., 2016)
肌肉的基本構成單元為纖維,一種多 核的圓柱形細胞,周圍被稱為肌膜/肌鞘 (sarcolemma)的外層膜圍住,這些纖維聚 集成束,被結締鞘(connective sheath)之肌 束膜所束縛,纖維束又透過結締組織集合 在 一 起 , 並 被 結 締 組 織 鞘 之 外 肌 膜 (epimysium)覆蓋。對肉類與魚類的質地和 食用性都重要的結締組織,包括纖維狀蛋 白 質 (fibrous proteins) 、 膠 原 蛋 白 (collagen)、網硬蛋白(reticulin)及彈性蛋白 (elastin)等。較之於畜肉,魚類肌肉的結締 組織含量低甚多,故,嫩化(tenderization) 有關的問題少。
(1)宏觀尺度
骨骼肌(skeletal muscle)由大約 90%肌 纖維和 10%結締組織及脂肪組織(adipose tissue)組成。骨骼肌中的結締組織分為圍 繞每條肌纖維的內肌膜、圍繞肌纖維束的 肌束膜、圍繞肌肉全部的外肌膜等(Astruc,
2014a; 2014b),肌肉組織構造如圖 2
所示,骨骼肌也含有脂肪及量更少的血管與 神 經 組 織 。 在 魚 類 , 可 食 部 位 的 魚 片 (fillets)是由數塊肌肉(生肌節)組成,它們
圖 2. 肌肉的一般組織圖。骨骼肌主要由肌纖維及結締組織組成,後者在肌肉中的分布:包圍每條肌纖維 的內肌膜、將纖維束的肌肉分隔之肌束膜、及將肌肉的外部封包之外肌膜。在纖維內,肌原纖維占 據幾乎整個胞內體積,肌纖維的收縮單元為肌小節。來源:Listrat et al. (2016)。
交錯嵌合並被數毫米厚的結締組織鞘(肌 隔)所分隔,肌隔自脊骨軸延伸至皮膚,呈 現結構的連貫性,其作用乃確保一個生肌 節的纖維收縮力傳遞至另一個生肌節,且 直通至骨骼及皮膚,這具有肌肉和結締鞘 交 替 的 特 殊 結 構 , 稱 為 體 節 組 織 (metameric organization)。上市體形大小的 圓體魚(round fish),魚片的生肌節類似 W 形狀(圖 3),但橫切面的組織更複雜(圖
4),肌隔可視為家畜肌肉的外肌膜,魚類
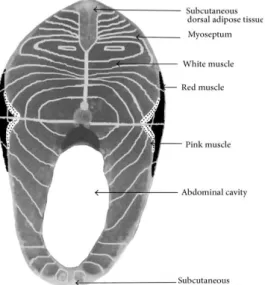
的其它肌內(intramuscular)結締組織如同 在陸生動物看到的。魚類肌肉的唯一特徵 即宏觀上三種主要肌肉類型為解剖學上 隔離的:白[色]肌、淺表層的紅[色]肌(red muscle) (沿著皮膚)和中層的粉紅[色]肌 (pink muscle),這些的肌肉存在每個生肌 節中(圖 4)。魚片也含有肌內脂肪組織,位 於肌纖維(myofibers)之間的生肌節和在肌 束膜內,但主要存在於將生肌節分隔之肌 隔。(2)微觀尺度
肌 纖 維 為 細 長 而 多 核 的 紡 錘 形 細 胞,大致上直徑 10~100 µ m,長度為數 mm (魚類)至數 cm (陸上動物),所有物種 的纖維大小都隨著動物年齡而增大,是出 生後肌肉生長的重要參數。肌纖維原生質 膜(plasma membrane)即是肌膜/肌鞘,纖維 的橫切 面積取決於 代謝和收縮類 型 (後 述)。在魚類,纖維的大小分佈根據肥大的 (hypertrophic; 由於體積增加而導致細胞 大小增大)和增生的(hyperplasic; 由於細
圖 3. 鮭魚的縱向面魚皮下面的魚片,表示兩肌肉 型態的生肌節的 W-形狀。來源:Listrat et al.
(2016)。
圖 4. 鱒魚的橫切肉塊中肌肉質量的組織及分布。
來源:Listrat et al. (2016)。
胞數量增加而導致肌肉體積增加)生長階 段等的重要性而變化。大的和小的纖維同 時存在,形成在魚類常看到的所謂馬賽克 (mosaic)般的結構(圖 5)。
不 論 種 類 , 排 列 成 束 的 肌 原 纖 維 (myofibril)幾乎占據了肌纖維的整個胞內 體積。單一肌纖維由直徑 1~2 μm 的肌原 纖維組成,是肌肉收縮的基本單元。與哺 乳動物不同的,魚類骨骼肌在結締組織薄 片之間排列的纖維長度相對短許多,短橫 薄片(肌隔)的結締組織將魚類肌肉分隔成
圖 5. 鱸魚(Dicentrarchus labrax)白色肌經 sirius red 及 fast green 染色。肌肉由粗與細纖維(直徑 分別約 100 與 10 μm)組成。來源:Listrat et al.
(2016)。
與 脊 骨 數 目 對 應 的 片 段 ( 即 生 肌 節 ) (Dunajski, 1979)。單一條肌原纖維被細小 管 網 狀 物 即 肌 漿 [ 質 ] 網 (sarcoplasmic reticulum)隔開,每條纖維的內部是稱為肌 漿(sarcoplasm)的液體基質,含有粒腺體 (mitochondria)、酵素、肝醣(glycogen)、腺 苷三磷酸(ATP)、肌酸(creatine)和肌紅素 (myoglobin)等。
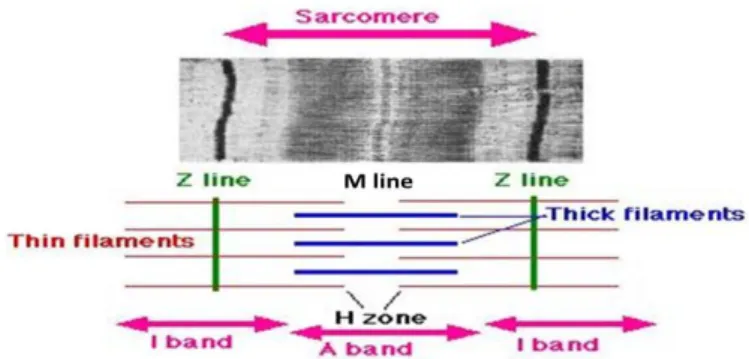
以相位差顯微鏡觀察肌原纖維的組 織結構,由於暗帶(或 A-帶 A-bands)和明 帶(或 I-帶 I-bands)的交替存在,可看出交 錯狀的橫紋,這樣的肌原纖維結構在魚類 和肉類非常相似。A-帶中有一較明亮的帶 (H-區)穿過,H-區的中心也有更暗的線即 M-線(M-line),而 I-帶的中央有一條暗線 稱 Z-線,肌原纖維的基本構成單元是肌 [小]節(sarcomere),即兩相鄰的 Z-線之間 即為一個肌小節,如圖 6所示。以電子顯 細不同的兩種絲狀(filaments),細肌絲(thin filament)主要由肌動蛋白(actin)、肌鈣蛋白 -T/-I/-C (troponin-T/-I/-C) (調節肌肉的收 (myosin)分子集合組成,具有 ATPase (ATP 酶 ) 活 性 催 化 AT P 降 解 為 腺 苷 二 磷 酸 (ADP),提供肌肉收縮所需的化學能。
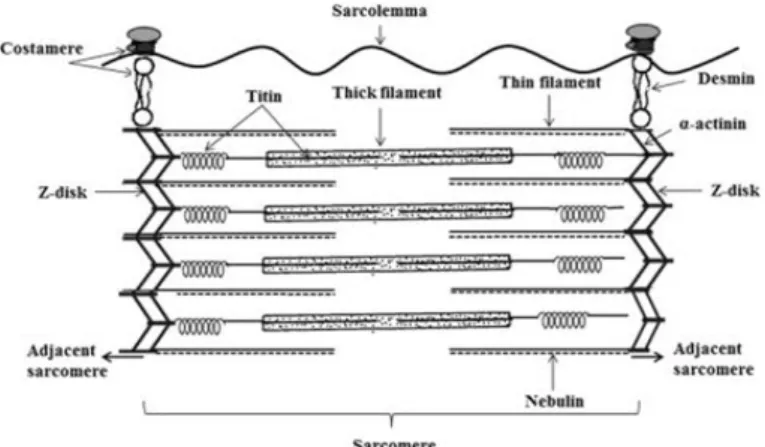
粗肌絲及細肌絲除外,還有肌聯蛋白 (connectin)和結蛋白(desmin)構成的絲狀 細胞骨架結構(filamentous cytoskeletal structure) (Young et al., 1980),肌聯蛋白是 肌肉中「間隙肌絲 gap filaments」的主要 肌原纖維蛋白質(myofibrillar proteins),遍 及 所 有 骨 骼 肌 的 肌 小 節 中 都 存 在 (Maruyama et al., 1976),Locker and Leet
圖 6. 肌肉的最小收縮單元之肌小節。來源:Wikipedia (2020)。
(1976a;
1976b) 指 出 在 過 度 伸 張
(overstretched)牛肉的纖維中,間隙肌絲跨 越粗肌絲與細肌絲之間的區域,Locker (1984)指出每條間隙肌絲在 A-帶形成一個
核心。Connectin (肌聯蛋白)的發現較早,後來得知 connectin 即是 titin (肌聯蛋白),
titin 由 titin-1、-2 和-3 等三個區分組成,
佔 雞 胸 肉 肌 原 纖 維 蛋 白 質 的 10~15%
(Wang et al., 1979),但 titin-3 後來已知是 不同的蛋白質,稱為伴肌動蛋白(nebulin) (Wang and Williamson, 1980)。又研究指出 結蛋白位在雞骨骼肌中 Z-盤(Z-disk)的外 圍(Lazarides and Hubbard, 1976;
Granger and Lazarides, 1978),可能扮演維持相鄰肌
小節的調準(alignment),使每條肌原纖維 的收縮過程一致。肌漿(肌纖維的細胞質 cytoplasm)中含有許多可溶性蛋白質,包 括醣解途徑(glycolytic pathway)的酵素和 肌紅素,肌紅素攜帶氧氣至線粒體,並染 紅細胞,油滴(lipid droplets)之外,還含有 肝醣顆粒,代表肌肉細胞的主要的局部能 量儲備。3.結締組織(Eskin et al., 2013)
肌細胞中的間隙空間占有三種蛋白
質:膠原蛋白、網硬蛋白和彈性蛋白,統 稱結締組織。圍繞肌纖維的內肌膜層是細 網狀膠原纖維(collagenous fibrils)組成,彈 性蛋白在肌肉中的分布稀落,與血液、毛 細 管 和 神 經 系 統 一 起 (Asghar et al.,
1984)。這些肌纖維集合成束,被更厚的結
締組織之肌束膜包圍,這些結締組織匯集 在 肌 肉 末 端 的 粗 肌 腱 纖 維 (thick tendon fibrils),如圖 7所示(Etherington and Sims,1981)。肌肉收縮時,移動透過肌腱傳遞至
骨骼,肌腱中的膠原蛋白其彈性有限,使 得肌肉收縮轉換成為高度的移動。結 締 組 織 的 主 要 蛋 白 質 是 膠 原 蛋 白,一種醣蛋白(glycoprotein),最初即認 為由兩種多肽鏈(polypeptide chains; α1-及 α2-鏈)組成 ,形成三重螺旋結構 (t ri pl e helical structure)。至少 10 種 α-鏈構成目前 已知的各種類型的膠原蛋白,膠原蛋白 I
圖 7. 肌肉中的結締組織。來源:Etherington and Sims (1981)。
型和 III 型是肌肉中最多量的,IV、V、
VI、XII、XIV、XV 和 XIX 型等較少,其 差別在於一級結構和胺基酸組成(Asghar
et al., 1984)。形態學上,三個離散的膠原
蛋白貯藏處――內肌膜、肌束膜和外肌 膜,構成了嵌在蛋白聚醣(proteoglycans) 基質上的膠原蛋白和彈性蛋白纖維的立 體網狀構造(Lepetit, 2008)。內肌膜圍繞每 條 肌 纖 維 及 覆 蓋 基 底 膜 (basement membrane) 的 結 締 組 織 層 (McCormick,1999)。肌束膜占肌內結締組織的大部分,
關 鍵 影 響 肉 類 質 地 的 差 異 (Lewis and
Purlow, 1990)。外肌膜圍繞各個肌肉的結
締鞘,並與肌腱相連而連結其它的肌肉 (McCormick, 1999),非常堅韌、耐剪切 (shear)且難溶解。膠原蛋白纖維(collagen fiber)的次單元(subunit)為膠原蛋白單體的 原膠原蛋白(tropocollagen),由三條多肽 α- 鏈組成,一條多肽鏈交錯重疊另一條鏈的 樣式排列。外肌膜和肌束膜兩者的主要組成分 是膠原蛋白 I 型,而 III、IV 和 V 型主要 存 在 於 內 肌 膜 (Bailey and Peach, 1968;
Bailey and Sims, 1977)。由於膠原蛋白是結
締組織的主要成分,對肉類質地的影響很 大,Bailey (1972)指出可接受的肉類質地 需 要 膠 原 蛋 白 分 子 之 間 有 些 的 交 聯 (cross-linking),這樣的鍵結過少或過多導 致肉質是較嫩或者較硬。年齡較老動物的 肉質韌度(toughness)偏高,可歸因於膠原 纖維中數量多且穩定的交聯(Eyre et al.,1984; Reiser et al., 1992),這些穩定的交聯
的相對數量決定烹煮肉的質地(Bailey and
Light, 1989; Bailey, 1989)。
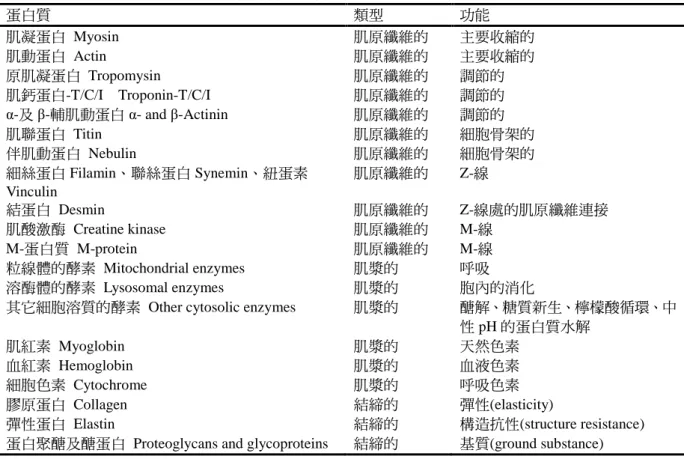
主要肌肉蛋白質的分類與功能,彙整 如表 1所示。
4. 魚 類 肌 肉 的 構 造 與 蛋 白 質 (Venugopal
and Shahidi, 1996; Delbarre-Ladrat et al., 2006)
魚類肉片的肌肉是順延著魚體兩側 的大塊體側肌(lateral muscles)形成,通常 白 色 至 灰 白 色 , 另 在 皮 下 肌 肉 (subcutaneous muscles)含有相當量的肌紅 素/肌紅蛋白,為紅色或深色肉(血合肉)。
魚類肌肉被結締組織的薄膜(肌隔)分隔成 片段(生肌節),每片生肌節都是由與魚體 的長軸平行而伸長的肌纖維組成,長度小 於 20 mm,直徑 0.02~1 mm,每條肌纖維 被含有薄膠原纖維之肌膜/肌鞘圍住,這些 細纖維和肌隔在生肌節‒肌隔接合點合併 一起,相對的,陸地動物的肌肉塊更加拉 長而形成了腱(Lampila, 1990)。一條肌纖 維具有細胞的所有成分,由 1000 至 2000 個肌原纖維集成,直徑可達 5 µm。肌原纖 維被片段化成為肌小節,由細肌絲和粗肌 絲構成,顯現出 Z-線所分界的重折光帶 (ani s ot ro pi c b and; A 帶 )和單折光帶 (isotropic band; I 帶)交替排列。肌肉收縮 時,肌凝蛋白組成的粗肌絲和肌動蛋白的 二 重 螺 旋 組 成 的 細 肌 絲 互 相 重 疊 和 滑 動。脊椎動物的粗肌絲含有 200~400 個肌 凝蛋白分子,與收縮機制有關的蛋白質尚 有原肌凝蛋白和肌鈣蛋白,都位於細肌絲 上(Skaara and Regenstein, 1990;
Suzuki,
表 1 主要肌肉蛋白質的類型與功能(Toldrá, 2006)
蛋白質 類型 功能
肌凝蛋白 Myosin 肌原纖維的 主要收縮的
肌動蛋白 Actin 肌原纖維的 主要收縮的
原肌凝蛋白 Tropomysin 肌原纖維的 調節的
肌鈣蛋白-T/C/I Troponin-T/C/I 肌原纖維的 調節的
α-及 β-輔肌動蛋白 α- and β-Actinin 肌原纖維的 調節的
肌聯蛋白 Titin 肌原纖維的 細胞骨架的
伴肌動蛋白 Nebulin 肌原纖維的 細胞骨架的
細絲蛋白 Filamin、聯絲蛋白 Synemin、紐蛋素 Vinculin
肌原纖維的 Z-線
結蛋白 Desmin 肌原纖維的 Z-線處的肌原纖維連接
肌酸激酶 Creatine kinase 肌原纖維的 M-線
M-蛋白質 M-protein 肌原纖維的 M-線
粒線體的酵素 Mitochondrial enzymes 肌漿的 呼吸
溶酶體的酵素 Lysosomal enzymes 肌漿的 胞內的消化
其它細胞溶質的酵素 Other cytosolic enzymes 肌漿的 醣解、糖質新生、檸檬酸循環、中
性 pH 的蛋白質水解
肌紅素 Myoglobin 肌漿的 天然色素
血紅素 Hemoglobin 肌漿的 血液色素
細胞色素 Cytochrome 肌漿的 呼吸色素
膠原蛋白 Collagen 結締的 彈性(elasticity)
彈性蛋白 Elastin 結締的 構造抗性(structure resistance)
蛋白聚醣及醣蛋白 Proteoglycans and glycoproteins 結締的 基質(ground substance)
1981)。肌肉主要由肌原纖維蛋白質組成,
在魚類,占蛋白質總量的 60~80%,高於 在哺乳動物的 40%。虹鱒白色肌的總蛋白 質 中 , 肌 原 纖 維 區 分 或 結 構 蛋 白 質 (structural proteins)占 64%,肌漿蛋白質占 30% (Howgate, 1979),魚類的肌漿蛋白質 占全部肌肉蛋白質的 20~50%,主要由醣 解酵素和其它參與細胞代謝的酵素等組 成(Nakagawa et al., 1988a; 1988b),而結締 組織蛋白質(膠原蛋白)占 3~10%。
欠缺如哺乳動物中的腱系統將肌肉 束(muscle bundles)連接至骨骼,魚類的肌 細胞平行排列,與繫在骨骼和皮膚的結締 組織鞘(肌隔)連接。哺乳動物和魚類骨骼 肌 的 特 徵 是 收 縮 蛋 白 質 (contractile
proteins) 精 確 地 建 構 成 為 條 紋 狀 肌 原 纖 維,亦即重複將構造單元的肌小節串聯排 列(
圖 8)。結蛋白中間肌絲(intermediate
filaments)處於戰略位置上橫向連接各個 肌原纖維的 Z-盤,使肌小節相互連接至肌 膜;換言之,在脊椎動物骨骼肌中 Z-盤連 結鄰近的肌小節,故其完整性對於各別肌 小節中肌動蛋白及肌凝蛋白肌絲的交互 作用是重要的(Takahashi, 1996)。一個中間 肌絲晶格(lattice)封包且連結所有肌小節 至膜細胞骨架(membrane cytoskeleton) (稱 為肋狀體 costamere)、線粒體、細胞核和 肌漿網。肋狀體及中間肌絲是固定結構性細 胞組成分,肋狀體在 Z-盤處將外圍肌原纖
圖 8. 肌原纖維的主要組成分示意圖。來源:Ahmed et al. (2015)。
維與肌膜連接之細胞骨架結構,構成的蛋 白質包括:血影蛋白(spectrin)、紐蛋素 (vinculin)、α-輔肌動蛋白(α-actinin)、肌萎 縮蛋白(dystrophin)、踝蛋白(talin)及細絲蛋 白 (filamin) , 而中 間肌 絲 主要 包括 結 蛋 白,在 Z-盤處連結肌原纖維,結蛋白由四 個分子量 53 kDa 的次單元組成,圍繞骨骼 肌中的 Z-盤,並在 Z-盤處連接相鄰的肌原 纖 維 (Huff-Lonergan
and Lonergan, 1999),對維持肌纖維的拉張力(tension)強
度和結構完整性,結蛋白中間肌絲是不可 欠缺的。肌萎縮蛋白(400 kDa)為肋狀體的 主要組成分,是富含紐蛋素的亞肌膜橫向 細 胞 骨 架 (sub-sarcolemmal transverse cytoskeleton),透過 C 末端與跨膜蛋白 (transmembrane proteins)結合,以及透過 N- 末 端 與 纖 維 狀 (F-) 肌 動 蛋 白 肌 絲 (fibrillary actin/F-actin filaments)結合。α- 輔肌動蛋白已知是脊椎動物肌肉中 Z-盤 的主要組成分,連結相鄰的肌小節,結構 強大而足以傳遞由個別肌小節的細肌絲 和粗肌絲交互作用所產生的拉張力。在骨 骼肌的肌原纖維中,α-輔肌動蛋白與 Z-盤的穩定性及組織有關(Goll et al., 1991;
Vigoreaux, 1994)。
肌凝蛋白是約 500 kDa 不對稱的六聚 體 蛋 白 質 , 包 含 數 個 結 構 和 功 能 區 域 (domains),肌凝蛋白組合成為粗肌絲,在 肌肉中的功能形式。聚合成為細肌絲的肌 動蛋白是肌肉中含量第二多的蛋白質,肌 動蛋白細肌絲和肌凝蛋白粗肌絲之間的 交互作用產生肌肉收縮力。聯結蛋白是肌 原纖維中第三高含量的蛋白質,迄今發現 的 最 大 蛋 白 質 (3000~3700 kDa) (Huff-Lonergan et al., 2010),在活生的骨 骼肌,肌聯蛋白約占肌原纖維的總彈性的 30% (Takahashi and Saito, 1979),占魚類肌 肉的肌原纖維蛋白質總量的 13% (Seki
and Watanabe, 1984) ; 由 α- 肌 聯 蛋 白
(titin-1)及 β-肌聯蛋白(titin-2)組成,以很薄 的彈性肌絲形式存在,將 Z-盤的 NH2-末 端連接至肌凝蛋白肌絲的 COOH-末端區 域(Maruyama, 1997),亦即在橫紋肌細胞 中,聯結蛋白至少有兩項的功能:提供模 板(template)給肌凝蛋白粗肌絲、結合 Z- 線中的α-輔肌動蛋白(Koretz et al., 1993)而作為粗肌絲和肌小節的 Z-線之間的彈 性連接元件(Wang and Jeng, 1992;
Joseph et al., 2001)。骨骼肌肌原纖維的另一重要
組成分為伴肌動蛋白,與肌動蛋白細肌絲 一同構成不可伸長的肌絲,座落於 I-帶的 伴 肌 動 蛋 白 是 另 一 種 高 分 子 量 蛋 白 質 (600~900 kDa),約占肌原纖維蛋白質總量 的 3~4%,伴肌動蛋白肌絲的一端繫在 Z- 線,並與肌聯蛋白肌絲平行,這些肌絲可 能 參 與 肌 動 蛋 白 肌 絲 的 維 持 與 調 節 (Huff-Lonergan et al., 2010)。肌肉蛋白質 的原肌凝蛋白及肌鈣蛋白都與肌肉收縮 的調節密切關連,和肌動蛋白結合在一起 的複合肌絲即是細肌絲;原肌凝蛋白是一 種二聚體蛋白質,魚類肌肉中的原肌凝蛋 白的同功型分佈已廣泛探討(Heeley andHong, 1994),肌鈣蛋白包含三個組成分,
各司有特定功能,肌鈣蛋白-C 結合 Ca2+, 肌鈣蛋白-I 抑制肌動凝蛋白(actomyosin) 的 ATPase 活性,肌鈣蛋白-T 提供讓肌鈣 蛋白結合至原肌凝蛋白(圖 9)。
在 骨 骼 肌 中 , [ 細 ] 胞 外 基 質
(extracellular matrix)或結締組織在結構上 和 功 能 上 都 很 複 雜 (McCormick, 1994;
Purslow, 1999)。膠原蛋白是胞外基質的主
要成分,負責肌隔的完整性和肌肉的機械 性質。結締組織是由封包肌肉的外肌膜、包圍肌纖維束的肌束膜及圍繞各別肌纖 維的內肌膜等組成。在硬骨魚肌肉,膠原 蛋白的主要兩種類型為 I 型和 V 型,各有 不同的生化特性(Bremner, 1992;
Sato et al., 1989)。
5.海產食品的蛋白質分類(Tahergorabi et
al., 2011; Coppes Petricorena, 2015)
蛋白質是海產食品肌肉組織的最重 要部分,占(濕重) 15~25% (
C onnell , 1980)。魚體重的 50~60%是肌肉,主要組
成分為 蛋白質 (16~21%) ,其餘為脂質 (0.5~2.3%)、灰分(1.2~1.5%)及碳水化合物 (0.5%左右),水分 52~82%。魚類具有兩種 肌肉類型:白色肌(普通肉)及紅色肌(血合 肉 ) , 白 肉 魚 例 如 鱈 魚 ( c o d ) 及 黑 線 鱈 (haddock)的血合肉比率很低,而多脂魚圖 9. 肌原纖維組織的示意圖。來源:Trinick (1994)及Campbell (1995)。
(fatty fish) 例 如 鯡 魚 (herring) 及 鯖 魚 (mackerel)的血合肉比率高;但是,普通肉 含較多的蛋白質(18~23%)。魚類蛋白質根 據溶解性的特徵而分為三大類:肌原纖維 蛋白質、肌漿蛋白質和基質蛋白質(stroma proteins) 等 , 分 別 占 肌 肉 蛋 白 質 總 量 的 70~80%、20~30%及 3%。
(1)肌原纖維蛋白質
構成肌原纖維的蛋白質,可溶於濃鹽 溶液(離子強度 0.6 以上),但在魚肉的常態 生理離子強度下則不溶於水(在虹鱒,離子 強度約 0.05)。肌原纖維蛋白質主要由肌凝 蛋白(占 65~78%)組成,以及肌動蛋白、原 肌凝蛋白、M-蛋白質(M-protein)、α-輔肌 動蛋白、β-輔肌動蛋白、c-蛋白質(c-protein) 及肌鈣蛋白-I/-C 等(Vareltzis, 2000),此 外 , 在 無 脊 椎 動 物 發 現 的 副 肌 凝 蛋 白 (paramyosin),脊椎動物的肌原纖維中並不 存在,含量因種類而不同(Vercruysse et al.,
2005)。魚類死後肌肉的縮短與其 pH 變
化、以及蛋白質水解會導致肌原纖維的崩 解,因而魚肉質地改變(Coppes Petricorenaet al. 2002; Coppes Petricorena, 2011)。
肌原纖維蛋白質提供許多水產加工 食品所需的功能特性。通常,海產食品的 肌原纖維蛋白質的熱穩定性低於來自陸 地動物者,pH 和離子強度等也影響熱穩 定 性 , 因 而 也 影 響 熱 誘 導 變 性 (heat-induced denaturation)。冷水域魚種的 肌原纖維蛋白質穩定性通常低於溫水域 種類者,此意謂兩海產食品的死後處置和 冷 凍 條 件 要 有 所 不 同 。 蛋 白 質 的 膠 化
(gelation) 與 質 地 形 成 有 關 的 流 變 性 質 (rheological properties),以及進而消費者接 受性等主要都取決於肌原纖維蛋白質的 品質,但也會受到海產原料的種類、年 齡、季節性、鮮度和加工參數例如蛋白質 濃度、pH、離子強度和溫度等影響(Suzuki,
1981)。魚類肌肉組織的構造,如圖 10
所示。
肌動蛋白占魚類肌肉的肌原纖維蛋 白質總量的 20%左右。肌動蛋白萃取容 易,但這特性卻衍生了問題,即要分離純 化肌凝蛋白時,因一起萃出的肌動蛋白在 溶 液 中 會 自 發 地 形 成 肌 動 凝 蛋 白 複 合 物,而阻礙肌凝蛋白的分離,因此,肌動 凝蛋白是鹽溶性魚類肌肉蛋白質的主要 形式。原肌凝蛋白和肌鈣蛋白調節肌肉的 收縮,前者的分子量 68 kDa,含兩個次單 元,是熱穩定性最高的肌肉蛋白質,容易
圖 10. 魚類肌肉組織的構造。來源:Hedges et al.
(2002)。
純化取得。在肌肉收縮過程中,肌鈣蛋白 是 原 肌 凝 蛋 白 作 為 鬆 弛 因 子 (relaxation factor)時所需的蛋白質。肌原纖維蛋白質 的水溶解性會因溫度、pH 和離子強度而 改變,過於偏酸或鹼性的 pH 和高溫都會 造成蛋白質變性,使溶解度降低(Suzuki,
1981)。
(2)肌漿蛋白質
由於大多數的組成分是肌紅素和水 解 酶 (hydrolases) 、 氧 化 還 原 酶 (oxidoreductases)、轉移酶(transferases)、
磷酸化酶(phosphorylase)、磷酸果糖激酶 (phosphofructose kinase) 和 轉 麩 醯 胺 酶 (transglutaminase),因此肌漿蛋白質的大 部分被認為是酵素,然而,這群蛋白質通 常會被膜蛋白污染,膜蛋白並非一定是可 溶的。每種蛋白質的含量在種類之間的變 動很大,例如有軟體類不含肌紅素。肌漿 蛋 白 質 含 有 稱 為 肌 蛋 白 / 肌 凝 蛋 白 原 (myogen)的幾種各自類型的水溶性蛋白 質,由於是完全水溶的,只要按壓魚肉組 織或以低離子強度鹽水溶液萃取,就可自 魚肉分離取得。與底棲魚類例如比目魚 (plaice) 和 鯛魚 (snapper) 比 較 , 表 層 魚 類 (pelagic fish)如沙丁魚(sardine)和鯖魚的肌 漿蛋白質含量通常較高。由於肌漿蛋白質 不會凝膠且保水力差,可能因而干擾膠體 形成過程中肌凝蛋白之間的交聯(Sikorski
et al., 1994)。肌漿蛋白質包括肌紅素、血
紅素(hemoglobin)、球蛋白(globins)、白蛋 白 (albumins) 和 一 些 水 溶 性 的 酵 素 等 (Connell, 1980)。在海產食品加工業,魚種鑑定是項重要的課題,有些國家甚至要求 在包裝上標示魚種。十二烷基硫酸鈉−聚 丙 烯 醯 胺 凝 膠 電 泳 (sodium dodecyl sulfate-polyacrylamide gel electrophoresis;
SDS-PAGE)被應用於種類的鑑定,肌漿蛋 白質作為標靶蛋白質(target proteins) (An
et al., 1989)。
(3)基質蛋白質
通常,肌肉蛋白質含約 3%基質蛋白 質,主要是由膠原蛋白及彈性蛋白(elastin) 組成,在肌肉構造中,基質蛋白質構成結 締組織。這些蛋白質完全不溶於水、酸或 鹼溶液、或生理鹽水溶液都無法萃取。彈 性蛋白非常耐濕熱,烹飪也不會影響。和 普通肉比較,血合肉含有較多的基質蛋白 質,但肌漿蛋白質含量較少。在一些魚類 例如鯊魚(shark)、魟(ray)及鰩(skate),基 質蛋白質占總肌肉蛋白質的 10% (w/w) (Venugopal, 2009)。
三、主要肌肉組成分的生化性質(Listrat et
al., 2016)
骨骼肌大約含 75%水、20%蛋白質、
1~10%脂肪及 1%肝醣。主要肌肉組成分 的生化性質說明如下述。
1.肌纖維
肌纖維通常以其收縮和代謝性質為 特徵(Lefaucheur, 2010; Astruc, 2014c)。收 縮性質主要取決於粗肌絲中的肌凝蛋白 重鏈同功型(myosin heavy-chain isoforms;
MyHCs),在大多數成熟哺乳動物的骨骼 橫紋肌中,所表現的 MyHC 有四種類型:
I、IIa、IIx 和 IIb,這些 MyHCs 的 ATP 酶 活性與收縮速度有關:慢速的(I 型)和快速 的(IIa、IIx 和 IIb 型),I 型纖維的收縮強 度低但抗疲勞,在姿勢肌(postural muscle) 和 呼 吸 肌 (respiratory muscle) 中 占 大 部 分。肌肉收縮需要來自 ATP 的能量,但不 同類型的肌纖維彼此的能量需求差異大 (Picard et al., 1998)。
肌 肉 中 ATP 的再生有兩種主要途 徑,其一為氧化的(需氧的)途徑(oxidative pathway),經由線粒體將丙酮酸(pyruvic acid)氧化,另一為醣解的(厭氧的)途徑 (glycolytic pathway),在肌漿內將丙酮酸轉 變為乳酸,這兩途徑的相對重要性決定了 代謝纖維(metabolic fiber)的類型:氧化型 (紅色肌;富含氧氣載體和肌紅素)、或醣 解型(白色肌;因氧氣需求的受限大,肌紅 素幾乎不存在)。一般而言,比起醣解型白 色纖維,氧化型紅色纖維的斷面積較小,
但 纖 維 類 型 之 間 的 差 異 程 度 也 會 因 肌 肉、以及同一肌肉內而改變,例如豬的半 腱肌(semitendinosus muscle)紅色部位,氧 化型纖維的斷面積大於醣解型者(Realini
et al., 2013),牛的腹直肌(Rectus abdominis
muscle)中的氧化型紅色纖維斷面積也大 於白色醣解型纖維(Oury et al., 2010)。肌 纖維是動態的結構,可根據以下的途徑從 某一類型轉變為另一類型:I ↔ IIA ↔ IIX↔ IIB (Meunier et al., 2010)。成熟哺乳動 物骨骼肌的不同類型纖維類的性質,整理 列表 2。不論種類,決定肌纖維組成的最 重要因素是肌肉類型,這很可能與其特定 的生理功能有關。任何肌肉其纖維的組成 都 依 種 類 而 變 化 , 因 此 , 豬 最 長 肌 (Longissimus muscle)所含的 I、IIA、IIX 和 IIB 型 纖維分別約 10%、 10%、 25%及 55%,牛最長肌中的 I、IIA 和 IIX 型纖維 平均含 30%、18%及 52%。肌纖維的組成
表 2 各種肌肉纖維類型的生物特徵(Lefaucheur, 2010)
I IIA IIX IIB
收縮速率 Contraction speed + +++ ++++ +++++
肌原纖維ATP酶 Myofibrillar ATPase + +++ ++++ +++++
收縮閾值 Contraction threshold + +++ ++++ +++++
每日收縮時間 Contraction time per day +++++ ++++ +++ +
抗疲勞 Fatigue resistance +++++ ++++ ++ +
氧化型代謝 Oxidative metabolism +++++ ++++ ++ +
醣解型代謝 Glycolytic metabolism + ++++ ++++ +++++
肌酸磷酸 Phosphocreatine + +++++ +++++ +++++
肝醣 Glycogen + +++++ ++++ +++++
三酸甘油酯 Triglyceride +++++ +++ + +
磷酯質 Phospholipids +++++ ++++ +++ +
血管形成 Vascularization +++++ +++ +, ++ +
肌紅素 Myoglobin +++++ ++++ ++ +
緩衝能力 Buffering capacity + +++ +++++ +++++
Z-線寬度 Z-line width +++++ +++ +++ +
直徑 Diameter ++ +, ++ ++++ +++++
註:+, 很低;++, 低;+++, 中;++++, 高;+++++, 很高。
也受到品種、性別、年齡、活動量、環境 溫度和餵養方法等的影響。
魚類也表現以收縮和代謝性質為特 徵的不同肌纖維類型,但對照哺乳動物或 鳥類,可觀察到魚類的兩種主要纖維類型 之間是解剖學上隔離的,例如在鱒魚,快 速纖維(fast fibers) (類似於哺乳動物的 IIB 纖維)位於魚體橫切面的中心,慢速纖維 (slow fibers) (類似於哺乳動物的 I 型)存在 於皮膚下方順沿著側線的周邊(Mascarello
et al., 1986),除這兩種主要纖維類型之
外,在某些魚種或發育階段也發現次要的 類型,如中間類型的粉紅纖維(pink fiber) 類型(相當於 IIA 類型)。這白色和紅色纖 維兩種主要類型分別與快速、慢速 MyHC 的表現有關(Rescan et al., 2001),但由於魚 類中同樣的纖維內會有數種 MyHCs 同時 存在,特別在直徑小的肌纖維中,故要將 一種 MyHC 同功型與纖維類型做系統性 地對照是有所困難的。2.肌內結締組織
圍繞肌纖維和肌纖維束的結締組織 是鬆散的,由細胞和胞外基質組成,後者 主 要 由 包 裹 在 蛋 白 聚 醣 (proteoglucans;
PGs)基質中的膠原蛋白纖維的複合網狀 物 組 成 (Abbott, 1977;
Bailey and Light, 1989; Astruc, 2014a)。膠原蛋白是纖維狀蛋
白質的一個家族,不論類型,其基本結構 單元(原膠原蛋白)是一種螺旋結構,三條 互相纏繞形成的螺旋狀多肽鏈組成,原膠 原蛋白分子透過鏈間的鍵結而穩定並形 成直徑 50 nm 的纖維,這些纖維經由分子內的鍵結(双硫鍵或氫鍵)或分子間的鍵結 (包括吡啶啉 pyridinoline 和脫氧吡啶啉 deoxypyridinoline)亦即交聯而趨於穩定。
骨骼肌中發現各種類型的膠原蛋白,纖維 狀膠原蛋白 I 型和 III 型是哺乳動物的主要 類型(Bailey and Light, 1989),在魚類則以 膠原蛋白 I 型和 V 型居多(Sato et al.,
1991)。結締組織的其它主要組成分為 PGs
(Nishimura, 2015),PGs 是複合的多功能分 子,由一個分子量 40~350 kDa 的核心蛋 白 質 以 共 價 鍵 結 合 數 十 個 糖 胺 聚 醣 鏈 (glycosaminoglycan chains)而組成,並透過 結合其它的 PG 和纖維狀蛋白(例如膠原蛋 白)形成更大分子的複合物,另也結合陽離 子(如鈉、鉀和鈣)和水(Iozzo and Schaefer,2015)。肌肉中的膠原蛋白的交聯比例和程
度 , 取 決 於 肌 肉 類 型 、 種 類 、 基 因 型 (genotype) 、 年 齡 、 雌 雄 和 身 體 運 動 量 (Purslow, 2005)。膠原蛋白總含量占成年牛 肌肉乾重的 1%至 15%,在商業屠宰體型 大 白 豬 的 肌 肉乾 重 介於 1.3% ( 腰 大 肌 Psoas major)至 3.3% (背闊肌 Latissimus dorsi) (Lebret et al., 1998),禽類的膠原蛋 白佔肌肉乾重的 0.75〜2% (Liu et al.,1996),在魚類也因魚種如從沙丁魚的 1%
至海鰻的 10% (Sato et al., 1986)、以及即 使同一種類和魚體前後段(尾部的量更多) 的不同等而變動(Sikorski et al., 1984)。PGs 只占肌肉乾重的一小部分(依肌肉而定,在 牛 0.05%至 0.5%) (Dubost et al., 2013)。
3.肌內脂
魚 類 的 肌 內 脂 含 量 也 是 因 種 類 而
異,從寡脂魚(lean fish)種類如鱈魚(cod) 的 3% 以 下 至 多 脂 魚 種 如 大 西 洋 鮭 魚 (Atlantic salmon)的 10%以上(Hocquette et
al., 2010),同一魚種之內也變動大,例如
鮭魚肉的脂肪含量在 8%至 24%之間變動 (Mørkøre et al., 2001)。四、魚類死後的肌肉代謝與肌肉收縮 1.肌肉代謝(Delbarre-Ladrat et al., 2006)
血液循環與氧氣供應停止之後,貯藏 肝醣很快地處於厭氧下降解,乳酸蓄積於 肌肉(Nazir and Magar, 1963;
Iwamoto et al., 1988; Watabe et al., 1989),導致魚肉
pH 從 7.4 附近降至 6,有時更低(Iwamoto etal., 1988; Watabe et al., 1989; Church, 1998) 。 死 後 數 小 時 內 (Mestre Prates, 2002
),肌肉滲透壓升高,ATP 量下降(Nazirand Magar, 1963; Iwamoto et al., 1988;
Watabe et al., 1989) , 氧 化 三 甲 胺
(trimethylamine oxide)被內源性酵素作用 及後來繁殖的細菌(當微生物活性出現)轉 變 為 三 甲 胺 (trimethylamine) (Church,1998), 一氧化氮(NO) 和活性氧(reactive
species of oxygen) 量 也 增 加 (Harper,1999)。由於 pH 下降及滲透壓變化,線粒
體和肌漿網變質而導致細胞溶質(cytosol) 釋出鈣離子,游離鈣的濃度可達 0.2 mM (Mestre Prates, 2002)。死 後 僵 直 (rigor mortis) 的 發 生 與 程 度,在生化特徵上為高能量的化合物完全 耗 盡 。 ATP 的 耗 盡 啟 動 死 後 僵 直 程 序 (Bate-Smith and Bendall, 1947;
Jeacocke,
1984),當 ATP 低於 2 μM (Reedy and Holmes, 1965),肌動蛋白和肌凝蛋白形成
不可伸展的肌動凝蛋白,整個魚體變得僵 硬。通常魚死後 1 至 6 小時後僵直開始 (Watanabe and Turner, 1993),但特別的 是,0℃貯藏鱸魚肌肉可延遲最長至死後 1.5 日。僵直狀態通常持續 1 日,然後死 後僵直解除,肌肉不再那般剛硬,但原有 的彈性已不復見。僵直受宰殺前緊迫的影 響很大:對照組鮭魚在死後約 8 小時的平 均僵直度達最大值,高度緊迫的魚在死後 30 分鐘就 進 入 僵直 階段 (Sigholt et al.,1997; Jerret and Holland, 1998; Skjervold et al., 2001)。
死亡後一段時間,稱為嫩化之逆向程 序在死後數小時內開始,並一直持續至貯 存期間。魚(Ando et al., 1991)和哺乳動物 (Koohmaraie, 1996)在死後貯藏的初期,嫩 化即開始。而被降解的主要結構為連結至 肌 小 節 和 至 原 生 質 膜 的 細 胞 骨 架 (cytoskeletal) (Taylor et al., 1995;
Steen et al., 1997; Taylor et al., 2002),但也有研究
提 出 , 胞 外 基 質 結 構 的 逐 漸 碎 解 (disintegration)也導致魚肉的嫩化(Ando etal., 1993)。嫩化的速度和程度依據種類和
其它因素而變化,特別是比起深海魚類,在表層魚類肌肉的降解更快速(Watabe et
al., 1989)。
2.肌肉收縮(Eskin et al., 2013)
雖大多數研究都以哺乳類動物肌肉 為對象,很明顯的,在魚類肌肉也發生同 樣的變化。魚類肌肉由紅色肌和白色肌兩
類 型 組 成 , 兩 者 的 僵 直 收 縮 (rigor contraction)不同。雖兩類型的比例因種類 而 不 同 , 紅 色 肌 都 未 超 過 全 部 肌 肉 的 10%,例如鮪魚(tuna)。Obatake and Heya
(1985)採用快速直接重量法測量 16 種煮熟
魚的血合肉和白色肌含量,紅肉魚如沙丁 魚、秋刀魚(saury pike)、圓花鰹(frigate mackerel)、鯡魚(frigate herring)、圓腹鯡 (round herring)、花腹鯖(common mackerel) 等的血合肉占全部肌肉的 12%以上,在真 鰺(竹筴魚)、斑鰶(gizzard shad)、花身雞魚 (tigerfish)、三線雞魚(grunt)等中間型魚種 介於 4~9%,而多帶海緋鯉(goatfish)、金 線紅姑魚(golden thread)、黃鰭鯛(yellow sea bream)和沙鮻(silago)等白肉魚的比例 低於 3%。暗色或紅色肌的特徵為含有高 量的肌紅素、以及特別的蛋白質(Hamoirand Konosu, 1965),與白色肌比較,魚類
的血合肉萃取物含有較多量的含氮組成 分 (nitrogen consitituents) 及 肌 酸 (Obatakeet al., 1985)。
魚類紅色肌的僵直收縮遠大於白色 肌,更接近哺乳動物紅色肌的收縮程度 (Buttkus, 1963)。死後魚類肌肉中,與死後 僵直的進展有關的收縮、拉張力(tension) 和彈性(elasticity)等的作用仍知之甚少。
Bate-Smith and Bendall (1956)發現兔肌肉
在僵直期間明顯縮短,但未連帶產生僵硬 (stiffening),且室溫下也很少發生。反之,長蛇齒單線魚(lingcod)和鱒魚(trout)的紅 色肌都在 20℃發生死後收縮(postmortem contraction),收縮速率可作為死前魚狀況
的指標(Buttkus, 1963)。
當魚體處於由
Cutting (1939)最早提
議的僵直前(prerigor)、完全僵直(full rigor) 和僵直後(postrigor)等不同的階段,Truccoet al. (1982)指出:採用視覺和觸覺方式判
定魚肉的剛性(rigidity)仍是再現性最佳的 方法,其結果顯示:嘉鱲(Sparus pagnes) 費時 10 小時進入死後僵直,約 30 小時後 開始解除,而鯷魚(anchovy)需約 55 小時,但一直至 80 小時後死後僵直的解除才明 顯。
Bito et al., (1983)開發利用剛性/僵直指
數(rigor index)的方法來確定魚類的死後 僵直階段,將整條魚的上半段放置平台 上,下半段尾部懸吊離開邊緣,每隔一定 的時間測量尾鰭基部與檯面之間的垂直 距 離 (L) , 計 算 僵 直 指 數 (%) = [(L0 – L)/L0 ] × 100%,其中 L0是死後立即測量 的值,L 值為不同時間後的值。Wang et al. (1998)採用僵直指數來檢
討養殖大西洋鮭(Salmo salar)的死後僵直 和 ATP 降解,所取得的數據與以黏度作為 嘉 鱲 的 僵 直 指 標 所 觀 察 得 到 的 樣 式 (Crupkin et al., 1979)相同,即大西洋鮭魚 死後 8 小時開始僵直,24~30 小時後達最 高值,60~70 小時後僵值完全解除。依據 僵直指數將魚類分類為不同的階段:僵直 之前的無僵硬(僵直指數<10%)、死後僵 直中的完全僵硬(僵直指數<100%)和僵 直後(僵直指數<10%),大西洋鮭魚肌肉 的 ATP 含量從 7.25 µmole/g 降至死後僵直 中的 0.14 µmole/g,此與鰈魚(plaice)達 100%僵直指數時的 ATP 降為<1 µmole/g(Iwamoto et al., 1987)的結果一致。大西洋 鮭魚在僵直前、僵直中和僵直後階段的 K 值 分 別 從 0.7% 升 至 10.6% 、 再 升 至 41.1%,這些數值都落入未緊迫養殖大西 洋 鮭 魚 所 測 得 的 範 圍 內 (Erikson et al.,
1997)。
五 、 魚 類 死 後 肌 肉 構 造 的 變 化
(Delbarre-Ladrat et al., 2006; Ahmed et al., 2015)
除了在冷藏後期發生由微生物活性 引起的肌肉腐敗,僵直解除之後魚類鮮度 的逐漸下降,可歸因於綜合了生化、物理 和結構變化等的影響。肌原纖維和胞外基 質的重要結構蛋白質的蛋白質水解斷裂 (proteolytic cleavage),以及死後肌肉中肋 狀體(將肌原纖維連接肌膜的 Z 盤之關連 構 造 ) 和 中 間 肌 絲 蛋 白 (intermediate filament proteins) (參與肌原纖維之間的聯 繫 之 蛋 白 質 ) 都 和 組 織 的 軟 化 有 關 (Delbarre-Ladrat et al., 2006),肌肉中的這 些死後變化從僵直之前即開始,並持續至 整個貯藏期間。Hernández-Herrero et al.
(2003)指出,比起肌原纖維蛋白質,魚類
軟化的原因更多是由於結締組織蛋白質 的降解,但這樣方式的降解發生在漁獲後 冷藏的後期。同樣,在死後的熟成(4oC 貯 藏)期間,牛肌內結締組織蛋白質的機械強 度變化緩慢,死後 10 日幾乎仍無變化,其後才漸次地下降,因此,肌內結締組織 似 會 影 響 牛 肉 長 時 間 熟 成 時 的 嫩 化 (Nishimura et al., 1998)。相較之下,主要
肌原纖維蛋白質的蛋白質水解,使魚類死 後 貯 藏 早 期 階 段 的 肌 肉 軟 化 進 展 更 快 (Taylor et al., 2002),在死後魚類肌肉,也 常見到醣解酵素含量多的肌漿蛋白質發 生降解(Hernández-Herrero et al., 2003)。
與死後魚類軟化有關的內源性肌肉 蛋白酶,包括細胞溶質的鈣蛋白酶、溶酶 體的組織蛋白酶和包含彈性蛋白酶和膠 原蛋白酶組成的結締組織蛋白酶。關於在 死後貯藏初期魚類組織的質地變質,特別 重要的酵素包括鈣蛋白酶(μ-和 m-鈣蛋白 酶)及組織蛋白酶 B/H/L,以及天門冬胺酸 組織蛋白酶 D 等。相配合時,死後的理化 條件(包括低溫、pH 降低及相對升高的肌 肉離子強度等)可能與內源性肌肉蛋白質 水解酵素之間以協同方式(synergy)作用,
從 而 改 變 蛋 白 質 的 交 互 作 用 及 構 形 (conformation) (Delbarre-Ladrat et al.,
2006)。
1.早期細胞內事件引起肌原纖維的斷片化 捕撈後貯藏早期所發生肌原纖維的 斷片化(fragmentation),加上隨後細菌的增 殖與作用而導致最終漁獲物的腐敗。死後 數分鐘內,肌肉中即發生一些的生化變 化,氧氣濃度急速下降,肌肉很快轉變成 厭氧狀態。捕撈後魚類肌肉中的生化變 化,包括磷酸肌酸(phosphocreatine)和肝醣 含量迅速減少,乳酸增加,ATP 量降低及 三 甲 胺 (trimethylamine) 含 量 緩 增 (Nazir
and Magar, 1963; Pawar and Magar,
1965),此外,脂質氧化、肌苷(inosine)和
次 黃 嘌 呤 (hypoxanthine) 濃 度 上 升(Delbarre-Ladrat et al., 2006)。
捕撈後數小時內,魚類肌肉的最明顯 變化為死後僵直的發生。僵直之前,肌肉 可伸展的狀態仍持續數小時,利用肌酸磷 酸和肝醣儲備來維持 ATP 的恆定供應,但 當 ATP 量下降,尤其在細胞內的濃度低於 2 μM,即啟動肌肉的死後僵直程序。肌動 蛋白和肌凝蛋白形成永久性的結合體,導 致肌肉喪失收縮或伸展的能力,最後肌肉 變僵硬(Delbarre-Ladrat et al., 2006)。在僵 直後階段,僵直的解除提高了肌肉的嫩 化,主要是由於肌肉蛋白質受到內源性鈣 蛋白酶和組織蛋白酶的水解所致(Ayala et
al., 2010),但也有研究指出,死後魚類軟
化的進展與死後僵直的解除無關(Ando etal., 1991)。
2.內源性肌肉蛋白酶的活化
在捕撈後的貯藏中,隨著肌肉滲透壓 的升高和肌肉 pH 的快速降低,一些生化 變化也隨同發生(Wang et al., 1998)。死後 肌肉 pH 和肌內離子強度的變化,可能是 活化或抑制蛋白酶的活性,以及透過調節 肌原纖維蛋白質的構形之方式,使之更易 受 到 蛋 白 質 水 解 的 斷 裂 (Yates et al.,
1983)。肌肉 pH 從漁獲後中性 pH 緩慢降
至最終 pH 6 或以下(Delbarre-Ladrat et al.,2006),哺乳動物肌肉中的肌內離子強度從
死 前 約 165 mM 氯化鈉 ,上升至死後 275~295 mM 氯 化 鈉 (Winger and Pope,1981),這些情況造成肌漿網、線粒體和溶
酶 體 等 膜 的 失 序 。 肌 漿 鈣 離 子 (sarcoplasmic calcium ions)的升高會活化μ-和 m-鈣蛋白酶,依鈣離子的濃度而定。
由於肌肉酸化(acidification) (pH 6.0~5.0) 而引起溶酶體膜的破壞,提高組織蛋白酶 的滲出與流入細胞溶質(Dutson, 1983),這 些蛋白酶的活化或協同作用導致魚類肌 原纖維的自家消化,以及伴隨而來死後魚 肉的軟化(Delbarre-Ladrat et al., 2006)。
3.肌肉中主要的構造變化
魚類肌肉為連接肌隔之生肌節組織 塊(tissue blocks),這樣結構讓肉原本就柔 軟的,特別當烹煮時,因為魚結締組織在 較低的烹煮溫度下是可溶解的。可是,魚 類的肌原纖維的死後結構變化非常少,且 實際上比哺乳動物更穩定;牛肉和綿羊的 結 構 變 化 已 相 當 瞭 解 (Ho et al., 1994;
Taylor and Koohmaraie, 1998; Taylor et al., 1995),即貯藏 7 天後 I-帶和肋狀體都明顯
斷裂。但截然不同,魚類的 I-帶幾乎未斷 裂(Busconi et al., 1989; Papa et al., 1997a;Taylor et al., 2002)。如先前所述,魚類和
哺乳動物的細胞骨架蛋白質(cytoskeletal proteins)在死後數天內就已降解,因此,魚類的肌原纖維的結構穩定性著實令人 意外,可能的解釋是這些結果是根據 4 種 精心處理樣品的電子顯微鏡觀察。事實 上,當純化取得魚(Tsuchiya et al., 1992;
Geesink et al., 2000)和哺乳動物(Olson et al., 1976; Taylor et al., 1995)的肌原纖維,
並量化肌纖維的斷裂程度,兩結果都顯示 死後大量的斷裂。因此,有必要採用機械 性破壞方式來證明魚類肌纖維的易脆性 (fragility) , 瞭 解 肌 纖 維 的 斷 片 化 指 數
(fragmentation index)與魚類質地的相關。
魚類(Taylor et al., 2002;
Papa et al., 1997b) 和 哺 乳 動 物 (Taylor et al., 1995;
Taylor and Koohmaraie, 1998)同樣在死後
24 小時內,顯示肌纖維與結締組織(內肌 膜)的脫離(detachment),這些斷裂的定量 結果表明與魚片質地有關,且很可能也可 以解釋許多早期的質地變化(Taylor et al.,2002)。如上述,肋狀體的降解和內肌膜的
脫離是由於鈣蛋白酶作用於細胞骨架蛋 白 質 所 致 。 哺 乳 動 物 (Taylor andKoohmaraie, 1998)和魚(Taylor et al., 2002)
的結締組織特別是內肌膜在死後是非常 穩定,但會與肌纖維脫離。內肌膜的脫離 是由於細胞骨架的斷裂如前所述,而不是 結締組織的降解。內肌膜至少在哺乳動物 也是熱穩定的,以掃描式電子顯微鏡觀察 肌肉萃取物,肌束膜顯現出一些的脆弱化 (weakening),但卻少見大量的斷裂(Andoet al., 1993)。魚肉貯藏約 5 天後,肌隔發
生 斷 裂 , 這 斷 裂 與 龜 裂 (gapping) 有 關 (Bremner, 1992)。貯藏期間,肌隔的力學 性質也下降(Love et al., 1972a),熱穩定性 很差(Yamaguchi et al., 1976),結締組織的 易脆性造成了魚片龜裂和長期貯藏的質 地變化(Taylor et al., 2002)。死後貯藏提供了讓維持肌肉微細結 構之主要肌原纖維與關連的蛋白質發生 蛋 白 質 水 解 的 降 解 (proteolytic degradation),這些變化可能包括 Z-盤的脆 弱化、肋狀體的釋出、結蛋白和肌肉萎縮 蛋白的崩解、α-輔肌動蛋白的消失、伴肌
動蛋白與肌聯蛋白與肌鈣蛋白-T 的蛋白 質水解,還有肌凝蛋白和肌動蛋白的降 解、原肌凝蛋白的非定域化(delocalization) 等。整體上,這些的死後變化造成了肌原 纖維的斷片化及脆弱化、失去肌肉細胞完 整性、以及最後在貯藏時魚類肌肉的嫩化 (Delbarre-Ladrat et al., 2006)。死後貯藏期 間許多的結構性肌肉蛋白質都被修飾,進 一步的瞭解請參考
Ahmed et al. (2015)的
綜述。六、蛋白質水解與其引起的肌肉變化 1.蛋白質水解(Toldrá and Reig, 2016)
蛋白質水解是包括蛋白質的降解和 小分子胜肽及游離胺基酸的生成之生化 現象。肌肉蛋白酶(組織蛋白酶 B 及 L 為 主)在微酸性條件和鈣蛋白酶在中性 pH 下 是有活性的,在死後魚類的 pH 範圍能夠 發揮作用,分解結構性肌原纖維蛋白質,
產生大分子胜肽和蛋白質片段。這樣的分 解影響及質地,使之軟化,而且大分子胜 肽可被肌肉肽酶水解,產生小分子胜肽和 游離胺基酸,這些都成為微生物可利用於 繁殖的基質(substrates)及/或將胺基酸再轉 化成其它化合物,例如生物胺 (biogenic amines)或氨等的不良風味。
蛋白質水解也是魚類加工過程中重 要的一群反應。實際上,蛋白質水解對質 地的影響很大,從而牽連至魚的軟化傾 向,因造成了負責肌肉構造的肌原纖維蛋 白質的分解,另產生的胜肽和游離胺基 酸,除直接影響滋味,也可作為進一步反
應的基質而貢獻香氣(Toldrá, 2006;
Toldrá et al., 2009)。通常,蛋白質水解為連續式
的階段,首先,鈣蛋白酶和組織蛋白酶作 用於主要的肌原纖維蛋白質,產生蛋白質 斷 片 和 中 度 分 子 大 小 的 多 肽 (polypeptides) , 然 後 再 被 二 肽 基 (dipeptidyl)及三肽基(tripeptidyl)肽酶進一 步 水 解 為 小 胜 肽 , 最 後 二 肽 酶 (dipeptidase) 、 胺 基 肽 酶 和 羧 肽 酶 (carboxypeptidases) 水 解 這 些 小分 子 胜 肽 而產生游離胺基酸。蛋白質水解的進展取 決於加工條件、肌肉類型和內源性蛋白質 水解酶的數量,例如溫度增高有利於酵素 的作用,弱酸性 pH 會增強溶酶體的酵素 (lysosomal enzymes)之組織蛋白酶活性。死後 pH 值的關係重大,因為不同的肽酶 的表現活性取決於 pH 值,並且對蛋白質 分解之影響可能也有所不同(Wang et al.,
2011)。魚肉採用含醋酸的石榴汁醃製,由
於低 pH 條件下蛋白質分解的程度高,釋 出 多 量 的 游 離 胺 基 酸 (Demirok et al.,2014)。蛋白酶也能水解肌原纖維和結締組
織之間的連結(Taylor et al., 2002),膠原蛋 白纖維也可被蛋白酶降解且影響及質地 (Sato et al., 2002)。蛋白酶在海產動物肌肉 的蛋白質水解中的作用,如圖 11所示。
2. 在 魚 肉 中 觀 察 到 的 蛋 白 質 水 解 (Delbarre-Ladrat et al., 2006)
細胞骨架組成分的蛋白質水解,導致 肌絲(myofilament)的降解(Busconi et al.,
1989; Ofstad et al., 1996)。依種類而定,在
魚 類 這 可 能 包 括 : 肌 聯 蛋 白 (Seki andWatanabe, 1984)、伴肌動蛋白(Astier et al., 1991)、肌肉萎縮蛋白(Papa et al., 1997b)
等的降解,α-輔肌動蛋白的釋出(Tsuchiyaand Seki, 1991; Papa et al., 1996),肌凝蛋
白的蛋白質水解和原肌凝蛋白的非定域 化(Astier et al., 1991)。大菱鮃(turbot)和沙 丁魚中的結蛋白雖被降解,但在鱸魚(sea bass) (Verrez-Bagnis et al., 1999)及石首魚 (croaker) (Busconi et al., 1989)並未發生。相反地,死後的牛肌肉中,結蛋白是鈣蛋 白酶的極佳基質,在 4℃熟成過程已大部
圖 11.死後處置及貯藏期間海產動物肌肉蛋白質水解中的蛋白酶作用。改自Singh and Benjakul (2018)。
分降解(Hwan and Bandman, 1989;
Taylor et al., 1995),將肌小節與肌膜連結之肋狀
體在死後 24 小時內也降解(Papa et al.,1997b; Taylor et al., 2002),大多數的變化
在不同魚種都是共同的,惟速率有所不同 (Ingolfsdottir, 1997)。尤其是鱸魚肌肉的變 化,包括肌膜的脫離、肌聯蛋白和伴肌動 蛋白的降解、以及來自 Z-線的 α-輔肌動蛋 白的釋出及蛋白質水解、肌肉萎縮蛋白的 降 解 等(Astier et al., 1991;Papa et al., 1996; Papa et al., 1997b)。鱸魚肌肉冷藏 4
天後的結蛋白仍未變化,但在沙丁魚已大 部分降解(Verrez-Bagnis et al., 1999),一種 16 kDa 的肌漿蛋白質(鑑定為核苷二磷酸 激酶 nucleoside diphosphate kinase)在貯藏 後也發生蛋白質水解(Verrez-Bagnis et al.,2001)。從肌原纖維中釋放出原肌凝蛋白;
在死後 0~48 小時,原肌凝蛋白萃取量在 5 mM EGTA (ethylene glycol tetraacetic acid;
乙二醇雙氨乙基醚四乙酸)的存在下隨著 時間而增加,採用 5 mM Ca2+的萃取物 中,原肌凝蛋白萃取量在 48 小時以後降 低(Astier et al., 1991)。
結締組織膠原蛋白在魚死後即被降 解,從掃描式電子顯微鏡分析冰藏期間的 肌肉,顯示肌隔之間和肌纖維之間的膠原 蛋 白 接 合 (collagen junctions) 逐 漸 地 降 解,可知膠原蛋白纖維網絡的結構變化與 死後嫩化有關(Ando et al., 1995)。肌細胞 周圍的結締組織中膠原蛋白纖維受到組 織破壞和降解,纖維之間的空隙也加大,
Bremner (1992)綜述魚肉結構中的膠原蛋
白的作用,指出這主要的胞外基質組成分 主導決定生鮮肉的質地屬性。冷藏期間的 膠原蛋白 V 型含量降低與魚肉的死後軟 化有關(Sato et al., 1997; Ando et al., 1999;
Shigemura et al., 2003),養殖大西洋鮭魚冰
藏時,膠原蛋白分子間的交聯可能斷裂 (Eckhoff et al., 1998),但大西洋鮭(Aidos etal., 1999)和大比目魚(halibut) (Olsson et al., 2003)貯藏期間膠原蛋白溶解度的變化
並無顯著差異,一些研究也指出在死後魚 肉中膠原蛋白是可溶解的,溶解度與質 地 、 季 節 和 水 溫 有 關 (Montero andBorderias, 1990; Sato et al., 1991; Aidos et al., 1999)。
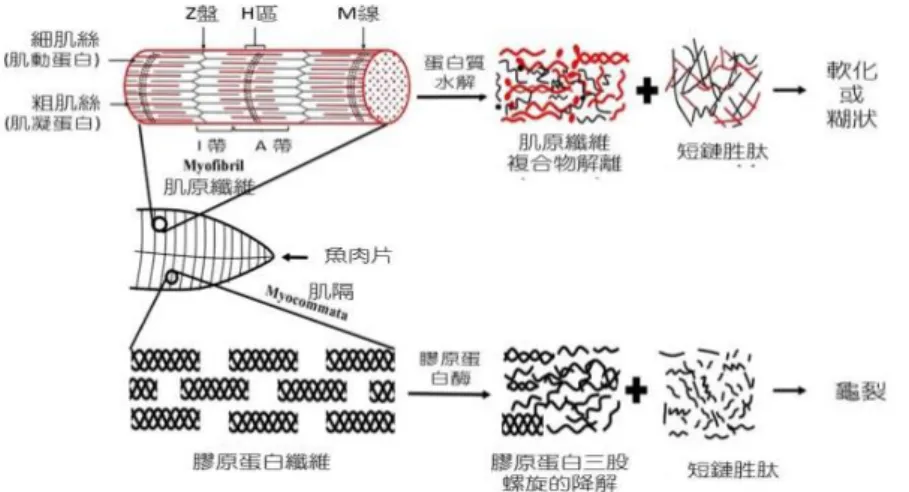
3.魚類和貝類的軟化(Singh and Benjakul,
2018)
魚死後,在死後處置和儲存期間發生 變質,其 pH 值和高水分及蛋白質含量的 狀態下,魚貝類容易受到酵素和微生物的 作用而腐敗。魚類的變質通常分為:死後 僵直(postmortem rigor)、解僵(resolution of rigor)、自家消化、細菌性腐敗(bacterial spoilage)等四個階段,這些階段發生的快 慢與時程的不同,依種類、生理條件、微 生 物 污 染 和 溫 度 而 定 (Lougovois and
Kyrana, 2005)。在貯藏或運輸過程中,消
化酵素可能被釋出,然後誘發大量的自家 消化。腸胃道內的蛋白酶會造成胃壁的破 裂和血液、水分的流出,這同時也伴隨蛋 白質和脂肪(Pushparajan et al., 2013)。另 外,肌肉組織中的蛋白酶譬如組織蛋白酶 和鈣蛋白酶能水解肌原纖維蛋白質,尤其針對肌凝蛋白重鏈(MyHC)。太平洋牙鱈 (Pacific whiting)冰藏 8 天期間,MyHC 明 顯被降解,但肌動蛋白的水解少(Benjakul
et al., 1997)。組織蛋白酶可降解鱸魚白色
肌的 MyHC 和 α-輔肌動蛋白,原肌凝蛋白 和肌動蛋白易受組織蛋白酶 L 的作用,但 肌鈣蛋白-T 不易被組織蛋白酶 D 水解,結 蛋白能被組織蛋白酶 B 和 L 降解(Ladrat etal., 2003)。由於肌肉組織中存在組織蛋白
酶 B + L + L-類似(L-like)活性,當反應溫 度為 55℃時,鯖魚肌肉 MyHC 的最大降 解速率在 pH 5.5 及 6.5 (Ho et al., 2000)。鯡魚肌肉的 MyHC 明顯易被組織蛋白酶 D 所降解,同時出現水解產物 150 及 128 kDa 兩新片段、 以及 4 個低分子量蛋白帶 (protein bands),顯示肌動蛋白和原肌凝蛋 白也都降解,另外出現的 100 kDa 蛋白 帶,如假定是輔肌動蛋白,很可能它並未 降解(Nielsen and Nielsen, 2001)。
與組織蛋白酶比較,鈣蛋白酶與肌原 纖維蛋白質的斷裂的關連性較低,但已知 它們會提高其它蛋白酶降解肌原纖維蛋 白質的敏感性。從 26.5 kDa 蛋白質含量僅 稍微減少之結果,推知μ-鈣蛋白酶對鱸魚 骨 骼 肌 的 肌 漿 蛋 白 質 的 作 用 有 限 (Verrez-Bagnis et al., 2002)。Taylor et al.
(1997)指出,肋狀體和中間肌絲的完全消
失,這造成鈣蛋白酶處理的鱸魚白色肌中 Z-盤的脆弱化。通常,鈣蛋白酶經由切斷 肌聯蛋白多肽肌絲而造成 Z-線的解體,其 活性也減弱肌聯蛋白/α-輔肌動蛋白間的 交互作用,導致從 Z-線釋出原本的 α-輔肌動蛋白,然後再被各種組織蛋白酶水解 (Ladrat et al., 2003)。
軟化或糊狀都和冰冷藏魚貝類肌肉 蛋 白 質 漸 進 地 降 解 有 關 。 膠 原 組 織 (collagenous tissue)的降解包含肌束膜和 內肌膜結締組織、以及位於 Z-線和 H-區 的蛋白質等,主要是蛋白酶的作用所引起 (圖 11)。魚貝類肌肉的緊實結構大多是膠 原蛋白所貢獻,因而膠原蛋白(I 型和 V 型) 的碎解,導致於肌纖維的瓦解(disruption) 和肉質的軟化(Kubota et al., 2003; Yoshida
et al., 2009)。黃鳍鮪(yellowfin tuna)於 4℃
貯存 1 天內,通常都會發生膠原蛋白纖維 (collagen fibrils)的崩解(Shigemura et al.,
2004)。 Saito et al. (2000)指出,膠原蛋白 V
型的專一性酵素的存在,造成冷藏虹鱒 (rainbow)和沙丁魚肌肉的軟化。在冷藏鱒 魚肌肉,當膠原蛋白 V 型的溶解增加,肌 肉緊實度(firmness)即降低,認為是膠原蛋 白酶的作用(Sato et al., 1991)。從太平洋藍 鰭鮪(Thunnus orientalis)貯藏期間肌肉的 組織學研究,也顯示細胞周圍的結締組織 發生碎解(Nakamura et al., 2005)。貝類冰藏期間也發生軟化與糊狀的 質地。大蝦於 5℃貯藏 3 天後,肌肉的肌 原纖維蛋白質中 Z-線的排列密度和次序 都降低,4 至 6 天後 Z-線、I-帶和 M-線已 逐漸破壞,至第 14 天肌肉的剪切力(shear force)從最初的 18.21 連續降為 10.79 N/cm (Pornrat et al., 2007)。蝦類的頭胸部含有肝 胰臟等各種器官,已知存在胺基肽酶、羧 肽酶 A 和 B、組織蛋白酶 C、胰凝乳蛋白
酶和膠原蛋白酶等,具有肽酶和蛋白酶活 性 , 可 降 解 膠 原 蛋 白 的 三 重 螺 旋 結 構 (Garcia-Carreno et al., 1994;
Sriket et al., 2011b)。淡水蝦類肝胰臟中的胰蛋白酶可
迅速降解蝦肉的 I 型膠原蛋白(Sriket et al.,2011b)。
4.肌肉龜裂(gapping) (Singh and Benjakul,
2018)
肌肉組織的龜裂是與質地變化有關 的另一現象。魚類及貝類的肉分割為肌細 胞塊(blocks of muscle cells),再被肌隔之 結締組織分隔成生肌節(圖 11),每個肌細 胞或纖維都圍繞著結締組織,這些結締組 織透過細膠原纖維而附著在肌細胞尾端 的肌隔。在冷藏期間,這些的纖維受到內 源性膠原蛋白酶的作用而變質(Bremner
and Hallett, 1985),導致肌隔與肌肉層分
離,因而引起魚片的龜裂(圖 11)。絲胺酸 蛋白酶(serine protease)、胰蛋白酶和胰凝 乳蛋白酶能切斷結締組織,而引起魚片的 龜裂。達 17°C 時,大西洋鱈魚(Pacific cod)都會發生龜裂,可能由於結締組織的 降解和高溫僵直,使得肌肉迅速收縮所致 (Lødemel and Olsen, 2003)。大西洋鱈魚、斑點狼魚(wolffish)和大西洋鮭魚在冰藏 期間也出現龜裂,已知基質絲胺酸蛋白酶 (matrix serine proteases; MSPs)和基質金屬 蛋白酶(matrix mettaloproteases; MMPs)可 切斷數種的胞外基質蛋白質,例如膠原纖 維。斑點狼魚和鱈魚肌肉中測出 MSPs 活 性,但鮭魚肌肉僅有 MMP 活性(Lødemel
and Olsen, 2003)。Kubota et al. (2003)證實
MMP-9 會影響魚肉的龜裂,當鈣離子存在 及 pH 7-9 時,這些酵素的活性最大(Saito et
al., 2000; Wu et al., 2008; Sriket, 2014);大
眼鯛(bigeye snapper)的魚皮也含有能降解 膠 原 蛋 白 的 β- 、 α1- 和 α2- 鏈 之 蛋 白 酶 (Nalinanon et al., 2008)。5.熱加工過程中魚肉膠體的脆弱化/軟化 (Singh and Benjakul, 2018)
加熱或烹煮時,有些魚類會發生液化 (liquefaction)或軟化,被消費者拒受。煮 熟太平洋鱈魚肉的糊狀是原生動物寄生 蟲的黏孢子蟲(Myxosporea)感染而引起,
因 在 魚 肉 內 分 泌 蛋 白 酶 (Tsuyuki et al.,
1982)。除了魚肉,魚肉產品尤其煉製品膠
體(fish gels)的質地軟化也是項問題,因為 市 場 價 值 和 消 費 者 接 受 度 降 低 。 魚 漿 (surimi/fish mince)會受到內源性蛋白酶的 降 解 (Benjakul et al., 2003d;Zhou and
Li-Chan, 2009),魚漿膠體加熱時,內源性
熱活化(heat-activated)蛋白酶介入肌肉蛋 白質的降解,導致於膠體軟弱,膠體軟化 或 膠 體 脆 弱 化 在 日 文 稱 為 modori (Benjakul et al., 2004)。肌肉組織中的蛋白 酶在 50℃附近至 60℃時的活性高,引發 肌 原 纖 維 蛋 白 質 尤 其 肌 凝 蛋 白 重 鏈 (MyHC)的降解快速且激烈,相對的肌動 蛋白的水解程度低而較穩定(Benjakul etal., 2003a),魚漿膠體的脆弱化(modori 現
象)因魚種的不同而差異大。魚類肌肉組織 中 發 現 的 主 要 蛋 白 酶 種 類 也 因 魚 種 而 異,可分為兩群:組織蛋白酶和熱穩定鹼 性蛋白酶(heat-stable alkaline proteases)。在太 平 洋 牙 鱈 和 美 洲 箭 齒 鰈 (arrowtooth flounder) (Wasson et al., 1993)、以及大麻 哈魚(chum salmon)、鯖魚(Lee et al., 2016) 等都存在組織蛋白酶 B、H 和 L 所介導的 高 活 性 半 胱 胺 酸 蛋 白 酶 (cysteine protease),在白帶魚(lizardfish)也發現與肌 原纖維關連的絲胺酸蛋白酶在 55~60℃間 水解 MyHC (Cao et al., 2000a)。相對於曳 絲大眼鯛(Priacanthus taayenus),大眼鯛 (紅目鰱,P. macracanthus)的魚漿和漂洗魚 漿中 MyHC 的降解都很明顯,很可能是肌 漿的蛋白酶(sarcoplasmic protease)含量較 高(Benjakul et al., 2003a)。Toyohara et al.
(1990)
指 出 , 金 線 魚 (threadfin bream) 的 MyHC 降解並非是熱活化蛋白酶主導,而 是 凝 膠 降 解 誘 導 因 子 (gel-degradation inducing factor; GIF)的介入,GIFs 可能以 肌漿的 GIFs 型式存在因而容易被漂洗除 去,或者是與肌原纖維基質緊密結合(肌原 纖維的 GIF 型式),肌漿的 GIF 引起金線 魚的膠體降解,肌原纖維的 GIF 普遍存在 於 馬 面 魨 (oval-filefish) (Toyohara et al.,1990)。
當白帶魚魚漿分別在 65℃及 60℃加 熱,未漂洗組的 MyHC 降解大於在漂洗 組,很可能是漂洗過程中除去了肌漿蛋白 酶;白帶魚的自家消化隨加熱時間的延長 而增加,因 SDS 膠體電泳中 MyHC 蛋白 帶的強度下降,三氯醋酸(trichloroacetic acid)可溶性胜肽量增加 (Benjakul et al.,
2003c)
。Yongsawatdigul and Piyadhammaviboon (2004)也指出,白帶魚
未漂洗及漂洗魚漿在 pH 6 及 7 的自家消 化速率最大(65℃加熱)。因此在 60~65℃
具有活性的原有蛋白酶貢獻於白帶魚未 漂洗魚漿及漂洗魚漿中的蛋白質降解和 膠 體 脆 弱 化 (Benjakul et al., 2003d;
Yongsawatdigul and Piyadhammaviboon, 2004)。
內源性蛋白酶影響未漂洗或漂洗魚 漿的膠體質地特性。當鯉魚漂洗魚漿中,
加入純化自鯉魚背部肌肉之組織蛋白酶 L,膠體中的 MyHC 被重度水解,破斷力 (breaking force) 下 降 24.3% (Hu et al.,
2012),同樣地,加入來自鰱魚(silver carp)
肌肉的組織蛋白酶 L 或 B,對照於控制 組,膠強度(gel strength)分別下降 38%及 25%,而添加織蛋白酶 L 組的破斷力和變 形度(deformation)分別降低 25%及 18%,顯示組織蛋白酶 L 會強力水解魚漿的膠體 構造而造成軟化。鯖魚漂洗魚漿加入鈣蛋 白酶處理後,膠強度的下降不明顯,但添 加組織蛋白酶 L 及 L-類似兩者和其中的 一種(55℃反應 2 小時),即顯著降低(Ho et
al., 2000)。 Benjakul et al. (2003c)指出在白
帶魚,肌原纖維關聯的蛋白酶既是半胱胺 酸也是絲胺酸蛋白酶,肌漿蛋白酶的特徵 為熱活化的鹼性蛋白酶(最適 pH 8.0 及溫 度 65℃),而在熱誘導膠化(hrat-induced gelation)期間白帶魚肌原纖維蛋白質的降 解,這導致膠體脆弱化,內源性肌漿的和 肌原纖維關聯的蛋白酶都扮演重要的作 用。6. 肌 肉 的 質 地 變 化 (Eskin et al., 2013;