高油飲食或糖水誘發代謝症候群之作用及機制探討
全文
(2) 目. 錄. 縮寫對照表……………………………………………………………….....I 縮寫對照表 I 組別縮寫意………………………………………………………..……….III III 組別縮寫意 摘要…………………………………………………………………...…....IV IV 摘要 Abstract……………………………………………..…………………...VⅡ VⅡ 第一章 前言………………………………………………………………...1 前言 第二章 文獻回顧…………………………………………………………...2 文獻回顧 一、代謝症候群定義與盛行率 代謝症候群定義與盛行率…………………………………….............2 定義與盛行率 (一)代謝症候群之定義 代謝症候群之定義………………………………………...……….…....2 (二)代謝症候群之判定 代謝症候群之判定…………….………………….………………….......2 (三)代謝症候群在台灣之判定標準與盛行率………………………………….3. 二、代謝症候群的發生…………………………………….…......................5 代謝症候群的發生 (一)胰島素訊息傳遞與胰島素阻抗………………………………………..….6 (二)脂肪細胞激素與代謝症候群之關聯……………………………………….7 1. leptin……………………………………………………………………7 2. adiponectin……………………………………………………………...8 3.resistin…………………………………………………………………...8 4. TNF-α…………………………………………………………………...9 5. IL-6……………………………………………………………………..9 6. PAI-1…………………………………………………………………..10. 三、高糖( 高糖(蔗糖)、 蔗糖)、高脂 )、高脂( 高脂(飽和油脂) 飽和油脂)飲食與代謝症候群之相關性...10 飲食與代謝症候群之相關性 (一)飲食誘發代謝症侯群實驗動物模式……………………………..………10 (二)蔗糖(或其中果糖 蔗糖 或其中果糖)引發代謝症候群的生化與分子機制 或其中果糖 引發代謝症候群的生化與分子機制……………………11 (三)高油脂(飽和脂肪酸 高油脂 飽和脂肪酸)引發代謝症候群的生化與分子機制 飽和脂肪酸 引發代謝症候群的生化與分子機制…………………12.
(3) 四、肝中脂質生合成之轉錄調控………………………………………...13 肝中脂質生合成之轉錄調控 (一)SREBP-1c與 與ChREBP轉錄因子 轉錄因子…………………………………………13 (二)肝中SREBP-1c、 、ChREBP與胰島素敏感性 與胰島素敏感性………………………………14 肝中. 五、Paternally expressed 1(Peg1) )/mesoderm specific transcript (Mest) ) 與肥胖之相關性……………………………………………………….…..15 與肥胖之相關性 第三章 材料與方法…………………………………………………….…17 材料與方法 一、動物飼養………………………………...................................................18 二、飼料配製………………………………..…………………….................18 三、動物犧牲與樣品收集…………………..……………………....................20 四、禁食血清脂質分析………………………………………………………..20 (一)三酸甘油酯含量測定……………………………………………………20 (二)膽固醇含量測定……………………………………………………….21 五、肝臟、 肝臟、肌肉脂質分析……………………………………………………..23 (一)均質液製備…………………………………………………………….23 (二)三酸甘油酯含量測定……………………………………………………23 (三)膽固醇含量測定……………………………………………………….24 六、禁食全血與血清葡萄糖含量分析…………………………………………24 (一)全血葡萄糖含量測定…………………………………………………..24 (二)血清葡萄糖含量測定…………………………………………………..24 七、口服葡萄糖耐受測試 Oral Glucose Tolerance Test (OGTT)……………….25 八、胰島素耐受測試 Insulin Tolerance Test (ITT)……………………………..26 九、禁食血清胰島素含量測定…………………………………………………26 十、禁食血清瘦素含量測定……………………………………………………27 十一、禁食血清 adiponectin 含量測定………………………………………….29 十二、 十二、禁食血清尿酸測定……………………………………………………..30 十三、西方點墨法(Western 西方點墨法 blot)分析肝臟 分析肝臟 SREBP-1c、 、ChREBP 蛋白質表現…..31.
(4) 十四、脂肪組織包埋切片……………………………………………………..32 十五、Real-time PCR 分析肝臟、 )mRNA 含量……………………34 分析肝臟、副睪脂( 副睪脂(EP) 十六、統計分析………………………………………………………………41. 第四章 結果………………………………………………………….........42 結果 第五章 討論…………………………………………………………….....92 討論 第六章 結論……………………………………………………………...102 結論 第七章 參考文獻………………………………………………………...104 參考文獻.
(5) 表 目 錄 表 2- -1 台灣代謝症候群之判定標準 台灣代謝症候群之判定標準…………………………………………………...3 之判定標準 表 2- -2 台灣代謝症候群及組成因子盛行率………………………………..……….....4 台灣代謝症候群及組成因子盛行率 表 2- -3 92 年國人代謝症候群相關疾病醫療費用……..………………………………..5 年國人代謝症候群相關疾病醫療費用 表 3- -1 高脂飼料組成 ………………………………………………………………...19 表 4–1 四組大鼠之攝食、 四組大鼠之攝食、飲水和能量攝取……………………………………………50 飲水和能量攝取 表 4- -2 大鼠餵食試驗飲食 大鼠餵食試驗飲食 5 個月之初、 個月之初、終體重及體重增加量…………………….51 終體重及體重增加量 表 4- -3 大鼠轉換正常飲食四週之初、 大鼠轉換正常飲食四週之初、終體重及體重增加量……………………….52 終體重及體重增加量 表 4- -4 大鼠餵食試驗飲食 5 個月之絕對與相對組織重…………………………….53 個月之絕對與相對組織重 表 4- -5 大鼠餵食試驗飲食 5 個月之肝臟 個月之肝臟、 肝臟、肌肉內脂質含量……………………….63 肌肉內脂質含量 表 4- -6 大鼠餵食試驗飲食 5 個月之肝臟和脂肪組織內基因表現量….....................76 個月之肝臟和脂肪組織內基因表現量 表 4- -7 四組小鼠之攝食、 四組小鼠之攝食、飲水和能量攝取………………………………………….77 飲水和能量攝取 表 4- -8 小鼠餵食試驗飲食 小鼠餵食試驗飲食 5 個月之初、 個月之初、終體重及體重增加量…………………….78 終體重及體重增加量 表 4- -9 小鼠餵食試驗飲食 5 個月之絕對與相對組織重………..……………………79 個月之絕對與相對組織重 表 4- -10 小鼠餵食試驗飲食 5 個月之肝臟 個月之肝臟、 肝臟、肌肉內脂質含量………………………84 肌肉內脂質含量 表 4- -11 小鼠餵食試驗飲食 5 個月之肝臟和脂肪組織內基因表現量………………91 個月之肝臟和脂肪組織內基因表現量 表 5- -1 大、小鼠餵食試驗飲食 5 個月誘發之代謝症候群症狀…………………….100 個月誘發之代謝症候群症狀.
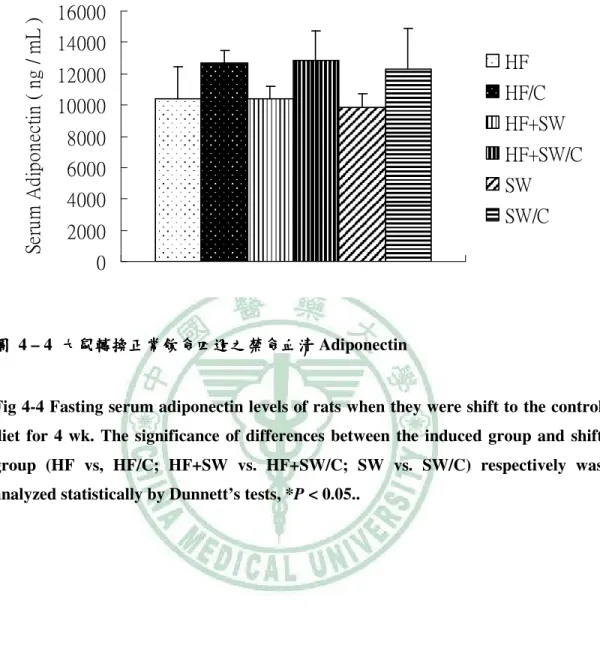
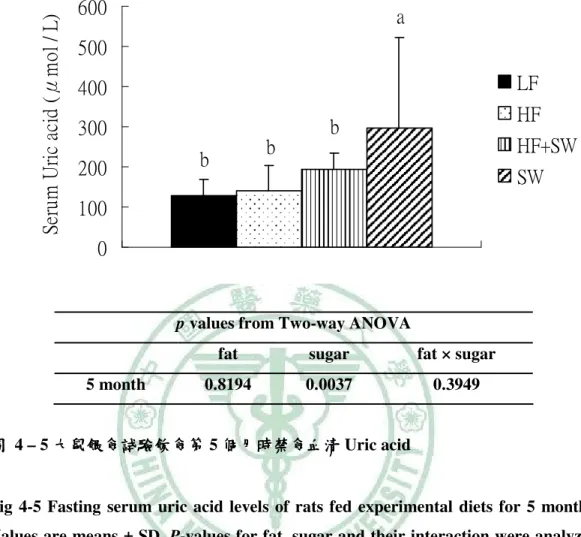
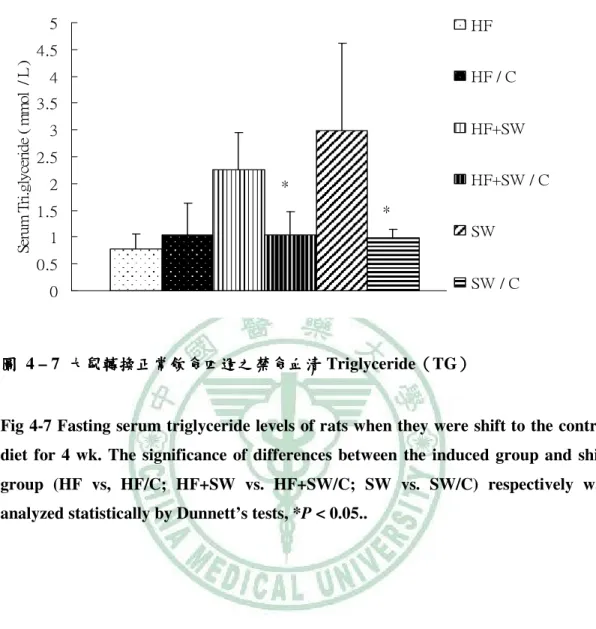
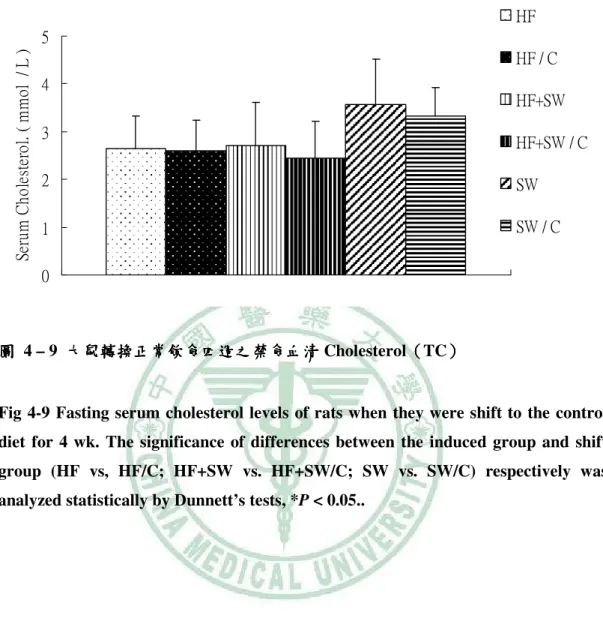
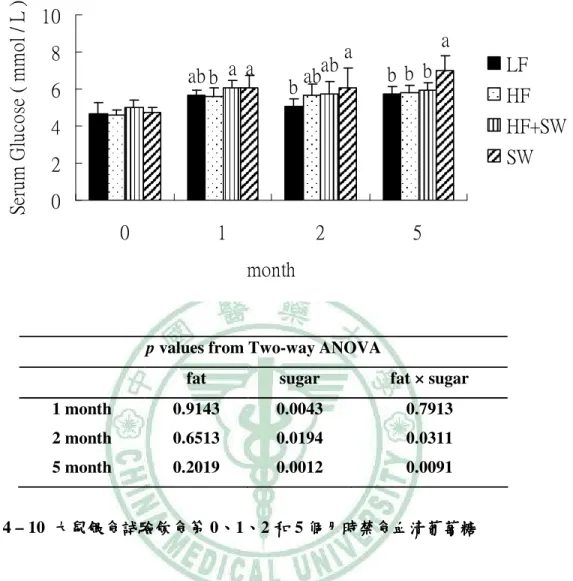
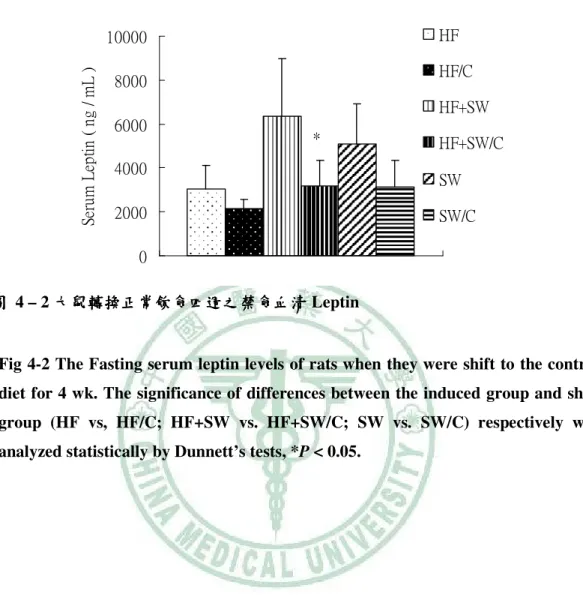
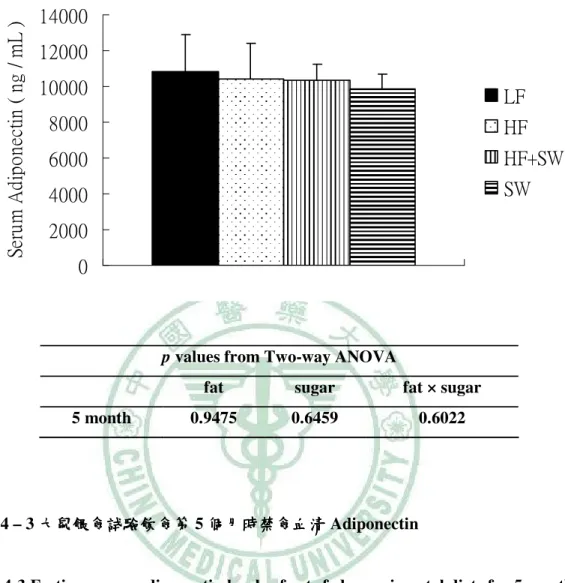
(6) 圖 目 錄 圖 2- -1 lipotoxicity 造成脂質異常累積………………………………………………...6 造成脂質異常累積 圖 2- -2 高果糖的與代謝症候群之相關性…………………………………………….13 高果糖的與代謝症候群之相關性 圖 2- -3 SREBP-1c、ChREBP 在肝中調控脂質生合成基因………………………..…15 在肝中調控脂質生合成基因 圖 3- -1 高油飲食、 高油飲食、糖水或兩者同時給予之下誘發代謝症候群模式………………..17 糖水或兩者同時給予之下誘發代謝症候群模式 圖 4- -1 大鼠餵食試驗飲食第 1、2 和 5 個月時禁食血清 Leptin ……………………..54 圖 4- -2 大鼠轉換正常飲食四週之禁食血清 Leptin …………………………………55 圖 4- -3 大鼠餵食試驗飲食第 5 個月時禁食血清 Adiponectin………………….……56 圖 4- -4 大鼠轉換正常飲食四週之禁食血清 Adiponectin……………........................57 圖 4- -5 大鼠餵食試驗飲食第 5 個月時禁食血清 Uric acid ………………………….58 圖 4- -6 大鼠餵食試驗飲食第 0、 、1、 、2 和 5 個月時禁食 Triglyceride.......................59 圖 4- -7 大鼠轉換正常飲食四週之禁食血清 大鼠轉換正常飲食四週之禁食血清 Triglyceride…………….......................60 圖 4- -8 大鼠餵食試驗飲食第 0、 、1、 、2 和 5 個月時禁食血清 Cholesterol …………………………………………………….......................61 圖 4- -9 大鼠轉換正常飲食四週之禁食血清 Cholesterol……………........................62 圖 4- -10 大鼠餵食試驗飲食第 0、1、2 和 5 個月時禁食血清葡萄糖……………….....64 個月時禁食血清葡萄糖 圖 4- -11 大鼠轉換正常飲食四週之禁食血清清葡萄糖 大鼠轉換正常飲食四週之禁食血清清葡萄糖……………………………...65 四週之禁食血清清葡萄糖 圖 4- -12 大鼠餵食試驗飲食第 1 和 5 個月時禁食血清胰島素………........................66 個月時禁食血清胰島素 圖 4- -13 大鼠轉換正常飲食四週之禁食血清胰島素………………………………...67 大鼠轉換正常飲食四週之禁食血清胰島素 圖 4- -14 大鼠餵食試驗飲食第 5 個月時葡萄糖耐量試驗……………………………68 個月時葡萄糖耐量試驗 圖 4- -15 大鼠餵食試驗飲食第 5 個月時葡萄糖耐量試驗(OGTT)葡萄糖曲線下面 葡萄糖曲線下面 個月時葡萄糖耐量試驗 積…………………………………………………….......................................69 圖 4- -16 大鼠餵食試驗飲食第 5 個月時胰島素耐量試驗…………………………....70 個月時胰島素耐量試驗 圖 4- -17 大鼠餵食試驗飲食第 5 個月時胰島素耐量試驗(ITT)葡萄糖曲線下面積 葡萄糖曲線下面積...71 個月時胰島素耐量試驗 葡萄糖曲線下面積 圖 4- -18 大鼠餵食試驗飲食 5 個月之收縮壓( )、舒張壓 )和脈搏 個月之收縮壓(Systolic)、 )、舒張壓( 舒張壓(Diastolic) (Pulse) )………………………………………………………………..………72 圖 4- -19 以 Western bolt 分析大鼠餵食試驗飲食 5 個月之肝臟 mature (68 kD)/ immature (128 kD) SREBP-1c 蛋白質表現量……………………………...73 蛋白質表現量.
(7) 圖 4- -20 以 Western bolt 定量分析大鼠餵食試驗飲食 5 個月之肝臟 nuclear / cytosol ChREBP 蛋白質表現量…………………………………………………….74 蛋白質表現量 圖 4- -21 大鼠餵食試驗飲食 5 個月之腹膜後脂肪組織切片與脂肪細胞平均直徑...75 個月之腹膜後脂肪組織切片與脂肪細胞平均直徑 圖 4- -22 小鼠餵食試驗飲食第 5 個月時禁食血清 Leptin…………………………..80 圖 4- -23 小鼠餵食試驗飲食第 5 個月時禁食禁食血清 Adiponectin………………81 圖 4- -24 小鼠餵食試驗飲食第 0、 、1、 、2 和 5 個月時禁食血清 Triglyceride( (TG) )..82 圖 4- -25 小鼠餵食試驗飲食第 0、 、1、 、2 和 5 個月時禁食血 Cholesterol( (TC) )…83 圖 4- -26 小鼠餵食試驗第 0、 、1、 、2 和 5 個月時禁食血清葡萄糖…………………...85 個月時禁食血清葡萄糖 圖 4- -27 小鼠餵食試驗第 5 個月時禁食血清胰島素…………………………..…….86 個月時禁食血清胰島素 圖 4- -28 小鼠餵食試驗飲食第 5 個月時葡萄糖耐量試驗…………………………...87 個月時葡萄糖耐量試驗 圖 4- -29 小鼠餵食試驗飲食第 5 個月時葡萄糖耐量試驗 )葡萄糖曲線下面 個月時葡萄糖耐量試驗( 糖耐量試驗(OGTT) 積……………………………………………………………………………...88 圖 4- -30 小鼠餵食試驗飲食第 5 個月時胰島素耐量試驗…………………………..89 個月時胰島素耐量試驗 圖 4- -31 小鼠餵食試驗飲食第 5 個月時胰島素耐量試驗(ITT)葡萄糖曲線下面積 葡萄糖曲線下面積..90 個月時胰島素耐量試驗 葡萄糖曲線下面積 圖 5- -1 大鼠餵食試驗飲食 5 個月之肝臟 ACC 蛋白質活性……………………….101 蛋白質活性.
(8) 縮寫對照表 縮. 寫. 全. ACC. 名. Acetyl - CoA carboxylase. AMPK. AMP - activated protein kinase. ACO. Acyl CoA oxidase. ApoB. Apolipoprotein B. BP. Blood pressure. bHLH. Basic helix-loop-helix. cAMP. 3' - 5'- Cyclic adenosine monophosphate. ChREBP. Carbohydrate response element binding protein. CPT - 1. Carnitine palmitoyltransferase – 1. DBP. Diastolic blood pressure. DAG. Biacylglycerol. FG. Fasting glucose. FAS. Fatty acid synthase. GK. Glucokinase. HDL. High density lipoprotein. IDF. International Diabetes Federation. IL-6. Interleukin -6. IRS. Insulin receptor substrates. ITT. Insulin tolerance Test. Mest NCEP - ATP - III. Mesoderm specific transcript National Cholesterol Education Program – Adult Treatment Panel – III. OGTT. Oral glucose tolerance test. PKC. Protein kinase C. PTP-1B. Protein tyrosine phosphatase 1B. PAI-1 PPAR-α. Plasminogen activator inhibitor-1 Peroxisome proliferator activated receptor-α. Peg1. Paternally expressed 1. PEPCK. Phosphenolpyruvate carboxykinase. I.
(9) SBP SREBP-1c. Systolic blood pressure Sterol regulatory element binding protein - 1c. TG. Triglyceride. TC. Total cholesterol. TNF-α. Tumor necrosis factor -α. VLDL. Very low density lipoprotein. II.
(10) 組別縮寫意義 組. 別. LF. 縮. 寫. 縮. 寫. 意. 義. Low fat control diet (chow diet + plane water). HF. High fat diet( (30% butter oil + Plane water) ). SW. chow diet + 30% sucrose containing water. HF + SW. high fat diet + sucrose containing water. III.
(11) 高油飲食或糖水誘發代謝症候群之作用及機制探討. 中國醫藥大學營養學系碩士班 陳姤君. 摘要. 代謝症候群 (Metabolic syndrome)是全球普遍文明病 是全球普遍文明病, 是全球普遍文明病,國人由於飲食西化, 國人由於飲食西化,攝 取過多高油食物及含糖飲料, 取過多高油食物及含糖飲料,再加上缺乏運動等因素, 再加上缺乏運動等因素,發生率逐年增加。 發生率逐年增加。本論文研 究的目的是以動物模式比較高油飲食或/和糖水的攝食誘發代謝症候群之效果 究的目的是以動物模式比較高油飲食或 和糖水的攝食誘發代謝症候群之效果, 和糖水的攝食誘發代謝症候群之效果,並探 討其可能作用之分子機制。 ,分別給予 30% 討其可能作用之分子機制。實驗使用 C57BL/6J mice 及 Wistar rats, 奶油之高油飼料 、30% 蔗糖糖水 (SW; chow diet 奶油之高油飼料 (HF; high fat diet + plane water)、 + sucrose water)或兩種同時給予 或兩種同時給予 (HF + SW; high fat diet + sucrose water )誘發出 誘發出 現代謝症候群症狀, ) 現代謝症候群症狀,另以接受正常飲食及飲水老鼠( 另以接受正常飲食及飲水老鼠(LF; chow diet + plane water) 做對照, 做對照,飼養 21 週,比較 2 種變因(高油飲食或糖水 種變因 高油飲食或糖水)誘發之效果 高油飲食或糖水 誘發之效果; 誘發之效果;另外在大鼠飼養 第 17 週時將三組誘導組半數轉為正常飲食( 、HF+SW/C、 、SW/C), ),為期四 週時將三組誘導組半數轉為正常飲食(HF/C、 ),為期四 週,期望飲食的轉換可改善代謝症候群的症狀。 期望飲食的轉換可改善代謝症候群的症狀。 在評估代謝症候群症狀方面以體重及腹部脂肪堆積作為肥胖(特別是中央型肥 在評估代謝症候群症狀方面以體重及腹部脂肪堆積作為肥胖 特別是中央型肥 胖)指標 指標;以血糖、血清胰島素、oral glucose tolerance test (OGTT)及 及 insulin tolerance test (ITT) 血 糖變化評估 是否 胰島 素阻抗 ; 並 量測 血脂質 (Triglyceride; TG 及 Cholesterol; TC) 及血壓 。 另測量腹部脂肪細胞大小及血液脂肪細胞激素(包括 另測量腹部脂肪細胞大小及血液脂肪細胞激素 包括 leptin、 、adiponectin)濃度 濃度、 濃度、肝臟與肌肉內脂質堆積、 肝臟與肌肉內脂質堆積、肝臟脂質代謝相關基因表現及 脂肪組織 adipocytokines 基因表現。 基因表現。在大鼠肝臟並量測負責調控脂質生合成與糖解 相關基因的轉錄因子--sterol regulatory element-binding protein (SREBP)-1c 與 相關基因的轉錄因子 carbohydrate responsive element binding protein( (ChREBP) )蛋白質在細胞核/細胞 蛋白質在細胞核 細胞 質分布。 質分布。 結果顯示在大鼠方面, 結果顯示在大鼠方面,三組誘導組體重、 三組誘導組體重、體脂堆積及脂肪細胞直徑皆顯著大於 LF(P<0.0001); ;HF+SW 與 SW 組的血清 Leptin 顯著高於 LF 組(P<0.0001); ; SW. IV.
(12) 的血清 Uric acid 顯著高於 LF 組(P<0.005); ;三組誘導組肝臟 TG 與 TC 均顯著高於 LF (P<0.0001); ;HF+SW 與 SW 肌肉內 TG 顯著高於 LF( (P<0.05); );SW 組的血 ); 清 TC 及 SW 與 HF+SW 組的血清 TG 顯著高於 LF 組(P<0.0001); ;三組誘導 三組誘導組皆呈 現高胰島素血症(P ,SW 組禁食血糖顯著高於 LF 組(P<0.05); ;在 OGTT 與 現高胰島素血症 <0.05), ITT 可發現 SW 組血糖值高於 LF( (P<0.05); );收縮壓方面 );收縮壓方面 HF+SW 顯著高於 LF ),舒張壓方面 HF+SW 和 SW 皆顯著高於 LF( (P<0.05) );SREBP-1c、 、 (P<0.005) ; ChREBP 蛋白質 nuclear/cytosol 比例, ;肝臟 fatty acid 比例,SW 皆顯著高於 LF(P<0.08); synthase(FAS) )mRNA 量四組無顯著差異,但 SW 組有較高趨勢;Glucokinase(GK) ) mRNA 表現量在 HF+SW 顯著高於其它三組(P ;脂肪組織中 Tumor necrosis 顯著高於其它三組 <0.08); 。Two-way factor-α( (TNF-α) )與 resistin mRNA 在 HF 組皆顯著高於 LF(P<0.05)。 ANOVA 顯示糖水因子對大鼠的體重增加、 顯示糖水因子對大鼠的體重增加、體脂堆積、 體脂堆積、肝脂堆積、 肝脂堆積、肌肉內脂質堆積、 肌肉內脂質堆積、 高 Leptin 血症、 血症、高尿酸血症、 高尿酸血症、血脂、 血脂、血糖、 血糖、胰島素及血壓有顯著作用, 胰島素及血壓有顯著作用,而高油因子 僅對體重增加、 僅對體重增加、體脂堆積、 體脂堆積、肝脂堆積及禁食血漿胰島素有顯著作用 肝脂堆積及禁食血漿胰島素有顯著作用。 及禁食血漿胰島素有顯著作用。 誘導組在為期四週飲食轉換後, 誘導組在為期四週飲食轉換後,各指標呈現不等程度改善: 各指標呈現不等程度改善:HF/C 的皮下脂肪、 的皮下脂肪、 肝臟 TC、 、肝臟 GK mRNA 量、脂肪組織 TNF-α、 、resistin、 、Plasminogen activated inhibitor-1( (PAI-1) )、leptin mRNA 量皆顯著性低於 HF(P=0.084,<0.05,<0.08, 、 ,HF+SW/C 的皮下脂肪、 <0.05,<0.05,<0.05,<0.05), 皮下脂肪、血清 Leptin 與 TG 顯著 性低於 HF+SW(P=0.0564,<0.05,<0.05),SW/C 的血清 TG 與肝臟 FAS、GK mRNA 量顯著性低於 SW(P<0.05 與<0.05、0.05)。 。 在小鼠方面, ; 在小鼠方面,三組誘導組的體重、 三組誘導組的體重、體脂及血清 Leptin 顯著高於 LF 組(P<0.0001); SW 和 HF+SW 肝中 TG 含量顯著高於 LF(P<0.05), ,HF 和 HF+SW 肝中 TC 含量 顯著高於 LF (P<0.05); ;三組誘導組的血清 三組誘導組的血清 TC 及 TG 顯著高於 LF 組(P<0.0001 與 0.05), ,HF 與 HF+SW 呈現高胰島素血症( ),HF 組不但出現高血糖, 呈現高胰島素血症(P<0.05), ), 組不但出現高血糖,且 OGTT 及 ITT 血糖變化顯著高於它組(P<0.0001,<0.0001,<0.05) ) ;肝臟 carnitine palmitoyl CoA transferase 1 mRNA 量在 HF 與 HF+SW 顯著高於 LF (P<0.0001), , acyl CoA oxidase 與 phosphenolpyruvate carboxykinase mRNA 量 HF 顯著高於 LF(P<0.05); ;脂肪組織中 TNF-α、 、resistin mRNA 量在誘導組與對照組雖沒有顯著 的差異但有高於對照組的趨勢, 的差異但有高於對照組的趨勢,Leptin mRNA 量在三組誘導組皆顯著高於對照組(P 量在三組誘導組皆顯著高於對照組. V.
(13) < 0.0001), , PAI-1 基因表現量在 HF 與 SW 顯著高於對照組(P ; HF 的 顯著高於對照組 < 0.05); mesoderm specific transcript mRNA 量顯著高於 LF(P<0.0005)。 。Two-way ANOVA 顯示糖水因子對體重增加、 顯示糖水因子對體重增加、體脂堆積、 體脂堆積、血脂有顯著上升作用, 血脂有顯著上升作用,而高油因子則對體重 增加、 增加、體脂堆積、 體脂堆積、肌肉內脂質堆積、 肌肉內脂質堆積、高 Leptin 血症、 血症、血脂、 血脂、血糖及血清胰島素均有 血糖及血清胰島素均有 顯著作用。 顯著作用。總括以上的結果顯示高油或糖水飲食在大、 總括以上的結果顯示高油或糖水飲食在大、小鼠分別有不同效果, 小鼠分別有不同效果,在大 鼠糖水誘發代謝症候群效果較佳, 鼠糖水誘發代謝症候群效果較佳,而小鼠則是對高油飲食較敏感。 而小鼠則是對高油飲食較敏感。而在大鼠中也可 看到代謝症候群因飲食的誘發也可因飲食的修正而得到改善 看到代謝症候群因飲食的誘發也可因飲食的修正而得到改善。 代謝症候群因飲食的誘發也可因飲食的修正而得到改善。未來若要建立代謝症 未來若要建立代謝症 候群的動物模式應用於健康食品開發, 候群的動物模式應用於健康食品開發,Wistar 大鼠適合以糖水誘發, 大鼠適合以糖水誘發,C57BL/6J 小 鼠適合以高油飲食誘發。 鼠適合以高油飲食誘發。本研究也證實含糖飲料的攝取如同高油食物的確會增加代 謝症候群之危險, 謝症候群之危險,近年國內杯裝飲料市場大幅成長, 近年國內杯裝飲料市場大幅成長,消費人口快速增加, 消費人口快速增加,其背後潛 在的國民健康問題值得注意。 在的國民健康問題值得注意。. 關鍵字: 關鍵字:代謝症候群、 代謝症候群、高油飲食 高油飲食、 飲食、蔗糖糖水. VI.
(14) The inducing effect and action mechanism of a high fat diet and the sucrose-containing drinking water on metabolic syndrome Gou - Chun Chen. Abstract Metabolic syndrome is a global healthy problem with a soaring morbidity. In Taiwan, a dietary patterm change with an increased high fat diet or/and sucrose-sweetened beverage consumption, accompanies with an absence of exercise are considered to be the risk factors of metabolic syndrome. This study was designed to compare the effect of a high fat diet or / and sucrose-containing drinking water on inducing metabolic syndrome and the possible molecular mechanisms involved were also studied. Male C57BL6J mice and Wistar rats were each divided into one control (chow diet; LF) and three inducing groups, including HF, SW and HF+SW, to receive a 30% butter-containing diet, 30% sucrose in drinking water, or both, respectively, After 21 wks, the dietary effects of a high fat diet and the sucrose-containing drinking water were compared among the four groups. For evaluating if it is reversible for diet-induced-metabolic syndrome, half of rats in the three inducing groups were shifted to a control diet( (HF/C, HF+SW/C, SW/C) )at 17 wks. After 4 wks, the metabolic sequela was compared with HF, HF+SW and SW, respectively. For assessing metabolic syndrome, body weight and visceral fat accumulation were used as an indicator of obesity, especially for central obesity. Fasting serum glucose and insulin, oral glucose tolerance( (OGTT) )and insulin tolerance test (ITT) were used as an indicator of insulin resistance. Serum lipid levels including triglyceride and cholesterol and blood pressure were alaso measured. For exploring the possible mechanism for diet-induced metabolic syndrome, adipocyte size in visceral fat, serum levels of adipocytokines ( leptin and adiponectin ) , lipid accumulation in liver and muscle and the expression levels of genes participating in lipid metabolism in liver and as adipocytokines in adipose tissue were all measured.. VII.
(15) The nuclear/cytosol distribution of sterol regulatory element-binding protein (SREBP)-1c and carbohydrate responsive element binding protein( ( ChREBP) ) proteins were also measured since the two transcription factors play an important role in regulating the lipogenic genes and glycolytic genes expression. In Wistar rats, results showed the body weight gain, adiposity and the average diameter of adipocyte in three inducing groups were significantly higher than those in the LF group (P<0.0001). The HF+SW and SW groups had a significantly higher serum leptin level than the LF group (P<0.0001). The serum uric acid in SW group was significantly higher than that in the LF group (P<0.005). The TG and TC concentrations in liver of three inducing groups (P < 0.0001) and the TG concentration in muscle of the HF+SW and SW groups (P < 0.05) were all significantly higher than those in the LF group. As compared with the LF group, the serum TC level in SW group and the serum TG level in SW and HF+SW groups were significantly increased (P<0.0001). Hyperinsulinemia and hyperglycemia were happened in the three inducing groups and in the SW group, respectively. During the 2 hr period of OGTT and ITT, significantly higher serum glucose levels were observed in the SW group as compared with the LF group (P<0.05). The systolic blood pressure in HF+SW group (P < 0.005) and the diastolic blood pressure (P<0.05) in HF+SW and SW groups were significantly higher than those in the LF group. The nuclear / cytosol ratios for SREBP-1c and ChREBP in SW group was significantly higher than that in the LF group (P<0.08). For gene expression levels in liver, a higher mRNA level of the fatty acid synthase( (FAS) in the SW group was observed, though the difference didn’t reach a statistical significance. The glucokinase( (GK) ) in the HF+SW group was significantly higher than in the other groups (P < 0.08). For gene expression levels in adipose tissue, tumor necrosis factor-α( (TNF-α) )and resistin mRNA levels in the HF group were significantly higher than those in the LF group(P < 0.05). Two-way ANOVA showed, the sucrose-containing drinking water has significant effects on body weight gains, adiposity, lipid accumulation in liver and muscle, serum levels of leptin, uric acid,. VIII.
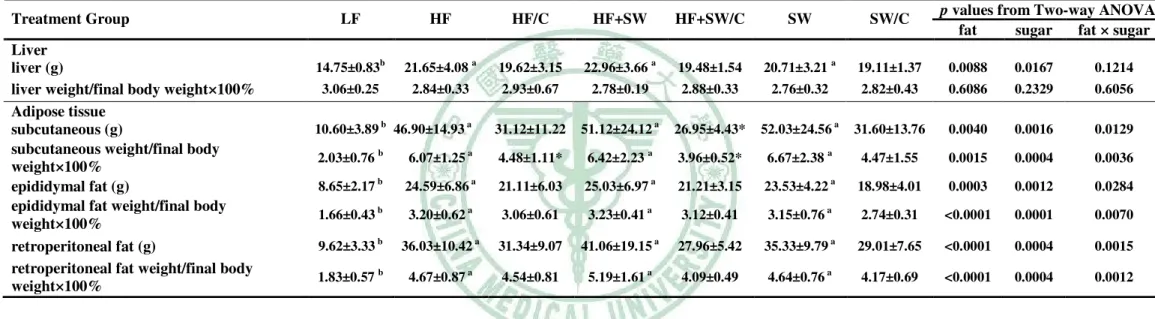
(16) lipids, glucose and insulin. However, the high fat dietary factor only showed significant effects on body weight gains, adiposity, liver lipid accumulation and fasting serum insulin. After shifting to a control diet for 4wk in inducing groups, most of the unfavorable effects were alleviated with different degrees by this dietary modification. The subcutaneous fat mass, TC concentration in liver, the mRNA levels of GK in liver and TNF-α, resistin, plasminogen activated inhibitor-1( (PAI-1) ) and leptin in adipose tissue were significantly reduced in the HF/C group as compared with the HF group (P=0.084,<0.05,<0.08,<0.05,<0.05,<0.05,. < 0.05). The subcutaneous fat mass, serum leptin and TG concentrations was significantly reduced in the HF+SW/C group as compared with the HF+SW group (P=0.0564,<0.05,<0.05). The serum level of TG and mRNA levels of FAS and GK in liver was significantly reduced in the SW/C group as compared with the SW group (P<0.05 and <0.05, 0.05). In C57BL/6J mice, as compared wth the LF group, the body weight gains, adiposity and serum leptin level in three inducing groups were significantly increased (P<0.0001). The liver TG concentration in the SW and HF+SW groups and the TC concentration in HF and HF+SW groups were significantly higher than those in the LF group(P<0.05). The hyperlipidemia (including TC and TG) was observed in the three inducing groups (P < 0.0001 and < 0.05) and the hyperinsulinemia was observed in the HF and HF+SW groups (P<0.05). The HF group showed not only a hyperglycemia (P<0.0001), but also a significantly higher serum glucose levels during the 2hr period of OGTT and ITT as compared with the other groups( ( P < 0.0001 and < 0.05, respectively) ) . The mRNA levels of the carnitine palmitoyl CoA transferase 1 in liver of the HF and HF+SW groups (P< 0.0001) and the acyl CoA oxidase and phosphenolpyruvate carboxykinase in liver of the HF group (P<0.05) were all significantly higher than those in the LF group. In adipose tissue, a higher trend of mRNA level of TNF-α and resistin in the three inducing groups was observed, though the differences didn’t reach a statistically. IX.
(17) significant level. The mRNA levels of the leptin in the three inducing groups (P< 0.0001) and the PAI-1 in the HF and SW groups (P<0.05) were significantly higher than those in the LF group. The mesoderm specific transcript mRNA level in adipose tissue of the HF group was significantly higher than that in the LF group(P. <0.0005). Two-way ANOVA showed, the sucrose-containing drinking water has significant effects on body weight gains, adiposity and serum lipids. However, a high fat diet has significant effects on body weight gains, adiposity, lipid accumulation in liver and muscle, serum levels of leptin, lipids, glucose and insulin. From those results, we concluded that a high fat diet and the sucrose-containing drinking water both can induce metabolic syndrome, though with different effects on rats and mice. The Wistar rats are prone to the sucrose water-induced metabolic syndrome, and the C57BL/6J mice are prone to a high fat diet-induced metabolic syndrome. As indicated by the results of dietary shift in rats, the metabolic syndrome induced by dietary factors can be reversed by dietary modulations. Key Words: :Metabolic syndrome、 、High fat diet、 、Sucrose-containing water. X.
(18) 第一章 前言. 第一章 前言. 由於現代人飲食不正常, 由於現代人飲食不正常,攝取過多熱量( 攝取過多熱量(高油脂食物、 高油脂食物、含糖飲料) 含糖飲料),引起肥胖 ,引起肥胖, 引起肥胖, 再 加 上 生 活 不 規 律 、 缺 乏 運動 等 因素 , 造就 了 現代 人 的文 明病 -- 代 謝 症 候 群 (Metabolic syndrome), ,以往代謝症候群出現在較高的年齡層, 以往代謝症候群出現在較高的年齡層,但隨著飲食西化變 遷,較低的年齡層也可能發生。 較低的年齡層也可能發生。代謝症候群主要是指腹部肥胖、 代謝症候群主要是指腹部肥胖、高胰島素血症、 高胰島素血症、高 血壓及血脂異常多種特徵共存於一人身上, 血壓及血脂異常多種特徵共存於一人身上,使其罹患動脈粥狀硬化心血管疾病與第 使其罹患動脈粥狀硬化心血管疾病與第 2 型糖尿病的風險特高。 型糖尿病的風險特高。目前國民健康局 91 年公告國人代謝症候群盛行率: 年公告國人代謝症候群盛行率:15 歲以 上為 14.99%( %(男 %,女 %),且隨年齡上升而有增加的趨勢 %(男 16.9%, %,女 13.8%), %),且隨年齡上升而有增加的趨勢。 且隨年齡上升而有增加的趨勢。又據衛生署 統計顯示, 統計顯示,代謝症候群所衍生之腦血管疾病、 代謝症候群所衍生之腦血管疾病、心臟病、 心臟病、糖尿病、 糖尿病、高血壓等慢性疾病, 高血壓等慢性疾病, 皆年居台灣十大死因榜中, 皆年居台灣十大死因榜中,此現象也造就了國家對於醫療保健費用龐大的支出, 此現象也造就了國家對於醫療保健費用龐大的支出,因 此如何預防代謝症候群已成為我國及世界之新興重要公共衛生議題。 此如何預防代謝症候群已成為我國及世界之新興重要公共衛生議題。雖然高油脂食 物與含糖飲料常被歸咎是現代飲食造成肥胖及慢性病禍首, 物與含糖飲料常被歸咎是現代飲食造成肥胖及慢性病禍首,但這兩種不良飲食型態 單獨或合併存在引發代謝症候群之後果從未被比較並深入研究。 單獨或合併存在引發代謝症候群之後果從未被比較並深入研究。因此本論文的目的 在比較高油飲食或糖水誘發代謝症候群之作用及機制探討 在比較高油飲食或糖水誘發代謝症候群之作用及機制探討, 高油飲食或糖水誘發代謝症候群之作用及機制探討,此研究成果不僅有助建 此研究成果不僅有助建 立代謝症候群的動物模式應用於健康食品開發, 立代謝症候群的動物模式應用於健康食品開發,也對未來飲食政策推動提供可參考 的科學佐證。 的科學佐證。. 1.
(19) 第二章 文獻回顧. 第二章 文獻回顧. 一、代謝症候群定義與盛行率 (一)代謝症候群之定義. 1923 年 , 代謝 症候群最早被敘 述為包括有高血壓(Hypertension) 、 高血糖 述為包括有高血壓 (Hyperglycaemia)和高尿酸血症 和高尿酸血症(Hyperuricaemia)的症候群 的症候群。 年的研究指出腹 和高尿酸血症 的症候群。在1947年的研究指出腹 部肥胖(Abdominal obesity)和脂質分佈與糖尿病及其他疾病的相關性 和脂質分佈與糖尿病及其他疾病的相關性; 部肥胖 和脂質分佈與糖尿病及其他疾病的相關性;接著在1965 接著在 年再次敘述到此症候群是含有高血壓、 於1988年 年 年再次敘述到此症候群是含有高血壓、高血糖以及肥胖的症候群。 高血糖以及肥胖的症候群。Reaven於 將 腹 部 肥 胖 、 高 胰 島 素 血 症 (Hyperinsulinemia) 、 高 三 酸 甘 油 酯 血 症 (Hypertriglyceridemia)、 、高血壓以及Low - HDL - cholesterol, ,這一群對糖尿病和心 高血壓以及 血管疾病的危險因子命名為Syndrome X, ,並指出代謝症候群主因是與胰島素抗性有 血管疾病的危險因子命名為 關(1)。 。也有其它學者將其命名為The Deadly Quartet (2)以及 以及The Insulin Resistance 也有其它學者將其命名為 以及 Syndrome (3)。 。. (二)代謝症候群之判定方法. 根據2001美國國家膽固醇教育計畫 美國國家膽固醇教育計畫 National Cholesterol Education Program 根據 Adult Treatment Panel - III( (NCEP – ATP - III) )主要針對心血管疾病的危險所建 立的判斷標準, 立的判斷標準,建立造成代謝症候群五種危險因子: 建立造成代謝症候群五種危險因子: (Ι) 腹部肥胖, 腹部肥胖,男性腰圍大於 102 cm和女性腰圍大於 和女性腰圍大於 88 cm; ; (Ⅱ Ⅱ) 血中三酸甘油酯濃度大於 150 mg / dl; ; (Ⅲ Ⅲ) 高密度脂蛋白 - 膽固醇 (HDL - Cholesterol) 濃度, 和女性小 濃度,男性小於 40 mg / dl和女性小 於 50 mg / dl; ; (Ⅳ Ⅳ) 血壓超過 135 / 85 mmHg; ; (Ⅴ Ⅴ) 禁食血糖濃度大於110 mg / 禁食血糖濃度大於 dl。 。NCEP判定須符合五項因子的其中三項以上即認為有代謝症候群且增加罹患心 判定須符合五項因子的其中三項以上即認為有代謝症候群且增加罹患心 血管疾病的風險(3, 血管疾病的風險 4)。 。在美國成年人罹患代謝症候群比率為24%。 在美國成年人罹患代謝症候群比率為 %。且已知與動脈硬 %。且已知與動脈硬 化及T2DM患者死亡率增加有正相關 患者死亡率增加有正相關 (3, 5, 6)。 。 化及. 2.
(20) 第二章 文獻回顧. 在2004年 年,International Diabetes Federation (IDF)建立出適用於任何國家的判 建立出適用於任何國家的判 斷標準。 斷標準 。 所建立的判斷標準包括有評估腹部脂肪堆積、 所建立的判斷標準包括有評估腹部脂肪堆積、 胰島素抗性、 胰島素抗性 、 atherogenic dyslipidaemia、 、血壓增加、 和pothrombotic state。 。目前 IDF 血壓增加、proinflammatory state和 在2005年又建立了最新的判斷標準 年又建立了最新的判斷標準, 年又建立了最新的判斷標準,特別強調中央型肥胖是判定代謝症候群的必要 條件, 條件,再加上高三酸甘油酯、 再加上高三酸甘油酯、低的高密度脂蛋白、 低的高密度脂蛋白、高血壓、 高血壓、高空腹血糖, 高空腹血糖,四項中兩 項。而中央型肥胖的判定則是依各民族自訂之標準 (7)。 。. (三)代謝症候群在台灣之判定標準與盛行率 代謝症候群在台灣之判定標準與盛行率. 依行政院衛生署國民健康局在 2006 年對代謝症候群的判定標準建議採 年對代謝症候群的判定標準建議採 94 年美國 NECP - ATP - Ⅲ的診斷標準, 的診斷標準,並將空腹血糖向下修正, 並將空腹血糖向下修正,於 96 年 1 月 18 日 公告, 公告,即以下 5 項危險因子中, 項危險因子中,若包含 3 項或以上者可判定為代謝症候群。 項或以上者可判定為代謝症候群。. 表 2 – 1 台灣代謝症候群之判定標準 台灣代謝症候群之判定標準 危 險 因 子. 異 常 值 腰圍( ): 腰圍(waist). 腹部肥胖(Central obesity) 腹部肥胖. 男性 ≧90 cm 女性 ≧80 cm SBP ≧130 mmHg /. 血壓(BP)上升 上升 血壓. DBP ≧85 mmHg 男性 <40 mg/dl. 高密度酯蛋白膽固醇(HDL-C)過低 過低 高密度酯蛋白膽固醇. 女性 <50 mg/dl. 空腹血糖值(Fasting glucose)上升 上升 空腹血糖值. FG ≧100 mg/dl. 三酸甘油酯(Triglyceride)上升 上升 三酸甘油酯. TG ≧150 mg/dl. 備註: 備註:上項危險因子中「 上項危險因子中「血壓上升」、「 血壓上升」、「空腹血糖值上升 」、「空腹血糖值上升」 空腹血糖值上升」之判定, 之判定,包括依醫師 處方使用降血壓或降血糖等藥品(中 處方使用降血壓或降血糖等藥品 中、草藥除外), 草藥除外 ,血壓或血糖之檢驗值正常者。 血壓或血糖之檢驗值正常者。. 3.
(21) 第二章 文獻回顧. 在盛行率方面, 在盛行率方面,國民健康局 91 年三高( 年三高(高血壓、 高血壓、高血糖、 高血糖、高血脂) 高血脂)調查研究顯 示,國人代謝症候群盛行率 %(男 %,女 %),且隨 國人代謝症候群盛行率:15 歲以上為 14.99%( %(男 16.9%, %,女 13.8%), %),且隨 年齡上升而有增加的趨勢, 年齡上升而有增加的趨勢,見表 2 - 1 所示。 所示。又據衛生署統計顯示, 又據衛生署統計顯示,代謝症候群所衍 生之腦血管疾病、 生之腦血管疾病、心臟病、 心臟病、糖尿病、 糖尿病、高血壓等慢性疾病, 高血壓等慢性疾病,皆年居台灣十大死因榜中, 皆年居台灣十大死因榜中, 此現象也造就了國家對於醫療保健費用龐大的支出, 此現象也造就了國家對於醫療保健費用龐大的支出,見表 2 - 2 所示。 所示。因此如何預防 代謝症候群已成為我國及世界之新興重要公共衛生議題。 代謝症候群已成為我國及世界之新興重要公共衛生議題。. 表 2 – 2 台灣代謝症候群及組成因子盛行率 91*年三高盛行率調查 男. 女. 16.9%. 13.8%. 14.99%. 高血壓(15 歲) 高血壓. 24.9%. 18.2%. 21.38%. 高三酸甘油酯 高三酸甘油酯. 20.3%. 11.3%. 15.6%. 高低密度膽固醇. 6.5%. 6.3%. 6.4%. 高血糖(19 歲↑) 高血糖. 8.8%. 7.2%. 8.0%. 高血糖(45 歲↑) 高血糖. 15.5%. 14.0%. 高血糖(65 歲↑) 高血糖. 18.8 %. 22.8%. 糖尿病前期. 3.2%. 3.2%. 3.2%. 高膽固醇. 10.8%. 10.9%. 10.9%. 代謝症候群* 代謝症候群. 組成因子. 資料來源: 資料來源:行政院衛生署國民健康局. 4. 合計.
(22) 第二章 文獻回顧. 表 2 - 3 92年國 年國人代謝症候群相關疾病醫療費用 年國人代謝症候群相關疾病醫療費用. 就診人數. 門診費用. 住院費用. 合計. (萬 萬). (億點數 億點數) 億點數. (億點數 億點數) 億點數. (億點數 億點數) 億點數. 糖尿病. 98.6. 95.0. 18.2. 113.2. 高血壓. 211.2. 129.3. 4.0. 133.3. 心臟病. 119.5. 57.6. 86.1. 143.7. 腦中風. 45.5. 51.8. 55.0. 106.8. 小計. 474.8. 333.7. 163.3. 497. 癌症. 31.7. 93.0. 127.6. 220.6. 23.1%. 17.3%. 13.61%. 15.9%. 3.59. 1.28. 2.25. 項目. 佔率 (給付總計 給付總計) 給付總計 代謝症候群 代謝症候群/癌症 候群 癌症. 資料來源: 資料來源:衛生署92年全民健康保險醫療統計年報 衛生署 年全民健康保險醫療統計年報. 二、代謝症候群的發生 代謝症候群的發生, 代謝症候群的發生,與現代人壓力過大、 與現代人壓力過大、生活型態不正常, 生活型態不正常,包括不正當的飲食 (尤其是過度精緻化的糖類食品、 尤其是過度精緻化的糖類食品、含糖飲料、 含糖飲料、高油飲食等)、 高油飲食等)、缺乏運動 )、缺乏運動、 缺乏運動、肥胖(內臟 肥胖 內臟 型肥胖( )等因素有關。 型肥胖(visceral obesity) 等因素有關。脂肪組織是脂質儲存的器官, 脂肪組織是脂質儲存的器官,但由於肥胖 造成脂質異常的代謝, 造成脂質異常的代謝,脂質儲存到其他非脂肪組織, 脂質儲存到其他非脂肪組織,例如肝臟、 例如肝臟、肌肉、 肌肉、胰臟、 胰臟、心臟 等器官, ,造成身體各組織對胰島素產生抗性 等器官,而這樣的過程稱之為 lipotoxicity, 造成身體各組織對胰島素產生抗性、 抗性、第 2 型糖尿病、 型糖尿病、心血管疾病接踵而來(8), 心血管疾病接踵而來 ,並且因為肥胖造成脂肪組織肥大, 並且因為肥胖造成脂肪組織肥大,一些由脂 肪組織分泌調控身體各機能的細胞激素分泌失調也會影響代謝症候群的發生。 肪組織分泌調控身體各機能的細胞激素分泌失調也會影響代謝症候群的發生。. 5.
(23) 第二章 文獻回顧. 圖 2-1 lipotoxicity 造成脂質異常累積 資料來源: 資料來源:Molavi et al, 2006 (8). (一)胰島素訊息傳遞與胰島素阻抗. 胰島素 訊息 傳遞是 一連 串且 複 雜的 路徑 , 當胰 島 素與 胰島 素受器 (insulin receptor; ;IR)結合後 結合後, receptor substrates 1 、2(IRS –1、 、2)上酪氨 上酪氨 結合後,主要活化insulin 主要活化 酸 磷 酸 化 位 點 進 而 活 化 磷 脂 醯 醇 3 激 酶 路 徑 (phosphatidylinositol 3-kinase pathway)、 、serine/threonine kinase (Akt/PKB ), ,刺激了肌肉和脂肪組織的葡萄糖轉 運體釋出, 運體釋出,且使肝臟和肌肉肝醣合成量增加, 且使肝臟和肌肉肝醣合成量增加,脂肪組織脂質生合成旺盛。 脂肪組織脂質生合成旺盛。胰島素阻 抗是指磷脂醯醇3激酶路徑受阻 kinase C (PKC) 使得IRS – 抗是指磷脂醯醇 激酶路徑受阻, 激酶路徑受阻,主要是活化的protein 主要是活化的 使得 1、 、2酪氨酸磷酸化位點去磷酸化且磷酸化絲胺酸位點 酪氨酸磷酸化位點去磷酸化且磷酸化絲胺酸位點, 酪氨酸磷酸化位點去磷酸化且磷酸化絲胺酸位點,導致身體利用、 導致身體利用、儲存和產生 能 量 的 組 織 無 法 正 確 有 效 地 與 血 液 中 的 胰 島 素 反 應 。 diacylglycerol (DAG) 或 triglyceride( TG)會活化 會活化PKC, , 亦會受mitogen-activated protein kinase family中 中 會活化 亦會受. 6.
(24) 第二章 文獻回顧. c-jun N-terminal kinase 所活化, cytokines 所活化, 所活化,而JNK 可被proinflammatory 可被 所活化, 如tumor necrosis factor α (TNF-α), ,最終導致胰島素阻抗(9-12)。 。 最終導致胰島素阻抗. (二)脂肪細胞激素與代謝症候群之關聯. 過去脂肪組織被認為和能量儲存有關的器官 過去脂肪組織被認為和能量儲存有關的器官, 織被認為和能量儲存有關的器官,但近幾年來發現脂肪細胞會分泌 peptide hormons, ,則也被歸於內分泌器官, 則也被歸於內分泌器官,脂肪細胞會分泌 hormons 包括 leptin, adiponectin, resistin、 、interleukin -6( (IL-6) ), tumor necrosis factor-α( (TNF-α)、 )、 plasminogen activated inhibitor-1 ( PAI-1 ) , 以 上 稱 之 為 脂 肪 細 胞 激 素 (adipocytokines) )脂肪細胞激素會調控食物的攝取、 脂肪細胞激素會調控食物的攝取、能量的消耗、 能量的消耗、代謝的平衡以及 其他生理功能 ,則這些脂 其他生理功能。 功能。當脂肪組織重量變化異常, 當脂肪組織重量變化異常,如 obesity 或 lipodystrophy, 肪細胞激素分泌失調而影響生理機能, 。 肪細胞激素分泌失調而影響生理機能,造成代謝上的紊亂(13)。 造成代謝上的紊亂. 1. Leptin Leptin 是 obese (ob) )gene 的產物, 的產物,由 167 個胺基酸所組成, 個胺基酸所組成,分子量大小為 16kDa, ,主要由白色脂肪組織合成(14)。 。leptin 結合在中樞神經系統和周圍的器官上 主要由白色脂肪組織合成 的專一性接受器經由活化 Janus kinase / signal transducer and activator of transcription pathway 來傳達訊息(15, 16)。 。leptin 可直接影響脂解作用、 來傳達訊息 可直接影響脂解作用、胰島素的 分泌及敏感性(17, 18), , 在短暫的禁食會降低其濃度而後再進食則會提高濃度, 分泌及敏感性 在短暫的禁食會降低其濃度而後再進食則會提高濃度, Kieffer 提出 adipoinsular axis 假說, ,當體 假說,認為 leptin 和胰島素呈現 feedback loop, 脂增加時, 脂增加時,增加的 leptin 會抑制胰島素合成和分泌, 會抑制胰島素合成和分泌,以侷限體脂無限擴增, 以侷限體脂無限擴增,若是 adipoinsular axis 失調, 。leptin 增加胰島素敏 失調,則會導致肥胖伴隨高胰島素血症(18)。 則會導致肥胖伴隨高胰島素血症 感性主要是其可活化 AMP - activated protein kinase pathway 而抑制 ACC 降低 Malony-CoA 而增加脂肪酸氧化, 而增加脂肪酸氧化,透過這樣的機制減少了骨骼肌細胞內的脂質堆積 改善胰島素敏感性(19-21)。 。 然而 leptin 也會抑制胰島素的分泌主要是透過活化 改善胰島素敏感性 JAK/STAT signaling 和干擾 cAMP pathway。 。leptin 被報導具有降低食物攝取、 被報導具有降低食物攝取、增 加能量消耗和增加生熱作用, 加能量消耗和增加生熱作用,但事實上不論在實驗動物或臨床常發現血液中 leptin 濃度與體脂堆積成正相關,通常認為是一種 leptin 阻抗現象(22, 23)。. 7.
(25) 第二章 文獻回顧. 2. Adiponectin Adiponectin 又名 Acrp30、 、AdipoQ、 、apM1 和 GBP28 是脂肪細胞分泌的蛋白 質,由 244 個胺基酸所組成, 。低濃度的 adiponectin 和冠 個胺基酸所組成,分子量大小為 30 kDa(24)。 狀心臟疾病、 狀心臟疾病、心血管危險因子、 心血管危險因子、葡萄糖不耐、 葡萄糖不耐、第 2 型糖尿病、 型糖尿病、高三酸甘油酯有關(22, 高三酸甘油酯有關 25-27)肥胖者血漿中 肥胖者血漿中 adiponectin 濃度較低, 濃度較低,而減重和降體脂可增加 adiponectin 的 濃度(28)。 。在孩童和青少年中 adiponectin 和 Body mass index、 、體脂、 濃度 體脂、腰圍成反比 (28-32), ,adiponectin 濃度也和內臟脂肪的累積成反比(33, 34)。 。Adiponectin 基因的 度也和內臟脂肪的累積成反比 表現和分泌會受到 TNF-α、 、IL-6 所抑制(25, 26)。 。血漿中 adiponectin 和胰島素刺激 所抑制 肌肉細胞內胰島素受器上酪氨酸麟酸化有關(35)。 。在小鼠以 leptin 和 adiponectin 處 肌肉細胞內胰島素受器上酪氨酸麟酸化有關 理之下可逆轉胰島素阻抗的現象。 理之下可逆轉胰島素阻抗的現象。在大鼠誘導肥胖和胰島素阻抗的模式之下, 在大鼠誘導肥胖和胰島素阻抗的模式之下,運用 病毒載體將 adiponectin cDNA 送入大鼠體內, 送入大鼠體內,可降低體重和改善周邊組織對胰島素 敏感性(36)。 。Adiponectin 和胰島素作用的標的器官有關, 敏感性 和胰島素作用的標的器官有關,在骨骼肌可以增加葡萄糖 在骨骼肌可以增加葡萄糖 的利用、 的利用、脂肪酸的氧化, 脂肪酸的氧化,在肝臟可增加胰島素敏感性、 在肝臟可增加胰島素敏感性、提高脂肪酸氧化降低肝臟葡 萄糖的釋出(22, 25, 35, 37)。 。 萄糖的釋出. 3.. Resistin Resistin 是一種脂肪細胞分泌和合成的蛋白質, 。在飲食 是一種脂肪細胞分泌和合成的蛋白質,分子量大小為 12 kDa。 誘發的肥胖或 leptin 和 leptin receptor 缺乏的鼠類會增加 resistin 濃度(38)。 。小鼠給 濃度 予西式高脂飲食會誘導高 resistin 濃度, 濃度,但在 antisense oligodexynucleotides 處理之 後,可以使 resistin 濃度回歸正常且改善肝臟胰島素阻抗的程度 。這樣的結果和 濃度回歸正常且改善肝臟胰島素阻抗的程度(39)。 抗的程度 resistin 剔除的小鼠是一致的, 剔除的小鼠是一致的,儘管沒有改變小鼠體重和體脂, 儘管沒有改變小鼠體重和體脂,在 resistin 剔除的小 鼠給予西式高脂飲食之後, ,葡萄糖不耐的現象顯著改善(39)。 。 鼠給予西式高脂飲食之後,比起 wild-type mice, 葡萄糖不耐的現象顯著改善 刪除 resistin 基因會增加肝臟中 AMPK 的活性而降低了糖質新生的酵素進而減少肝 臟葡萄糖的產率(39), ,而當 resistin 利用 transgenic overexpression 則會增加肝中葡 臟葡萄糖的產率 萄糖產率、和葡萄糖不耐(40) 和葡萄糖不耐 。resistin 對於小鼠脂質的代謝也有關,在正常餵給 chow diet 小鼠以 小鼠以 adenovirus 感染促使 resistin 過度表現, 過度表現,血漿中 TG 增加且肝中 TG 分 泌也增加(41)。 。 但 resistin 在人類對於肥胖或胰島素阻抗的相關性是不一致的(42, 泌也增加 在人類對於肥胖或胰島素阻抗的相關性是不一致的. 8.
(26) 第二章 文獻回顧. 43), ,脂肪細胞是 resistin 的合成來源是受爭議的(有人認為 的合成來源是受爭議的 有人認為 resistin 其實來自脂肪組 織中的 macrophages)(44)。 。人類的 resistin 只有 64%和鼠科是同源 和鼠科是同源, 和鼠科是同源,在胰島素阻抗 上是否和鼠科扮演相同的角色仍有待觀察(44)。 。 上是否和鼠科扮演相同的角色仍有待觀察. 4.. Tumor necrosis factor α (TNF-α) TNF-α 是一個分子量大小為 26 kDa 的穿膜蛋白。 的穿膜蛋白。雖然 TNF-α 和肥胖、 和肥胖、胰島素. 阻抗的關係不是很清楚, 阻抗的關係不是很清楚,但在此兩種情形之下組織中 TNF-α 的表現增加(45)。 的表現增加 。此外, 此外, 小鼠 TNF-α 或接受器基因剔除後, 或接受器基因剔除後,可增加胰島素敏感性和改善血漿中游離脂肪酸的 含量(46)。 。TNF-α 藉由 p44 / 42 和 JNK 使 perilipin (an oil droplet coating protein) 含量 磷酸化, 磷酸化,脫離脂肪油滴表面, 脫離脂肪油滴表面,以便 hormone-sensitive lipase 進行脂解, 進行脂解,釋出 free fatty acids(47)。 。在肝臟中過多的 在肝臟中過多的 TNF-α 會干擾內生性的脂肪酸生合成, 會干擾內生性的脂肪酸生合成,而太少的 TNF-α 則會干擾脂肪酸氧化。 則會干擾脂肪酸氧化 。 當急性的 TNF-α 刺激之下, 刺激之下 , 肝臟的 Very low density lipoprotein( (VLDL) )產出率增加, 產出率增加,TNF-α 和增加的 VLDL 結合而抑制脂肪組織的 脂蛋白脂解酶, 脂蛋白脂解酶,使脂肪細胞內脂肪酸的利用不良, 使脂肪細胞內脂肪酸的利用不良,血液當中呈現高三酸甘油酯血症 (48)。 。TNF-α 干擾胰島素傳訊是藉由活化 Ser / Thr kinases( (nPKC) )使胰島素對於 胰島素接受器或 IRS 上酪氨酸磷酸化減弱, 。 上酪氨酸磷酸化減弱,導致胰島素阻抗(49)。 導致胰島素阻抗. 5.. Interleukin-6 (IL-6) ). IL-6 的分子量大約 22~27kDa, ,循環中 IL-6 有 1/3 的量由脂肪細胞所分泌(50)。 。 的量由脂肪細胞所分泌 體脂肪堆積、 體脂肪堆積、胰島素阻抗和血漿中高游離脂肪酸和血漿中 IL-6 高濃度成正相關。 高濃度成正相關。肥 胖者脂肪細胞分泌 IL-6 的增加負向調控 IRS, ,正向調控 suppressor of cytokine signaling 3 造成肝臟中胰島素訊息傳遞訊息受阻, 造成肝臟中胰島素訊息傳遞訊息受阻,且促進肥胖者脂肪細胞內 TG 的 脂解作用增加造成高游離脂肪酸(51)。 。IL-6 並且抑制脂肪細胞分泌 adiponectin 使肝 脂解作用增加造成高游離脂肪酸 臟 胰 島 素 阻 抗 更 加 嚴 重 (52) 。 IL-6 也 會 間 接 促 進 血 小 板 的 聚 集 , 肝 臟 合 成 fibrinogen、 、C-reactive protein 增加, 增加,內皮細胞黏附因子表現量增加而造成血栓的形 成(53, 54)。 。. 9.
(27) 第二章 文獻回顧. 6.. Plasminogen activator inhibitor-1 (PAI-1) ). 代謝症候群的肥胖患者並且罹患第 2 型糖尿病有著高濃度的 PAI-1, ,且男性比 女性有著更高的趨勢(55)。 。很多研究指出隨著胰島素阻抗情形改善, 女性有著更高的趨勢 很多研究指出隨著胰島素阻抗情形改善,PAI-1 濃度跟著 降低,以低卡飲食有效降低體重、體脂肪後也觀察到 PAI-1 濃度的降低,血漿中 PAI-1 濃度增加和肥胖的促進有關 (56) 。 此外 , 第 2 型糖 尿病給予的胰島素增敏劑 metformin 或 troglitazone 後,PAI-1 的濃度也可回歸正常(57)。 。PAI-1 對於肥胖和 的濃度也可回歸正常 胰島素阻抗大多數研究著重於 PAI-1 基因的 polymorphism, ,promoter 上-675 位點 的 4G / 5G, ,4G carriers 會促進肥胖、 。研究者在纖維母 會促進肥胖、代謝症候群的發生(58-60)。 代謝症候群的發生 細胞中發現 PAI-1 藉由阻止 vitronectin 和黏著分子 αvβ3 結合而抑制 PKC 的磷酸 化,妨礙胰島素的訊息傳遞(61)。 。過度的 PAI-1 表現會抑制細胞分化(這可能又是一 妨礙胰島素的訊息傳遞 表現會抑制細胞分化 這可能又是一 種身體防止脂肪組織過度擴增的機制), 種身體防止脂肪組織過度擴增的機制 , 在 PAI-1-. / -. 小鼠的前脂肪細胞可發現比. wild-type 分化程度較高, 。PAI-1 由 分化程度較高,且可顯示出胰島素的刺激葡萄糖汲取增加(62)。 且可顯示出胰島素的刺激葡萄糖汲取增加 於會抑制 tissue plasminogen activator, ,則使得纖維蛋白(fibrinogen)溶解作用受阻 溶解作用受阻, 則使得纖維蛋白 溶解作用受阻, 加速血栓的形成, 。 加速血栓的形成,在心血管疾病的病人當中 PAI-1 濃度也有顯著性的增加(43)。 濃度也有顯著性的增加. 三、高糖( 高糖(蔗糖)、 蔗糖)、高脂 )、高脂( 高脂(飽和油脂) 飽和油脂)飲食與代謝症候群之相關性 (一 一) 飲食誘發代謝症侯群實驗動物模式. 對於代謝症候群動物模式的建立, 對於代謝症候群動物模式的建立,先前的研究多以高油 先前的研究多以高油、 高油、高糖添加於飼料或糖 水的給予大、 水的給予大、小鼠以模擬代謝症候群的發生。 小鼠以模擬代謝症候群的發生。以高飽和油脂或高蔗糖添加於飼料給 予 C57BL / 6J mice, ,發現高飽和油脂添加於飼料會誘發出肥胖、 發現高飽和油脂添加於飼料會誘發出肥胖、脂肪細胞肥大、 脂肪細胞肥大、葡 萄糖不耐、 萄糖不耐、胰島素阻抗、 胰島素阻抗、高 leptin 血症等現象, 血症等現象,但高蔗糖添加於飼料僅出現短暫的 葡萄糖不耐之現象(63, 64)。 。以高飽和油脂或高蔗糖添加於飼料給予 Wistart rats, , 葡萄糖不耐之現象 發現高飽和油脂添加於飼料會誘發出腹部脂肪堆積、 發現高飽和油脂添加於飼料會誘發出腹部脂肪堆積、體重增加、 體重增加、禁食狀態下血漿中 葡萄糖、 ,但 葡萄糖、胰島素濃度增加等現象 胰島素濃度增加等現象, 加等現象,高蔗糖添加於飼料不會出現肥胖的現象(65), 高蔗糖添加於飼料不會出現肥胖的現象 蔗糖添加於飲水中給予 Wistart rats 則會出現體重增加、 則會出現體重增加、腹部脂肪堆積、 腹部脂肪堆積、高胰島素. 10.
(28) 第二章 文獻回顧. 血症、 。飲食在代謝症候群誘發模式中對於 血症、血脂異常、 血脂異常、高血壓等現象(66)。 高血壓等現象 飲食在代謝症候群誘發模式中對於大 代謝症候群誘發模式中對於大、小鼠 分別有不同效果, 分別有不同效果,且程度也不同。 且程度也不同。. (二 二) 蔗糖(或其中果糖 蔗糖 或其中果糖)引發代謝症候群的生化與分子機制 或其中果糖 引發代謝症候群的生化與分子機制. 先前的研究指出, 先前的研究指出,大鼠給予果糖的飲食會刺激大鼠的攝食量, 大鼠給予果糖的飲食會刺激大鼠的攝食量,但葡萄糖的給予 則不會刺激攝食增加(67), ,且雙醣類的蔗糖促進肥胖的效果比葡萄糖較好, 則不會刺激攝食增加 雙醣類的蔗糖促進肥胖的效果比葡萄糖較好,因為蔗 糖裡內含的果糖不會刺激生熱反應( ),消耗能量 。在人體試驗 糖裡內含的果糖不會刺激生熱反應(thermogenesis), ),消耗能量(68)。 消耗能量 當中果糖飲料攝取相對於葡萄糖飲料腹部脂肪的堆積有較明顯的現象 ,而腹部 當中果糖飲料攝取相對於葡萄糖飲料腹部脂肪的堆積有較明顯的現象(69), 果糖飲料攝取相對於葡萄糖飲料腹部脂肪的堆積有較明顯的現象 脂肪堆積也就是內臟型肥胖和胰島素阻抗息息相關(70, 71), ,由於內臟脂肪組織增 脂肪堆積也就是內臟型肥胖和胰島素阻抗息息相關 大,對於胰島素的敏感性不好, 對於胰島素的敏感性不好,但對於兒茶酚胺較敏感, 但對於兒茶酚胺較敏感,脂解的能力較其他地方的 脂肪組織強, 脂肪組織強,游離出的脂肪酸經門脈循環運送至肝臟, 游離出的脂肪酸經門脈循環運送至肝臟,造成肝臟三酸甘油酯堆積, 造成肝臟三酸甘油酯堆積, 導致胰島素阻抗。 導致胰島素阻抗。adiponectin 會增加肝臟脂質的異化和促進胰島素的敏感性, 會增加肝臟脂質的異化和促進胰島素的敏感性,但增 大的內臟脂肪組織 adiponectin 產出率較少, 。果糖的 產出率較少,更加速了肝臟胰島素阻抗(72)。 更加速了肝臟胰島素阻抗 大量攝取會增加肝臟脂質生合成(73), ,由於果糖在糖解的路徑中比葡萄糖少一限速 大量攝取會增加肝臟脂質生合成 步驟酶 phosphofructokinase 的作用, 的作用,fructose-1-phosphate 快速的生成 acetyl-CoA 和 glycerol-3-phosphate, ,加速了肝臟中三酸甘油酯的堆積, 加速了肝臟中三酸甘油酯的堆積, 造成肝臟中胰島素阻 抗,而過多的三酸甘油酯和 Apolipoprotein B( (apoB) )聚集成 VLDL 經由循環, 經由循環,血 漿內 TG 增加, 增加,最後使得肌肉或脂肪組織累積更多的三酸甘油脂, 最後使得肌肉或脂肪組織累積更多的三酸甘油脂,使周邊組織也產 生胰島素阻抗(74)。 。 生胰島素阻抗. 由分子的層次來看 由分子的層次來看, 來看,禁食再餵食高碳水化合物會促進肝臟中 Sterol regulatory element binding protein-1c (SREBP-1c) )蛋白質表現量增加, 蛋白質表現量增加,SREBP-1c 是一轉錄 因子, 因子,主要調控糖解、 主要調控糖解、脂質生合成的相關基因, 脂質生合成的相關基因,葡萄糖和胰島素會促進 SREBP-1c 表現增加, 表現增加,在肝臟產生胰島素阻抗時, 在肝臟產生胰島素阻抗時,雖然肝醣合成減少, 雖然肝醣合成減少,但由於高濃度的胰島素, 但由於高濃度的胰島素, 使得 SREBP-1c 表現量多, 76)。 。在果糖 表現量多,內生性的脂質不會因胰島素阻抗而減少(75, 內生性的脂質不會因胰島素阻抗而減少 誘導脂質生合成方面, 誘導脂質生合成方面,果糖雖不會促使胰島素分泌而誘導 SREBP-1c 增加, 增加,但果糖 會促使 protein tyrosine phosphatase 1B (PTP-1B) )過度表現, 過度表現, PTP-1B 會促進. 11.
(29) 第二章 文獻回顧. SREBP-1c mRNA 表現增加, 表現增加,最後促使 SREBP-1c 促進肝中脂質生合成基因表現量 增加(77)。 。 相對於其他的糖果糖的攝取 )的濃度(78, 增加 相對於其他的糖 果糖的攝取會提高 果糖的攝取 會提高血漿中尿酸 會提高 血漿中尿酸( 血漿中尿酸( uric acid) 的濃度 79), ,血漿中尿酸和體重增加、 。血漿中尿酸的含量和血 血漿中尿酸和體重增加、內臟脂肪堆積也有相關(70)。 內臟脂肪堆積也有相關 管舒張作用有關的一氧化氮有關, 管舒張作用有關的一氧化氮有關,高尿酸則會使得一氧化氮濃度減少, 高尿酸則會使得一氧化氮濃度減少,進而造成高 血壓(79), 血壓 ,而胰島素的濃度和一氧化氮也有關聯, 而胰島素的濃度和一氧化氮也有關聯,因為胰島素的增加會使一氧化氮 因為胰島素的增加會使一氧化氮 的 bioavailability 增加,促使血管擴張血流通透,使葡萄糖更順利的到達目的組織(78, 使葡萄糖更順利的到達目的組織 79)。 。果糖攝取產生的糖化終產物 advanced glycation end products、 、Methylglyoxal ( 果糖糖解途徑中間產物) 果糖糖解途徑中間產物 ) 的增加會造成氧化壓力和發炎反應的產物增加, 的增加會造成氧化壓力和發炎反應的產物增加 , 如 hydrogen peroxide、 、aortic nicotinamide adenine dinucleotide phosphateoxidase-4 和 vascular cell adhesion molecule-1 等,會增加血管收縮素( )造成血壓 會增加血管收縮素(angiotensun 1) 的上升(80, 81)。 。 的上升. (三 三) 高油脂(飽和脂肪酸 高油脂 飽和脂肪酸)引發代謝症候群的生化與分子機制 飽和脂肪酸 引發代謝症候群的生化與分子機制. 高飽和脂肪酸對於胰島素阻抗有很強的關聯, 高飽和脂肪酸對於胰島素阻抗有很強的關聯,由於過量的攝取飽和油脂造成的 肥胖影響最大(82), ,尤其是膳食之中的油脂直接儲存於內臟脂肪組織中, 肥胖影響最大 尤其是膳食之中的油脂直接儲存於內臟脂肪組織中,過多的 TG 堆積造成脂肪細胞的胰島素阻抗, 堆積造成脂肪細胞的胰島素阻抗,脂肪細胞的脂解作用增加, 脂肪細胞的脂解作用增加,循環中的游離脂肪酸 增加造成肝臟 TG 儲存也增加, 儲存也增加,出現肝臟胰島素阻抗, 出現肝臟胰島素阻抗,肝臟肝醣分解速率快造成高 胰島素血症, 胰島素血症,此外肝中過多 TG 也造成 VLDL 釋出過盛造成高三酸甘油酯血症 釋出過盛造成高三酸甘油酯血症, 造成高三酸甘油酯血症,而 高的三酸甘油酯也會提升心血管疾病的發生率(69)。 。由於脂肪細胞胰島素阻抗脂解 高的三酸甘油酯也會提升心血管疾病的發生率 作用旺盛, 、DAG 和 intramyocellular lipid 而 作用旺盛,游離出的脂肪酸在肌肉內堆積成 TG、 影響了胰島素的訊息傳遞, 影響了胰島素的訊息傳遞,降低胰島素刺激葡萄糖轉運體汲取葡萄糖最後造成胰島 素阻抗(83, 84)。 。 素阻抗. 12.
(30) 第二章 文獻回顧. 圖 2-2 高果糖的與代謝症候群之相關性 資料來源: &Adeli,2008(85) 資料來源:Miller&. 四、肝中脂質生合成之轉錄調控. (一 一) SREBP-1c與 與ChREBP轉 轉錄因子. SREBP-1c屬於 屬於SREBP family transcription factor中的一員 中的一員, 屬於 中的一員,基本構造為basic 基本構造為 helix-loop-helix( (bHLH), ),可與 responsive element 上的 E-box結合進行轉 結合進行轉 ),可與sterol 可與 錄 和 脂 質 或 糖 解 相 關 的 基 因 , 如 : fatty acid synthase (FAS) 、 acetyl-CoA. carboxylase (ACC) 、stearoyl-coenzyme A desaturase 、 Spot 14 、glucokinase (GK) 。SREBP-1c表現在大部分的組織 表現在大部分的組織, 表現在大部分的組織,尤其以肝臟、 尤其以肝臟、白色脂肪組織最多。 白色脂肪組織最多。在肝細. 13.
數據

相關文件
低脂奶類
Apart from European civilisation, the Islamic civilisation has also made significant contributions to the history of civilisation. Though communication
It’s not chocolate that causes problems, but the highly processed nature of the products containing chocolate and high levels of sugar and fat.. While it’s great that chocolate
(2007) demonstrated that the minimum β-aberration design tends to be Q B -optimal if there is more weight on linear effects and the prior information leads to a model of small size;
Most of teachers agree with positive effects of the 99 curriculum on practical instruction in school, however, they seem to concern inequalities of content between volumes and
5.1.1 This chapter presents the views of businesses collected from the business survey, 12 including on the number of staff currently recruited or relocated or planned to recruit
熱水可令喉管及裝置釋 出更多雜質,應避免從 熱水水龍頭取水飲用或
BhaktiYoga Counseling and Training Centre Limited.. Kinesics and Context: Essays on Body Motion Communication. Philadelphia: University of Pennsylvania Press. Photo