計 畫 名 稱 : 腫 瘤 抑 制 蛋 白 質 為 促 進 抗 癌 藥 物 療
效的分子
單位:國立成功大學醫學檢驗生物技術學系
主持人:徐麗君
導 論
含雙色胺酸功能區氧化還原酶
含 雙 色 胺 酸 功 能 區 氧 化 還 原 酶 (WW domain-containing oxidoreductase ; 亦 命 名 為 WWOX、fragile site FRA16D oxidoreductase FOR、或者是 WOX1),是在 2000 年被發 現的,其基因位於人類染色體 (chromosome) 16q23.3-24.1,而這段區域也是 common fragile site FRA16D 的位置 (Bednarek et al., 2000; Chang et al., 2001; Ried et al., 2000)。 經過基因體 (genomic) 序列的分析後發現 WWOX 基因有 9 個表現序列 (exons),可表現 出全長的 WWOX/WOX1。其 mRNA 經由替代性剪接 (alternative splicing) 後可產生另 外七個不同的轉錄物 (transcripts),可以進一步轉譯為 WOX1 的同質異構物 (protein isoforms) (Figure 1A) (Chang et al., 2007)。
全長的 WOX1 蛋白質在 N 端具有兩個 WW domains,以及一個位於 C 端的 short-chain alcohol dehydrogenase-reductase (SDR) domain。兩個 WW domains 之間有一個 nuclear localization sequence (NLS),在 SDR domain 上則有粒線體移位訊息序列 (mitochondria-targeting sequence) 以及可和荷爾蒙 (hormone) 或 substrate 作用的 NSYK motif (N232、S281、Y293和K297) (Figure 1A) (Chang et al., 2007; Chang et al., 2001)。 在正常或癌化的乳房細胞上,利用免疫螢光染色方法可在粒線體 (mitochondria) 內發現 有 WOX1 蛋白質的存在 (Chang et al., 2005b)。在過去的研究中發現,具有 SDR domain 的蛋白質,例如:nicotinamide adenine dinucleotide (NAD)- 或者是 nicotinamide adenine dinucleotide phosphate (NADP)-dependent oxidoreductase 等大部分都扮演著代謝調控者 的角色 (metabolic mediators),或者是和脂質荷爾蒙 (lipid hormone) 的氧化及還原作用 有關 (Oppermann et al., 2001),因此推測 WOX1 及其 family proteins 可能和荷爾蒙的代 謝有關。初步也證實,WOX1 蛋白質會利用 SDR domain 上之 NSYK motif 與一些固醇 類的性荷爾蒙 (sex steroid hormones),例如男性荷爾蒙 (androgen) 和雌激素 (estrogen) 作用而活化。
發現有兩個重要的磷酸化位置 (phosphorylation sites),即 Tyr33 (Chang et al., 2003a; Chang et al., 2005b; Lokeshwar et al., 2005; Sze et al., 2004) 以及 Tyr287 (Mahajan et al., 2005),這兩個位置上的磷酸化對於 WOX1 的作用有極大的影響。當細胞受到一些壓力 (stress) 或是荷爾蒙的刺激時,會誘使細胞內 WOX1 蛋白質的 Tyr33 進行磷酸化,其 後,經磷酸化而活化的 WOX1 即可和其他的蛋白質,例如 p53 等結合 (Chang, 2002; Chang et al., 2005a),再進一步地執行其功能。當磷酸化的位置是位於 Tyr287 時,會促 使 WOX1 產生多次泛素化 (polyubiquitination),導致 WOX1 蛋白質進行蛋白酶降解作 用 (proteasomal degradation) (Mahajan et al., 2005)。
WWOX 和癌症的關連性
腫瘤生成 (tumorigenesis) 是一個複雜的過程,包括基因體頻繁的改變,導致腫瘤基因 (oncogenes) 的活化,或是促使腫瘤抑制基因 (tumor suppressor genes) 的不活化。染色體 的脆性部位 (chromosomal fragile sites) 在 cancer 形成過程中所扮演的角色多年來一直受 到關注,後來的實驗也證實位於 common fragile sites 上的基因和 cancer 的確有關聯。 在許多的腫瘤,例如:乳房、前列腺等,常發現在第 16 對染色體長臂 (16q) 有同合子 缺失 (homozygous deletion) ,或是異合型喪失 (loss of heterozygosity, LOH) 的現象 (Aqeilan and Croce, 2007),因此推測有 tumor suppressor gene 位於此處,極有可能是因 為這些基因上的缺失,導致細胞失去正常的調控而導致腫瘤的生成。
有趣的是,WWOX 基因即位於這個位置上,研究亦證實許多人類的惡性腫瘤中 WWOX 基因在 16q23 的位置上有基因的變異 (genomic alteration) (Bednarek et al., 2000;
Paige et al., 2001; Ried et al., 2000),此外,在一些從腫瘤組織所分離得來的細胞株上也 發現有同合子缺失的現象 (Finnis et al., 2005),如此的改變可能導致 WWOX 基因表現產 生變化。近年來的研究發現,和正常的細胞相較之下,惡性腫瘤細胞的 WOX1 蛋白質 表現量較低,甚至是不表現 (Aqeilan et al., 2004a; Guler et al., 2004; Pimenta et al., 2006),此外,失去 WWOX/WOX1 的表現可能和腫瘤的侵犯性 (aggressiveness) 具有高 度關聯性 (Chang et al., 2005b; Donati et al., 2007)。除了基因上的改變而導致腫瘤的生 成,啟動子 (promoter) 區域上的高度甲基化 (hypermethylation) 也同樣會影響到基因的
表現而促使腫瘤生成,在若干人類腫瘤中同樣也被觀察 WWOX 基因到有啟動子高度甲 基化 (promoter hypermethylation) 的現象 (Kuroki et al., 2004)。根據過去的研究推論,若 干腫瘤細胞中 WOX1 蛋白質的表現量較低,這可能是造成腫瘤生成的因素之一,因此 WWOX/WOX1 被認為是扮演 candidate tumor suppressor 的角色。
WOX1 在細胞中的功能和角色
過去的研究除了發現 WOX1 蛋白質和癌症之間的關連以外,亦發現在胚胎發育的時期 (Chen et al., 2004) 以及許多人類器官的細胞中,例如:腦、皮膚、心臟等,皆可見到 WOX1 蛋白質的表現 (Nunez et al., 2006)。WOX1 蛋白質也被發現存在於粒線體、細胞 核、高爾基氏體 (Golgi)、溶小體 (lysosome) 等細胞內的胞器,但是目前對於 WOX1 的 瞭解仍然非常有限。因此,許多的研究開始深入探討 WOX1 在細胞中的功能及其所扮 演的角色。
目前已知,當 stress 產生時,細胞內的 tyrosine kinase Src 會促使 WOX1 蛋白質上 的 Tyr33 進行磷酸化而促使 WOX1 活化 (Aqeilan et al., 2004c)。活化後的 WOX1 會和 許多不同的蛋白質交互作用,或者是移行 (translocate) 到其他的胞器中,例如:活化後 的 WOX1 會和活化的 p53 交互作用,再一起移行到粒線體或是細胞核之中,進一步促 使細胞凋亡 (Chang, 2002; Chang et al., 2003b; Chang et al., 2005a; Chen et al., 2005) (Figure 1B)。活化後的 WOX1 也會去影響基因的轉錄 (transcription):活化後的 WOX1 會加強結合 p73 以及 AP-2γ 的能力,藉此去抑制這些轉錄因子 (transcription factors) 移 行至細胞核 (nuclear translocation),進而影響他們在基因轉錄上的功能 (Aqeilan et al., 2004b; Aqeilan et al., 2004c);此外,YAP (WW domain-containing Yes-associated protein) 結合 ErbB4 後可促使 gene transcription,WOX1 則被發現會和 YAP 競爭結合 ErbB4, 藉此去調控基因的表現 (Aqeilan et al., 2005)。從這些相關的研究中可歸納出 WOX1 具 有兩種功能:
1. WOX1 具有促進細胞凋亡活性 (proapoptotic activity)
Qin et al., 2006) 或 caspase-independent (Chang et al., 2003a; Chang et al., 2005a; Chang
et al., 2001) 的細胞凋亡途徑 (apoptosis pathway)。此外,WOX1 可以直接結合 p53
而穩定活化後的 p53 蛋白質,並且一起誘發細胞凋亡產生 (Chang et al., 2005a)。相 反的,若利用反義 (antisense) mRNA 以及 siRNA 等的方式來抑制 WOX1 的表現, 即會保護細胞而不會凋亡 (Chang et al., 2003a; Chang et al., 2001)。故 WOX1 在細胞 中的作用被認為可促進細胞走向凋亡。
2. WOX1 可作為 tumor suppressor
基因上的變化會導致蛋白質表現程度的不同,因此若在一些不會表現或是表現較少 WOX1 蛋白質的腫瘤細胞中回復其表現,可以抑制腫瘤的生長 (Cantor et al., 2007; Fabbri et al., 2005; Qin et al., 2006)。相反的,若細胞失去 WOX1 的表現則會促使腫 瘤生成 (Aqeilan et al., 2007; Mahajan et al., 2005)。因此,WOX1 被認為具有抑制腫 瘤生長的角色。
WWOX 在鱗狀上皮細胞癌 (squamous cell carcinoma; SCC)中的角色
鱗狀上皮細胞癌又稱為上皮癌,是表皮角質細胞 (keratinocytes) 最重要的惡性轉形。其 致病原因大多與日光中紫外線的曝曬有關,或是暴露於輻射線、瀝青等致癌物的接 觸、皮膚感染 (如病毒)、慢性疾病 (如廔管、骨髓炎)、以及基因變異等所引起。此疾 病好發於 50 歲以上之男性,其好發的部位有耳、鼻、唇、舌、手等,細胞生長速度 快,常會造成潰瘍,甚至於擴散到全身。在過去的研究中發現,WOX1 及其 family proteins 的表現量與皮膚細胞的分化程度似乎具有關聯性:正常皮膚上皮細胞分化程度 愈高時,其 WOX1 蛋白質表現量愈高。此外,皮膚 SCC 癌細胞的分化程度也可依據 其角質化之現象分為分化良好 (well- differentiated)、中等分化 (moderately-differentiated) 以及分化不良 (poorly-differentiated) SCC,而 WOX1 及其 family proteins 的蛋白質表現 量在 well-differentiated SCC 細胞內較高,poorly-differentiated SCC 細胞內最低。皮膚 組織切片經免疫化學染色分析後發現,相較於正常的皮膚,SCC 癌細胞中 WOX1 蛋白 質的表現量有明顯減少的趨勢 (Lai et al., 2005; Pimenta et al., 2006)。有趣的是,有些 SCC 的 WWOX mRNA 表現量並沒有減少,而其 WOX1、WOX2 蛋白質表現以及 Tyr33 位置上的磷酸化程度則有明顯的降低,推測有可能癌細胞中的轉譯或是蛋白質降解的
機制受到了調控,導致蛋白質表現量的減少 (Lai et al., 2005)。另外,也有可能是產生 了有缺陷的轉錄物,進而去影響 WOX1 蛋白質的轉譯 (Pimenta et al., 2006)。
目前治療 SCC 有多種不同的策略,例如使用外科手術去除,或是使用冰凍手術、 放射線電療、化學療法。在化學療法上常用的藥劑之ㄧ就是 methotrexate (MTX)。 MTX 為一種葉酸拮抗劑 (folate antagonist),可以抑制二氫葉酸還原酶 (dihydrofolate reductase, DHFR),使 FH2 (dihydrofolate) 無法還原成 FH4 (tetrahydrofolate),而
FH4 是促使 dUMP 轉變成為 dTMP 重要的輔助因子,MTX 的抑制作用會破壞
folate 的生合成,導致核酸的合成受阻,促使細胞走向細胞凋亡 (Genestier et al., 2000; Zhao and Goldman, 2003)。MTX 亦具有免疫抑制作用,可能是抑制了淋巴球的增殖反 應,故常用於治療風濕性關節炎等自體免疫引起的發炎反應。疣狀癌 (verrucous carcinoma; VC) 是屬於鱗狀上皮細胞癌的一種,患有 VC 的患者利用 MTX 做局部動脈 注射後,對於 VC 的治療極有效果 (Sheen et al., 2004)。成大醫院皮膚科許漢銘醫師及 奇美醫學中心皮膚科賴豐傑醫師在 VC 患者經 MTX 治療前後,將此患者的腫瘤部位做 切片檢查與組織免疫化學染色分析後發現,MTX 治療後 WOX1 蛋白質顯著地被誘導 表現,而且 caspase-3 有活化的現象,腫瘤部位的細胞有凋亡的情形,因此我們推測 WOX1 的表現可能在 MTX 治療 SCC 的過程中扮演了極重要的角色。因為在正常的角 質細胞角化 (cornification) 前的成長以及分化過程中,WOX1、WOX2 蛋白質表現量以 及 Tyr33 位置上的磷酸化也有增加的現象 (Lai et al., 2005),但卻沒有caspase-3的活化 情形,推測 WOX1 及其 family proteins 在這個過程中的表現可能和分化有關。然而到 目前為止,對於 WOX1 在環境壓力之下如何轉而執行 proapoptoti的功能仍不清楚。 過去對於 WWOX/WOX1 的研究上大多都只注意到其在腫瘤或組織中的分布及表 現情形,到目前為止,並沒有研究深入地去了解,WOX1 在癌症化學治療中實際扮演 的角色為何。在本研究中,我們嘗試利用不同分化程度之 SCC 細胞株的研究模式來探 討 WOX1 在 MTX 治療 SCC 中所扮演的角色,以及 WOX1 在癌症化學治療中是否具 有藥物開發方面的潛力,以期在未來 cancer therapy 中能提供新的治療策略。
實驗結果
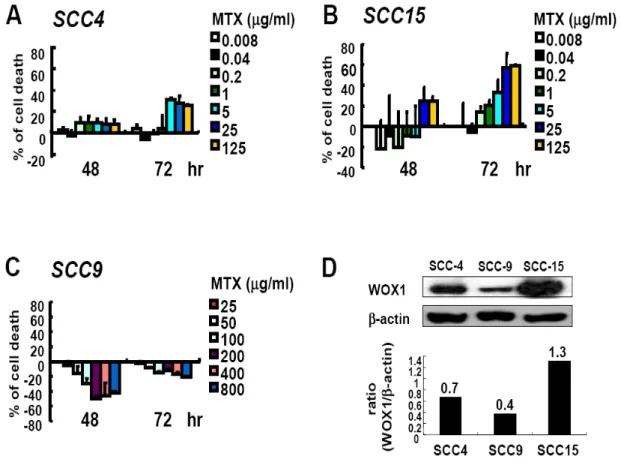
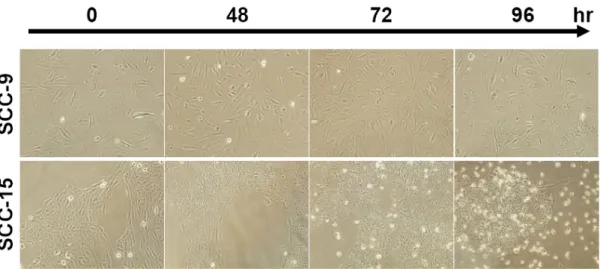
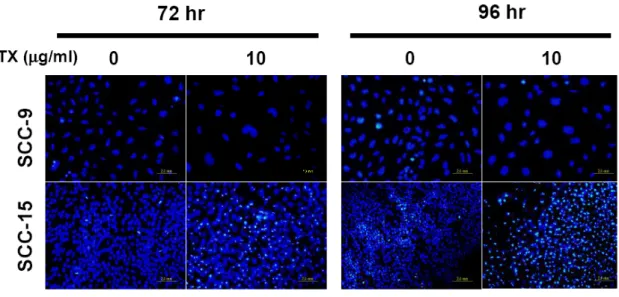
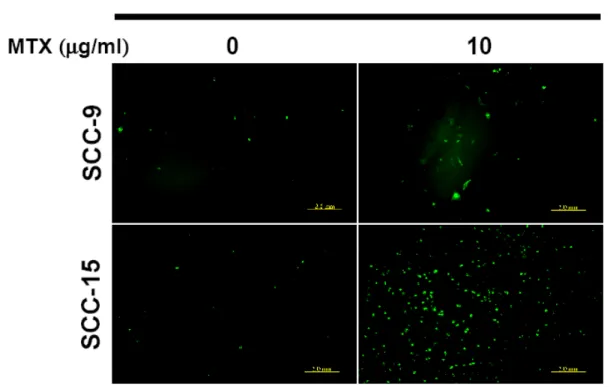
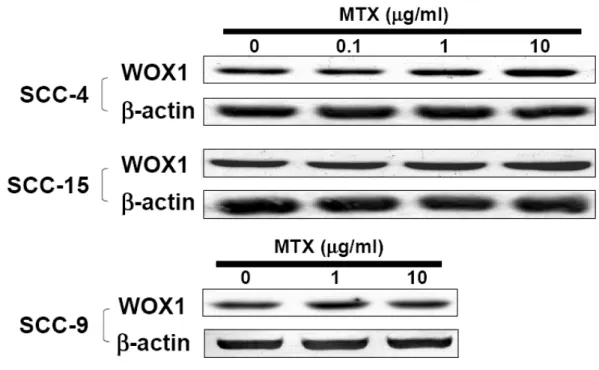
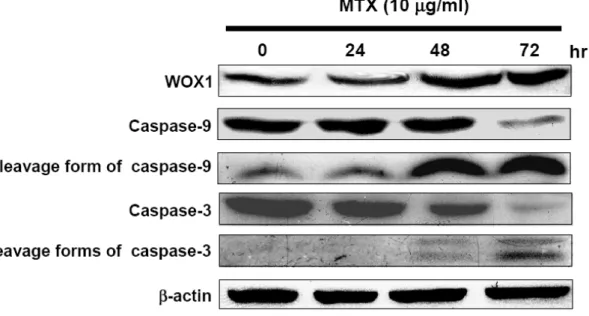
1. SCC-4 以及 SCC-15 細胞在 MTX 處理後會有凋亡的現象,而 SCC-9 細胞則對 MTX 有極高的耐受性 我們利用 SCC-4、SCC-9 以及 SCC-15 這三株分離自舌頭鱗狀上皮細胞癌的細胞株 來建立一個體外培養的研究模式。為了瞭解 MTX 對這三株 SCC 細胞株的治療效 果,我們將這三株細胞分別培養在 96 孔培養盤中一天以後,加入不同濃度的 MTX 後於 37°C 培養箱中繼續培養 48 和 72 小時。利用結晶紫溶液染色後,洗去結晶紫 染劑,待乾後,利用醋酸溶液將結晶紫自細胞中溶出,並用 ELISA reader 以波長 590 nm 讀取吸光值後分析細胞存活的情形。Figure 2 的結果顯示,在這三株細胞株 之中,SCC-15 細胞對於 MTX 的敏感度較高,有明顯細胞死亡的情形 (Figure 2B), 而 SCC-9 細胞對 MTX 的感受度最低,看不到細胞死亡的現象 (Figure 2C),SCC-4 則介於其中 (Figure 2A)。利用西方墨點法進一步分析這三個細胞株內源性的 WOX1 蛋白質表現量,結果顯示,對 MTX 較敏感的 SCC-15 細胞中內源性 WOX1 蛋白質 的表現量明顯高於其他兩者 (Figure 2D),而 SCC-9 對於 MTX 的敏感性是三者中最 低的,其內源性 WOX1 蛋白質的表現量也最低 (Figure 2D)。因此我們初步認為 SCC 細胞中內源性 WOX1 蛋白質之表現量可能與細胞對於 MTX 之敏感度有關。 2. MTX 誘發 SCC-15 細胞的凋亡 細胞死亡可以區分為細胞凋亡 (apoptosis) 或是細胞壞死 (necrosis) ,所以我們想進 一步釐清 MTX 所引發的細胞死亡現象為哪一種類型。在細胞凋亡的過程中可以觀 察到 membrane blebbing、染色質濃縮 (chromatin condensation) 等現象。並且在以前 的研究中也顯示,當細胞要進行凋亡時,會有細胞膜內膜外翻而造成內膜上的 PtdSer (PS) 暴露的現象,外翻之 PS 可與 FITC-conjugated Annexin V 結合,可以利 用這個現象作為偵測細胞凋亡的方式之一。我們初步先去觀察三種 SCC 細胞株在 施予 10 µg/ml MTX 之後,隨著培養時間的增加,其細胞型態的改變,同時也進行 DAPI 以及 Annexin V 染色,再利用螢光顯微鏡觀察細胞核和細胞膜上之變化。結果顯示,在施予 MTX 之後隨著時間增加,在 SCC-15 這株對 MTX 較敏感的細胞, 可見到有明顯細胞死亡的現象 (Figure 3),而這樣的現象包含了有細胞核濃染 (nuclear condensation) 以及凋亡小體之形成 (apoptotic bodies),而 SCC-9 則沒有這樣 的現象 (Figure 4)。我們進一步的利用 annexin V 的染色並進行觀察,從結果顯示, 當細胞在施予 MTX 後 72 小時,SCC-15 相較於 SCC-9 細胞株有明顯 Annexin V 結 合到細胞膜的情形,顯示有大量內膜外翻的現象 (Figure 5)。由以上的實驗結果顯 示,我們初步證實 MTX 所誘發之 SCC 細胞死亡為細胞凋亡。 3. MTX 誘發 SCC-15 細胞凋亡時會誘導 WOX1 蛋白質的表現量增加,並且進一 步引發 Caspase-9 與 Caspase-3 的活化 首先,我們想先確認 MTX 是否會誘導 SCC 細胞改變 WOX1 蛋白質的表現量,因 此我們將培養在直徑 10 公分細胞培養盤中的這三株細胞株,利用 0、0.1、1 以及 10 µg/ml MTX 處理 72 小時後,收集細胞並萃取細胞內蛋白質,利用西方墨點法分 析 WOX1 蛋白質的表現量。從結果得知,SCC-4 和 SCC-15 這兩株細胞株在施予 MTX 之後,細胞內 WOX1 蛋白質的表現量會隨著 MTX 的濃度提高而增加,但此 現象卻未出現在 9 這個細胞株中 (Figure 6)。相同地,我們針對最敏感的 SCC-15 細胞株施予 10 µg/ml MTX 後,經過不同的時間收集細胞並萃取細胞蛋白質後進 一步分析。結果顯示,在施予 MTX 後的 48 小時 SCC-15 細胞內 WOX1 蛋白質的 表現量會顯著增加,培養 72 小時後則更加明顯。Caspase-9 以及 Caspase-3 在細胞 凋亡的訊息途徑中扮演重要的角色,因為前面的實驗已初步證實 MTX 誘導 SCC-15 細胞進行凋亡,因此我們也想去觀察,是否 Caspase-9 以及 Caspase-3 之活化也有所 變化。我們從結果中發現,當 MTX 刺激 SCC-15 細胞 48 小時以後,可以觀察到 Caspase-9 活化而產生 cleavage form 的現象,72 小時後則見到 Caspase-3 繼起而活 化之情形 (Figure 7)。相對的,SCC-9 細胞在施予 MTX 後則完全沒有見到 caspase-3 活化的現象 (Figure 13A)
4. MTX 誘導 WOX1 的表現量增加
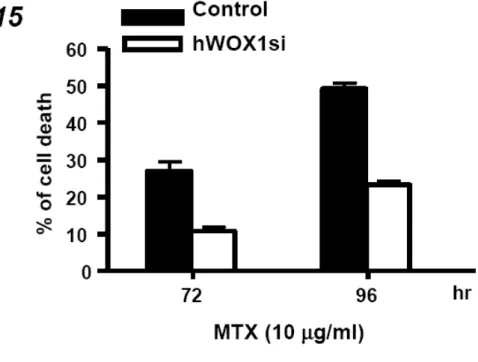
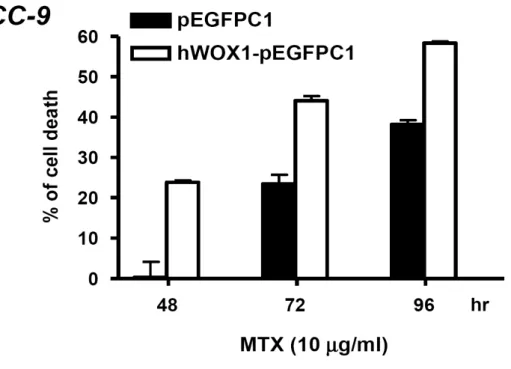
轉錄及轉譯這兩個層次上的調控對於蛋白質表現量的增加有重要的影響。先前的結 果顯示,在對 MTX 感受度較高的 SCC-4 和 SCC-15 細胞中,MTX 會促進 WOX1 蛋白質的表現。因此我們想要進一步的瞭解,MTX 是否影響 WOX1 mRNA 的表 現。SCC-9 以及 SCC-15 在施予 10 µg/ml MTX 後培養經過不同的時間,我們利用 RT-PCR 的方法分析 WOX1 mRNA 的表現量。結果顯示,MTX 刺激 24 小時以後 SCC-15 細胞中的 WOX1 mRNA 表現量明顯增加,這個增加的趨勢延續至 48 小時 以後,然而 SCC-9 細胞中 WOX1 mRNA 的表現量在施予 MTX 後並沒有任何改變 (Figure 8)。 5. WOX1 參與在 MTX 誘發 SCC 細胞凋亡的途徑之中 為了確認 WOX1 的表現和 MTX 誘發的細胞凋亡是否有直接關係,我們使用 siRNA 的方法,去抑制 WOX1 表現量較高之 SCC-15 細胞中 WOX1 的表現,並且觀察是 否會改變此細胞對於 MTX 的敏感度。我們利用電穿孔的方式將表現 hWOX1si 與 GFP 的質體以 4:1 的比例同時送入 SCC-15 細胞,培養一天後利用細胞篩選的方 式,分離出帶有螢光的細胞後再將其培養在 96 孔培養盤中,在施予 MTX 後繼續培 養 72 和 96 小時,利用結晶紫染色的方式分析細胞存活的情形。從結果顯示,若抑 制了 SCC-15 細胞中 WOX1 的表現量之後,確實可以降低其對於 MTX 的敏感度 (Figure 9)。相同的,我們也利用過度表現的實驗模式,測試對 MTX 具高度耐受性 的 SCC-9 細胞,研究分析增加 WOX1 的表現是否會影響其對 MTX 的敏感度。從 實驗結果得知,當 SCC-9 細胞送入表現 WOX1 的質體後,和對照組相較之下,過 度表現 WOX1 的 SCC-9 細胞確實會提高對於 MTX 的敏感度 (Figure 10)。從以上結 果顯示,WOX1 的確在 MTX 所導致的細胞凋亡途徑中扮演重要的角色。 6. WOX1 蛋白質的磷酸化作用參與在 MTX 誘發細胞凋亡的途徑之中 過去的研究發現,WOX1 蛋白質在 Tyr33 位置上的磷酸化對於其在細胞中的功能極 為重要。我們想要去探討在 MTX 刺激之下,是否會促使 WOX1 蛋白質磷酸化。從 實驗中得知,在施予 10 µg/ml MTX 後 12 及 24 小時,SCC-15 細胞中 WOX1 蛋白
質在 Tyr33 以及 Tyr61 的磷酸化現象有明顯的增加,但此現象在 SCC-9 中無法觀察 到 (Figure 11)。為了進一步的去證實 WOX1 的磷酸化在 MTX 誘發細胞凋亡中的重 要性,因此我們外送入一個 WOX1 dominant negative 的質體,此質體在第 28 以及 29 個胺基酸的位置上做了變異,使得表現出之 WOX1 無法在 Tyr33 的位置上產生 磷酸化。我們利用這個質體送入感受度較高之 SCC-15 去觀察是否會影響到其對 MTX 之敏感性。結果顯示表現 WOX1 dominant negative 的 SCC-15 細胞死亡的現象 與控制組相較之下明顯降低許多 (Figure 12),表示 WOX1 蛋白質在 Tyr33 位置上的 磷酸化對於其在 MTX 誘發細胞凋亡中的功能有重要的影響。
討
論
SCC-9 對於 MTX 的耐受性
因為癌細胞內的基因體不穩定 (genetic instability),常有基因突變的產生,所以在化學 治療上會發現有些癌細胞對藥物具有耐受性。根據目前針對 MTX 耐受性方面的研究, 可以整理歸納出幾點原因 (Genestier et al., 2000; Zhao and Goldman, 2003):
1. MTX 需經由細胞膜上 transportor 以主動運輸的方式進入細胞,因此 MTX transport system 的變化也會影響到藥物的治療效果。 2. MTX 會和 DHFR 結合,進而影響 DHFR 合成 folate 的能力,因此 MTX 和其 作用之酵素的親和性 (affinity) 也會影響到其效果。 3. MTX 作用之酵素在細胞內的表現量。 4. 因為 MTX 在細胞內須轉換為 polyglutamated methotrexate 才具有作用,因此與 細胞內轉換代謝 MTX 的能力,以及與 MTX 代謝相關之酵素的表現量有所關 聯。 5. 若干 transport mechanism 會促使 MTX 被送出細胞外,因此無法產生作用。 但在本論文的實驗中,我們觀察到 SCC-9 細胞在施予 MTX 之後,細胞雖不會凋 亡,但是細胞內若干蛋白質的表現量卻隨著刺激的時間而有改變的趨勢,這些結果顯 示 MTX 確實有進入細胞內,並且細胞也因為 MTX 的作用而產生了對應的變化。因為 MTX 主要是影響細胞內 folate 的合成,而這樣的變化或許可以推測,SCC-9 可能藉由 某些機制維持細胞內的作用,而補足了 folate 的需求量,因此可以抵禦由 MTX 所造成 的損害。 MTX 誘導細胞凋亡與 WOX1 表現的關係 從我們的研究中證實,WOX1 蛋白質的表現以及其磷酸化的狀態,確實與 MTX 誘導 細胞凋亡的作用有所關聯。WOX1 在 SCC-9 細胞中的蛋白質表現量與磷酸化程度較 低,或許就是造成 SCC-9 細胞不易受到 MTX 的影響而進行細胞凋亡的原因之ㄧ。基
因表現程度受到影響的原因有許多,從以前的研究得知,若干癌細胞發展出一些策略 以逃避走向凋亡。癌細胞促進存活之機制可能是去抑制一些促凋亡蛋白質 (proapoptotic proteins) 的表現,利如:基因啟動子高度甲基化 (hypermethylation) 或是蛋白質高度泛 素化 (hyperubiquitination)。基因的啟動子 (promoter) 上若是被高度地甲基化,會影響酵 素的辨識,因此阻礙了基因的表現 (Wilson et al., 2007)。蛋白質若是在經過 K48 polyubiquitination 後即會被送入蛋白酶體 (proteasome) 中分解,經由這個蛋白質後修飾 (post-translational modification) 的過程即無法執行其功能。 在本研究中,我們發現對 MTX 感受度較高的 SCC-15 細胞在受到 MTX 刺激時, WOX1 mRNA 以及蛋白質的表現都有顯著增加,而在 SCC-9 細胞中卻無法見到此現 象。在以往的研究中也發現,與正常的細胞相較之下,較惡性的癌細胞中 WOX1 的表 現量較低,也可能是表現出不正常的轉錄物,導致無法轉譯出正常之 WOX1 蛋白質。 因此,我們推測可能由於以上幾點因素而造成了 SCC-9 細胞中 WOX1 的蛋白質表現沒 有產生變化,而確切原因有待進一步的查證。
總結
綜合我們的研究發現,在 MTX 的處理之後,SCC-15 和 SCC-4 細胞會走向凋亡,而且 會透過 caspase-9 以及 casapas-3 的活化。若是進一步在 SCC-9 細胞中過量表現 WOX1 蛋白質,或是利用 siRNA 降低 SCC-15 細胞中 WOX1 蛋白質表現,我們的實驗也已經 確認 WOX1 的確參與在 MTX 所誘導的細胞凋亡途徑。這些研究成果將對癌症化學治 療的成效提供重要訊息,也可以應用在未來的治療策略上。參考文獻
Aqeilan RI, Donati V, Palamarchuk A, Trapasso F, Kaou M, Pekarsky Y et al (2005). WW domain-containing proteins, WWOX and YAP, compete for interaction with ErbB-4 and modulate its transcriptional function. Cancer Res 65: 6764-72.
Aqeilan RI, Kuroki T, Pekarsky Y, Albagha O, Trapasso F, Baffa R et al (2004a). Loss of WWOX expression in gastric carcinoma. Clin Cancer Res 10: 3053-8.
Aqeilan RI, Palamarchuk A, Weigel RJ, Herrero JJ, Pekarsky Y, Croce CM (2004b). Physical and functional interactions between the Wwox tumor suppressor protein and the AP-2gamma transcription factor. Cancer Res 64: 8256-61.
Aqeilan RI, Pekarsky Y, Herrero JJ, Palamarchuk A, Letofsky J, Druck T et al (2004c). Functional association between Wwox tumor suppressor protein and p73, a p53 homolog.
Proc Natl Acad Sci U S A 101: 4401-6.
Aqeilan RI, Trapasso F, Hussain S, Costinean S, Marshall D, Pekarsky Y et al (2007). Targeted deletion of Wwox reveals a tumor suppressor function. Proc Natl Acad Sci U S A 104: 3949-54.
Bednarek AK, Laflin KJ, Daniel RL, Liao Q, Hawkins KA, Aldaz CM (2000). WWOX, a novel WW domain-containing protein mapping to human chromosome 16q23.3-24.1, a region frequently affected in breast cancer. Cancer Res 60: 2140-5.
Cantor JP, Iliopoulos D, Rao AS, Druck T, Semba S, Han SY et al (2007). Epigenetic modulation of endogenous tumor suppressor expression in lung cancer xenografts suppresses tumorigenicity. Int J Cancer 120: 24-31.
Chang NS (2002). A potential role of p53 and WOX1 in mitochondrial apoptosis (review). Int
J Mol Med 9: 19-24.
Chang NS, Doherty J, Ensign A (2003a). JNK1 physically interacts with WW domain-containing oxidoreductase (WOX1) and inhibits WOX1-mediated apoptosis. J Biol Chem 278: 9195-202.
Chang NS, Doherty J, Ensign A, Lewis J, Heath J, Schultz L et al (2003b). Molecular mechanisms underlying WOX1 activation during apoptotic and stress responses. Biochem
Pharmacol 66: 1347-54.
Chang NS, Doherty J, Ensign A, Schultz L, Hsu LJ, Hong Q (2005a). WOX1 is essential for tumor necrosis factor-, UV light-, staurosporine-, and p53-mediated cell death, and its tyrosine 33-phosphorylated form binds and stabilizes serine 46-phosphorylated p53. J Biol
Chem 280: 43100-8.
Chang NS, Hsu LJ, Lin YS, Lai FJ, Sheu HM (2007). WW domain-containing oxidoreductase: a candidate tumor suppressor. Trends Mol Med 13: 12-22.
Chang NS, Pratt N, Heath J, Schultz L, Sleve D, Carey GB et al (2001). Hyaluronidase induction of a WW domain-containing oxidoreductase that enhances tumor necrosis factor cytotoxicity. J Biol Chem 276: 3361-70.
Chang NS, Schultz L, Hsu LJ, Lewis J, Su M, Sze CI (2005b). 17beta-Estradiol upregulates and activates WOX1/WWOXv1 and WOX2/WWOXv2 in vitro: potential role in cancerous progression of breast and prostate to a premetastatic state in vivo. Oncogene 24: 714-23. Chen ST, Chuang JI, Cheng CL, Hsu LJ, Chang NS (2005). Light-induced retinal damage involves tyrosine 33 phosphorylation, mitochondrial and nuclear translocation of WW domain-containing oxidoreductase in vivo. Neuroscience 130: 397-407.
Donati V, Fontanini G, Dell'Omodarme M, Prati MC, Nuti S, Lucchi M et al (2007). WWOX expression in different histologic types and subtypes of non-small cell lung cancer. Clin
Cancer Res 13: 884-91.
Fabbri M, Iliopoulos D, Trapasso F, Aqeilan RI, Cimmino A, Zanesi N et al (2005). WWOX gene restoration prevents lung cancer growth in vitro and in vivo. Proc Natl Acad Sci U S A
102: 15611-6.
Finnis M, Dayan S, Hobson L, Chenevix-Trench G, Friend K, Ried K et al (2005). Common chromosomal fragile site FRA16D mutation in cancer cells. Hum Mol Genet 14: 1341-9. Genestier L, Paillot R, Quemeneur L, Izeradjene K, Revillard JP (2000). Mechanisms of action of methotrexate. Immunopharmacology 47: 247-57.
Guler G, Uner A, Guler N, Han SY, Iliopoulos D, Hauck WW et al (2004). The fragile genes
FHIT and WWOX are inactivated coordinately in invasive breast carcinoma. Cancer 100:
1605-14.
Kuroki T, Yendamuri S, Trapasso F, Matsuyama A, Aqeilan RI, Alder H et al (2004). The tumor suppressor gene WWOX at FRA16D is involved in pancreatic carcinogenesis. Clin
Cancer Res 10: 2459-65.
Lai FJ, Cheng CL, Chen ST, Wu CH, Hsu LJ, Lee JY et al (2005). WOX1 is essential for UVB irradiation-induced apoptosis and down-regulated via translational blockade in UVB-induced cutaneous squamous cell carcinoma in vivo. Clin Cancer Res 11: 5769-77.
Lokeshwar VB, Cerwinka WH, Isoyama T, Lokeshwar BL (2005). HYAL1 hyaluronidase in prostate cancer: a tumor promoter and suppressor. Cancer Res 65: 7782-9.
Mahajan NP, Whang YE, Mohler JL, Earp HS (2005). Activated tyrosine kinase Ack1 promotes prostate tumorigenesis: role of Ack1 in polyubiquitination of tumor suppressor Wwox. Cancer Res 65: 10514-23.
Nunez MI, Ludes-Meyers J, Aldaz CM (2006). WWOX protein expression in normal human tissues. J Mol Histol 37: 115-25.
Oppermann UC, Filling C, Jornvall H (2001). Forms and functions of human SDR enzymes.
Paige AJ, Taylor KJ, Taylor C, Hillier SG, Farrington S, Scott D et al (2001). WWOX: a candidate tumor suppressor gene involved in multiple tumor types. Proc Natl Acad Sci U S A
98: 11417-22.
Pimenta FJ, Gomes DA, Perdigao PF, Barbosa AA, Romano-Silva MA, Gomez MV et al (2006). Characterization of the tumor suppressor gene WWOX in primary human oral squamous cell carcinomas. Int J Cancer 118: 1154-8.
Qin HR, Iliopoulos D, Semba S, Fabbri M, Druck T, Volinia S et al (2006). A role for the
WWOX gene in prostate cancer. Cancer Res 66: 6477-81.
Ried K, Finnis M, Hobson L, Mangelsdorf M, Dayan S, Nancarrow JK et al (2000). Common chromosomal fragile site FRA16D sequence: identification of the FOR gene spanning FRA16D and homozygous deletions and translocation breakpoints in cancer cells. Hum Mol
Genet 9: 1651-63.
Sheen MC, Sheu HM, Lai FJ, Lin SD, Wu CF, Wang YW et al (2004). A huge verrucous carcinoma of the lower lip treated with intra-arterial infusion of methotrexate. Br J Dermatol
151: 727-9.
Sze CI, Su M, Pugazhenthi S, Jambal P, Hsu LJ, Heath J et al (2004). Down-regulation of WW domain-containing oxidoreductase induces Tau phosphorylation in vitro. A potential role in Alzheimer's disease. J Biol Chem 279: 30498-506.
Wilson AS, Power BE, Molloy PL (2007). DNA hypomethylation and human diseases.
Biochim Biophys Acta 1775: 138-62.
Figure 1. (A) The structure of WOX1 family proteins. (B) Actions of WOX1 (Chang et al., 2007).
Figure 2. MTX treatment induces cell death in SCC-4 and SCC-15, but not SCC-9 cells.
SCC-4 (A), -9 (B) and -15 (C) cells were seeded on 96-well cell culture plates and treated with various doses of MTX for 48 and 72 hr. The percentages of cell death were determined by crystal violet staining. (D) The expression of endogenous WOX1 in SCC-4, -9 and -15 cells was determined by Western blotting.
Figure 3. MTX treatment induces cells death in SCC-15, but not SCC-9 cells. SCC-9
and SCC-15 cells were treated with 10 µg/ml MTX and cultured for 48, 72 and 96 hr. The cell morphology was examined under a microscope (200X).
Figure 4. MTX treatment induces nuclear condensation and fragmentation in SCC-15 but not SCC-9 cells. SCC-9 and SCC-15 cells were treated with or without 10 µg/ml MTX
for 72 and 96 hr. After fixation, the cell nuclei were stained by DAPI, and visualized using a fluorescence microscope.
Figure 5. MTX induces PS exposure on the surface of SCC-15 cells. SCC-9 and SCC-15
cells were treated with or without 10 µg/ml MTX for 72 hr. The binding of Annexin V-FITC to PS on the cell surface was examined under a fluorescence microscope.
Figure 6. MTX treatment upregulates WOX1 protein levels in SCC-4 and SCC-15, but not SCC-9 cells. SCC-4, -9 and -15 cells were treated with various doses of MTX for 72 hr,
Figure 7. MTX treatment induces WOX1 protein upregulation accompanied by caspase-9 and -3 activation in SCC-15 cells. SCC-15 cells were treated with 10 µg/ml
MTX and cultured for 24, 48 and 72 hr. WOX1 protein levels and the cleavage of caspase-9 and -3 were determined by Western blotting.
Figure 8. MTX treatment upregulates WOX1 mRNA expression in SCC-15 cells. SCC-9
and SCC-15 cells were treated with 10 µg/ml MTX and cultured for various time intervals. The expression levels of WOX1 mRNA were determined by RT-PCR.
Figure 9. MTX-induced cell death is suppressed in SCC-15 cells expressing WOX1 siRNA. SCC-15 cells were electroporated with an siRNA construct targeting WOX1
(WOX1si) or a control plasmid. The transfected cells were sorted and seeded on 96-well cell culture plate. Cells were treated with 10 µg/ml MTX and cultured for 72 and 96 hr. The percentages of cell death were determined by crystal violet staining.
Figure 10. Ectopic overexpression of WOX1 in SCC-9 cells increases MTX-induced death. SCC-9 cells were electroprated with hWOX1-pEGFPC1 or a control vector. After
incubating for 24 hr, the SCC-9 cells expressing green fluorescence proteins were sorted and cultured on 96-well cell culture plate with or without the treatment of 10 µg/ml MTX. The percentages of cell death were determined using crystal violet staining.
Figure 11. Protein phosphorylation of WOX1 at Tyr33 and Tyr61 is induced by MTX in SCC-15, but not SCC-9. SCC-9 and SCC-15 cells were treated with 10 µg/ml MTX for
various time interval. WOX1 protein phosphorylation at Tyr33 and Tyr61 was determined by Western blotting.
Figure 12. Dominant-negative WOX1 suppresses MTX-induced death in SCC-15 cells.
SCC15 cells were electroporated with WOX1(K28T/D29V)-pEGFPC1, hWOX1-pEGFPC1, control vector or a buffer control. After transfection, the cells were cultured for 24 hr and then sorted by a FACSAria cell sorter. The sorted cells were seeded on 96-well cell culture plates and treated with or without 10 µg/ml MTX for 96 hr. The percentages of cell death were determined by crystal violet staining.
Figure 13. MTX treatment suppresses LC3 expression and autophagosome formation in SCC-15 cells. (A) Where indicated, SCC-9 and SCC-15 cells were treated with 10 µg/ml
MTX. Caspase-3 activation and LC3 protein expression were determined by Western blotting. (B) SCC-15 cells were electroporated with LC3-pEGFPC1 or a control vector. After 24 hr, the transfected cells were treated with or without 10 µg/ml MTX for 48 hr. The expression of GFP-LC3 fusion protein was examined using a fluorescence microscope. The cells with GFP-LC3 puctate were considered to have accumulated autophagosomes.