蛋白質溶液的結晶化行為與形態學觀察 Crystallization and Morphology of protein solution
陳詵佳、周哲民、洪伯達* 國立台灣科技大學 高分子工程系
E-mail: poda@mail.ntust.edu.tw
Abstract
In this study, we investigated temperature effect for aggregation behavior and morphology in protein solution which fixed salt concentration (3wt% NaCl) and buffer solution concentration (0.1M NaAc) at pH4.5. Using cloud point determination, the phase boundaries (binodal) for metastable liquid-liquid phase separation in supersaturated lysozyme solution. The L-L phase separation region was examined by real-time small-angle light scattering (RTSALS)、 ball falling method 、 light microscopy 、 scanning electron microscopy (SEM). Microscopic observation a unusual type of globe-shaped microcrystals at 10℃ and forming conglobation microstructure at 6.5℃.
RTSALS results show that the scattering pattern exhibits a scattering ring growth at middle period, qmax not shift at 10
℃ and on the other hand qmax changed with time at 6.5℃.
Finally, we create aggregation model to describe this system in the future.
摘要
探討在固定濃度(3wt% NaCl)與緩衝液(0.1M NaAc,pH= 4.5)溶液下,溶菌酶(lysozyme)在不同溫 度聚集體的形態差異與其聚集行為。我們使用曇點建立 過飽和溶液下的相圖。在液液相分離區域由光學和電子 顯微鏡觀察到在 10℃不同於一般單晶形態的球狀結晶 和 6.5℃下由許多小球聚集形成的球狀體。在 RTSALS 方面,10℃在持溫一段時間後出現了一散射環,環的位 子不隨時間改變,暗示著新的結構生成。在 6.5℃方面,
散射環出現後隨著時間往 low q 移動,意謂著結構尺寸 不斷隨時間改變。後續,我們將詴著串連顯微鏡觀察到 的形態與 SALS 提供的動力學訊息,建立蛋白質溶液的 聚集過程模型。
介紹
蛋白質是人體上重要的組成元素,是構成細胞的基 本單位。溶菌酶(lysozyme)屬於球形蛋白質,在水溶 液中因為胜肽鏈具有親、疏水基會傾向折疊成相對緊密 的結構。研究蛋白質聚集的過程中,可以藉由調整 pH1、 加入鹽類2或降低電荷密度來改變系統環境,即讓短程 吸引力優勢地主導系統的聚集行為,導致系統產生相分 離3,或進而形成結晶4。如果短程吸引力夠大,可能導 致一不可逆聚集行為5,當蛋白質透過熱運動而接觸撞 擊後,因為吸引力大於排斥力使得彼此無法再分離,最 終系統結構可能形成非平衡的凝膠。在近年 W.C.K Poon6一系列針對球形蛋白質的研究顯示,可藉由調整 短程作用力(short-rang attraction)控制群簇(clusters)
的結構。並將膠體系統的硬球模型成功地套用在蛋白質 上,建立球形蛋白質相圖7。
若 把 每 一 條 蛋 白 質 分 子 鏈 都 是 單 一 個 粒 子
(particle),在 SAXS 和 SANS8的研究結果顯示蛋白質傾 向形成巨大的群簇(cluster),有兩個散射峰分別對應 到 cluster 內部和 cluster-cluster 之間的相關性。巨觀結 構上,蛋白質溶液受溫度影響液液相分離所引起的結構 形態,例如形成液滴(drop)、網絡結構(network)、凝 膠(gel)結構3或非平衡結構(Jammed state)9。由群簇 形成巨觀結構,這其中的聚集行為,目前尚未有一明確 定論。在 2008 年 Weitz10所提出關於吸引力球體為非渝 滲現象的凝膠化過程,可以提供我們對於聚集行為另一 個的思考方向。
在本研究室 2007 年「蛋白質溶液聚集行為之研究」
11中,由小角光散射數據分析後,蛋白質聚集行為不適 合用相分離動力學來描述,系統傾向利用分形聚集來形 成最終結構(solid-like gel)。本文將著重在溫度對聚集 形態與行為的影響,繼續深入瞭解蛋白質溶液系統。
實驗
本 實 驗 中 所 使 用 的 蛋 白 質 為 雞 蛋 白 溶 菌 酶
(lysozyme)屬於生醫藥用藥等級,購於美國 Sigma 公 司(L7651,經過三次純化),由 129 個胺基酸殘基、四 個雙硫鍵組成,半徑約為 1.7nm 的球形蛋白質,重量平 均分子為 14.4kDa。由美國 Aldrich 購得醋酸鈉(NaAc 36.5~38%,分生等級)和氯化鈉(NaCl ,Mw 58.44),調 配成 pH =4.5、3wt% NaCl、0.1M NaAc 緩衝水溶液。
為了去除未溶的蛋白質及雜質,在混合後一分鐘內使用 0.22m 過濾膜(Millipor Millex-GV filter)過濾後,立 即進行實驗。由於混合溶液處於過飽和狀態,經過一段 時間會有蛋白質結晶析出,每次實驗的溶液皆當場配製 並使用 UV-Vis 進行濃度標定。當欲配置溶液濃度高於 150mg/mL,先使用離心濃縮機濃縮後再由 UV-Vis 進行 濃度標定。溶菌酶吸光係數為 2.64g-1cm-1mL(20℃)12。
在不同溫度下蛋白質的聚集體形態分別使用光學 顯微鏡(Leica DMLP)提供 10 倍目鏡與 4 倍、20 倍、
50 倍物鏡擷取像差、偏光下的影像,搭配溫控裝置
(Linkam THMS 600)及 CCD(TK-C1380)拍攝升降 溫過程中隨時間形態上的變化,以及 SEM(HITACH 公司 S-3000N)拍攝特定溫度下最終形態的微觀結構。
再加上 real-time 小角光散射來呈現材料結構動態形成 過程的。Real-time 小角光散射由本研究室所架設,使 用光源為 10mW He-Ne 雷射,波長 632nm,角度範圍 為 0.83~22。,相當於散射向量 q=0.19~5.08(m-1),對應 實 際 尺 寸 為 1.24~33m。 在 本 文 內 所 呈 現 皆 為 Vv pattern。
相圖由本研究室自行組裝的曇點測量儀偵測濁度 隨溫度的變化,繪製出實驗 binodal 曲線。並藉由落球 法瞭解溫度變化對結構的影響,得到固-液轉移曲線。
並初步劃分出五個不同聚集形態的區域。
結果與討論
在先前研究裡,我們已知誘發蛋白質的聚集行為原 因相當多,如 pH 值、離子濃度、溫度、蛋白質濃度或 緩衝液種類都會影響蛋白質的聚集行為。本研究在固定 緩衝液、鹽類濃度、蛋白質濃度條件下,探討溫度變化 對蛋白質聚集形態與形成過程的影響。由先前研究報告 得知,在飽和溶解度以下的蛋白質聚集結構包含了不同 晶格的單晶13,在低溫下產生相分離與凝膠化等聚集行 為。隨著時間,聚集體無法維持原本的形貌而形成沈澱
6。顯示了在飽和溶解度下蛋白質溶液的複雜與多樣 性。
物理凝膠的形成一般是透過物理鍵作用力、一階相 轉變或分子鏈糾纏所引起。凝膠是溶劑充滿分子鏈間構 成三維網狀結構,並由無限的群簇(clusters)組成。其 最大的特點就是具有熱可逆性。在本系統中,低溫下,
蛋白質聚集成白色固體(solid-like gel),隨著溫度變化具 有可逆性,但低溫下的固體結構並非穩定的最終結構。
對於蛋白質聚集行為是否可以用典型物理凝膠化過程 的理論來描述?如何建立蛋白質聚集過程的模型?將 是本研究欲瞭解的方向。
大部份通常透過熱力學與形態學(morphology)的 研究,來推測可能的凝膠化模型。因此我們首先需建立 熱力學平衡相圖與實驗相圖。
在蛋白質溶液中,由於電解質溶液與鹽類的關係,
導致溶菌酶溶液的飽和溶解度下降。這是源自於鹽類在 溶液中解離出正負離子,使原本蛋白質表面正電荷造成 庫倫排斥力使蛋白質在系統中穩定懸浮而不會產聚集 的情況,受到正負離子的影響而產生遮蔽效應,而開始 進行聚集。在 Martin 論文裡提供鹽類導致系統在不同 溫度區間產生豐富的相行為,並利用下式14
Tcloud = Tcrit 1 − A ccritccrit−cp 1/β (1)
這裡 Tcloud 、Tcrit、ccrit、β、cp、A 分別為曇點、臨 界溫度、臨界濃度、臨界指數、蛋白質濃度和可調整參 數。文獻中 Tcloud為已知,調整各項參數去擬合實驗數 據,得知臨界溫度與鹽類濃度有線性關係。借此本研究,
參考文獻建立 binodal 曲線。
在高溫的飽和溶解度曲線,參閱 van’t Hoff equaiton 其平衡常數、溫度變化對相對溫度下的熱焓存在指數關 係
csat = c0exp κTΔH
0 Tsat−T0
T0 (2) 上式 csat、T0分別為飽和濃度與參考溫度,設 csat
=c0 (298K)。在 Fig.1 中實線與虛線分別由式子(1)和(2)
所得,參數皆為文獻值14。另外上下兩條折點線為實驗 點。
在 Fig.1 固定鹽類濃度與緩衝液的相圖中,我們以 實驗點和模擬曲線初步劃分出五個區域。圖表中綠、紫 和藍色的圓點分別表示不同濃度的變性溫度、相分離溫 度區域(紫和藍圓點)皆是由曇點測量儀所得;(Ⅰ)在 高於 70℃時,蛋白質的三級結構瓦解失去活性,並產 生不可逆聚集形成白色固體15;(Ⅱ)高於溶解度曲線,
屬於未飽和溶液的穩定區域,蛋白質在此區域不會形成 結晶或不可逆的聚集行為,呈現均勻透明溶液狀態;(Ⅲ)
低於溶解度曲線,系統處於過飽和不穩定狀態進而產生
結晶的液固共存區,且由文獻得知在更低溫度區域呈現 液液相分離與凝膠化等更複雜行為。
本研究室 2007 年論文11指出蛋白質溶液隨溫度下降,
穿透光強度會有兩階段不同斜率的下降。第一段開始緩 慢下降的轉折點定為曇點(TC1),為系統產生液液相分 離所造成。第二段穿透光強度快速衰減至零,顯示系統 形成某種形態結構,導致大量的散射而使穿透光強為零。
此溫度(TC2)下流體轉變為白色固體(solid-like gel)。由 實驗數據,分別將穿透光強兩階段下降的轉折溫度劃分 成(Ⅳ)和(Ⅴ)。其中第二段液固轉變溫度,與理論模 擬曇點(實線)曲線相近,而非與利用曇點所獲得的臨 界區(第一段轉折溫物)吻合,這是相當明顯地落差。
在系統處於過飽和的情況下,結晶和聚集行為相互競爭,
因此使用在熱力學平衡態下的平均場理論或經典相分 離來描述蛋白質系統相行為並不適合,因為當系統處於 兩種動力學過程競爭下,本身就不屬於平衡態。
蛋白質的變性與單晶已有許多學者提相關研究報 告。後續,我們將針對(Ⅳ)和(Ⅴ)溫度範圍內所形成 的聚集結構作敘述及討論。
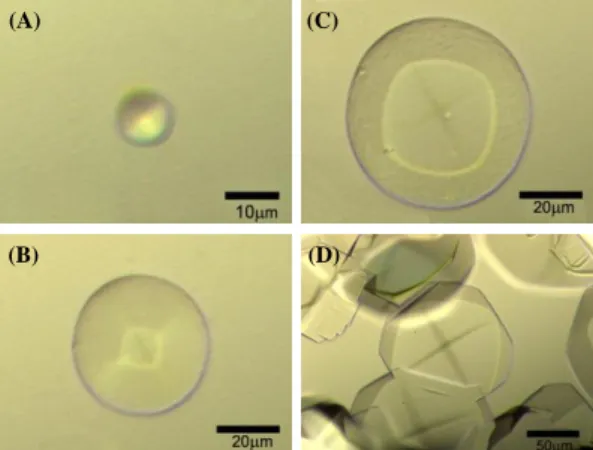
Fig.2 為 150mg/mL 溶菌酶溶液,在不同溫度等溫後,
所呈現的各種的單晶形態,根據文獻15在 NaCl 與 NaAc 的混合溶液裡有兩種形態單晶,四方晶系(tetragonal,
20~40℃,Fig. 2D)和正交晶系(othorhombic,50~60℃,
Fig.2B)。tetragonal 單晶的瓦解溫度約在 47~50℃,而 othorhombic 單晶升溫至 60℃以上並不會溶解,直到超 過變性溫度後直接裂解。顯示只有在結晶未形成之前的 有限時間之內(Ⅱ)是暫時穩定均勻溶液區域,也意謂著 蛋白質溶液系統的多變性。
在各種溫度下的單晶形態中,我們注意到在 10℃
時,形成的球狀單晶(Fig.2F)不同於一般 teteagonal 單晶 形態。Fig.3 顯示在 10℃隨時間球狀單晶的成長過程,
初期在溶液中同時形成許多小滴(drops)。隨著時間小 滴會慢慢成長成較大球狀體,並中心出現黑十字,顯示 內部為有序結構。約 85min 後,轉變成一般 tetagonal 單晶形態。在 W. Saenger5的論文中提到這些只受溫度 影響而產生多樣貌的結構,可以歸因於溫度擾動引起的 空間漲落變化。文中舉 Takizawa 關於溫度影響溶菌酶 多結晶型態著名的實驗,在特定溫度範圍內溶菌酶結晶 可以由 tetragonal 轉變成 orthorhombic 晶系。來說明 溫度對於蛋白質聚集結構的影響,但並沒有詳細對於聚 集行為動力學過程的描述。
當溫度再稍微降低到 6℃(Fig.1,G),系統產生明 顯的變化,由流體轉變成白色固體(solid-like gel)。利用 落球法獲得液固轉移曲線,由表徵結構機械強度的落球 法來觀察蛋白質溶液巨觀聚集結構瓦解現象。在毛細管 中注入等量的溶液,並放入鋯球(ρ>5.95g/cm3),逐步 調整溫度並倒置毛細管觀察鋯球移動的情形,當鋯球固 定在毛細管底端無法落下時,認定該溫度下結構為固體。
如 Fig.5 所示,由左到右,蛋白質溶液濃度分別為 0(純 緩衝液)、100 和 150mg/mL。在 4℃時,純緩衝溶液呈 現透明,鋯球可以自由移動;100mg/mL 為白霧色溶液,
鋯球可移動;150mg/mL 為乳白色固體,鋯球被定住在毛 細管底端倒置也無法落下。在本實驗中先將溶液降至低 溫形成白色固體,但緩衝溶液未結冰-10℃後,開始升 溫(1℃/min)至溶液恢復透明。當鋯球開始移動的溫度,
訂為固液轉變溫度(Fig.1,◇)。落球法得到的固液轉 變溫度與曇點得到第二段轉折溫度(TC2)幾乎重疊。
之前的研究11,在 TC2觀察到蛋白質溶液呈現 “似”
雙連續相的結構。進一步提高解析度後,我們之前看到
的“似”雙連續相其實是由許多液滴(drop)所組成的
(Fig.4A)。而且由落球法得知 TC2溫度以下會轉變成固 體,因此在稍略低於 TC2的溫度得到蛋白質白色固體後,
急驟到-196℃凍結結構,進行冷凍乾燥製備 SEM 所需 樣本。
SEM 使用的倍率為 10000 倍,由 Fig. 4B 可觀察到 約 2m 大小的球內是由許多小球(globule)所聚集而 成的。2m 大小的球與在像差顯微鏡觀察到液滴(drop)
大小相近。因此推論在低溫時,蛋白質溶液系統會先由 小球聚集成較大約 2m 的球體(conglobation),球體再 相互堆積形成巨觀上的白色固體。這樣的推論是否合理 呢?接下來我們藉由小角光散射技術來企圖瞭解結構 形成的動態聚集過程。
散射技術可以呈現材料結構的特徵,不論是在體整
(特徵尺寸、形狀因子等)或是界面相的微細結構。而 本研究室所架設的 real-time 小角光散射(RTSALS),
更可以對材料結構形成的過程進行解析,瞭解結構演變 與時間的關係。。
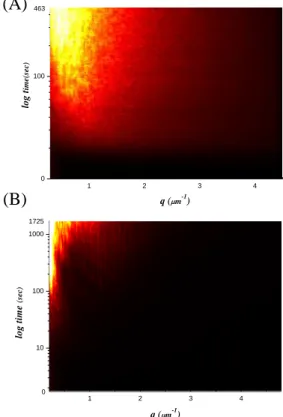
Fig.1 中 G(6.5℃)和 F(10℃)兩個溫度點,微小的溫 度差距,顯示完全不同的聚集形態。在 6.5℃下 RTSALS 會得到類似 spinodal ring 的散射圖案(Fig.6A)。系統 約在 30sec 左右 high q 的部份出現散射環,而且隨時間 不斷地往 low q 移動、強度持續上升,最終散射環會縮 小進入 beam stop 中。而 10℃略高於 TC2,對應於曇點 TC1和 TC2之間,為結晶化和液液相分離共存的區域。
在初期約 180sec,接近 q = 0 處強度開始慢慢增加,此 時強度增加可能來自於數量上的增加,散射體之間無相 關性。隨時間到 300sec 左右,high q 處強度產生一散 射環(Fig.6B),表示在原先的結構中產生了新的相關性。
這是否反映了在 Fig.3 中觀察到球狀結晶內部的結構生 成呢?由 Fig. 7 Intensity Map 可以更清楚的看出各散 射向量 q 上,時間與強度的變化。
如何透過 scaling-law 來分析小角光散射所提供結 構演化上的訊息,並與宏觀的聚集體形態作串連將是本 研究後續欲瞭解的方向。
參考文獻
1 C. Elizabeth; L.P. Macr, J. Crystal Growth, 114, 286 (1991)
2 L. F. Filobelo; O. Galkin; P. G. Vekilov, J. Chem. Phys., 123,014904(2005)
3 H. Tanaka; Y. Nishilawa, Phys. Rev. Lett., 95,078103 (2005)
4 G. V. Peter, Crystal Growth & Design, 4,671(2004)
5 P. Umbach; Y. Georgails ;D.M. Soumpasis; W. Sanger , J. Am. Chem. Soc., 120, 5539(1998)
6 A. Stradner; H. Sedgwick; F. Cardinaux; W.C.K. Poon;
S. U. Egelheaaf; P. Schurtenberger, Nature,432, 492 (2004)
7 W.C.K. Poon, Phys. Rev. E, 55,3762(1997)
8 A. Strader; F. Cardinaux; P. Schurtenberger, J. Chem.
Phys. B, 110, 21222(2006)
9 J. N. Wilking; S. M. Graves; C. B. Chang; K. Meleson;
M.Y. Lin; T. G. Mason, Phys. Rev. Lett., 96, 015501 (2006)
10 P. J. Lu; E. Zaccarelli; F. Ciulla ; A. B. Schofield; F.
Sciortino; D. A. Weitz, Nature, 453, 499(2008)
11 Y. K. Wang, “Aggregation behavior in protein solution”
(碩), 2007
12 I. E. Dickerson; I. Geis, “The Structure and Action of Proteins”; Harper and Row: New York, 1969
13 E. Petrova; P. Dold; K. Tsukamoto, J. Crystal Growth, 304, 141(2007)
14M.Muschol; F.Rosenberger, J. Chem. Phys. 107, 1953 (1997)
15E. Cacioppo; M. L. Pusey, J. Crystal Growth, 114, 186(1991)
( I )
( II )
( III )
( IV ) ( V )
○C
○B
○D
○E
○F
○A
○G
○G’
Figure 1. The phase diagram for lysozyme solution with fixed salt concentration(3wt% NaCl) and buffer solution( 0.1M NaAc).(I) Denatureation region for irreversible aggregation in high temperature, (II) Homogenous solution,(III) Liquid-Solid coexistence region (crystallization),(IV) Liquid-Liquid phase separation and crystallization(V) form white soiId-like stage for reversible aggregation in low temperature. Dotted line : fIt to eq. (1), solid lIne :fIt to eq.(2). Two dash dot line : form experiment data.Point A~G’make temperature of sample of used in crystal morphology study.
Figure 3. Photomicrogeaphs of morphology obtained in sample F in Fig.1.The glode-shaped crystals growing process with time (1)-(4) .Conditions are 150mg/dL lysozyme incubated with 3wt% NaCl in NaAc pH 4.5 ,at 283K.The times records are 4, 16, 39, 85min form (1)-(4).
(C)
(B) (D)
(A)
Figure 4. The phase contrast microscope and SEM images obtained in sample G’in Fig.1 of lysozyme solution at 100mg/mL at 277K.
(A) (B)
Figure 5. The ball falled method obtained solid-fluid transation curve in sample G and G’in Fig. 1 (◇,c= 0,100 and 150 mg/mL from left to right) at 277K.
Figure 2. The fixed protein concentration correspond to different temperature of morphology in sample (A)~(F) in Fig. 1. (A) h o m o g u e n o u s s o l u t i o n a b o v e s o l u t I l i t y c u r v e , ( B ) t h e orthorhombic crystals in 320K,(C)~(E) the tetragonal crystals group in 313K, 303K, 293K, respective.(F) the globe-shaped lysozyme ctystals.
(A)
(B)
(D)
(F) (E)
(C)
(A)
(B)
Figure6. Scattering patterns for lysozyme solution at differ- ent temperature (A) 279.5K at 58sec,(B) 283K at 640s ,re- spectively. Condition are 150mg/mL lysozyme incubated with 3% NaCl in 0.1M NaAc, pH=4.5.The scattering vector , q, in the range between 0.19 ~ 5.08 mm-1 .
(A)
(B)
1 2 3 4
0 100
q (mm-1)
log time(sec)
463
1 2 3 4
10 100 1000
log time(sec)
q (mm-1)
1725
0
Figure 7 . Intenstity map for different temperature. (A) 279.5K, (B)283K.The verical direction means log time 0~463s and 0~1725s,respectively.