行政院國家科學委員會專題研究計畫 成果報告
新型連續光熱化學骨牌反應研究 研究成果報告(精簡版)
計 畫 類 別 : 個別型
計 畫 編 號 : NSC 100-2113-M-011-003-
執 行 期 間 : 100 年 08 月 01 日至 101 年 07 月 31 日 執 行 單 位 : 國立臺灣科技大學化學工程系
計 畫 主 持 人 : 何郡軒
計畫參與人員: 碩士班研究生-兼任助理人員:李雅雯 碩士班研究生-兼任助理人員:丁毅舜 碩士班研究生-兼任助理人員:劉瑋琪 碩士班研究生-兼任助理人員:周俐廷 碩士班研究生-兼任助理人員:張宏賓 碩士班研究生-兼任助理人員:鄧福琳
公 開 資 訊 : 本計畫可公開查詢
中 華 民 國 101 年 10 月 29 日
中 文 摘 要 : 我們成功利用 3-(4-取代基苯乙烯基)呋喃在還原劑中進行光 化學反應,可以得到一系列 2-(取代基萘-2 基)乙醇化合物,
開發出新的光熱連續骨牌反應。反應是經由鹼催化光化學反 應醛基中間體,利用還原劑還原成醇類化合物,同時提高了 此光化學反應的總產率,最高可達 96%。我們也利用同樣的 方式,成功製造出 2-(苯并呋喃-5-基)乙醇及 2-(苯并噻吩- 5-基)乙醇。
中文關鍵詞: 骨牌反應、光化學反應、苯并呋喃、萘。
英 文 摘 要 : A new continuous photochemical and thermal domino reaction, irradiation of 3-(4-substitutedstyryl)- furans with reducing agent to afford 2-
(substitutednaphthan-2-yl)ethanols, has been
successfully developed. The key step of this reaction is a reduction of aldehyde group to alcohol one in the intermediate of base-induced photoreaction. This treatment also increases the total yield of this photoreaction up to 96%. Using this method, we also successfully synthesized 2-(benzofuran-5-yl)ethanol and 2-(thiophen-5-yl)ethanol.
英文關鍵詞: domino reaction, photochemical reaction, styrylfuran, naphthanene.
行政院國家科學委員會補助專題研究計畫 ■成果報告
□期中進度報告
新型連續光熱化學骨牌反應研究
計畫類別:■個別型計畫 □整合型計畫 計畫編號:NSC 100-2113-M-011-003-
執行期間: 100 年 8 月 1 日至 101 年 7 月 31 日 執行機構及系所:臺灣科技大學化學工程系
計畫主持人:何郡軒 共同主持人:
計畫參與人員:李雅雯、丁毅舜、劉瑋琪、周俐廷、鄧福琳、張宏賓
成果報告類型(依經費核定清單規定繳交):■精簡報告 □完整報告
本計畫除繳交成果報告外,另須繳交以下出國心得報告:
□赴國外出差或研習心得報告
□赴大陸地區出差或研習心得報告
□出席國際學術會議心得報告
□國際合作研究計畫國外研究報告
處理方式:除列管計畫及下列情形者外,得立即公開查詢
□涉及專利或其他智慧財產權,□一年□二年後可公開查詢 中 華 民 國 101 年 10 月 25 日
新型連續光熱化學骨牌反應研究
計畫編號:NSC 100-2113-M-011-003-
執行期限:100 年 8 月 1 日至 101 年 7 月 31 日 主持人:何郡軒 臺灣科技大學 化學工程系
計畫參與人員:李雅雯、丁毅舜、劉瑋琪、周俐廷、鄧福琳、張宏賓
一、前言:
「骨牌反應」1即是反應由起始物轉變為複雜產物,中間經歷多個反應步驟,但卻不需分離純化中 間化合物而可直接得到其產物。這種反應不但可省去繁瑣的純化分離步驟,且非常符合工業化大量製 造所需的經濟、快速及方便的要求,因此成是化學反應上希望可研究發展的合成步驟。通常與聯繼反 應或一鍋反應的形態類似。
在光化學反應研究中,常先產生特定的中間體,再反應成產物。這些特定的中間體常具有適合進 行其他反應的活性結構,但因為反應的條件不足,因此無法進行再反應。此時若能以適當的光源、溫 度或試劑,便可誘發反應中間體進行其他的反應。利用這樣的概念很容易可以建立新的連續光熱骨牌 反應,或設計為新的合成反應路徑 (Scheme 1)。
Scheme 1
Establish a New Domino Reaction from the Photochemical Intermediate
近期文獻中還有一些其他光化學起始的骨牌、聯繼及一鍋反應,包括 di--methane rearrangement2、 Photoreaction of carbonyl group with hydrogen abstraction3-5、Wolff rearrangement6,7、photorearrangement of heterocycles8,9、photooxidation10,11。都是在照光反應後產生活性中間體,因而可進行一連串的重排反應 或與另一分子結合,而得到複雜產物。其中我們以一例說明,利用 Photo-Fries 反應發生在苯環上的醯 胺基或酯基,當照光時醯基會由氧或氮原子轉移至鄰近苯環上的碳原子上。利用這種轉移,配合適當 之官能基,就可促使轉移的部分與原本之氧或氮原子再進行反應。例如具有,β-不飽和酯類的萘環12, 在照光時側鏈轉移至鄰近的碳上,可再與原來的氧原子進行加成反應,而得到環化產物(Sheme 2)。
Scheme 2
A New Domino Reaction from the Intermediate of Photo-Fries Reaction
最近我們研究發現了一個新的鹼催化光重排反應
13,反應機構如 Scheme 3 所示。以化合物 3-(4-methylstyryl)furan trans-A 為例,利用 300 nm 的紫外光照射,化合物會進行順反異構化反應 (trnas- cis isomerization) 成為順式的化合物 cis-A,接著再照光可以進行六電子光環化反應 (six-electron photocyclization) 而生成中間體 DHNF。中間體 DHNF 所存在的 C−O鍵因為可與後方的芳香乙烯基共
O O
OH
O
O
O
O
O
hv KOH
Reactant Intermediate Product
New Product hv
hv', temp, or reagent
振而成為好的離去基,因此在鹼性的條件下會進行除去反應 (elimination reaction) 而後到中間體 N1。
接下來由反應溶劑中得到了質子 (protonation) 後所形成的中間體 N2,可以快速進行烯醇與醛的互變 異構化反應(tautomerization)而生成化合物 N3。由於醛基在照光反應中並不穩定,因此會進行 Norrish Type 1 的光化學反應,斷裂 C=O 旁的 C−C鍵而生成照光重排的產物 2,7-dimethylnaphthalene。此光化 學反應可以得到非常獨特的變化,由原本合成菲化合物 (phenantherene) 的照光方法,經由呋喃環 (furan) 的作用,在反應中進行開環 (ring-opening) 及裂片 (fragmentation) 的作用,而得到了萘環化合 物,是一種有效的新的合成方法。
Scheme 3
Proposed Mechanism of Base-Induced Photorearrangement of 3-Styrylfurans.
2009 年學者 Baker 發表
14了一篇利用[2+2]光環化加成反應 ([2+2] photocycloaddition) 合成天然物 骨架 5,4,5-三環結構,如 Scheme 4 所示。作者利用有側鏈的環戊烯酮 C 進行環上及側鏈兩隻雙鍵的[2+2]
光環化加成反應,可以得到化合物 D 為理論產物。但在作者的研究中,並無法理想的得到化合物 D,
原因在於結構中的酮基化合物在紫外光的照射下並不安定,且四環是個能量不穩定的結構,因此當化 合物 D 中的酮基吸收了光能後,便產生了多種不可預期的化學反應,導致反應結果變得雜亂。為了解 決這個問題,作者研究出利用照光反應時同時加入有效之還原劑 LiBH
4,可以在反應產成酮基時立即 進行熱化學反應中的還原反應,使酮基變成醇基生成化合物 E,此時化合物因不吸收光反應所用的紫 外光,因而得到安定且單純的反應結果。在照光反應後生成化合物 E 的產率可以達到 70%以上。
這個例子間接建立了一種新的光熱型骨牌反應類型,光化學反應的部分是[2+2]光環化加成反應,
而熱化學反應就是 LiBH
4還原酮基。
Scheme 4
In-Situ Reduction of Photochemical Intermediate of [2+2] Photocycloaddition.
二、研究目的:
在先前曾提到,我們利用原本合成菲化合物的照光方法,經由呋喃環的替換,經一連串的反應及 中間體,而得到了萘環化合物,是一種有效的新的合成方法(Scheme 5)。而反應可產生一個醛基中間體,
表示我們可以利用前 Baker 的方法,在我們的光反應中建立另一個類子的光熱型骨牌反應。
另外我們的反應存在了產率不佳的問題,例如在苯乙烯基取代基若是烷基類取代基,我們只能得
O
O O
H
O
O HO
trans-A cis-A DHNF N1
N2 B N3
a b c
d
e f
a: trans-cis isomerization, b: six-electron photocyclization, c: base-induced elimination d: protonation, e: tautomerization, f: Norrish-Type 1 photoreaction.
O H
O H
O O
O H
OHH
C D E
hv CH3CN
reducing agent
R1 R2
R3 R4
X O
OHC +
R1 R2
R3
R4 O
X=Cl/Br
1a: R1=R2=R3=H, R4=CH3 1b: R1=CH3, R2=R3=R4=H 1c: R1=CH3, R2=R3=H, R4=CH3 1d: R1=H, R2=CH3, R3=H, R4=CH3 1e: R1=CH3, R2=H, R3=CH3, R4=H 1f: R1=R2=CH3, R3=R4=H
O O
O S
O O
1g 1h 1i
1a-1f Na2CO3(aq)
18-crown-6 CH2Cl2
X=PPh3(Cl/Br)
PPh3 C6H6 reflux
到 50~60 %的照光重排反應。我們認為可能存在的原因有二,第一是 3-呋喃基結構在鹼性條件下並不 安定,第二為化合物 N3 的醛基結構在照光條件下會變化 (Scheme 5)。關於第一個原因,我們已經利 用在非照光條件下維持 50 度反應溫度觀察化合物 A 的穩定度,結果是在 3 小時的時間後,我們只回收 到 60 %化合物 A,這表示此化合物在照光機的環境溫度下並不安定,我們的光化學反應的速率必需與 化合物 A 的熱分解競爭。而參考前述 Baker 的研究,我們認同第二個原因存在的可能性,因為 Norrish Type-1 光反應屬於自由基的反應機構,由於自由基極不安定,有可能進行多種反應而得到不同產物,
因此降低了反應產率。
我們研究的目的是要利用加入還原劑進行照光反應,讓我們所開發出的鹼催化光化學反應所生成 的中間體 N3,可以直接在反應瓶中 (in-situ) 進行還原生成醇,而得到新的一系列化合物 F。這一類的 化合物將不具有光不穩定的醛基,不會因為要進行 Norrish Type 1 反應而產生自由基而致反應變的複 雜。如此將可解決第二個問題。希望可以提升此光重排反應產率至 80 %以上,使其更有效的成為萘的 合成步驟。而以反應形態而言,這也符合在光重排反應後,對不穩定的中間體進行了熱化學中的還原 反應,而開發出新型態的光熱骨牌反應。
Scheme 5
In-Situ Reduction of Photochemical Intermediate of Base-Induced Photorearrangement.
三、結果與討論:
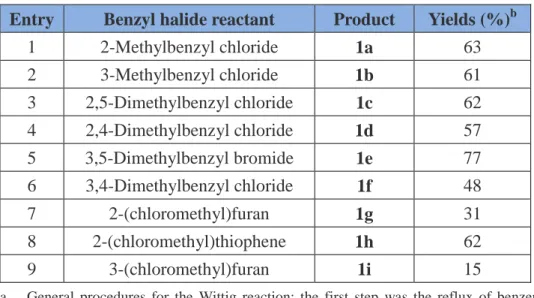
利用適合的芳香甲基鹵化合物,進行典型的 Wittig 反應,可以合成一系列起始物。由於在先前的 研究中,我們發現 3-(4-methylstyryl)furan 有最好的反應效果,因此我們合成化合物 1a-1f 為甲基或雙甲 基取代起始物
15。而另合成化合物 1g-1i 為雜環起始物。其合成步驟及產率如 Table 1 所列,經由兩步 驟的 Wittig 反應所得到的總產率,苯環類化合物 1a-1f 及噻吩化合物 1h 大約介於 40~77%,而呋喃環 的反應結果較差,產率約為 31%以下。
Scheme 6
Syntheses of Starting Materials 1a-1i by the Wittig Reaction.
O
O
trans-A
N3 B
OH
F
Reducing Agent
Table 1
Results of Syntheses of Starting Materials 1a-1i by the Wittig Reaction.
aEntry Benzyl halide reactant Product Yields (%)b
1 2-Methylbenzyl chloride
1a63 2 3-Methylbenzyl chloride
1b61 3 2,5-Dimethylbenzyl chloride
1c62 4 2,4-Dimethylbenzyl chloride
1d57 5 3,5-Dimethylbenzyl bromide
1e77 6 3,4-Dimethylbenzyl chloride
1f48 7 2-(chloromethyl)furan
1g31 8 2-(chloromethyl)thiophene
1h62 9 3-(chloromethyl)furan
1i15
a. General procedures for the Wittig reaction: the first step was the reflux of benzene solution containing benzyl halide reactant and triphenylphosphine and the second step was the reaction of benzyltriphenylphosphonium halide and 3-fural.
b. Total yields of cis and trans products for the 2 steps.
接著我們利用化合物 1d 來進行反應條件的測試。我們選擇了三種類似的還原劑 LiBH
4、NaBH
4、 及 KBH
4進行還原照光反應條件測試。這三個還原劑在反應特性上以 LiBH
4試劑的反應性最為激烈,
反應配置時時有輕微起火的現象。而另外兩個試劑反應效果較為溫和,但還原能力就較差。反應結果 列於 Scheme 7 及 Table 2。最後由於 entry 1 中有最高的還原反應產物,因此我們選擇了以 LiBH
4還原 試劑進行一系列的還原照光反應。
Scheme 7
Testing Photoreaction of 1d with Different Reducing Agents.
Table 2
Results of Photoreaction of 1d with Different Reducing Agents.
aEntry Reactant Reducing Agent
hv Time
Yields of 2d(%)1
1dLiBH
43 hr 59
2
1dNaBH
43 hr 42
3
1dKBH
43 hr 32
a. General procedures for photoreaction: The methanol solution containing 1d, potassium hydroxide, and reducing agent was prepared in a quartz tube sealed with septa and deoxygenated by N2-bubling. Then the solution was irradiated with 300 nm. After working up, determined the isolated yield of 2d by silica gel chromatography.
O
OH + hv
MBH4 CH3OH
1d 2d 3d
M = Li, Na, K
Scheme 8
Photoreaction of 1a−1i with LiBH
4under 300 nm-Irradiation.
Table 3
Results of Photoreaction of 1a−1i with LiBH
4under 300 nm-Irradiation.
aEntry Reactant
hv Time
Conv.(%)
Product (%)
Product (%)
Total Yields (%)
1
1a3 100
2a (29) 3a (38)67
2
1b3 100
2b, 2b' (18) 3b,3b’(43)61
3
1c3 100
2c (44) 3c (42)86
4
1d3 100
2d (59) 3d (37)96
5
1e3 100
2e (44) 3e (31)75
6
1f3 100
2f,2f’(37) 3f,3f’(34)71
7
1g3 100
2g (29) 3g (0)29
8
1h3 100
2h (84) 3h (5)89
9
1i3 100
2i (0) 3i (0)0
a. General procedures for photoreaction: The methanol solution containing 1, potassium hydroxide, and reducing agent was prepared in a quartz tube sealed with septa and deoxygenated by N2-bubling.
Then the solution was irradiated with 300 nm. After working up, determined the isolated yield of 2 and 3 by silica gel chromatography.
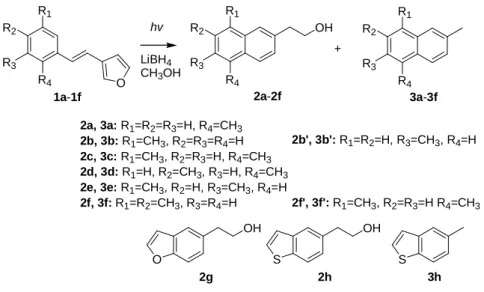
將化合物 1a-1f 分別溶於含有氫氧化鉀的甲醇溶液中,並加入還原劑 LiBH
4後,置於石英試管中以 氮氣除氧,在 300 nm 的波長下照光,所得到之反應結果如 Scheme 8 及 Table 3 所示。苯環類化合物 1a-1f 及噻吩化合物 1h 經照光反應可以得到兩種產物,分別為照光重排並還原醛基的產物 2
16、及照光重排 的產物 3
17。而呋喃化合物 1g 照光後只得到了照光重排並還原醛基的產物 2g,而 1i 照光反應後則是完 全得不到任何產物,且無起始物回收。
在進行矽膠管層析後我們發現,除了化合物 1i 以外,幾乎所有的反應皆可得到還原的產物 2,所 得到的產率差距較大,由 18~84%。而烷基的起始物 1a-1f 皆可生成明顯的光重排產物 3,產率分布較 平均在 31~43%。而噻吩起始物 1h 則會得到 5%的光重排產物 3。這表示當加入強還原劑時,最後於還 原醛基的步驟反應速率無法明顯快過 Norrish Type 1 的光化學反應,因此得到了兩種反應產物。但當我
R1 R2
R3
R4 O
2a, 3a: R1=R2=R3=H, R4=CH3 2b, 3b: R1=CH3, R2=R3=R4=H 2c, 3c: R1=CH3, R2=R3=H, R4=CH3 2d, 3d: R1=H, R2=CH3, R3=H, R4=CH3 2e, 3e: R1=CH3, R2=H, R3=CH3, R4=H 2f, 3f: R1=R2=CH3, R3=R4=H 1a-1f
R1 R2
R3 R4
OH
R1 R2
R3 R4 +
2a-2f 3a-3f
O
OH
S
OH
2g 2h
hv LiBH4 CH3OH
S 3h 2b', 3b': R1=R2=H, R3=CH3, R4=H
2f', 3f': R1=CH3, R2=R3=H R4=CH3
中都有大幅度的提升,總產率介於 61~96%。我們的推論此現象的成因是,相較於先前利用氫氧化鉀的 反應,LiBH
4中所提供之 H
–同時提供作為 Scheme 3 中 DHNF 到 N1 除去反應步驟所需要之鹼。由於鹼 度提高,使後此步反應速率加快,足以超越其他因 3-呋喃基造成分解的旁反應,因此使得光重排反應 的總產率大為提升。
另外在化合物 1b 及 1f 照光反應時,我們會得到兩種甲基取代基位於不同位置的反應產物,原因 是因為當反應進行六電子環化的過程中(Scheme 3, cis-A DHNF)具有兩種反應位向選擇性,因而衍生 出兩種反應的產物,此二產物具有相等之比例。
四、總結:
我們成功的利用 LiBH
4使得我們開發出的新型照光反應的醛基中間體在反應中直接進行還原得到 一系列新的芳香基乙醇的化合物,建立起另一個光熱型骨牌反應的實例。而在此我們也發現,加入的 LiBH
4具有較強鹼的作用催化除去反應,而使得此光重排反應產率大幅提升至 96%。
五、參考文獻:
1. L.F. Tietze, G. Brasche, K.M. Bericke, Domino Reactions in Organic Synthesis, Wiley-VCH, 2006.
2. M. Fleming, R. Basta, P.V. Fisher, S. Mitchell, F.G. West, J. Org. Chem. 1999, 64, 1626–1629.
3. A.J. Herrera, M. Rondón, E. Suárez, J. Org. Chem. 2008, 73, 3384–3391.
4. N. Basaric, M. Horvat, K. Mlinaric-Majerski, E. Zimmermann, J. Neudorfl, A.G. Griesbeck, Org. Lett.
2008, 10, 3965–3968.
5. M. Horvat, H. Gorner, K.-D. Warzecha, J. Neudorfl, A.G. Griesbeck, K. Mlinaric-Majerski, N. Basaric, J.
Org. Chem. 2009, 74, 8219–
8231.6. R. Sarpong, J.T. Su, B.M. Stoltz, J. Am. Chem. Soc. 2003, 125, 13624–13625.
7. A. Padwa, L. Precedo, M.A. Semones, J. Org. Chem. 1999, 64, 4079–4088.
8. M. Amati, S. Belviso, M. D’Auria, F. Lelj, R. Racioppi, L. Viggiani, Eur. J. Org. Chem. 2010, 3416–3427.
9. A. Pace, I. Pibiri, S. Buscemi, N. Vivona, J. Org. Chem. 2004, 69, 4108-4115.
10. Y. Shiraishi, Y. Sugano, S. Tanaka, T. Hirai, Angew. Chem. Int. Ed. 2010, 49, 1656 –1660.
11. W.-Z. Xu, Z.-T. Huang, Q.-Y. Zheng, J. Org. Chem. 2008, 73, 5606–5608.
12. C.S. Lopez, R. Erra-Balsells, S.M. Bonesi, Tetrahedron Lett. 2010, 51, 4387–4390.
13.
J.-H. Ho, T.-H. Lee, C.-K. Lo, C.-L. Chuang, Tetrahedron Lett. 2011, 52, 7199–
7201.14.
L. M. Tedaldi, J. R. Baker, Org. Lett. 2009, 11, 811–814.15. Spectral data of 1a:
1H NMR (500 MHz, CDCl
3): 7.64 (d, J = 7.5 Hz, 1H), 7.62 (s, 1H), 7.51-7.50 (m, 1H), 7.32-7.26 (m, 3H), 7.15 (d, J = 16 Hz, 1H), 6.96 (d, J = 16 Hz, 1H), 6.71 (d, J = 2 Hz, 1H), 2.5 (s, 3H).
13
C NMR (125 MHz, CDCl
3) : δ 143. 66, 140. 91, 136. 36, 135. 38, 130. 35, 127. 27, 126. 15,125.08, 124.84, 119.61, 107.43, 19.85. MS (EI, 70 eV): 184 (M+, 100), 169 (5), 155 (68), 141 (27), 91 (19), 58 (20).
HRMS (C
13H
12O) c a l c ’ d: 184. 0883, f ound: 184. 0886.
16. Spectral data of 2a:
1H NMR (500 MHz, CDCl
3) : δ 7. 97 ( d, J = 8.5 Hz, 1H), 7.69 (d, J = 1.5 Hz, 1H), 7.67 (d, J = 8 Hz, 1H), 7.41 (dd, J = 8.5, 2 Hz, 1H), 7.38 (t, J = 7 Hz, 1H), 7.30 (d, J = 7 Hz, 1H), 3.95 (t, J = 6.5 Hz, 2H), 3.04 (t, J = 6.5 Hz, 2H), 2.70 (s, 3H).
13C NMR (125 MHz, CDCl
3) : δ 135. 56, 134. 10, 133. 64, 131.39, 128.06, 127.17, 126.16, 125.91, 125.83, 124.48, 63.49, 39.11, 19.28.
17. Spectral data of 3a:
1H NMR (500 MHz, CDCl
3) : δ 7. 83 ( d, J = 0.5 Hz, 1H), 7.81 (d, J = 8.5 Hz, 1H),
7.73-7.71 (m, 3H), 7.62 (s, 2H), 7.4-7.33 (m, 5H), 2.76 (s, 3H), 2.62 (s, 3H), 2.55 (s, 6H).
13C NMR (125
MHz, CDCl
3) : δ 135. 25, 134. 39, 133. 48, 132. 72, 131. 87, 131. 70, 128. 32, 128. 09, 127. 68, 127. 01, 126. 55,
126.06, 124.62, 123.18, 22.02, 21.58, 19.36. MS (EI, 70 eV): 157 (M++1, 5), 156 (M+, 100), 155 (M+-1,
13), 141(38), 115 (4). HRMS (C
12H
12) c a l c ’ d: 156.0934, found: 156.0936.
國科會補助計畫衍生研發成果推廣資料表
日期:2012/10/29
國科會補助計畫
計畫名稱: 新型連續光熱化學骨牌反應研究 計畫主持人: 何郡軒
計畫編號: 100-2113-M-011-003- 學門領域: 有機合成
無研發成果推廣資料
100 年度專題研究計畫研究成果彙整表
計畫主持人:何郡軒 計畫編號:100-2113-M-011-003- 計畫名稱:新型連續光熱化學骨牌反應研究
量化
成果項目 實際已達成
數(被接受 或已發表)
預期總達成 數(含實際已
達成數)
本計畫實 際貢獻百
分比
單位
備 註 ( 質 化 說 明:如 數 個 計 畫 共 同 成 果、成 果 列 為 該 期 刊 之 封 面 故 事 ...
等)
期刊論文 0 0 100%
研究報告/技術報告 0 0 100%
研討會論文 5 5 100%
論文著作 篇
專書 0 0 100%
申請中件數 0 0 100%
專利 已獲得件數 0 0 100% 件
件數 0 0 100% 件
技術移轉
權利金 0 0 100% 千元
碩士生 6 6 100%
博士生 0 0 100%
博士後研究員 0 0 100%
國內
參與計畫人力
(本國籍)
專任助理 0 0 100%
人次
期刊論文 1 1 100%
研究報告/技術報告 0 0 100%
研討會論文 0 0 100%
論文著作 篇
專書 0 0 100% 章/本
申請中件數 0 0 100%
專利 已獲得件數 0 0 100% 件
件數 0 0 100% 件
技術移轉
權利金 0 0 100% 千元
碩士生 3 3 100%
博士生 0 0 100%
博士後研究員 0 0 100%
國外
參與計畫人力
(外國籍)
專任助理 0 0 100%
人次
其他成果 (無法以量化表達之成 果如辦理學術活動、獲 得獎項、重要國際合 作、研究成果國際影響 力及其他協助產業技 術發展之具體效益事 項等,請以文字敘述填 列。)
無
成果項目 量化 名稱或內容性質簡述
測驗工具(含質性與量性) 0
課程/模組 0
電腦及網路系統或工具 0
教材 0
舉辦之活動/競賽 0
研討會/工作坊 0
電子報、網站 0
科 教 處 計 畫 加 填 項
目 計畫成果推廣之參與(閱聽)人數 0
國科會補助專題研究計畫成果報告自評表
請就研究內容與原計畫相符程度、達成預期目標情況、研究成果之學術或應用價 值(簡要敘述成果所代表之意義、價值、影響或進一步發展之可能性)、是否適 合在學術期刊發表或申請專利、主要發現或其他有關價值等,作一綜合評估。
1. 請就研究內容與原計畫相符程度、達成預期目標情況作一綜合評估
■達成目標
□未達成目標(請說明,以 100 字為限)
□實驗失敗
□因故實驗中斷
□其他原因 說明:
2. 研究成果在學術期刊發表或申請專利等情形:
論文:□已發表 □未發表之文稿 ■撰寫中 □無 專利:□已獲得 □申請中 ■無
技轉:□已技轉 □洽談中 ■無 其他:(以 100 字為限)
3. 請依學術成就、技術創新、社會影響等方面,評估研究成果之學術或應用價 值(簡要敘述成果所代表之意義、價值、影響或進一步發展之可能性)(以 500 字為限)
在學術成就上,此計畫(連續光熱骨牌反應研究)建立了一種新型化學反應,我們利用了 一種鹼催化光化學反應的醛基中間體,與強還原劑 LiBH4 在反應中直接作用,即得到一系 列新的連續光熱骨牌反應結果,也是合成萘基乙醇的新方法。
在技術創新上,此計畫建立了可以系統性研究與探討新的化學反應的技術平臺,以此 計畫報告為例,在我們了解了反應具有醛基中間體後,利用還原劑可使中間體反應成醇類 的產物,未來可再延伸與胺反應形成亞胺、與氧化劑反應成酸…等各種組合。此方法可以 由了解反應中間體,進行不同反應因素的控制,而快速發展出各式的新化學反應,同時也 可以探討中間體的特性,對有機化學領域有很重要的影響
我認為此計畫的研究概念,應能夠開發出具有工業或商業價值的化學品的合成方法,
再結合了骨牌反應本身具效率、節約能源及環保的優點,對社會將會有非常好的影響。