行政院國家科學委員會專題研究計畫 成果報告
溫室氣體二氧化碳回收、固定及再利用新技術之開發--子
計畫四:光催化還原方法減量溫室氣體 CO2
研究成果報告(完整版)
計 畫 類 別 : 整合型 計 畫 編 號 : NSC 95-EPA-Z-002-007- 執 行 期 間 : 95 年 03 月 01 日至 95 年 12 月 31 日 執 行 單 位 : 國立臺灣大學化學工程學系暨研究所 計 畫 主 持 人 : 吳紀聖 共 同 主 持 人 : 林欣瑜 計畫參與人員: 碩士班研究生-兼任助理:吳姿樺、黃朝偉、周宏其、李東和 處 理 方 式 : 本計畫可公開查詢中 華 民 國 96 年 01 月 26 日
95 年度「環保署/國科會空污防制科研合作計畫」
成果完整報告
溫室氣體二氧化碳回收、固定及再利用新技術之開發
子計畫四: 光催化還原方法減量溫室氣體 CO
2計畫類別:整合型計畫
計畫編號:NSC 95-EPA-Z-002-007-
執行期間: 95 年 3 月 1 日至 95 年 12 月 31 日
總計畫主持人:陳郁文
計畫主持人:
吳紀聖
共同主持人:
林欣瑜
計畫參與人員:
吳姿樺、黃朝偉、周宏其、李東和
執行單位:
國立台灣大學化工所、國立東華大學材料所
中 華 民 國 96 年 1 月 27 日
摘要
為了解決二氧化碳溫室氣體和能源問題,利用太陽光能,進行光催化還原CO2,碳 源將循環來自CO2,可以根本解決CO2排放和再生能源的問題。本子計畫目標發展高效 率光反應器,進行光催化還原CO2,生成碳氫化合物產物,並研發非TiO2新型光觸媒, InNbxTa1-xO4等系列新型光觸媒,進行二氧化碳轉化成甲醇反應之活性測試。研究完成 改良式熱水解法製備一系列Cu/TiO2、Ag/TiO2、Pt/TiO2覆膜液,藉由浸漬覆膜法於直徑 為0.1 mm 之光纖表面。於容納 216 根光纖之光反應器內,以 100 W 高壓汞燈、波長 365 nm、光反應器溫度 348K、流動式穩定狀態氣相系統中進行二氧化碳光催化還原反應, 測得主要產物為甲醇,及其他微量產物甲酸。由 SEM 之觀測,光纖表面的觸媒層具有 許多奈米級孔隙,觸媒顆粒略呈圓形,粒徑約為10~20 nm,觸媒層厚約 26~33 nm。經 XRD 繞射圖譜分析觸媒皆為 anatase 晶相。由 XPS 表面分析結果顯示,負載於二氧化鈦 的Cu、Ag 及 Pt 等金屬,分別以 Cu+、Ag0及Pt2+或Pt4+存在於二氧化鈦表面。當光強度 增強時,觸媒活性也隨之增加。銅、銀、鉑等過渡金屬的添加皆有效地提高甲醇的產率。 原位 FTIR 偵測二氧化碳進行光催化反應,觀察到某些微弱訊號成長,即是光反應產生 的H 原子會對二氧化碳進行還原反應的產物,包括甲酸鹽類、甲酸、甲醛、甲醇與其他 中間產物等。在InNbxTa1-xO4等系列新型光觸媒實驗,發現除了InNbO4觸媒外,其他合 成的觸媒反應活性均優於商用Degussa P-25 TiO2。結果並顯示Ta 取代 InNbO4之Nb 可 提高觸媒反應之活性,1% NiO/InNb0.5Ta0.5O4觸媒,發現其CO2 光催化還原反應之活性較未添加NiO 助觸媒時提高了 7 倍以上。
Abstract
This project aims to remedy greenhouse gas, CO2, and to generate renewable energy via the photo catalytic reduction using solar energy. The carbon source is from CO2 so that this route can reduce CO2 emission and produce renewable energy simultaneously. The goal of this subproject is to improve the catalytic performance of an optical-fiber photo reactor and to carry out the photo catalytic reduction of CO2 to hydrocarbons. In addition, a novel InTaO4 catalyst was synthesized to perform the activity test of CO2 transformation to methanol. A modified thermal hydrolysis was used to prepare a series sols of Cu/TiO2, Ag/TiO2 and Pt/TiO2
respectively, for dip-coating on an optical fibers with 0.1 mm diameter. The optical-fiber photo reactor was consisted of 216 optical fibers. The photo reduction of CO2 was performed in steady-state flow under 365 nm UV irradiation using 100W Hg lamp at 348K. Primary product was methanol and minor formic acid was also found. From the SEM micrographs, the nano porous catalyst films were 26-33 nm thick and composed of spherical TiO2 particles with 10-20 nm in diameters. The crystalline phase of catalyst was anatase revealed by XRD. The chemical status of metal loaded on TiO2 were Cu+, Ag0 and Pt4+ from the XPS measurement. The photo activity increased with increasing light intensity in the experiment. The methanol yields were enhanced by doping Cu, Ag and Pt compared with that in TiO2. The photo catalytic CO2 reduction was also studies by in situ FTIR. Several weak absorption bands of IR spectra indicated that photo-generated H atom reduced CO2 to produce formate, formic acid,
formaldehyde, methanol and some intermediates. The performance test of InNbxTa1-xO4 series catalysts indicated that all catalysts, except InNbO4, gave higher activities than those of Deguss P25 TiO2. The results showed that the substitution of Nb in InNbO4 with Ta can enhance the activity. For the catalyst, 1% NiO/InNb0.5Ta0.5O4, its activity of CO2 photo reduction increased 7 times higher than that of those without co-catalyst NiO.
空污防制科研計畫研究成果資料表
□ 可申請專利 V 可技術移轉 日期:96 年 1 月 27 日計畫資料
計畫名稱:光催化還原方法減量溫室氣體 CO2 計畫主持人:吳紀聖 計畫編號:NSC 95-EPA-Z-002-007- (總計畫名稱: 光催化還原方法減量溫室氣體 CO2)技術/創作名稱
光催化還原 CO2發明人/創作人
吳紀聖 中文: 高效率光纖光反應器,進行光催化還原 CO2,生成碳氫化合物產物, 碳源將循環來自CO2,可以根本解決CO2排放和再生能源的問題。技術說明
英文:A high performance optical-fiber photo reactor can carry out the photo catalytic reduction of CO2 to hydrocarbons. The carbon source is from CO2 so that this method can reduce CO2 emission and produce
renewable energy simultaneously.
可利用之產業
及
可開發之產品
光纖光反應器技術特點
解決CO2排放和再生能源的問題推廣及運用的價值
※ 1.每項研發成果請填寫一式二份,一份隨成果報告送繳本會,一份送 貴單 位研發成果推廣單位(如技術移轉中心)。 ※ 2.本項研發成果若尚未申請專利,請勿揭露可申請專利之主要內容。 ※ 3.本表若不敷使用,請自行影印使用。目 錄
摘要 ………...Ι Abstract ………...ΙΙ 空污防制科研計畫研究成果資料表 ……….ΙΙΙ 目錄 …..………...ΙV 一、緒論 ………...1 二、實驗 ………...2 2.1 光纖反應器改良 ………....3 2.2 二氧化碳光催化還原 ………....7 2.3 SISC 色層分析數據處理系統[14] ………11 三、結果討論 ………...12 3.1 二氧化鈦覆膜液………12 3.2 觸媒檢測及特性分析 ………13 3.3 觸媒光催化活性檢測 ………24 3.4 量子效率………....28 3.5 原位 FTIR ………...33 3.6 InNbxTa1-xO4 觸媒 ………...34 四、結論 ………...38 參考文獻 ………...39 附件 研發成果資料表 ………..41一、緒論
近百年來化石產品的大量應用造成全球暖化的嚴重衝擊,起因於地球大氣層中的 化石燃料燃燒後的產物-二氧化碳等氣體,會阻擋地表向外幅射吸收自太陽的熱能,使 地表和大氣增溫,形成溫室效應(greenhouse effect)。目前除了積極的減少使用化石燃料 以有效減少二氧化碳的排放外,如何將環境中過多的二氧化碳轉變成其他經濟較高的化 學原料與燃料,亦是一項重要的課題。二氧化碳經光催化還原後將會產生甲烷、甲醇、 甲酸和甲醛等產物;若可進一步控制產品之選擇性,將二氧化碳廢氣轉變成可作為替代 能源之甲醇等化學品,可同時解決環境與能源之議題。以光觸媒進行光催化還原CO2 生產碳氫化合物,是模擬植物光合作用,具有再生能源和降低CO2的優點,是根本解決 CO2和能源的最佳選擇。 光纖本質上為一軸對稱圓柱結構的介質光波導(Optical Wave-guide),自軸心往徑向 方向可分為三種不同的構造:核心(core)、外殼(cladding)和保護層(jacket)。高折射率的 纖芯(core)為光纖中負責傳遞光信號的部份,直徑一般為 5~50µm。由光學原理得知,當 光線由光密介質(折射率值較大的介質)射向光疏介質(折射率值較小的介質)時,折射光 將偏離法線。若入射角大於臨界角度時,折射光將全部返回光密介質,此現象即為全反 射。以Snell’s Law 說明光束於光纖內之折射與反射機制,如圖 1 所示。 一般而言,石 英折射率(n1)為 1.4~1.5 而 TiO2折射率(n2)為 2.4~2.9,由圖 1(b)得知,光束將以部份反射 與部份折射方式於光纖內進行傳遞。 圖1: Snell’s Law-光束傳導機制[1] 本實驗室先前已致力於光纖光反應器之研發,以每根直徑為 ~0.1mm 的石英光纖所 組成的光纖反應器[2],利用光在其中行進所形成的部份反射與部份折射的特性,使吸附 在距離光纖表面較為接近的二氧化碳分子,也能充分與折射光進行光還原反應,而獲得 較佳的光轉化效率,在氣相中生成甲醇,已具備良好之CO2光催化的成果[3]。 將二氧化碳光分解還原,會有一氧化碳、甲酸(兩個電子轉移)、甲醛(四個電子轉 移)、甲醇(六個電子轉移)、甲烷(八個電子轉移)等不同產物,可經由反應條件和觸媒的不同來調整產物的選擇性及產率。在所有半導體光觸媒中,以二氧化鈦為最被廣泛應用 的金屬氧化物。因為其具有良好的光電性質、高化學穩定性、價格低廉及無毒等優點。 二氧化鈦具有三種晶體結構:anatase phase、rutile phase 及 brookite phase。其中以 anatase 晶相擁有較高的光催化活性[4,5]。添加金屬於二氧化鈦表面並控制其種類及添加量,使 二氧化鈦表面產生有助益之補捉電子或電洞的基位(shallow charge trapping site),可降低 表面電子電洞再結合的速率,有助於提升其光催化效率[6,7]。由文獻可知,在進行二氧 化碳的還原反應時,添加Cu、Ag、Pt 金屬改質之觸媒可增加甲醇的轉化率 [8-10]。 近年來鉭銦氧化物 InTaO4光觸媒被發現在可於可見光照射下催化水分解製氫反 應,而摻雜少量的鎳,可明顯提高In1-xNixTaO4 (x < 0.15) 觸媒之水分解製氫催化活性, 當鎳之摻雜量等於 0.1 時 In1-xNixTaO4觸媒有最高的催化活性,其量子效率可達 0.66% [11]. Sayama [12] 等人發現當 K4Nb6O17之Nb 被 Ta 取代時,其 b 軸長度隨著 Ta 之摻雜 量增加而增大,且摻雜Ta 使 K4Nb6O17 UV-Vis 光譜之吸收邊緣往可見光區域移動,但當 Ta 含量大於 Nb 時其 UV-Vis 光譜之吸收邊緣反而往短波常移動,其研究中並發現當 Nb: Ta =2:1 時有最高之水分解光催化活性。Zou [13] 等人於 BiTa1-xNbxO4光觸媒之研究中發 現當x=0 及 0.5 時,BiTa1-xNbxO4之結晶結構為三斜晶系(triclinic),但當 x=0.2,0.8 及 1 時其結晶結構為正交晶系(orthorhombic),並且發現三斜晶相之 BiTa1-xNbxO4能隙較正交 晶相高。由文獻報導可得知光觸媒材料之結晶結構對其反應活性有很大的影響,於光觸 媒結構中摻雜少量的雜質元素可能改變其結晶相及能帶結構。
二、實驗
以改良式熱水解法製備一系列二氧化鈦觸媒覆膜液。先稱取預先計算好重量之氯化 銅、硝酸銀、氫六氯鉑酸等金屬的前驅物,使其溶於0.1M(pH=1.05)的硝酸溶液,均勻攪拌五分鐘。取四丁基醇氧化鈦(Titanium butoxide,TBOT)與 HNO3 (0.1M)體積比為 1: 6,混合後均勻攪拌加熱至 80°C 後,將增黏劑聚乙二醇(Polyethylene glycol,PEG)加入 溶液中並持溫8 小時,即完成 TiO2、1.2%-Cu/TiO2、1.0%-Ag/TiO2及1.0%-Pt/ TiO2覆膜
液。光纖先以高溫燒除表面披覆的一層高分子樹脂,再以5M 之氫氧化鈉進行震盪清洗
後烘乾。覆膜時先將光纖浸入含Cu、Ag、Pt 金屬 TiO2覆膜液內,靜置五分鐘後,以3cm/min
的速度拉升。覆膜完畢後,放入高溫鍛燒爐進行熱處理程序。此時TiO2將會形成利於
光催化反應的anatase 晶相,而聚乙二醇(PEG)也會被分解成二氧化碳。
光催化活性檢測在於利用含有不同金屬之二氧化鈦光觸媒還原二氧化碳,所測得的
產物為甲醇。實驗所使用之二氧化碳為高純度二氧化碳,其成份分析如表 1,可證實甲
表1: 高純度二氧化碳成份檢測[三福氣體]
成份 含量 量測量位
Total Purity >99.999 %V
Hydrogen <0.05 Oxygen and Argon 0.137
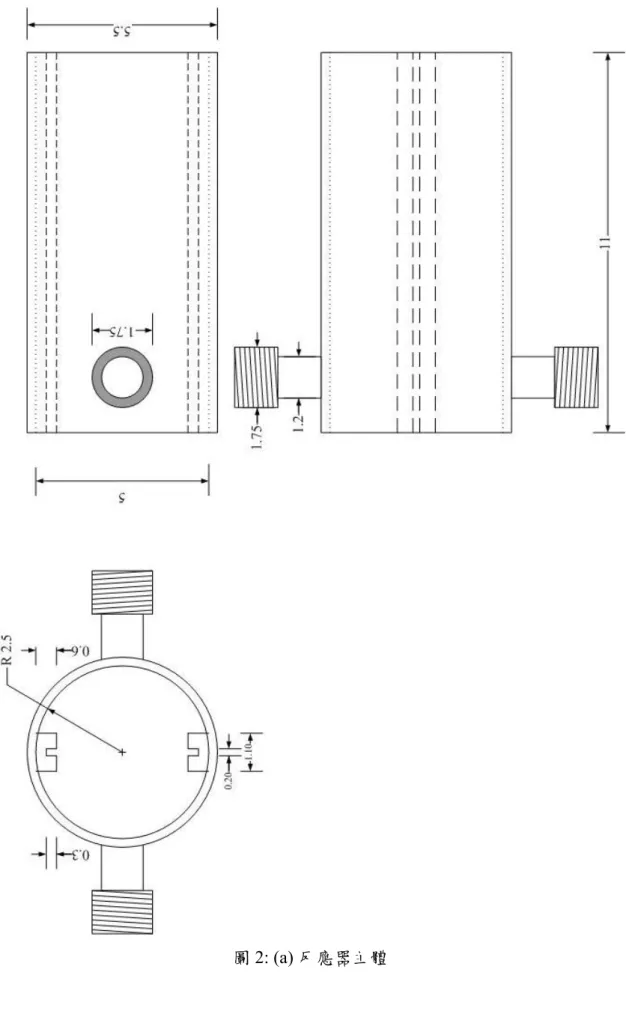
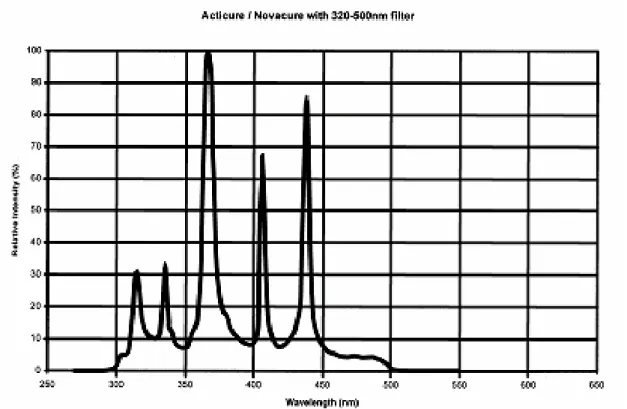
Nitrogen 0.364 Carbon monoxide <0.05 Total hydrocarbons 0.120 Water 0.224 PPMV 2.1 光纖反應器改良 實驗所使用的反應器可分成三個部分:(a)反應器主體 (b)不銹鋼內件 (c)不銹鋼骨 架,如圖2 所示。反應器主體為圓柱型玻璃管(Pyrex),其上留有進料入口與產物出口端, 以鐵弗龍製接頭填塞,並將八分之一吋不銹鋼轉接頭旋入此鐵弗龍接頭內,使輸送管件 與反應器主體得以結合。主體兩側以不銹鋼圓盤及O-ring 促使反應器玻璃主體完全達到 密封狀態,其中一側附有石英窗口供光源通過,以進行光催化反應。反應器主體內置入 可乘載216 根光纖的不銹鋼內件,外部再以加熱帶包覆用以加熱反應器,提高反應溫度。 於進料入口前端接上一個三通管,可使溫度探針(thermocouple)深入反應器以測得溫度。 本實驗所使用的光源為100W 高壓汞燈,入射光源的波長分布如圖 3 所示,以 365nm 為主。紫外光經光纖液晶導管連接經設計過之不銹鋼旋轉轉接頭 (圖 4),可調整光源的 投射面積及強度,紫外光再經過厚約3mm 之石英玻璃入射反應器內。
圖3: 燈源波長(320-500nm)分佈圖
圖4: 光源與反應器連接裝置。1: 光源轉接頭 2: 不銹鋼圓盤
2.2 二氧化碳光催化還原
二氧化碳光催化還原反應流動系統如圖5 所示。在照光反應進行前,先以氦氣沖洗
碳通過裝有純水的飽和瓶,一併將飽和水汽帶入反應器內。藉由進口端之球閥與出口端 之針閥即可控制反應物滯留時間及反應器內的壓力。同時開啟自耦變壓器以控制纏繞於 玻璃管外之加熱帶,當溫度及流量到達設定值1 小時後,開始進行照光反應。所使用的 觸媒分別有 TiO2、1.2%Cu/TiO2、1.0%Ag/TiO2及 1.0%Pt/TiO2四種,反應操作參數包含 紫外光強度及反應物滯留時間。為了簡化實驗並減少差異性,四種觸媒實驗時個別以同 一批覆膜光纖進行測試,順序如圖 6。雖然觸媒會有失活現象,但卻可減少同一種觸媒 因覆膜、鍛燒或組裝反應器時造成的影響。 實驗中所生成產物藉由氣相層析儀進行分析定量。GC 使用之 Carrier gas 為高純度 氦氣,流速控制在20mL/min;在分析過程管柱壓力維持在 195kPa,GC 的管柱為 2m 長 的Porapak QS,注入端( Injection)溫度為 150oC,Oven 定溫於 80oC,FID 溫度為 150oC,
氫氣及空氣之壓力在點火後,分別維持在50kPa 及 125kPa。一典型積分圖譜如圖 7 所示, 由積分圖譜上可見一出現在四分鐘左右之波峰,此為甲醇訊號。 為定量生成甲醇之莫耳數,先配製5 種濃度(2、6、8、12、14ppm)之甲醇溶液,在 相同設定的條件下,注入3 L 以知濃度標準甲醇溶液於GC,由 SISC 層析數據處理系 統讀出特定波峰之積分面積值,將甲醇含量與積分面積回歸作圖,可得甲醇校正曲線; 反應進行中產物會流經5mL 的取樣閥(sampling loop),於取樣時間到達時,由六向閥將 sampling loop 內的產物攜入 GC 進行分析。將積分值 (x)代入公式,即可推算 5 毫升中的 甲醇含量( y mole): 11 15
1
.
7095
10
10
2208
.
4
×
− −×
−=
x
y
進而以下述公式推算出每單位時間、單位重量觸媒,所產生的甲醇產率(Y)。 = Y ) ( 1 ) ( 3600 ) ( 1 ) ( ) ( hr s g s ml (ml) mole × × ×觸媒重
流速
取樣體積
甲醇莫耳數
w at er s a tu ra to r
C
O
2 ba ll va lv eH
e
ba ll va lv e th re e-w ay s va lv e ph o to re a ct er G C / F ID bu bb le fl o w m et e r ! th e rm al c ou pl e th re e-w ay s va lv e pr es su re g au ge U V s ou rc e w at er m et er in g va lv e 圖5: 光反應流動系統裝置圖插裝216根覆膜觸媒光纖(TiO2) He沖排反應器一整晚 新鮮觸媒 光強度10W/cm2 照光11小時 滯留時間5000sec 光強度10W/cm2 照光6小時 滯留時間5000sec He沖排反應器一整晚 He沖排反應器一整晚 光強度6W/cm2 照光6小時 滯留時間7500sec He沖排反應器一整晚 光強度6W/cm2 照光6小時 滯留時間10000sec He沖排反應器一整晚 光強度2W/cm2 照光6小時 滯留時間5000sec He沖排反應器一整晚 光強度10W/cm2 照光6小時 滯留時間5000sec 更換觸媒(1.2%-Cu/TiO2、 1.0%-Ag/TiO2及1.0%-Pt/TiO2) 重複左方步驟 圖6: 二氧化鈦觸媒覆膜光纖測試順序圖
mv minutes 0 5 10 0 5 10 15 20 25 30 1) 1. 227 2) 4. 0 92 圖7: 甲醇水溶液積分圖譜 2.3 SISC 色層分析數據處理系統[14] 此數據處理系統可分為兩大部分:硬體部分為類比數位轉換介面盒(ADC),軟體部 分為色層分析數據處理系統。此系統可以應用於許多層析分析儀器如HPLC、GC、LC、 GPC、CE、SFC 等。這些儀器的共同點及都會有電壓訊號輸出,一般即稱為類比訊號 (analog),但此種訊號不能直接接至電腦,而必須透過介面轉換為數位訊號(digital),才 能被電腦接受,這個轉換的介面就是類比數位轉換介面盒(ADC,Analog to Digital Converter)。透過 ADC,GC 輸出的訊號轉成電腦可用的訊號後,再透過色層分析數據處 理系統的積分參數設定,進而求得各成份波峰之積分面積值。 積分參數包含了雜訊臨界點、半波峰之寬度、最小積分面積、積分區間、基線切割 靈敏度值及自動扣除背景基線六項,另外還有特殊積分功能。雜訊臨界點(含上限及下 限值)可決定波峰要積分的起始斜率值,其目的用於決定波峰的起點與終點,而所決定 出來的波峰需達到半波峰之寬度(秒)以上,才會被判定為波峰並進行積分處理;所決定 出來的波峰,其波峰面積要超過最小波峰面積(μV*sec)才算是波峰,否則將該波峰當作 是雜訊峰;積分區間(分鐘)則決定了層析圖上某時間範圍內的波峰才進行積分處理,此 外將不進行積分。基線切割靈敏度值可決定重疊峰的切割方式,也會影響波峰的終點位 置,一般設定值越小,判定波峰終點會越早,否則相反。當層析圖上基線發生漂移時, 則可用自動扣除背景基線功能,將漂移的基線扣除。 當一張層析圖非常複雜,例如有注射峰、負波峰、重疊峰及基線漂移等情形,此時 就需要特殊積分功能。特殊積分共有四項:不積分區間、負波峰積分、拖尾峰積分及波 甲醇
前峰積分。不積分區間可分成十段來設定,即某些區間內的波峰將不進行積分計算;負 波峰積分用於有負波峰產生又需要積分該波峰面積時;拖尾峰積分用於有重疊峰產生且 其波峰後端比前端寬度大許多時;波前峰積分則恰與拖尾峰相反,用於有重疊峰產生且 其波峰前端比後端寬度大許多時。數據擇取的取點速率為10 點/秒。 本實驗中因為產物中甲醇含量極低(ppm 等級),故利用 GC 分析時選擇最大的放大 倍率(attenuator=1),不僅甲醇波峰被放大,雜訊波峰亦被放大,而在定量甲醇時其波峰 又有拖尾(tailing)現象。因為每次實驗狀況、注射方法、試樣狀態、試樣濃度等皆不相同, 因此每張積分圖譜所使用的積分參數也隨之不同,這樣才能使切割出來的波峰面積較具 代表性或較準確並降低誤差。 FTIR 實驗使用光反應器的圓蓋上具有三個視窗:其中 2 個 KBr 視窗可讓 IR 與 UV 波段的光通過,石英材質的視窗可讓 UV 穿透,但 IR 部分波段無法通過石英。365nm 單波長之UV 光由 100W 汞燈產生,藉由光導管導入光源傳送至石英視窗,以提供反應 所需之UV 輻射。
InNbxTa1-xO4 (0 < x < 1) 光觸媒製備,取等計量比之 In2O3,Nb2O5,與Ta2O5 置於 瑪瑙研缽充分研磨後於 1100°C 固態反應 10 小時。InNi0.1Ta0.9O4光觸媒製備:取等計量 比之In2O3,Ta2O5 與 Ni(NO3)2 置於瑪瑙研缽充分研磨後於 1100°C 固態反應 10 小時。 將InNb0.5Ta0.5O4觸媒含浸於Ni(NO)3水溶液之中製備1% NiO/InNb0.5Ta0.5O4光觸媒。將 InNb0.5Ta0.5O4 觸媒含浸於 CuCl2 水溶液之中製備 1% Cu/InNb0.5Ta0.5O4 光觸媒。1% Cu/InNb0.5Ta0.5O4-C500 觸媒:將 1% Cu/InNb0.5Ta0.5O4觸媒經過在 500 oC 空氣中熱處理 0.5 小時。 1% Cu/InNb0.5Ta0.5O4-C500-R300:將 1% Cu/InNb0.5Ta0.5O4-C500 於氫氣中於 300oC 還原 1 小時。
三、結果討論
3.1 二氧化鈦覆膜液 為了將添加銅、銀或鉑金屬的 TiO2觸媒均勻穩定地覆膜於光纖表面,實驗以改良 式熱水解法製備這一系列 TiO2 覆膜液。先行計算好欲添加重量百分比為 1.2%-Cu、 1.0%-Ag 及 1.0%-Pt 各金屬的前驅物克數,加入 0.1M 硝酸溶液攪拌溶解後,溶液分別呈 現淡藍色、無色及橘紅色。再緩慢將四丁基醇氧化(TBOT)滴入,此時溶液中大量的水會 使其快速水解而形成米白色沉澱,其 中含 1.0%-Pt 金屬的溶液則為顏色較深的乳黃色。 待 TBOT 全滴入,升溫至 80℃後持溫攪拌八小時,此時,原本米白色的過氧化物沉澱 逐漸解膠形成一次粒子,覆膜液也慢慢形成微透明乳白色的膠體溶液。而含 1.0%-Pt 金 屬的覆膜液在持溫80℃攪拌至第二~三小時,逐漸由乳黃色轉變為灰黑色,而後再漸漸 轉變成微透明的淺灰色。將製備好的覆膜液靜置於室溫下,待其溫度冷卻後,量測 pH溶液 pH 值離等電點愈遠時,溶液含有較多帶有相同電荷的粒子,彼此間的靜電排斥力 將有助於減少二氧化鈦粒子的聚集。故覆膜液完成後,即使長期(八個月以上)靜置於室 溫下,仍不會有沉澱物抑或溶液分層的現象發生。然而, 添加 1.0%-Pt 金屬的二氧化鈦 覆膜液卻出現黑色沉澱物,推測為覆膜液不夠遠離等電位點,而造成部分粒子聚集沉澱。 3.2 觸媒檢測及特性分析 為了更深入了解所製備出的一系列二氧化鈦光觸媒,及其與光催化活性間的關係, 取澄清覆膜液進行光纖或蓋玻片浸漬覆膜,再經高溫鍛燒熱處理成膜,抑或直接將覆膜 液高溫鍛燒成粉體,進行各種儀器分析。其中,將1.0%-Pt/TiO2覆膜液中的黑色沉澱物 獨立出來經相同熱處理鍛燒成粉體(以 1.0%-Pt/TiO2*表示),表 2 為觸媒之特性分析結果。 表2: 觸媒之特性分析結果 Catalyst Sol. pH value Crystal sizea (nm) Band gapb (eV) BET (m2/g) pure TiO2 1.26 14.4 3.59 59.75 1.2%-Cu/TiO2 1.21 16.8 3.62 55.82 1.0%-Ag/TiO2 1.39 12.0 3.51 71.66 1.0%-Pt/TiO2 1.23 16.7 3.40 72.23 1.0%-Pt/TiO2* 1.23 12.7 ━ ━
a: 由 XRD 圖譜 anatase 繞射峰(2θ= 25.28o)半高寬代入 Scherrer’s eqn.估算 b: 由 UV-VIS 圖譜之吸收邊緣延伸至吸收度為零的交點估算
3.2.1 XRD
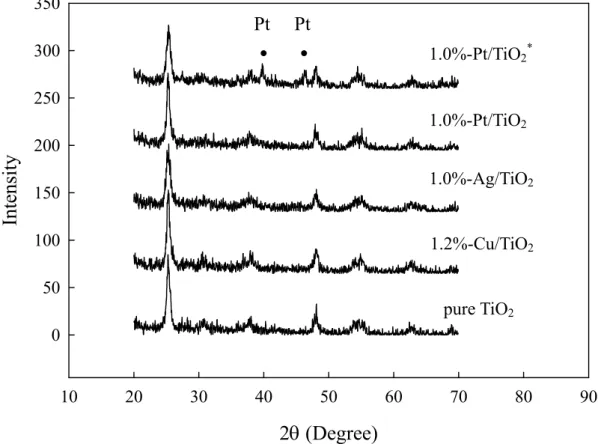
一系列二氧化鈦觸媒各取少許粉體進行 XRD 檢測,以鑑定二氧化鈦與金屬之晶
型,進而估算晶粒大小。實驗結果如圖8,對照 JCPDS-Power Diffraction File 可發現所 有觸媒均呈現單一 anatase 晶相,將其主要繞射峰之半高寬代入 Debye-Scherrer’s equation,估算出晶粒大小,結果列於表 2。純二氧化鈦晶粒大小為 14.4nm,添加 Cu 及 Pt 金屬之二氧化鈦粒徑增為 16.8nm 及 16.7nm,而添加 Ag 金屬之二氧化鈦粒徑則減為 12.0nm。 在本實驗中因添加的金屬(Cu、Ag 及 Pt)含量甚少,故於 XRD 圖譜上無法觀察到各 金屬的繞射波峰,而其中 1.0%-Pt/TiO2*則可看到 Pt 的主要特性峰出現在 39.77°及 46.25°,推論 1.0%-Pt/TiO2覆膜液中的黑色沉澱物應含有 Pt,而上層澄清覆膜液裡的 Pt 含量則不到1.0wt%。
2θ (Degree)
10 20 30 40 50 60 70 80 90Int
ens
ity
0 50 100 150 200 250 300 350圖8: M(Cu, Ag, Pt)/TiO2觸媒經500℃鍛燒之 XRD 圖譜
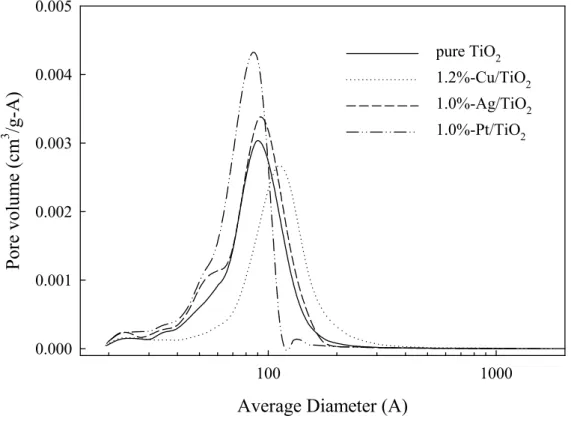
3.2.2 BET 及孔徑分佈 以N2吸附法量測粉體觸媒之BET,結果列於表 2。純二氧化鈦的比表面積為 59.75 m2/g,添加 Cu 金屬後,比表面積略為下降至 55.82 m2/g,而添加 Ag 及 Pt 金屬比表面積 反而增加為71.66 m2/g 及 72.23 m2/g。在分析比表面積的同時,偵測孔徑大小與分佈, 利用Kelvin 方程式計算孔徑,對脫附量作圖後再微分即可得到孔徑分佈圖,如圖 9 所示。 由圖可現本實驗中製備出的一系列二氧化鈦觸媒粉體在顆粒之間存在mesopore,孔徑分 佈約在4-11nm,主要孔徑約為 9 nm。 Pt ․ Pt ․ pure TiO2 1.2%-Cu/TiO2 1.0%-Ag/TiO2 1.0%-Pt/TiO2 1.0%-Pt/TiO2*
Average Diameter (A) 100 1000 Por e volum e (cm 3 /g -A ) 0.000 0.001 0.002 0.003 0.004 0.005 pure TiO2 1.2%-Cu/TiO2 1.0%-Ag/TiO2 1.0%-Pt/TiO2
圖9: M(Cu, Ag, Pt)/TiO2觸媒之孔徑分佈圖
3.2.3 UV-VIS
用蓋玻片覆膜觸媒測定二氧化鈦於可見光及紫外光下的吸收圖譜。由結晶性佳的二 氧化鈦能階圖可知,在可見光區完全不會有吸收,而在近紫外光區因為光子能量較高可 使共價帶上的電子躍升至傳導帶,因此會有吸收峰出現。圖10 為 M(Cu, Ag, Pt)/TiO2觸 媒的紫外-可見光光譜,由吸收邊緣延伸至吸收度為零的交點決定起始吸收波長後,帶
Wavelenght (nm)
100 200 300 400 500 600 700 800 900Absorpt
ion
0 1 2 3 pure TiO2 1.2%-Cu/TiO2 1.0%-Ag/TiO2 1.0%-Pt/TiO2圖10: M(Cu, Ag, Pt)/TiO2觸媒之紫外-可見光光譜
3.2.4 SEM 藉由SEM 可觀察斷面及表面微結構,因此我們可拍攝光纖橫截面以估算覆膜在光 纖上的二氧化鈦觸媒層厚度,並拍攝光纖表面以獲得觸媒在光纖表面的分佈狀態及顆粒 大小。因二氧化鈦為不良導體,故拍攝前必須先鍍上一層白金(Pt)幫助導電。圖 11 為放 大十萬倍之光纖橫截面圖,覆膜的觸媒是1.2%-Cu/TiO2,圖下方為光纖基材,其上有光 纖折斷過程所造成之斷裂紋理,小圓點則為白金顆粒;斷裂紋理的消失處有一層明顯的 連續大圓點,此即為1.2%-Cu/TiO2觸媒。根據以上特徵,可分別判斷估算出覆膜在光纖
上的各觸媒層厚度。圖12 為 M(Cu, Ag, Pt)/TiO2觸媒覆膜在光纖上的橫截面圖。從圖中
可發現,各觸媒層厚度均差不多,約在30nm 左右。以純二氧化鈦為最厚有 33nm,添加
Cu、Ag 及 Pt 等金屬會略為減少觸媒層厚度,依序為 1.2%-Cu/TiO2的31nm、1.0%-Pt/ TiO2 的30nm 及 1.0%-Ag/TiO2的27nm。
圖11: 放大十萬倍之光纖橫截面圖
(a) pure TiO2 (b) 1.2%-Cu/TiO2
(c) 1.0%-Pt/TiO2 (d) 1.0%-Ag/TiO2
H=30.14nm H=26.79nm
圖12: M(Cu, Ag, Pt)/TiO2觸媒覆膜光纖之橫截面圖;右上角為光纖表面之SEM 圖 Optical fiber
圖13: 1.2%-Cu/TiO2觸媒覆膜光纖之表面圖 3.2.5 EDS 利用電子激發出的特性X 光可以分析元素成分。本實驗以 15eV 之電子束進行分析 前處理完畢之光纖與蓋玻片(圖 14)及有覆膜觸媒的光纖表面組成元素。由圖 14(a)可見, 蓋玻片主要成份為二氧化矽(SiO2),另外也有少量的鈉(Na)、鋅 (Zn)、鉀(k)、鋁(Al)等元 素。圖14(b)中僅有二氧化矽(SiO2),顯示光纖經高溫鍛燒及 NaOH 鹼洗後,原附著於表 面之高分子樹脂薄膜外殼已不存在,只剩下石英材質的核心(core)部份。 有覆膜觸媒光纖的EDS 檢測,結果竟與未覆膜之裸光纖相同,如圖 14(b),主要原 因為 EDS 之電子束會以水滴狀穿透約 1000 奈米的深度(視樣品密度而不同),而表面覆 膜之觸媒層僅 30nm,因此偵測到的元素大部分為光纖核心的石英材質,而無法分析覆 膜於光纖表面的觸媒成份。不過,我們可藉由XPS 來補足這部分的遺憾。 (a) 空白蓋玻片 (b)空白光纖 圖14: EDS 分析圖譜
3.2.6 XPS
利用單一能量(1254.6eV)之特性 X 光激發觸媒樣品的核心軌域(core level)電子使其
游離,但由於電子的平均自由徑很短,因此只有距離表面1nm 以內的電子可以脫離而不 耗損能量,故XPS 所測得的光譜為觸媒樣品表面的化學特性。為了檢測覆膜於光纖表面 的光觸媒組成元素成分及添加金屬之價態,實驗將高溫鍛燒熱處理研磨後的粉體觸媒壓 片後貼於載台上,進行XPS 測定。 因二氧化鈦為不良導體,在測定過程其表面會有電荷累積的現象,導致各特性峰往 高束縛能偏移,因此實驗結果之數據必須先經C(1s) 284.8eV 與 O(1s)531.6eV 校正[16]。 圖15 為 M(Cu, Ag, Pt)/TiO2觸媒粉體的Ti(2p)經 C(1s)與 O(1s)校正後之 XPS 圖譜。圖中 所有譜線均含有二個波峰,此為 spin doublet 分裂的 2p 層電子,束縛能分別為 2p3/2的 459.5eV 以及 2p1/2的465.2eV,相差約為 5.7eV,兩波峰的相對強度(面積)約為 2:1,是 標準TiO2的Ti(2p)譜線。
圖16 為 M(Cu, Ag, Pt)/TiO2觸媒粉體O(1s)的 XPS 圖譜,最強波峰出現在束縛能為 530.7eV,此為 TiO2之O(1s)的標準譜線。在此 O(1s)圖譜中,譜線有些微不對稱,在 533eV 附近有一肩峰出現。根據文獻[17],推論可能為二氧化鈦表面 OH 基、水分子吸附或是 有機物殘留的C-O 等貢獻。
圖17 顯示 Cu(2p)的 XPS 圖譜,最強波峰出現在束縛能為 932.7eV。根據文獻指出, 標準金屬Cu 之 Cu 2p3/2及2p1/2的波峰分別在於932.4eV 及 952.2eV[18]; Cu2O 之 Cu 2p3/2 及2p1/2的波峰分別在於932.8eV 及 952.8eV;CuO 之 2p3/2主峰位置則在933.8eV,而 2p1/2 則 是 953.8eV [14] 。 對 於 Cu 而 言 , 各 價 態 之 束 縛 能 間 僅 有 0.4eV(Cu0/Cu+) 與 1.0eV(Cu+/Cu2+)之差,因此在判別上可利用 Cu+與Cu2+會有搖昇譜線(shake-up line)而 Cu0
沒有的特性來判斷Cu 價態。圖 17 中可明顯看出,譜線有搖昇現象,因此推論所製備出
的1.2%-Cu/TiO2觸媒表面之Cu 價態絕大部分為 Cu+,但是也有極少數Cu0存在。 圖 18 顯示 Ag(3d)的 XPS 圖譜,最強波峰出現在束縛能為 368.6eV。根據文獻 [19,20],金屬 Ag0之束縛能為 368.2eV,Ag2O 之束縛能為 367.8eV,AgO 之束縛能為 367.4eV。對於 Ag 而言,各價態之束縛能間僅有 0.4eV 之差,因此要以 XPS 來判定價態 並不容易。在圖18 中,Ag 3d5/2及3d3/2的波峰分別在368.6eV 及 374.6eV,相差為 6.0eV, 兩波峰的相對強度(面積)約為 3:2,推論所製備出的 1.0%-Ag/TiO2觸媒表面之Ag 價態 為Ag0。
圖 19 顯示 Pt(4f)的 XPS 圖譜。金屬 Pt0之束縛能為 70.4-71.0eV,Pt2+之束縛能為 72.4eV(PtO、 Pt(OH)2)或 73.4eV(PtCl2),Pt4+之束縛能為74.2eV(Pt(OH)4)、74.8eV(PtO2) 或 75.8eV(H2PtCl6)。對於 Pt 而言,spin doublet 分裂的 4f 層電子,束縛能相差約為 3.2-3.5eV,
而各價態之束縛能間僅有 1.4-3.4eV 之差,因此當添加的 Pt 含量並不高時,無法很正確
上更是難上加難。在圖19 中,1.0%-Pt/TiO2的最強波峰出現在束縛能約為76.6eV,但沒
有另一根分裂的4f 波峰,最強波峰又並非完全對稱,此因為 1.0%-Pt/TiO2上層覆膜液中
Pt 含量極少所導致,故無法準確判定其價態,只能推測可能為 Pt2+或Pt4+。而1.0%-Pt/TiO2* 的最強波峰出現在束縛能為75.1eV,其次為 71.65eV,相差為 3.45eV,但兩波峰的相對 強度(面積)並非為 3:4,且圖中譜線並不對稱,在 76.6eV 附近有一肩峰出現。經由曲線 擬合(curve fitting)後,曲線中為 4f7/2可能包含 71.3eV、73.4eV 及 74.6eV,因此推測 1.0%-Pt/TiO2覆膜液中的黑色沉澱物可能含有Pt0,以及少量的PtO2及微量的PtCl2。 對同一觸媒粉體而言,可利用XPS 圖譜中,各不同元素的最強譜線波鋒面積 I,及 該儀器公司所提供不同元素的感受係數S(表 3)之比值,代入下列公式即可計算出各元素 間的相對含量 n1/n2,結果如表4。實驗發現,表面金屬與 Ti 的莫耳比皆高於整體(bulk) 的理論計算值,這表示添加的金屬絕大部分皆存在觸媒表面上。 2 2 1 1 2 1
S
I
S
I
n
n =
表3: 本研究所使用 XPS 儀器對不同元素、軌域之感受係數 S Element Orbital S Ti 2p3/2 522 Ti 2p1/2 269 O 1s 293 Cu 2p3/2 1673 Cu 2p1/2 866 Ag 3d5/2 1066 Ag 3d3/2 738 Pt 4f7/2 865 Pt 4f5/2 681表4: 觸媒表面 M/Ti、O/Ti 莫耳比及 OH 基比例 M/Ti O/Ti Catalyst M Surface (XPS) Bulkc (calculated) Surface (XPS) Bulkc (calculated) OH ratiod Pure TiO2 ━ ━ ━ 2.7579 0.238 1.2%-Cu/TiO2 Cu 0.0725 0.0153 2.6744 0 1.0%-Ag/TiO2 Ag 0.0221 0.0075 2.8306 0.088 1.0%-Pt/TiO2 Pt 0.0057 0.0041 2.8174 0.302 1.0%-Pt/TiO2* Pt 0.0179 ━ 2.8442 2 0.855 c: 以製備時金屬與 Ti 的前驅物添加量計算
d: 解析 O(1s) XPS 532.7eV 位置波峰對整個 O(1s)波峰定量比例估算
Binding energy (eV)
450 455 460 465 470 475 480 In te nsity ( co unts/se c) 0 5000 10000 15000 20000 1.0%-Pt/TiO2* 1.0%-Pt/TiO2 1.0%-Ag/TiO2 1.2%-Cu/TiO2 pure TiO2
圖15: M(Cu, Ag, Pt)/TiO2觸媒Ti(2p)之 XPS 圖譜 Ti 2p3/2
Binding energy (eV) 520 525 530 535 540 545 550 In ten sity ( cou nt s/sec) 0 5000 10000 15000 20000 25000 30000 1.0%-Pt/TiO2* 1.0%-Pt/TiO2 1.0%-Ag/TiO2 1.2%-Cu/TiO2 pure TiO2
圖16: M(Cu, Ag, Pt)/TiO2觸媒O(1s)之 XPS 圖譜
Binding energy (eV)
920 930 940 950 960 970 Int ens ity (c ount s/ se c) 5500 6000 6500 7000 7500 圖17: 1.2%-Cu/TiO2觸媒之Cu(2p) XPS 圖譜 Cu 2p3/2 Cu 2p1/2 O 1s
Binding energy (eV) 355 360 365 370 375 380 385 390 Int ens ity (c ou nt s/ se c) 600 800 1000 1200 圖18: 1.0%-Ag/TiO2觸媒之Ag(3d) XPS 圖譜
Binding energy (eV)
65 70 75 80 85 90
In
tensity (
co
un
ts/sec)
1000 1200 1400 1600 1800 1.0%-Pt/TiO2 (powder)* 1.0%-Pt/TiO2 (powder) 圖19: 1.0%-Pt/TiO2觸媒之Pt(4f) XPS 圖譜 Ag Ag Pt 4f7/2 Pt 4f5/23.3 觸媒光催化活性檢測 二氧化碳光催化還原反應可能會有一氧化碳、甲烷、甲酸、甲醛、甲酸、甲醇等產 物,本實驗中以 GC/FID 測得主要產物為甲醇,其餘尚有極少量的甲酸甲酯(9min)及甲 酸(24min)。在 4-5 分鐘時出現了兩根波峰,推論為甲醇與甲酸在管柱中發生酯化反應, 導致甲醇的特性峰出現分裂現象,因此在計算甲醇產率時,將兩個波鋒皆視為甲醇的特 性峰。而甲酸在GC/FID 的 靈敏度不高,甲酸甲酯特性峰面積又極小,故以甲醇產率來 評 估觸媒的活性大小。 3.3.1 空白實驗 在進行二氧化碳光催化還原之前,必須先作空白實驗,以確定實驗所測得的甲醇為 二氧化鈦觸媒光催化還原二氧化 碳而來。操作參數有五個(一)光纖、(二)覆膜二氧化鈦 觸媒、 (三)紫外光源、(四)反應氣體:高純度二氧化碳及(五)H 原子 來源:H2O。空白實 驗共有五個,測試結果如表 5。由空白實驗 1 及 2 可知,二氧化碳在沒有二氧化鈦觸媒 的催化下,並不會有甲醇訊號產生。經實驗3 的測試可知,二氧化鈦觸媒若無紫外光照 射,無法引發催化反應。將反應氣體改成He 氣通入反應器(實驗 4),結果沒有甲醇訊號 產生,此證明了生成甲醇的碳源來自二氧化碳。而在實驗5 中並無提供 H 原但卻有極微 弱的甲醇特性峰出現,推測應為吸附在觸媒表面的水分子或OH 基照光後與二氧化碳產 生作用的結果。經五種空白實驗結果可證實,本研究甲醇的生成,確實為利用二氧化鈦 光觸媒光催化還原二氧化碳後的產物。 表5: 一系列空白實驗反應結果
Experimente Optical fiber Catalyst (TiO2) UV light (365nm) Reactant gas H atom (H2O) CH3OH
1 X X O CO2 O X 2 O X O CO2 O X 3 O O X CO2 O X 4 O O O He O X 5 O O O CO2 X Oˇ e: 反應操作在滯留時間 5000 秒、反應器溫度 75℃、Pco2=1.19bar
3.3.2 二氧化碳光催化還原 本研究製備四種觸媒TiO2、1.2%-Cu/TiO2、1.0%-Ag/TiO2及1.0%-Pt/TiO2分別測試 對二氧化碳還原的光催化活性,為了減少同一觸媒因覆膜、鍛燒或組裝反應器過程造成 之差異性,四種觸媒實驗時個別以同一批覆膜光纖進行測試,順序如圖 6。將 216 根覆 膜觸媒光纖經高溫鍛燒後插入反應器並組裝完畢後,先通入高純度 He 沖排反應器內的 空氣及污染物,再通入帶有飽和水汽之CO2,加熱反應器並調整CO2之流量與壓力,等 各反應參數到達設定值1 小時後,開始進行照光反應。 圖20 為純 TiO2觸媒照光時間與甲醇產率之關係。圖中為同一批TiO2觸媒在相同條 件下進行二氧化碳光催化還原,第一次照光(新鮮),發現初始甲醇產率非常大,而第二 次照光甲醇產率則為慢慢增加,推論為覆膜完畢之光纖在鍛燒過程表面殘留有機物,在 照光後脫附並參與反應,導致初始甲醇產率非常大。經過第一次照光反應,像是表面經 除汚後再進行第二次二氧化碳光催化還原,甲醇產率為慢慢增加,在經照光2-3 小時後 達到穩態(steady-state),之後每隔一小時偵測一次,取第 4-6 小時之甲醇產率平均,視為 該觸媒之甲醇產率代表。因此第一次照光反應可視為除汚前處理,第二次照光才是二氧 化碳光催化還原之真正初始反應。但也有可能在第一次照光時,覆膜觸媒表面的活性基 就被產物覆蓋,導致觸媒快速失活。 圖 21 為添加不同金屬之二氧化鈦觸媒在不同紫外光強度照之甲醇產率關係圖。結 果顯示當紫外光強度增加時,有助於 產率的提升。在光強度為 10W/cm2的初始反應下, 有添加Cu、Ag 及 Pt 等金屬之二氧化鈦觸媒皆比純二氧化鈦觸媒的光催化效率為大,以 添加1.0% Pt 的二氧化鈦觸媒影響最為顯著,甲醇產率為 4.45 µmole/g-cat..hr。其次為 1.0%-Ag/TiO2觸媒,甲醇產率為 4.12 µmole/g-cat..hr,及 1.2%-Cu/TiO2觸媒,甲醇產 率為3.80 µmole/g-cat..hr。光催化效率最差的純 TiO2,甲醇產率僅有2.28 µmole/g-cat.. hr。
如圖 6 順序之測試後,發現最後一組以光強度為 10W/cm2進行二氧化碳光催化還
原時,甲醇產率並非與初始反應(光強度為 10W/cm2)相等,而有些微下降的趨勢,此為
二氧化鈦觸媒之失活現象,以穩定度(stability)表示之(表 6)。由結果發現,光催化效率 較佳者如1.2%-Cu/TiO2、1.0%-Ag/TiO2及 1.0%-Pt/TiO2,其穩定度皆較純TiO2低。
圖 22 顯示使用添加不同金屬之二氧化鈦觸媒在不同滯留時間對甲醇產率的影響。
理論上,隨著滯留時間增長,生成物的產率應隨之增加,然而結果卻相反,甲醇的產率 反而下降。
表6: 紫外光強度對甲醇產率的影響 (a) 以觸媒重為基準計算
CH3OH production ratef (µmole/g-cat..hr) Catalyst 10W/cm2initial 6W/cm2 2W/cm2 10W/cm236h stability(%) g pure TiO2 2.28 1.74 0.54 1.61 70.6 1.2%-Cu/TiO2 3.80 2.46 0.79 2.07 54.5 1.0%-Ag/TiO2 4.12 1.87 0.54 2.48 60.2 1.0%-Pt/TiO2 4.45 2.41 0.81 2.45 55.1 (b) 以觸媒表面積為基準計算
CH3OH production ratef (µmole/cm2.hr) Catalyst 10W/cm2initial 6W/cm2 2W/cm2 10W/cm236h stability(%)g pure TiO2 0.016 0.012 0.004 0.011 68.8 1.2%-Cu/TiO2 0.021 0.014 0.004 0.012 57.1 1.0%-Ag/TiO2 0.021 0.009 0.003 0.012 57.1 1.0%-Pt/TiO2 0.027 0.015 0.005 0.015 55.6 f: 反應操作在滯留時間 5000 秒、反應器溫度 75℃、PCO2=1.19bar、PH2O=0.03bar g: CH3OH production rate 10W/cm236h / CH3OH production rate 10W/cm2initial
Irradiation time (hr) 0 2 4 6 8 10 CH 3 OH produ ct ion ra te ( µm ole/g -c at hr ) ‧ 0 2 4 6 8 10 12 14 16 18 20
first irraditaion (fresh) second irraditaion
Light intensity (W/cm2) 0 2 4 6 8 10 12 CH 3 OH pro duc tion rat e (µm ole/g -c at hr ) ‧ 0 1 2 3 4 5 pure TiO2 1.2%-Cu/TiO2 1.0%-Ag/TiO2 1.0%-Pt/TiO2 圖21: 紫外光強度對甲醇產率的影響 (滯留時間 5000 秒,反應器溫 度75℃,PCO2=1.19bar,PH2O=0.03bar)
space time (sec)
4000 5000 6000 7000 8000 9000 10000 11000 CH 3 OH produ ction rate ( µmole/g-cat hr ) ‧ 0.5 1.0 1.5 2.0 2.5 3.0 3.5 pure TiO2 1.2%-Cu/TiO2 1.0%-Ag/TiO2 1.0%-Pt/TiO2 圖 22: 滯 留 時 間 對 甲 醇 產 率 的 影 響 ( 光 強 度 6W/cm2, 反 應 器 溫 度 75 ℃ , PCO2=1.19bar,PH2O=0.03bar)
3.4 量子效率 利用光能進行光催化反應時,評估光觸媒活性的一個重要指標為量子效率(quantum efficiency, Φ ),其定義為一個光子可激發多少電子產生反應。在本實驗中,光催化還 原二氧化碳成一莫耳甲醇會有六莫耳電子轉移,量子效率的計算如下式:
( )
% = 6× 3 ×100 Φ catalyst by absorbed photon UV of mole rate production OH CH of mole efficiency quantum 其中,因為無法實際測得光纖上覆膜觸媒實際吸收到光子數,以測量反應器主體前 端( 經 光 源 之 光 纖 液 晶 導 管- 放 大 透 鏡- 石 英 玻 璃 窗 口 後 約 略 1cm 處 ) 紫 外 光 強 度 (74mW/cm2)轉換計算代替,並考慮兩種情形:第一為假設量得之光強度轉換成光子數後 皆可由觸媒吸收( Φ,照光面積為22π = 12.566cm2),第二為扣掉不銹鋼內件所阻擋掉 之光子數才可被觸媒吸收( Φ2,照光面積為2.702cm2)。每一光子的能量可由下式計算 λ C h E= 其中,h:6.6262×10-34J-sec/光子, C:3×108m/s, λ:3.65×10-7m 表7: 紫外光強度對量子效率的影響hTiO2 Catalyst pure TiO2 1.2%-Cu 1.0%-Ag 1.0%-Pt 10W/cm2initial 0.00017 0.00023 0.00022 0.00029 6W/cm2 0.00031 0.00035 0.00024 0.00037 2W/cm2 0.00028 0.00033 0.00020 0.00037 Φ 10W/cm236h 0.00012 0.00013 0.00013 0.00016 10W/cm2initial 0.00081 0.00107 0.00104 0.00136 6W/cm2 0.00144 0.00162 0.00110 0.00172 2W/cm2 0.00131 0.00155 0.00095 0.00172 Φ2 10W/cm236h 0.00057 0.00059 0.00062 0.00075 h: 反應操作在滯留時間 5000 秒、反應器溫度 75℃、PCO2=1.19bar、PH2O=0.03bar Φ: 照光面積為 12.566cm2, Φ2: 照光面積為 2.702cm2
將甲醇產率代入量子效率的計算式,經過計算後可得到M(Cu, Ag, Pt)/TiO2觸媒在
Ag 及 Pt 等金屬之二氧化鈦觸媒皆比純二氧化鈦觸媒的光催化效率為大,以添加 1.0% Pt 的二氧化鈦觸媒影響最為顯著,量子效率( Φ2)為 0.00136%。此外,添加 1.0% Pt 的二氧 化鈦觸媒,在光強度為6W/cm2的反應下,具有最大量子效率( Φ2)為 0.00172%。
表8: 滯留時間對量子效率的影響i
TiO2 Catalyst pure TiO2 1.2%-Cu 1.0%-Ag 1.0%-Pt 5000sec 0. 00031 0. 00035 0. 00024 0.00037 7500sec 0. 00023 0. 00028 0. 00021 0. 00029 Φ1 10000sec 0. 00019 0. 00024 0. 00019 0. 00023 5000sec 0.00144 0.00162 0.00110 0.00172 7500sec 0.00105 0.00130 0.00097 0.00134 Φ2 10000sec 0.00089 0.00113 0.00089 0.00108 i: 反應操作在光強度 6W/cm2 、反應器溫度75℃、PCO2=1.19bar、PH2O=0.03bar Φ1: 照光面積為 12.566cm2, Φ2: 照光面積為 2.702cm2 3.4.1 金屬改質效應 由於金屬的功函數(work function)較高,因此當金屬負載至二氧化鈦表面時,由於 要達到一致的Fermi level [22],二氧化鈦載體上的電子會流向負載的金屬。藉由負載金 屬吸收光激發電子,並同時快速地將電子轉移至反應物,可有效降低電子電洞再結合的 速率,進而提升光催化效率。本實驗中,添加Cu、Ag 及 Pt 等金屬改質二氧化鈦,期望 可增加二氧化碳光催化還原成甲醇的產率。 3.4.1.1 銅在 Cu/TiO2之價態與特性 在XRD 的檢測實驗,由於 Cu 的含量太低,並推測其顆粒極小且分散,因此在圖 8 的 1.2%-Cu/TiO2中觀察不到Cu 的繞射峰。由圖 17 之 Cu(2p) XPS 圖譜,觀察其最強波 峰出現位置,發現譜線有搖昇現象並且波形並非完全對稱,推測製備出的1.2%-Cu/TiO2 觸媒表面之Cu 主要價態為 Cu+,並含有少量Cu0。而XPS 的定量分析結果(表 4)顯示, 有部分Cu 集中分布在 TiO2表面。在過去的研究[23~25]裡,銅觸媒為 CO2氫化成甲醇的 反應中,最具活性及選擇性的觸媒,而 Cu+被認為是合成甲醇的活性位置[26,27]。本實 驗中,添加 Cu 改質二氧化鈦觸媒(1.2%-Cu/TiO2),在其表面的 Cu 主要價態為 Cu+,提 供合成甲醇的活性位置,有效提升了甲醇產率(圖 21)。
3.4.1.2 銀在 Ag/TiO2之價態與特性 在圖8 中,1.0%-Ag/TiO2的XRD 圖上同樣的觀察不到 Ag 的繞射峰,這是因為 Ag 的添加量僅有1.0 wt %,而也可能是因為 Ag 晶粒太小而觀察不到。由 Ag(3d)的 XPS 圖 譜(圖 18) 上最強波峰出現位置,推測 Ag 以金屬銀 Ago存在於1.0%-Ag/TiO2的觸媒表面。 Epifani 等人[28]提出,在 Ag/TiO2薄膜上的銀很容易接受電子被還原成 Ago。故在進行 光催化反應時,負載在TiO2上的Ag+容易接受一個電子還原成Ago,能更快速轉移電子, 扮演電子儲槽(electron-sink)的角色,提升光催化活性。 3.4.1.3 鉑在 Pt/TiO2之價態與特性 在製備 1.0%-Pt/TiO2覆膜液的過程,溶液的顏色較不同於其他兩者(1.2%-Cu/TiO2 及 1.0%-Ag/TiO2),最後甚至出現黑色沉澱物。雖然覆膜光纖是取上層澄清溶液,但為 了得知黑色沉澱物為何物,上層澄清溶液(1.0%-Pt/TiO2)與黑色沉澱物(1.0%-Pt/TiO2*)皆 經高溫處理成粉體,分別進行檢測。從圖 8 XRD 的圖譜中,1.0%-Pt/TiO2並無發現 Pt 的繞射峰,而1.0%-Pt/TiO2*明顯出現Pt 的繞射峰,推測添加的 Pt 大部分皆以金屬 Pt 沉 澱。 由圖19 Pt(4f)的 XPS 圖譜中,1.0%-Pt/TiO2無法觀察到成對Pt(4f) 的特性峰,這是 因為原本Pt 的添加量就不高,且由 XRD 的檢測結果可知,大部分的 Pt 皆沉澱在底部。 1.0%-Pt/TiO2*雖有成對的 Pt(4f) 的特性峰,但是相對強度(面積)並非為理論比值 3:4, 且譜線並不對稱,故推論有多種價態的Pt(4f)重疊。經由曲線擬合(curve fitting)後,譜線 中有三組 4f 特性峰,根據其束縛能推測 1.0%-Pt/TiO2覆膜液中的黑色沉澱物可能含有 Pt0,以及少量的 PtO2及微量的PtCl2。由 XPS 的定量分析結果(表 4)也可看出,大部分 Pt 集中分布在 1.0%-Pt/TiO2*表面。1.0%-Pt/TiO2粉體為淺灰棕色,1.0%-Pt/TiO2*粉體為 灰黑色,由顏色的表現上,也符合應為黑色的Pt 與 PtO2。雖然添加的Pt 大部分以 Pt0、 Pt2+及些許的Pt4+沉澱於底部,但是其上層澄清溶液覆膜之光纖光催化活性卻是最好的, 推測仍是有極少量的 Pt 以 Pt2+或 Pt4+存在覆膜液裡。在進行光催化反應時,Pt2+或 Pt4+ 會接受電子還原成Pt0[21],能轉移電子降低電子電洞再結合的速率,進而提升光催化效 率。Pt 的添加也可促進水分解成 H2,進而幫助二氧化碳氫化[29]。 由表4 的 XPS 定量分析結果中,O/Ti 的莫耳比皆比理論計算值 2 大,顯示表面含 有較多的吸附水分子或氫氧基存在 [17]。將束縛能 532.7eV 視為二氧化鈦表面 OH 基的 貢獻,也進行 XPS 定量,結果列於表 4。由圖 21 發現,以 1.0%-Pt/TiO2觸媒甲醇產率 的整體表現較佳,推測應是其觸媒表面具有較多的OH 基所致[30]。其他檢測如 BET 為 最大,能隙為最小,皆可能為1.0%-Pt/TiO2觸媒表現較其他觸媒為佳的原因。
3.4.2 影響二氧化碳光催化還原之因素 在進行二氧化碳光催化還原時,除了負載在二氧化鈦的金屬價態及表面OH 基量等 因素會影響產率外,入射光強度及滯留時間也是重要的影響因素。 3.4.2.1 紫外光強度效應 以改良式熱水解法製備出的一系列二氧化鈦觸媒,由圖10 紫外光-可見光吸收光譜 可得知,其起始吸收波長約在紫外光區的350nm 附近。對二氧化鈦的 anatase 晶相而言, 能隙理論值約3.2eV,本實驗製備出的二氧化鈦觸媒將吸收波長換算成能隙約為 3.5eV, 較理論值為大。圖 11 光纖橫截面 SEM 圖中顯示,覆膜在光纖上的觸媒層厚度僅約有 30nm,而用 XRD 特性峰的半高寬推算出的平均粒徑約為 15nm,因此推測是因為產生 量子效應(quantum effect)[31]導致能隙變大。在實驗中紫外光所扮演的角色為供應激發 光觸媒所需之能量,因此紫外光強度大小將影響觸媒的光催化活性。研究[29]指出,光 觸媒反應速率與紫外光強度有二種階數(regime)關係存在;於較低光強度下,屬於 1 級 階數(first-order)。光催化觸媒後產生的電子-電洞經化學反應所消耗的速率會大於電子電 洞對的再結合速率。而在較高光強度範圍時,階數則為 0.5(half-order),此時電子-電洞 的再結合反應將主導反應的進行。由圖 21 光強度與甲醇產率的關係圖發現,本研究中 二氧化碳光催化反應速率大約與光強度的一次方成正比,然而若將失活現象考慮進去, 則反應速率大約與光強度的 0.5 次方成正比。不管如何,隨著光強度的增加,二氧化碳 光催化還原的反應速率也隨之增加。 3.4.2.2 滯留時間效應 理論上,隨著滯留時間增長,生成物產率會隨之增加,最後當正逆向反應速率相當 時,才會達到反應平衡。圖 22 為滯留時間與甲醇產率的關係圖,結果顯示隨著滯留時 間的增長,甲醇的產率反而下降,推論可能原因有二,一為觸媒失活所造成,使用同一 觸媒進行不同滯留時間的測試時,必須同時考慮觸媒失活現象所導致甲醇產率的降低。 二為質傳阻力所造成,增加滯留時間即為降低反應物的流速,進而增加邊界層(boundary layer)厚度,導致質傳速度變慢。 為了測試觸媒是否有失活現象,在實驗完成後,再以光強度為 10W/cm2進行二氧 化碳光催化還原反應,如圖 6 之順序。實驗結果(表 6)顯示,甲醇產率比初始反應(光強 度為 10W/cm2)之產率為低,因此判定二氧化鈦觸媒有失活現象,以穩定度(stability)表 示。由結果發現,光催化效率越佳者,其穩定度越小,即失活的越快,其中以純 TiO2 觸媒穩定度最高。綜合甲醇產率與穩定度的表現,則以1.0%-Ag/TiO2最佳。 3.4.3 活性比較 近年來有許多學者皆致力於二氧化碳光催化還原的研究,有液相批式系統[24,30,32] 及汽相流動系統[3, 33],隨著照光時間的增加,甲醇產量也隨之增加,然而甲醇產率與
量子效率皆不高。本實驗中所使用的光纖反應器為改良林[33]之光纖反應器,為了增加 反應物在反應器內行走路徑進而增加與觸媒的接觸時間,在反應器內增加一隔板設計。 由於光在光纖內傳遞時會有強度衰減的現象,經過模擬計算後發現,光進到光纖內約 11cm 後,理論上強度已衰減為原來的 1% [20]。因此過長光纖的後段其實無法發揮功用, 於是本研究減短光纖長度,並增加光纖反應器內的光纖數。與林[33]之光纖反應器作一 比較列於表9。 選用林[33]研究結果中具最佳甲醇產率的觸媒(1.2%-Cu/TiO2),並沿用其反應操作 條件,做為本研究中的參考基準。將周[30]與林[33]之實驗結果,選擇其中活性最佳者 為代表與本研究作比較,整理列於表10。 結果顯示,本研究之甲醇產率皆高於周[30],推測其原因可能為:在液相系統中, TiO2觸媒以粉體形式存在於水溶液中,光源位於反應器中間,當光經過石英玻璃及水溶 液時,光強度遞減得更快;觸媒粉體間也可能會產生遮蔽效應,導致光在利用上並不理 想。另外,二氧化碳在水中的溶解度不高,反應物濃度比不上汽相系統中使用的高純度 二氧化碳,且水汽分壓也是影響反應速率的重要因素之一[33],水分子與二氧化碳間的 競爭吸附,導致甲醇產率皆較本研究為低。 本研究之甲醇產率皆高於林[33],推測其原因可能有二:一為光纖反應器的改良成 功,使反應物可與觸媒充分接觸,提升甲醇產率。二為覆膜在光纖上的觸媒層厚度較薄 (約 30nm)且具有許多奈米級孔隙,導致二氧化碳分子更容易擴散到觸媒層內部。由 XRD 檢測(表 2)與覆膜光纖表面之 SEM 圖(圖 13)的結果得知觸媒粒徑為 10-20nm,而圖 9 孔 徑分佈顯示觸媒粉體存在mesopore,主要孔徑約為 9nm,推論此應為晶粒之間的空隙。 因此,當光在光纖內以部分反射部分折射的方式傳遞時,折射光激發二氧化鈦產生的電 子-電洞對可以更容易且快速地傳遞到表面,光催化還原吸附在觸媒表面的二氧化碳分 子。 反觀量子效率,本研究與林[33]之結果大約相等,但卻皆較周[30]低了三個數量級, 最大的原因為無法測得觸媒實際吸收的光子數。周[30]之入射光強度是以實際測量值扣 掉不含觸媒之背景值,而本研究與林[33]則是直接以射進反應器內的光強度為基礎去估 算,實際經由光纖傳遞到觸媒並吸收激發反應的光子數並不知道,導致量子效率極低。 表9: 光纖反應器比較 直徑(cm) 長度(cm) 體積(cm3) 光纖數 隔板 林[33] 3 16 113 117 無 本研究 5 11 216 216 有
表10: 反應系統與甲醇產率及量子效率之比較 周[30] 林[33] 本研究 系統 液相批式 汽相流動 汽相流動 UVA 強度 (µW/cm2) 650 a 139×103b 74×103c CO2分壓(bar) 1.13 1.29 1.19 H2O 含量 (或分壓) 300g 0.0267bar 0.0284bar 觸媒製備法 溶凝膠法 熱水解法 熱水解法
TiO2觸媒 2.0%-Cu 1.2%-Cu TiO2 1.2%-Cu 1.0%-Ag 1.0%-Pt 甲 醇 產 率 (µmole/g-cat.hr) 0.86 0.4 2.28 3.80 4.12 4.45 量子效率Φ (%) 0.10 0.00029 d 0.00031d 0.00035 d 0.00024 d 0.00037 d a: UVA 偵測器距離光源 3cm 處,實際測量值扣掉不含觸媒之背景值 b: UVA 偵測器距離反應器石英玻璃視窗前(光源入射端)3cm 處 c: UVA 偵測器距離反應器石英玻璃視窗後(不銹鋼內件前端)1cm 處 d: Φ,假設量得之光強度轉換成光子數後全部被觸媒吸收 3.5 原位 FTIR 原位FTIR 偵測二氧化碳進行光催化反應,圖 23 是 2wt%Cu/TiO2觸媒以照UV 光前 為背景圖譜,觀察到在1421、1222cm-1等代表碳酸氫根有明顯的增加,1558cm-1代表吸 附於觸媒上的碳酸根有略微的增加,1342cm-1代表吸附於銅上的碳酸根,訊號強度也有 增加的趨勢;1645cm-1是二氧化碳彎曲振動有減少的趨勢。另外有些微弱增加的訊號包 括 1539、1403cm-1代表 HCOO 的增加;1618cm-1有 HCOOH 的訊號;1460、1114cm-1 代表H2COO 的物種;1508cm-1代表H2CO;1053cm-1代表CH3O-M 的訊號。2wt%Cu/TiO2 觸媒吸收強度比純TiO2觸媒強1.5 倍,2wt%Cu/TiO2多以碳酸根的形式吸附二氧化碳, 且碳酸根的訊號會把碳酸氫根的吸收訊號遮蔽住,使得觀察到的大多是碳酸根的訊號。 故推測有銅的參與使得較多的二氧化碳吸附轉換成碳酸根與碳酸氫根,並經由遷移
訊號成長,即是光反應產生的 H 原子會對二氧化碳進行還原反應的產物,包括甲酸鹽 類、甲酸、甲醛、甲醇與其他中間產物等。 2200 2000 1800 1600 1400 1200 1000 (a) (b) (c) (d) (e) (f) (g) Abs wavenumbers[cm-1] (h) 1222 1427 1558 1342 1645 0.05 1539 1403 1618 1460 1114 1508 1053 圖23: 紅外線偵測圖譜(2200-1000cm-1), 觸媒 2wt%Cu/TiO2照光 (a)10sec,(b)1min,(c)10min,(d)20min,(e)30min, (f)1hr,(g)1hr30min,(h)2hr 3.6 InNbxTa1-xO4 觸媒 所合成之InNbxTa1-xO4 (x= 1, 0.25, 0.5 ,0.75, 1) 觸媒及摻雜 Ni 之 In0.9Ni0.1TaO4觸媒 之XRD 圖譜如圖 24 所示。由圖 24 (a)及(e)可之所合成的 InNbO4 (與 JCPDS 83-1780 相 符) 與 InTaO4 (與 JCPDS 81-1196 相符) 顯示出良好之 wolframite 型層狀結晶結構。分析 結果並且發現,隨著摻雜Ta 量增加,位於 2θ 30.95o 之 (0 2 0)繞射峰強度增加並且往高 角度偏移。此現象並顯示所製得之InNbxTa1-xO4 (x= 1, 0.25, 0.5 ,0.75, 1) 觸媒樣品為結晶 良好的固熔體化合物而非相分離之混和物。比較圖24(e)及(f)可發現摻雜 Ni 之 InTaO4 之 繞射峰與InTaO4非常類似,僅 (0 2 0)繞射峰些許往小角度偏移,且並未觀察到 NiO 的 特徵峰,顯示Ni 應成功摻雜至 InTaO4結構內。
10 20 30 40 50 (a) (b) (c) (d) (e) (f) 2θ (deg.) In tens it y / arb. unit s
圖24: (a)InNbO4 (b) InNb0.75Ta0.25O4 (c) InNb0.5Ta0.5O4 (d) InNb0.25Ta0.75O4 (e) InTaO4 (f) In0.9Ni0.1TaO4 之 XRD 圖譜
圖 25 為 所 合 成 之 InNbxTa1-xO4 (x= 1, 0.25, 0.5, 0.75, 1) 觸 媒 及 摻 雜 Ni 之 In0.9Ni0.1TaO4觸媒之UV-vis 圖譜。當 InNbO4 之 Nb 被少量 Ta 取代時 (x=0.25)其 UV-vis 光吸收強度降低並且吸收邊緣略往紫外光區偏移 (圖 25 (a) 及 b))。但當 Ta 之取代量 x=0.5 時,UV-vis 之吸收強度增加且吸收邊緣往長波長偏移,當 Ta 之取代量 x=0.75 時 UV-vis
之吸收邊緣續往長波長偏移但吸收強度減小。InTaO4觸媒較含 Nb 之觸媒有更高的
UV-vis 吸收且其吸收邊緣位於可見光區,而鎳摻雜的 In0.9Ni0.1TaO4 觸媒有最高之 UV-vis 吸收。
300 350 400 450 500 550 600 Wavelength (nm) (F (R )* h ν) 1/ 2 a b c d e f
圖25: (a)InNbO4 (b) InNb0.75Ta0.25O4 (c) InNb0.5Ta0.5O4 (d) InNb0.25Ta0.75O4 (e) InTaO4 (f) In0.9Ni0.1TaO4 之 UV-Vis 圖譜
台大吳紀聖教授所提供的以溶膠凝膠法合成之 Cu/TiO2 觸媒及以含浸法製備之
Cu/P-25 觸媒為參考觸媒,與所合成之 InNbxTa1-xO4 (x= 1, 0.25, 0.5 ,0.75, 1) 觸媒及摻雜 Ni 之 In0.9Ni0.1TaO4觸媒之二氧化碳轉化成甲醇反應活性比較。實驗結果如表11 所列, 實驗結果顯示所合成之InNbxTa1-xO4觸媒活性均高於商用TiO2 (P-25)觸媒。其中,InTaO4 觸媒之光催化活性較 InNbO4觸媒高,此結果與 InMO4(M=Ta, Nb)觸媒之光催水分解活
性類似,這是因為InTaO4之導帶底部能階較InNbO4為負而提高了光激發電子之還原能
力[34]。反應測試結果並發現當 Ta 部分取代 InNbO4時 Nb 觸媒的反應活性略微降低,
但值得注意的是當 Ta 之取代量為 x=0.5 時,其反應活性遠高於 InNbO4觸媒及 InTaO4 觸媒。雖然InNb0.5Ta0.5O4觸媒活性尚低於台大吳紀聖教授所提供的sol-gel Cu/TiO2觸媒
但亦顯示出相當高之二氧化碳轉化成甲醇反應活性。故我們嘗試將InNb0.5Ta0.5O4觸媒進
表11:InNbxTa1-xO4 於 150 瓦汞光源照射下之 CO2 光催化還原反應之活性 觸媒樣品 產物之甲醇含量 (µmole/g-cat.) 觸媒樣品 產物之甲醇含量 (µmole/g-cat.) P-25 2.19 In0.9Ni0.1TaO4 6.6 InNbO4 9.3 1% NiO/InNb0.5Ta0.5O4 295.0 InNb0.75Ta0.25O4 5.9 1% Cu/InNb0.5Ta0.5O4 260.6 InNb0. 5Ta0.5O4 41.8 1% Cu/InNb0.5Ta0.5O4-C500 16.4 InNb0.25Ta0.75O4 6.2 1% Cu/InNb0.5Ta0.5O4-C500-R300 6.4
InTaO4 11.4 Sol-gel Cu/TiO2 67.6
1% Cu/P-25 6.6
由文獻報導可知摻雜鎳可提高 InTaO4之可見光應答並對其於可見光催化水分解反
應有極大之促進效果[11],故我們以固態反應法製備 Ni 摻雜之 In0.9Ni0.1TaO4觸媒,但結 果顯示,雖然 In0.9Ni0.1TaO4有最高之 UV-vis 吸收,其 CO2光催化還原反應之活性較未
添加 InTaO4低,這可能是由於添加鎳使 InTaO4觸媒的能隙降低而其導帶邊緣往正電位
移 動 而 降 低 光 催 化 還 原 反 應 進 行 的 驅 動 力 。 我 們 更 進 一 步 以 含 浸 法 製 備 1% NiO/InNb0.5Ta0.5O4觸媒,發現其CO2 光催化還原反應之活性較未添加 NiO 助觸媒時提高 了 7 倍以上。在文獻上 Kudo 等人曾報導[35]以含浸法製備之 NiO/NaTaO3高效能光觸
媒,NiO 在 NaTaO3顆粒表面形成奈米級的微粒,此NiO 奈米粒子有助於電子電洞分離
而 使 NaTaO3 之 水 分 解 光 催 化 活 性 大 幅 提 高 12 倍 以 上 。 在 本 實 驗 中 1% NiO/ InNb0.5Ta0.5O4之 XRD 圖譜與 InNb0.5Ta0.5O4類似(未列出),並未發現 NiO 繞射峰,顯示
所添加之NiO 粒子應該很小,以致無法由 XRD 圖譜觀測到。此微小的 NiO 助觸媒粒子 可促進光激發產生之電子電洞分離而大幅提高CO2光催化還原反應活性。此外,在CO2 光催化還原反應上 Cu 亦被發現是很好的助觸媒,可大幅提昇 TiO2 光觸媒之催化活性 [8]。在本實驗中,我們發現對於 InNb0.5Ta0.5O4 觸媒,Cu 亦是非常好的助觸媒,1% Cu/InNb0.5Ta0.5O4 光催化還原反應之活性較 InNb0.5Ta0.5O4提高了 6 倍以上。我們亦測試 了 前 處 理 對 Cu 添 加 之 InNb0.5Ta0.5O4 光 催 化 還 原 反 應 活 性 影 響 , 發 現 1% Cu/InNb0.5Ta0.5O4-C500及 1% Cu/InNb0.5Ta0.5O4-C500-R300觸媒活性遠低於未經過前處理 的1% Cu/InNb0.5Ta0.5O4觸媒。
四、結論
本研究以改良式熱水解法製備出一系列奈米級粒徑(10~20nm)的二氧化鈦光觸媒, 藉由浸漬覆膜法於光纖表面,觸媒層厚約26~33nm。以 216 根覆膜光纖之反應器進行流 動相之二氧化碳光催化還原反應,在光強度為10W/cm2、滯留時間為5000sec 的操作條 件下,1.0%-Pt/TiO2具有較高的甲醇產率 2.51 µmole/g-cat.hr。而由於在滯留時間為 5000sec 時,已達反應穩定狀態,因此增長滯留時間並無法有效提升甲醇產率。添加 Cu、 Ag 及 Pt 等金屬之二氧化鈦觸媒在整體表現上,以添加 1.0%Pt 金屬可大為提升甲醇產 率,但卻以純二氧化鈦觸媒具有較佳的穩定度。所合成之 InNbxTa1-xO4 (x= 1, 0.25, 0.5 ,0.75, 1) 觸媒及摻雜 Ni 之 In0.9Ni0.1TaO4觸媒之二氧化碳轉化成甲醇反應之活性,顯 示Ta 取代 InNbO4之Nb 可提高觸媒反應之活性,其反應活性較 InNbO4觸媒提高了47%, 亦較較InTaO4觸媒提高了10%。參考文獻
1. W. Choi, J. Y. Ko, H. Park, J. S. Chung, Appl. Catal. B: Environmental, 31 (2001) 209-220. 2. C.-F. Lo, J. C. S. Wu, J. Ch. Inst. Ch. Eng., 36(2) (2005) 119-125.
3. J. C. S. Wu, H.-M. Lin, C.-L. Lai, Appl. Catal. A: General, 296(2) (2005) 194-200.
4. Hoffmann, M. R., Martin, S. T., Choi, W. and Bahnemann, D. W., Chem. Rev. 95 (1995) 69. 5. Fujishima, A., Rao, T. N. and Tryk, D. A., J. Photochem. Photobiol. C 1 (2000) 1.
6. Zhang, Z., Wang, C. C., Zakaria, R. and Ying, J. Y., J. Phys. Chem. B 102 (52), (1998) 10871-10884
7. 曾怡享,奈米金屬氧化鈦觸媒光催化還原二氧化碳,國立台灣大學博士論文,第 217-219 頁,2003。
8. Tseng, I. H., Chang, W. C., Wu, J. C. S., Appl. Catal. B 37 (2002) 37..
9. Sugawa, S., Sayama, K., Okabe, K., Arakawa, H., Energy Convers. Manage. 36 (1995) 665. 10. Guan, G., Kida, T. and Yoshida, A., Appl. Catal. B 41 (2003) 387.
11. Zou, Z. G.,Ye, J. H.,Sayama, K. and Arakawa, H., Nature, 414 (2001) 625-627. 12. Sayama, K.,Arakawa, H. and Domen, K., 1996, Catal. Today, 28 (1996) 175-182. 13. Zou, Z.,Ye, J.,Sayama, K. and Arakawa, H., Chem. Phys. Lett., 343 (2001) 303-308. 14. I. H. Tseng, J. C. S. Wu, H.Y. Chou, Journal of Catalysis, 221 (2004) 432-440. 15. J. Yu, X. Zhao, Q. Zhao, Thin Solid Films, 379 (2000) 7-14.
16. 葉君棣,陳志堅合譯,X 射線光電子分光儀應用手冊,黎明書店 (1992),第 2-33 頁。 17. J. Yu, X. Zhao, Q. Zhao, Thin Solid Films, 379 (2000) 7-14.
18. W. Gao, J. Chen, X. Guan, R. Jin, F. Zhang, N. Guan, Catalysis Today, 93-95 (2004) 333-339.
19. I. M. Arabatzis, T. Stergiopoulos, M. C. Bernard, D. Labou, S. G. Neophytides, P. Falaras, Applied Catalysis B: Environmental, 42 (2003) 187-201.
20. H.G. Huang, T.C. Chu, J. C. S. Wu, and D.P. Tsai,中華民國物理年會,Taipei, Taiwan (2005).
21. J.C. Yang, Y.C. Kim, Y.G. Shul, C.H. Shin, T.K. Lee, Applied Surface Science, 121/122 (1997) 525-529.
22. W. D. Callister, Jr., Materials Science and Engineering, 6th Edition, John Wiley & Sons, Inc. 1994, p.w-1.
23. H. Y. Chen, S. P. Lau, L. Chen, J. Lin, C. H. A. Huan, K. L. Tan, J. S. Pan, Applied Surface Science, 152 (1999) 193-199.
24. I. H. Tseng, W. C. Chang, J. C. S. Wu, Applied Catalysis B: Environmental, 37 (2002) 37-48.
25. G. C. Chinchen, K. C. Waugh, D. A. Whan, Applied catalysis, 25 (1986) 101-107. 26. A. Fujishima, T. N. Rao, D. A. Tryk, Journal of Photochemistry and Photobiology C:
Photochemistry Reviews, 1 (2000) 1-21.
27. M. Anpo, H. Yamashita, Y. Ichihashi, S. Ehara, Journal of Electroanalytical Chemistry, 396 (1995) 21-26.
28. M. Epifani, C. Giannini, L. Tapfer, L. Vasanelli, Journal of the American Ceramic Society 83,10 (2000) 2385-2393.
29. S. B. Kim, S. C. Hong, Applied Catalysis B: Environmental, 35 (2002) 305-315.
30. 周欣穎,奈米 Ag/TiO2 觸媒進行二氧化碳光催化還原反應,國立台灣大學碩士論文, 2002,第 56-60 頁。
31. M. R. Hoffmann, S. T. Martin, W. Choi, D. W. Bahnemann, Environmental applications of semiconductor photocatalysis, Chemical Reviews, 95 (1995) 69-96.
32. 曾怡享,奈米金屬氧化鈦觸媒光催化還原二氧化碳,國立台灣大學博士論文,2003, 第217-219 頁。
33. 林宏明,以光纖反應器進行二氧化碳光催化還原,國立台灣大學碩士論文,2004, 第80-85 頁。
34. Zou, Z.,Ye, J. and Arakawa, H., Mat. Res. Bull. 36 (2001) 1185.
附件
研發成果資料表
日期:96 年 1 月 27 日 計畫名稱: 光催化還原方法減量溫室氣體 CO2 計畫主持人:吳紀聖 計畫編號: NSC 95-EPA-Z-002-007-期刊 Application of Optical-fiber Photoreactor for CO2
photocatalytic Reduction, Topics in Catalysis, revised 論文 研討會 技術報告 申請 獲得 專利 應用 與產業界、研發機 構互動成果 正在與工研院能環所洽談合作太陽能利用研究計畫。 可利用之產業 及 可開發之產品 技術特點 模擬人工光合作用,利用光能透過光纖光反應器,將 CO2 和 H2O 轉 化成甲醇。是一種生再生能源的技術。 推廣及運用的價值 ※ 本表若不敷使用,請自行影印使用。
![表 1: 高純度二氧化碳成份檢測[三福氣體]](https://thumb-ap.123doks.com/thumbv2/9libinfo/8776804.214150/9.892.144.747.148.421/表1高純度二氧化碳成份檢測三福氣體.webp)