行政院國家科學委員會專題研究計畫 成果報告
以 Dinitrosyl Iron Complex (DNIC)及紫質錯合物進行生
物系統一氧化氮偵測、生理系統訊號傳導、藥物設計研究--一氧化氮及一氧化氮鐵硫錯合物顯影與偵測(子計畫
三)(3/3)
研究成果報告(完整版)
計 畫 類 別 : 整合型 計 畫 編 號 : NSC 100-2627-M-009-002- 執 行 期 間 : 100 年 08 月 01 日至 101 年 08 月 31 日 執 行 單 位 : 國立交通大學生物科技學系(所) 計 畫 主 持 人 : 王雲銘 計畫參與人員: 碩士級-專任助理人員:許光美 碩士班研究生-兼任助理人員:林谷奎 博士班研究生-兼任助理人員:吳啟銘 博士班研究生-兼任助理人員:陳彥豪 博士後研究:薛存洧 公 開 資 訊 : 本計畫可公開查詢中 華 民 國 101 年 09 月 21 日
中 文 摘 要 : 本實驗室設計合成了兩種一氧化氮的探針,利用不同的方式 將其本身的螢光性質抑制,在與一氧化氮反應之後,使兩種 探針的螢光性質再度顯現出來,並且不受到其他具有活性的 含氧物質所影響。目前 Rhodamine-H 及 FA-OMe 兩探針已完 成了光物理性質、穩定度、特異性、細胞存活率以及細胞內 之一氧化氮螢光影像研究,上述研究之結果顯示這兩探針為 有效的一氧化氮探針,並且極具應用於生物體內之潛力。 中文關鍵詞: 一氧化氮、探針、螢光染料 英 文 摘 要 : 英文關鍵詞:
行政院國家科學委員會補助專題研究計畫
□期中進度報告
□期末報告
以 Dinitrosyl Iron Complex (DNIC)及紫質錯合物進行生物系統一氧
化氮偵測、生理系統訊號傳導、藥物設計研究—一氧化氮及一氧化
氮鐵硫錯合物顯影與偵測
計畫類別:□個別型計畫 □整合型計畫
計畫編號:NSC100-2627-M-009-002-
執行期間:2011 年 8 月 1 日 至 2012 年 7 月 31 日
執行機構及系所:
計畫主持人: 王雲銘
共同主持人:
計畫參與人員:薛存洧、許光美、吳啟銘、陳彥豪、林谷奎
本計畫除繳交成果報告外,另含下列出國報告,共 ___ 份:
□移地研究心得報告
□出席國際學術會議心得報告
□國際合作研究計畫國外研究報告
處理方式:除列管計畫及下列情形者外,得立即公開查詢
□涉及專利或其他智慧財產權,□一年□二年後可公開查詢
中 華 民 國 101 年 9 月 21 日
2
一、中文摘要
本實驗室設計合成了兩種一氧化氮的探針,利用不同的方式將其本身的螢光 性質抑制,在與一氧化氮反應之後,使兩種探針的螢光性質再度顯現出來,並且 不受到其他具有活性的含氧物質所影響。目前 Rhodamine-H 及 FA-OMe 兩探針 已完成了光物理性質、穩定度、特異性、細胞存活率以及細胞內之一氧化氮螢光 影像研究,上述研究之結果顯示這兩探針為有效的一氧化氮探針,並且極具應用 於生物體內之潛力。 關鍵詞:一氧化氮、探針、螢光染料 Abstract:We designed and synthesized two different nitric oxide probes with different fluorescence quenching properties. Fluorescence of all probes restored after reacting with nitric oxide, and the result is not influenced by other reactive oxygen species. For Rhodamine-H and FA-OMe, we have already studied the photophysical properties, pH stability, selectivity, cell viability, and cell images. These results demonstrated that these two probes are good nitric oxide probes and can be applied in biological system potentially.
Keywords:nitric oxide, probe, fluorescent dye
二、前言
分子影像技術是以光學(optical)、磁振(magnetic resonance)或伽馬(γ) 造影方式來觀察生物體基因或細胞生理變化之科技 1 。上述的幾種方式中,共通 的特性是均屬於非侵入性的技術。在分子影像領域中,一氧化氮(nitric oxide) 的分子影像是個相當值得研究的題目 2-10 ,由於一氧化氮在近二十年來受到廣泛 的研究,科學家發現一氧化氮是人體內許多重要生物作用的媒介,其在生理上也 扮演著許多重要的角色。特別是在於訊息傳導方面,一氧化氮是哺乳動物體內重 要的訊息傳遞分子,影響哺乳動物的生理作用甚劇。近年來有許多和一氧化氮相 關的病變已經被探討,因此觀察一氧化氮在活體內的表現,在醫學診斷及治療上 將有有極大的幫助。三、研究目的
為了得到一氧化氮的分子影像,我們選擇了螢光的方法去進行一樣化氮的偵 測, 因為螢光方法是一種非侵入性的方法且具有極高的靈敏度,可以在極微量 的狀態下產生極明顯的變化。本研究目的在針對先前合成出之一氧化氮螢光探針 Rhodamine-H 及 FA-OMe 進行更深入研究,其中包括了解其光物理性質、穩定性、3 對一氧化氮之特異性 、 與一氧化氮反應後螢光訊號與一氧化氮濃度之相關性以 及外生性與內生性之一氧化氮細胞影像,評估這兩探針在生物體內偵測一氧化氮 之應用性。此外,我們也嘗試合成新的一氧化氮螢光探針,藉由一氧化氮的存在 與否來調控螢光。
四、文獻探討
在 2010 年 Jinli Yuan 等人 11 合成出 bis(2,2-bipyridine)(4-(3,4-diamino-phenoxy)- 2,2-bipyridine) ruthenium(II) hexafluorophosphate ([Ru(bpy)2(dabpy)]2+)此一 Ru(II) 錯合物偵測 NO,如下圖所示。利用其結構上兩個鄰位的 amino group 與 NO 反應,形成一個三氮五元環。而[Ru(bpy)2(dabpy)]2+本身是螢光的強度是很低的, 與 NO 反應之後,形成[Ru(bpy)2(T-bpy)]2+,螢光的強度明顯得上升。此探針在 pH > 5 的環境中能保持螢光性質的穩定,同時具有極佳的水溶性,作者也將此探 針應用於細胞當中,成功的獲得動物細胞外生性一氧化氮影像以及植物細胞內生 性一氧化氮影像。 同年,Jason B. Shear 等人12合成出 NO550此螢光探針來偵測一氧化氮,如下圖 所示。NO550本身不具有螢光,但在與一氧化氮反應後造成原本結構上多生成了 一個環而形成 AZO550,此產物則具有極佳的螢光性質。此探針對一氧化氮具有 極佳的選擇性,此外其螢光強度與一氧化氮之濃度呈現性關係,提供了對一氧化 氮進行定量的可能性。作者也利用此探針成功獲得神經細胞內一氧化氮之影像。
4
同年,Dan Yang 和 Tao Peng13合成出 HKGreen-3 用來偵測過氧亞硝酸鹽,如下
圖所示。HKGreen-3 本身螢光極低,與過氧亞硝酸鹽反應過後導致官能機內部環 化進而斷鍵,使探針呈現高強度的螢光並且能做到定量的線性關係。作者也將此 探針應用於巨噬細胞,達到成功偵測過氧亞硝酸鹽的目的。
2011 年,Keli Han 等人 14 將 Selenium 接在近紅外光的染劑上,利用 PET
(photoinduced electron transfer)原理將螢光抑制,與過氧亞硝酸鹽反應後不再具有 PET 效應而呈現高強度螢光。此時可再利用 glutathione 達到還原的效果,作者也 成功將此探針用於細胞實驗。
5
五、研究方法
Rhodamine B hydrazide(RH)、Fluoresceinamine 及 FA-OMe 與一氧化氮反應之
產物分析 2-Amino-3',6'-bis(diethylamino)spiro[isoindole-3,9'-xanthene]-1-one (Rhodamine B hydrazide, RH)之合成 O O N N O O N N N NH2 O NH2NH2 absolute ethanol
Rhodamine B base Rhodamine B Hydrazide (RH)
本合成方式乃參考文獻15並加以修飾。取 7.2 克 rhodamine B base 溶於 180 毫升
之絕對乙醇中,於室溫及氮氣環境下,取 18 毫升之 hydrazine 於一小時中將其慢 慢滴入至劇烈攪拌的 rhodamine B base 溶液中。待 hydrazine 完全滴入後,將上 述混和溶液置於油浴中加熱迴流反應 7 小時,該溶液之顏色由暗紅色轉為亮橘色。 待溶液冷卻後,將溶劑以減壓濃縮機移除後加入 300 毫升之 1M 鹽酸溶解殘留物, 再利用 1M 之氫氧化鈉水溶液將前述溶液之 pH 值調整到 9.5,此時會有沉澱物產 生。過濾該沉澱物並用 10 毫升的二次去離子水清洗沉澱物 5 次,將沉澱物以真 空乾燥後再利用乙腈/水體積比 1/1 之溶液進行再結晶。乾燥後得產物 4.8 克, 產 率 67.0% 。 ESI-MS, m/z 457.1 ([M+H]+), M+ calculated 456.2. 1H NMR (DMSO-d6) = 7.76 (m, 1H, ArH), 7.46 (m, 2H, ArH), 6.98 (m, 1H, ArH), 6.37–6.32 (d, 6H, xanthene-H), 4.27 (s, 2H, NH2), 3.32 (q, 8H, NCH2CH3), 1.07 (t, 12H, NCH2CH3); 13C NMR (DMSO-d6) = 12.46, 43.7, 64.76, 97.42, 105.46, 107.79, 122.16, 123.51, 127.72, 128.12, 129.63, 132.39, 148.11, 151.9, 153.04, 165.29.
5-Amino-2-(6-hydroxy-3-oxo-3H-xanth-en-9-yl)benzoic acid methyl ester (FA-OMe)之合成 O O OH COOH NH2 O O OH COOMe NH2 Fluoresceinamine FA-OMe MeOH, Conc.H2SO4 本合成方式乃參考文獻16並加以修飾。取 200 毫克之 fluoresceinamine 溶於 10 毫升的甲醇之中,並加入 0.2 毫升之濃硫酸,將此溶液加熱迴流反應 48 小時。 待溶液冷卻後倒入至 300 克的冰塊中,以飽和的碳酸氫鈉水溶液慢慢滴入直到 pH 值達 6.5,可得到橘色的沉澱物。以離心方式將沉澱物分離後,進一步使用薄 板層析(TLC)技術,以甲醇與二氯甲烷比例 1 比 12 之溶液作為沖提液進行純化分 離,經真空乾燥後得產物 184 毫克,產率 88.5%。 ESI-MS: m/z 362.1 ([M + H]+ ),
6 M+ calculated 361.1. 1H NMR (DMSO-d6): = 7.30 (s, 1H), 7.00 (d, J = 9.0 Hz, 1H), 6.90 (d, J = 9.0 Hz, 1H), 6.77(d, J= 9.0 Hz, 2H), 6.30 (d, J= 9.0 Hz, 2H), 6.23 (s, 2H), 5.81 (br s,2H), 3.49 (s, 3H);13C NMR (DMSO-d6): = 178.4, 166.2, 157.3, 152.9, 149.7, 131.5, 130.8, 129.8, 122.8, 120.7, 117.0, 114.7, 111.1, 103.1, 51.9. FA-OMe 與一氧化氮反應之產物分析 取 30 毫克之 FA-OMe 溶於 100 毫升 pH 值為 7.4 的 HEPES 緩衝溶液之中, 在室溫且含氧的環境下通入 10%的一氧化氮氣體,利用 TLC 板確認所有的 FA-OMe 消耗完後停止反應,利用減壓濃縮將溶劑移除後再以 TLC 純化殘留物 (甲醇與二氯甲烷體積比為 1 比 10 之溶液作為沖提液)。真空乾燥後經鑑定得知 主 要 產 物 為 2-(6-hydroxy-3-oxo-3H-xanthen-9-yl)benzoic acid methyl ester (dA-FA-OMe)。產率 78.0%。 ESI-LRMS: m/z 347.1 ([M+H]+), M+ calculated 346.1. EI-HRMS: m/z 346.0836 (M+), M+ calculated 346.0841. 1H NMR (DMSO-d6): δ = 8.12 (d, J = 7.8 Hz, 1H), 7.80 (dd, J = 7.5 and 7.8 Hz, 1H), 7.71 (dd, J= 7.5 and 7.8 Hz, 1H), 7.40 (d, J = 7.5 Hz, 1H), 6.59 (d, J= 9.0 Hz, 2H), 6.30 (m, 4H), 3.54 (s, 3H);13C NMR (DMSO-d6): δ = 178.7, 165.5, 157.2, 151.3, 134.8, 132.7, 130.7, 130.3, 129.8, 129.5, 129.3, 123.2, 110.3, 103.4, 52.2. 一氧化氮水溶液之製備17 由於氧氣會快速地使 NO 氧化成 NO2,故製備 NO 水溶液所使用之器材與二 次去離子水均先以超高純度氬氣持續通入 30 分鐘以上以去除氧氣。配製 100 毫 升之飽和 sodium nitrite 水溶液以及 150 毫升之 2 M H2SO4水溶液,當 H2SO4水溶液 滴入到 sodium nitrite 水溶液時會產生 NO 以及 NO2,因此將產生之氣體先導入 30 % 的氫氧化鈉水溶液以去除 NO2,最後通入到 10 毫升維持在 20 ± 0.1 ℃的二 次去離子水中,並持續 30 分鐘以獲得 NO 飽和水溶液(1.8 mM)。每次實驗都採 用新配製的 NO 飽和水溶液,並且在使用前該水溶液都保存在充滿 NO 環境的密 閉瓶中,NO 飽和水溶液的濃度均以 Griess method 進行測定。裝置如圖所示:
螢光性質之分析
本研究中所有螢光光譜之測定採用 Hitachi F-7000 型螢光光譜儀,量測溫度 為攝氏 25.0 ± 0.1℃,光電倍增管之設定電壓為 500 伏特,使用四面拋光之石英
製比色槽盛裝。 螢光量子產率之測定乃利用 fluorescien 溶於 0.1 M NaOH(aq)作為
7
unk = std (Iunk/Aunk)(Astd/Istd)(unk/std)2
其中unk表示待測物的螢光量子產率;std表示標準品的螢光量子產率,此處使
用的標準品為溶於 0.1 M NaOH(aq)之 fluorescein,std = 0.95;Iunk及 Istd分別表示
待測物及標準品的螢光發射強度的積分值;Aunk及 Astd分別表示待測物及標準品
的於激發波長位置的莫耳吸收度;unk及std分別表示待測物溶液及標準品溶液
所用溶劑的折射率。
pH 穩定度之研究
Rhodamine B hydrazide(RH)及 rhodamine B(RB)之穩定度
配製 50 M 的 RH 及 RB 溶液(100 mM HEPES,20% CH3CN),以 HCl(aq)及
NaOH(aq)調整 pH 值,使其 pH 範圍由 4 至 12。RH 及 RB 在各個不同 pH 值下的
螢光強度於溶液配製兩小時後進行測定。
FA-OMe、dA-FA-OMe 及 fluoresceinamine 之穩定度
分別配製 20 mM 的 FA-OMe、dA-FA-OMe 及 fluoresceinamine 溶液(100 mM
HEPES),以 HCl(aq)及 NaOH(aq)調整 pH 值,使其 pH 範圍由 6 至 10。FA-OMe、
dA-FA-OMe 及 fluoresceinamine 在各個不同 pH 值下的螢光強度於溶液配製兩小 時後進行測定。
選擇性之研究
選擇性研究中所使用的各種活性氧化物(reactive oxygen species)及活性氮化
物(reactive nitrogen species)如下:NO 來自上述之 NO 水溶液;NO2來自 NaNO2
水溶液;NO3來自 NaNO3水溶液;H2O2來自 30%的 H2O2水溶液,濃度藉由 UV/Vis
光譜儀定量(A240nm = b[H2O2], = 43.6 M1 cm1,b = 1 cm)18;HNO 來自 Angeli’s
salt 之 10 mM NaOH 溶液,濃度藉由 UV/Vis 光譜儀定量(A237nm = b[HNO], =
6100 M1 cm1,b = 1 cm)19;OH∙來自[Fe(NH
4)2(SO4)2‧6H2O]與 H2O2反應生成
20;ONOO來自 ONOONa 之 0.3M NaOH 溶液,濃度藉由 UV/Vis 光譜儀定量
(A302nm = b[ONOO], = 1670 M1 cm1,b = 1 cm)21。 細胞毒性之研究 Rhodamine b hydrazide(RH)在不同時間之細胞存活率 以 96 孔盤培養 Raw264.7 巨噬細胞至細胞密度達每孔 105個細胞後,將 5 M 的 RH(2.5% DMSO) 於 37℃下與細胞分別培養 2、4、8 及 12 小時,將上清液移除 後 再 以 PBS buffer 清 洗 細 胞 三 次 。 加 入 3-(4,5-dimethylthiazol-2-yl)2,5-diphenyltetrazoilum bromide (MTT) (20 L, 5 mg mL1)到每孔中,經過四小時的培養後,加入 100 L DMSO 到細胞中,並將 96 孔盤置於震盪器震盪 5 分鐘以呈色。利用 ELISA 讀取細胞在波長 570 nm 下的吸 收值。未加入 RH 的對照組將其細胞存活率定為 100%,並針對與 RH 共同培養 2、4、8 及 12 小時的各組分別計算其細胞存活率。 FA-OMe 之細胞毒性 以 96 孔盤培養 Raw264.7 巨噬細胞至細胞密度達每孔 105個細胞後,將不同 濃度的 FA-OMe 於 37℃下與細胞分別培養 24 小時,將上清液移除後再以 PBS
8
buffer 清洗細胞三次。加入 3-(4,5-dimethylthiazol-2-yl)2,5-diphenyl tetrazoilum
bromide (MTT) (20 L, 5 mg mL1)到每孔中,經過四小時的培養後,加入 100 L DMSO 到細胞中,並將 96 孔盤置於震盪器震盪 5 分鐘以呈色。利用 ELISA 讀取 細胞在波長 570 nm 下的吸收值。未加入 FA-OMe 的對照組將其細胞存活率定為 100%,並針對與不同濃度 FA-OMe 共同培養的各組分別計算其細胞存活率。 細胞之培養與一氧化氮之細胞影像之研究 將 Raw 264.7 細胞置於培養皿中以含有 10 % (v/v)胎牛血清、1% sodium pyruvate 及 1% MEM 的 DMEM 培養液培養細胞,再將細胞放入細胞培養恆溫箱
中,維持 37°C 及 5% CO2,每隔一至兩天更換一次培養液。 RH 對 NO 之細胞影像研究 外生性一氧化氮之偵測: 將 Raw264.7 細胞與 5 M RH 一起培養 4 小時後,以 PBS buffer 清洗細胞三 次,再將細胞以含有 375 M SNAP 的 DMEM 培養基培養細胞 2 小時,將細胞 以 PBS buffer 清洗乾淨後,以螢光顯微鏡觀察。 內生性一氧化氮之偵測: 將 Raw264.7 細胞與 1 g mL1的 lipopolysaccharide(LPS)一起培養 4 小時, 以誘導巨噬細胞內的 inducible nitric oxide synthase 活化進而催化一氧化氮的形成,
以 PBS buffer 清洗細胞三次,再將受 LPS 刺激過的細胞與 5 M RH 分別培養 2、 4、6、8 小時,將細胞以 PBS buffer 清洗乾淨後,以螢光顯微鏡觀察。在抑制 iNOS 活性的實驗中,Raw264.7 細胞先與 1 mM 的 NG-nitro-L-Arginine(L-NNA,iNOS 的抑制劑)培養 1 小時,再與 1 g mL1的 lipopolysaccharide (LPS)一起培養 4 小 時,最後與 5 M RH 培養 8 小時。 FA-OMe 對 NO 之細胞影像研究 內生性一氧化氮之偵測: 將 Raw264.7 細胞與 0.5 g mL1的 lipopolysaccharide(LPS)一起培養 4 小時, 以誘導巨噬細胞內的 inducible nitric oxide synthase 活化進而催化一氧化氮的形成, 以 PBS buffer 清洗細胞三次,再將受 LPS 刺激過的細胞與 10 M FA-OMe 分別培 養 4 小時與 8 小時,將細胞以 PBS buffer 清洗乾淨後,以螢光顯微鏡觀察。 FA-OMe 擴散/區域化之研究: 將 Raw264.7 細胞先與 1.25g mL1 LPS 培養 4 小時後,再與 M FA-OMe 培養 8 小時,將細胞以 PBS buffer 清洗乾淨後,以螢光顯微鏡觀察。在 螢光顯微鏡觀察的過程中,每隔 10 分鐘用 2 mL PBS buffer 沖洗細胞三次。
六、結果與討論
本實驗室成功合成出 Rhodamine-H 及 FA-OMe 兩種一氧化氮的探針,其 螢光性質以及與一氧化氮反應之探討如下:9 RH 與一氧化氮反應產物之分析及其反應機制之推測 為了解 RH 與一氧化氮反應後所形成的產物為何,將 RH 溶於乙腈之中並 通入 10%的一氧化氮氣體,反應過程中可明顯觀察到容易顏色由透明無色轉變為 粉紅色。利用管柱層析將產物分離,經鑑定後確定產物為 rhodamine B (RB)。推 測 RH 與 NO 之反應機制如 Scheme 1 所示,首先 NO 先與 O2反應生成 NO2,NO2
再與 NO 本身反應生成 N2O322,接著 N2O3與 RH 上的 hydrazide amino group
(NNH2)反應造成 RH 亞硝基化(NHNO),原本受到亞硝基化的 amino group
經過電子的轉移及質子的參與轉而形成 diazonium group (N2),當 diazonium
group 轉化成含有 azide (N3)的中間產物時,原本的五元環也隨之打開,最後轉
化成產物 RB。
Scheme 1 Proposed mechanism of reacting RH with NO under aerobic condition
RH 及 RB 的光譜性質具有相當大的差別,RH 的 UV/Vis 吸收光譜在 320 nm 處有微弱的吸收峰,在 450 nm 到 650 nm 處沒有任何吸收峰;RB 則是在 560 nm 處有很強的吸收峰(Figure 1a)。另外 RH 在螢光光譜上沒有任何的螢光訊號;RB 則是在 580 nm 處有明顯的螢光訊號(Figure 1b)。由此可知原本無色、非螢光的 RH 與一氧化氮反應後會形成粉紅色、具螢光的 RB。
10
Figure 1. (a) The absorption spectra of RH (dash line) and RB (solid line) and (b) the
fluorescence spectra of RH (dash line) and RB (solid line)
RH 及 RB 的穩定度研究 一氧化氮螢光探針受其所處環境之 pH 值影響的程度關係到其生物應用性, 若該螢光探針會因周遭的 pH 值而造成螢光訊號的改變,將會影響一氧化氮偵測 結果。RH 及 RB 的 pH 穩定的研究結果如 Figure 2 所示。在 pH 值 4-12 範圍中 幾乎觀察不到 RH 的螢光訊號,表示 RH 在此 pH 範圍中並不會受到環境酸鹼度 的影響而形成具有螢光的產物,而在 pH 4 的環境下可以觀察到有些微的螢光 產生,且溶液顏色呈現淡粉紅色,此結果乃是由於 pH 4 的酸性環境造成 RH 上的五元環開環所致23。相對地,RB 在 pH 值 412 範圍中則是觀察到其螢光訊 號維持相當穩定,表示當 RH 與一氧化氮反應後生成的 RB 並不會因周遭環境的 酸鹼度而造成螢光訊號的下降或熄滅(quench)。由以上結果顯示不論是 RH 或其 與一氧化氮反應後的產物 RB 在 pH 值 412 範圍中具有高度的穩定性,證明 RH 在生理環境中相當穩定且具有在生物體內偵測一氧化氮的應用潛力。 Figure 2. ) and RB () in 100 mM HEPES buffer with 20% CH3CN at 25.0 ± 0.1℃. The fluorescence intensities
11 RH 與一氧化氮反應之時間及濃度效應 為了解 RH 偵測一氧化氮的能力,我們針對 RH 與不同濃度的一氧化氮反應 後其反應時間與螢光強度上升情形進行探討,其結果如 Figure 3a 所示。將 50 M RH 溶液在 25.0 ± 0.1℃環境下分別與 0.2、0.4、0.6、0.8 及 1.0 當量的一氧化氮 反應後,發現隨著反應時間的增加,溶液在 583 nm 處的螢光強度也跟著增加, 並且在約莫 25 分鐘後螢光強度達到持平不再上升的狀態。估計此時溶液中的 RH 與一氧化氮反應已經結束,具螢光性質的 RB 已不再產生,因而螢光強度達到持 平的狀態。將 RH 溶液與一氧化氮反應 30 分鐘後量測該溶液的螢光光譜,其結 果如 Figure 3b 所示,可以明顯看見溶液的螢光強度隨著加入的一氧化氮當量數 增加而增加。將溶液螢光強度對一氧化氮的當量數作圖,發現兩者具有相當良好 的線性關係,如 Figure 3c 所示。
Figure 3. (a) Time-dependent fluorescence spectra obtained when various equivalents of
NO(aq) were added to a 50 M RH solution (in 100 mM HEPES with 20% CH3CN at pH
7.4) at 25.0 ± 0.1 ℃ (ex = 510 nm, em = 583 nm); (b) concentration-dependent
fluorescence spectra based on the intensities at 25 min as shown in (a); and (c) fluorescence intensities upon various equivalents of NO(aq) based on (b).
利用螢光強度對一氧化氮當量數作圖所得到的校正曲線經由下列公式可進
一步獲得 RH 對一氧化氮的偵測極限(limit of detection, LOD)24:
LOD = Xbi + 3Sbi
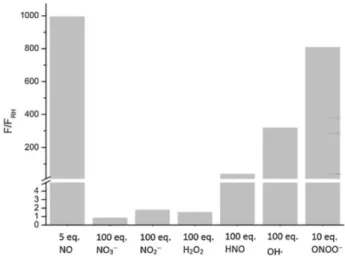
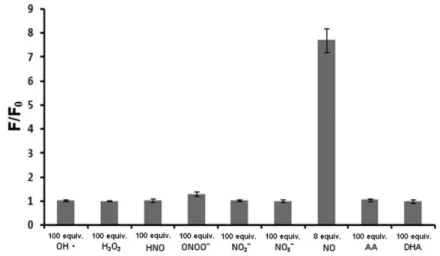
12 由上述公式得 RH 對一氧化氮的偵測極限是 20 nM。以上結果顯示 RH 與一氧化 氮反應後所產生的螢光強度與一氧化氮的當量數具有高度的線性關係,表示 RH 極具對一氧化氮進行定量分析的潛力。 RH 對一氧化氮之選擇性研究 為了評估 RH 是否能作為對一氧化氮具有特異性的探針,本研究中亦針對 RH 對於一氧化氮以及其他可能與一氧化氮競爭的活性氧化物或活性氮化物的選 擇性進行探討。將 RH 分別與 5 當量的 NO;10 當量的 ONOO−;100 當量的 H2O2、
NO3−、NO2−、HNO、OH∙反應 1 小時後的螢光強度結果如 Figure 4 所示。在 RH
與 5 當量的 NO 反應後,溶液螢光強度上升 994 倍;在 RH 分別與 100 當量的
H2O2、NO3−、NO2−及 HNO 反應後,發現溶液的螢光強度明顯低於 RH 與 5 當量
NO 反應後的螢光強度;就 RH 與 NO 及 OH∙反應 1 小時後的結果而言,OH∙的 濃度是 NO 的 20 倍,但其所造成的螢光增強度只有 NO 的 32%;就 RH 與 NO
及 ONOO−反應小時後的結果而言,當量的 ONOO−所造成的螢光增強度是 5
當量 NO 的 81%。由以上結果發現當環境中 NO 與 ONOO−同時存在的時候,RH
對 NO 的偵測結果似乎會受到 ONOO−的影響。然而在生物體中 ONOO−是由 NO
與 O2−反應而生成25,又因 O2−會被 superoxide dismutase (SOD)清除,最終有效
抑制 ONOO−的產生。因此利用 RH 進行細胞或是生物體內一氧化氮的偵測時,
基本上不會受到 ONOO−的影響。
Figure 4. Specificity of RH for NO over other reactive nitrogen and oxygen species.
Fluorescence responses of RH were determined in the absence (FRH) and presence (F) of
following substances: 5 equiv. NO, 100 equiv. NO3 −
, NO2 −
, H2O2, HNO (Angeli’s salt),
OH∙, and 10 equiv. ONOO−. All data were measured after 1 h addition reactive nitrogen/oxygen species at 25.0 ± 0.1℃.
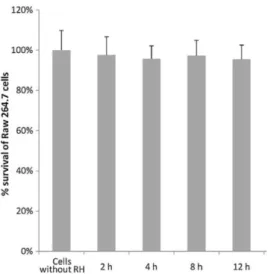
13 一氧化氮在細胞中的螢光影像研究 為了要獲得在細胞中外生性以及內生性一氧化氮的螢光影像,首先必須先確 認使用的 RH 濃度不會造成細胞的死亡。在本研究中發現使用 5 M 的 RH (2.5% DMSO 作為助溶劑)與 Raw 264.7 巨噬細胞培養 12 小時後,不會對該細胞的存活 率造成影響,其結果如 Figure 5 所示。根據此細胞存活率的結果,在進行一氧化 氮之細胞螢光影像研究時所使用的 RH 濃度為 5 M。
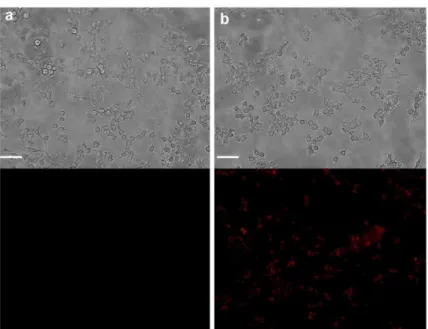
Figure 5. Cell viability with different incubation time (5 M RH in 2.5%, v/v DMSO). Left to right: Raw 264.7 cells without RH and incubated with RH for 2, 4, 8, and 12, respectively. 針對外生性一氧化氮之細胞螢光影像研究中,先將 Raw 264.7 細胞與 5 M 的 RH 培養 4 小時後,再將含有 RH 的細胞與一氧化氮的釋放試劑 SNAP 一起培養 2 小時,最後以螢光顯微鏡觀察細胞,其結果如 Figure 6 所示。由 Figure 6a 可以 觀察到在不含 SNAP 的對照組中,其螢光影像結果看不到有紅色的螢光訊號。相 較於對照組,在含有 SNAP 的實驗組 Figure 6b 中可以觀察到細胞中產生很明顯 的紅色螢光。此結果表示在細胞內的 RH 偵測到了 SNAP 所釋放的一氧化氮並與 之反應,進而生成了具有螢光性質的產物 RB,造成在螢光顯微鏡下可以觀察到 細胞內有明顯的紅色螢光訊號。同時此結果也顯示 RH 在細胞中可以成功地獲得 外生性一氧化氮的螢光影像。
14
Figure 6. Exogenously generated NO detection in Raw 264.7 macrophage cells by RH.
Bright-field (up) and fluorescence (down) images of the RH-deposited Raw 264.7 cells in the absence (a) and presence (b) of SNAP. The scale bar represents 50 m.
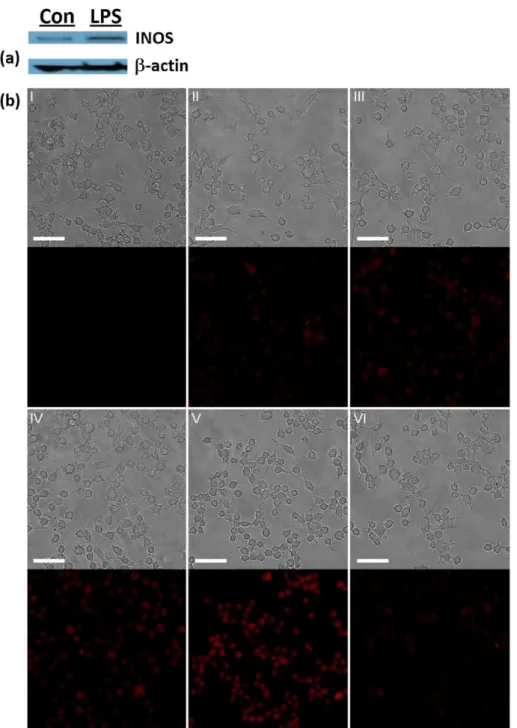
針對內生性一氧化氮之細胞螢光影像研究中,Raw 264.7 巨噬細胞內的一氧
化氮可以經由利用 lipopolysaccharide (LPS)刺激活化 iNOS 進而產生 26。Raw
264.7 細胞先與 LPS 培養 4 小時後,利用 western blotting 檢視 iNOS 的表現量, 結果顯示在經過 LPS 的刺激後 iNOS 的表現量確實有增加,其結果如 Figure 7a 所示。將受到 LPS 刺激過的細胞與 RH 分別培養 2、4、6、8 小時後,利用螢光 顯微鏡觀察之結果如 Figure 7b 所示。在此實驗中,將 RH 與未受 LPS 刺激的細 胞培養 12 小時作為對照組,可以觀察到對照組沒有螢光訊號產生(Figure 7b-I); 在實驗組的部分,隨著 RH 與受 LPS 刺激過的細胞培養時間的增加,可以觀察 到紅色螢光訊號也隨之增強(Figure 7bII - 7bV);另外在抑制 iNOS 活性的實驗中, 先利用 iNOS 的抑制劑 L-NNA 與細胞培養 1 小時後,再依序與 LPS 培養 4 小時, 與 RH 培養 8 小時,在螢光顯微鏡中觀察到微弱的紅色螢光(Figure 7bVI)。由以 上結果得知隨著 RH 與細胞培養時間的增加,進入到細胞中的 RH 也隨之增加, 在與細胞內生性的一氧化氮反應後生成具有螢光的產物 RB 也增加,因此可觀察 到螢光強度增強的趨勢;當 iNOS 的抑制劑 L-NNA 存在的情況下,雖然 Raw 264.7 細胞受到 LPS 的刺激,其 iNOS 的表現量受 L-NNA 的影響而降低,進而影響細 胞內一氧化氮的生成量,因此在螢光顯微鏡的觀察下發現僅有微弱的紅色螢光。 同時此結果也顯示 RH 在細胞中可以成功地獲得內生性一氧化氮的螢光影像。
15
Figure 7. Endogenously generated NO detection in Raw 264.7 macrophage cells by RH. (a)
The expression of iNOS in the absence and presence of stimulation with LPS for 4 h. Left lane: cells without LPS stimulation; right lane: cells with LPS stimulation. (b) RH (5 M) incubation with cells for (I) 12 h without LPS pre-stimulation; (II) 2 h with LPS (1 g mL−1) pre-stimulated for 4 h; (III) 4 h with LPS (1 g mL−1) pre-stimulated for 4 h; (IV) 6 h with LPS (1 g mL−1) pre-stimulated for 4 h; (V) 8 h with LPS (1 g mL−1) pre-stimulated for 4 h; and (VI) Raw 264.7 cells sequentially treated with L-NNA (1 mM) for 1 h, LPS for 4 h, and RH for 8 h. The scale bar represents 50 m.
FA-OMe 與一氧化氮反應產物之分析及其反應機制之推測
FA-OMe 可以很容易地經由加熱回流 fluoresceinamine 的甲醇溶液藉由酸催 化反應而得。為了解 FA-OMe 與 NO 反應後的產物以及 FA-OMe 的光學特性, 因此將 FA-OMe 溶於水中並通入 NO 氣體,觀察到溶液顏色由黃色立即轉變為淡
16
綠色,經由分離及鑑定後確認產物為具螢光性質的 dA-FA-OMe。因此初步確認 FA-OMe 可偵測 NO,並經由 reductive deamination 反應獲得具有螢光的 dA-FA-OMe。推測 FA-OMe 與 NO 的反應機制如 Scheme 2 所示。首先 FA-OMe
上的 primary amino group (-NH2)先與 NO 的自身氧化物 N2O322反應,形成具有
N-nitrosoamine (-NH-NO)的中間產物 1,接著 NO2離子與中間產物 1 反應而產
生具有 nitroamine (-NH-NO2)的中間產物 2。中間產物 2 又被 N2O3亞硝基化而形
成具有 N-nitroso nitroamine (-N(-NO)-NO2)的中間產物 3,而中間產物 3 的
N-nitroso nitroamine 會經過重新排列而形成中間產物 4 並繼續往下形成具有 diazo
nitrate (-N2-NO3)的中間產物 5。根據文獻記載27,有些 diazo nitrate 會經過一個
均勻斷鍵(homolytic fission)的過程而形成相對應的自由基、氮氣及硝酸基自由基 (nitrate radical)。因此推論中間產物 5 可能經過均勻斷鍵後產生具有 fluoresceinyl radical 的中間產物 6,最後中間產物 6 會立刻抓取溶劑中的氫自由基而生成最終
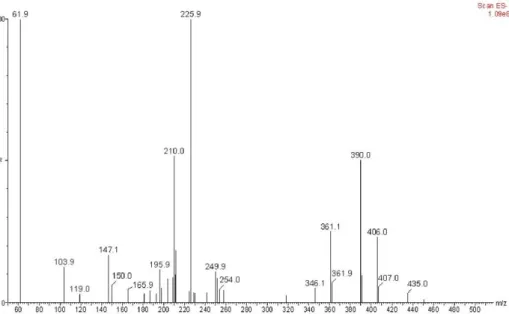
產物 dA-FA-OMe。在 ESI-MS 光譜上發現當 FA-OMe 與 NO(aq)反應 1 分鐘時,能
看到我們所假設的中間產物 1、2、5(或 3、4,因 3、4、5 的分子量相同)的分子 峰,如 Figure 8 所示,因而初步支持了我們所假設的反應機制。然而,要完全確 立上述的反應機制仍需更進一步的實驗,其中更須包含將中間產物分離並鑑定。
17
Figure 8. ESI-Mass spectrum of FA-OMe reacting with 20 equiv. NO(aq) in pH 7.4 100 mM
HEPES buffer for 1.0 min under aerobic condition. The peaks at m/z 361.1 and 346.1 are ascribed to FA-OMe and dA-FA-OMe, respectively; the peaks at m/z 390.0 and 406.0 correspond to the N-nitrosoamine intermediate 1 and the nitroamine intermediate 2, respectively; The peak at m/z 435.0 is assigned to the diazo nitrate intermediate 5 (or the N-nitroso nitroamine intermediate 3, the 5-membered ring intermediate 4).
PeT 效應之理論計算(由高雄醫學大學 陳信允老師協助計算)
利用 Gaussian 09 程式計算並了解 FA-OMe 與 dA-FA-OMe 之間螢光強度變 化之理論,藉由 density function theory (DFT)之 B3LYP 方法搭配 6-31++G**以取 得 FA-OMe 與 dA-FA-OMe (methyl 3-aminobenzoate、 methyl benzoate、及 xanthene 三個部位)之前列分子軌域(frontier molecular orbitals)的最佳化幾何構型及其電 子能階。其結果如 Figure 9 所示,methyl 3-aminobenzoate moiety 的 HOMO 能階 略高於 xanthene 的 HOMO 能階,且落在 xanthene 之 LUMO 與 HOMO 能階之間, 因此當 xanthene 受到光激發後將有利於由 methyl 3-aminobenzoate moiety 之 HOMO 到 xanthene 之 HOMO 的電子轉移;相反地,methyl benzoate 的 HOMO 能階明顯低於 xanthene 的 HOMO 能階,因此將不利於由 methyl benzoate 之 HOMO 到 xanthene 之 HOMO 的電子轉移。由上述理論計算之結果證實 FA-OMe 受到 NO 調控螢光之行為符合 photoinduced electron transfer (PeT)的現象。
18
Figure 9. Energy levels of the methyl 3-aminobenzoate, methyl benzoate, and xanthene
moieties. The values in parentheses were derived from the calculations considering the aqueous environment
FA-OMe 及 dA-FA-OMe 之光學性質
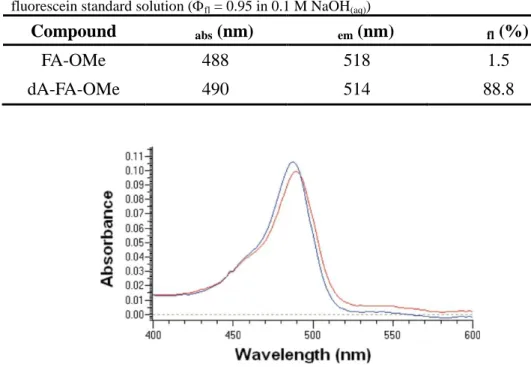
FA-OMe 與 dA-FA-OMe 的光學性質如 Table 1 所示。FA-OMe 與 dA-FA-OMe 的 UV/Vis 吸收光譜如 Figure 10 所示,二者均在 490 nm 處有吸收並沒有明顯的 差別。然而 dA-FA-OMe 的螢光量子產率比 FA-OMe 高 59 倍,所以當 FA-OMe 與 NO 反應後即使只有很微量的 dA-FA-OMe 形成,依舊能產生相當明顯的螢光。
Table 1. Fluorescence quantum yields (fl) and absorption and emission maxima (abs, em)
of FA-OMe and dA-FA-OMe in 0.1 M NaOH(aq) determined by comparison with a
fluorescein standard solution (fl = 0.95 in 0.1 M NaOH(aq))
Compound abs (nm) em (nm) fl (%)
FA-OMe 488 518 1.5
dA-FA-OMe 490 514 88.8
Figure 10. Absorption spectra of FA-OMe (1 M, blue line) and dA-FA-OMe (1 M, red line) in 0.1 M NaOH(aq).
19
FA-OMe 與 dA-FA-OMe 的穩定度研究
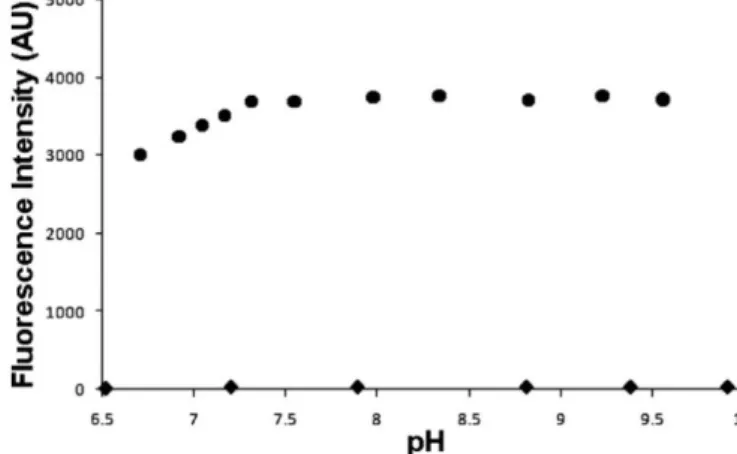
FA-OMe 及 dA-FA-OMe 的 pH 穩定的研究結果如 Figure 11 所示。在 pH 值
6.510.0 範圍中幾乎觀察不到 FA-OMe 的螢光訊號,表示 FA-OMe 在此 pH 範圍 中 並 不 會 受 到 環 境 酸 鹼 度 的 影 響 而 形 成 具 有 螢 光 的 產 物 。 相 對 地 , 雖 然 dA-FA-OMe 的螢光強度從 pH 值 6.5 時持續上升,直到 pH 值 7.4 時達最大值, 但由 pH 值 7.4 到 10.0 時維持相當穩定的狀態,而且 dA-FA-OMe 對 FA-OMe 的 螢光強度比在 pH 值 6.5 到 10.0 的範圍內始終保持高比值。由此結果可知在生理 環境下利用 FA-OMe 作為一氧化氮的螢光探針,其偵測結果將不會因環境的酸鹼 度變化而有所影響。
Figure 11. pH dependence of the fluorescence intensities of 20 M FA-OMe (◆) and dA-FA-OMe (●) in 100 mM HEPES buffer at 25.0 ± 0.1℃. The fluorescence intensities were detected at 524 nm with excitation at 460 nm.
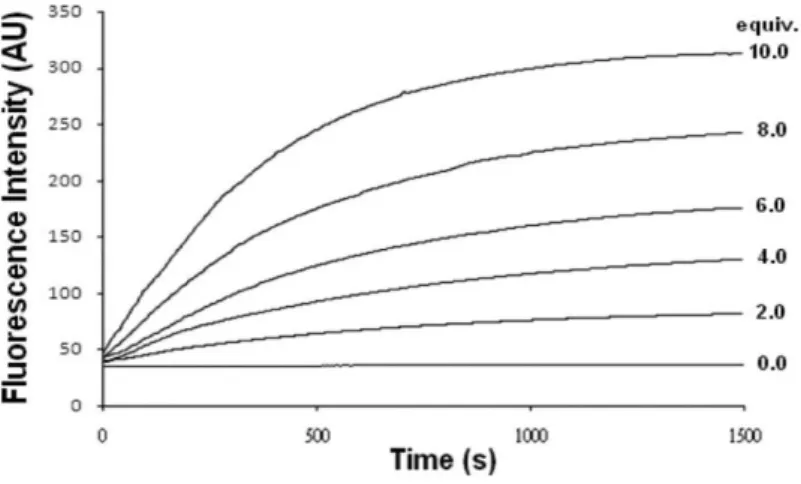
FA-OMe 與一氧化氮反應之時間及濃度效應 為了解 FA-OMe 偵測一氧化氮的能力,我們針對 FA-OMe 與不同濃度的一 氧化氮反應後其反應時間與螢光強度上升情形進行探討。將 50 M FA-OMe 溶液 在 25.0 ± 0.1℃環境下分別與 0.2、0.4、0.6、0.8 及 1.0 當量的一氧化氮反應後, 發現隨著一氧化氮濃度的增加,溶液在 524 nm 處的螢光強度也跟著增加,其結 果如 Figure 12 所示。另外在 FA-OMe 與一氧化氮反應時間效應研究中,發現約 在 FA-OMe 與一氧化氮反應 20 分鐘後可觀察到溶液在 524 nm 處的螢光達到持 平不再上升的狀態,如 Figure 13 所示。由濃度效應研究中發現 FA-OMe 溶液螢 光強度與一氧化氮濃度具有高度的線性關係,且 FA-OMe 對一氧化氮的偵測極限 為 44 nM。以上結果顯示 FA-OMe 極具對一氧化氮進行定量分析的潛力。
20
Figure 12. Fluorescence emission spectra of FA-OMe (50 M) upon reaction with various amounts of NO(aq) in 100 mM HEPES buffer of pH 7.4 at 25.0 ± 0.1℃(ex 460 nm,em 524
nm)
Figure 13. Time dependence of the fluorescence intensity of 50 M FA-OMe in pH 7.4 100 mM HEPES buffer with different amounts of the NO stock solution. The fluorescence intensities were detected at 524 nm with excitation at 460 nm at 25.0 ± 0.1℃.
FA-OMe 對一氧化氮之選擇性研究
一氧化氮探針對一氧化氮的高特異性乃是評估應用該探針於了解一氧化氮 多種生物作用方面不可缺少的重要性質。因此本研究針對 FA-OMe 對於一氧化氮 以及其他可能與一氧化氮競爭的活性氧化物或活性氮化物的選擇性進行探討。將
FA-OMe 分別與 8 當量的 NO 及 100 當量的 OH∙、H2O2、HNO、ONOO−、NO2−
及 NO3 −
反應 2 小時後的螢光強度結果如 Figure 14 所示。在 FA-OMe 與 NO 反應 後溶液螢光強度上升約 8 倍,與其他活性氮、氧化物反應後則是沒有螢光強度的
上升。文獻指出目前已商業化的一氧化氮探針 DAF-28b會與 dehydroascorbic acid
(DHA)及 ascorbic acid (AA)反應,造成在生理環境下產生螢光訊號而干擾對一
氧化氮的偵測28。因此我們針對 FA-OMe 對 DHA 及 AA 的選擇性也做了研究,
發現 DHA 及 AA 與 FA-OMe 反應 2 小時後並不會造成 FA-OMe 溶液的螢光強度 增加,此結果說明了 DHA 與 AA 不會影響 FA-OMe 對一氧化氮的偵測。此外亦
有文獻29指出當 H
2O2/peroxidase、ONOO−或 OH∙存在下將會造成 o-diaminophenyl group 的氧化形成不穩定的 arylaminyl radical,再與 NO 反應形成 triazole 的結構
21
而造成螢光強度上升。由以上結果顯示 FA-OMe 對一氧化氮的特異性優於 DAF-2, 其原因可能是由於相較於 DAF-2 結構上的兩個 amino group,FA-OMe 結構上只 有一個 amino group,因而使得與一氧化氮反應的部位電子密度較低,比較不容 易受到其他活性氮、氧化物、DHA 以及 AA 的影響。
Figure 14. Selectivity of FA-OMe (20 M) for NO over other reactive oxygen and nitrogen species: normalized fluorescence response after 2 h relative to the emission of the probe in 100 mM HEPES buffer at pH 7.4 and 25.0 ± 0.1℃ (ex 460 nm, em 524 nm).
一氧化氮在細胞中的螢光影像研究
將 FA-OMe 應用到偵測細胞中一氧化氮之前,必須先了解 FA-OMe 的細胞 毒性。在本研究中,我們將 Raw 264.7 細胞與不同濃度的 FA-OMe 培養 24 小時, 然後利用 MTT assay 了解細胞的存活率,其結果顯示 FA-OMe 的細胞毒性相當 低,如 Figure 15 所示。
Figure 15. MTT assay on Raw 264.7 murine macrophages treated with different
concentrations of FA-OMe for 24 h.
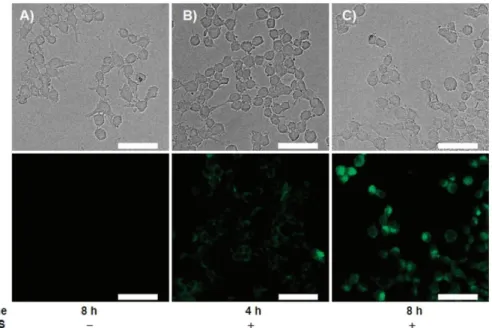
針對內生 性一 氧化氮 之細胞螢 光影 像研究 中,首先 利用 0.5 g mL1
lipopolysaccharide (LPS)刺激活化 Raw 264.7 巨噬細胞內的一氧化氮合成酶 iNOS,
進而使細胞內大量產生一氧化氮。再將受 LPS 刺激過的細胞與 10 M 的 FA-OMe
分別培養 4 小時與 8 小時,並將未受 LPS 刺激過的細胞與 10 M 的 FA-OMe 培
22
LPS 刺激活化 iNOS 的對照組並無螢光產生(Figure 16A),而受到 LPS 刺激活化 iNOS 的實驗組有明顯的螢光產生,並且隨著與 FA-OMe 培養的時間增加,其螢 光影像也愈明顯(Figure 16B 及 16C)。由以上結果得知隨著 FA-OMe 與細胞培養 時間的增加,進入到細胞中的 FA-OMe 也隨之增加,在與細胞內生性的一氧化 氮反應後生成具有螢光的產物 dA-FA-OMe 也增加,因此可觀察到螢光強度增強 的趨勢,同時此結果也顯示 FA-OMe 在細胞中可以成功地獲得內生性一氧化氮 的螢光影像。
Figure 16. Endogenous NO detection in Raw 264.7 murine macrophages by FA-OMe (10
M): (top) DIC images; (bottom) fluorescence. FA-OMe incubation with cells for (A) 8 h without LPS pre-stimulation, (B) 4 h with LPS (0.5 g mL1) pre-stimulation for 4 h, and (C) 8 h with LPS (0.5 g mL1) pre-stimulation for 4 h. The scale bar represents 50 m.
為了解 FA-OMe 停留在細胞內的能力,我們利用 1.25 g mL1的 LPS 刺激
並活化 Raw 264.7 細胞內的 iNOS 並將受 LPS 刺激過的細胞與 10 M 的 FA-OMe
一起培養 8 小時。然後每隔 10 分鐘將細胞以 PBS buffer 清洗後以螢光顯微鏡觀 察,於 30 分鐘內觀察四次。由結果顯示,細胞經過 PBS buffer 數次的沖洗過程 中,其螢光影像的強度並沒有明顯的變化,表示 FA-OMe 進入細胞與一氧化氮反 應後能有效地停留在細胞中,結果如 Figure 17 所示。推測其原因乃是 FA-OMe 進入到細胞後其結構上的 ester 官能基被細胞內的 esterase 酵素切割,進而形成 FA-OMe-carboxylate 限制了再次通過細胞膜的能力,當 FA-OMe-carboxylate 與 NO/O2反應後生成 dA-FA-OMe-carboxylate 而產生螢光。為了證明在細胞中螢光 訊 號 的 來 源 並 非 來 自 於 FA-OMe-carboxylate , 我 們 針 對 FA-OMe 與 fluoresceinamine ( 根 據 文 獻 在 pH > 4 的 水 溶 液 中 , fluoresceinamine 會 以 FA-OMe-carboxylate 形式存在30)在 pH 值 6.5 10.0 範圍內的穩定度進行研究, 其結果如 Figure 18 所示。由結果觀察到在此 pH 範圍內 fluoresceinamine 與 FA-OMe 的螢光強度沒有明顯的差別,表示在細胞實驗中螢光訊號的來源並非來 自於 FA-OMe-carboxylate (fluoresceinamine)。
23
Figure 17. FA-OMe diffusion/localization in Raw 264.7 murine macrophages: (top) DIC
images; (bottom) fluorescence. After each image, the cells were washed three times with 2 mL of PBS. [FA-OMe] = 10 M, [LPS] = 1.25 g mL−1, scale bars 25 m.
Figure 18. pH dependence of the fluorescence intensities of 20 M fluoresceinamine (▲) and FA-OMe (◆) in 100 mM HEPES buffer at 25.0 ± 0.1℃. The fluorescence intensities were detected at 524 nm with excitation at 460 nm. Inset: comparison to that of 20 M dA-FA-OMe (●) in 100 mM HEPES buffer at 25.0 ± 0.1℃.
七、結論與建議
本 研 究 中 已 成 功 發 展 rhodamine B hydrazide (RH) 及
5-Amino-2-(6-hydroxy-3-oxo-3H-xanth-en-9-yl)benzoic acid methyl ester (FA-OMe)兩個一氧化氮之螢光探針。相較於目前文獻上已發表的一氧化氮 螢光探針,RH 與 FA-OMe 之合成方式容易,有效地簡化了合成步驟。就穩 定度而言,RH 與 FA-OMe 及其與一氧化氮反應後的產物在生理環境的 pH 值附近均呈現高度的穩定性,不會因為周遭環境酸鹼度的變化而造成螢光性 質的改變。此外不論 RH 或 FA-OMe 隨著一氧化氮濃度的增加,其螢光強度 均呈現正向增加的狀態。其中,在與一氧化氮反應前由於 RH 上的五元環處
24 於未打開的狀態,因此 RH 不具任何背景螢光。對於螢光強度與一氧化氮濃 度之間,RH 與 FA-OMe 均具有高度的線性關係,且二者對一氧化氮的偵測 極限都到達 109 M 等級,顯示二者均具有對一氧化氮濃度進行定量測量的潛 力。RH 與 FA-OMe 對一氧化氮均有良好的選擇性,其中又以 FA-OMe 改善 了目前常見具有 o-diaminophenyl group 的螢光探針會受其他活性氮氧化物、 DHA 及 AA 影響偵測結果之缺點尤佳。在針對一氧化氮進行細胞內螢光造 影的部分,RH 與 FA-OMe 不僅對於 Raw 264.7 巨噬細胞不具有毒性,且能 在細胞中成功獲得外生性及內生性一氧化氮的螢光影像,顯示 RH 及 FA-OMe 將能更廣泛地應用於生物系統中一氧化氮的偵測。
八、參考文獻
1. Archer, S., FASEB J. 1993, 7, 349-360.2. Lim, M. H.; Xu, D.; Lippard, S. J., Nat. Chem. Biol. 2006, 2, 375-380. 3. Zheng, H.; Shang, G.-Q.; Yang, S.-Y.; Gao, X.; Xu, J.-G., Org. Lett. 2008, 10,
2357-2360.
4. Si rmatel, Ö .; Sert, C.; Tümer, C.; Bilgin, A. Ö . M.; Ziylan1, Z., Bioelectromagnetics 2007, 28, 152-154.
5. Pluth, M. D.; Lippard, L. E. M. S. J., Org. Lett. 2010, 12, 2318-2321. 6. Liu, G.; Li, Y.; Pagel, M. D., Magn. Reson. Med. 2007, 58, 1249-1256.
7. Domek-Lopacinska; Urszula, K.; Strosznajder, J. B., Mol. Neurobiol. 2010, 41, 129-137.
8. Pavanelli, W. R.; Silva, J. J. N., The Open Nitric Oxide Journal 2010, 2, 1-6. 9. Wan, A.; Gao, Q.; Li, H., J. Appl. Polym. Sci. 2010, 117, 2183-2188.
10. Tain, Y.-L.; Hsieh, C.-S.; Lin, I.-C.; Chen, C.-C.; Sheen, J.-M.; Huang, L.-T., Nitric Oxide 2010, 23, 34-41.
11. Zhang, R., Ye , Z., Wang, G., Zhang, W., Yuan, J., Chem. Eur. J. 2010, 16, 6884-6891.
12. Y. Yang, S. K. Seidlits, M. M. Adams, V. M. Lynch, C. E. Schmidt, E. V. Anslyn, J. B. Shear, J. Am. Chem. Soc. 2010, 132, 13114-13116.
13. Tao Peng, Dan Yang, Org. Lett. 2010, 12, 4932-4935.
14. Fabiao Yu, Peng Li, Guangyue Li, Guangjiu Zhao, Tianshu Chu, and Keli Han, J. Am. Chem. Soc. 2011, 133, 11030–11033.
15. Xiang, Y.; Tong, A.; Jin, P.; Ju, Y., Org Lett 2006, 8, 2863-2866. 16. Sigmund, H.; Pfleiderer, W., Helv. Chim. Acta 2003, 86, 2299-2334.
17. [a]Ouyang, J.; Hong, H.; Shen, C.; Zhao, Y.; Ouyang, C.; Dong, L.; Zhu, J.; Guo, Z.; Zeng, K.; Chen, J.; Zhang, C.; Zhang, J., Free Radic. Biol. Med. 2008, 45,
25
1426-1436; [b]Huang, K. J.; Wang, H.; Ma, M.; Zhang, X.; Zhang, H. S., Nitric Oxide 2007, 16, 36-43; [c]Noyes, W. A., J. Am. Chem. Soc. 1925, 47, 2170. 18. Lei, B.; Adachi, N.; Arai, T., Brain Res. Brain Res. Protoc. 1998, 3, 33-36. 19. Maragos, C. M.; Morley, D.; Wink, D. A.; Dunams, T. M.; Saavedra, J. E.;
Hoffman, A.; Bove, A. A.; Isaac, L.; Hrabie, J. A.; Keefer, L. K., J. Med. Chem.
1991, 34, 3242-3247.
20. Setsukinai, K.; Urano, Y.; Kakinuma, K.; Majima, H. J.; Nagano, T., J. Biol. Chem. 2003, 278, 3170-3175.
21. Hughes, M. N.; Nicklin, H. G., J. Chem. Soc. A 1968, 2, 450-452.
22. Ignarro, L. J.; Fukuto, J. M.; Griscavage, J. M.; Rogers, N. E.; Byrns, R. E., Proc. Natl. Acad. Sci. U. S. A. 1993, 90, 8103-8107.
23. [a]Zhao, Y.; Zhang, X. B.; Han, Z. X.; Qiao, L.; Li, C. Y.; Jian, L. X.; Shen, G. L.; Yu, R. Q., Anal. Chem. 2009, 81, 7022-7030; [b]Kang, S.; Kim, S.; Yang, Y.-K.; Bae, S.; Tae, J., Tetrahedron Lett. 2009, 50, 2010-2012.
24. EURACHEM, The Fitness for Purpose of Analytical Methods: A Laboratory Guide to Method Validation and Related Topics. LGC: United Kingdom, 1998.
25. Pacher, P.; Beckman, J. S.; Liaudet, L., Physiol. Rev. 2007, 87, 315-424. 26. Conner, E. M.; Grisham, M. B., Methods 1995, 7, 3-13.
27. [a]Tuaillon, J.; Perrot, R., Helv. Chim. Acta 1978, 61, 558-566; [b]Jr., J. F. B., J. Am. Chem. Soc. 1957, 79, 2480-2488.
28. [a]Zhang, X.; Kim, W. S.; Hatcher, N.; Potgieter, K.; Moroz, L. L.; Gillette, R.; Sweedler, J. V., J. Biol. Chem. 2002, 277, 48472-48478; [b]Ye, X.; Rubakhin, S. S.; Sweedler, J. V., J. Neurosci. Methods 2008, 168, 373-382.
29. [a]Wardman, P., Free Radic. Biol. Med. 2007, 43, 995-1022; [b]Roychowdhury, S.; Luthe, A.; Keilhoff, G.; Wolf, G.; Horn, T. F., Glia 2002, 38, 103-114; [c]Jourd'heuil, D., Free Radic. Biol. Med. 2002, 33, 676-684.
30. Munkholm, C.; Parkinson, D. R.; Walt, D. R., J. Am. Chem. Soc. 1990, 112, 2608-2612.
十、計畫結果自評
1. 研究內容符合原計劃 2. 已達成預期目標
國科會補助計畫衍生研發成果推廣資料表
日期:2012/09/17國科會補助計畫
計畫名稱: 一氧化氮及一氧化氮鐵硫錯合物顯影與偵測(子計畫三)(3/3) 計畫主持人: 王雲銘 計畫編號: 100-2627-M-009-002- 學門領域: 以尖端物理/化學方法探索生物 系統跨領域研究無研發成果推廣資料
100 年度專題研究計畫研究成果彙整表
計畫主持人:王雲銘 計畫編號:
100-2627-M-009-002-計畫名稱:以 Dinitrosyl Iron Complex (DNIC)及紫質錯合物進行生物系統一氧化氮偵測、生理系統
訊號傳導、藥物設計研究--一氧化氮及一氧化氮鐵硫錯合物顯影與偵測(子計畫三)(3/3) 量化 成果項目 實際已達成 數(被接受 或已發表) 預期總達成 數(含實際已 達成數) 本計畫實 際貢獻百 分比 單位 備 註 ( 質 化 說 明:如 數 個 計 畫 共 同 成 果、成 果 列 為 該 期 刊 之 封 面 故 事 ... 等) 期刊論文 2 2 100% 研究報告/技術報告 0 0 100% 研討會論文 0 0 100% 篇 論文著作 專書 0 0 100% 申請中件數 0 0 100% 專利 已獲得件數 0 0 100% 件 件數 0 0 100% 件 技術移轉 權利金 0 0 100% 千元 碩士生 1 1 100% 博士生 2 2 100% 博士後研究員 1 1 100% 國內 參與計畫人力 (本國籍) 專任助理 1 1 100% 人次 期刊論文 0 0 100% 研究報告/技術報告 0 0 100% 研討會論文 0 0 100% 篇 論文著作 專書 0 0 100% 章/本 申請中件數 0 0 100% 專利 已獲得件數 0 0 100% 件 件數 0 0 100% 件 技術移轉 權利金 0 0 100% 千元 碩士生 0 0 100% 博士生 0 0 100% 博士後研究員 0 0 100% 國外 參與計畫人力 (外國籍) 專任助理 0 0 100% 人次
其他成果
(
無法以量化表達之成 果如辦理學術活動、獲 得獎項、重要國際合 作、研究成果國際影響 力及其他協助產業技 術發展之具體效益事 項等,請以文字敘述填 列。) 無 成果項目 量化 名稱或內容性質簡述 測驗工具(含質性與量性) 0 課程/模組 0 電腦及網路系統或工具 0 教材 0 舉辦之活動/競賽 0 研討會/工作坊 0 電子報、網站 0 科 教 處 計 畫 加 填 項 目 計畫成果推廣之參與(閱聽)人數 0國科會補助專題研究計畫成果報告自評表
請就研究內容與原計畫相符程度、達成預期目標情況、研究成果之學術或應用價
值(簡要敘述成果所代表之意義、價值、影響或進一步發展之可能性)
、是否適
合在學術期刊發表或申請專利、主要發現或其他有關價值等,作一綜合評估。
1. 請就研究內容與原計畫相符程度、達成預期目標情況作一綜合評估
■達成目標
□未達成目標(請說明,以 100 字為限)
□實驗失敗
□因故實驗中斷
□其他原因
說明:
2. 研究成果在學術期刊發表或申請專利等情形:
論文:■已發表 □未發表之文稿 □撰寫中 □無
專利:□已獲得 □申請中 ■無
技轉:□已技轉 □洽談中 ■無
其他:(以 100 字為限)
3. 請依學術成就、技術創新、社會影響等方面,評估研究成果之學術或應用價
值(簡要敘述成果所代表之意義、價值、影響或進一步發展之可能性)(以
500 字為限)
We have prepared two fluorescent NO probes, rhodamine B hydrazide (RH) and FA-OMe, possessing high NO specificity, photo-stability, pH stability and low cytotoxicity. In exogenously generated NO detection study, clear intracellular fluorescence was observed in the presence of S-nitroso-N-acetyl-D,L-penicillamine (SNAP, a kind of NO releasing agent). In endogenously generated NO detection study, increasing incubation time of RH/FA-OMe with lipopolysaccharied (LPS) pre-treated cells could obtain a highly fluorescent cell image. These cell imaging results demonstrated that RH/FA-OMe can efficiently penetrate into Raw 264.7 cells and be used for detection of exogenously and endogenously generated nitric oxide.