國 立 交 通 大 學
材料科學與工程研究所
碩
士
論
文
共軛高分子太陽能電池之材料合成與研究
The Synthesis of Low Bandgap Polymers for Polymer Solar
Cells
研 究 生:藍上哲 Shang-Che Lan
共軛高分子太陽能電池之材料合成與研究
The Synthesis of Low Bandgap Polymers for Polymer Solar Cells
研 究 生:藍上哲 Student:Shang-Che Lan 指導教授:韋光華 Advisor:Kung-Hwa Wei 國 立 交 通 大 學 材料科學與工程研究所 碩 士 論 文 A Thesis
Submitted to Department of Material Science and Engineering College of Engineering
National Chiao Tung University in partial Fulfillment of the Requirements
for the Degree of Master
in
Materials Science & Engineering August 2009
Hsinchu, Taiwan, Republic of China
摘要
本實驗合成兩種新的施體-受體共聚低能隙高分子,pCTDDP 與
pCbzBtIm,並應用於高分子太陽能電池,希望藉由發展低能隙高分 子以增加對光的吸收範圍進而提升高分子太陽能電池的效率。
pCTDDP 是 以 Diketo-Pyrrolo-Pyrrole(DPP) 為 電 子 受 體 ,
cyclopenta- [2,1-b;3,4-b´]-dithiophene(CT)為電子施體。根據 UV-Vis 吸 收光譜,pCTDDP 的光學分子能隙為 1.31 eV。經電化學分析,pCTDPP
的 HOMO 能階位於-4.95eV,LUMO 能階位於-3.31eV,很適合做為
高分子太陽能電池的 P 型材料。將 pCTDPP 與 PCBM 以 1:3(wt/wt) 混掺製成塊狀異質介面高分子太陽能電池,效率可達 1%。 pCbzBtIm 是以 Carbazole 為電子施體與我們新合成的電子受體 ([2,1,5]thiadiazolo [3,4-g] benzimidazole)共聚所得。[2,1,5]thiadiazolo- [3,4-g] benzimidazole 為 2,1,3-benzothiadiazole(BT)的結構衍生物,是 在 BT 的 5,6 號位置合成一個 imdazole 官能基,以加強 BT 對電子的 拉力。高分子 pCbzBtIm 的光學能隙為 1.76 eV,由電化學分析得知
Abstract
Two novel low bandgap polymers, pCTDDP and pCbzBtIm, based on alternating donor-acceptor copolymers have been designed and synthesized for application in polymer solar cells(PSCs).
pCTDPP was copolymerized by Diketo-Pyrrolo-Pyrrole(DPP) and cyclopenta[2,1-b;3,4-b´]-dithiophene(CT). According to UV-Vis absorption spectrum, pCTDPP has a relative low bandgap at 1.31 eV. Electrochemical analysis reveal the HOMO level and LUMO level of pCTDDP are on -4.95 eV and -3.31 eV, and is suitable for PSCs. The maximum power conversion efficiency(PCE) of PSCs the based on pCTDPP/PC61BM(1:3, wt/wt) system reaches 1.0% with a short circuit
current density(Jsc) of 2.76 mA/cm 2
, an open circuit voltage (Voc) of 0.6 V,
and a fill factor (FF) of 0.60 under AM 1.5G (100 mW/cm2) illumination. We also synthesized a novel copolymer (pCbzBtIm) based on a new acceptor, [2,1,5]thiadiazolo[3,4-g]benzimidazole, and copolymerized with carbazole. pCbzBtIm has a optical bandgap at 1.76 eV, and it’s HOMO level is on -5.46 eV which could get high Voc of polymer solar
cells. The maximum power conversion efficiency(PCE) of the PSCs based on pCbzBtIm/PC61BM(1:4, wt/wt) system reaches 1.06% with a
short circuit current density (Jsc) of 4.02 mA/cm 2
, an open circuit voltage (Voc) of 0.76 V, and a fill factor (FF) of 0.34 under AM 1.5G (100
謝誌
在碩士班兩年的生涯中,首先要感謝我的指導教授韋光華老師, 沒有為老師對我們的支持及提供如此充足的實驗資源,這篇論文就無 法完成。此外我還要感謝黃華宗教授、林宏州教授及鄭彥如教授在百 忙之中抽空參與學生的口試並提供指導。 這兩年來很感謝陳冠宇學長對我的指導,讓我一個有機合成的門 外漢漸漸了解到合成的奧妙,同時如果沒有他在旁對我的提攜與鼓 勵,我將無法完成這一篇論文。此外謝謝袁茂川學長與江建銘學長在 實驗上給與的幫助,並願意時時與我互相討論,讓我在合成上學得更 多更快。在這,我很感謝蘇明鑫學長在百忙之中抽空幫我製作元件, 沒有學長的幫忙這篇論文就永遠無法完整。在實驗室中,知識豐富的 茂源學長一直是我學習的對象;旭生學長對遇到困境時的堅毅讓我一 直銘記在心,在此也希望學長能早日畢業。碩麟學長對於學弟我的幫 助,讓我不知如何回報。芝吟學姐在電腦資訊上給與我們的幫忙,讓 我們在研究的路上如虎添翼。家閔學長對我的提點,讓我受益匪淺, 同時他那打球時矯健的身手令人難忘。昌隆學長那無限的體力永遠是研究生活注入了歡笑的泉源,很開心能與妳當同學,也謝謝妳在我感 到困惑時能適時的給我意見。見到秉萱那天使般的微笑,人的心情總 也快樂起來,希望在未來的工作上妳能順順利利。宗諭,在碩士班最 後的半個月裡,感謝你與我一同走過。改邪歸正的曜璿學弟,個性幽 默的柏宇學弟以及美食鑑賞家毓倩學妹與惠尼學妹,希望妳們能研究 順利。 最後感謝我的父母,謝謝你們對我的支持,謝謝你們對我的栽 培,謝謝你們對我的包容,謝謝你們對我的愛。今天的我,你們是最 大的幕後推手。謝謝你們。
目錄
中文摘要 ... I 英文摘要 ... II 謝誌... III 目錄... V 圖目錄... XI 表目錄... XVI 第一章 緒論 1-1 前言 ... 1 1-2 太陽能電池 ... 3 1-3 共軛高分子 ... 5 第二章 原理與文獻回顧2-2 分子結構與分子能隙 ...11
2-3 低能隙高分子 ... 14
2-3-1 聯環系統(Fused Ring Systems) ... 14
2-3-2 施體—受體共聚高分子 ... 16 2-4 高分子太陽能電池 ... 18 2-4-1 操作原理... 18 2-4-2 高分子太陽能電池元件設計 ... 20 2-4-3 I-V 曲線與元件效率 ... 22 2-4-4 低能隙高分子應用於有機太陽能電池 ... 25 2-5 高效率高分子材料 ... 27 2-5-1 poly(3-hexyl thiophene) (P3HT) ... 27 2-5-2 Benzothiadiazole (BT) ... 30 2-5-3 Diketo-pyrole-Pyrole (DPP) ... 34
Part A. 低能隙高分子 PCTDDP 之合成與研究
A1 研究動機... 38 A2 實驗... 39 A2-1 藥品 ... 39A2-2 儀器 ... 40 A2-2-1 核磁共振光譜儀 ... 40 A2-2-2 凝膠滲透層析儀 ... 40 A2-2-3 紫外-可見光吸收光譜儀...40 A2-2-4 循環伏特安培計 ... 41 A2-2-5 微差掃瞄式卡計 ... 41 A2-2-6 熱重分析儀 ... 41
A2-2-7 旋轉塗佈機(Spin Coater) ... 41
A2-2-8 模擬光源 ... 42
A2-2-9 光強度偵測計 ... 42
A2-2-10 電性分析儀 ... 42
A2-3 合成 ... 43
A2-4 高分子太陽能電池元件製作 ... 46 A3 結果與討論... 47 A3-1 合成部份 ... 47 A3-1-1 化合物 M1 之合成 ... 47 A3-1-2 pCTDPP 聚合反應 ... 47 A3-2 高分子物理性質 ... 49 A3-2-1 GPC 量測 ... 49 A3-2-2 DSC 和 TGA 測量 ... 49 A3-2-3 溶解度測試 ... 51 A3-3 光學性質 ... 52 A3-4 電化學性質—氧化還原電位測量 ... 54 A3-5
元件效率量測
... 56 A3 結論... 57Part B. 低能隙高分子 pCbzBtIm 之合成與研究
B1 研究動機... 58B1-1 背景... 58 B1-2 動機... 58 B2 實驗... 60 B2-1 藥品... 60 B2-2 合成... 62 B2-2-1 合成[2,1,5]thiadiazolo [3,4-g] benzimidazole ... 62 B2-2-2 Carbazole 合成方法 ... 67 B2-2-3 pCbzBtIm 合成方法 ... 71 B4 結果與討論... 72 B3-1 合成... 72 B3-1-1 單體 M3 之合成... 72 B3-1-2 化合物 S1 之合成 ... 74 B3-1-3 單體 M4 合成方法... 74
B3-2 高分子物理性質分析 ... 77 B3-2-1 GPC 分析 ... 77 B3-2-2 DSC 和 TGA 測量 ... 78 B3-2-3 溶解度測試 ... 79 B3-3 光學性質... 80 B3-4 電化學性質—氧化還原電位測量 ... 83 B3-5 元件效率量測 ... 84 B4 結論... 85 參考文獻... 87 附錄... 92
圖目錄
Fig. 1-1:近四十萬年全球二氧化碳濃度變化... 2
Fig. 1-2:近兩千年全球溫度變化... 3
Fig. 2-1: 半導體能帶結構示意圖... 9
Fig. 2-2: 聚乙炔的共振結構... 10
Fig. 2-3: 在非簡併激發態高分子下的 polaron、bipolaron 和 exciton 的能階...11 Fig. 2-4: poly(p-phenylene)、poly(pyrrole)、poly(thiophene)... 12 Fig. 2-5:影響分子能隙的因素... 13 Fig. 2-6:各種常見的聯環分子... 15 Fig. 2-7:poly(isothianaphthene)低能隙原理示意圖... 15 Fig. 2-8:(a)利用推電子施體與拉電子受體共聚,以增加共軛長度(b) 推電子施體與拉受體分子軌域混成示意圖... 17
Fig. 2-11:高分子太陽能電池操作原理示意圖... 19 Fig. 2-12:高分子太陽能電池之雙層結構示意圖... 21 Fig. 2-13:高分子太陽能電池之塊狀異質介面元件結構示圖 ... 22 Fig. 2-14:太陽能電池 I-V 曲線圖... 23 Fig. 2-15:(a) 元件 VOC與N 型 C60衍生物的還原電位之關係 (b)不同 P 型高分子與元件 VOC之關係圖]... 24 Fig. 2-16:太陽光譜能量分佈圖... 26
Fig. 2-17:Regioregular P3HT 與 Random P3HT 示意圖... 27
Fig. 2-18:(a) rr-PHPIT 分子結構 (b) rr-PHPIT UV-Vis 吸收光譜 ... 28
Fig. 2-19:數種高效率施體―受體共聚高分子之分子結構 ... 31
Fig. 2-20:DPP 與 pBBTDPP2 之分子結構 ... 35
Fig. 2-21:pBBTDPP2 之 UV-Vis 吸收光譜(a)溶液態(b)薄膜態 ... 35
Fig. 2-22:(a) PCBTDDP2 分子結構 (b) PCBTDDP2 的 UV-Vis 吸收光 譜... 37
Fig. A-1:pCTDPP 的分子結構... 33
Fig. A-2:pCTDPP 熱性質分析。(a)DSC (b)TGA ... 50
Fig. A-4:pCTDPP 之 CV 量測圖譜 ... 55
Fig. A-5:pCTDDP 元件 I-V 曲線圖 ... 56
Fig. B-1:pCbzBtIm 的分子結構 ... 59
Fig. B-2:pCbzBtIm 熱性質分析 ... 78
Fig. B-3:化合物 B5 的 UV-Vis 吸收光譜 ... 80
Fig. B-4:pCbzBtIm 在溶液態與薄膜態的 UV-Vis 吸收光譜 ... 82
Fig. B-5:pCabBtIm 之 CV 量測圖譜... 83
Fig. B-6:pCbzBtIm 元件 I-V 圖... 85
附圖. 1:1H-NMR spectrum of A2 ... 92 附圖. 2:1H-NMR spectrum of M1 ... 93 附圖. 3:1H-NMR spectrum of M3 ... 94 附圖. 4:1H-NMR spectrum of pCTDPP ... 95 附圖. 5:1H-NMR spectrum of B1 ... 96 附圖. 6:1H-NMR spectrum of B3 ... 97
附圖. 10:1H-NMR spectrum of B6 ... 101 附圖. 11:1H-NMR spectrum of S1... 102 附圖. 12:1H-NMR spectrum of B7 ... 103 附圖. 13:1H-NMR spectrum of B8 ... 104 附圖. 14:1H-NMR spectrum of B9 ... 105 附圖. 15:1H-NMR spectrum of M4 ... 106 附圖. 16:1H-NMR spectrum of B10 ... 107 附圖. 17:1H-NMR spectrum of S2 ... 108 附圖. 18:1H-NMR spectrum of pCbzBtIm... 109 附圖. 19:13C-NMR Spectrum of A2 ...110 附圖. 20:13C-NMR Spectrum of M1 ...111 附圖. 21:13C-NMR Spectrum of M2 ...112 附圖. 22:13C-NMR Spectrum of B1 ...113 附圖. 23:13C-NMR Spectrum of B2 ...114 附圖. 24:13C-NMR Spectrum of B4 ...115
附圖. 25:13C-NMR Spectrum of M3 ...116 附圖. 26:13C-NMR Spectrum of B6 ...117 附圖. 27:13C-NMR Spectrum of S1...118 附圖. 28:13C-NMR Spectrum of B7 ...119 附圖. 29:13C-NMR Spectrum of B9 ... 120 附圖. 30:13C-NMR Spectrum of B10 ... 121 附圖. 31:13C-NMR Spectrum of M4 ... 122 附圖. 32:13C-NMR Spectrum of B10 ... 123 附圖. 33:13C-NMR Spectrum of S2... 124
表目錄
Table 1-1:各種太陽能電池目前效率進展 --- 5 Table 2-1:PHPIT 不同退火時間對元件效率之影響 --- 29 Table 2-2:PHPIT 不同退火時間對元件中載子傳導速率之影響 --- 30 Table 2-3:Fig. 2-15 中各高分子元件效率 --- 32 Table 2-4:pBBTDPP2 在不同成膜條件下之元件效率 --- 35 Table A-1:pCTDPP 分子量 --- 49 Table A-2:pCTDPP 與的玻璃轉換溫度與熱裂解溫度 --- 51 Table A-3:pCTDPP 之溶劑度測試 --- 51 Table A-4 : pCTTDPP 吸光性質整理 --- 53 Table A-5:pCTDDP 的電化學分析 --- 55 Table B-1:pCbzBtIm 分子量 --- 77 Table B-2:pCbzBtIm 的玻璃轉換溫度與熱裂解溫度 --- 79 Table B-3:pCbzBtIm 之溶劑度測試 --- 79 Table B-4 : 化合物 B5 與 DTBT 之吸光性質整理 --- 81Table B-5 : pCbzBtIm 與 pCDTBT 的吸光性質整理 --- 82
第一章 緒論
1-1 前言
自19 世紀工業革命以來,人類的生活品質得到大幅度的改善,但隨著
科技日益的發展,人們對能源的需要也在逐漸的擴大當中,綜觀19、20 兩
個世紀,能源的取得主要是來自煤、石油、天然氣等石化燃料。
根據國際能源署(International Energy Agency)在《世界能源展望•2008》
[1]中預估 2006 年到 2030 年全世界能源需求的年增率約為 1.6%,直至 2030 年總成長量將達到2006 年總需求量的 45%,其中石油的成長率約為 1%。 伴隨能源需求的成長,有兩個問題也逐漸浮現在我們的眼前。一個是石 油在全球的含量與開採價值,另一個則是溫室效應造成的全球暖化與氣候 變遷。 目前全球石油的含量究竟有多少,一直以來仍是眾說紛紜,但根據美國
地質學家M. King Hubbert 所提出的 Hubbert peak theory,他認為一個油田在
到達產量的巔峰後,其產量會急遽的下降。而這項理論在1970 年後逐漸得
到證實,如美國與北海等大型油田都已達到高峰期,而產量也都在逐年的
下滑當中[2]。依此現象發展,在未來低成本易開採的油田將會越來越少,而
全球暖化則是使用石化燃料所帶來的另一項問題,由於石化燃料是由 碳、氫、氧、氮等元素所組成,經燃燒後會產生二氧化碳、氮氧化合物等 溫室氣體,進而造成全球溫度上升,導致脆弱的氣候系統受到破壞,使得 全球乾旱、水災、寒害等天禍頻傳。 在Fig. 1-1 可發現,地球的二氧化碳濃度會隨著冰河期產生交替變化, 但在最近的兩百年,地球的二氧化碳濃度已大幅超越過去四十萬年的平均 水準,這跟人類的工業革命似乎具有相當大的關聯性。 再參照Fig. 1-2 近兩百年來,地球溫度較前一千多年大約增加了 0.4℃, 剛好也與二氧化碳濃度成長趨勢相符。由此可知,我們人類的生活正一點 一滴的在改變這個地球的生存環境。
Fig. 1-2:近兩千年全球溫度變化[3]
1-2 太陽能電池
茲如1-1 所述,由於石化燃料所帶來的種種問題,近年來替代能源的開
發與研究,正如雨後春筍般被廣泛的發表。太陽能電池更是其中相當受關
切的主題。
自20 世紀初 Albert Einstein 與 Robert Andrews Millikan 對光電效應 (photovotalic effect)的深入研究,開啟了太陽能電池研究的大門。目前太陽
能電池可分為三個世代。第一個世代以矽晶圓為代表,第一世代在所有世
代中具有最高的光電轉換效率,目前單一個矽晶圓電池效率最高約可達
25%,三五族單晶電池則更可達到 28.8 %[4]。但由於此世代的產品在生產的
回收期,因此雖已有成熟的商品但卻難以普及。
第二代為薄膜電池,希望藉由減少原料的使用及簡化製程等方法,降低
成本與能源的投入,使電池在成本、效率、能源回收這三者間找到一個具
商業競爭力的平衡點。此世代電池包含有非晶矽電池(amophorous silicon
cell)、多晶矽(polysilicon)、CdTe、CIGS(Copper indium gallium selenide,
CuInxGa(1-x)Se2)等。目前以 CIGS 最為成功,單一電池效率可達 19.9%[5],First
Solar、Nanosolar、Hoda 等公司都已進入商品化的階段。 第三代系統為有機太陽能電池,由於有機分子對光具有較高的吸收度, 因此希望可藉此再更進一步的減少材料的使用,製造出更便宜更輕薄短小 的太陽能電池。一般來說薄膜型太陽能電池的主動層厚約5—10 微米,但 有機太陽能電池的主動層卻只需100―200 奈米,厚度只有薄膜型的十分之 一,對微型電子元件、可撓式電子元件、拋棄式電子元件等產品具有很大 的優勢。有機太陽能電池主要分兩類,第一種是染料敏化太陽能電池 (Dye-Sensitized Cells,DSC),第二種是有機薄膜太陽能電池(Organic Thin
Film Cells),目前 DSC 最佳效率約為 10%,而有機薄膜太陽能電池則為
Table 1-1:各種太陽能電池目前效率進展[4]
1-3 共軛高分子
自1971 年 Shirakawa 無意間發現了具導電性的共軛高分子,高分子電
子元件便隨即受到人們的關注,主要是由於高分子相較於其他金屬或半導
但由於共軛高分子如要達到良好的導電度,必須掺雜大量的碘,且掺雜後
的高分子容易氧化,因此近年來人們將目光放到共軛高分子的半導體特
性。現今共軛高分子的能隙介於1.5―2.5eV,恰巧其吸光與放光正好位於
可見光的範圍,因此很適合應用於發光二極體(polymer light emitting diode,
第二章 原理與文獻回顧
2-1. 共軛高分子
2-1-1. 發展 一般的高分子主要是以σ 單鍵相連的結構,使得電子被侷限在兩個原子 之間,因此沒有多餘的電子可進行自由移動,所以相對上大部份的高分子 材料都屬於絕緣體,例如:bulk polyethylene(聚乙烯)的能隙(bandgap,Eg) 高達8.8eV[6]。但是具有單雙鍵交替的共軛高分子,則可藉由π 軌域的重疊, 使π 電子在分子間或內呈現非定域化(delocalization),也就是說 π 電子具有 一定的自由度,因而產生導電的可能性。 回顧歷史,具有導電性質的高分子在1960 年代相繼被發現。1910 年時 首次出現無機聚合物,poly(sulphur nitride)[7],直至 1962 年始被發現為一個 半導體高分子[8],此一材料隨後即被加以證實在溫度為0.4oK 時具有導電的 現象[9]。 1971 年時,日本人 Shirakawa 和 Ikeda 在無之中做出了具導電性的高分子―Polyacetylene(聚乙炔)之 free standing films (自由立膜)[10]。但這種導電
高分子聚合膜的完整研究報告,是在1977 年由 Shirakawa、Heeger、
MacDiarmid[11]所共同發表,他們認為經由碘或氟化砷掺雜之化學聚合物,
在聚合物的認知上具有關鍵的意義,成為在物理和化學研究上的一個重要
的里程碑,終於在2000 年這三位科學家由於此一卓越貢獻,因而獲得諾貝
爾化學獎之殊榮。
2-1-2. 導電原理
根據能帶理論(band theory),能帶(energy band)是指當原子鍵結成分子
時,會使分子軌域的數目隨著鍵結原子的數目而增加,使得分子能階間的
距離越來越小,最後彼此的軌域發生重疊,而引起能階聚集的效應,進而
致使其生成近似連續性之能帶。在基態時價電子所佔有的能帶稱之為價帶 (Valance Band, VB),而沒有電子佔據的空能帶則稱為導帶(Conduction Band,
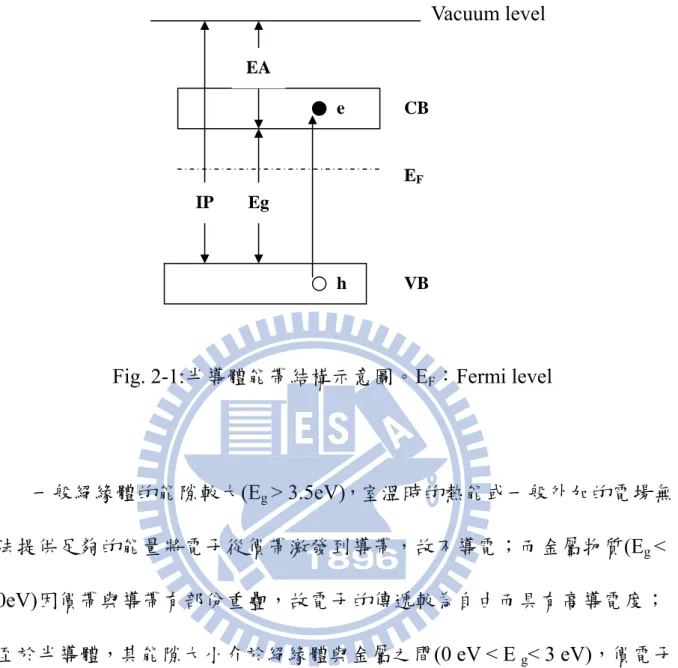
CB),導帶最低能量與價帶最高能量間的差距稱之為能隙(Energy gap, Eg)。
將電子從價帶激發到Vacuum level 所需的能量我們稱為游離能(Ionization
Potential, IP),而將電子從 Vacuum level 移到導帶時所釋放出來的能量則稱
VB CB EA Eg IP h e EF Vacuum level
Fig. 2-1:半導體能帶結構示意圖。EF:Fermi level
一般絕緣體的能隙較大(Eg > 3.5eV),室溫時的熱能或一般外加的電場無 法提供足夠的能量將電子從價帶激發到導帶,故不導電;而金屬物質(Eg < 0eV)因價帶與導帶有部份重疊,故電子的傳遞較為自由而具有高導電度; 至於半導體,其能隙大小介於絕緣體與金屬之間(0 eV < E g< 3 eV),價電子 可藉由升溫或外加電場等方式,使價電子躍遷至導帶,因而具有導電的能 力。 有機共軛高分子,從化學結構來看,高分子的主鏈是由單鍵―雙鍵交替 的共軛結構所組成,因為共振效應使得 π 電子在主鏈上呈現非定域化 (delocalization),Fig. 2-2 中顯示聚乙炔的 π 電子可藉由共振在主鏈上做有限 制的移動。
C C C C C C C C C C C C C C C C C C C C H H H H H H H H H H H H H H H H H H H H Fig. 2-2: 聚乙炔的共振結構 由於此類有機共軛高分子亦具有一種重覆的晶格結構,根據固態物理 學,在1979 年 Heeger 等人發表了 SHH 模型[12],這是目前較廣泛使用的理 論模型。其分子主鏈上之π 電子軌域經混成而形成一進似連續的分子軌域, π-π*能隙隨著 π 電子共軛長度增加而減少,而高分子會因主鏈上的結構缺陷 與有限的共軛長度影響內部的電子結構。 在共軛高分子中常見的準粒子,一般認為是soliton、polarons 與 bipolarons。soliton 是一種帶電的激子,帶有三種電性:中性態[S0]、負電性 [S-]、正電性[S+];polaron 是由兩個 soliton 組成,一個帶電,另一個則是中
性。而偏極子(polaron, p)與雙偏極子(bipolaron, bp)及激子(exciton)的狀態如
π*(CB) Δ luminescenc ω0 p- bp 2-p+ bp2+ Singlet exciton π(VB)
Fig. 2-3:在非簡併激發態高分子下的 polaron、bipolaron 和 exciton
的能階(2Δ 為能隙大小,2ω0為能隙內偏極子能階的能量差)
2-2. 分子結構與分子能隙
[14] 聚乙炔等主鏈單雙鍵交替的共軛高分子,往往因為熱運動或氧化物的影 響,而導致分子鏈在基態的狀況下自動裂解斷裂,降低了材料的實用性。 相對於此類材料,芳香環(Aromatic ring)的高分子聚合物在熱裂解和氧化電 位上就具有較良好的穩定性,如poly(p-phenylene)(X = ― (CH=CH) ―)[15]、poly(pyrrole) (X = NH)[16][17] 和 poly-(thiophene) (X = S)[18][19],Fig. 2-4。在
此類高分子中,有兩種不同的電子結構,一種是Aromatic form,另一種是
無法利用共振來移動,因此具有較高的分子能隙。Quinoid form,結構類似 聚乙炔,電子在鏈上可進行較自由的移動,因此具有較低的能隙[21]。通常 一個芳香環的高分子,其兩種電子結構同時存在,而我們所觀測到的電子 能隙,是這兩種結構的平均狀況。如果我們想要降低分子能隙,我們就必 須要設法提升Quinoid form的影響力。 Fig. 2-4: poly(p-phenylene)、poly(pyrrole)、poly(thiophene) [14] 在分子結構上有幾個因素會影響分子的能隙,見Fig. 2-5,分別是Eδγ、 Eθ
、ERes、ESub和Eint。Eδγ,係指分子中鍵長變化的程度,亦即在交替的單雙
鍵的結構中,單鍵與雙鍵的鍵長差,在聚乙炔此等線形共軛高分子,Eδγ是
決定能隙的主要因素。
Eθ
代表一個分子的有效共軛長度(effective conjugate length)[26]―[28],Eθ
數值越 大則Eg越大。
芳香環在自然界中相對的穩定是由於環內的π電子雲為一建設性干涉
(constructive diffraction),根據Hückel Theory具有(4n+2)個環內的π電子才能
形成穩定的芳香環。ERes係指每個芳香環的共振穩定能,一個π電子要在環
間移動必須克服環內的共振穩定能[29],如果環內的共振穩定能越大則能隙
越大。
Fig. 2-5:影響分子能隙的因素[14]
分子能隙是指分子的HOMO(Highest Occupied Molecular Orbital)能階與
LUMO(Lowest Unoccupied Molecular Orbital)能階的差值。一般常見控制
HOMO與LUMO能階的方法是在側鏈接上推電子(electron-releasing)或拉電
電子基則會降低LUMO能階。ESub就是指側鏈取代基對能隙的影響。
以上四種因素決定了單一條高分子鏈的分子能隙,而接下來最後一項影
響能隙的因素,Eint,係指高分子堆疊時,分子鏈間的作用力,藉由分子間π
軌域的重疊可促使π電子在分子鏈間移動,增加共軛長度降低分子能隙,在
線性的共軛高分子中,Eint對分子的穩定性也提供了相當的幫助[30]。換個角
度想,Eint其實類似於所謂的晶格能(lattice energy)。
2-3. 低能隙高分子
2-3-1. 聯環系統(Fused Ring Systems)
常見的共軛高分子,如poly(3-hexyl thiophene)(P3HT)、poly[2-methoxy-5-
(2'-ethyl-hexyloxy)-1,4-phenylene vinylene](MEH-PPV) , 其 分 子 能 隙 約
2.5eV~1.8eV。為了進一步縮小共軛高分子的能隙,人們利用聯環(Fused Ring)
的 芳 香 族 分 子 做 為 單 體 , 成 功 合 成 出 許 多 超 低 能 隙 的 共 軛 高
分子,如 Isothianaphthene[31]―[33]、Thieno[3,4-b] pyrazine[34]、 Thieno[3,
S S S
S N N
Isothianaphthene Thieno[3,4-b]pyrazine Thieno[3,4-b]thiophene Fig. 2-6:各種常見的聯環分子
此種利用聯環分子合成低能隙高分子想法最早於 1984 年被 F. Wudl 等
人所提出,在Fig. 2-7 中,benzene 和 thiophene 的共振能穩定能分別為 1.56
eV 與 1.26 eV[37],因此 F. Wudl 認為由 benzene 和 thiophene 所組成的
isothianaphthene 會 因 benzene 的 共 振 穩 定 能 較 大 , 使 得 聚 合 後 的
poly(isothianaphthene) 易 形 成 Quinoid form , 實 驗 結 果 指 出
poly(isothianaphthene)光學能隙約 1.0—1.2 eV[32][33],較P3HT 降低近 1eV。 S Er = 1.56 eV Er = 1.26 eV S S . . S S n n polymerization Fig. 2-7 :poly(isothianaphthene)低能隙原理示意圖
2-3-2. 施體—受體共聚高分子 除了2-3-1.節所提到利用聯環的芳香族分子聚合可降低能隙外,使用電 子施體(Donor)與電子受體(Acceptor)共聚也可達到降低能隙的目標,其中電 子施體係指分子本身相對具有推電子的特性,而電子受體則相對具有拉電 子的特性。當施體與受體兩種不同特性的分子聚合時,藉由一推一拉的特 性,使電子易在環與環間共振,增加共軛的長度,降低分子能隙[38][39],見
Fig. 2-8(a)。從混成軌域的原理來看,因為推電子分子具有較高的 HOMO
Level,拉電子分子具有較低的 LUMO Level,所以當兩分子的軌域混成後,
會如Fig. 2-8(b)所示,新的 HOMO level 會比原來推子電分子的 HOMO
level 高,而新的 LUMO Level 會比原來拉電子分子的 LUMO Level 低,因
(a)
(b)
Fig. 2-8 :(a)利用推電子施體與拉電子受體共聚,以增加共軛 長度(b)推電子施體與拉電子受體軌域混成示意圖
目前常見的推電子材料有thiophene、pyrrole、fluorene、carbazole等,見 Fig. 2-9 ,拉電子材料則以2-3-1中介紹的聯環分子為主。 S N H H N Thiophene Pyrrole Flourene Carbazole Fig. 2-9:常見用於聚合之推電子材料
2-4. 高分子太陽能電池
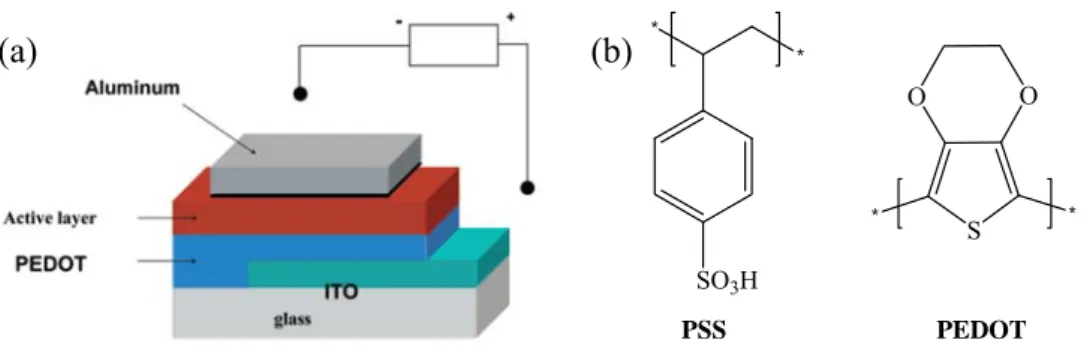
[40] 2-4-1. 操作原理 Fig. 2-10 (a)是目前常見的高分子太陽能電池結構,底層是透光的基板,如玻璃、塑膠等。接著是ITO(Indium Tin Oxide),為一具導電性的透明玻璃,
當作電池的陽極。再上去是一層PEDOT:PSS 的薄膜,厚約 30―40 奈米,
主要用來當作電洞傳導層(Hole Transport Layer),同時也可以修飾 ITO 表面
使其更平整。再上面一層是電池的主動層(Active Layer) ,通常是用 P 型的
* * S O O * * SO3H PSS PEDOT (a) (b)
Fig. 2-10:(a) 一般高分子太陽能電池元件結構 (b) PEDOT:PSS 分 子結構[40] 高分子太陽能電池的光電轉換包含數個步驟。首先是高分子受光激發後 形成激子(exciton),激子為一種高能的電子電洞對。然後激子擴散到 P-N 介 面產生電荷分離,形成自由的電子與電洞。最後藉由內建之電場驅使電子 與電洞往兩端電極移動,經外導線形成一個迴路。見Fig. 2-11。 Fig. 2-11:高分子太陽能電池操作原理示意圖。(1)吸光形成激子(2) 激子在P-N 介面間分離(3)載子往兩極移動
2-4-2. 高分子太陽能電池元件設計
高分子太陽能電子的元件依主動層不同可分成兩類,第一種是雙層結構
(bilayer devices),第二種是塊狀異質介面(bulk heterojunction devices)。
雙層結構(bilayer devices):係指元件的主動層由一層 P 型材料與一層 N 型材料所組合而成,見Fig. 2-12,此結構常見於矽的太陽能電池,但卻不 適用於有機系統。主要是由於有機材料的激子擴散長度(excition diffusion- length)太短,一般有機物其激子擴散長度大約只有 10—20 奈米[41],也就是 當有機物被激發後,激子在移動10—20 奈米之後就會降解回到基態,但有 機薄膜至少要有100—200 奈米的厚度才能將光做有效率的吸收。換而言之 對於雙層結構,整個元件只有在P-N 介面間 40 奈米的區間,激子才有能力 移動到P-N 介面進行電荷分離而產生自由載子,其餘絕大部份的激子都以 光或熱的形式降解回到基態,而元件效率也受到了大幅的限制,所以此結 構只常見於早期的有機太陽能電池文獻。但雙層結構仍有其獨特的優點, 雙層結構在載子的傳導和收集上較另一種塊狀異質介面結構佳,同時其製 程也較簡單和容易控制。
Fig. 2-12:高分子太陽能電池之雙層結構示意圖[40]
塊狀異質介面(bulk heterojunction devices)︰係指元件的主動層是由 P
型與N 型材料混合後製成的薄膜,見 Fig. 2-13。此類結構為目前高分子太 陽能電池的主流,其優點是當兩種材料混合後可形成無數個P-N 介面,激 子在形成後旋即在介面分離產生自由載子。但由於此兩種材料相互混合, 使得主動層缺乏一個完整的內建電場梯度,自由載子生成後只能依著區間 的電場變化移動,造成載子在傳遞上缺乏有效路徑,同時也增加電子與電 洞再結合的機率,故塊狀異質介面結構的載子收集率較低,但整體而言效 率還是高於雙層結構。 因載子只能依著區間電場移動,主動層的微結構成了影響元件效率的重 要因素。有序結構與適當的相分離有助於元件的效率提升,如P3HT/PCBM 的系統,當元件經過退火後會因P3HT 結晶而與 PCBM 產生相分離,可將 效率從3%提升到 5%[42]。
Fig. 2-13:高分子太陽能電池之塊狀異質介面元件結構示圖[40] 2-4-3. I-V 曲線與元件效率 太陽能電池可當成一個二極體,當我們對電池施一外加偏壓並測量電流 即可得到一條I-V 曲線圖,Fig. 2-14 為太陽能電池在不照光和照光兩種情形 下的I-V 曲線圖。可發現當電池未照光時,其 I-V 曲線與普通的二極體無異, 但當電池照光後因自身產生電流,導致在未加偏壓時即測得一個數值為負 的電流,短路電流(short circuit current,Isc),係為曲線與 y 軸的交點。隨著
偏壓的增加,電流逐漸減少,直至電流歸零時稱此時的偏壓大小為電池的 開路電壓(open circuit voltage,Voc),係為曲線與 x 軸的交點。在第四象限的
mpp mpp out oc sc e in in in mpp mpp oc sc
V
I
P
V
P
P
P
V
I
FF
V
I
η
=
=
×
=
×
×
×
=
×
I
FF
其中Pin係指光照強度,Vmpp與Impp係指最大功率之點的電壓跟電 流,FF 則稱為填充因子(fill factor)。 Fig. 2-14:太陽能電池 I-V 曲線圖。虛線為未照光 的情況。實線為照光的情況[40]開路電壓(Voc):在太陽能電池中,所能獲得的最大電壓,是由 P 與 N
兩種半導體的準費米能階差(quasi Fermi level)所決定。對於有機系統的太陽
能電池,P 型的準費米能階係指推電子材料的 HOMO,而 N 型的準費米能 階則是拉電子材料的LUMO。 C. Brabec 等人很清楚的指出[43],開路電壓與N 型材料的 LUMO 能階呈 線性關係,見Fig. 2-15(a)。Scharber 等人也報導了 26 種異質介面的太陽能 電池,發現其Voc與推電子材料的HOMO 呈線性關係[44],見Fig. 2-13(b)。 (a) (b)
短路電流(Jsc):在理想狀態下,短路電流係由光生成的電荷載子密度
(photoinduced charge carrier density)與載子移動速率(carrier mobility)所決
定,可表示成下列公式: SC
I
=
ne E
μ
n 是電荷載子的密度,e 是載子電荷量,μ 是載子移洞速率,E 是內建電場 大小。內建電場則是由P-N 介面的能階差質所決定。至於載子的移動速率, 它不僅是材料本身的性質,同時也是元件的變數。在有機太陽能電池中, 載子的傳導速率會因為有機薄膜的奈米形貌(nanomorphology)而有所改變 [45]―[47]。而有機薄膜的奈米形貌通常決定於薄膜的製備方法,其變因大概有 幾種,如溶劑的種類、溶劑揮發的速率還有基板的溫度及蒸鍍的方法等。 2-4-4. 低能隙高分子應用於有機太陽能電池 Fig. 2-16[48] 為地球表面所接收到的太陽光光譜(AM 1.5),可發現太陽光 的能量主要集中在可見光區與近紅外光區,以矽晶圓的能隙1.1 eV 來估算 可吸收地表太陽光的77%。大部份的有機半導材料能隙約在 2.0 eV (620 nm) 附近,至多只能吸收地表太陽光30%[41],為了要增加吸光的範圍,我們需 要低能隙的有機半導體材料應用於電池的主動層。Fig. 2-16:太陽光光譜圖[48] 現今低能隙高分子應用在有機太陽能電池,主要以施體―受體此種共聚 高分子較為常見,由於此種高分子在能階的位置與能隙的大小上具有較佳 的調控性,不像單以芳香族聯環分子聚合之高分子,容易有能隙過低或是 在大氣下易氧化等問題。但施體―受體的高分子仍然有著電洞傳導速率過 低的問題,導致即使已降低能隙增加吸光範圍,但電洞仍無法有效從電池 中傳導出來,因此效率並無顯著的增加。
2-5. 高效率高分子材料
2-5-1. poly(3-hexyl thiophene) (P3HT):
P3HT 應用於高分子太陽能電池,早已被廣泛的研究。其中規則性
P3HT(Regioregular P3HT,rr-P3HT)與 PCBM 製成之塊狀異質介面太陽能電
池,目前外部量子轉換效率(external quantum efficiencies)可達 75%,整體能
量轉換效率則有5%[42][49],是目前少數幾種高分子效率可超越5%的材料。
rr-P3HT 係指 3-hexyl thiophene 以頭對尾(head-to-tail,HT)規則性鍵結,
見Fig. 2-17。因為 rr-P3HT 具有結晶性,所當它與 PCBM 混合後可藉由“溶
劑退火(solvent annealing)”[50]、“熱退火(thermal annealing)”[42]等方式使主動
層出現相分離而形成rr-P3HT 結晶區與 PCBM 的聚集區,使整個元件的載 子移動速率提升並且降低載子再結合的機率,所以單一元件效率可達5%。 S S S S S S S S H-T H-T H-T H-H T-T H-T Regioregular P3HT Random P3HT
Fig. 2-17:Regioregular P3HT 與 Random P3HT 示意圖。H: Head T: Tail
最近我們實驗室成功合成出一個新的rr-P3HT 衍生物[51],是將thiophene 的3 號位子的長碳鏈改以 imdiazole 的分子基團取代,再聚合形成高分子, 見Fig. 2-18(a)。此設計原理主要是希望能藉由在側鏈接上一個拉電子基 團,使得主鏈在被光激發後,激子可先藉由分子內的電荷轉移(Intramolecular Charge Transfer),讓電子與電洞先行分離爾後再將電子轉移到 PCBM 上, 加強電荷分離的效果。 S N N C6H13 C6H13 C6H13 n rr-PHPIT (a) (b)
由Fig. 2-18(b) 可發現 rr-PHPIT 在 552 nm 較 P3HT 紅位移了 40 nm,且 吸收範圍也變得比較寬,C. Y. Chang 認為這是因為主鏈與側鏈是屬於一推 一拉的電子特性,因而增長了分子鏈的共軛長度。而在元件效率上,rr-PHPIT 的表現也比P3HT 好,見 Table 2-1,究其原因,除了 rr-PHPIT 具有較佳的 吸光特性外,最主要的原因是rr-PHPIT 在電洞的傳導率上比 P3HT 好,見 Table 2-2。此外我們還可以發現,rr-PHPIT 與 PCBM 製成元件後,元件在 電子與電洞的傳導率上非常的接近,這也是整體效率比P3HT 好的原因。 Table 2-1:不同退火時間對元件效率之影響[51]
Blend annealing at 120℃ Voc[V] Jsc[mA·cm-2] FF[%] PCE[%]
PHPIT/PCBM(1:1,w/w) for 20 min 0.6 8.3 62 3.1 PHPIT/PCBM(1:1,w/w) for 30 min 0.61 11.3 60 4.1 PHPIT/PCBM(1:1,w/w) for 45 min 0.61 7.8 58 2.7 P3HT/PCBM(1:1,w/w) for 30 min 0.58 7.6 66 2.9
Table 2-2:不同退火時間對元件中載子傳導速率之影響[51]
Blend annealing at 120℃ Hole mobility [μh, cm2Vs-1]
Electron mobility [μe, cm2Vs-1]
[μe/μh]
P3HT/PCBM(1:1,w/w) for 30 min 1.8±0.1×10-6 1.8±0.1×10-5 10 PHPIT/PCBM(1:1,w/w) for 20 min 9.0±0.3×10-6 2.6±0.1×10-5 2.9 PHPIT/PCBM(1:1,w/w) for 30 min 1.9±0.1×10-5 4.2±0.1×10-5
2.2 PHPIT/PCBM(1:1,w/w) for 45 min 6.5±0.1×10-6 2.11±0.1×10-5 3.2
2-5-2. Benzothiadiazole (BT):
2,1,3-benzothiadiazole 做為拉電子基團應用於施體―受體的低能隙高分
子,根據目前研究的文獻顯示其元件效率有相當不錯的表現,Fig. 2-19 為
數種不同推電子基團與BT 共聚的高分子。Table 2-3 為各種高分子的元件
C8H17 C8H17 S N S N S n N C8H17 C8H17 S N S N S n S S C8H17 C8H17 N S N n S Si S C8H17 C8H17 N S N n S S N S N S m n C6H13 C6H13 C6H13 C6H13 poly(TPT) PSBTBT APFO-3 PCPDTBT PCDTBT Si C8H17 C8H17 S N S N S n PSiF-DBT Fig. 2-19.:數種高效率施體―受體共聚高分子之分子結構
Table 2-3: Fig. 2-15 中各高分子元件效率
P-type N-type Voc[V] Jsc[mA·cm-2] FF[%] PCE[%]
APFO3 PCBM 1.03 6.2 43 2.8 PCBM 0.89 6.92 63 3.6 PCDTBT PC71BM 0.88 10.6 66 6.1 PCBM 0.65 9.0 45 2.67 PCPDTBT PC71BM 0.62 16.2 55 5.5 PSiF-DBT PCBM 0.90 9.5 50 5.4 PSBTBT PC71BM 0.68 12.7 55 5.1 poly(TPT) PC71BM 0.80 10.1 53 4.3
APFO-3[52] 因 Flourene 並非強力的電子施體,所以 APFO-3 在吸光特性
的表現上與P3HT 的吸收位置相近,能隙約為 1.92 eV。在調控主動層形貌
後,效率可達2.8 %,其較佳效率主要是由於 Voc的值高達1 V。
隊已將PCDTBT 的效率提升到 6.1 %。其效率的提升主要是在於主動層型 貌的調控及利用Optical spacer 增加光的吸收量,使元件的電流大幅增加。 cyclopenta[2,1-b;3,4-b´]-dithiophene 是一個具有較強推電子能力的分子 基團,與BT 共聚後使得 PCPDTBT[55]的光學能隙大幅降至1.4 eV (890 nm)。 同時因為其結構是由兩個共平面的thiophene 所組成,因此電洞的傳導速率 也獲得了提升,所以在最早的元件上Jsc就已達到9 mA·cm-2。2007 年 J. Peet[56] 等人在元件製程上利用alkane dithiols 改良主動層的形貌,更使得 Jsc大幅增 加到16 mA·cm-2,效率也從2.67 % 提升至 5.5 %。 2008 年初 E. Wang[57]等人報導了一個新高分子PSiF-DBT,其結構與
APFO-3 非常相似,只單純將 Flourene 上的四級碳用矽原子取代。E. Wang
等人發現PSiF-DBT 的光學能隙較 APFO-3 下降了 0.1 eV (1.82 eV),而在元
件的表現上卻發現Jsc較APFO-3 增加了約 3 mA·cm-2,效率也從2.8 %增加
到5.4 %,作者認為矽不僅增強了分子的共軛長度,同時更大幅提升了高分
子對電洞的傳到速率,由field-effect transistor 量測得知 PSiF-DBT 的電洞傳
導率高達10-3 cm2V-1s-1,幾乎是APFO-3 (3×10-4 cm2V-1s-1)的十倍。同年 Yang Yang[58]的團隊仿照 PSiF-DBT 想法,將 cyclopenta[2,1-b;3,4-b´]-dithiophene
上的四極碳改用矽原子取代,發現在一般製程下元件效率高達5.1 %,同時
Thiophene-Phenylene-Thiophene(TPT)[59]因其結構上具有良好的平面 性,在與BT 聚合後可增加高分子傳導電洞的能力,文獻指出 poly(TPT)的 電洞傳導率為3.4×10-3 cm2Vs-1,反應在元件效率上,Jsc達到 10.1 mAcm-2。 2-5-3. Diketo-Pyrrolo-Pyrrole (DPP): Rene´ A. J. Janssen[60]團隊發表了一個新的低能隙高分子,是以DPP 為 拉電子基然後與推電子基thiophene 共聚而成,見 Fig. 2-20。pBBTDDP2 分 子在薄膜態能隙約為1.4 eV 且有著很特別的吸光特性,在 Fig. 2-21 我們可 以發現此高分子在不同溶劑下有著截然不同的吸光範圍,作者認為 pBBTDDP2 在 o-dichlorobenzene(OCDB)中會因紅位移而大幅增加吸光範 圍,是由於高分子在此溶劑中較易傾向聚集或結晶。最後在調整元件參數 後,作者發現利用OCDB 與 Chloroform 共溶劑成膜具有較高的原件效率, 這可能是因為半結晶的高分子薄膜有著較佳的載子傳導率。Table 2-4 列出 不同成膜條件的元件效率。
N N O O R R ∗ ∗ N N O O S S S S C12H25 C12H25 n DPP pBBTDPP2 Fig. 2-20:DPP 與 pBBTDPP2 之分子結構
Table 2-4:pBBTDPP2 在不同成膜條件下之元件效率[60]
Voc[V] Jsc[mAcm-2] FF[%] PCE[%]
pBBTDPP2:[60]PCBM
from chloroform 0.78 2.4 41 1.1 pBBTDPP2:[60]PCBM
from ODCB suspension 0.66 9.4 47 2.9 pBBTDPP2:[60]PCBM from chloroform:ODCB 0.63 9.4 54 3.2 pBBTDPP2:[70]PCBM from chloroform:ODCB 0.61 11.3 58 4.0 2009 年 M. Leclerc[61] 團隊也利用DPP 與他們自行開發的 Carbazole 衍生 物聚合,見Fig. 2-22(a)。我們發現 PCBTDDP 在吸收上較 pBBTDDP2 藍位 移,而且也沒有發生像pBBTDDP2 在薄膜態時產生的大幅紅位移,可能是 因為Carbazole 本身的推電子能力較 thiophene 弱,還有就是高分子並無法 像pBBTDDP2 具有那麼好的堆疊特性,經計算,在薄膜態時分子的能隙為
Fig. 2-22:(a) PCBTDDP2 分子結構 (b) PCBTDDP2 的 UV-Vis 吸收光譜[61]
Part A
低能隙高分子 pCTDDP 之合成與研究
A1. 研究動機
由第二章所述,可發現 DPP 可做為一個強力的拉電子受體,同時此結構 具有較強的 π-π 作用力可能可以促使高分子具有良好的堆疊,使高分子 展現出較高的電洞傳導速率,因此我們試想是否能再進一步降低高分子的 能隙及提升其電洞的傳導的速率。為此我們利用cyclopenta[2,1-b;3,4-b´]- dithiophene 當做高分子的施體,希望藉由共平面的 thiophene 增加高分子的 共軛長度與電洞的傳導速率。Fig. A-1 為 pCTDPP 的分子結構。 S S S N N S O O nA2. 實驗
A2-1. 藥品
名稱 廠商
t-Amyl alcohol ACROS
Thiophene-2-carbonitrile ALFA
Dibutyl succinate TCI
18-Crown-6 TCI
2-ethylhexyl bromide TCI
N-bromosuccinimide ACROS
Sodium hydrogen carbonate SHOWA
Aliquat®336 TCI
Tetrakis(triphenylphosphine) Palladium TCI
Benzeneboronic acid Aldrich
上述所列藥品,不純化直接使用。甲苯經過 CaH2除水蒸餾,其餘皆購
自於Merck、Aldrich、Mallickrodt、Fisher Scientific、聯工等公司。
A2-2. 儀器
A2-2-1. 核磁共振光譜儀(Nuclear Magnetic Resonance,NMR)
使用Varian Unity-300核磁共振儀。其中以 d-chloroform 為溶劑時,氫 譜以溶劑訊號δ=7.26 ppm 當作內標準,碳譜以δ=77.24 ppm 為內部標準。
A2-2-2. 凝膠滲透層析儀(Gel Permeation Chromatography,GPC)
使用 Water 410 Didderential Refractometer 及 Water 600 Controller
(Waters Styragel Column),以 polystyrene(PS)標準品製作分子量校正曲線。
樣品溶液之配製為每2.0 mg 溶於 1.0 mL Tetrahydrofuran(THF)中並加入一滴
的Toluene。測試時以 THF 為沖堤液,流速 1 ml/min 並保持於 40℃的衡溫
槽中。
A2-2-4. 循環伏特安培計(Cyclic Voltammetry,CV)
使用 Autolab 的 AVD 164 型電位儀來紀錄氧化-環原電位。配置 0.1M
tetrabutylammonium hexafluorosphate(TBAPF6) 的 Acertonitrile 為 電 解 液
3mL,通入氮氣 1 分鐘,將待測的樣品配製為 10mg/mL(溶於 THF 中)的溶
液 , 塗 佈 於 工 作 電 極 上 , Ag/Ag+ 為 參 考 電 極 , 並 以
ferrocene/ferrocenium(Fc/Fc+)為內參考電極,以碳電極為工作電極,白金絲
為導電電極,掃瞄速率為100mV/S,範圍-200~2000 mV 與-200~-2000mV。
A2-2-5. 微差掃瞄式卡計(Differential Scanning Calorimeter,DSC)
使用Perkins Elmer Pyris DSC1 及水浴系統。溫度以 indium 及 tin 做校
正,實驗秤取樣品2—5 mg,加熱速率為 10℃/min,用以量測樣品之玻璃轉
換溫度(Tg)。
A2-2-6. 熱重分析儀(Thermal Gravimetric Analyzer,TGA)
使用Du Pont TGA-2950 熱重分析儀。實驗時秤取樣品 2—10mg,加熱
速率為10℃/min,並在氮氣流量 100ml/min 下測其熱穩定性。
A2-2-7. 旋轉塗佈機(Spin Coater)
製造商:LAURELL,型號:MODEL WS-400B-6NPP/LITE。用以將配
薄膜。
A2-2-8. 模擬光源
製造商:New port,型號:6902 Oriel 150W Xenon lamp solar simulator。
自然太陽光源會受到各種因素干擾,使用模擬太陽光源可以將實驗參數固 定於相同的條件下,且不受天氣因素影響。利用氙氣搭配透鏡可以模擬出 光源頻譜強度為AM 1.5 的均勻穩定光源。 A2-2-9. 光強度偵測計 製造商:OPHIR thermalpie。利用熱感應的方式來定量光的強度,用來 搭配模擬太陽光源,可以校正光源的強度來達到所要求的強度與頻譜。 A2-2-10. 電性分析儀 製造商:Keithley,型號:Model 236。用以量測元件的 I-V 曲線,並計 算光電效率。靈敏度10fA, 10μV。
A2-3. 合成
A2-3-1. 合成 Diketo-pyrole-pyrole 3,6-dithiophen-2-yl-2,5-dihydro-pyrrolo[3,4-c]pyrrole-1,4-dione (A1) 取鈉 (0.49 g, 21.3 mmol)置入三頸瓶中,加入t-amyl alcohol (10 mL)與少 量氯化鐵。然後將溫度升至90℃攪拌反應至鈉完全溶解後,使溫度再降回 50℃,並將thiophene-2-carbonitrile (0.99 mL, 10.64 mmol)加入反應瓶中並使溫度再升至90℃。取dibutyl succinate (1 mL)加入t-amyl alcohol (4 mL)稀釋
後,使其緩緩滴入反應瓶中,待完全滴入後將溫度維持在90℃攪拌反應20 hr,接著再降回至50℃並緩緩加入醋酸(5 mL),此時有固體析出,之後再加 熱至迴流攪拌10 min,最後再將溫度冷卻至室溫。然後把反應的混合液過 濾,所得固體以熱水與熱甲醇清洗數次後得紅色固體。 2,5-Bis-(2-ethyl-hexyl)-3,6-dithiophen-2-yl-pyrrolo[3,4-c]pyrrole-1,4-dio ne (A2)
取化合物A1 (2.5 g, 8.33 mmole) 置入雙頸瓶中,加入Dimethylformamide
(DMF)溶解後,再加入碳酸鉀(3.83 g, 27.75 mmole)及少量18-crown-6,並使
反應溫度升至120℃。將2-ethylhexyl bromide(4.89 mL, 27.49 mmole)以
反應overnight。讓溫度回到室溫,將反應的混合液過濾並以三氯甲烷清洗濾 餅,取有機層並水萃取以移除DMF,之後將有機層加入無水硫酸鎂除水, 過濾、濃縮。以乙酸乙酯/正己烷為:1/6進行管柱層析,得2.05 g,產率47 %。 1H NMR(300 MHz, CDCl 3): δ 8.86 (dd, 2H, J = 1.2, 3.9 Hz), 7.60 (dd, 2H, J = 1.2, 4.8 Hz), 7.24 (dd, 2H, J = 1.2, 4.8 Hz), 3.97 (vt, 4H, J = 7.8 Hz), 1.82–1.84 (m, 2H), 1.21–1.38 (m, 16H), 0.76–1.20 (m, 12H) 13C NMR(75 MHz, CDCl 3): δ 161.7, 140.4, 135.2, 130.5, 129.8, 128.4, 107.9, 45.8, 39.1, 30.2, 28.3, 23.5, 23.0, 14.0, 10.5 GC-MS(m/e):524 (M+) 2,5-Bis-(2-ethyl-hexyl)-3,6-bis(5-bromo-thiophen-2-yl)-pyrrolo[3,4-c]py rrole-1,4-dione (M 1) 取化合物A2 (0.5 g, 0.95 mmole)置入雙頸瓶中,加入三氯甲烷(30 mL) 與醋酸(30mL) 使其溶解,之後利用鋁箔紙將反應瓶包覆後,再將 NBS(0.36 g, 2.0 mmole)加入,在室溫下攪拌 48 小時。之後將反應的混合液倒入水中 (100 mL),並以三氯甲烷萃取,取有機層加入無水硫酸鎂除水,過濾、濃縮。 以三氯甲烷/正己烷為:5/3 進行管柱層析,得 0.34 g,產率 53 %。 1H NMR(300 MHz, CDCl ): δ 8.62 (d, 2H, J = 4.5 Hz), 7.19 (d, 2H, J = 4.5 Hz),
Anal. Calcd. for C30H38Br2N2O2S2 : C, 52.79; H, 5.61; N, 4.10. Found: C, 52.50; H, 5.34; N, 3.77. A2-3-2. cyclopenta[2,1-b;3,4-b´]-dithiophene(M2) M2 由本實驗室的共同工作者所提供。 1H NMR(300 MHz, CDCl 3): δ 7.40(s, 2H), 1.78(m, 4H), 1.33(s, 24H), 1.09–1.27(br, 24H), 0.82(t, J = 6.9 Hz, 6H) 13C NMR(75 MHz, CDCl 3): δ 161.4, 143.8, 131.0, 84.0, 52.7, 37.8, 31.7, 30.0, 29.2, 29.2, 24.7, 24.4,22.6, 14.0 GC-MS(m/e): 654(M+)
Anal. Calcd. for C37H60B2O4S2:C, 67.89; H, 9.24. Found: C, 67.70; H, 9.42
A2-3-3. 合成 PCTDPP
將化合物 M1 (100 mg, 0.03 mmol) 、M2 (96.1 mg, 0.03 mmole)、 Aliquate®336(~15 mg)、甲苯(2.82 mL)及 2M K2CO3水溶液(1.41 mL),加熱
到60℃用氮氣 purge 除氧 10 分鐘。冷卻後加入 Pd(PPh3)4(~20 mg),並將反
應瓶升溫至110℃。攪拌 8 小時後,加入 benzeneboronic acid(24.3 mg, 0.29 mmol)反應 12 小時後,再加入 bromobenzene(44.7 mg, 0.29 mmol),持續攪
拌 12 小時。將反應降至室溫,滴入甲醇/蒸餾水:7/3 進行再沉澱,過濾,
烘乾。利用Soxhlet extraction 裝置,以甲醇、丙酮與正己烷清洗產物,最後
mg,產率 59 %。 1H NMR(300 MHz, CDCl 3): δ 8.86(br, 2H), 7.15(br, 2H), 6.89–6.93(m, br, 2H), 4.06(br, 4H), 1.87(br, 6H), 1.23(br, 40H), 0.87(br, 18H) 13C NMR(75 MHz, CDCl 3): δ 160.9, 159.6, 143.3, 138.2, 137.3, 127.6, 123.4, 118.3, 107.8, 54.5, 45.9, 39.2, 37.9, 31.8, 30.1, 29.6, 29.4, 29.3, 28.6, 24.5, 23.7, 23.1, 22.6. 14.0, 10.6, 0.9
Calcd. for C55H74N2O2S4 : C, 71.53; H, 8.08; N, 3.03. Found: C, 72.08; H, 7.89;
N, 3.03.
A2-4. 高分子太陽能電池元件製作
1. 將 pattern 過的 ITO 玻璃利用超音波震盪依下列流程清洗:清潔液(10 min)
Æ 清水(10 min) Æ 甲醇(40 min) Æ 丙酮(40 min) Æ 異丙醇(40 min)
2.將清洗好的 ITO 玻璃用 UV-Ozone 照射 10 min 以便去除表面有機物。
3.在 ITO 玻璃上旋轉塗佈 PEDOT:PSS(5000 rpm, 40 s)。
4.調配主動層溶液(20 mg/ml),並旋轉塗佈於 PEDOT:PSS 層上方(1000 rpm,
1 min)。
5.先利用 THF 除去覆蓋在電路上多餘的主動層,再用甲醇同樣除去覆蓋在
A3. 結果與討論
A3-1. 合成部份
A3-1-1. 單體 M1 之合成
合成反應步驟如Scheme A-1 所示,首先以 thiophene-2-carbonitrile 與
dibutyl succinate 為起始物在強鹼的環境下反應生成化合物 A1。化合物 A2
利用SN2反應接上2-ethylhexyl bromide 生成化合物 A3。化合物 A2 再經
N-bromosuccinimide 溴化產生化合物 M1。
A3-1-2. pCTDPP 聚合反應
化合物 M1 與本實驗室所合成出的 Cyclopentadithiophene 硼化物為單
體,在1:1 之比例下以 Pd(PPh3)4催化進行Suzuki Coupling 反應,並於反應
結束前,分別加入benzeneboronic acid 與 bromobenzene 以消去末端尚未反
應之官能基。反應溶液再沉澱後,置入Soxhlet extraction 裝置,以分別以熱
甲醇、丙酮與正己烷連續萃取,最後以三氯甲烷溶解產物,並於甲醇中進
Scheme A-1 S CN + O O O O C4H9 C4H9 S H N N H O O S S N N O O S S N N O O S Br Br Na t-amyl alcohol NBS Br K2CO3 DMF CHCl3 / HOAc A1 A2 M 1 18-crown-6 Scheme A-2 S S B B O O O O + M 1 M 2 Toluene K2CO3 Pd(PPh3)4 N O
A3-2. 高分子物理性質
A3-2-1. GPC 量測 分子量與高分子的物理性質息息相關,同時每個高分子鏈末端對於有機 電子元件來說如同結構缺陷,但分子量越高會降低高分子的溶解度,同時 也會使得高分子的分子量分佈過大使分子性質不穩定。於我們的需求,我 們希望高分子的分子量至少能大於一萬,這樣高分子才能具有較佳的成膜 性質與電性。 目前最佳實驗結果,pCTDDP 的數目平均分子量為 18010 Da,重量平 均分子量為38216 Da,PDI 為 2.12,且易溶於 chloroform、THF 等常見的 溶劑中。 Table A-1:pCTDPP 分子量Mn(Daltons) Mw(Daltons) PDI pCTDPP 18010 38216 2.12 Mn:數目平均分子量 Mw:重量平均分子量 Mw/Mn(polydispersity):用以表示分子量分佈的寬度。 A3-2-2. DSC 和 TGA 測量 DSC 和 TGA 主要用來觀察化合物的熱性質,DSC 可測量玻璃轉移溫 度;TGA 可測量重量隨溫度變化和裂解溫度,由其重量損失百分率可觀察
高分子的熱穩定性。熱穩定性對元件或高分子的穩定性相當的重要,有機 電子元件即因其熱穩定性差而常遭人詬病。 pCTDPP 的玻璃轉換溫度高達 150℃,在一般環境下的元件操作範圍 20―80℃具有不錯的穩定性。熱裂解溫度上,可發現約在 385℃時達到 5% 的重量損失,到約 400℃以後高分子開始迅速瓦解,見 Fig.A-2。 (a) 50 100 150 200 250 -1.5 -1.0 -0.5 0.0 0.5 1.0 1.5 Tg~150oC He at fl ow end o do wn Temperature (o C) 60 70 80 90 100 110 los s (%) (b)
Table A-2: pCTDPP 的玻璃轉換溫度與熱裂解溫度 Tg(℃) Td(-5%)(℃) Td(-10%)(℃) pCTDPP 150 385 412 Tg:玻璃轉移溫度。 Td(%):樣品重量損失百分率的溫度。 A3-2-3. 溶解度測試 在高分子太陽能電池元件製程中,一般是利用旋轉塗佈的方式來製備 高分子薄膜,因此高分子的溶解度也是影響製程的一大要素,TableA-3 列 出高分子 pCTDPP 對常見溶劑之溶解度。pCTDPP 對大部份的溶劑都有良 好的溶解度。 Table A-3:pCTDPP 之溶劑度測試
Toluene Chlorobenzene chloroform o-DCB THF
pCTDPP + + + + + + + + + +
o-DCB:o-dichlorobenzene + +:溶解;+ -:加熱溶解
A3-3. 光學性質
Fig. A-3 為高分子 pCTDPP 的 UV-Vis 吸收光譜,其光譜的性質總結於
Table A-4。在 CHCl3溶液狀態下有主要的吸收峰位於756 nm,此外在 427 nm 也有一個微弱的吸收訊號。在薄膜態時,可發現高分子的吸收峰的位置並 無明顯的變化只有稍微的紅位移,比較特別的是在838 nm 有一個吸收峰出 現,此吸收峰在溶劑態時並不明顯,可能是由於薄膜態時分子間的π-π 作用 力加強了此區的吸收,此外也可發現,高分子在溶液態時似乎也已有些微 的聚集現象發生。 不過最令人感到興趣的則是 pCTDPP 的吸收範圍,在運用較強的推電 子基團cyclopenta[2,1-b;3,4-b´]-dithiophene 後,薄膜態時高分子吸收的 onset 已紅位移到 948 nm (1.31 eV),與 2-5-3 中以 thiophene 為施體之高分子 pBBTDPP2 相較[60],光學能隙縮減了0.09 eV (1.4 eV Æ 1.31 eV)。此外 pCTDPP 具有相當寬廣的吸收範圍,在高分子的吸收範圍寬達 500 nm (500 nm ― 1000 nm)。吸收了大部份的可見光與部份近紅外光,與 P3HT 的吸收 區相比(450 nm ― 650 nm),兩者吸光範圍正好具有互補的功能,故 pCTDPP 也很適合與P3HT 一起應用於 tandem cell。
300 400 500 600 700 800 900 1000 1100 1200 1300 0.0 0.2 0.4 0.6 0.8 1.0 N o rm ail z ed A b sorptio n Wavelength (nm) polymer in CHCl3
polymer Film from Chlorobenzene
427 756 838 772 Fig. A-3:pCTDDP 的吸收光譜。溶劑態(黑色實線),薄 膜態(紅色虛線)。 Table A-4 : pCTTDPP 吸光性質整理 UV-vis λmax (nm)
In CHCl3 Film λonseta Egopt. (eV)
pCTDPP (427), (756) (427), (772),
(838) 948 1.31
a
A3-4. 電化學性質—氧化還原電位測量
為了探討應用於元件的有機材料,我們先建立能階圖,用以得知我們 選用的材料特性,預測電子與電洞分離的位置及電子轉移的效果。在此使 用循環伏安法(cyclic voltammetry, CV ),當外加電位達到待測物的反應電位 時,氧化或還原反應隨即發生,此時電流將隨著電位的變化而改變。而電 流的大小是由物質到電極表面的擴散速率所控制,所以當擴散速率遠小於 外加電位的變化速率,且電極表面的反應已趨完全時,此時電流即衰減下 來。Table A-5 為 pCTDDP 的 CV 數值的整理。 我們利用下列公式來計算HOMO、LUMO 值,其中氧化起始電位(E ) 採用伏特為單位(vs. Fc/Fc+),常數為 4.8 為 ferrocene 相對於真空狀態時之能 階。 ox onset HOMO = -4.8 - Eox onset LUMO = -4.8 - Ered onset Fig. A-4 為 pCTDPP 的 CV 量測結果,可發現其還原電位與氧化電位皆夠促使激子在P-N 介面間分離。 -2.5 -2.0 -1.5 -1.0 -0.5 0.0 0.5 1.0 -0.06 -0.04 -0.02 0.00 0.02 0.04 0.06 Cu rren t [mA] Pontential (V vs. Fc/Fc+) Fig. A-4:pCTDPP 之 CV 量測圖譜 Table A-5:pCTDDP 的電化學分析 Ered (V) a onset E (V) a ox onset HOMO (eV)b LUMO (eV) c LUMOopt (eV)d E (eV) e el g pCbzBtIm -1.49 0.15 -4.95 -3.31 -3.64 1.64
aPotential values are versus Fc/Fc+.
bHOMO determined from onset oxidation. cLUMO determined from onset reduction. dLUMOopt = (HOMO + opt
g
E )
eElectrochemical bandgap E = LUMO - HOMO. el g
A3-5. 元件效率量測
將pCTDPP 與 PCBM 以 1:3(wt/wt)的比例混合並以 chlorobenzene 為溶
劑,然後依照第四章中元件的製程流程製作高分子太陽能電池,其主動層
厚約90 nm,利用 AM 1.5(100 mWcm-2)的光照射元件,得到元件的性質如
Fig. A-5。其中 Voc = 0.6 V,Jsc = 2.76 mA·cm-2,FF = 0.60,PCE = 1.00 %。
FF 高達 0.60 這是一個製作良好的元件,但短路電流只有 2.76 mA·cm-2, 仍然有著很大的進步空間,或許是我們還未找到一個較佳的成膜條件,導 致電荷載子不易往外傳導,在未來我們會嘗試各種不同的溶劑及退火溫 度,以提升元件的電流與效率。 -4.5 -4.0 -3.5 -3.0 -2.5 -2.0 -1.5 -1.0 -0.5 0.0 0.5 1.0 J ( mA/c m 2 ) Voc = 0.60 V Jsc = 2.76 mA/cm2 FF = 0.60 PCE = 1.00 %
A4. 結論
1. 我們成功利用 cyclopenta[2,1-b;3,4-b´]-dithiophene 與 DPP 共聚合成出一
新低能隙高分子pCTDPP。
2. 利用 cyclopenta[2,1-b;3,4-b´]-dithiophene 當電子施體,使高分子 pCTDPP
的光學能隙降至1.31eV (984nm)。
3. pCTDPP 之 HOMO 與 LUMO 能階分別為-4.95 eV 及-3.31 eV,適合當作
P 型材料與 PCBM 混合製成高分子太陽能電池。 4. 將 pCTDPP 與 PCBM 以 1:3(wt/wt)之比例混合製成高分子太陽能電池, 得到元件效率1.00%,其中 Voc = 0.6 V,Jsc = 2.76 mA·cm -2,FF = 0.60。 在此,元件的效率仍未最佳化,希望在未來將藉由改變成膜條件與退火 等方法,來提升元件的電流與效率。
Part B
低能隙高分子
pCbzBtIm 之合成與研究
B1. 研究動機
B1-1. 背景
共軛高分子的能隙大小與能階位置,對高分子太陽能電池的效率有很大 的影響,近來已有些文獻在討論這之間的關係。關於能隙在先前已有提過, 較低的能隙可增加吸光範圍,補捉更多光子。至於分子的能階位置,較低 的HOMO 能階可以得到較大的 Voc,而且高分子也較不易被空氣氧化。至 於LUMO 的位置,由於目前高分子太陽能電池常以 PCBM 當作 N 型材料, 為了要有較佳的驅動力促使被激發的電子從高分子轉移到PCBM,高分子 的LUMO 能階相對於 PCBM 的 LUMO 能階至少要高出 0.2—0.3 eV[62][63]。 綜合上述幾種因素,理想中的高分子其HOMO 能階要位於-5.2 和-5.8 eV 之 間,LUMO 能階要位於-3.7 到-4.0 eV 之間[64]。B1-2. 動機
能階則位於-3.6 eV。觀察其能階位置,分子能隙與 LUMO 能階還有下降的 空間,為此我們希望能置換一個較強的拉電子受體來取代BT,以縮減分子 能隙與降低LUMO 能階,但同時盡量維持 HOMO 能階的位置。 一些強力的拉電子受體已在其他文獻被人提出與探討,如thieno[3,4-b]-pyrazine(TP) [65] [66]和[1,2,5]thiadiazolo[3,4-g]quinoxaline (TQ)[67][68]。根據文獻 指出,TP對高分子的HOMO影響很大,與施體聚合易促使高分子的HOMO 能階大幅上升,故不適合我們的要求。TQ則為一很強的拉電子基團,在與
Fluorene共聚後能隙減至1.3 eV,但同時LUMO能階卻也降至 -4.0 eV,不利
於電子轉移,因此也不適合我們的要求。此外N. Blouin等人在發表PCDTBT 後也利用了一系列受體與Carbzole聚合,探討能隙與能階的變化與效率,但 仍未找到可促使效率更佳的受體[64]。 在此我們以TQ為參考的基礎,將pyrazine改以拉電子力較弱的imidazole 取代,合成新的受體B5,藉著舒緩拉電子能力,讓LUMO能階稍微上升, 同時在受體上接上溶解基提升溶解度,以期在與Carbazole共聚後可得到一 個在能階上更適合用於太陽能電池的高分子。Fig. B-1為高分子pCbzBtIm的 分子結構
pCbzBtIm N S N S N HN N S O n Fig. B-1 :pCbzBtIm 的分子結構
B2. 實驗
B2-1. 藥品 名稱 廠商 2,1,3-benzothiadiazole TCITrifluoromethanesulfonic acid Alfa
Sulfuric acid 98 % SHOWA
Fuming nitric acid Fluka
tributyl(thien-2-yl)stannane Aldrich
Bis(triphenylphosphine)palladium(II) chloride TCI
Iron powder SHOWA
Hydrochloric acid SHOWA
Hydrogen peroxide SHOWA
4,4-dibromobiphenyl TCI
Triphenylphosphine Lancaster
Sodium hydroxide SHOWA
2-isopropoxy-4,4,5,5-tetramethyl-1,3,2-dioxaborolane Aldich
1-bromo octane ACROS
Ethyl fromate Alfa
P-toluenesulfonyl chloride TCI
tetraethylammonium hydroxide SHOWA
tris(dibenzylideneacetone)dipalladium(0) TCI tri(o-tolyl)phosphine Aldich 上述所列藥品,不純化直接使用。THF 經過鈉除水蒸餾,其餘皆購自於 Merck、Aldrich、Mallickrodt、Fisher Scientific、聯工等公司。
B2-2. 合成
B2-2-1. 合成[1,2,5]thiadiazolo [3,4-g] benzimidazole 4,7-Dibromo-2,1,3-benzothiadiazole (B1) 將2,1,3-benzothiadiazole(3 g, 22 mmol)置入雙頸瓶中,再加入氫溴酸(6.6 mL),並加熱到 110 ℃。接著將溴(3.36 ml, 65.5 mmol)用加液漏斗慢慢滴入 瓶中,在滴入的過程中可發現有固體析出,等溴完全加入後再將氫溴酸(4.5 mL)加入瓶中。反應 3 hr,移去熱源,等溫度降回室溫後再把反應的混合物 倒入飽和的亞硫酸氫鈉水溶液中,抽濾取得固體。最後用熱乙醇再結晶即4,7-Dibromo-5,6-dinitro-2,1,3-benzothiadiazole (B2)
取一個三頸瓶,加入濃硫酸 (10 mL)。之後在冰浴的環境下加入
Trifluoromethanesulfonic acid (7.53 mL, 85 mmol),緊接著利用加液漏斗將的
發煙硝酸(1.8 mL, 42.5 mmol)緩緩滴入反應瓶中,此時可發現有白色固體析 出,最後再加入化合物B1 (2 g, 6.8 mmol)。反應 24 個小時後,將反應的混 合物緩緩倒入0 ℃的冰水中並且抽濾取得粗產物,為一黃色固體。最後利 用管柱層析,以乙酸乙酯/正已烷:5/95 為沖堤液,即可得到產物 1.28 g, 產率48 %。 13C NMR(75 MHz, CDCl 3): δ 151.33, 127.45, 110.27 GC-MS(EI) m/z: 384(M+) 5,6-Dinitro-4,7-dithien-2-yl-2,1,3-benzothiadiazole (B3) 取一個雙頸瓶,加入化合物B2(1.4 g, 3.6 mmol),抽真空並加熱除氧, 再用真空與氮氣系統抽灌三次,使整個系統除水除氧。緊接著加入無水的 THF (20 mL) 和 tributyl(thien-2-yl)stannane(3.5mL, 11mmol) , 然 後 加 入 PdCl2(PPh3)2 (75 mg, 2 mmol%),升溫到 80 ℃。反應四個小時後發現有橘色 固體析出,將溫度降回室溫,抽濾取得固體,並用正已烷沖洗濾餅。因為 此時橘色固體仍含有tributyl(thien-2-yl)stannane,因此我們用熱的 THF 將其 溶解,再加入大量冰的正已烷使產物析出,最後過濾即得想要的產物1.2g,
產率84.2%。 1H NMR(300 MHz, CDCl 3): δ 7.75(dd, J = 1.2, 5.1 Hz, 2H), 7.52(dd, J = 1.2, 3.6 Hz, 2H), 7.24(dd, J = 3.6, 5.1 Hz, 2H) GC-MS(EI) m/z: 390(M+) 5,6-Diamino-4,7-dithien-2-yl-2,1,3-benzothiadiazole (B4) 將化合物B3(1 g, 2.6 mmol)與鐵粉(1.7 g, 30mmol)混於醋酸( 50 mL)中, 加熱到80℃,反應 3 hr 。之後將反應的混合物倒入水中,可發現有黃色的 固體出現,然後用乙醚萃取。將收集到的有機層用5%的氫氧化鈉水溶液和 食鹽水清洗,並用無水硫酸鎂除水,過濾、濃縮,即得想要的產物0.77 g, 產率91%。 1H NMR(300 MHz, CDCl 3):δ 7.56(dd, J = 1.2, 5.1 Hz, 2H), 7.36(dd, J =1.2, 3.6 Hz, 2H), 7.25(dd, J = 3.6, 5.1Hz, 2H), 4.39(s, 4H) 13C NMR(75 MHz, CDCl 3):δ 151.22, 139.65, 135.55, 128.82, 127.78, 127.50, 107.40 4,10-Bis(thiophene-2-yl)-7-[4-(2-ethyl-hexyloxy)-phemyl]-6H-[1,2,5]thia
mmol)和 37%的 HCl 水溶液(0.343 mL, 4.23mmol),室溫下攪拌 1 hr。用 TLC 片確定反應已完成後,將反應的混合物倒入水中,用乙酸乙酯萃取,取有 機層加入無水硫酸鎂除水,過濾、濃縮,取得粗產物,再用乙酸乙酯/正己 烷:10/90 進行管柱層析,取得產物 547 mg,產率 83%,為暗紅色固體。 1H NMR(300 MHz, CDCl 3): δ 9.624(s, 1H), 9.06(dd, J = 0.9, 3.9 Hz, 1H), 8.10(d, J = 6.9 Hz, 2H), 8.02(dd, J = 0.9, 3.6 Hz, 1H), 7.58(td, J =0.9, 5.4 Hz, 2H), 7.30–7.38(m, 2H), 7.05(d, J = 8.7 Hz, 2H), 3.94(d, J = 5.7 Hz, 2H), 1.58–1.81(m, 1H), 1.25~1.58(br, 8H), 0.91–0.99(br, 6H) GC-MS(EI) m/z: 544(M+) 4,10-Bis(5-bromo-thiophene-2-yl)-7-[4-(2-ethyl-hexyloxy)-phemyl]-6H-[ 1,2,5]thiadiazolo[3,4-g]benzimidazole(M3) 取化合物B5 (500 mg, 0.91 mmol)置入雙頸瓶中,溶於 DMF(15 mL),並 將反應瓶冰浴。之後將NBS(335.2 mg,1.88 mmol)分成五份,每半小時加 入一份到反應瓶中。等NBS 添加完畢,再持續反應 15―30 分鐘,用 TLC 確定起始物已完全反應成雙溴的產物,即把反應的混合物倒入水中,用乙 酸乙酯萃取,取有機層用無水硫酸鎂除水,過濾、濃縮,得到粗產物,再 用乙酸乙酯/正已烷:5/95 進行管柱層析,即得化合物 M3。最後用二氯甲 烷和正己烷再結晶,得產物437 mg,產率 68%。 1H NMR(300 MHz, CDCl 3): δ 9,27(s, 1H), 8.73(d, 4.2 Hz. 1H), 7.92(d, J = 8.7 Hz), 7.61(d, J = 3.9 Hz, 1H), 7.25–7.26(1H), 7.19(d, J = 3.9 Hz, 1H), 6.95(d, J

![Fig. 1-2:近兩千年全球溫度變化 [3]](https://thumb-ap.123doks.com/thumbv2/9libinfo/8222406.170594/22.892.117.801.108.815/Fig12近兩千年全球溫度變化3.webp)
![Table 1-1:各種太陽能電池目前效率進展 [4]](https://thumb-ap.123doks.com/thumbv2/9libinfo/8222406.170594/24.892.139.755.178.808/Table11各種太陽能電池目前效率進展4.webp)
![Fig. 2-5:影響分子能隙的因素 [14]](https://thumb-ap.123doks.com/thumbv2/9libinfo/8222406.170594/32.892.263.643.456.806/Fig25影響分子能隙的因素14.webp)

![Fig. 2-12:高分子太陽能電池之雙層結構示意圖 [40]](https://thumb-ap.123doks.com/thumbv2/9libinfo/8222406.170594/40.892.327.643.106.351/Fig212高分子太陽能電池之雙層結構示意圖4.webp)
![Fig. 2-13:高分子太陽能電池之塊狀異質介面元件結構示圖 [40] 2-4-3. I-V 曲線與元件效率 太陽能電池可當成一個二極體,當我們對電池施一外加偏壓並測量電流 即可得到一條 I-V 曲線圖,Fig](https://thumb-ap.123doks.com/thumbv2/9libinfo/8222406.170594/41.892.343.655.114.361/Fig與元太陽能電池可當成一體當我們對電池施一外加偏壓並測量電流.webp)
![Fig. 2-16:太陽光光譜圖 [48] 現今低能隙高分子應用在有機太陽能電池,主要以施體―受體此種共聚 高分子較為常見,由於此種高分子在能階的位置與能隙的大小上具有較佳 的調控性,不像單以芳香族聯環分子聚合之高分子,容易有能隙過低或是 在大氣下易氧化等問題。但施體―受體的高分子仍然有著電洞傳導速率過 低的問題,導致即使已降低能隙增加吸光範圍,但電洞仍無法有效從電池 中傳導出來,因此效率並無顯著的增加。](https://thumb-ap.123doks.com/thumbv2/9libinfo/8222406.170594/45.892.142.792.112.866/種共聚高分子高分子問題但施體受體的高分子仍然有著電洞傳導速率.webp)