中藥對骨細胞活性的評估; evaluation of chinese herbal medicines on bone cell activities
87
0
0
全文
(2) 所以人工骨骼生醫材料的發展已成為未來“移植骨”的研究趨勢。 目前我們醫學工程實驗室開始使用一種新的天然交聯劑—綠梔子素 ( genipin ),交聯明膠( gelatin ),製備成生物膠使用。綠梔子素是由梔 子的果實裡萃取出來的一種天然交聯劑,而綠梔子素可以和氨基酸 ( amino acid )、蛋白質( proteins )等產生交聯反應,使其強度增加以延 遲體內酵素對它的分解作用,進而能存在生物體內較長的時間。並且 經過生物適應性評估,發現綠梔子素的生物毒性比常用的人工合成化 學交聯劑如:甲醛、戊二醛、carbodimide 等的生物毒性要低很多,另 外由其材料物理性質的評估結果亦顯示,經綠梔子素處理後之材料其 機械強度、降解速度,均優於人工合成化學交聯劑,因此,本研究室 乃希望以綠梔子素做為明膠之交聯劑,進而添加三鈣磷酸鹽 ( Tricalcium phosphate;TCP ),形成 GTG ( Gelatin-Tricalcium phosphate-Genipin ) 〔 2~7〕 複合材料( composite )之人工骨骼生醫材料, 以模擬天然骨骼成份中的膠原蛋白及鈣磷化合物礦物質結晶。但由於 GTG 複合材料仍是無生物活性的骨傳導作用,本實驗室為了提升所 研製之組織修復材料往組織工程邁進,嘗試欲在 GTG 複合材料中移 植骨母細胞,並在複合材料中添加藥劑以促進並維持骨母細胞的活 性,使複合材料成為骨誘發〔4〕作用,以使本身即具有骨生成的活性。 因此首先尋找能促進骨母細胞增生( proliferation )和分化 ( differentiation )能力的藥劑,及一套有效的評估方法是本實驗首重的 課題。. 1.2 具增進骨骼組織增生和分化能力之藥物. 〔8.9〕. 在目前的研究報告中發現副甲狀腺素( PTH ;10-10~10-7 M )、 血清降鈣素( calcitonin ;10- 10~10- 7 M )、雌激素( estrogens ; 10- 10~10- 8 M )、雄性素( androgens ;10- 10~10- 7 M )、類皮質固醇 ( glucocorticoids ;10- 9~10- 6 M )、Interleukin-1 ( IL-1 ;10- 12~10- 8 M )、Transforming growth factor ( TGF- a ;10- 11~10- 8 M )、 Insulin-like growth factors I/II ( IGF I/II;10 ~100 ng/mL )、 Platelet-derived growth factors ( PDGF;1~10 ng/mL )在體外實驗( in vitro )中可促進骨細胞增生。. 2.
(3) 另外,維生素 1,25(OH)2D3 ( 10- 11~10- 7 M )、雌激素( estrogens; 10- 10~10- 8 M )、雄性素( androgens;10- 10~10- 7 M )、類皮質固醇 ( glucocorticoids;10- 9~10- 6 M )、Transforming growth factor ( TGF-ß; 0.1~10 ng/mL )、Insulin-like growth factors I/II ( IGF I/II; 〔8,9〕 10 ~100 ng/mL ) 在體外實驗中則可促進骨細胞分化 ,進而表現出 高度的鹼性磷酸酵素活性和 osteocalcine 生成量。 以上這些藥物和荷爾蒙在體內實驗( in vivo )未盡理想,如活化效 果不如預期、細胞活性無法被持續維持或在此作用活性濃度下長時間 投藥會出現其他生理上的副作用抑或產生相反的效應,以及這些藥物 和荷爾蒙並非單一標的目標( target ),因此對體內其它細胞組織會有 副作用等等。 所以尋找並評估一個更理想的藥物是此次實驗努力的目標,而在 臨床上我們可以看到有相當比例的骨折患者轉而求助於傳統中醫藥 的治療,並且都獲得良好的療效。因此,本實驗室憑藉著本所(中醫 所)豐富的中醫藥資源,根據歷代典籍的文獻記載中搜尋篩選出下列 七種有關“續筋骨”、“強腰膝”記載的藥物(龜鹿膠、杜仲、骨碎 補、續斷、桑寄生、懷牛膝、菟絲子),希望能從其中找出具有促進 骨骼組織增生和分化能力之藥物,對於其中的機理想要加以探討並作 一個科學化的評估,使中醫藥在現代科學輔助下發揮更大的功效。. 3.
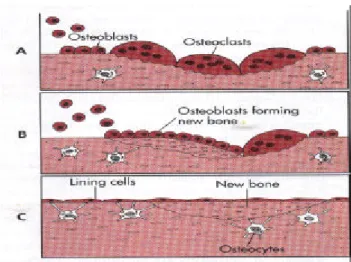
(4) 2. 文獻探討 2.1 骨骼細胞的生理 骨骼是一種特殊的結締組織,它以鈣化的網狀膠質作為人體的骨 架。其中礦物質( mineral ) / 有機物( organic ) = 3 / 1,而礦物質的 主要成份是磷酸鈣化合物 hydroxyapatite ( HAP );(Ca10(PO4)6(OH)2), 〔1,3,6〕 有機物則為膠原蛋白( collagen )。骨骼中含有三種型式的細胞 : 骨母細胞( osteoblast; O.B. )、蝕骨細胞( osteoclast; O.C. )和成骨細胞 ( osteocyte )。 O.B.是由骨生成( osteogenic )的間葉( mesenchymal )基( stromal ) 細胞演變而來 〔 10〕,其主要的功能是形成骨骼和第I型膠原蛋白( type I collagen )。O.B.能對 PTH 產生反應且在 1,25-dihydroxyvitamin D 的刺 激下能產生 osteocalcin。在骨骼的表面有一層活化的 O.B.細胞,能分 泌磷酸鈣合成類骨質( osteoid )而形成新的骨骼,並使新的骨基質 ( matrix )礦物質化( mineralize )。新骨的形成必須經過 Transforming growth factor-β ( TGF-β)、Epidermal growte factor、Insuline-like growth factor 等生長因子( growth factors )〔3〕的刺激下進一步的進行模 化( shaped )和再塑,而模化和再塑必須由 O.B.和 O.C.協調共同來完 〔1〕 成【圖 2.1】 。由於骨骼的形成和重吸收( resorption )是互相偶合 ( coupling ),因此 O.B.會分泌一些因子( factors )刺激 O.C.的活性,相 對的,O.C.也會在 PTH 的存在下受到巨噬細胞( macrophage )所分泌 的 colony-stimulating factor 和 interleukins-1,-3,-6 的刺激下促進骨骼礦 物質化〔12〕。然而 O.B.有兩種狀態,一種是活化狀態,另一種是休止 狀態。當它處於活化狀態,則會分泌合成類骨( osteoid )。而當它處於 休止狀態,則轉變為成骨細胞,包埋在已鈣化的骨基質小窩( lacuna ) 中。在適當的刺激下,休止狀態的 O.B.還會再活化。成骨細胞的主要 功能是維持負責維持基質中的有機質(organic)和無機質(inorganic)的恆定性 ( homeostasis ),使鈣、磷和其他礦物質在激素的調控下維持血漿中所 須的濃度 〔 3,6〕。 而 O.C.是一種巨大的多核細胞,它由 Hematopoietic monocyte-macrophage lineage 演變而來,其主要功能是功能則是在骨骼 生長或修復時負責重吸收( resorb )骨質〔 11,12,13〕。 4.
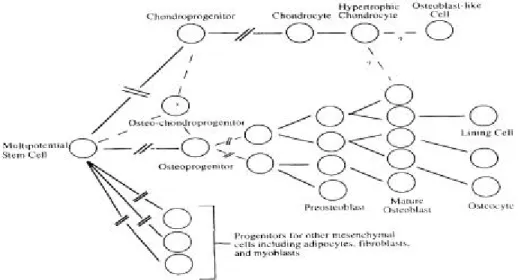
(5) 圖 2.1 骨骼的形成和再塑過程. 〔1〕. 2.2. 骨母細胞 2.2.1 骨母細胞的來源和分化 骨生成( osteogenic )細胞是由具有多種能力的間葉細胞分化而 來,間葉細胞不僅可分化成硬骨原始細胞( osteoprogenitor ),還包括 軟骨細胞( chondrocyte )、脂肪細胞( adipocytes )、纖維母細胞 ( fibroblasts )、肌細胞( myoblasts )等細胞群系【圖 2.2】〔 10〕。現在許多 研究已經證實已分化的軟骨細胞、脂肪細胞在某些刺激下能進一步逆 行性的去分化( dedifferentiate ),然後再分化( redifferentiate )轉型為骨 母細胞〔10〕因此,我們希望能尋找出能促進間葉細胞分化成這些前趨 細胞群系的細胞數目增生,然後進一步往硬骨原始細胞 ( osteoprogenitor )譜系( lineage )趨勢分化的藥物。. 5.
(6) 圖 2.2 具有多種能力的間葉細胞可分化成硬骨原始細胞、軟骨細胞、 脂肪細胞纖維母細胞、肌細胞等 〔 10〕。. 硬骨原始細胞( osteoprogenitor )可分化為骨母細胞,其主要功能 是分泌膠原蛋白( collagen )、彈性蛋白( elastin )、生太醣肝醣原 ( proteoglycan )、葡萄糖氨基肝醣原( glycosaminoglycan )等,形成類 骨質,並分泌鹼性磷酸酵素( alkaline phosphatase )參與鈣化,使最後 形成的骨骼基質礦物質化( mineralization )〔 1,3,6〕。 當新的骨骼組織形成時,有些骨骼組織會被移除,這個過程稱為 “再塑作用”,骨骼的形成主要是由骨母細胞所完成,而吸收移除則 由噬骨細胞。 成骨細胞是骨骼組織中硬骨原始細( osteoprogenitor )分化達成最 後穩定的型態,當骨母細胞經過製造骨質的活性期後,大部分會轉型 成不活化狀態的骨細胞,存在於陷窩( lacunae )中,每個細胞有許多 突起( process ),經過骨小管( canaliculus )傳輸養份,以裂隙結合( gap junction )和其它細胞連接,主要負責骨骼基質的維持有關 〔 1,3,6,10〕。. 6.
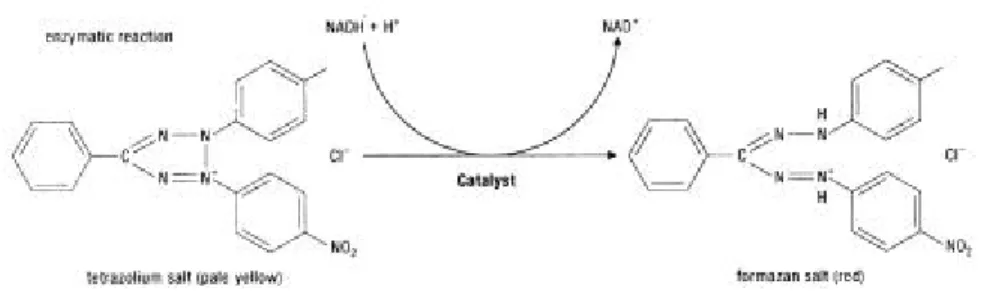
(7) 2.2.2 骨骼細胞增生和分化的過程中,可定性和定量的 生化指標( biochemical marker ) 2.2.2.a 定 量 骨 骼 細 胞 增 生 的 生 化 指 標 — MTT 分 析 MTT (3-(4,5-dimethylthazol-2-yl)-2,5-diphenyl tetrazolium bromide) reduction – a tetrazolium-based colorimetric assay for cell survival and proliferation〔 14-19〕 原理: 利用活細胞粒腺體中的 dehydrodenase可將黃色水溶性的 MTT 還原轉換成 〔17〕 暗藍色水不溶性的 formazan【圖 2.3】 ,再用溶劑( acid/alcohol – 0.04 N HCL in. isopropanol )將 formazan 溶解,然後分別在 O.D. 570nm和 O.D.650nm測其吸 光值,所得的吸光值差即和活細胞的數目成正比,因此MTT 分析可作為藥 物對骨細胞存活( survival )和增生( proliferation )能力的評估。. 活細胞的數目= ( 測試波長 O.D.570 nm ) - ( 參考波長 O.D.650 nm ) formazan 在 O.D. 550 ~ 570 nm 有最大吸光值。 胞屑( cell debris )和蛋白質在 O.D. 630 ~ 650 nm有最大吸光值,會使背景吸光值 增加造成誤差,故須減去。. 圖 2..3 活細胞粒腺體中的dehydrodenase可將黃色水溶性的MTT還原轉換成暗 藍色水不溶性的 formazan〔 17〕。 7.
(8) 2.2.2.b 定性骨母細胞分化的生化指標— 鹼性磷酸酵素染色法 ( Alkaline Phosphatase stain, ALP stain ) 〔 6,20-22〕 前驅骨母細胞( pre-osteoblast )到成熟的骨母細胞會分泌一種酵 素稱為鹼性磷酸酵素,它是結合在細胞膜表面由雙硫鍵聯接 ( disulfide-linked )的兩股多生太( polypeptide )雙體,主要和基質礦物 質化的形成有關。 而成熟的骨母細胞及成骨細胞則會分泌一種非膠原蛋白 ( noncollagenous protein,NCP ),稱為 osteocalcin,它對鈣離子具有 適度的親和力。在體外實驗中,osteocalcin 會抑制溶液中 HAP 結晶 的生長,主要作用機轉還不甚清楚,其推論可能是調節鹼性磷酸酵素 的作用,使骨骼基質在適當的時間和空間條件下礦物質化。所以當骨 骼組織中的間葉細胞分化為骨母細胞及成骨細胞愈完全,則相對的其 鹼性磷酸酵素的活性和 osteocalcin 的分泌量也就愈高。因此,我們使 用這兩種生化產物作為我們評估其分化能力的指標。 原理: 鹼性磷酸酵素是一種漿膜酵素( plasmamembraneenzyme)〔6〕,是由雙硫鍵 所聯結的雙體( disulfide-linked dimer )組成,它依靠phosphatidyl inositol linkage 和 細胞膜表面鍵結。有許多相關的 isozymes,分別來自下列不同的基因,placental isozyme, intestinal isozyme, germ cell isozyme, 及 tissue nonspecific isozyme, 而 tissue nonspecific isozyme 可在骨骼、肝臟和腎臟中大量發現,少量存在於 skin fibroblasts, leukocytes。而在骨細胞中的鹼性磷酸酵素主要是由骨母細胞所製 造,在骨骼合成發展時會大量表現,其功能是在 endochondral和 woven bone形 成的早期階段促進礦物質的沉澱。 鹼性磷酸酵素在體外〔 26-38〕 於 pH=8~10環境下,能催化水解單酯磷酸 ( monoester phosphate ),故利用此原理加入一單酯磷酸受質 naphthol AS-BI phosphate ,鹼性磷酸酵素會將其磷酸水解,剩下的 naphthol AS-BI 可和 〔 23,24〕 diazonium salt fast blue BB base 形成不可溶的紫色色素沉澱【圖 2.4】 ,因此. 可將骨母細胞的鹼性磷酸酵素活化位染成藍紫色,故對骨母細胞染色有專一性 〔 6,20,21〕. 。 8.
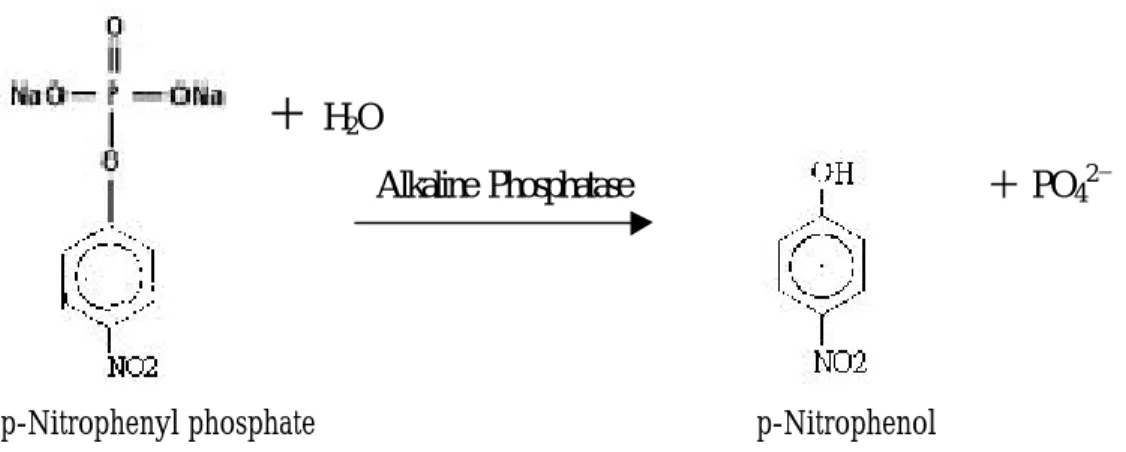
(9) +PO42-. +H2O Alkaline Phosphatase pH=8~10 Naphthol AS-BI phosphate. Naphthol AS-BI. +. Diazo Dye. naphthol AS-BI. 圖 2.4 鹼性磷酸酵素將 naphthol AS-BI phosphate 水解成 naphtholAS-BI和磷 酸,然後 naphthol AS-BI再和 diazonium salt fast blue BB base 形成不可溶的紫色 色素沉澱〔 23,24〕。. 2.2.2.c 定量骨母細胞分化的生化指標— 鹼性磷酸酵素活性分析 ( Alkaline Phosphatase Activity Assay ) 〔 6,20,21〕 原理: 利用鹼性磷酸酵素在體外於 pH=8~10 環境下,能催化水解單酯磷酸 ( monoester phosphate ),故利用此原理加入一單酯磷酸受質 p-nitrophenylphosphate,鹼性磷酸酵素會將其磷酸水解,剩下的 p-nitrophenylate anion在波長 O.D .405 nm 有最大的吸光值,故利用 spectrophotometric microplate reader在 O.D. 405 nm測其吸光值的增加速率,其吸 光值的增加速率即正比於 ALP 的活性〔 26-38〕【圖 2.5】。. 9.
(10) + H2O + PO42-. Alkaline Phosphatase. p-Nitrophenyl phosphate. p-Nitrophenol. 圖 2.5 鹼性磷酸酵素能催化水解 p-nitrophenylphosphate,而釋放p-nitrophenylate anion,在波長 O.D .405 nm 有最大的吸光值〔 26-38〕。. 以 ELISA plate reader測其連續 15分鐘每分鐘吸光值的變化,並以下列公式表示 鹼性磷酸酵素活: Mean ALP Activity ( Sigma Unit / L ) = △ALP Activity × T V ×1000 / 18.45 × LP × SV 即每 Liter 中,每分鐘有多少 Sigma Unit 的 p-nitrophenylphosphate 被 ALP 轉換 成 p-nitrophenylate anion。 △ALP Activity ( △A / min )=. Final Absorbance - InitialAbsorbance / Time. Interval ( change in absorbance per minute at 405 nm ) TV = Total Volume SV = Sample Volume 18.45 = Millimolar absorptivity of p-nitrophenol at 405 nm LP = Lightpath ( 1- cm ) 1000 = Conversion of units per mL to units per liter. 10.
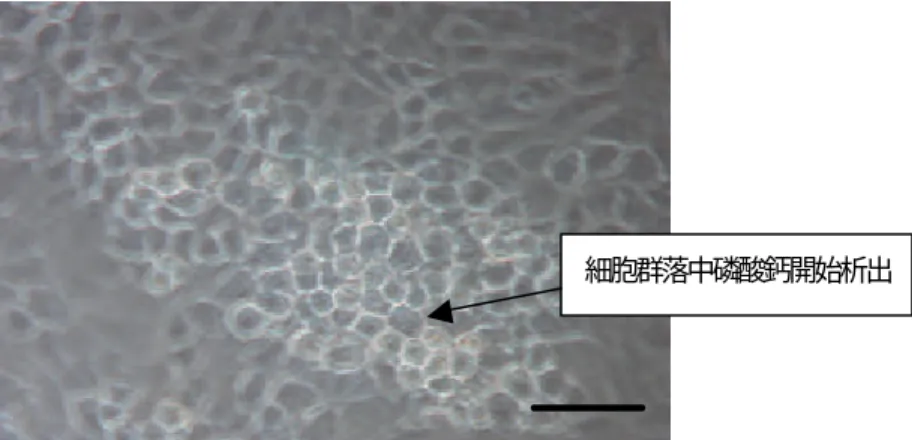
(11) 2.2.3 礦物質化結節〔 39-44〕 ( mineralized nodule )形成的評估 原理: 在骨母細胞培養中加入 50μg/ mL ascorbic acid 和 10 mM ß-glycerophosphate,經過長時間的培養( ~15天 ),單層紡錘狀的( spindle-shaped ) 成骨細胞會形成多層( multilayer )立體狀的群落( confluency ),其細胞形狀也會由 紡錘狀轉變成多角形( polygonal )【圖 2.6 ~ 2.8】,並進一步產生磷酸鈣 Hydroxyapatite ( HA )的沉澱【圖 2.9 ~ 2.12】 ,骨母細胞也會變為成骨細胞被包埋 在礦物質化的基質中,最後形成 ~ 0.1 – 0.5 mm2 的礦物質化結節。 根據研究〔 39-44〕,礦物質化結節的形態( morphological )、顯微結構 ( ultrastructural )及生化特徵( biochemical characteristic )和胚胎( embryonic ) / woven bone極為類似,亦即此礦物質化結節的形成類似在體內骨骼的生成,因 此我們可利用此實驗模型在體外快速的評估藥物對骨骼生成的影響。 而礦物質化結節的組成乃磷酸鈣化合物,因此我們可用Von Kossa’s Stain 來 染色以定量結節的數目。其原理乃是利用硝酸銀(AgNO3)溶液和礦物質化結節 中的磷酸鈣反應,生成暗褐色的磷酸銀沉澱,再計數暗褐色結節的數量以評估 藥物對骨生成( osteogenic )能力的影響。. 單層紡錘狀細胞. 多層、多角形立體狀的細胞群落. 圖 2.6 培養 15 天後骨母細胞形成多層、多角形立體狀的群落 ( scale bar=100 µm ). 11.
(12) 細胞群落中磷酸鈣開始析出. 圖 2.7 培養 15 天後骨母細胞形成多層、多角形立體狀的群落 ( scale bar=50 µm ). 圖 2.8 培養 15 天後骨母細胞形成多層、多角形立體狀的群落 ( scale bar=25 µm ). 圖 2.10 析出的 HA 結晶 ( scale bar=25 µm ) 圖 2.9 培養 21 天後形成礦物質化結節 ( scale bar=100 µm ). 12.
(13) 圖 2.12 溶液中析出單獨 的 HA 結晶 ( scale bar=25 µm ) 圖 2.11 培養 21 天後形成礦物質化結節( scale bar=200 µm ). 2.3 骨母細胞 / 蝕骨細胞共培養( co-culture ;mixed-bone cells culture ) 為了更進一步模擬骨骼的生理,我們實驗模式採用一種共培養系統,即骨 母細胞和蝕骨細胞一起培養,除了前述評估藥物單獨對骨母細胞的作用外,此 系統還可在蝕骨細胞存在的交互影響下,更接近骨骼的生理狀況評估藥物對骨 母細胞的影響,試著尋找出能促進骨母細胞生長和分化的藥物,而相反地也能 抑制蝕骨細胞。 骨母細胞是由骨生成的間質基質(stromal)細胞衍生而來,可從新生小鼠的 頭蓋骨取得〔1,3,6〕。而蝕骨細胞是一種巨大的( giant )、多核的( multinucleated )細 胞,由造血的( hematopoeitic )組織(如骨髓、脾臟細胞)所分化的單核細胞 ( mononucleated )經由膜融合( membrane fusion )而產生,和單核球-巨噬細胞譜系 ( monocyte-macrophage lineage )同屬於血液細胞( blood cells )的白血球家族 〔13〕 ( leukocyte family ),均具有高度的運動性( motility )【圖 2.13】 。我們實驗則. 是從新生小鼠的脾臟取得,首先 CFU (GM) ( granulocyte and macrophage colony-forming cells )分成兩條路徑分化,一條是巨噬細胞譜系( macrophage lineage ),最後增生和分化為巨噬細胞。另一條是單核球細胞譜系 ( monocyte 13.
(14) lineage ),而單核球細胞譜系則增生為蝕骨原始細胞(osteoclastprogenitors),進 而分化為單核的蝕骨細胞( mononuclearosteoclasts),單核的蝕骨細胞彼此互相 經由膜融合成多核的蝕骨細胞( multinuclear osteoclasts ),最後活化成具有刷狀緣 的多核蝕骨細胞( osteoclasts with ruffled borders ) 〔 10-12〕。 骨母細胞 / 蝕骨細胞共培養中,骨母細胞:脾臟細胞 = 1:50,且培養液 中須加入 PTH或 1,25(OH2)-D3,使骨母細胞刺激脾臟細胞分化成為蝕骨細胞, 本實驗則是添加 10 nM 的 1,25(OH2)-D3〔 10-12〕。. 圖 2.13 多核的蝕骨細胞分化流程圖〔 13〕. 2.3.a 定 量 混 合 骨 細 胞 培 養 ( mixed-bone cells culture )中,骨骼細 胞 增 生 的 生 化 指 標 — MTT 分 析 法 評估藥物在骨母細胞 / 蝕骨細胞共培養條件下,對骨骼細胞存活和增生 能力的影響 〔 45〕。 2.3.b 定 量 混 合 骨 細 胞 培 養 中,骨母細胞分化的生化指標— 鹼性磷酸酵素活性分析( Alkaline Phosphatase Activity Assay ) 評估藥物在骨母細胞 / 蝕骨細胞共培養條件下,對骨母細胞分化能力的 影響 〔 45〕。 14.
(15) 2.4 蝕骨細胞 2.4.1 蝕骨細胞的來源和分化 如前 2.3 節所述,蝕骨細胞來自造血的前驅細胞(hemopoieticprogenitors), 即 CFU (GM) ( granulocyte and macrophage colony-forming cells ),在體外共培養 系統中,蝕骨細胞的成熟約需 6天,可被分成 2相( phases),前 4天是蝕骨前驅 細胞的增生期,後 2天則是蝕骨細胞的分化期,每期均需不同cytokines 的刺激, 如增生期需 M-CSF ( macrophage colony-stimulatingfactor);分化期需 M-CSF 和 RANKL ( receptor activator of nuclear factor NF-kB ligand );存活和融合期需 M-CSF、RANKL和 IL-1;活化期則需 RANKL和 IL-1。另外,不同分化階段 的蝕骨細胞也表現出特殊的生化指標,如 tartrate-resistant acid phosphatase ( TRAP )、calcitonin receptors ( CTR )、vitronectin receptors 以及在骨骼或牙質 ( dentine )薄片( slices )上產生重吸收( resorption )小窩( pits )的能力〔11-13〕【圖 2.14】 〔 12〕. 。. 圖 2.14 蝕骨細胞分化過程中所需的cytokines和不同階段所表現的生化指標〔 12〕. 2.4.2 在 O.B./O.C.共培養系統中骨母細胞影響蝕骨細胞的形成 在 O.B./O.C. 共培養系統中,將取自小鼠頭蓋骨的基質細胞和取自脾臟的 造血( hematopoeitic )細胞一起培養,於培養液中添加骨營養因子(osteotropic 15.
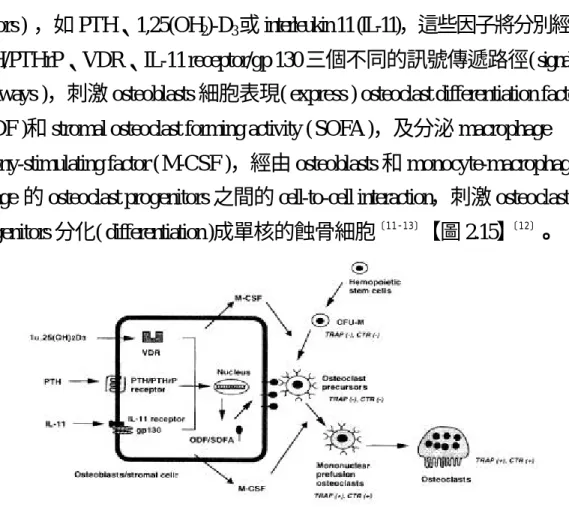
(16) factors ) ,如 PTH、1,25(OH2)-D3 或 interleukin 11 (IL-11),這些因子將分別經由 PTH/PTHrP、VDR、IL-11 receptor/gp 130 三個不同的訊號傳遞路徑( signaling pathways ),刺激 osteoblasts 細胞表現( express ) osteoclast differentiation factor ( ODF )和 stromal osteoclast forming activity ( SOFA ),及分泌 macrophage colony-stimulating factor ( M-CSF ),經由 osteoblasts 和 monocyte-macrophage lineage 的 osteoclast progenitors 之間的 cell-to-cell interaction,刺激 osteoclast progenitors 分化( differentiation )成單核的蝕骨細胞〔 11-13〕【圖 2.15】〔 12〕。. 圖 2.15 骨母細胞在骨營養因子,如 PTH、1,25(OH2)-D3 或 interleukin11 (IL-11) 的刺激下,會影響蝕骨細胞的生成〔 12〕. 2.4.3 蝕骨細胞分化的過程中,可定性和定量的生化指標 我們實驗則是以 TRAP 作為評估 O.C.分化能力的指標,而酸性磷酸酵素 ( acid phosphatase,ACP )至少有 6種 isoforms,分別存在蝕骨細胞、血球細胞 ( biood cells )和血小板(platelets),而在蝕骨細胞中的 ACP 又分為兩種同功酵素 ( isozymes ),一種是對酒石酸敏感( tartrate senstitive )的大 isozyme,另一種則為 對酒石酸具耐受性( tartrate resistant )的小 34k-Daisozyme,即酒石酸耐受性酸性 磷酸酵素( tartrate-resistant acid phosphatase ; TRAP )。TRAP 存在於蝕骨細胞的 刷狀緣( ruffled border ),當骨骼重吸收(resorption)時則被大量釋出,所以測量 TRAP 的活性即可評估蝕骨細胞的分化能力〔 45-53〕【圖 2.16】〔 54〕。. 16.
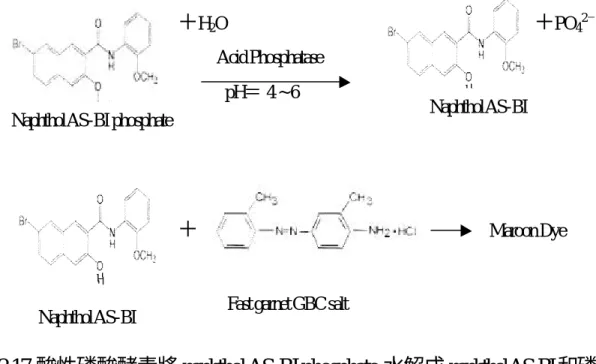
(17) 圖 2.16 蝕骨細胞重吸收時釋放出 Tartrate-Resistant Acid Phosphatase ( TRAP ) 〔 54〕. 2.4.3.a 定 性 蝕 骨 細 胞 分 化 的 生 化 指 標 — 蝕骨細胞形態觀察 酒石酸具耐受性酸性磷酸酵素染色法( TartrateResistantAcid Phosphatase Stain ) 〔 45-53〕 原理: 酸性磷酸酵素在體外於 pH=4 ~ 6 環境下,能催化水解單酯磷酸 ( monoester phosphate ),故利用此原理加入一單酯磷酸受質 naphthol AS-BI phosphate,酸性磷酸酵素會將其磷酸水解,剩下的naphthol AS-BI可和 diazotized fast garnet GBC salt 形成不可溶的褐紅色( maroon )色素沉澱,因此可將蝕骨細胞 的酸性磷酸酵素活化位染成褐紅色,故對蝕骨細胞染色有專一性【圖 2.17】 〔 23,55〕. 。. 17.
(18) +H2O. +PO42-. Acid Phosphatase pH= 4 ~ 6 Naphthol AS-BI phosphate. +. Naphthol AS-BI. Naphthol AS-BI. Maroon Dye. Fast garnet GBC salt. 圖 2.17 酸性磷酸酵素將 naphthol AS-BI phosphate 水解成 naphtholAS-BI和磷 酸,然後 naphthol AS-BI 再和 diazonium salt fast garnet GBC salt 形成不可溶的 褐紅色色素沉澱〔 23,55〕 2.4.3.b 定量蝕骨細胞分化的生化指標— 酒石酸具耐受性酸性磷酸 酵素活性分析( Tartrate Resistant Acid PhosphataseActivityAssay) 原理: 酸性磷酸酵素在體外於pH=4 ~ 6環境下,能催化水解單酯磷酸( monoester phosphate ),故利用此原理加入一單酯磷酸受質α-naphthyl phosphate,酸性磷酸 酵素會將其磷酸水解,剩下的α-naphthol可和 fastredTRsalt 形成黃色的色素 ( chromophore ),此色素在波長 O.D .405 nm 有最大的吸光值,故利用 spectrophotometric microplate reader在 O.D. 405 nm測其吸光值的增加速率,其吸 光值的增加速率即正比於 ACP 的活性〔 45-53〕【圖 2.18】〔 24,56,57〕。. 18.
(19) 圖 2.18 酸性磷酸酵素(ACP)能催化水解α-naphthylphosphate,產生α-naphthol 和 phosphate,而α-naphthol可和 fast red TR salt 形成黃色的色素( chromophore ), 此色素在波長 O.D .405 nm 有最大的吸光值〔 24,56,57〕. 2.5 實驗模型的建立 骨生成( osteogenic )細胞是由具有多種能力的間質細胞分化而 來,而間質細胞最早是來自胚胎時期的外胚層和內胚層之間,後來分 化為各種結締組織,包括骨、軟骨、肌膜、肌肉等等。 因此,我們實驗模型必須使用愈早期愈原始未分化的細胞愈好, 目前在此相關的研究所使用的實驗模型有下列幾種:初生的小鼠頭蓋 骨、懷孕 21 天的胎鼠頭蓋骨、19 天大的雞胚胎頭蓋骨和 40 天~50 天大的成鼠股骨骨髓。本實驗採用的是第一種:即剛出生 1 天內的 Sprague-Dawley 小鼠頭蓋骨作為評估藥物的實驗模型。 而蝕骨細胞是一種巨大的( giant )、多核的(multinucleated)細胞,由造血的 ( hematopoeitic )組織(如骨髓、脾臟細胞)所分化的單核細胞( mononucleated )經由 膜融合( membrane fusion )而產生,和單核球-巨噬細胞譜系 ( monocyte-macrophage lineage )同屬於血液細胞( blood cells )的白血球家族 ( leukocyte family ),即 CFU ( GM ) ( granulocyte and macrophage colony-forming cells ),均具有高度的運動性( motility )。我們實驗則是從新生小鼠的脾臟取得。. 2.6 有關“續筋骨”、“強腰膝”藥物記載的歷代中醫文獻 19.
(20) 探討和現代藥理 ( 1 ) 龜鹿膠( Gui-Lu-Jiao )〔 58-62〕 龜板膠由龜科動物烏龜 Chinemys reevesii (Gray)的腹甲經煎煮, 濃縮熬成膏狀。其主要成份為骨膠原,內含天門冬氨酸、蘇氨酸、蛋 氨酸、苯丙氨酸、亮氨酸等多種氨基酸。另含角蛋白、碘質、碳酸鈣、 磷酸鈣和銅、鋅、鍶等多種元素。 根據中醫典籍記載:《本草衍義補遺》:“大有補陰之功… … … 力 猛而兼祛瘀血、續筋骨,”。 《本草綱目•卷四十五•水龜》:“治腰 腳酸痛,補心腎,”。 《本草通玄》:“龜板鹹平,腎經藥也。大有補 水治火之功,故能強筋骨,”。《本草匯言》:“主陰虛不足,發熱口 渴,… … … 腰膝痿弱,筋骨疼痛,”。 鹿角膠由鹿科動物梅花鹿 Cervus nippon Temminck 或馬鹿 C. elaphus L.的雄鹿已骨化老角煎熬而成的膠塊。其主要成份為骨膠 原,其中以脯氨酸、賴氨酸、丙氨酸為最多。又含碳酸鈣、磷酸鈣及 銅、鐵、鈷、鉬、鑷、錳、鋅等元素。 根據中醫典籍記載:《本經》:“主傷中勞絕,腰痛嬴瘦,”。 《名醫別錄》:“療吐血,… … … 四肢酸痛,… … … 折跌傷損。”。 ( 2 ) 杜仲( Du-Zhong )〔 58-62〕 為杜仲科落葉喬木植物杜仲 Eucommia ulmoide Oliv.的樹皮。其 主要成份為杜仲膠、韖質、綠原酸、咖啡酸、黃酮類化合物及少量生 物鹼。 根據中醫典籍記載:《本經》:“主腰脊痛,補中益精氣,堅筋 骨,”。《名醫別錄》:“主腳中酸痛,不欲踐地,”。《本草備要》: “肝充則筋健,腎充則骨強,能使筋骨相著。治腰膝酸痛,”。 ( 3 ) 骨碎補( Gu-Sui-Bu )〔 58-62〕 為水龍骨科多年生蕨類植物槲蕨 Drynaria fortunei ( Kunze ) J. Sm. 的根莖。其主要成份為骨碎補酸、骨碎補雙氫黃酮柑、柚皮柑等。 根據中醫典籍記載:《開寶本草》:“破血止血,補折傷。”。 《本 草述》:“治腰痛行痺,中風鶴膝風,”。 20.
(21) ( 4 ) 續斷( Xu-Duan )〔 58-62〕 為川續斷科多年生草本植物川續斷 Dipsacus asper Wall. 的乾燥 根。其主要成份為續斷鹼及揮發油。 根據中醫典籍記載:《本經》:“金瘡癰傷,折跌,續筋骨,”。 《滇 南本草》:“補肝,強筋骨,走經絡,”。 ( 5 ) 桑寄生( San-Gji-Sheng )〔 58-62〕 為桑寄生科常綠小灌木桑寄生 Loranthus parasiticus ( L.) Merr.或 槲寄生 Viscum coloratum (Komar.) Nakai 的帶葉莖枝。其主要成份為 黃酮類、槲皮素、齊墩果酸等。 根據中醫典籍記載:《本經》:“主腰痛,小兒背強,癰腫,安胎, 充肌膚,堅髮齒,長鬚眉。”。 《日華子本草》:“助筋骨,養血脈,”。 ( 6 ) 懷牛膝( Hui-Niu-Xi )〔 58-62〕 為莧科多年生草本植物牛膝 Achyranthes bidentata Blume 的根。 其主要成份為促脫皮留醇、牛膝留醇、三帖皂甘、齊墩果酸等。 根據中醫典籍記載:《本經》:“主寒濕痿痺,四肢拘攣,膝痛不 可屈,”。 《名醫別錄》:“補中續絕,填骨髓,除腦中痛及腰脊痛,”。 《本草綱目•卷十六•牛膝》:“治腰膝骨痛,足痿,”。 ( 7 ) 菟絲子( Tu-Si-Zi )〔 58-62〕 為旋花科一年生寄生性蔓草菟絲子 Cuscuta chinensis Lam. 或大 菟絲子 C. japonica Choisy 的成熟種子。其主要成份為樹脂樣配醣體、 澱粉酵素、維生素 A 等。 根據中醫典籍記載:《本經》:“主續絕傷,補不足,”。 《名醫別 錄》:“養肌強陰,堅筋骨,”。 《藥性本草》:“能治男人女人虛冷, 添精益髓,去腰痛膝冷,”。. 3. 材料與方法 21.
(22) 3.1 實驗材料 3.1.1 實驗藥物的製備 本實驗所評估的中藥材包括龜鹿膠、杜仲、骨碎補、續斷、桑寄生、懷牛 膝、菟絲子 7種(興隆藥行,台灣台中市),其中於龜鹿膠溶液的製備中,先將 20g龜板膠和 20g鹿角膠分別粉碎成細塊,以 1:1的比例稱重混合後,用水 加熱溶解,依序配成下列 7種不同的濃度:100 mg/mL、10 mg/mL、1 mg/mL、 100μg/mL、10μg/mL、1μg/mL、100 ng/mL。 另外杜仲、骨碎補、續斷、桑寄生、懷牛膝、菟絲子6種藥材,則各取 40 g 分別粉碎成粗粉,用水加熱萃取 3 次,用濾紙(ToyoRoshiKaisha,Ltd.Japan)去 除藥滓後收集萃取液,將萃取液慢慢加熱濃縮成糊狀,再隔水加熱濃縮成膏狀, 最後用冷凍乾燥法脫乾水份使其成乾燥粉末,然後同樣依序配成下列7種不同 濃度的稀釋液:100 mg/mL、10 mg/mL、1 mg/mL、100μg/mL、10μg/mL、 1μg/mL、100 ng/mL。 藥物 7 種不同濃度的配製方法: 將乾燥的中藥粉末先用水加熱溶解配製成濃度 100mg/mL,然後移入無菌 操作台內用 0.22μm無菌過濾膜( Millipore, USA )過濾滅菌,再用無菌水稀釋成 其它 6種不同的濃度,分裝至無菌 15 mL離心管中,標示之儲存於4 ℃冰箱中。 3.1.2 骨母細胞培養液的配製 骨母細胞培養基( medium )內含有 Dulbecco`s Modified Eagle`s Medium ( DMEM ;Gibco BRL, Rockville, MD, USA )、10 ﹪胎牛血清( Fetal Bovine Serum, FBS;Gibco BRL, Rockville, MD, USA )、抗生素(含有 100 IU/mL Penicilline G Sodium、100μg/mL Streptomycin sulfate、0.25μg/mL Amphotericine B;Gibco BRL, Rockville, MD, USA )、2 mM L-glutamin ( Gibco BRL, Rockville, MD, USA )、5μ M 非必需氨基酸( Non-Essential Amino Acids, NEAA ;Gibco BRL, Rockville, MD, USA )。 3.1.3 骨母細胞礦物質化骨結節形成實驗培養液的配製. 22.
(23) 於骨母細胞培養液中添加50μg/mL ascorbic acid ( 聯工化學製藥,台灣 )和 10 mM ß-glycero –phosphate ( sigma )。 3.1.4 骨母細胞 / 蝕骨細胞共培養培養液的配製 於骨母細胞培養液中加入 10 –8 M 1a,25 vitamin D3。. 3.2 實驗方法 3.2.1 骨母細胞 3.2.1.1 骨母細胞的培養 取剛出生 3 天內的 Sprague-Dawley新生小鼠(中國醫藥學院實驗動物中心) 的頭蓋骨,將周邊的肌肉、結締組織儘量剝除乾淨,隨後將頭蓋骨剪成碎塊, 再用 0.2 ﹪的第一型膠原蛋白脢( collagenase type ? ;GibcoBRL,Rockville,MD, USA, 235 units/mg )消化(digestion)頭蓋骨的結締組織,使間葉基質細胞釋放 出來,然後置於培養箱內( 溫度 37℃、95﹪air / 5﹪CO2 )作初代骨母細胞的培 養,每 2天更換新的培養基,並將大塊的碎骨殘骸用吸管吸除,約7天後細胞 即可長滿整個培養皿。 3.2.1.2 繼代骨母細胞培養 隨後將已培養 7 天長滿細胞的培養皿,加入 0.25 ﹪的胰蛋白脢(Trypsin)/ EDTA ( Gibco BRL, Rockville, MD, USA )使細胞脫離培養皿的底部而成圓球 狀,再用血球計數器( haemocytometer )於 100X倒立顯微鏡下觀察,計數細胞的 存活率,之後將細胞懸浮液以 1:3的比例稀釋均勻分散後,平均分配於3盤 10 cm 的培養皿( TPP Europe/switzer land )中作繼代細胞培養,每 2天更換新的 培養基,約 2 ~ 3 天後細胞即可長滿整個培養皿,此為第 2代的繼代細胞。 待細胞長滿後,重複上述繼代細胞的分盤步驟,取繼代第2或第3代的骨 23.
(24) 母細胞作為本實驗的材料。 3.2.1.3 細胞型態的觀察 3.2.1.3.1 劉氏染色法( Liu’s stain ) 原理:可將細胞染成藍紫色,但對染色的細胞無專一性。 操作: 將繼代的骨母細胞在 48 孔培養盤( 48 -well plate)中分別接種 5×103/well 的細胞數,再加入 7種中藥 7種不同濃度,n=3,放入細胞培養箱中培養 2天。 2 天後取出細胞,用 4 ﹪中性福馬林( neutral buffered formaline,NBF)固 定細胞後,用微量吸管加入 100μL 的 Liu’sstainsolutionA ( 武藤化學株式會 社,日本 ),約染色30秒後,再加入 200μL的 Liu’s stain solution B ( 武藤化學 株式會社,日本 ),搖晃之使 A液和 B液充分混合,約 90秒後溶液表面出現 金屬光澤,吸除 Liu’s stain solution A 和 B 液。 將 48孔培養盤移至水槽中,用自來水輕輕的小心沖洗染液,之後靜置風 乾,於 200X的倒立式顯微鏡下觀察 7種不同藥物 7種不同濃度下,細胞形態 上的變化。 3.2.1.3.2 鹼性磷酸酵素染色法( Alkaline Phosphatase stain,ALPstain) 原理:可將骨母細胞的鹼性磷酸酵素活化位染成藍紫色,故對骨母細胞染 色有專一性。 操作: ※ 細胞固定液的配製: ( Alkaline phosphatase stain kit, ALP stain, procedure no.86, alkaline phosphatase, leukocyte, Sigma Co., St. Louis, MO, USA ) 準備100 mL的玻璃瓶,加入65 mL Acetone 和25 mL Citrate solution 及 8 mL Formaldehyde,儲存於 2~8 ℃冷藏,使用前回溫至 18~26 ℃。 ※ 鹼性磷酸酵素染色液的配製:. 24.
(25) ( Alkaline phosphatase stain kit, ALP stain, procedure no.86, alkaline phosphatase, leukocyte, Sigma Co., St. Louis, MO, USA ) (1)準備 100 mL 的玻璃瓶,加入 45 mL 已回溫至 18~26 ℃的去離子 ( deionized )無菌水。 (2)準備 15 mL的無菌離心管,加入 1 mL Sodium Nitrite Solution 和 1 mL Fast blue BB Alkaline Solution,蓋緊瓶蓋輕輕的搖晃均勻,靜置 2分鐘使其反 應成 diazonium salt solution。 (3)將離心管中 2 mL 的 diazonium salt solution加入 Step.(1)的玻璃瓶中, 再加入 1 mL 的 Naphthol AS-BI Alkaline Solution,搖晃混合均勻後蓋 上瓶蓋,靜置於 18~26 ℃的室溫下備用。 ※ 骨母細胞鹼性磷酸酵素染色法: 將繼代的骨母細胞在48孔培養盤中分別接種 5×103 / well的細胞數,再加 入 7 種中藥 7 種不同濃度, N=3,放入細胞培養箱中培養 2 天。 2 天後取出細胞,加入 200μL 的細胞固定液( Acetone-CitrateFormaldehyde ),靜置 30秒後吸除固定液,再用 400μL的去離子水清洗,靜置 45 秒後吸除上清液,之後加入200μL的鹼性磷酸酵素染液,在室溫下(18 ~ 26 ℃)避光靜置 15分鐘。15分鐘後吸除染液,同樣用 400μL的去離子水清洗, 靜置 2 分鐘後吸除上清液,最後用 10μL Neutral Red Solution 對比染液 ( counterstaun )染色,1分鐘後吸除對比染液,將 48孔培養盤移至水槽中,用自 來水輕輕的小心沖洗染液,之後靜置風乾,於 200X的倒立式顯微鏡下觀察7 種不同藥物 7 種不同濃度下骨母細胞形態上的變化。. 3.2.1.4 中藥對骨母細胞存活( survival )和增生( proliferation)能力的評 25.
(26) 估-MTT 分析;MTT (3-(4,5-dimethylthazol-2-yl)-2,5-diphenyl tetrazolium bromide)reduction – a tetrazolium-based colorimetric assay for cell survival and proliferation 原理: 利用活細胞粒腺體中的dehydrodenase可將黃色水溶性的 MTT還原轉換成 暗藍色水不溶性的 formazan ,再用溶劑( acid/alcohol – 0.04 N HCL in isopropanol ) 將 formazan 溶解,然後分別在 O.D. 570nm 和 O.D.650nm測其吸光值,所得 的吸光值差即和活細胞的數目成正比。 操作: 3.2.1.4.1 MTT 溶液的配製 從-20℃的冰箱中取出 MTT 粉末( USB, Amersham Life Science ),用微量 天平稱取 50 mg,倒入 15 mL離心管中,移入無菌操作台內,加入 10 mL PBS, 蓋上瓶蓋均勻搖晃使 MTT粉末溶解後,用0.22μm無菌過濾膜( Millipore, USA ) 過濾滅菌,裝至 15 mL無菌離心管中,用鋁箔紙包覆管身避光,標示之儲存於 4 ℃冰箱中。 3.2.1.4.2 formazan 溶劑( acid/alcohol – 0.04 N HCL in isopropanol )的配 製: 取 50 mL無菌離心管,加入 2 mL 1 N HCL,再加入 48 mL isopropanol ( 聯 工化學試藥,台灣 ),標示之儲存於室溫下。 3.2.1.4.3 formazan吸光值(O.D.570-650nm)V.S. 骨母細胞數檢量線的 製定 將繼代的骨母細胞在 96孔培養盤中由左至右依序接種細胞數由 1×103、2 ×103、3 ×103、4 ×103、5 ×103 、1 ×104 、2×104 、3 ×104 、4 ×104 、5 ×104 /well; N=6,每個 well 中先用微量吸管加入 100μL的骨母細胞培養液,然後將無菌 操作台內的燈光關閉,避光下再加入 10μL的 MTT,再放入細胞培養箱中培 養 4小時。4小時後取出,小心用吸管吸除上清液,避免使底部藍色的 formazan 沉澱損失,用微量吸管加入 200μL 的 acid/alcohol – 0.04 N HCL in isopropanol 26.
(27) 溶劑,蓋上蓋子,將培養盤移至 shaker plate ( Firstek Scientific ),約 10分鐘後於 100X 的倒立式顯微鏡下觀察,沉澱的 formazan結晶則會完成溶解,最後在 ELISA plate reader ( Biolink )以雙波長測量其( 測試波長 O.D.570nm)減去( 參考 波長 O.D.650 nm )的吸光值。 將結果在座標上繪成吸光值對應細胞數的關係,並將曲線作迴歸,求出MTT 對應細胞數目的檢量線。 3.2.1.4.4 MTT 分析 將繼代的骨母細胞在 96孔培養盤中分別接種 5×103/well的細胞數,每個 well 中先用微量吸管加入 180μL 的骨母細胞培養液,再於實驗組中加入 20μL的 7種中藥之6種不同濃度,而空白( blank )組則加入20μL的 PBS;N =6。( 因此最後每個孔的體積為 200μL,而藥物濃度則被稀釋了 10倍 ),再 放入細胞培養箱中培養 2 天。 2天後取出細胞,再如同上( 3.2.1.4.3節 ) MTT分析的步驟測量其吸光值, 然後 將吸光值利用 MTT 檢量線換算成細胞數,以評估 7種中藥6種不同濃度對細 胞存活和增生能力的影響。 3.2.1.5 中藥對骨母細胞分化能力的評估 鹼性磷酸酵素活性分析 操作: 3.2.1.5.1 ALP 試劑的配製 在無菌操作台內,將 2 顆 ALP 試劑 B ( Alkaline phosphatase EC3.1.3.1 colorimetric test, procedure no. DG1245-UV, sigma Co., St. MO, USA )和 5mL的去 離子水加入 15mL的無菌離心管中,蓋上瓶蓋適度搖晃使 ALP 試劑B完全溶 解後,再加入 25 mL 的 ALP 試劑 A( Alkaline phosphatase EC3.1.3.1colorimetric test, procedure no. DG1245-UV, sigma Co., St. MO, USA ),標示之置於室溫 25℃ 下。 3.2.1.5.2 0.1 ﹪Triton X-100 的配製 27.
(28) 取 50 mL 的無菌離心管中,用微量吸管加入 50μL Triton X-100 ( USB, Amershan Life Science ),再加入 PBS 至 50mL,蓋上瓶蓋適度搖晃,標示之置 於室溫 25℃下。 3.2.1.5.3 p-nitrophenylate anion 在 O.D.405nm 每分鐘吸光度的增加量 ( △A / min ) V.S. 骨母細胞鹼性磷酸酵素活性檢量線的製定 將繼代的骨母細胞在 96孔培養盤中由左至右依序接種細胞數由 1×103、 2 ×103、3 ×103、4×103、5×103 、1 ×104 、2 ×104 、3 ×104 、4 ×104 、5 ×104 /well; N=8,在室溫 25℃下,每個 well 先用微量吸管加入 20μL 的 0.1 ﹪Triton X-100,靜置 5 分鐘,待 TritonX-100將細胞膜融解(lysis ),使鹼性磷酸酵素溶 離,再加入 100μL 的 ALP 試劑,迅速以 ELISAplatereader測其連續 15分鐘 每分鐘吸光值的變化,並以下列公式表示: Mean ALP Activity ( Sigma Unit / L ) =△ALP Activity × T V ×1000 / 18.45 × LP × SV 即每 Liter 中,每分鐘有多少 Sigma Unit 的 p-nitrophenylphosphate 被 ALP 轉換 成 p-nitrophenylate anion。 △ALP Activity ( △A / min )=. Final Absorbance - InitialAbsorbance / Time. Interval ( Change in absorbance per minute at 405 nm ) TV = Total Volume SV = Sample Volume 18.45 = Millimolar absorptivity of p-nitrophenol at 405 nm LP = Lightpath ( 1- cm ) 1000 = Conversion of units per mL to units per liter 將計算結果在座標上繪成 ALP Activity ( Sigma Unit / L )對應細胞數的關係,並將 曲線作迴歸,求出 ALP Activity 對應骨母細胞數的檢量線。. 3.2.1.5.4 中藥對骨母細胞鹼性磷酸酵素活性的測定 28.
(29) 將繼代的骨母細胞在 96孔培養盤中分別接種 5×103/well的細胞數,每個 well中先用微量吸管加入 180μL的骨母細胞培養液,再於實驗組中加入 20μL 的 7種中藥 6種不同濃度,而空白組則加入 20μL的 PBS;N=6,再放入細胞 培養箱中培養 2 天。 2天後取出細胞,在室溫 25℃下,再如同上(3.2.1.5.3)測量 ALP 活性的步 驟測其連續 15 分鐘每分鐘吸光值的變化,並以下列公式表示: Mean ALP Activity ( Sigma Unit / L ) =△ALP Activity × T V ×1000 / 18.45 × LP × SV 將 ALP Activity ( Sigma Unit / L )利用骨母細胞的 ALP 檢量線換算成細胞數,以 評估 7 種中藥 6 種不同濃度對骨母細胞分化能力的的影響。 3.2.1.6 礦物質化結節形成的評估 3.2.1.6.1 Von Kossa’s Stain〔 63〕 原理: 利用硝酸銀(AgNO3)溶液和礦物質化結節中的磷酸鈣反應,生成暗褐 色的磷酸銀沉澱,再計數暗褐色結節的數量以評估藥物對骨生成(osteogenic) 能力的影響。 配製: 取 5 g的硝酸銀粉末( 聯工化學試藥,台灣 ),加入已滅菌 150 mL 血清瓶 中,再加入 95 mL去離子水,配製成5 ﹪的硝酸銀溶液。用鋁箔紙包覆避光, 標示之儲存於室溫下。 3.2.1.6.2 礦物質化結節形成實驗 操作: 將繼代的骨母細胞在 35mm培養皿中接種 2×104/dish的細胞數,每個培養 皿中先用吸管加入 4.5 mL的細胞培養液(內含 50μg/ ml ascorbic acid 和 10 mM ß-glycerophosphate ),再於實驗組中加入 0.5mL的 7種中藥 6種不同濃度,而 空白組則加入 0.5mL的 PBS;N=3,再放入細胞培養箱中培養,每 3天更換 29.
(30) 細胞培養液和添加藥物,連續培養至 21 天。 21天後取出細胞,再用 4 ﹪中性福馬林( neutral buffered formaline, NBF )固定 細胞,之後再加入 3.0 mL的 5 ﹪硝酸銀溶液,並用 100W 的白熱燈照射 1小時, 待結節( nodule )暗褐色的磷酸銀沉澱出現,吸去上清液,用 5.0 mL的去離子水重 覆清洗 2次。最後在解剖用顯微鏡( dissecting microscope;Carl Zeiss )放大 30倍的 視野下( magnification × 30 ),用 2 mm2的方格計數礦物質化結節形成的數量, 以評估中藥促進骨骼生成的能力。. 3.2.2 蝕骨細胞 3.2.2.1 中藥對 O.B. / O.C. 共培養系統中蝕骨細胞分化能力的評估 酒石酸具耐受性酸性磷酸酵素活性分析(TartrateResistantAcid Phosphatase;TRAP , Activity Assay ) 操作: 3.2.2.1.1 骨母細胞 / 蝕骨細胞共培養 取剛出生 3天內的 Sprague-Dawley新生小鼠的頭蓋骨,用第一型膠原蛋白 酵素分離出骨原始細胞( Osteoprogenitor , ) 和取同一隻鼠體的脾臟分離出脾臟細 胞,分別用血球計數器計數過細胞數後,將同一隻鼠體的骨原始細胞和脾臟細 胞依比例 = 1:50 一起培養。 在 48 孔培養盤中接種 1 ×104 脾臟細胞/well和 2×102骨原始細胞/well,放 入細胞培養箱中培養過夜,隔天取出細胞,將實驗組分為4組,分別在不同的 時間點添加中藥,因根據研究〔46,47,48〕,在體外骨母細胞 / 蝕骨細胞共培養實驗 中,蝕骨細胞的成熟約需培養 6 天,而前 4 天是蝕骨前驅細胞( osteoclast progenitors )的增生期,後 2天則是蝕骨細胞的分化期,故第 1組於 1 ~ 4天、第 2組於 5 ~ 6天、第 3組於 1~ 6天、第 4組於第 7~8天時添加中藥,以觀察不同 時期中藥對蝕骨細胞的影響。 3.2.2.1.2 酒石酸具耐受性酸性磷酸酵素活性分析 30.
(31) 將添加藥物組每個培養皿中先用微量吸管加入 360μL的共培養細胞培養 液,再加入 40μL的 7種中藥 6種不同濃度,非添加藥物組則加入 400μL的 共培養細胞培養液,而空白組則加入40μL的 PBS;N=4。每 2天更新培養液, 再放入細胞培養箱中培養至第 6 天(第 4 組培養至第 8 天)。 6天(第 4組於第 7天時添加中藥,培養 2天後取出細胞)後取出細胞,用 100μL的微量吸管小心往復的抽吸 4組細胞上清液,使其混合均勻,再用微量 吸管將 48 孔培養盤的 4組細胞上清液取 30μL移至 96 孔培養盤中,再加入 100μL已用恆溫槽回溫至 37℃的 ACP 混合試劑(ACP 試劑 / ACP Tartrate 試劑 = 10/1;Acid phosphatase procedure no. 435, Sigma Co., St. Louis, MO,USA ),迅 速以 ELISAplatereader測其連續 5分鐘每分鐘吸光值的變化,並以下列公式表 示: Mean TRAP Activity ( Sigma Unit / L ) =△TRACP Activity × T V ×1000 / 12.9 × LP × SV 即每 Liter 中,每分鐘有多少 Sigma Unit 的α-naphthylphosphate 被 TRAP 轉換 成α-naphthol。 △TPAP Activity ( △A / min )=. Final Absorbance - InitialAbsorbance / Time. Interval ( Change in absorbance per minute at 405 nm ) TV = Total Volume (130μL) SV = Sample Volume (30μL) 12.9 = Millimolar absorptivity of a–naphthol-fast red TR complex at 405 nm LP = Lightpath ( 1- cm ) 1000 = Conversion of units per mL to units per liter 將 4組實驗計算結果在座標上繪成TRAP Activity ( Sigma Unit / L )對應各藥物不 同濃度的關係,以評估不同時期 7種中藥6種不同濃度對蝕骨細胞增生和分化 能力的的影響。. 3.2.2.2 蝕骨細胞形態觀察:酒石酸具耐受性酸性磷酸酵素染色法( Tartrate 31.
(32) Resistant Acid Phosphatase Stain ;TRAP Stain ) 操作: ※ 細胞固定液的配製: ( Acid phosphatase stain kit, ACP stain, procedure no.387, acid phosphatase, leukocyte, Sigma Co., St. Louis, MO, USA ) 準備 100 mL 的玻璃瓶,加入 65 mL Acetone 和 25 mL Citrate solution 及 8 mL37﹪的 formaldehyde,儲存於 2~8 ℃冷藏,使用前回溫至 18~26 ℃。 ※ TRAP 染色液的配製: ( Acid phosphatase stain kit, ACP stain, procedure no.387, acid phosphatase, leukocyte, Sigma Co., St. Louis, MO, USA ) (1)準備 100 mL 的玻璃瓶,加入 45 mL 已回溫至 37℃的去離子無菌水。 (2)準備 15 mL 的無菌離心管,加入 0.5 mLSodium Nitrite Solution 和 0.5mL Fast garnet GBC base solution,蓋緊瓶蓋輕輕的搖晃均勻,靜置 2分鐘使 其反應成 diazonium salt solution。 (3)將離心管中 1 mL 的 diazonium salt solution加入 Step.(1)的玻璃瓶中, 再加入 0.5 mL 的 Naphthol AS-BI phosphate solution,搖晃混合均勻後蓋 上瓶蓋,靜置於 37℃的恆溫槽內備用。. ※ TRAP 染色法: 將前步驟 4 組 48 孔培養盤,加入 200μL 的細胞固定液( Acetone-CitrateFormaldehyde ),靜置 30秒後吸除固定液,再用 400μL的去離子水清洗,靜置 45 秒後吸除上清液,之後加入 200μL的 TRAP 染液,放入 37℃培養箱中避光 靜置 1小時。1小時後取出吸除染液,同樣用400μL的去離子水清洗,靜置 2 分鐘後吸除上清液,最後用 10μL 的 Hematoxylin 對比染液(counterstaun)染 色,1分鐘後吸除對比染液,將 48孔培養盤移至水槽中,用自來水輕輕的小心. 32.
(33) 沖洗染液,之後靜置風乾,於 100X的倒立式顯微鏡下觀察7種不同藥物7種 不同濃度下,TRAP 染色蝕骨細胞形態上的變化。. 3.2.3 骨母細胞 / 蝕骨細胞共培養 操作 a(同種系鼠體): 3.2.3.a.1 骨母細胞 / 蝕骨細胞共培養 取剛出生 3 天內 Sprague-Dawley新生小鼠的頭蓋骨培養至繼代骨母細胞 後,再取同種系剛出生3天內 Sprague-Dawley 新生小鼠的脾臟,分離出脾臟細 胞,將骨母細胞:脾臟細胞 = 1:50 ( 5× 104 :2.5× 106 )的比例接種培養在10 cm 培養皿中,每 2天更換培養液,連續培養 6天。6天後,用倒立式顯微鏡觀察, 骨母細胞成紡錘狀,蝕骨細胞則成大小不等圓形的單核和多核細胞。 將已培養 6 天長滿細胞的培養皿,加入 0.25 ﹪Trypsin/EDTA 使細胞脫 離,用血球計數器計數 O.B./O.C.混合細胞的數目,以作為下列研究評估。 3.2.3.a.2 中藥對 O.B. / O.C.共培養,細胞存活和增生能力的評估- MTT 分析 ※ formazan 吸光值( O.D.570-650 nm ) V.S. O.B. / O.C.混合細胞數檢 量線的製定 將 O.B. / O.C.混合細胞,用血球計數器計數過細胞數後,在 96孔培養盤中 由左至右依序接種細胞數由 1×103、2 ×103、3 ×103、4 ×103、5 ×103 、1 ×104 、 2 ×104 、3 ×104 、4 ×104 、5 ×104 、6×104/well;N=6,再如同上( 3.2.4.3 節 ) MTT 分析的步驟測量其吸光值,然後將結果在座標上繪成吸光值對應細胞數的關 係,並將曲線作迴歸,求出 MTT 對應混合細胞數目的檢量線。. 33.
(34) ※ MTT 分析 將 O.B. / O.C.混合細胞,用血球計數器計數過細胞數後,在 96孔培養盤中分 別接種 5 ×103 / well 的細胞數,每個培養盤中先用微量吸管加入 180μL的骨母 細胞培養液,再於實驗組中加入 20μL的 7種中藥 6種不同濃度,而空白組則 加入 20μL 的 PBS;N=6。再放入細胞培養箱中培養 2 天。 2天後取出細胞,再如同上( 3.2.1.4.3 節) MTT分析的步驟測量其吸光值, 然後將吸光值利用 MTT 檢量線換算成細胞數,以評估7種中藥6種不同濃度 對 O.B. / O.C. 共培養混合細胞存活和增生能力的影響。 3.2.3.a.3 中藥對 O.B./O.C.共培養骨母細胞分化能力的評估:鹼性磷酸酵 素活性分析 ※ p-nitrophenylate anion 在 O.D .405 nm 每分鐘吸光度的增加量( △A / min ) V.S. 骨母細胞鹼性磷酸酵素活性檢量線的製定 將 O.B./O.C.混合細胞,用血球計數器計數過細胞數後,在 96孔培養盤中 由左至右依序接種細胞數由 1×103、2 ×103、3 ×103、4 ×103、5 ×103 、1 ×104 、 2 ×104 、3 ×104 、4 ×104 、5×104 、6 ×104/well; N=8,在室溫 25℃下,再如 同上( 3.2.1.5.3 節 )測量 ALP 活性的步驟測其連續 15分鐘每分鐘吸光值的變 化,並以下列公式表示: Mean ALP Activity ( Sigma Unit / L ) =△ALP Activity × T V ×1000 / 18.45 × LP × SV 即每 Liter 中,每分鐘有多少 Sigma Unit 的 p-nitrophenylphosphate 被 ALP 轉換 成 p-nitrophenylate anion。 將計算結果在座標上繪成 ALPActivity(SigmaUnit/L)對應細胞數的關係,並 將曲線作迴歸,求出 ALP Activity 對應 O.B. / O.C. 共培養混合細胞數的檢量線。. 34.
(35) ※ 中藥對 O.B. / O.C. 共培養骨母細胞鹼性磷酸酵素活性的測定 將 O.B./O.C.混合細胞,用血球計數器計數過細胞數後,在 96孔培養盤中 分別接種 5 ×103 / well的細胞數,每個培養盤中先用微量吸管加入 180μL的成 骨細胞培養液,再於實驗組中加入 20μL的 7種中藥6種不同濃度,而空白組 則加入 20μL 的 PBS;N=6,再放入細胞培養箱中培養 2 天。 2天後取出細胞,在室溫 25℃下,再如同上(3.2.1.5.3)測量 ALP 活性的步 驟測其連續 15 分鐘每分鐘吸光值的變化,並以下列公式表示: Mean ALP Activity ( Sigma Unit / L ) =△ALP Activity × T V ×1000 / 18.45 × LP × SV 將 ALP Activity ( Sigma Unit / L )利用混合細胞的 ALP 檢量線換算成細胞數,以 評估 7種中藥 6種不同濃度對 O.B. / O.C. 共培養下,骨母細胞分化能力的影響。. 操作 b(同一隻鼠體): 3.2.3.b.1 骨母細胞 / 蝕骨細胞共培養 取剛出生 3天內 Sprague-Dawley新生小鼠的頭蓋骨用第一型膠原蛋白酵素 分離出骨原始細胞( Osteoprogenitor ),和取同一隻鼠體的脾臟分離出脾臟細胞, 分別用血球計數器計數過細胞數後,將骨原始細胞和脾臟細胞依比例 = 1:50 一起培養。 3.2.3.b.2 中藥對 O.B. / O.C. 共培養細胞存活和增生能力的評估- MTT 分析 ※ formazan吸光值( O.D.570-650 nm ) V.S. O.B. / O.C.混合細胞數檢量線的 製定: 將同一隻鼠體的骨原始細胞和脾臟細胞依比例 = 1:50一起培養,先將脾 臟細胞,在 96 孔培養盤中由左至右依序接種細胞數由 5×103 、 1 ×104 、 2 ×104 、 3 ×104 、 4 ×104 、 5 ×104 、 6 ×104/well;N=8,同樣再接種骨原始 細胞依序為 1×102 、 2 ×102 、 4 ×102 、6×102 、 8 ×102 、 1 ×103 、 1.2 ×103 35.
(36) /well;N=8,放入細胞培養箱中培養 6天,每 2天更新培養液,6天後取出細 胞,再如同上( 3.2.1.4.3 節) MTT 分析的步驟測量其吸光值,然後將結果在座標 上繪成吸光值對應細胞數的關係,並將曲線作迴歸,求出MTT對應混合細胞 數目的檢量線。 ※ MTT 分析: 將同一隻鼠體的骨原始細胞和脾臟細胞分離出來後,依比例骨原始細胞/ 脾臟細胞 = 1 / 50 一起培養,即在 96 孔培養盤中接種 5×103 脾臟細胞/well 和 1 ×102骨原始細胞/well,放入細胞培養箱中培養 6天,每 2天更新培養液,6 天後取出細胞,吸除上清液,每個培養盤中先用微量吸管加入180μL的骨母 細胞培養液,再於實驗組中加入 20μL的 7種中藥 6種不同濃度,而空白組則 加入 20μL 的 PBS;N=8,再放入細胞培養箱中培養 2 天。 2天後取出細胞,再如同上( 3.2.1.4.3 節) MTT分析的步驟測量其吸光值, 然後將吸光值利用 MTT 檢量線換算成細胞數,以評估7種中藥6種不同濃度 對 O.B. / O.C. 共培養混合細胞存活和增生能力的影響。 3.2.3.b.3 中藥對 O.B. / O.C.共培養骨母細胞分化能力的評估: 鹼性磷酸酵素活性分析 ※ p-nitrophenylate anion 在 O.D .405 nm 每分鐘吸光度的增加量( △A / min ) V.S. 骨母細胞鹼性磷酸酵素活性檢量線的製定: 將同一隻鼠體的骨原始細胞和脾臟細胞依比例 = 1:50一起培養,即先將 脾臟細胞,用血球計數計計數過細胞數後,在 96孔培養盤中由左至右依序接種 細胞數由 5 ×103 、 1 ×104 、 2 ×104 、 3 ×104 、 4 ×104 、 5 ×104 、 6 ×104/well; N=8,同樣再接種骨原始細胞依序為1 ×102 、 2 ×102 、 4 ×102 、6 ×102 、 8 ×102 、 1 ×103 、 1.2 ×103 /well;N=8,放入細胞培養箱中培養 6天,每 2天 更新培養液,6天後取出細胞,在室溫 25℃下,再如同上( 3.2.1.5.3 節)測量 ALP 活性的步驟測其連續 15 分鐘每分鐘吸光值的變化,並以下列公式表示:. 36.
(37) Mean ALP Activity ( Sigma Unit / L ) =△ALP Activity × T V ×1000 / 18.45 × LP × SV 即每 Liter 中,每分鐘有多少 Sigma Unit 的 p-nitrophenylphosphate 被 ALP 轉換 成 p-nitrophenylate anion。 將計算結果在座標上繪成 ALP Activity ( Sigma Unit / Min / L )對應細胞數的關 係,並將曲線作迴歸,求出 ALPActivity 對應 O.B./O.C. 共培養混合細胞數的 檢量線。 ※ 中藥對 O.B. / O.C.共培養骨母細胞鹼性磷酸酵素活性的測定: 將同一隻鼠體的骨原始細胞和脾臟細胞分離出來後,依比例骨原始細胞 / 脾臟細胞 = 1 / 50 一起培養,即在 96 孔培養盤中接種 5×103 脾臟細胞/well 和 1 ×102骨原始細胞/well,放入細胞培養箱中培養 6天,每 2天更新培養液,6 天後取出細胞,再如同上(3.2.1.5.3 節 )測量 ALP 活性的步驟測其連續 15分鐘 每分鐘吸光值的變化,並以下列公式表示: Mean ALP Activity ( Sigma Unit / L ) =△ALP Activity × T V ×1000 / 18.45 × LP × SV 將 ALP Activity ( Sigma Unit / L )利用混合細胞的 ALP 檢量線換算成細胞數,以 評估 7種中藥 6種不同濃度對 O.B. / O.C. 共培養下,骨母細胞分化能力的影響。. 37.
(38) 3.3 統計方法 以 Student'st-test來探究 7種中藥 6種濃度對於骨細胞增生和分化能力的影 響,評估在 MTT 分析、鹼性磷酸酵素活性、礦物質化結節形成的數量,以及 骨母細胞/蝕骨細胞共培養中 MTT 分析、鹼性磷酸酵素活性、酸性磷酸酵素活 性上有無統計上之差異。本實驗統計上檢定之第一誤差設定在 0.05,若 P < 0.05 時則認定為數量統計明顯差異,第二誤差設定在 0.01,若 P<0.01時則認定為 數量統計明顯差異。. 38.
(39) 4. 結果 4.1 骨母細胞 4.1.1 細胞型態的觀察 4.1.1.a. 劉氏染色法( Liu’s stain ) 劉氏染色法能將細胞染成藍紫色,且細胞核和細胞體的輪廓清晰可辨,但 對染色的細胞則無特異性,可快速的評估藥物對細胞的生物適應性。在濃度 100mg/mL的培養下除了龜鹿膠、懷牛膝、菟絲子外,其細胞型態均呈萎縮狀 【圖 4.1】,而 7 種藥物其餘 10 mg/mL~ 100 ng/mL6種濃度及 100mg/mL的龜 鹿膠、懷牛膝和菟絲子其培養的細胞型態均呈完整的紡錘狀【圖4.2】 ,且細胞 偽足明顯,顯示藥物對細胞的生物適應性良好。. 圖 4.1 濃度 100 mg/mL 的杜仲、骨碎補、續斷、桑寄生 培養下 Liu’s stain 細胞體呈萎縮狀( scale bar=50 µm ). 39.
(40) 圖 4.2 Liu’s stain 細胞體呈紡錘狀,偽足明顯( scale bar=50 µm ). 4.1.1.b 鹼性磷酸酵素染色法( ALP stain ) 鹼性磷酸酵素染色法對骨母細胞有專一性,可將骨母細胞染成藍紫色,在 濃度 100 mg/mL 的培養下,杜仲、骨碎補、續斷、桑寄生的細胞體大部分死亡 【圖 4.3】 ,而龜鹿膠、懷牛膝、菟絲子的細胞型態均呈萎縮狀【圖4.4】 ,而其 餘濃度的細胞型態均呈完整的紡錘狀【圖 4.5 ~ 4.6】 ,且細胞偽足明顯,顯示藥 物對骨母細胞生物適應性良好。 本實驗經由最基本的細胞型態觀察分析出在濃度 100mg/mL下,由劉氏染 色法( Liu’s stain )觀察出杜仲、骨碎補、續斷、桑寄生會使細胞體萎縮,而另外 由鹼性磷酸酵素染色法(ALPstain)觀察出在此濃度對骨母細胞分化的影響,7 種藥物均使細胞體萎縮,可能直接因藥物對細胞的毒性或間接滲透度太高的影 響,故本實驗採用 10 mg/mL、1 mg/mL、100μg/mL、10μg/mL、1μg/mL、 100 ng/mL 6 種濃度,來作為骨細胞活性評估。. 40.
(41) 圖 4.3 濃度 100 mg/mL 的杜仲、骨碎補、續斷、桑寄生 培養下 ALP 染色細胞體大部分死亡( scale bar=50 µm ). 圖 4.4 濃度 100 mg/mL 的龜鹿膠、懷牛膝、菟絲子 培養下 ALP 染色細胞體呈萎縮狀( scale bar=50 µm ). 圖 4.5 ALP 染色細胞體呈紡錘狀,偽足明顯( scale bar=50 µm ). 41.
(42) 圖 4.6 ALP 染色(加對比染劑 neutral red)細胞體呈 紡錘狀,偽足明顯( scale bar=50 µm ). 4.1.2 中藥對骨母細胞 MTT 分析 骨母細胞 MTT 檢量線【圖 4.7】: 骨母細胞數 (萬) / well 和 formazan 吸光值( O.D.570-650 nm )的對應 關係為. Y = 0.0907 X + 0.0722 X:骨母細胞數 (萬) / well Y:formazan 吸光值( O.D.570-650 nm ) y = 0.0907x + 0.0722. Optic Density(O.D.570 - 650 ). MTT Test ( Osteoblasts ). R2 = 0.9662. 0.60 0.55 0.50 0.45 0.40 0.35 0.30 0.25 0.20 0.15 0.10 0.05 0.00. 數列1 線性 (數列1) 0. 0.5. 1. 1.5. 2. 2.5. 3. 3.5. 4. 4.5. 5. 5.5. (萬 ) cells / well. 圖 4.7 formazan 吸光值( O.D.570-650 nm ) V.S. 骨母細胞數檢量線. 42.
(43) 中藥對骨母細胞 MTT 分析結果,如【表 4.1】: (1)龜鹿膠稀釋液在濃度 1mg/mL、 100μg/mL、10μg/mL、1μg/mL對骨母 細胞有促進增生作用,其它濃度和控制組則無統計上差異。 (2)杜仲稀釋液在 10 mg/mL ~ 100 ng/mL6種濃度下,對骨母細胞均有促進 增生作用,且隨著濃度降低,增生作用也隨之遞減。 (3)骨碎補稀釋液在 10 mg/mL~1μg/mL5種濃度下,對骨母細胞均有促進 增生作用,且隨著濃度降低,增生作用也隨之遞減,降低至 100ng/mL 時,和控制組則無統計上差異。 (4)續斷稀釋液在濃度 10 mg/mL時對骨母細胞有抑制作用,而在 1mg/mL 和 100μg/mL 則對骨母細胞有促進增生作用,其它濃度和控制組則無 統計上差異。 (5)桑寄生稀釋液在濃度 10 mg/mL、1 mg/mL、100μg/mL、10μg/mL時 對骨母細胞有抑制作用,且濃度愈高抑制效果愈強,當濃度降低至 1μg/mL 和 100 ng/mL 時則和控制組則無統計上差異。 (6)懷牛膝稀釋液在 10 mg/mL ~ 100 ng/mL6種濃度下,對骨母細胞均呈抑 制作用, (7)菟絲子稀釋液在濃度 10 mg/mL~1μg/mL5種濃度下,對骨母細胞均有 促進增生作用,而當濃度降低至 100 ng/mL則和控制組則無統計上差 異。 綜合上述結果,在單一的骨母細胞培養中,桑寄生、懷牛膝稀釋液對骨細 胞增生為抑制作用,其他 5種藥物(除了續斷在高濃度 10mg/mL下為抑制作用 外),在特定濃度下均為促進作用,增生作用最佳濃度如下: (龜鹿膠:10μg/mL、 杜仲:1 mg/mL、骨碎補:1 mg/mL、續斷:1 mg/mL、菟絲子:100μg/mL)。. 43.
(44) 表 4.1:中藥對骨母細胞 MTT 分析結果 O.B.MTT 10mg/ml 龜鹿膠 杜仲 ++ 骨碎補 ++ 續斷 ×× 桑寄生 ×× ×× 懷牛膝 菟絲子 ++. 1mg/ml. 100µg/ml. 10µg/ml. 1µg/ml. +. +. ++. ++. ++. ++. ++. ++. ++. +. +. +. + ××. + ××. ××. ××. ××. ××. ××. ++. ++. ++. ++. 100ng/ml +. ××. 促進:P<0.05〝+〞 ;P<0.01〝++〞 ; 抑制:P<0.05〝 × 〞 ;P<0.01〝 × × 〞. 4.1.3 中藥對骨母細胞 ALP 活性分析 骨母細胞 ALP 檢量線【圖 4.8】: 鹼性磷酸酵素活性對應骨母細胞數的關係 為. Y = 3.1979 X + 0.4048 X:骨母細胞數 (萬) / well Y:鹼性磷酸酵素活性 ( sigma unit / min / L) y = 3.1979x + 0.4048. ALP ( Osteoblasts ). 2. Sigma unit / Min / L. R = 0.9752. 20.0 18.0 16.0 14.0 12.0 10.0 8.0 6.0 4.0 2.0 0.0. 數列1 線性(數列1). 0. 0.5. 1. 1.5. 2. 2.5. 3. 3.5. 4. 4.5. 5. 5.5. (萬) cells / well. 圖 4.8 鹼性磷酸酵素活性 ( sigma unit / min / L) V.S. 骨母細胞數檢量線. 44.
(45) 中藥對骨母細胞 ALP 活性分析結果,如【表 4.2】: (1)龜鹿膠稀釋液在濃度 100μg/mL、10μg/mL、1μg/mL對骨母細胞鹼性 磷酸酵素活性有促進作用,其中又以 10μg/mL促進作用最強,其它濃 度和控制組則無統計上差異。 (2)杜仲稀釋液在濃度 10mg/mL時對骨母細胞鹼性磷酸酵素活性有抑制作 用,而其它濃度和控制組則無統計上差異。 (3)骨碎補稀釋液在濃度 100μg/mL和 10μg/mL對骨母細胞鹼性磷酸酵素 活性有促進作用,其它濃度和控制組則無統計上差異。 (4)續斷稀釋液在濃度 10mg/mL時對骨母細胞鹼性磷酸酵素活性有抑制作 用,而在 10μmg/mL 和 1μg/mL則對骨母細胞鹼性磷酸酵素活性有促 進作用,其它濃度和控制組則無統計上差異。 (5)桑寄生稀釋液在濃度 10mg/mL時對骨母細胞鹼性磷酸酵素活性有抑制 作用,而其它濃度和控制組則無統計上差異。 (6)懷牛膝稀釋液在 10 mg/mL ~ 100 ng/mL6種濃度下,對骨母細胞鹼性磷 酸酵素活性均呈抑制作用,且濃度愈高抑制效果愈強。 (7)菟絲子稀釋液在濃度 10μg/mL和 1μg/mL時對骨母細胞鹼性磷酸酵素 活性有促進作用,而其它濃度和控制組則無統計上差異。 綜合上述結果,在單一的骨母細胞培養中,對於骨母細胞的分化能力(鹼 性磷酸酵素活性) ,杜仲、續斷、桑寄生稀釋液在高濃度 10 mg/mL呈抑制作用, 而懷牛膝稀釋液在 10 mg/mL~100ng/mL6種濃度下均為抑制作用。相反的, 龜鹿膠、骨碎補、續斷(高濃度10 mg/mL 下為抑制作用) 、菟絲子則為促進作 用,分化作用最佳濃度如下: (龜鹿膠:10μg/mL、骨碎補:100μg/mL 、續 斷:1μg/mL 、菟絲子:10μg/mL)。. 45.
(46) 表 4.2:中藥對骨母細胞 ALP 活性分析結果 O.B.ALP 10mg/ml 龜鹿膠 杜仲 ×× 骨碎補 續斷 ×× 桑寄生 ×× 懷牛膝 ×× 菟絲子. 1mg/ml. 100µg/ml. 10µg/ml. 1µg/ml. ++. ++. ++. ++. ++ +. ××. ××. 100ng/ml. ++. ××. ××. ++. ++. ××. 促進:P<0.05〝+〞 ;P<0.01〝++〞 ;抑制:P<0.05〝 × 〞 ;P<0.01〝 × × 〞. 4.1.4 中藥對骨母細胞礦物質化結節形成的評估 對骨母細胞 MTT 分析和 ALP 活性分析有促進作用的中藥,進一步作礦物 質化結節的形成評估。 中藥對骨母細胞礦物質化結節形成的評估結果【表 4.3】: (1)龜鹿膠稀釋液在濃度 10μg/mL和 1μg/mL對礦物質化結節的形成有促 進作用,其它濃度和控制組則無統計上差異。 (2)杜仲稀釋液在濃度 10 mg/mL 時對礦物質化結節的形成有抑制作用, 而其它濃度和控制組則無統計上差異。 (3)骨碎補稀釋液在濃度 100μg/mL和 10μg/mL對礦物質化結節的形成有 促進作用,其它濃度和控制組則無統計上差異。 (4)續斷稀釋液在濃度 10 mg/mL 時對礦物質化結節的形成有抑制作用, 而在和 1μg/mL 則有促進作用,其它濃度和控制組則無統計上差異。 (5)菟絲子稀釋液在濃度 10μg/mL和 1μg/mL時對礦物質化結節的形成有 促進作用,而其它濃度和控制組則無統計上差異。 在礦物質化結節形成的評估,我們實驗以對骨母細胞的增生和分化能力均 有促進作用的龜鹿膠、杜仲、骨碎補、續斷、菟絲子為對象,發現礦物質化結 46.
(47) 節形成的能力和鹼性磷酸酵素的活性有正相關,除了杜仲、續斷在高濃度 10 mg/mL 下為抑制作用外,其餘在特定濃度下均為促進作用,根據以上實驗結 果,礦物質化結節的形成和骨母細胞的分化能力有關,亦即能促進 ALP 活性的 藥物,即能使骨質增生加速。. 表 4.3 中藥對骨母細胞 MTT 分析、ALP 活性分析、礦物質化結節形成評估比 較表 nodules 龜鹿膠. 杜仲. 骨碎補. 續斷. 菟絲子. 10mg/ml MTT ALP nodules MTT ALP nodules MTT ALP nodules MTT ALP nodules MTT ALP nodules. ++. 1mg/ml. 100µg/ml. 10µg/ml. 1µg/ml. +. +. ++. ++. ++. ++. ++. ++. ++. ++. ++. ++. ++. ++. +. +. +. ++. ++. ++. ++. 100ng/ml. ×× ×× ++. ×× ×× ×× ++. +. + +. ++ ++. ++. ++. 促進:P<0.05〝+〞 ;P<0.01〝++〞 。. ++. ++. ++. ++. ++. ++. 抑制:P<0.05〝 × 〞 ;P<0.01〝 × × 〞. 47. +.
(48) 4.2 蝕骨細胞 4.2.1 具酒石酸耐受性酸性磷酸酵素活性分析【表 4.4】 4.2.1.a 給藥期 1 ~ 4 天 (1)龜鹿膠稀釋液在 10 mg/mL ~ 100 ng/mL 6種濃度下,對 TRAP 活性和控制 組均無統計上差異。 (2)杜仲稀釋液在10 mg/mL ~ 100 ng/mL 6 種濃度下,對 TRAP 活性和控制組 均無統計上差異。 (3)骨碎補稀釋液在濃度 10mg/mL和 1mg/mL對 TRAP 活性有促進作用, 其它濃度和控制組則無統計上差異。 (4)續斷稀釋液在 10 mg/mL~ 100 ng/mL6種濃度下對 TRAP 活性和控制組 均無統計上差異。 (5)桑寄生稀釋液在濃度10 mg/mL 對 TRAP 活性有明顯的促進作用,其它濃 度和控制組則無統計上差異。 (6)懷牛膝稀釋液在濃度10 mg/mL 對 TRAP 活性有促進作用,其它濃度和控 制組則無統計上差異。 (7)菟絲子稀釋液在濃度 10 mg/mL、1 mg/mL 和 100μg/mL對 TRAP 活性 有抑制作用,且濃度愈高抑制效果愈強,當濃度降低至 10μg/mL則和 控制組無統計上差異。. 4.2.1.b 給藥期 5 ~ 6 天 (1)龜鹿膠稀釋液在濃度 10mg/mL和 1mg/mL對 TRAP 活性有抑制作用, 其它濃度和控制組則無統計上差異。 (2)杜仲稀釋液在濃度 10 mg/mL對 TRAP 活性有促進作用,在其它濃度和控 制組則無統計上差異。 (3)骨碎補稀釋液在濃度 10 mg/mL、1 mg/mL和 100μg/mL對 TRAP 活性有 48.
(49) 促進作用,其它濃度和控制組則無統計上差異。 (4)續斷稀釋液在濃度 10 mg/mL對 TRAP 活性有促進作用,在其它濃度和控 制組則無統計上差異。 (5)桑寄生稀釋液在濃度 10mg/mL和 1mg/mL對 TRAP 活性有促進作用, 其它濃度和控制組則無統計上差異。 (6)懷牛膝稀釋液在濃度10 mg/mL 對 TRAP 活性有抑制作用,其它濃度和控 制組則無統計上差異。 (7)菟絲子稀釋液在濃度 10 mg/mL、1 mg/mL、100μg/mL、10μg/mL 對 TRAP 活性有抑制作用,且濃度愈高抑制效果愈強,當濃度降低至 1μg/mL 則和控制組無統計上差異。. 4.2.1.c 給藥期 1 ~ 6 天 (1)龜鹿膠稀釋液在濃度 10 mg/mL ~ 100 ng/mL對 TRAP 活性均有抑制作用。 (2)杜仲稀釋液在濃度 10 mg/mL對 TRAP 活性有促進作用,在其它濃度和控 制組則無統計上差異。 (3)骨碎補稀釋液在濃度 10mg/mL和 1mg/mL對 TRAP 活性有促進作用, 其它濃度和控制組則無統計上差異。 (4)續斷稀釋液在濃度 10mg/mL對 TRAP 活性有促進作用,在其它濃度和 控制組則無統計上差異。 (5)桑寄生稀釋液在濃度10 mg/mL 對 TRAP 活性有促進作用,其它濃度和控 制組則無統計上差異。 (6)懷牛膝稀釋液在濃度10 mg/mL 對 TRAP 活性有抑制作用,其它濃度和控 制組則無統計上差異。 (7)菟絲子稀釋液在濃度 10 mg/mL、1 mg/mL、100μg/mL、10μg/mL 對 TRAP 活性有抑制作用,且濃度愈高抑制效果愈強,當濃度降低至 1μg/mL 則和控制組無統計上差異。. 49.
(50) 4.2.1.d 給藥期 7 ~ 8 天 (1)龜鹿膠稀釋液在濃度 10 mg/mL ~ 100 ng/mL對 TRAP 活性均有抑制作用。 (2)杜仲稀釋液在濃度 10 mg/mL對 TRAP 活性有促進作用,其它濃度和控制 組則無統計上差異。 (3)骨碎補稀釋液在濃度 10mg/mL和 1mg/mL對 TRAP 活性有促進作用, 在其它濃度和控制組則無統計上差異。 (4)續斷稀釋液在濃度 10 mg/mL和 1mg/mL對 TRAP 活性有促進作用,在 其它濃度和控制組則無統計上差異。 (5)桑寄生稀釋液在濃度 10mg/mL和 1mg/mL對 TRAP 活性有促進作用, 其它濃度和控制組則無統計上差異。 (6)懷牛膝稀釋液在濃度10 mg/mL 對 TRAP 活性有促進作用,其它濃度和控 制組則無統計上差異。 (7)菟絲子稀釋液在濃度 10 mg/mL ~ 100 ng/mL對 TRAP 活性均有抑制作用, 且濃度愈高抑制效果愈強。. 4.2.1.e 綜合分析. ※ 龜鹿膠 (1)在 1~4 天 O.C.前驅細胞的增生期,龜鹿膠稀釋液在 10 mg/mL ~ 100 ng/mL6 種濃度下,TRAP 活性和控制組均無統計上差異。 (2)在 5~6天成熟 O.C.的分化期,龜鹿膠稀釋液在濃度 10 mg/mL 和 1 mg/Ml 對 TRAP 活性有抑制作用,其它濃度和控制組則無統計上差異。 (3)在 1~6 天 O.C.的增生期和分化期,龜鹿膠稀釋液在濃度 10 mg/mL~ 100 ng/mL 對 TRAP 活性均有抑制作用。 (4)~7 天後已分化為成熟的 O.C.,龜鹿膠稀釋液在濃度 10 mg/mL ~ 100 ng/mL 對 TRAP 活性均有抑制作用。. 50.
數據

+7
相關文件
the lymphocyte function-associated antigen 1, or LFA-1, was so named because antibodies recognizing this structure interfere with lymphocyte cell adhesion events and
10 SF12259A 黃文豊 一項隨機分配、開放性、多中心臨床 試驗,對於先前未接受過治療的 CD20 表面抗原陽性之瀰漫性大型 B 細胞淋 巴瘤或 CD20 表面抗原陽性之濾泡性
評估以 S-649266 或最佳現有療法進行治療罹患抗 Carbapenem 革蘭氏陰性菌感染的患者的臨床結果 (包括詴驗用藥 S-649266
眼睛是心靈之窗,心靈是眼神之源。在眼球後方 感光靈敏的角膜含有 1.37 億個細胞,將收到的信 息傳送至腦部。這些感光細胞,在任何時間均可 同時處理
• 是細胞不正常增生,且這些增生的細胞可
基因編輯技術以人工核酸酶辨識特定 DNA 位置,並於此處切斷雙股 DNA。DNA 斷
1.概估 2.設計估價 3.競爭估價 4.明細估價 5.實費精算估價 6.雇工估價
當時,許多科學家認為“活”的酵素(如酵母細胞)與“沒 有生命”的胃消化液是不同的東西(生機論),但德國生 理學家Kühne則提出後者是所謂的“酵素”