利用蛋白質體學方法鑑定針對日本腦炎病毒之治療標的; Identification of therapeutic targets against Japanese Encephalitis Virus using proteomic approaches
全文
(2) 中 國 醫 藥 大 學 醫學檢驗生物技術學系碩士班 碩士學位論文. 利用蛋白質體學方法鑑定針對日本腦炎病毒之治療標的. Identification of therapeutic targets against Japanese Encephalitis Virus using proteomic approaches.. 指導教授: 林振文. 教授. Cheng-Weng Lin 研究生: 邱曼慈 Man-Tzu Chiu. 中華民國. 九十八. 年. 六. 月.
(3) . 誌 謝 回想兩年前,我曾經那麼地排斥研究所這條路,總覺得那不是我想 做的事,不懂事的我一路跌跌撞撞,帶著些許的不情願與憑著我也可以 做得到的想法,我踏上了這裡。感謝林振文老師,在我最無助的時候願 意收留我,讓我有一個穩定的環境學習,也謝謝他兩年來的指導,教導 我的不只是在學術上的思維,也包含了面對人生的態度。同時感謝長庚 大學陳維鈞教授以及中國醫醫學所林應如老師在畢業口試時給予我許 多論文與實驗上的建議,讓我的論文有更多努力的方向。特別感謝美秀 學姊,有妳先前的努力耕耘,才能讓我的碩士生涯走得更順利,以及姿 穎學姊與俊瑋學長在畢業之後仍給予我很多實驗上的幫助。 在實驗室裡,感謝詩雯學姊、博誠學長在實驗上不吝給予指導。感 謝我的好夥伴心元、紹晟,總是能適時給我實驗上的建議;于楨,在實 驗室裡互相幫助,也是最好吐苦水的好朋友,以及宏綸,大家一起渡過 苦悶的碩士生涯並為我的生活添加許多歡樂與活力。也感謝可愛的學弟 妹們莉馨、京伶、妍冠、偉生在實驗上的幫助,同時替實驗室帶來歡笑, 在未來的時間裡,大家要一起努力喔。 最後謝謝我的爸媽、姊姊,從小到大我老是想到做什麼就做什麼, 很多時候都未曾經過深思熟慮,但是他們總是包容著不懂事又任性的 我,從來不曾嚴厲地指責過,而是讓我自己去嘗試後循循善誘,感謝他. . i.
(4) . 們讓我在滿滿的愛中長大,碩士生活因為有他們的支持,我才能走得更 穩。僅以此本論文獻給我最愛的家人。. . ii.
(5) . 中文摘要. 日本腦炎病毒屬於以蚊子為傳染媒介的黃質病毒科,它能造成人類 與許多動物中樞神經的感染,甚至形成腦膜炎。流行在亞洲地區,每年 病例約三萬至五萬人。目前在台灣地區由於疫苗的廣泛施行,從 1998 至 2007 日本腦炎通報病例數每年約 3-4 百人,確定病例每年約 20-30 例。在治療方面並沒有針對日本腦炎之抗病毒藥物,只能依病情給予支 持性療法。日本腦炎病毒的非結構蛋白 NS5 在日本腦炎病毒基因組裡屬 最大段也是具高度保守的序列,它與甲基轉移酶以及依附 RNA 型 RNA 聚合酶有關,是病毒複製時非常重要的蛋白。在過去的研究指出,日本 腦炎病毒 NS5 蛋白能夠藉由阻斷 Jak-Stat 分子訊息傳遞的方式去抵抗第 一型干擾素的作用。本研究論文之目的在確認 NS5 蛋白為干擾素的拮抗 物,並利用二維電泳圖譜以及基質輔助雷射脫附游離-飛行時間質譜之蛋 白質體學方法去比較 NS5 表現蛋白細胞經干擾素 IFN-β 處理作用後相關 蛋白變化以了解 NS5 蛋白在細胞內的分子機制。首先利用流式細胞儀檢 測 Annexin V 與 PI 染色後的細胞,發現 NS5 蛋白表現的細胞能夠抑制 IFN-β 所誘導之細胞凋亡。另一方面以細胞內冷光報導基因試驗顯示 NS5 蛋白具有抑制干擾素所引起的 ISRE 啟動子活性的作用。同時利用 即時定量聚合酶連鎖反應試驗發現 NS5 蛋白對於 IFN-β 所誘發產生的抗 病毒蛋白基因 PRK 及 OAS 有抑制表現的現象。接著經二維電泳及質譜 . iii.
(6) . 儀分析發現與空載體對照組細胞相比,在 NS5 蛋白表現細胞加入干擾素 誘發表現上升的蛋白有:Fascin、Peroxiredoxin-1 及 Cyclophilin A 等 5 個蛋白;而表現下降的蛋白如:Heterogeneous nuclear ribonucleoprotein L 及 Stress-induced- phosphoprotein 1 等 16 個蛋白。同時我們利用西方墨 點法確認 Cyclophilin A 在 NS5 蛋白表現細胞中含量較空載體對照細胞 高。最後我們加入 cyclophilin A 抑制劑 Cyclosporin A 能夠回復被 NS5 蛋白所抑制的干擾素下游 ISRE 啟動子之活性,以及抑制 ERK1/2 的磷 酸化。此外利用即時定量聚合酶連鎖反應與流式細胞儀發現 Cyclosporin A 具有對抗日本腦炎病毒複製以及抗病毒所誘發的細胞凋亡能力。藉由 病毒蝕斑得知 Cyclosporin A 處理其他種類細胞株有同樣的抗日本腦炎 病毒反應。本論文的發現或許能夠提供一個治療日本腦炎的新療法。. . iv.
(7) . Abstract. Japanese encephalitis virus (JEV), a mosquito-borne flavivirus, infects central nervous system in human and animal, resulting in encephalitis. Thirty to fifty thousand JE cases occur annually in Asia. A mass vaccination of Nakayama strain JE inactivated vaccine has been launched since 1968 in Taiwan, therefore only sporadic JE cases occur between August and October in Taiwan. Specific and effective anti-viral drugs for JE treatment are not available, thus JE treatment is supportive. JEV non-structural protein 5 (NS5),. the. largest. and. most. conserved. flavivirus. protein,. has. methyltransferase and RNA-dependent RNA polymerase activities, being critical for virus replication. In addition, JEV NS5 protein has been demonstrated the inhibitory effect on the interferon (IFN)-α/β response by blocking JAK-STAT singaling pathway. The goal of this study is to investigate the molecular mechanism of the IFN antagonist function by JEV NS5 using two-dimensional electrophoresis (2-DE) and mass spectrometric (MS) identification, developing the novel targets for the JE treatment. Initially, the NS5-expressing cells, but not vector control cells were resistant to the effects of IFN-β treatment, such as apoptosis, the promoter activity of the interferon stimulation response element (ISRE), and the mRNA . v.
(8) . expression of oligoadenylate synthetases (OAS) and protein kinase R (PKR). Comparison of proteome profiling between NS5-expressing cells and vector control cells revealed that the expression of JEV NS5 protein resulted in the up-regulation of 5 identified proteins including fascin, Peroxiredoxin-1, and cyclophilin A, and down-regulation of 16 identified proteins including heterogeneous. nuclear. ribonucleoprotein. L. and. stress. induced. phosphoprotein 1 in human medulloblastoma TE671 cells. Western blotting confirmed the up-regulation of cyclophilin A in NS5-expressing cells in absence or presence of the IFN-β treatment. Finally, cyclosporin A, a cyclophilin inhibitor restored IFN-β induced ISRE promoter activity and inhibited the phosphorylation of ERK1/2 in NS5-expressing cells in presence of the IFN-β treatment. Importantly, cyclosporin A inhibited the JEV replication and decreased JEV-induced apoptosis in TE671 cells and BHK-21 cells. This study demonstrate unique proteome profiling of NS5-expressing cells in absence and presence of the IFN-β treatment, identifying cyclophilin A as the therapeutic target against JEV. The results might provide a new therapeutic strategy for JEV infection.. . vi.
(9) . 目錄 誌 謝 ....................................................... i 表目錄 .................................................... xii 圖目錄 ................................................... xiii 第一章 前言 ................................................. 1 第一節. 研究背景 ............................................................................... 1. 1.1 日本腦炎 ....................................................................................... 1 1.1.1 日本腦炎流行病學與臨床症狀 ................................................ 1 1.1.2 基因組與結構 ............................................................................ 2 1.1.3 NS5 的結構及功能 .................................................................... 5 1.1.4 日本腦炎病毒導致腦炎的機制 ............................................... 6 1.1.5 診斷與治療 ............................................................................... 6 1.2 干擾素 .......................................................................................... 8 1.2.1 干擾素的種類與功能 ............................................................... 8 1.2.2 干擾素的細胞訊息傳遞與病毒拮抗干擾素之策略............. 10 1.3 胞內環孢靈 A (Cyclophilin A) .................................................. 11 1.4 胞內環孢靈 A (Cyclosporin A) ................................................. 12 1.5 蛋白質體學 ................................................................................ 13 1.5.1 二維電泳的原理 ..................................................................... 14. . vii.
(10) . 1.5.2 質譜儀的原理 ......................................................................... 15 第二節. 研究目的 ............................................................................. 16. 第二章 研究方法 ............................................ 18 第一節 研究設計 .................................................................................... 18 2.1.1 建立 NS5 蛋白之細胞表現.................................................... 18 2.1.2 確認 NS5 具有對抗干擾素之功能........................................ 19 2.1.3 蛋白質體學鑑定治療標的 ..................................................... 19 2.1.4 選用抑制劑 ............................................................................. 19 第二節 研究材料 .................................................................................... 20 2.2.1 細胞株 ..................................................................................... 20 2.2.2 病毒株 ..................................................................................... 20 2.2.3 質體 ......................................................................................... 20 2.2.4 抗體 ......................................................................................... 21 2.2.5 引子 ......................................................................................... 21 2.2.6 呈色劑 ..................................................................................... 22 2.2.7 實驗試劑與緩衝溶液 ............................................................. 22 第三節 實驗方法 .................................................................................... 23 2.3.1 DNA 轉染 (DNA transfection) ............................................... 23 2.3.2 細胞蛋白萃取 (Cell extraction)............................................. 23. . viii.
(11) . 2.3.3 蛋白質濃度測定 (Bradford method)..................................... 23 2.3.4 蛋白質電泳分析 (SDS-PAGE).............................................. 24 2.3.5 蛋白質轉漬 (Transfer) ........................................................... 24 2.3.6 西方墨點法 (Western bloting) ............................................... 25 2.3.7 流式細胞儀 (Flow cytometry)............................................... 25 2.3.8 冷光測試啟動子活性(Luciferase assay)................................ 26 2.3.9 二維電泳蛋白質前處理 ......................................................... 27 2.3.10 蛋白質二維電泳(Two-dimensional electrophoresis)...... 27 2.3.11 蛋白質等電點聚焦電泳法 (Isoelectric focusing, IEF)....... 28 2.3.12 SDS 聚丙烯膠電泳 (SDS-polyacrylamide gel electrophoresis).................................................................................. 28 2.3.13 銀染 (Sliver stain) ................................................................ 29 2.3.14 軟體比對 ............................................................................... 30 2.3.15 膠內蛋白質水解 ................................................................... 30 2.3.16 病毒增幅 (virus amplyfication) ........................................... 31 2.3.17 核醣核酸萃取 (RNA extraction) ......................................... 31 2.3.18 反轉錄聚合酶連鎖反應 (Reverse transcription PCR) ....... 32 2.3.19 即時定量聚合酶連鎖反應 (Real-time PCR)...................... 32 2.3.20 病毒斑點試驗 (plaque assay) .............................................. 33 第三章 . 研究結果 ......................................... 34 ix.
(12) . 3.1. 日本腦炎 NS5 蛋白對干擾素訊號傳遞之影響 ................ 34. 3.1.1. 建立 NS5 蛋白表現之 TE671 細胞 ................................... 34. 3.1.2. 以 IFN-β 測試 NS5 對干擾素之抗性 ................................ 34. 3.1.3. NS5 蛋白幫助細胞對抗干擾素誘導之細胞凋亡 ............. 34. 3.1.4. 日本腦炎 NS5 抑制 ISRE 啟動子之活性 ......................... 35. 3.1.5. 日本腦炎 NS5 促進 NF-κB 啟動子之活性....................... 35. 3.1.6. 日本腦炎 NS5 蛋白對細胞激素與干擾素下游基因表現. 之影響 ……………………………………………………………36 3.2. 二維電泳圖譜分析干擾素對 NS5 蛋白表現細胞之影響 37. 3.2.1. 二維電泳圖譜分析 ............................................................. 37. 3.2.2. 受 IFN-β 影響而表現差異的蛋白質點 ............................. 37. 3.2.3. 表現差異蛋白質點身份之確認 ......................................... 37. 3.3. 針對 Cyclophilin A 做為治療標的之測試......................... 39. 3.3.1. 確認干擾素對 NS5 蛋白表現細胞中 Cyclophilin A 之影. 響........... ............................................................................................ 39. . 3.3.2. Cyclosporin A 抑制 ISRE 啟動子活性 .............................. 39. 3.3.3. Cyclosporin A 對於 Cyclophilin A 下游 ERK 分子之影響40. 3.3.4. 測試 Cyclosporin A 抗病毒之能力 .................................... 41. 3.3.5. Cyclosporin A 於 BHK-21 細胞的抗病毒能力 ................. 42. x.
(13) . 第四章. 討論 ............................................. 43 4.1 日本腦炎病毒抑制干擾素之作用 ............................................ 43 4.2 蛋白質體學圖譜分析 ................................................................ 45 4.3 以環孢靈 A(Cyclosporin A)作為日本腦炎之抑制劑 .............. 47. 第五章. 結論與建議 ....................................... 50. 第一節. 結論 ..................................................................................... 50. 第二節. 建議 ..................................................................................... 50. 參考文獻 ................................................... 51 圖 ......................................................... 55 表 ......................................................... 75 附錄 ....................................................... 80. . xi.
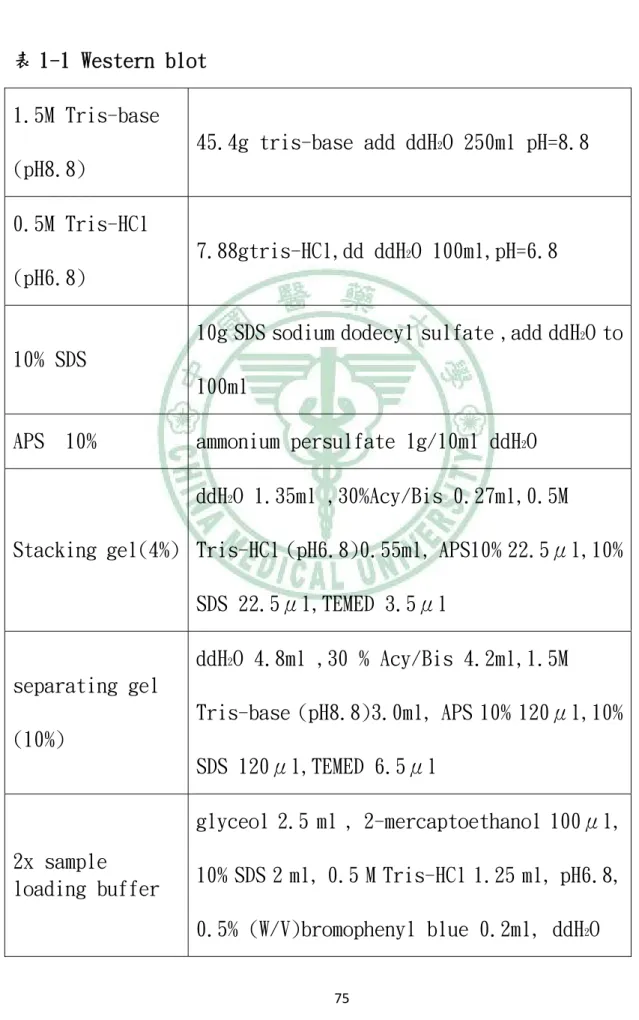
(14) . 表目錄 表 1-1 Western blot.................................................. 75 表 1-2 Protein concentration detection ................................ 76 表 2-1 蛋白質體學分析之差異性蛋白 ............................... 77. . xii.
(15) . 圖目錄 圖、研究設計流程......................................................................................... 18 圖一、利用 TE671 細胞表現 NS5 蛋白....................................................... 55 圖二、利用 IFN-β 測試 NS5 蛋白對干擾素的抗性.................................... 56 圖三、利用流式細胞儀觀察細胞凋亡現象................................................. 57 圖四、以西方墨點法觀察 Caspase-9 之表現 .............................................. 58 圖五、利用冷光報導測試 NS5 蛋白表現細胞經 IFN-β 處理後對 ISRE 活 性之影響 ......................................................................................................... 59 圖六、利用冷光報導測試 NS5 蛋白細胞經 IFN-β 處理後對 NF-κB 活性 之影響 ............................................................................................................. 60 圖七、以即時定量連鎖反應測試 NS5 對細胞激素與干擾素下游基因表現 之影響 ............................................................................................................. 61 圖八、利用二維電泳圖譜分析未加入 IFN-β 的空載體對照細胞............. 62 圖九、利用二維電泳圖譜分析加入 IFN-β 的空載體對照細胞................. 63 圖十、 利用二維電泳圖譜分析未加入 IFN-β 的 NS5 蛋白表現細胞...... 64 圖十一、利用二維電泳圖譜分析加入 IFN-β 的 NS5 蛋白表現細胞........ 65 圖十二、Spot 24. Cyclophilin A.................................................................... 66 圖十三、確認 Cyclophilin A 在空載體對照細胞及 NS5 蛋白表現細胞的 . xiii.
(16) . 表現 ................................................................................................................. 67 圖十四、利用 Cyclosporin A 做為抑制劑測試 ISRE 啟動子活性............. 68 圖十五、Cyclosporin A 對於 Cyclophilin A 下游 ERK 分子之影響.......... 69 圖十六、測試 Cyclosporin A 於 TE671 細胞的抗病毒能力 ...................... 70 圖十七、利用即時定量連鎖反應測試 Cyclosporin A 抗病毒複製之能力71 圖十八、利用流式細胞儀觀察 Cyclosporin A 抑制病毒誘導之細胞凋亡現 象 ..................................................................................................................... 72 圖十九、藉由病毒蝕斑觀察 Cyclosporin A 於 BHK-21 細胞抗病毒之情形 ......................................................................................................................... 73 圖二十、病毒蝕斑趨勢分析......................................................................... 74. . xiv.
(17) . . xv.
(18) . 第一章 前言. 第一節. 研究背景. 1.1 日本腦炎. 1.1.1 日本腦炎流行病學與臨床症狀. 日本腦炎病毒(Japanese encephalitis virus,簡稱 JEV)屬於黃病毒科 (Flavivirudae),利用節肢動物(Arthropod-borne)做為傳播媒介而引起 日本腦炎。日本腦炎於西元一八七一年在日本最早被認知,並於西元一 九二四年爆發大流行;在西元一九三五年首次從患者腦部組織分離鑑定 而命名為日本腦炎病毒。日本腦炎病毒會在動物之間傳染,最主要的增 幅宿主(Amplifying host)有猪、鳥和馬,宿主並不會發病但會使叮咬的蚊 子產生病毒血症。當蚊子叮咬受到感染的猪隻,病毒便會在病媒蚊體內 大量複製,並終生帶有傳染力,而人類若受到病媒蚊叮咬,就有可能得 到日本腦炎。在台灣主要的媒介為三斑家蚊(Culex tritaeniorhynchus) 及環蚊家蚊(Culex annulus)(Detels, Cross et al. 1976) [1],猪隻則是最主 要的增幅動物。日本腦炎在亞洲國家仍是重要的傳染疾病,雖然近來已 有疫苗注射,但在中國大陸、菲律賓、印尼、馬來西亞、印度等國家仍 時有流行 (Solomon 2003) [2]。感染日本腦炎病毒之後,患者會有發燒、 . 1.
(19) . 噁心、頭痛、腹痛、嗜睡等症狀,症狀加劇者可能會嘔吐、抽搐、昏迷、 顱神經麻痺、震顫等,致死率約 5~40%,存活病例可能會留下四肢肌肉 張力異常、痙攣、說話不清楚等神經性後遺症。. 日本腦炎是於夏季廣泛流行於亞洲地區的疾病,因於民國五十七年 開始全面實施疫苗施打,台灣民眾罹患日本腦炎的機率已經大幅下降, 屬於控制良好的流行性傳染病,但因疫苗屬於非活性疫苗,效力可達百 分之九十五以上但其免疫力持續性不佳,保護力僅約 5-10 年,又因民 國五十七年起才全面施打,目前許多 40 歲以上的壯年人口多未接受疫 苗注射,而且鄉村都市化,養猪戶集中化等,使人與病媒蚊接觸機會逐 年降低,導致高年齡層易感性宿主增加,尤其老人免疫力下降,自然受 感染的機率增大,罹病後也無高專一性的抗病毒藥物可供治療,因此在 台灣,日本腦炎仍有大流行的潛在風險。在台灣 1998-2007 日本腦炎通 報病例數每年約 3-4 百人,確定病例每年約 20-30 例。. 1.1.2 基因組與結構. 日本腦炎病毒在分類上屬於黃病毒科(Flaviviridae)、黃病毒屬 (Flavivirus),其基因體為單股正性的 RNA,顆粒大小為 40~50 nm,全 長約 11kb,在 5’端有 Type I cap,而 3’端缺少 poly A tail。5’端與 3’端 都有一段非轉譯區(Untranslation Region,簡稱 UTR),可形成高度保留 . 2.
(20) . 的二級結構,這段非轉譯區中夾帶有開放性區域(Open reading frames, 簡稱 ORF),這段 ORF 能轉譯一段聚胜肽鏈(polypeptide),這段聚胜肽 鏈經由宿主與病毒蛋白酶 NS2B-NS3 切割之後產生三個結構蛋白 (structure protein):核蛋白(core protein;C)、前膜蛋白(membrane protein;prM)、套膜蛋白(envelope protein;E);及七個非結構蛋白 (non-structure protein):NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5(附 圖 1)。其中結構蛋白的功能主要為負責病毒顆粒結構的組成:核蛋白 則是包覆病毒核酸、套膜蛋白為病毒外殼組成,負責包裝以及病毒與 宿主接觸融合有關 (Butrapet, Kimura-Kuroda et al. 1998) [3];而前膜蛋白 為膜蛋白(M protein)的前驅物,當病毒在宿主體內複製後要釋出細胞 外,前膜蛋白的 N 端會被切除而形成膜蛋白。至於非結構蛋白的功能, 目前仍在研究當中,已知的有 NS1 可能與病毒顆粒的成熟有關 (Fan and Mason 1990) [4],為病毒複製的複合體(Replication complex,簡稱 RC)之一。NS2B 與 NS3 會形成蛋白酶,促進 M protein 的分泌 (Jan, Yang et al. 1995) [5]。NS3 同時具有絲胺酸蛋白酶(Serine protease)、解旋酶 (Helicase)、核醣核酸三磷酸酶(RNA triphosphatase)的功能 (Wengler 1993) [6]。在同屬黃病毒科的 C 型肝炎病毒(HCV)研究中指出,NS4A 可做為 NS5 聚合酶的輔助因子 (Koch and Bartenschlager 1999) [7]。 NS4B 能使宿主細胞膜通透性改變,造成細胞病變(cytopathic effect,簡. . 3.
(21) . 稱 CPE) ,可在病毒感染時誘導含有病毒蛋白質的囊狀小泡形成。NS5 為依附 RNA 型的 RNA 聚合酶(RNA-dependent RNA polymerase,簡稱 RdRp),是病毒複製 RNA 時最主要的酵素。. 目前針對日本腦炎病毒複製過程的研究並不多,但是同為黃病毒屬 的 Kunjin virus 在感染細胞之後,會與宿主的核醣體合成病毒的蛋白。 在合成 NS5 時,NS2A 和 NS3 會與 NS5 N'端的三個高度保留區段 (Highly conserved region)結合,之後 NS 5 會與 NS3 再和正股基因體 的 3’-long stable hairpin(3’LSH)相結合 (Khromykh, Sedlak et al. 1999) [8]. ,使宿主細胞的蛋白質經由蛋白質與蛋白質,及蛋白質與 RNA 的交. 互作用而形成一個病毒的複合體(replication complex,簡稱 RC)。經由 蛋白複合體上 NS2A 的疏水性區域(hydrophobic region)和內質網膜 (ER)上的 NS4A 產生親合作用而將複合體連接至內質網膜上,並藉 由 NS4A 與膜內 NS1 作用將複合體轉移到內質網膜內 (Lindenbach and Rice 1999) [9]。複製複合體利用正股基因為模板以合成互補的負股基因 體序列,形成雙股 RNA 複合型(replicative form,簡稱 RF),當第一條 正股基因體正在複製且尚未完成時,第二條正股基因體就已經開始複 製,此複製型態稱為複製中間型(replication intermediates,簡稱 RI), 經由複製中間型不停的複製,將使病毒更易於產生正股基因體 (Bartholomeusz and Thompson 1999) [10]。 . 4.
(22) . 1.1.3 NS5 的結構及功能. NS5 位在整段病毒基因組的末端(附圖 1),含有 905 個胺基酸、大 小約 103kDa,N’端有一個甲基轉移酶(S-adenosyl-L-methioninedependent methyltransferase domain,簡稱 MTase domain),含有 methyltransferase core。在 MTase domain 之後有三段高度保留的區域, 分別為 a、b、c 三段,與病毒的 NS2A、NS3 結合;另一個功能區域是 核定位序列(nuclear localization sequences,簡稱 NLS) ,此序列可幫助 蛋白質進入細胞核;C’端的主要功能為 RdRp,含有一段 Gly-Asp–Asp 序列(GDD motif),此序列與 NS5 的 RdRp 活性相關,若此序列發生 突變會使 RdRp 失去活性,影響病毒的複製、包裝跟分泌(Guyatt, Westaway et al. 2001) [11]。 NS5 蛋白會在真核細胞內進行轉譯後修飾(post-translational modifiction),並且能被 Ser/Thr kinase 磷酸化。在黃病毒複製的過程中, NS5 被認為具有反式作用之功能(trans-acting element),當病毒的 NS5 蛋白序列發生缺失或突變時,可外加正常的 NS5 即能使複製繼續進 行。目前研究發現,NS5 蛋白在病毒感染宿主細胞時,可能扮演阻斷 干擾素活化 Jak-Stat 分子路徑刺激 protein tyrosine phosphatases (PTP)下 游的角色 (Park, Morris et al. 2007) [12]。. . 5.
(23) . 1.1.4 日本腦炎病毒導致腦炎的機制. 為探討日本腦炎病毒感染宿主動物後通過血腦障壁(brain-blood barrier) 而感染腦部的方式, Hase 等學者用腹腔注射的方式使小鼠感 染日本腦炎病毒,發現小鼠腦部的神經細胞也會受到病毒感染,且腦 部組織中有白血球浸潤的現象,推論血腦障壁會因感染日本腦炎病毒 而受到破壞(Hase, Dubois et al. 1990) [13]。再將染劑注射進入感染日本腦 炎病毒的小鼠血管中,發現染劑會進入到大腦中,顯示血腦障壁有缺 損的情形 (Chaturvedi, Dhawan et al. 1991) [14]。小鼠血腦障壁缺損的原 因可能是由於病毒感染後,產生巨噬細胞源趨化因子 (macrophage-derived chemotactic factor),使血管通透性增加(Khanna, Agnihotri et al. 1991) [15],並誘導內皮細胞產生 VCAM-1、 ICAM-1 等 細胞激素 (cytokine),促使白血球附著在被病毒感染的內皮細胞上 (Shen, SS et al. 1997) [16]導致血腦障壁的缺損,這些結果顯示病毒可能 從缺損的血腦障壁處進入腦部,進而感染腦部的神經細胞。. 1.1.5 診斷與治療. 感染日本腦炎病毒後,99%是沒有症狀或只是輕微不適,通常小兒 及老人對臨床病狀的感受性最高。目前日本腦炎的診斷方法,依據台灣 疾病管制局(Centers for Disease Control, CDC)定義的臨床病徵包含: . 6.
(24) . 有腦膜炎症狀,且出現下列任一項症狀:發燒、意識障礙、嘔吐、頸部 僵硬、抽筋、肌張力異常、頭痛、腦膜刺激症狀、意識障礙及精神症狀。 潛伏期大約四至十四日。目前實驗室的檢驗方法有:病毒核酸檢驗(即 時反轉錄聚合酶鏈鎖反應,Real-time reverse transcriptase - polymerase chain reaction,簡稱 Real-time RT-PCR)以及 IgM 及 IgG 抗體檢驗 (Capture IgM and IgG ELISA)。實驗結果確認以下任何一項:(1) 由組 織、血液、腦脊髓液或其他體液中偵測到日本腦炎病毒或病毒核酸、(2) 腦脊髓液中,抗日本腦炎病毒之 IgM 抗體呈現陽性反應、(3) 單支血清 中,抗日本腦炎病毒之 IgM 、IgG 抗體均呈現陽性反應,而抗登革病 毒之 IgM 抗體陰性者以及成對血清中,抗日本腦炎病毒之 IgM 或 IgG 抗體效價高於 4 倍或上升更高倍者。以上,即確認為日本腦炎陽 性之患者。. 在治療方面,與日本腦炎同屬黃病毒科之病毒已知能造成人類出 血、急性腦炎或肝臟病變等疾病 (Lindenbach 2001) [17]。而由蚊子做為 媒介的日本腦炎病毒、黃熱病毒、登革熱病毒、西尼羅病毒已造成嚴重 的全球性公共衛生疾病問題。研究指出,日本腦炎病毒可誘發 IFN 的 產生 (Ghosh, Goverdhan et al. 1990) [18]並對 IFN 具有敏感性 (Hasegawa, Satake et al. 1990) [19],目前除了日本腦炎病毒及黃熱病毒已 經有疫苗可預防之外,大部分黃病毒所造成的疾病目前並無疫苗,罹病 . 7.
(25) . 後臨床上亦無專一性的抗病毒藥物,治療大多採支持療法為主,主要為 控制抽筋、調整水份補充、降低腦水腫與減少發燒等,另視有無其他感 染症狀,斟酌給予抗生素使用。. 1.2 干擾素. 1.2.1 干擾素的種類與功能. 干擾素為自然產生之物質能對抗病毒複製及製造的能力,於 1957 年 Isaacs 及 Lindermann 等學者把減毒的流行性感冒病毒接種於雞胚 胎細胞內而發現了胚胎會分泌物質去抑制流感病毒,而命名為干擾素 (Interferon;簡稱 IFN)。干擾素依照性質、功能與製造細胞等細分主要 可分為兩大型:Type I interferon、Type II interferon。第一型干擾素主要 有 IFN-α 與 IFN-β,以抑制病毒與細胞分化為主要功能,在抵禦病毒入 侵的第一道防禦機制上扮演著重要的角色。因為這兩種干擾素的細胞表 面接受器相同,胺基酸排列亦有 29% 相符,所以被認為活性相似 (Hughes, Brown et al. 1987) [20],也由於都可直接被生物體內的大部分細 胞所生成,以因應病毒的感染,所以又稱為病毒型干擾素,幾乎所有細 胞種類都能產生第一型干擾素,但是 IFN-α 主要來源為單核球(monocyte) 與 B 型淋巴球(B lymphocyte),而 IFN-β 主要為纖維母細胞(fiberblast)分 泌。第二型干擾素為 IFN-γ,主要由 T 淋巴細胞(CD4+與 CD8+ T cells) . 8.
(26) . 與天然殺手細胞(Nature killer cells)所產生,前者藉由抗原的刺激或一些 T 細胞的刺激劑(如 concanavalin A 或 phytohemagglutinin)而產生 IFN-γ, 而後者被激活後也能分泌。Type II interferon 以負責免疫調節 (immunomodulation)為主。. 其中 IFN-β 主要為抑制病毒增殖,當細胞受到病毒感染時,會釋放 出 IFN-β,經由 autocrine 或 paracrine 的方式誘導細胞的 endonuclease 作用,而切割細胞質中的 mRNA ;並且活化 protein kinase ,使得 eIF-2 (Eukaryotic initiation factor-2) 磷酸化而喪失活性,進而抑制蛋白質的合 成,再藉此抑制病毒在細胞內大量複製 (Diamond and Harris 2001) [21]及 抑制病毒感染之細胞增生,接著增加 p53 的表現,使細胞走向凋亡。 經由調控其他細胞激素的表現,IFN-β 可以調控組織抗原(major histocompatibility complex, MHC)的基因表現 (Belardelli and Gresser 1996) [22]、NK 細胞的活化、antibody- dependent 細胞毒性,以及引起活 體內具有抗原專一性的 CD8+ T 細胞增生、抑制 CD4+ 細胞中 IL-4 以 及 IL-5 的分泌,並增加 IFN-γ 的表現,促進 T helper 1 的免疫反應,包 括 IgM、IgG2a 以及 IgA 等免疫球蛋白的作用。. 一般來說,干擾素的功能主要有三方面:(1) 抗病毒作用、(2) 免疫 調節以及(3) 抗腫瘤增生,一般病毒的感染涉及多個步驟:進入細胞、. . 9.
(27) . 脫去外殼、合成病毒蛋白質與核酸等。對於不同病毒感染不同細胞,干 擾素可能會影響一個或多個不同的步驟,藉著刺激其他抗病毒基因的表 現,而達到抗病毒的功效。. 1.2.2 干擾素的細胞訊息傳遞與病毒拮抗干擾素之策略. 以 IFN-β 路徑為例,RNA 病毒在複製時所產生的中間產物 (replication intermediates)或雙股 RNA 都可以作為病毒感染的信號來 誘導細胞合成干擾素。經由刺激細胞內 MDA-5 與 RIG-1 進而引發兩種 主要路徑(附圖 2):TRAF3、TRAF6 與 RIP1,接著刺激下游 interferon regulatory factor-3(IRF-3)、NF-κB,並促使其進入細胞核內與 ATF-2/c-Jun 三個蛋白分子分別結合至 IFN-β 的 promotor 上,使 IFN-β 開始進行轉 錄。細胞產生干擾素分泌之後,會再進一步刺激細胞(附圖 3),細胞表 面的干擾素接受器(IFNAR1 與 IFNAR2)形成二聚體會與 IFN 結合,使接 受器上的 Jak-1 以及 Tyk-2 磷酸化,進而刺激下游 Stat-1 與 Stat-2 蛋白磷 酸化,會由 Stat-1 與 Stat-2 形成異二聚體(heterodimer)再與 IRF-9 結合形 成一個轉錄因子 ISGF-3(interferon stimulated gene factor)進入細胞核內 與 ISRE (interferon- stimulated response element)的啟動子結合產生一些 抗病毒的蛋白;或是經由 Stat-1 與 Stat-1 形成同二聚體(homodimer),進 入核內結合至 GAS 的啟動子上,而這些蛋白包含了一些酵素、熱休克. . 10.
(28) . 蛋白、訊息傳遞物質、轉錄因子以及細胞凋亡蛋白等,例如 PKR、 2’,5’-OAS、IRF-7 (Goodbourn, Didcock et al. 2000) [23]。. 大多數病毒會演化出一些對抗干擾素免疫反應的策略以順利複 製、繁衍。目前已知病毒有幾種逃避干擾素免疫的方法:(1)直接影響干 擾素傳遞至細胞或表現、(2)藉由製造結構相似的物質影響干擾素結合至 細胞受器上、(3)阻斷干擾素在細胞內的訊息傳遞以及(4)直接影響干擾素 下游所產生的一些抗病毒之蛋白(Katze, He et al. 2002) [24] 。而以黃病毒 屬為例,其登革熱病毒(Dengue virus,簡稱 DEN-2)的非結構蛋白 NS2A、NS4A、NS4B 可以抵抗第一型干擾素的作用 (Munoz-Jordan, Sanchez-Burgos et al. 2003) [25],西尼羅河病毒(West Nile virus,簡稱 WNV)的非結構蛋白 NS2A、NS4B (Guo, Hayashi et al. 2005) [26]及黃熱 病毒(Yellow fever virus,簡稱 YFV)的 NS4B 都可以抑制干擾素,壁 虱性腦炎病毒(Tick- borne encephalitis virus,簡稱 TBEV)的非結構蛋 白 NS5 可以作為干擾素的抑制劑 (Best, Morris et al. 2005) [27],而日本 腦炎病毒也已被發現能藉由抑制干擾素接受器上的 Tyk2 激酶的磷酸化 來阻撓干擾素的訊息傳遞。. 1.3 胞內環孢靈 A (Cyclophilin A). Cyclophilin 家族的主要功能為催化胜肽鍵(peptide bond)順式-反式 . 11.
(29) . 轉換的異構酶(cis/trans isomerase),以幫助蛋白質的摺疊 (Fischer, Wittmann-Liebold et al. 1989) [28],因此也被稱做一種伴護蛋白分子 (molecular chaperons)。Cyclophilin A 會與免疫抑制藥物結合及鈣調磷酸 酶形成複合物,進而阻斷 T 細胞活化,達到免疫抑制的目的。但同時可 以誘導細胞內活性氧簇和活性氮簇等氧化應激物質產生,而對細胞形成 毒性。另外,Cyclophilin A 結合線粒體膜間腔的 Cyclophilin 受體 D 之 後後,可引起遲發的溶酶體損傷,啟動組織蛋白酶 D 造成細胞壞死。有 研究指出,Cyclophilin A 與 HIV 感染新的細胞時,會與病毒基因結合並 幫助其在宿主細胞內的複製 (Luban, Bossolt et al. 1993) [29]。. 1.4 胞內環孢靈 A (Cyclosporin A). 環孢靈(cyclosporin A)為含有 11 個胺基酸之環型多肽類 (polypeptide)。它是一種很強有效的免疫抑制劑,可以延長各種同種異 體移植之存活,例如皮膚、心臟、腎臟、胰臟、骨髓等(Starzl, Weil et al. 1980) [30]。Cyclosporin A 主要抑制 T 細胞促成性反應之發生,包括同種 異體免疫,延遲性皮膚過敏,Freund 氏佐藥關節炎,移植物反宿主疾病 及 T 細胞依賴性抗體之產生。它也可抑制淋巴激素(Lymphokine)之產生 及釋放,包括 interleukin 2 或 T 細胞生長因子(TCGF)。Cyclosporin A 對 淋巴球有選擇性及可逆性的作用。不像細胞抑制劑,它不抑制造血,而. . 12.
(30) . 且對吞噬細胞的功能沒有影響。. 目前有研究指出,Cyclosporin A 及其衍生物能透過抑制 Cyclophilin 的活性去影響 Hepatitis C virus RNA 的複製 (Watashi, Hijikata et al. 2003) [31]. ,目前已經有效應用到 C 型肝炎患者的身上。. 1.5 蛋白質體學. 蛋白質體(proteome)和蛋白質體學(proteomics)是在 90 年代初 期,由 Marc Wikins 和學者們首先提出,蛋白質體學包括二維電泳以及 蛋白質鑑定兩個部分,可有效分析特定組織或細胞所表現的蛋白質,而 成為基因組與蛋白質組表現斷層的橋樑,目前二維電泳技術已經廣泛應 用於動物、植物及醫藥研究上的發展,為現今研究生物體功能性蛋白質 之重要研究方法之一。. 其應用範圍可分為下列幾項:. 1. 表現性蛋白質體學(expression proteomics):表現性蛋白質體學在 定性分析(qualitative analysis)方面的主要研究目的包括分析某生 物樣品所含有之蛋白質身分鑑定及轉譯後修飾分析 (post-translational modifications)。. . 13.
(31) . 2. 功能性蛋白質體學(functional proteomics) :主要分析某蛋白質其 在整體生理反應中所扮演的生化功能角色。. 3. 生產性蛋白質體學(productive proteomics):生產性蛋白質體學是 以如何有效發展高效能蛋白質表現與純化技術進行研究。. 4. 結構性蛋白質體學(structural proteomics). 5. 細胞位圖蛋白質體學(cell-map proteomics):細胞位圖蛋白質體學 的研究重點就是針對蛋白質生合成後被輸送到哪個位置、分佈 (localization)在哪個次細胞內或間隔。. 6. 生物資訊蛋白質體學(bioinformatic proteomics):解譯 3 萬至 4 萬 個基因與其蛋白質產物的互動關係上,基因體學與蛋白質體學的 高速分析會製造出龐大的實驗數據資料庫,包括基因序列資料 庫、蛋白質體序列資料庫、蛋白質交互作用網路資料庫、蛋白質 結構資料庫等。. 1.5.1 二維電泳的原理. 二維電泳即 2D SDS-PAGE,其原理是利用蛋白分子量與等電點的 不同進行分離,同時利用等電點電泳(isoelectric focusing,簡稱 IEF)以及. . 14.
(32) . 聚丙烯膠體電泳(polyacrylamide gel electrophoresis)兩種方法,此種雙向 電泳是利用樣品中不同成分 pI 差異,進行 IEF-PAGE 第一向分離,然後 縱向切割再以垂直於第一向的方向進行第二向 SDS-PAGE,從而使不同 分子量的蛋白質進一步分離,其中等電點沉澱法是在具有 pH 梯度環境 中進行的電泳。將蛋白質置於不同 pH 梯度的膠體進行電泳,它會朝著 與自身所帶電性相反的電極方向移動,直到抵達與等電點(pI)相同的 pH 值處才停止。待二維電泳完成後,可以將蛋白質保存於膠體中,直 到下一個分析步驟。. 1.5.2 質譜儀的原理. 樣品送入質譜儀之前,要先用酵素將大分子的蛋白質切成小片段, 這樣有利於儀器作出正確的判斷,因為由 6 到 20 個氨基酸所組成的 peptides 對於質譜儀和 database 的解讀最為有利。質譜儀(mass spectrometry, MS)是以熱電子撞擊氣體分子,使產生碎片及離子,再經 磁場分離,依據質荷比之測量,來決定分子質量的技術。而質量是分子 的一種特質,因此可以用於分子的鑑定或確認。質譜儀主要包括三個部 分:離子源、質量分析器、以及離子偵測器。離子源將分析物氣化及離 子化,導入質量分析器,在這裡各種離子會依 m/z 值作分離,經離子偵 測器將離子數多寡轉成電子訊號的強弱。質譜儀在離子源上的技術主要. . 15.
(33) . 有兩種:。一是電噴灑離子化技術(electrospray ionization 或簡稱 ESI) , 另一是基質輔助雷射脫附離子化(matrix-assisted laser desorption / ionization 或簡稱 MALDI),而基質輔助雷射脫附離子化的離子源,則 常與飛行時間(time-of-flight 或簡稱 TOF)質量分析器串接,在使用上 較為簡單、靈敏而效率高。質譜儀目前主要用於研究蛋白質的初級結構 (primary structure)問題,如蛋白質身份鑑定(protein identification)與 後轉譯修飾(post-translational modification)等。此外,也被應用於其他 的蛋白質結構問題,如複合體形成、蛋白質折疊(protein folding)等。. 第二節. 研究目的. 我們實驗室鄭傑文學長發現日本腦炎的 NS4A 蛋白與 NS4B 蛋白具 有抑制干擾素之作用,而 NS4A 的抑制效果又比 NS4B 來的好;而在鄭 美秀學姊的研究中指出,日本腦炎的 NS5 蛋白也具有拮抗干擾素之功 能,並能降低細胞內 ISRE 的活性。因此,我們的研究動機是希望藉由 日本腦炎 NS5 蛋白為主軸,除了確認與干擾素之間的影響外,進一步利 用蛋白質體學分析的方式,找到一個有效的治療標的。. 目前亦有文獻指出,日本腦炎病毒具有對抗干擾素的現象,而且日 本腦炎的非結構蛋白 NS4A 與 NS5 具有阻斷干擾素訊息傳遞的功能,尤 其是 NS5 已有研究發現會經由影響 PTP 分子機制進而阻斷 Jak-Stat 訊息 . 16.
(34) . 分子傳遞,因此我們利用 NS5 當作實驗主軸,確認 NS5 對抗干擾素之 功能後,進一步利用蛋白質體學去分析、鑑定受 NS5 調節之蛋白,從中 找出一個有效的治療標的,利用此標的開發抑制劑,並探討此標的蛋白 之抑制劑是否對於日本腦炎有抑制的效果。. . 17.
(35) . 第二章 研究方法. 第一節 研究設計. 建立日本腦炎病毒 NS5 蛋白於 TE671 細胞中. 觀察 NS5 蛋白拮抗干擾素之反應. 利用蛋白質體學分析. 鑑定治療標的及選用抑制劑. 確認抑制劑於 TE671 與 BHK-21 對日本腦炎病毒的抑制效果. 圖、研究設計流程. 2.1.1 建立 NS5 蛋白之細胞表現. 首先將 NS5 序列構築在 PCR3.1 載體上,PCR3.1 於真核細胞中可利 用 CMV promotor 進行蛋白表現。將構築好的載體利用商業試劑轉染進 人類腦胚胎瘤細胞中,加入 G418 使其穩定表現蛋白,接著利用西方墨 點法確認蛋白表現。. . 18.
(36) . 2.1.2 確認 NS5 具有對抗干擾素之功能. 利用冷光報導基因 ISRE-Luc 偵測日本腦炎病毒 NS5 蛋白抑制干 擾素 IFN-β 反應的程度,以及利用即時定量連鎖反應去觀察 NS5 蛋白表 現對於干擾素下游所產生的一些抗病毒基因以及細胞激素的改變。另外 利用流式細胞儀以及冷光報導基因 NF-κB-Luc 偵測 NS5 的表現對於細 胞是否有幫助宿主細胞逃避免疫反應所造成之細胞凋亡現象。. 2.1.3 蛋白質體學鑑定治療標的. 將 TE671-PCR3.1 與 PCR3.1-NS5 穩定表現之細胞,進行加入與未 加入 IFN-β 處理後,利用二維電泳圖譜分析,進行膠體比對後,將膠體 取下做水解處理並進行 MALDI-TOF 分析,上機之後的蛋白鑑定的檔案 利用 MASCOT 資料庫做搜尋,利用這些蛋白再去尋找其分子相關機 制,進一步找到可能做為治療標的的蛋白。. 2.1.4 選用抑制劑. 利用尋找出來的治療標的蛋白,選用抑制劑重新測定 ISRE-Luc 觀 察是否能回復被 NS5 抑制的干擾素下游表現。接著將抑制劑與干擾素分 別與同時加入不同之細胞株中去感染日本腦炎病毒,利用觀察細胞病變 以及即時定量連鎖反應的方式去偵測病毒是否有被抑制的現象;另一方 . 19.
(37) . 面也利用病毒斑點測試病毒被抑制的情形,進而找到一個新的治療日本 腦炎之方法。. 第二節 研究材料. 2.2.1 細胞株 在本實驗中所使用的細胞株為人類腦胚胎瘤細胞(The human medulloblastoma line, TE671),以含有 10% FBS (fetal bovine serum)的 MEM (minimal essential medium)培養液進行培養,培養箱環境為 37℃、 5% CO2。幼小倉鼠腎臟纖維母細胞( BHK-21 cell)同樣以含有 10% fetal bovine serum 的 MEM( Minimum Essential Medium),培養在 75cm2 cell culture flask 中,以 37℃、5% CO2 的環境下培養在培養箱中。. 2.2.2 病毒株. 日本腦炎病毒台灣本土株(T1P1)。(長庚大學 陳維鈞教授提供). 2.2.3 質體. pCR3.1 (Invitrogen):含有 5060 個鹼基對,在哺乳動物細胞中經由 human cytomegalovirus (CMV) immediate_early_promoter 表現蛋白質,並且於 N . 20.
(38) . 端帶有 3 個 Flag-tag。. pEGFP-N1(BD Biosciences Clontech): 含有 4.7 個鹼基配對,可在哺 乳動物細胞 (mammalian cells) 中,經 human cytomegalovirus (CMV) immediate_early_promoter表現Enhanced green fluorescent protein (EGFP) 蛋白質,在顯微鏡下產生綠色螢光。. 2.2.4 抗體. Goat anti-mouse IgG,AP Conjugate labeled antibody (ZYMED)\Anti-mouse Peroxidase(Kirkegaard Perry Liboratories;KPL) HRP-labeled anti-Mouse IgG (H+L) (Kirkegaard Perry Laboratories) Anti-GAPDH Anti-β actin (SIGMA) Anti-cyclophilin A (abcam) Anti-ERK1 (ZYMED) Anti-phosphate ERK1/2 (BIOSOURCE) 2.2.5 引子 JEV-NS5-F. 5’-GTCGC GGATCC ggaagacctgggggcaggacg-3’. JEV-NS5-R. 5’-CTAGA CTCGAG gatgaccctgtcttcctggat-3’. . 21.
(39) . JEV-ED3-F. 5’-GGGAGTGATGGCCCCTGCAAAATT-3’. JEV-ED3-R. 5’-TCCAATGGAGCCAAAGTCCCAGGC-3’. IRF-3-F. 5’-CTGGCTAGAGCATGGAAACC-3’. IRF-3-R. 5’-AGCAGCTAACCGCAACACTT-3’. IL-6-F. 5’-GATGGATGCTTCCAATCTGGAT-3’. IL-6-R. 5’-AGTTCTCCATAGAGAACAACATA-3’. PKR-F. 5’-CAACCAGCGGTTGACTTTTT-3’. PKR-R. 5’-ATCCAGGAAGGCAAACTGAA-3’. OAS-F. 5’-GATGTGGTTAGGTTTATAGCTG-3’. OAS-R. 5’-TTGGGGGTTAGGTTTCTGCCTTT-3’. GAPDH-F. 5’-AGCCACATCGCTCAGACAC-3’. GAPDH-R. 5’-GCCCCAATACGACCAAATCC-3’. 2.2.6 呈色劑. ABTS (2,2’-azino-di-(3-ethyl-benzthiazoline-6-sulfonate),and hydrogen peroxide BCIP/NBT Lique Substrate System (sigma) 2.2.7 實驗試劑與緩衝溶液. 表 1-1~1-2. . 22.
(40) . 第三節 實驗方法. 2.3.1 DNA 轉染 (DNA transfection). 將適量細胞分至 6 well plate 待隔天貼附後,利用 Arrest In(AI) transfection kit 進行轉染。將 3.0μg/well 的 DNA 以及 15μl/well 的 Arrest In transfection kit 各自以不含胎牛血清之培養液 0.5ml/well 稀釋後,再使兩 者在室溫下混合均勻靜置十五分鐘,已便 DNA/AI complex 形成。移除 欲轉染 6 well plate 細胞之培養液,以一倍 PBS 清洗,加入 DNA/AI complex solution,在 37℃、5% CO2 的環境下培養 4 小時,最後更換含 有胎牛血清之培養液持續培養 48 小時。. 2.3.2 細胞蛋白萃取 (Cell extraction). 依據實驗所需條件及時間點,將細胞培養液移除,加入適量一倍 PBS 清洗後,依細胞量加入 Radio-immunoprecipitation assay (RIPA) buffer 並放置在 4℃、5 分鐘作用,收至 1.5 ml 離心管離心 12000rpm、4℃、 30 分鐘,收集其上清液後,利用超音波細胞破碎機(Sonicator)震盪 2 分 鐘,將細胞蛋白保存在-20℃。. 2.3.3 蛋白質濃度測定 (Bradford method). . 23.
(41) . 收下來的細胞蛋白利用 Bio-Rad protein assay 染劑測試,以不同濃 度的胎牛血清製作標準曲線,由 1mg/ml BSA stock 分別配成 0、0.2、0.4、 0.8。1.0 mg/ml 各 10μl,再加入 990μl 染劑,利用分光光度計測量 OD595nm 吸光值並算出線性公式。最後再取蛋白質樣品 10μl 加 990μl 染劑並分析 蛋白質濃度。. 2.3.4 蛋白質電泳分析 (SDS-PAGE). 首先配置 0.75mm 厚度的 acrylamide gel:上層 stacking gel 含 4%的 acylamide,而下層膠則依蛋白質分子大小決定 acrylamide 含量。配置好 的膠放入 Bio-Rad 電泳槽中,並注入電泳緩衝溶液。將收下來的細胞蛋 白質以同體積加入 2X protein loading dye,利用乾浴器 110℃、7 分鐘變 性後放置冰上 5 分鐘,最後以轉速 12000rpm、3 分鐘離心。將處理好的 細胞蛋白以及標準標示分子量的 Multimaker 注入電泳槽的膠孔內,以 80Volts、50mA,30 分鐘之後待蛋白集中在上層膠下緣後,再以 110V 分離蛋白質。. 2.3.5 蛋白質轉漬 (Transfer). 本實驗使用 Bio-Rad Semi-Dry transfer cell 進行電泳轉漬。先將電泳 膠移除上層膠部分,再小心地將膠拆下。準備 transfer buffer,把. . 24.
(42) . Nitrocellulose membrane、3M 濾紙和電泳膠浸泡在 transfer buffer 內,接 著把轉漬機的正極板以 transfer buffer 潤濕,依序放上 3M 濾紙、 Nitrocellulose membrane、電泳膠、3M 濾紙,並仔細地移除之間的氣泡。 以 15V、1 小時進行轉漬。. 2.3.6 西方墨點法 (Western bloting). 電泳膠轉漬到 membrane 上之後,將 membrane 浸泡在以 1X TBST 配置 的 5%脫脂奶粉,4℃均勻搖晃 1 小時後,用 1X TBST 清洗 membrane 7 分鐘 4 次,再加入一級抗體(以 1X TBST 稀釋,稀釋倍數依抗體說明書 建議),於 4℃搖晃至隔天。翌日將 membrane 以 1X TBST 清洗過後,依 實驗所需加入二級抗體於室溫均勻搖晃 2 小時,再以 1X TBST 清洗 7 分鐘 5 次。取出 membrane 加入 NBT/TCIP 呈色劑呈色,待蛋白呈色之 後加入 ddH20 中止反應並晾乾;另外也可利用 ECL 呈色劑(Reagent 1 與 Reagent 2 1:1 混合)均勻分布在 membrane 上,反應 3 分鐘後,放入壓片 夾中,以 X 光片進行壓片。. 2.3.7 流式細胞儀 (Flow cytometry). 本實驗是利用 Annexin V 對於磷脂類(如 Phosphatidylserine,PS)有 高度親和性去偵測細胞凋亡時 PS 從細胞膜內翻轉至膜外,另外利用. . 25.
(43) . propidium iodide 去排除細胞壞死所造成的 PS 轉移,以得到同時辨識細 胞壞死與細胞凋亡的實驗目的。將 TE671-pCR3.1 以及 TE671-pCR3.1-NS5 cells 以 2×105/well 細胞量下至 6 well plate,區分實 驗組與對照組。待隔天細胞貼附,實驗組加入 IFN-beta 1000U/ml 48 小 時後,將細胞以 trypsin 收下,並利用 1X PBS 清洗兩次,再用 1X Binding buffer 回溶製成 1×106/ml 懸浮液,各取 100μl 細胞液至 Falcon 試管,加 入適量螢光標記 Annexin V FITC 以及 propidium iodide(PI)核酸染料混勻 後,在室溫下避光 15 分鐘。於各試管內加入 1X Binding buffer 400μl, 並在一個小時內上機完畢。. 2.3.8 冷光測試啟動子活性(Luciferase assay). 將 TE671-pCR3.1 以及 TE671-pCR3.1-NS5 cells 分盤至 6 well plate, 待細胞貼附隔天,轉染各種不同帶有 luciferase 的報導基因質體,例如: pISRE-Luc、pNFκB-Luc 等,並依 9:1 比例轉染 luciferase 質體及 Renilla luciferase 質體,待 48 小時後質體表現,將細胞分至 24 well plate,細胞 貼附後依實驗條件不同加藥 4 小時,吸掉培養液加入 100μl lysis buffer, 將細胞收至 1.5ml 離心管離心 12000rpm、10 分鐘。離心完取細胞上清 液測定 luciferase 及 Renilla luciferase 的活性。測定時取 20μl 上清液放 至 96 孔白盤中,加入 Luciferase assay substrate 100μl 以冷光分析儀測定. . 26.
(44) . Luciferase 活性,再加入 Stop&Glo® reagent 100μl 以冷光分析儀測定並 記錄數值。Promoter 活性是以 Luciferase 及 Renilla luciferase 的比值表 示。. 2.3.9 二維電泳蛋白質前處理. 蛋白質樣本前處理可使樣品鹽分降低以利二維電泳圖譜的分析 。細 胞定量後,加入 IFN-ß 1000U/ml 處理 48小時,以1x PBS洗2次去除培養 液,加入500μl RIPA buffer 冰上作用5min,用刮子將細胞刮下來,將液 體吸出加至 1.5ml 離心管,4℃ 離心12000rpm 30分鐘,取出上清液以 0.45μM filter 過濾,加入 4 倍體積冰acetone,置於 -80℃ 8小時或 overnight,4℃ 12000rpm 離心30分鐘,完全去除上清液,加入100μl buffer A 回溶蛋白質,定量蛋白質。. 2.3.10 蛋白質二維電泳(Two-dimensional electrophoresis). 二維電泳技術是以:第一維的等電點電泳(isoelectric focusing),依 等電點 (isoelectric points,pI) 分開蛋白質,利用蛋白質等電點的差異, 在 pH 梯度 (pH gradeint)環境存在下,於電場的驅動力之下,蛋白質會 泳動至淨電荷為 0 的 pH 值 下;第二維的 SDS-聚炳烯膠 (SDS -polyacrylamide gel electrophoresis,SDS-PAGE) 是依分子量大小分開蛋. . 27.
(45) . 白質。. 2.3.11 蛋白質等電點聚焦電泳法 (Isoelectric focusing, IEF). 所使用的 IEF 電泳系統為 IPGphor Isoelectric Focusing System (Bio -Rad)。處理過的樣本取 300 μg 加入 Buffer A (containing 7 M urea ,2% CHAPS, 2 mM DTT,0.5% IPG buffer,0.1% bromophenol blue) 使總體積為 350μl,以 pipette 充分混合後,吸入 Immobiline DryStrip Reswelling Tray 中,用鑷子將 DryStrip 膠上的保護膜撕去,膠面朝下 慢慢放入膠條,在膠條上加 ml 礦物油(mineral oil)進行 rehydration,原 本乾燥的膠條在 rehydration 時會將蛋白質吸入膠條的孔洞中,而加入 3 ml 礦物油(mineral oil)可減少反應過程中水份蒸發及尿素結晶,最後將 整個載體放入 IEF 平台上進行電泳,IEF 條件為在 20℃rehydration 16 小時, 200V 1 小時,500V 1 小時,1000V 1 小時,5000V 2 小時,8000V 8 小時。. 2.3.12 SDS 聚丙烯膠電泳 (SDS-polyacrylamide gel electrophoresis). 第一維電泳完成後,將 IEF 機器電源關上。以夾子將膠條取出,電 泳膠條先在 20 ml DTT 平衡緩衝液(6M Urea,30% glycerol, 2% SDS, 0.2g DTT)室溫搖晃作用 20 分鐘,以調整膠條的環境至 SDS-PAGE 電. . 28.
(46) . 泳的狀態,倒除 DTT 平衡緩衝液後,再以 20 ml IAA 平衡緩衝液(6M Urea,30% glycerol, 2% SDS, 0.4g iodoacetamide ) 室溫搖晃作用 20 分 鐘,倒除 IAA 平衡緩衝液後,電泳膠條靠右側橫放在先前已鑄好的 12% Tris- glycine SDS polyacrylamide gel上(Protean®II xi Cell , Bio-Rad),左 側放入滴上 5μl Marker 的濾紙,上層以 Agarose sealing solution 封滿鑄 膠玻璃,去除多餘之氣泡,室溫靜置 10 分鐘待上層 Agarose 凝固,放 入蛋白質垂直電泳系統( PROTREAN II xi, Bio -Rad,具水流冷卻管可增 加蛋白質再現度),倒入 SDS electrophoresis buffer 蓋上蓋子,設定電泳 條件,開啟開關進行電泳,過程大約 15 小時。. 2.3.13 銀染 (Sliver stain). 將 SDS-PAGE 膠片放入裝有ddH2O的水盆搖晃清洗2次,每次10分 鐘,倒除ddH2O之後,將膠片浸入,加入Fixation solution中固定2小時, 移除 Fixation solution,以ddH2O搖晃清洗兩次,每次10分鐘,加入 sensitizing solution (5 % Sodium thiosulphate solution, 0.1% Sodium acetate solution,25 % Glutardialdehyde solution) 作用30 分鐘,倒掉 sensitizing solution 再以ddH2O沖洗2次,每次5 分鐘。加入Silver solution (2.5 % AgNO3 solution,37 % Formaldehyde. solution)進行 20 分鐘的銀染作用,再以 ddH2O 沖洗 2 次,每次 5 分鐘,. . 29.
(47) . 加入 Developing solution,避光呈色 1~2 分鐘,加入 37 % Formaldehyde solution,浸泡至膠片上的蛋白質點呈現清晰且完整出現為止,倒掉 37 % Formaldehyde solution 加入 stop solution (0.02% EDTA solution) 終止 反應 10 分鐘,最後利用 ddH2O 沖洗 3 次,每次 5 分鐘,銀染後的膠 片使用高解析度的掃描器(GS-800 Calibrated Imaging Densitometer, Bio-Rad)掃瞄,掃瞄後將電泳膠封片,放 4℃冰存。. 2.3.14 軟體比對. 使用的軟體為 BIO-RAD PDQUEST-7.0.0 軟體,可自動進行不同膠 片的蛋白質圖譜比對以及蛋白質點的定量分析。. 2.3.15 膠內蛋白質水解. 將先前實驗中所得到的二維電泳膠數位化影像,使用 BIO-RAD PDQUEST -7.0.0 的軟體來進行不同膠片的蛋白質圖譜比對,將具有表現 差異性的蛋白質點利用被剪刀剪斷,尖端之孔動直徑大小為 2-3mm 的 200μl pipette tip 從膠片上挖出放入 1.5 ml 微量離心管中,以 100μl wash buffer (25mM aminonim bicarbonate in 50%acetone nitrite)震盪清洗 2 次,每次 15 分鐘 ,去除 wash buffer,加入 100μl silver stain solution(10 mg potassium ferricyanide、15mg sodium thiosulfate in 1ml Q water)進行. . 30.
(48) . 脫色反應(destain),直至膠片呈現透明無色,再以 100μl 25 mM NH4HCO3 震盪清洗 2 次,每次 10 分鐘,加入 100μl 100% acetone nitrite,室溫靜置 10 分鐘使膠片脫水乾躁,去除 100% acetone nitrite, 待其完全乾燥後,加入 3μl typsin(1μg/ml)4℃反應 1 小時,加入 25mM aminonim bicarbonate,置於 37℃下反應 12-16 小時,再加入 100 μl 10 % formic acid 萃取 peptides,可將處理好之樣品儲存於-20 ℃下保存或直接 進行串聯式質譜儀鑑定。. 2.3.16 病毒增幅 (virus amplyfication). 日本腦炎病毒 T1P1 株(長庚大學陳維鈞教授提供)是利用貼附性 BHK-21 細胞當作病毒的放大細胞。當 BHK-21 細胞長滿單層時,移去 舊培養液加入新培養液 10ml。以 M.O.I=10(病毒顆粒/細胞數)比例, 感染 BHK-21 細胞在 37℃恆溫培養箱以 T-75 (75cm2 cell culture flask)培 養,培養液為含有 2﹪胎牛血清的 MEM 培養液。病毒的收取在感染後 2-3 天,觀察細胞的細胞病理現象(Cytopathic Effect,CPE)。待細胞 CPE 達 80﹪以上,收集病毒培養液,以離心速度 3000rpm、離心時間 30 分鐘去除細胞碎屑,再以 0.22μm filter 過濾離心後的上清液以每管 0.5ml 分裝並儲存於-80℃冰箱。. 2.3.17 核醣核酸萃取 (RNA extraction) . 31.
(49) . i.. 病毒核醣核酸. 病毒感染細胞之後,依時間點收取上清液,利用 QIAamp Viral RNA Mini Kits (QIAGEN) 所提供之步驟去純化病毒核醣核酸。其中以含有 carrier RNA 的 AVL buffer 去萃取,純化好的核醣核酸保存在-80℃。. ii.. 動物細胞核醣核酸. 依實驗條件收下細胞,以 1 倍 PBS 清洗 1~2 次,離心 2000rpm、5 分鐘,去除上清之後剩餘的細胞沉澱物利用 PureLinkTM Micro-to-Midi Total RNA Purification System (Invitrogen)試劑去純化動物細胞之核醣核 酸。萃取出來的核醣核酸保存在-80℃。. 2.3.18 反轉錄聚合酶連鎖反應 (Reverse transcription PCR). 將萃取好的病毒或動物細胞核醣核酸,依照不同物種去選擇合適的 reverse primer,並且透過聚合酶連鎖反應的方式,以反轉錄酶的活性將 RNA 反轉錄成 cDNA。. 2.3.19 即時定量聚合酶連鎖反應 (Real-time PCR). 將反轉錄好的 cDNA 在測過核酸濃度之後,以 cDNA 當做模板,設 計好想要偵測的正、反向引子,利用 Smart Quant Green Master Mix 試劑 . 32.
(50) . 嵌入雙股 DNA 之特性,偵測 mRNA 層級的表現量。PCR 的反應條件為: 第一階段 95℃,15 分鐘;第二階段 95℃,15 秒鐘;第三階段 60℃,1 分鐘,反應進行 40 個循環,然後利用 ABI Prism 7000 SDS software 評 估所得之數據資料。本實驗計算方式利用 Ct 值與△△Ct 值(Cycle threshold value)呈現(△△Ct=(Ct. treated-Ct. GAPDH)-(Ct. untreated-Ct. GAPDH)),數值越高代表細胞內表現量越低。. 2.3.20 病毒斑點試驗 (plaque assay) 先將 BHK-21 cells(幼小倉鼠腎臟纖維母細胞 BHK-21; baby hamster kidney cell)培養於含 10%FBS 的 MEM 培養基的 6 格培養盤 (6-well plate) ,再加入病毒液每個 well 加入 200μL(二重複) ,在 37ºC, 5% CO2 培養箱,每格 15 分鐘輕拍 6 格培養盤,使病毒液均勻分散。 一小時候加入覆蓋液含有 1.1%甲基纖維素(methylcellulose)的 MEM 每格 2mL 至於培養箱,二天之後吸除覆蓋液,加入奈酚藍黑染色劑染色並計 數,依稀釋倍數判讀病毒價以 PFU/mL ( plaque forming unit/mL)表示。. . 33.
(51) . 第三章. 3.1. 研究結果. 日本腦炎 NS5 蛋白對干擾素訊號傳遞之影響. 3.1.1. 建立 NS5 蛋白表現之 TE671 細胞. 首先將 NS5 蛋白表現在 PCR3.1 質體(感謝中央研究院 林宜玲老師 提供)裡,再利用 PCR3.1 與 PCR3.1-NS5 兩種質體轉染至 TE671 細胞中, 由於質體上帶有 neomycin resistance 基因,我們利用 G418 加入細胞培養 液中做篩選,建立細胞持續穩定表現空載體對照細胞及 NS5 蛋白表現細 胞。將細胞收下經過蛋白處理之後,利用西方墨點法 NBT 呈色之方式, 於 103 kDa 的位置發現 NS5 蛋白之表現(圖一)。. 3.1.2. 以 IFN-β 測試 NS5 對干擾素之抗性. 將載體送入細胞之後,利用穩定表現空載體對照細胞及 NS5 蛋白表 現細胞培養至六孔盤中,於培養液加入 1000 U/ml IFN-β 處理,經過 0、 24、48 小時於顯微鏡下觀察細胞,發現在 48 小時之後,TE671 PCR3.1 細胞有大量死亡的現象,而有 NS5 蛋白表現之細胞大部分仍存活(圖二)。. 3.1.3. NS5 蛋白幫助細胞對抗干擾素誘導之細胞凋亡. 由圖二之結果發現有 NS5 蛋白表現之細胞加入干擾素處理後細胞 . 34.
(52) . 存活率較高,因此我們利用空載體對照細胞及 NS5 蛋白表現細胞培養至 6 孔盤,加入 1000 U/ml IFN-β,48 小時後,進行 Annexin V FITC 與 PI 雙染,利用 Flow cytometry 分析螢光反應,發現 TE671 PCR3.1 的細胞 在早期與晚期細胞凋亡的情況到達 70%;而有 NS5 蛋白表現之細胞, 凋亡情況只有 10%以下(圖三)。接著利用西方墨點法去觀察 Caspase-9 的表現,發現空載體對照細胞及 NS5 蛋白表現細胞對照之後,空載體對 照細胞有較多的活化型 Caspase-9 的表現(圖四)。此結果表示有 NS5 蛋 白存在的細胞或許具有對抗細胞凋亡的功能。. 3.1.4. 日本腦炎 NS5 抑制 ISRE 啟動子之活性. 由於文獻指出日本腦炎 NS5 蛋白能影響干擾素作用,因此利用穩定 表現空載體對照細胞及 NS5 蛋白表現細胞培養至 6 well plate,將 pISRE-Luc 與 pRunilla-Luc 的冷光報導基因以 9:1 的比例轉染進細胞中, 待 48 小時培養之後,於培養液中加入 3000 U/ml IFN-β,4 小時後,利 用冷光儀所得的數值以 pISRE-Luc/pRunilla-Luc 呈現,發現有 NS5 蛋白 表現之細胞其 ISRE 的活性與 mock 細胞相比降低了 90%(圖五)。由此證 明,NS5 蛋白的表現確實會影響干擾素下游的作用。. 3.1.5. . 日本腦炎 NS5 促進 NF-κB 啟動子之活性. 35.
(53) . 利用穩定表現空載體對照細胞及 NS5 蛋白表現細胞培養至 6 well plate,將 pNF-κB-Luc 與 pRunilla-Luc 的冷光報導基因以 9:1 的比例轉染 進細胞中,待 48 小時培養之後,於培養液中加入 3000 U/ml IFN-β,4 小時後,利用冷光儀所得的數值以 pNF-κB-Luc/pRunilla-Luc 呈現,結果 發現有 NS5 蛋白表現之細胞其 NF-κB 的活性比起 PCR3.1 細胞活性高出 70%(圖六)。而 NF-κB 的下游基因表現有能增進細胞增生與抗細胞凋亡 的功能,因此由結果可知 NS5 蛋白的表現可以幫助細胞對抗細胞凋亡。. 3.1.6. 日本腦炎 NS5 蛋白對細胞激素與干擾素下游基因表現之影響. 進一步將空載體對照細胞及 NS5 蛋白表現細胞培養在 25 T 培養瓶 中,於培養液中加入 1000 U/ml IFN-β,8 小時後,將細胞收下並萃取細 胞 RNA,並反轉錄成 cDNA 後,利用 Real time PCR 分析後以△△Ct 值(Cycle threshold value)呈現(△△Ct=(Ct. treated-Ct. GAPDH)-(Ct. untreated-Ct. GAPDH)),數值越高代表細胞內表現量越低。我們利用 IL-6、IRF-3、PKR 與 OAS 四組設計好的引子去分析,發現在 NS5 表現 的細胞中,除了 IRF-3 沒有太大的差異之外,IL-6、PKR 與 OAS 表現 量比起 PCR3.1 之細胞有下降的趨勢(圖七),由結果可知 NS5 蛋白的表 現會影響細胞激素 IL-6 與 IFN-β 下游所表現的抗病毒蛋白。. . 36.
(54) . 3.2. 二維電泳圖譜分析干擾素對 NS5 蛋白表現細胞之影響. 3.2.1. 二維電泳圖譜分析. 實驗利用蛋白質體學之方式分析,將處理 48 小時 IFN-β 1000 U/ml 的空載體對照細胞及 NS5 蛋白表現細胞,進行 pH 4-7 的 18-cm 二維電 泳分析。對於 TE671 細胞的二維電泳圖譜,我們進行 3 次電泳實驗,以 降低再現性不佳的誤差。(圖八~圖十一)為 3 次二維電泳實驗之結果。 在使用 300 μg/ml 蛋白質量下,48 小時的 TE671 細胞之二維電泳圖譜, 兩種狀況之蛋白質圖譜均清晰且均勻的分散開來,蛋白質點解析度也良 好。. 3.2.2. 受 IFN-β 影響而表現差異的蛋白質點. 對經 IFN-β 處理與未經處理之空載體對照細胞及 NS5 蛋白表現細胞 二維電泳圖譜,經 PDQUEST 軟體比對出在每一對中均會出現的 1.5 倍以上及 0.5 倍以下表現差異的蛋白質點。我們發現在 NS5 蛋白表現 細胞加入 IFN-β 表現量上升的蛋白點有:spot 5、14、24;而表現量下 降的蛋白點有:spot 1、2、9、12、18、25(表 2-1)。. 3.2.3. . 表現差異蛋白質點身份之確認. 37.
(55) . 利用二維電泳,取得經 IFN-β 處理的空載體對照細胞及 NS5 蛋白 表現細胞,和未經處理的空載體對照細胞及 NS5 蛋白表現細胞的二維電 泳圖譜,我們利用 PDQUEST 軟體比對此 4 片的二維電泳圖譜,從電 泳膠片中挖出有差異的蛋白質點,利用 trypsin 進行膠內水解(in-gel digestion),經 MODI-TOF/MS 質譜分析與 NCBI、MASCOT 及 SWISSPROT database 比對後,鑑定出蛋白質的資料(表 2-1)。我們發現了有 29 個差異點的蛋白,分別為 Alpha-enolase、Inosine- 5'-monophosphate dehydrogenase 2、D-3-phosphoglycerate dehydrogenase、Heterogeneous nuclear ribonucleoprotein H3、60 kDa heat shock protein, mitochondrial precursor、Heterogeneous nuclear ribonucleoprotein D0、Heat shock protein beta-1、ATP synthase subunit beta, mitochondrial precursor、Heterogeneous nuclear ribonucleoprotein K、Protein DJ-1、Cofilin-1、T-complex protein 1 subunit beta、Phosphoglycerate kinase 1、Peroxiredoxin-1、Heterogeneous nuclear. ribonucleoprotein L、Superoxide dismutase [Mn], mitochondrial. precursor、Dermcidin precursor、Stress-induced-phosphoprotein 1、Fumarate hydratase, mitochondrial precursor、Thioredoxin、Elongation factor 1-beta、 Prohibitin、Fascin、Chain A, Cyclophilin A Complexed、Calreticulin precursor、EDAR-associated death domain、Triosephosphate isomerase 1、 CDK5 regulatory subunit、Cyclin-I。. . 38.
(56) . 由鑑定出來的蛋白,我們注意到 spot 24 的 Cyclophilin A,它在四張 二維電泳圖相比較之下,於 NS5 蛋白表現的細胞中有較高的表現量(圖 十二)。. 3.3. 針對 Cyclophilin A 做為治療標的之測試. 3.3.1. 確認干擾素對 NS5 蛋白表現細胞中 Cyclophilin A 之影響. 基於蛋白質體學之分析結果,進一步確認 Cyclophilin A 於 NS5 蛋 白表現之細胞的影響。將空載體對照細胞及 NS5 蛋白表現細胞於培養液 中加入 0、250、500、1000 U/ml IFN-β,經過 24、48 小時之後,把細胞 收下並處理蛋白,利用西方墨點法以及壓 X 光片呈色方式呈現。由結果 可知,空載體對照細胞及 NS5 蛋白表現細胞比較之後,有 NS5 蛋白表 現細胞之 Cyclophilin A 的表現量有上升的現象(圖十三),與二維電泳圖 譜分析比對之後的結果吻合。之後的實驗我們將針對這個點做為一個治 療標的,觀察是否能影響日本腦炎病毒的複製。. 3.3.2. Cyclosporin A 抑制 ISRE 啟動子活性. 由於有研究指出 Cyclosporin A 可抑制 Cyclophilin A 的活性,進而 影響病毒複製,因此我們選用 Cyclosporin A 當作抑制劑,測試它抗病毒 . 39.
(57) . 之能力。. 利用穩定表現空載體對照細胞及 NS5 蛋白表現細胞培養至 6 孔 盤,將 pISRE-Luc 與 pRunilla-Luc 的冷光報導基因以 9:1 的比例轉染進 細胞中,待 48 小時培養之後,於培養液中分別加入四組濃度:0 U/ml IFN-β+0 ng/ml CsA、3000 U/ml IFN-β + 0 ng/ml CsA、0 U/ml IFN-β + 2000 ng/ml CsA、3000 U/ml IFN-β + 2000 ng/ml CsA,4 小時後,利用冷 光儀所得的數值以 pISRE-Luc/pRunilla-Luc 呈現。由結果發現,有 NS5 蛋白表現的細胞原本能抑制 IFN-β 下游啟動的 ISRE 啟動子之活性,但 是在加入 Cyclosporin A 之後,ISRE 啟動子又恢復其活性(圖十四)。可 知 Cyclosporin A 也許能針對日本腦炎病毒達到抗病毒的功效。. 3.3.3 Cyclosporin A 對於 Cyclophilin A 下游 ERK 分子之影響. 由於 Cyclophilin A 下游會影響 ERK 磷酸化,進而促進細胞增生與 分化,因此我們利用 0 U/ml IFN-β + 0 ng/ml CsA、3000 U/ml IFN-β + 0 ng/ml CsA、0 U/ml IFN-β + 2000 ng/ml CsA、3000 U/ml IFN-β + 2000 ng/ml CsA 處理空載體對照細胞及 NS5 蛋白表現細胞,1 小時之後收下 細胞蛋白,進行西方墨點法。由結果可知 NS5 蛋白表現的細胞在加入 Cyclosporin A 後,ERK1/2 磷酸化有被抑制的現象(圖十五)。. . 40.
(58) . 3.3.4. 測試 Cyclosporin A 抗病毒之能力. 為了確認 Cyclosporin A 是否有抑制日本腦炎病毒的能力,我們將 TE671 細胞培養至 25 T 培養瓶中,於培養液中加入四組藥物濃度:(1) 0 U/ml IFN-β+ 0 ng/ml CsA、(2) 500 U/ml IFN-β+0 ng/ml CsA、(3) 0 U/ml IFN-β+ 1000 ng/ml CsA 以及(4) 500 U/ml IFN-β+ 1000 ng/ml CsA,並且 同時加入 JEV T1P1 strain (m.o.i=0.5),進行下面實驗。首先於 24 小時之 後觀察細胞病變情形(Cytopathic effect)。由顯微鏡觀察發現,24 小時後 只有加病毒液的實驗組 CPE 情形明顯,而同時加入 IFN-β 與 Cyclosporin A 之實驗組細胞存活率為最高(圖十六)。利用上述實驗收取上清病毒液 後,萃取出病毒 RNA,並利用 Real time PCR 以及設計好之 JEV T1P1 ED3 引子去測試病毒的表現量,此結果以 Ct 值(Cycle thereshold value)呈現, 數值越高表示表現量越低。因此由結果可知,隨著一至四組濃度,病毒 表現量越低,所以 Cyclosporin A 確實能抑制 JEV T1P1 的感染力(圖十 七)。. 接著我們利用 TE671 細胞,並依照相同之實驗條件(1) 0 U/ml IFN-β+ 0 ng/ml CsA、(2) 500 U/ml IFN-β+0 ng/ml CsA、(3) 0 U/ml IFN-β+ 1000 ng/ml CsA 以及(4) 500 U/ml IFN-β+ 1000 ng/ml CsA,同時加入 JEV T1P1 (m.o.i=0.5)感染 24 小時之後,處理細胞染上 Annexin V FITC-PI,利用流. . 41.
(59) . 式細胞儀去分析發現在同時加入干擾素與 Cyclosporin A 的實驗組,其細 胞凋亡的現象有下降的情形(圖十八)。. 3.3.5 Cyclosporin A 於 BHK-21 細胞的抗病毒能力. 進一步確認 Cyclosporin A 在其他種類的細胞株是否也有相同抗病 毒之能力,我們使用 BHK-21 細胞進行病毒斑點試驗。分成以下藥物濃 度:(1) 500 U/ml IFN-β,(2) 500 ng/ml、1000ng/ml CsA,(3) 500 U/ml IFN-β + 500ng/ml CsA、500 U/ml IFN-β + 1000ng/ml CsA,同時感染病毒 100 PFU/ml,48 小時之後觀察病毒蝕斑情形。發現 Cyclosporin A 在濃度 1000 ng/ml 比起單獨加入 IFN-β 有較佳的抑制病毒效果,在同時配合加入干 擾素與 Cyclosporin A 則更能影響病毒蝕斑的現象(圖十九)。由圖二十可 得到單獨加入 cyclosporin A 或是同時加入干擾素時,確實有抑制病毒複 製的趨勢。. . 42.
(60) . 第四章. 討論. 蛋白質體學技術能在短時間內大規模分析特定樣品內的眾多蛋白 質身份,越來越多的研究人員開始利用此技術探討基礎及臨床醫學的問 題。凡是想要比較某兩種生物樣本之間(如發病組織與正常組織、腫瘤與 非腫瘤、致病菌與非致病菌)、或是同一生物樣本在不同生理條件下(如 處理同一藥物前後,或處理不同藥物)其整體蛋白質表現之狀況,皆可從 蛋白質體學角度來探討。. 在本篇研究中,我們探討了日本腦炎病毒非結構蛋白 NS5 在宿主細 胞中表現時,是否會抑制第一型干擾素的反應,以及在宿主細胞中,是 否有其他蛋白因子與 NS5 對抗干擾素的功能有關,並利用蛋白質體學之 方法進一步去找出一個有效的治療標的。. 4.1 日本腦炎病毒抑制干擾素之作用. 在免疫系統中,干擾素是宿主細胞對抗病毒一個強而有力的機制, 它透過細胞內 Jak 與 Stat 訊息分子傳遞而產生抗病毒的免疫反應 (Samuel 2001) [32]。而許多病毒都有藉由阻斷 Jak-Stat 訊息傳遞而對抗干 擾素作用的機制,例如 Simian virus 5 (Didcock, Young et al. 1999) [33]和 Mumps virus (Kubota, Yokosawa et al. 2001) [34]會降解 Stat-1 蛋白;而. . 43.
(61) . Human parainfluenza virus type 2 則會造成 Stat-2 水解(Parisien, Lau et al. 2001) [35]。在先前的文獻指出 (Lin, Liao et al. 2004) [36],日本腦炎病毒可 以阻斷細胞膜上第一型干擾素接受器的 Tyk2 磷酸激酶進行磷酸化的 現象,使下游的 STAT 無法磷酸化而抑制干擾素反應,在西尼羅病毒、 登革熱病毒、tickborne Langat virus 也會藉由阻斷 Jak1、Tyk2、Stat1 以 及 Stat2 去影響干擾素鎖誘導產生的 Jak-Stat 訊息路徑。接著研究指出, 黃病毒科的西尼羅病毒、黃熱病毒、登革熱病毒的非結構蛋白 NS4B 也 可以抑制干擾素訊息傳遞路徑 STAT-1 的磷酸化;而登革熱病毒也能透 過 NS2A 和 NS4A 去影響干擾素。後來發現 tickborne Langat virus 的非 結構蛋白 NS5 能單獨抑制 Stat-1 的磷酸化,之後研究人員也發現日本腦 炎病毒的 NS5 蛋白在真核細胞中會進行轉譯後修飾,且能被 Ser/Thr kinase 進行磷酸化,而在日本腦炎病毒感染宿主時扮演阻斷干擾素刺激 Jak-Stat 訊號活化 PTPs 的路線(Lin, Chang et al. 2006) [37]。而 C 型肝炎 病毒感染細胞時,NS5A 會環繞於核膜外圍,磷酸化的 NS5A 會與 NS5B 相互作用,調節 RNA 聚合酶之活性,其 NS5A 具有一段稱之 ISDR(IFN sensitivity- determining region)抗干擾素的胺基酸序列,此區域會與干擾 素的雙股 RNA 依賴型蛋白激酶 (double strand RNA- dependent protein kinase, PKR) 相互作用,並抑制其功能,使 C 型肝炎病毒可持續性的感 染細胞。在本篇研究中,我們首先將 TE671 細胞株轉染帶有 NS5 序列. . 44.
數據



相關文件
the prediction of protein secondary structure, multi-class protein fold recognition, and the prediction of human signal peptide cleavage sites.. By using similar data, we
replacement therapy」 ,請儘可能明確列出給予 外源性 FVIII 置換療法之標準 (criteria),包 括治療時機和用量。統計部分亦請說明此指 標將如何估計,針對 missing value 的插補方 法
本案件為乳癌標準化化學藥物治療與個人化化學治 療處方手術前化學治療療效比較之國內多中心研 究,於 2008 年 8 月 1 日由
In Pre-Qin and Han era, the theories of heaven mind and Tao mind had a different level from human mind: an individual can conduct the human mind by means of self-cultivation and
The novel coronavirus outbreak has drawn increased international attention as the virus quickly spreads across the world..
Southern African ancient genomes estimate modern human divergence to 350,000 to 260,000 years ago..
Immune Parameters Correlate with Protection, Gary Wong et al., Science..
PIV: parainfluenza virus, RSV: respiratory syncytial virus, MPV: metapneumovirus, Group A Strept: group A streptococcal disease.. Rhinovirus 鼻病毒