應執行安全監視之醫療器材品項
一、 本規定依醫療器材管理法第四十七條第一項及第三項規定訂定 之。
二、 應執行安全監視之醫療器材品項如下,監視期間自發證日起三 年:
(一) 塗藥血管支架(Drug-Eluting Stents, DES)。
(二) 第一個核准上市國為我國之第三等級醫療器材。
(三) 經陰道骨盆腔器官脫垂治療用手術網片(Surgical mesh for transvaginal pelvic organ prolapse repair,簡 稱經陰道手術修補網):本器材為由合成、非合成、或混 合合成與非合成的多孔隙植入物,用以加強骨盆底部之 軟組織強度。
三、 前點醫療器材執行安全監視之方式,依醫療器材安全監視管理 辦法第三條第一款之規定辦理。
四、 醫療器材許可證所有人執行醫療器材安全監視前,應訂定安全 監視計畫書,其應載明之項目、內容及格式,規定如下:
(一) 項目:依醫療器材安全監視管理辦法第五條第三項之規 定辦理。
(二) 內容及格式:如附件一至附件三。
五、 本規定生效前,第二點醫療器材已執行安全監視,而監視期尚
未屆滿者,應依醫療器材安全監視管理辦法之規定,完成後續
安全監視作業。
附件一
塗藥血管支架(Drug-Eluting Stents, DES)
(請以正體中文依格式填寫及詳述說明,不可自行刪減項目或僅寫「詳見附件」。
檢附之附件資料如非正體中文或英文者,應另附正體中文或英文譯本。)
一、醫療器材產品資料 (一) 許可證字號:
(二) 中文品名:
(三) 英文品名:
(四) 型號:
(五) 製造業者名稱:
(六) 製造業者所在國家:
(七) 許可證所有人:
二、安全監視期間
(第一期監視起始日不得遲於發證日,並以每半年為一期)全程監視期: 年 月 日~ 年 月 日
第一期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日 第二期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日 第三期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日 第四期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日 第五期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日 第六期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日
三、資料整理
(如國外資料統計時間與國內監視期間範圍不同,應另外說明)(一) 國內、外使用人數
監視期間
推估使用人數(或次數)
國內 國外
第一期 第二期 第三期 第四期 第五期 第六期 總人數
(二) 國內執行機構累積使用情形
醫事機構層級 販售數量 推估使用人數(或次數)
總數
*若不敷使用請自行增加欄位
(三) 國內、外不良事件件數
(非嚴重不良事件應包括顧客申訴)四、不良事件資料收集
(請將本期不良事件內容以條列式呈現)(一) 國內醫療器材嚴重不良事件 (二) 國內醫療器材非嚴重不良事件 (三) 國外醫療器材嚴重不良事件
(如有通報至國外主管機關之不良事件,請特別註明) (四) 國外醫療器材非嚴重不良事件
(五) 國內、外學術期刊文獻及學術研討會上發表之病例報告 五、國內使用 DES 個案整理
(DES 使用個案資料如附錄一,使用醫療機構如附錄二)
屬性 嚴重不良事件 非嚴重不良事件
國內 國外 國內 國外
第一期 第二期 第三期 第四期 第五期 第六期 總件數
附錄一:DES 使用者資料 (一) 病人代碼
(二) 醫事機構 (三) 手術醫師
(四) 植入日期: ___年___月___日 (五) 病人性別
(六) 病人年齡
(七) 監視項目及執行情形:
表格 A
監視項目 手術前 手術後
是/否 日期 是/否 日期 血管造影
心電圖
表格 B
抗血栓藥物 手術前 手術後
開始日 期
用法及 劑量
開始日 期
用法及 劑量
Aspirin
Ticlopidine Clopidogrel Dipyridamole
其他
(八) 手術後追蹤:
表格 C 追蹤情 形
定期追蹤:□ 有 □ 無 追蹤間隔時間:___週/月 追蹤期
間異常 發現
a)日期:
異常情形(包括併發症,請詳細描述):
b) 日期:
異常情形(包括併發症,請詳細描述):
c) 日期:
異常情形(包括併發症,請詳細描述):
註:本附錄為一式二份存於醫療機構及醫療器材商,每位使用病人
均需分別填寫。若欄位不足,請自行增加欄位。本附錄應保存
至監視期間屆滿後五年供備查。
附錄二:本次報告監視期間的 DES 使用情形統計表
DES 使用總支數 執行機構使用情形
醫事機構名稱 使用支數
註:本附錄為必繳交項目。若欄位不足,請自行增加欄位。
附件二
第一個核准上市國為我國之第三等級醫療器材
(請以正體中文依格式填寫及詳述說明,不可自行刪減項目或僅寫「詳見附件」。
檢附之附件資料如非正體中文或英文者,應另附正體中文或英文譯本。)
一、醫療器材產品資料 (一) 許可證字號:
(二) 中文品名:
(三) 英文品名:
(四) 型號:
(五) 製造業者名稱:
(六) 製造業者所在國家:
(七) 許可證所有人:
二、安全監視期間
(第一期監視起始日不得遲於發證日,並以每半年為一期)全程監視期: 年 月 日~ 年 月 日
第一期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日 第二期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日 第三期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日 第四期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日 第五期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日 第六期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日
三、資料整理
(如國外資料統計時間與國內監視期間範圍不同,應另外說明)(一) 國內、外使用人數
監視期間
推估使用人數(或次數)
國內 國外
第一期 第二期 第三期 第四期 第五期 第六期 總人數
(二) 國內執行機構累積使用情形
(如為租借請註明)醫事機構層級 販售數量 推估使用人數(或次數)
總數
*若不敷使用請自行增加欄位
(三) 國內、外不良事件件數
(非嚴重不良事件應包括顧客申訴)四、不良事件資料收集
(請將本期不良事件內容以條列式呈現)(一) 國內醫療器材嚴重不良事件 (二) 國內醫療器材非嚴重不良事件 (三) 國外醫療器材嚴重不良事件
(如有通報至國外主管機關之不良事件,請特別註明) (四) 國外醫療器材非嚴重不良事件
(五) 國內、外學術期刊文獻及學術研討會上發表之病例報告
屬性 嚴重不良事件 非嚴重不良事件
國內 國外 國內 國外
第一期 第二期 第三期 第四期 第五期 第六期 總件數
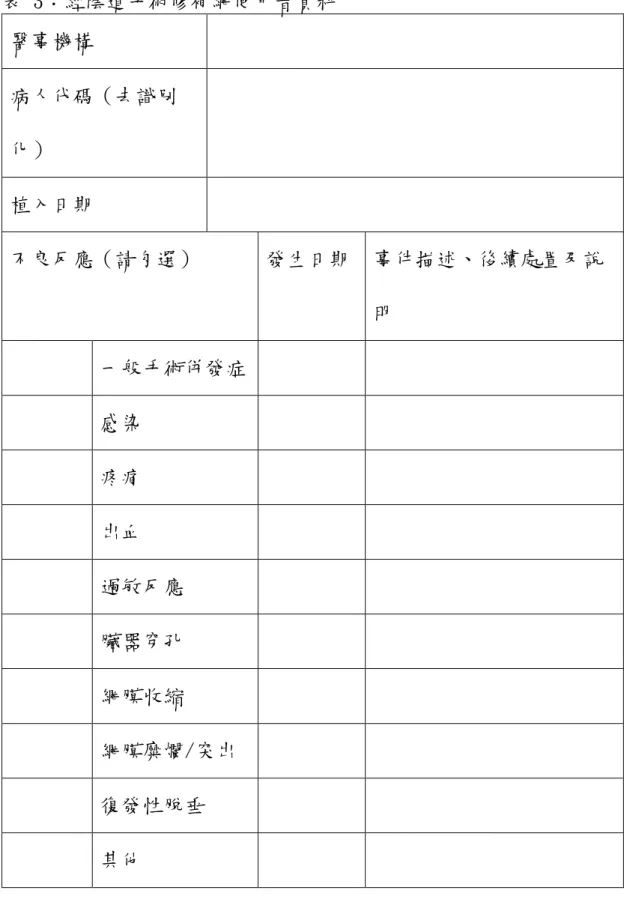
附件三
經陰道手術修補網
(請以正體中文依格式填寫及詳述說明,不可自行刪減項目或僅寫「詳見附件」。
檢附之附件資料如非正體中文或英文者,應另附正體中文或英文譯本。)
一、醫療器材產品資料 (一) 許可證字號:
(二) 中文品名:
(三) 英文品名:
(四) 型號:
(五) 製造業者名稱:
(六) 製造業者所在國家:
(七) 許可證所有人:
二、安全監視期間
(第一期監視起始日不得遲於發證日,並以每半年為一期)全程監視期: 年 月 日~ 年 月 日
第一期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日 第二期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日 第三期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日 第四期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日 第五期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日 第六期資料起訖: 年 月 日~ 年 月 日 繳交期限: 年 月 日
三、資料整理
(如國外資料統計時間與國內監視期間範圍不同,應另外說明)(一) 國內、外使用人數
監視期間
推估使用人數(或次數)
國內 國外
第一期 第二期 第三期 第四期 第五期 第六期 總人數
(二) 國內執行機構累積使用情形
醫事機構層級 販售數量 推估使用人數(或次數)
總數
*若不敷使用請自行增加欄位
(三) 國內、外不良事件
(非嚴重不良事件應包括顧客申訴)四、不良事件資料收集
(請將本期不良事件內容以條列式呈現)(一) 國內醫療器材嚴重不良事件 (二) 國內醫療器材非嚴重不良事件 (三) 國外醫療器材嚴重不良事件
(如有通報至國外主管機關之不良事件,請特別註明) (四) 國外醫療器材非嚴重不良事件
(五) 國內、外學術期刊文獻及學術研討會上發表之病例報告
屬性
嚴重不良事件 非嚴重不良事件
國內 國外 國內 國外
件數 比例 (件數 /使用 數量)
件數 比例 (件數 /使用 數量)
件數 比例 (件數 /使用 數量)
件數 比例 (件數 /使用 數量) 第一期
第二期 第三期 第四期 第五期 第六期 總件數