行政院國家科學委員會專題研究計畫 成果報告
探討 hepsin 與癌細胞轉移的相關性(3/3)
研究成果報告(完整版)
計 畫 類 別 : 個別型 計 畫 編 號 : NSC 95-2320-B-002-054- 執 行 期 間 : 95 年 08 月 01 日至 96 年 07 月 31 日 執 行 單 位 : 國立臺灣大學醫學院醫學檢驗暨生物技術學系 計 畫 主 持 人 : 林淑華 計畫參與人員: 碩士級-專任助理:蘇英卉 博士後研究:蘇剛毅 研究生:楊璧卉、林建宇 報 告 附 件 : 出席國際會議研究心得報告及發表論文 處 理 方 式 : 本計畫可公開查詢中 華 民 國 96 年 09 月 14 日
行政院國家科學委員會補助專題研究計畫
■ 成 果 報 告
□期中進度報告
探討 Hepsin 與癌細胞轉移地相關性
計畫類別:■ 個別型計畫 □ 整合型計畫
計畫編號:NSC 93 - 2314 - B - 002 - 076
執行期間: 93 年 8 月 1 日至 96 年 7 月 31 日
計畫主持人: 林 淑 華
共同主持人:
計畫參與人員:
成果報告類型(依經費核定清單規定繳交):□精簡報告 ■完整報告
本成果報告包括以下應繳交之附件:
□赴國外出差或研習心得報告一份
□赴大陸地區出差或研習心得報告一份
□出席國際學術會議心得報告及發表之論文各一份
□國際合作研究計畫國外研究報告書一份
處理方式:除產學合作研究計畫、提升產業技術及人才培育研究計畫、
列管計畫及下列情形者外,得立即公開查詢
□涉及專利或其他智慧財產權,□一年■二年後可公開查詢
執行單位: 國立台灣大學醫學院醫事技術學系
中 華 民 國 96 年 7 月 31 日
壹、中文摘要 Hepsin 屬第二型穿膜絲胺酸蛋白酶,以肝臟細胞的表現量最多。過去實驗結果 推論,hepsin 可能與肝細胞發育、受精卵著床、血液凝固機轉及細胞癌化、轉移有 關,但其分子機制尚未明確。已知hepsin 基因剔除的小鼠並無異常,且生長及交配、 繁殖也正常,故 hepsin 的研究尚無法描繪出其特異的重要生理功能及機轉。此外 hepsin 在多種癌細胞株中大量表現,尤以前列腺癌最為明顯。除可成為癌細胞的生 物標記外,許多證據顯示hepsin 可能參與癌細胞的生長與轉移,但調控方式仍不清 楚。 為探討hepsin 與癌細胞生長、轉移的相關性和機制,本計畫利用體外細胞培養 系統及hepsin剔除小鼠動物模型等兩部份實驗進行。根據第一年實驗,利用穩定表 達hepsin腫瘤細胞株進行體外細胞生長及活體裸鼠腫瘤形成實驗後,觀察到hepsin的 表現能降低腫瘤細胞生長速率及在裸鼠形成腫瘤之大小、速度。本計劃以基因遺傳 工程方法建構N端區域具偵測標記Flag及Teteracysteine (TC)之四種人類hepsin融合 蛋白;包括野生型WT、蛋白活化區突變型R162A、酵素功能區突變型S353Y及雙點 突變型R162AS353Y融合蛋白。Hepsin融合蛋白可利用抗flag單株抗體之免疫螢光染 色及FlAsH-EDT2染色偵測。經反轉錄聚合酶鏈反應確認人類癌細胞株HeLa及 Sk-Hep1 不表現hepsin後,將上述野生型及突變型hepsin基因轉入HeLa及Sk-Hep1, 經過G418 篩選後,並利用西方墨點及免疫沉澱法確定hepsin融合蛋白的表現。我們 成功取得了穩定表現野生型、活化區突變型、酵素功能區突變型、雙突變型hepsin 的癌細胞株,除了可以西方墨點法偵測其表現外,也證明了所表現出來的野生型 hepsin可以具有切割凝血第七因子的活性。在體外細胞生長實驗及活體裸鼠腫瘤形 成實驗中亦觀察到,表現hepsin之癌細胞生長速率降低,並且在裸鼠形成之腫瘤大 小、速度亦有明顯差異。此結果顯示hepsin可能具有未知活化機制影響表現,並可 能在癌細胞的生長上扮演重要的角色。 計畫第二年以SK-Hep1 肝癌細胞株,進行體外細胞生長實驗及癌細胞群落生成 實驗,亦觀察到類似結果。另一方面,為著手製備抗hepsin 抗體,藉大腸桿菌表現 系統表現人類 hepsin 基因重組蛋白及小鼠 hepsin 基因重組蛋白,並開始利用人類 hepsin 重組蛋白免疫小鼠。由於目前在大腸桿菌表現系統所表現的 hepsin 重組蛋白 形成包涵體,因此需經較繁複的純化方式,需先要確定這樣的方式得到的hepsin 基 因重組蛋白是否有活性。另外,也考慮利用 Pichia pastoris 酵母菌表現系統改進蛋 白表現量及修飾度,而製備人類hepsin 單株抗體的小鼠免疫工作則將進行 cell fusion 的步驟。 延續第二年成果,為證明hepsin 參與肝臟抑制腫瘤細胞轉移相關機制,第三年 度以腫瘤轉移小鼠動物模型實驗,發現自小鼠尾靜脈注射 B16F1 黑色素瘤細胞 21 天後進行解剖觀察,腫瘤聚落都集中於肺,而肝臟幾乎計數不到,但在hepsin 基因 剔除小鼠進行相同實驗時,雖然肺部腫瘤數與對照小鼠相近,在肝臟腫瘤數卻高出 四十倍以上。另外以不同注射方式(尾靜脈或脾臟注射)或不同腫瘤細胞(如肺癌細 胞株,Lewis Lung Carcinoma)進行腫瘤轉移小鼠實驗,均觀察到類似結果,相同結 果也反應在存活率實驗中。故推測hepsin 與抑制腫瘤細胞轉移至肝臟機制有關。
一氧化氮(NO)毒殺癌細胞,促使癌細胞自體凋亡,以抑制癌細胞轉移,本年度亦利 用電子順磁共振譜儀(EPR)分析,發現相較於野生型小鼠,hepsin 基因剔除小鼠在注 射黑色素瘤細胞後8 及 24 小時,無法測得肝臟被癌細胞引發產生的 NO,且藉自體 凋亡螢光染色標定腫瘤細胞後,計數各時間點肝臟不同區域入侵癌細胞的自體凋亡 數目,也發現 hepsin 基因剔除小鼠腫瘤細胞在竇間隙自體凋亡比例較低,故推測 hepsin 可能影響肝臟的 NO 生合成,以抑制腫瘤細胞轉移。
貳、前言
Hepsin 最早於 1988 年被報告,當時利用絲胺酸蛋白酶(serine protease)的高度保 留區之反譯寡核苷酸做為探針,篩選人類肝臟互補基因庫得到其互補基因。由於此 蛋白酶在肝臟大量表現,因此命名為hepsin (Leytus et al.,1988)。Hepsin 互補基因全 長約1.8kb,轉譯出具 417 個胺基酸、大小約 51kDa。由蛋白序列分析預測,hepsin 屬第二型穿膜絲胺酸蛋白酶;其N 端 1-17 個胺基酸位於細胞膜內,第 18-44 個胺基 酸穿插於細胞膜間,其餘373 個胺基酸包含酵素功能區位於細胞膜外。初合成 hepsin 為酶原態 (Zymogen),經過 Arg162-Ile163 切割水解後被活化,形成 N 端的非活化 區以及C 端的活化區,兩區以雙硫鍵連結 (Tsuji et al.,1991)。受活化的 hepsin 有可 能進一步自體活化,且此機制與hepsin 濃度呈正相關。然而,相關的活化、調控及 下游的作用受質目前仍不清楚 (Vu et al,1997)。另外,hepsin 蛋白的晶體結構已於 2003 年解出(Somoza et al., 2003),提供更多 hepsin 在細胞膜上立體空間結構、活化 反應等相關資訊。
小鼠及大鼠的hepsin 在序列的比對上和人類 hepsin 相似性高達 88% (Kawamura et al., 1999),三者最大的差異在於細胞膜內 N 端;小鼠 hepsin 另有經 mRNA 替代 交換接合(alternative splicing)的亞型,此產物多出 20 個胺基酸,真正生理功能尚 未知。人類hepsin 基因位於第 19 號染色體短臂的 11-13.2 區域(Kurach et al., 1994), 目前尚無未有任何遺傳疾病相關的報告與此區域相關(Kawamura et al., 1999)。
體內hepsin 除在肝臟大量表現外,以北方點墨法分析,在許多組織,如:腎臟、 胰臟、肺臟、前列腺、甲狀腺以及睪丸也有少量表現(Tisuji et al., 1991)。已知穿膜 絲胺酸蛋白酶參與許多生理玏能及生化反應,包括細胞生長分化、發炎反應、蛋白 分解、血液凝固、纖維蛋白溶解至癌細胞生長、轉移以及組織形態的維持等。相關 報告顯示,體外培養細胞株 HepG2 及 Alexander 時,培養液外加 hepsin 的抗體會 使細胞生長受抑制(Torres-Rosado et al., 1993);根據序列及結構的相似性, hepsin 也被推論可能直接或間接影響肝細胞的生長。另外在小鼠胚胎發育早期的二細胞時 期,就能測到hepsin mRNA 表現,至著床前的囊胚期達到高峰,故推論 Hepsin 可 能與胚胎著床相關 (Vu et al, 1997)。在體外試管實驗中,hepsin 能活化第七凝血因 子,故被推論可能參與血液凝固的起始機制(Kazama et al., 1995)。
儘管推測了上述多項生理特性及功能, hepsin 基因剔除小鼠並無重大缺陷,不 僅正常發育、繁殖,相關生化分析甚至肝臟再生能力、血液凝固方面都沒有任何異 常。唯一不同的是這些基因剔除小鼠骨骼中的鹼性磷酸酶 (alkaline phosphatase)較野 生型小鼠高兩倍 (Wu et al., 1998 ; Yu et al., 2000) ,所意謂生理意義還不得而知。生 物體內是否另有其他互補系統參與hepsin 彌補或代償作用,目前尚待研究。
2003 年,Somoza 等人 (Somoza et al., 2003)利用 Pichia pastoris 表現系統表現出 hepsin 的膜外區域蛋白,並解出解析度高達 1.75Å 的 hepsin 晶體結構,晶體結構分 析發現 hepsin 的膜外區域蛋白主要由兩個部分組成,其中較大一部分是絲胺酸蛋 白酶的高度保留區”酵素活化中心”所形成的絲胺酸蛋白酶區域,由 255 個胺基酸形 成,另外只具109 個胺基酸較小的 non-catalytic 區域藉由 DALI (Holm and Sander, 1994)軟體分析得知該區與 Mac-2 結合蛋白 (Mac-2 Binding Protein, M2BP) 的
scavenger receptor cysteine rich (SRCR)區域在結構上有高相似度,然而兩者序列相 似度卻很低。這兩個區域主要是由絲胺酸蛋白酶區域上的 Cys277 和 noncatalytic chain 的 Cys153 的雙硫鍵鍵結以及其他非共價鍵網連接。由電子雲分佈圖觀察得知 絲胺酸蛋白酶區域中由 His203、Asp257 以及 Ser353 所形成的 catalytic triad 中, Ser353 是主要和 hepsin 受質結合的區域,並且根據立體結構分析,Asp347 佔據了 hepsin 的主要受質區,因此形成一個 nucleophile 的區域,造成 hepsin 傾向和帶有 含正電的 Lys 或 Arg 受質結合。此結構特性,可提供更多可能和 hepsin 有作用之 分子其相關資訊,並進一步作為尋找 hepsin 在生物體內的探針,或作為 hepsin 的 抑制劑,應用於前列腺癌症治療。另外,Hepsin 由第 50-159 胺基酸形成的區域除 了主要和M2BP Scavenger receptor cysteine rich (SRCR)區域在結構上具有高度相似 性外,和其他過去定義中的SRCR 區域 (Resnick et al., 1994)序列相似度則非常低。
SRCR 區域最早由 Krieger 等人在 1994 年分析第一型 macrophage scavenger receptor 時發現一個大約 110 個胺基酸所形成具高度保留的 trimeric 穿膜蛋白。 Krieger 根據這一段區域中的 conserved cysteine 形態將 SRCR superfamily 定義為 A 和B 兩大群,其中 A 群主要是包含六個 cysteine,通常和其他功能性區域,例如: enzymatic (protease) domains 或 collagenous regions 的連接形成 multidomain mosaic proteins。另外 B 群大多是由 8 個 cysteine 形成,而這些 cysteine 在 SRCR 區域所表 現的位置也具有高度保留性。通常是由多個SRCR 區域經 tandem repeats 組成,目 前已知多種淋巴細胞表面蛋白如CD5、CD6 有 B 群 SRCR 參與 ectodomain 形成。 目前已知SRCR 區域主要和動脈硬化、附著以及宿主防禦相關 (Krieger et al., 1994 ; Freean et al., 1990),並且在很多免疫相關的蛋白及細胞表面上發現 (Resnick et al., 1994 ; Aruffo et al., 1997),SRCR 區域的功能主要和蛋白間的相互作用以及 ligand binding 相關,其詳細的作用機轉至今仍不清楚 (Hohenester et al., 1999)。Hepsin 的 noncatalytic chain 中 cysteine 所形成的雙硫鍵,其表現位置較接近 A 群的分佈,因 此Somoza 等人根據 hepsin 結構具有 SRCR 區域的特性進一步推測 hepsin 可能和一 些可溶性蛋白或細胞表面蛋白作用、蛋白之間的相互作用、水解功能等相關。由於 hepsin 酵素活化區與 SRCR 區域的結構看似並不影響 hepsin 蛋白質水解或與受質 的接和作用,因此透過 hepsin 結構的瞭解,可更進一步探討 hepsin 在生物體細胞 內所扮演的角色 (Somoza et al., 2003)。
另一方面,多種穿膜絲胺酸蛋白酶已被證實在腫瘤發展、轉移過程中扮演重要角 色 。 近 來 利 用 基 因 微 陣 列 晶 片 (cDNA microarrays) 、 組 織 微 陣 列 晶 片 (tissue microarrays)、定量性反轉錄聚合酶鏈反應(quantitative RT-PCR)以及細胞內雜交法 (in situ hybridization)等技術發現,hepsin 在前列腺癌細胞株及組織中均有高量表現 (Margee et al., 2001; Dhanasekaran et al., 2001),並且在前列腺癌以及良性前列腺肥 大組織 (Benign prostatic hyperplasia, BPH)中基因表現量有顯著的差異,由於目前 對於前列腺癌的主要檢測方法是以血清中的前列腺特異性抗原 (prostate specific antigen, PSA)作為腫瘤標誌,但此抗原在一些良性前列腺肥大組織中也有高量表 現,因此相對降低了前列腺癌檢測的準確性/特異性。相較於 PSA,hepsin 在前列
腺癌組織以及 BPH 中表現量的差異意味著提供更廣泛的檢測可行性。另外,
Srikantan 等人將帶有 hepsin 的質體轉染並大量表現到前列腺癌細胞株 : LNCaP、 DU145 以及 PC-3,經實驗發現,這些細胞的生長、侵蝕 (invasion) 能力明顯下降, 細胞增生 (proliferation) 也受到抑制,且絕大多數會表現 hepsin 的 PC-3 細胞中細 胞週期多停留於G2-M phase,走向細胞凋亡的細胞總數比例也上升,這些現象意
味著hepsin 可能藉由抑制細胞 G2 phase 並進一步調控細胞生長的情形 (Srikantan et al., 2002)。 藉由上述各種 hepsin 的生物功能分析,hepsin 可發展前列腺癌檢測、 預後以及治療的的分子標記。
實驗發現,hepsin 不論在前列腺癌細胞株(LnCAP、PC3)、或肝癌細胞 HepG2、 Alexander cells、卵巢癌細胞、乳癌細胞、神經細胞 PC12 均有高量表現(Margee et al., 2001; Tanimoto et al., 1997;Zacharski et al., 1992)。以基因微陣列晶片 (cDNA microarrays) 等技術分析臨床前列腺癌組織表現量及相關統計後,發現 hepsin 大量 表現,並與病人癒後緩解有關;故hepsin 不但可做為前列腺癌的生物標記,也可能 與腫瘤細胞癌化或轉移機制具高度相關(Dhanasekaran, S. M. et al.)。 在 2004 年 Klezovitch 實驗室以基因轉殖鼠模式證實,hepsin 會促進前列腺癌 進程與轉移(Klezovitch, O. et al.,2004)。但相反的,體外培養細胞實驗,觀察到過 度表現hepsin,會抑制癌細胞生長及菌落形成,並抑制癌細胞轉移能力(Welsh, J. B. et al., 2001; Srikantan, V. et al., 2002)。由於 hepsin 生理功能及作用分子仍不明,故是 否參與腫瘤細胞轉移過程及透過哪些相關機制調控,目前均無解答。 在2002 年,Gaietta等人(Gaietta et al., 2002)發表一種新的活體細胞標記方式,它 是利用可自由穿透細胞,並具有雙鉮 (As)的染劑FlAsH-EDT2與蛋白序列中的TC (-Cys-Cys-Xaa-Xaa-Cys-Cys-;Xaa為半胱胺酸以外的任意胺基酸)進行具有高親 和力以及特異性結合,並在結合以後才會被激發出綠色螢光的特性來進行活體細胞 標記。由於此標定法中染劑對細胞為低毒性且細胞也不需要事先固定,因此可使標 定動作對欲研究之重組蛋白的影響降到最低。在該篇文章中,作者還利用了另一種 會發出紅色螢光的雙鉮染劑ReAsH-EDT2進行標定;同樣地,ReAsH-EDT2 對於上 述序列中的四個半胱胺酸也呈高特異性親和力的結合。 因此,利用這兩種染劑螢 光顏色之不同,在不同時間點以不同染劑與細胞作用,進行細胞pulse-labeling活體 標記,藉由螢光顏色的異同可區分出不同時間合成重組蛋白;此外,FlAsH-EDT2和 ReAsH- EDT2染劑也可以在電子顯微鏡下觀察,做為細胞標記物。換言之,除了利 用不同顏色的兩種染劑進行細胞活體標定,也可直接用電顯觀察重組蛋白 (Griffin et al., 1998 ; Stroffekova et al., 2001)。
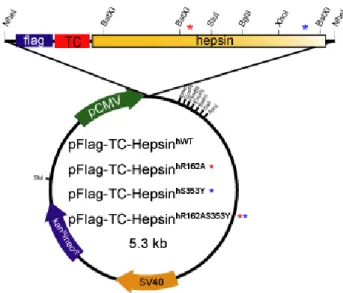
由以上回顧過去hepsin 的研究,雖然 hepsin 蛋白的晶體結構已經解出,也知 道hepsin 可切割凝血第七因子,然而由微陣列結果顯示 hepsin 在前列腺癌組織中 有大量表現,但在前列腺細胞株以及肝癌細胞(HepG2)大量表現 hepsin 時卻抑制細 胞生長(Tsuji et al., 1991,Srikantan et al., 2002),顯示 hepsin 的生理功能及在細胞 癌化後的角色仍有待釐清。因此本計劃利用在癌細胞中表現 hepsin 來探討 hepsin 對癌細胞的作用,實驗以Flag-tag 及 Tetracysteine (四個半胱胺酸,TC)作為標記物, 將Flag 及 TC 標記在 hepsin 的 N 端,利用定點突變法 (Site-Direct Mutagenesis)製 造具有切割點(Arg162)及活化中心(Ser353)突變的 hepsin 基因,作為分析野生型 hepsin 蛋白活化機制的自體活化及外界未知蛋白作用的對照組,本計劃選擇癌細 胞株 HeLa 及 Sk-Hep1 作為研究對象,探討轉染後表現的野生型與突變型 hepsin 對此兩種癌細胞的影響。
為探討hepsin 與癌細胞生長、轉移的相關性和機制,本計畫利用體外細胞培養 系統及hepsin 剔除小鼠動物模型等兩部份實驗進行。根據第一年實驗,利用穩定表 達hepsin 腫瘤細胞株進行體外細胞生長及活體裸鼠腫瘤形成實驗後,觀察到 hepsin 的表現能降低腫瘤細胞生長速率及在裸鼠形成腫瘤之大小、速度。而計畫第二年以
SK-Hep1 肝癌細胞株,進行體外細胞生長實驗及癌細胞群落生成實驗,亦觀察到類 似結果。另一方面,為著手製備抗 hepsin 抗體,已藉大腸桿菌表現系統表現人類 hepsin 基因重組蛋白,並開始進行小鼠免疫。本年度利用先前已建立的 hepsin 缺乏 小鼠為模型,進行腫瘤轉移的實驗,結果意外發現自小鼠尾靜脈注射B16F1 黑色素 瘤細胞 21 天後進行解剖觀察,腫瘤聚落都集中於肺,而肝臟幾乎計數不到,但在 hepsin 基因剔除小鼠進行相同實驗時,發現雖然肺部腫瘤數與對照小鼠相近,在肝 臟腫瘤數卻高出四十倍以上。由於利用尾靜脈注射之腫瘤細胞會經下腔靜脈流進心 臟後,先經右心室流進肺臟,再經血液循環流入肝臟,可能造成注射入腫瘤細胞大 多滞留於肺部微小血管內,極少量流入肝臟,可能使觀察結果不夠明確。為減少實 驗可能變因,實驗改採脾臟內注射腫瘤細胞,使癌細胞經肝門靜脈能直接到達肝 臟,以確認hepsin 小鼠腫瘤肝轉移是否較嚴重。結果發現,以不同注射方式(尾靜 脈或脾臟注射)或不同腫瘤細胞(如肺癌細胞株,Lewis Lung Carcinoma)進行腫瘤轉 移小鼠實驗,均觀察到類似結果。另外相同結果也反應在存活率實驗中,hepsin 小 鼠經脾臟注射入腫瘤細胞後,存活率明顯低於對照小鼠。故推測hepsin 與抑制腫瘤 細胞轉移至肝臟機制有關,且該機制並非只針對特定腫瘤細胞,未來將著手討論 hepsin 與抑制腫瘤細胞轉移相關機制。 此外,由於相關文獻指出,黑色素瘤細胞經門靜脈入肝臟後,會引發肝臟產生 內源性一氧化氮(NO)毒殺癌細胞,促使癌細胞自體凋亡,以抑制癌細胞轉移,本年 度亦利用電子順磁共振譜儀(EPR)分析,發現相較於野生型小鼠,hepsin 基因剔除小 鼠在注射黑色素瘤細胞後8 及 24 小時,無法測得肝臟被癌細胞引發產生的 NO,且 藉自體凋亡螢光染色標定腫瘤細胞後,計數肝臟不同區域入侵癌細胞的自體凋亡數 目,也發現hepsin 基因剔除小鼠腫瘤細胞在竇間隙自體凋亡比例較低,故推測 hepsin 可能影響肝臟的NO 生合成,以抑制腫瘤細胞轉移。
參、研究方法及材料
一、Flag 及 tetracysteine 標記融合蛋白質體構築
實驗室先前已製備出hepsin N端標記flag及tetracysteine (TC)的質體,但其 末端序列錯誤,因此本實驗利用定點突變法 (site direct mutagenesis)將錯誤的序 列 置 換 為 全 長 人 類hepsin cDNA 序 列 。 定 點 突 變 方 法 是 以 PCR 為 基 礎 的 Quick-Change Site Direct Mutagenesis (STRATAGENE)方法,取 50 ng的帶有flag 及TC標記之野生型及活化區突變型、活性區突變型、及活化區活性區雙突變型 大鼠hepsin質體DNA,加入 1.4 µl帶有突變位置鹼基的一對引子 (10 µM Hep 417 U、10 µM Hep 417D,序列如表一),dNTP及反應緩衝液,用滅菌水將體積 補至49 µl,最後加入 1 µl連鎖反應酶Pfu Polymerase (2.5U/µl , STRATAGENE), 開始進行連鎖反應。反應條件為,cycle 1 : 95℃ 30 秒 ; cycle 2-18 : 95℃ 30 秒, 42℃ 1 分鐘,68℃ 11 分鐘 ; cycle 19 : 68℃ 10 分鐘 ; cycle 20 : 4℃。反應作用 完後,加入1µl Dpn I限制酶 (New England BioLabs, NEB)於 37℃下作用 1 小 時,之後80℃去活化 20 分,取出 10µl作形質轉移 (transformation),隔天選取 在篩選培養基中長出的菌落,先抽取少量質體DNA,由Nhe I限制酶 (NEB) 切
割篩選出帶有突變鹼基的質體DNA,經過定序確認全長後,可得野生型
pFlag-TC-HepsinhWT、活化點突變型pFlag-TC-HepsinhR162A、酵素活性區突變型 pFlag-TC-HepsinhS353Y及雙突變型pFlag-TC-HepsinhR162AS353Y四種質體,再將帶有 四種質體DNA之菌落大量培養,製備supercoil form DNA,將質體DNA轉染至 哺乳動物細胞中表現蛋白質。
二、細胞株篩選 a. RNA 萃取
將欲分析之細胞株利用 trypsin 脫落,使用 1 ml TriPure reagent (Genesis) 與細胞混合均勻,接著加入0.1 ml Chloroform,劇烈震盪後,靜置室溫 15 分鐘, 以12,000 g 於 4 ℃下離心 15 分鐘,然後吸取上層水層至新離心管,再加入 0.6 ml isopropanol,混合均勻,重覆上述離心 10 分鐘,使 RNA 沈澱於管底,去除 上清液之後,再以0.6 ml 75%酒精清洗沈澱物,離心 12,000g 2 分鐘,去除酒 精,待乾燥後,將RNA 溶於 0.1% DEPC (diethyl pyrocarbonate) 處理過的無菌 水,待RNA 溶解完全,將稀釋 200 倍測定 O.D. 260/280 值並以洋菜電泳膠檢 視RNA 品質及定量。
b. 反轉錄-聚合酶鏈反應 (RT-PCR)
取2 µg RNA 以 oligo dT 作為引子 與 0.1% DEPC 處理過的無菌水混合, 70℃作用 10 分鐘,迅速放到冰上冷卻五分鐘,利用反轉錄酶 (M-MuLV Reverse Transcriptase, NEB)於 42℃下作用 60 分鐘,合成首股 cDNA 後再取部分產物, 以一對引子 (序列如表一)進行 PCR 反應,在總體積為 50µl 的反應溶液中包含 0.1 µM 引子,0.2mM dNTP 及 0.02 unit Taq DNA 合成酶 (BerTaq),PCR 反應 設定是94℃ 30 秒,55℃ 30 秒,72℃ 30 秒如此反覆循環 35 次,接著 72℃作 用7 分鐘,取得產物,洋菜膠電泳分析產物正確性。
三、細胞轉染 (Transfection)
本實驗利用Sk-Hep1 作為表現hepsin蛋白的細胞株。細胞培養在直徑 10 公 分的培養皿,用DMEM (Dulbecco’s Modified Eagle Media , BIOCHROM AG) 作
為培養液,外加10% 胎牛血清 (Fetal bovine serum, FBS,HyClone),100 unit/ml penicillin及 100µg/ml streptomycin,2mM L-glutamine (BIOCHROM AG),培養 在5% CO2、37℃ 恆溫培養箱。轉染方法為磷酸鈣沈澱法 (Calcium Phosphate
transfection),在進行轉染前一天,在每個直徑 10 公分培養皿放置 1x106顆細胞, 隔天進行轉染前30 分鐘換成新鮮的培養液 5 ml,接下來準備欲轉染的磷酸鈣-質體沈澱物。取20 µg質體 與 125 µl CaCl2混合,再補水至250 µl混合均勻後,
以每秒一滴的速度緩慢加入 250 µl 2xHBS (HEPES Buffered Saline ; 0.28 M NaCl,1.5 mM sodium phosphate,50 mM HEPES, pH 7.1) 溶液中,並同時打入 氣泡,之後劇烈震盪20 秒,靜置 20 分鐘,形成磷酸鈣-質體沈澱,再將上述沈 澱混合溶液均勻分散加入細胞,培養 16 小時。另外也利用lipofection方法 (LipofectamineTM 2000 ,Invitrogen )轉染細胞,進行轉染前一天在每個 24 小格培 養皿中放置含 2x105顆細胞的 500 µl 細胞培養液,隔天將 1 µg質體與 2 µl Lipofectamine分別與DMEM培養液混合,使終體積為 50 µl,接下來將質體與轉 染溶液等體積混合,室溫作用 20 分鐘形成DNA與脂質複合物,加入細胞中, 培養24~48 小時,作為短暫大量表現hepsin蛋白的方法,以便進一步分析。 四、細胞株篩選並確認
轉染16 小時後,以Phosphate Buffered Saline (PBS)清洗三次,再置換新鮮 細胞培養液,隔天以 1:8 比例將細胞平均培養在 10 公分的培養皿, SK-Hep1 及Sk-Hep1 細胞分別以含 1 mg/ml及 1.2 mg/ml G418 抗生素 (CALBIOCHEM) 的細胞培養液作篩選,經 2~3 星期挑出單一細胞群落至 24 小格培養皿中,待 長滿後萃取細胞蛋白質(利用M-PERTM,Mammalian Protein Extraction Reagent, PIERCE),由西方墨點分析法以抗flag單株抗體 (Sigma)確認表現hepsin的細胞 株。
五、蛋白質電泳分析 (SDS-PAGE),西方墨點分析(Western blotting)
取適量蛋白與3 倍cracking buffer (3xCB; 0.15 M Tris-HCl, pH6.8, 6 mM EDTA, 3% SDS, 24% Glycerol, 3% 2-Mercaptoethanol, 0.075% Bromophenol blue) 混合使其最後成為1 倍,在 100℃煮沸 5 -10 分鐘使蛋白充分變性,以 10~12% SDS-PAGE、130V電壓展開,進行 1-1.5 小時電泳(Hoefer Mighty Small, Pharmacia Biotech Inc.)。完畢後,利用電導轉移的方式,將蛋白以 110 mA轉移(Hoefer TE70 Semiphor Semi-dry Transfer unit, Pharmacia Biotech Inc.)至硝基纖維膜 (NC膜, Nitrocellulose membrane, Hybond C Extra, Amersham )上,然後將NC膜以 5% 牛 奶溶液(5%脫脂牛奶,Anchor, 20 mM Tris-HCl, 150 mM NaCl, 0.5% Tween-20), 在室溫作用 2 小時或 4℃隔夜,再將NC膜換置於以 5%牛奶稀釋的初級抗體 (anti-Flag M2 monoclonal antibody, Sigma),室溫作用 2 小時或 4℃隔夜。之後 以TBST(20 mM Tris-HCl, pH 7.5, 150 mM NaCl, 0.05% Tween 20)清洗三次, 每次 10 分鐘。再以Horse-Radish Peroxidase (HRP)標記的次級抗體(Pharmacia Biotech Inc.),在室溫下於 5% 牛奶稀釋溶液作用 1 小時,接著以TBST清洗三 次 。 最 後 在 冷 光 劑(Enhanced Chemiluminescence, ECL reagent, Western LightingTM, PerkinElmer)浸泡1分鐘,然後以X光片 (Hyperfilm, Amersham)感光 顯影。
六、人類凝血第七因子活化 (Activation of Coagulation Factor VII)
利用Lipofection轉染法表現WT及S353Y於SK-Hep1 細胞株,隔 48 小時後 吸去培養基,以A緩衝液 (10 mM HEPES, pH 7.45,137 mM NaCl,4 mM KCl,
11 mM glucose) 清洗 1 次,再以A衝液 (A緩衝液,0.1% BSA,5 mM CaCl2) 清
洗兩次之後,加入內含凝血第七因子FVII的A緩衝液 (A緩衝液,0.1% BSA,5 mM CaCl2) 於細胞上,置於 37℃培養箱反應,並於反應開始之 0 分鐘起每隔
30 分鐘收取固定量的上清液,共收取四個時間點,以 12% SDS-PAGE展開,使 用F5-8A1 單株抗體(抗FVII輕鍊)進行西方點墨法分析。此外,也將第七因子 活化作用完的細胞萃取蛋白,接著用抗flag的抗體偵測細胞所表現的hepsin以及 同時測定細胞總蛋白質的濃度(BCA protein assay kit ,Pierce)。
七、細胞群落生成實驗
a. Colony Formation Assay
將細胞數調至每1 ml 含 2 x 103顆,加入已含有1 ml 細胞培養液的 6 小格 培養皿中,每星期換一次新鮮細胞培養液,培養3 週,吸去培養液,加入Amido black染色 5 分鐘,以PBS清洗 2 次,計算細胞群落數目。
b. Soft Agar Assay
配置2 x DMEM以及 1.75 % 低熔點洋菜膠 (FMC)置於 42℃待用,將 2 x DMEM、FBS、1.75 % 低熔點洋菜膠以 5:1:4 的比例混合,形成 0.7% 低熔點 洋菜培養膠,在每個6 小格培養皿中加入 2 ml,放置室溫約 1~2 小時待凝, 此時以 trypsin打散細胞,並以細胞生長培養液將細胞數調整為每 0.75ml含 2 x 104顆細胞數,與0.7% 低熔點洋菜培養膠等體積混合成含有細胞之 0.35%低熔 點洋菜培養混合液,在每個6 小格培養皿中加入 1.5 ml 上述細胞混合液,放置 室溫3~4 小時,凝固後每個小格加入 0.5 ml細胞生長培養液保濕,每隔 3 天置 換新鮮培養液,培養 1~2 週後,加入 50 µl MTT (Methylthiazolyldiphenyl- tetrazolium bromide, 5 mg/ml,Sigma),37℃培養 4 小時,計數細胞群落數。 八、細胞生長速率實驗 (Cell Growth Rate Assay)
2x104顆未轉染SK-Hep1、WT、R162A、S353Y、R162A S353Y SK-Hep1 細胞於6 小格培養皿中,分別在 2、4、6、8 day取出並計數細胞總數。
九、小鼠體內腫瘤生成分析(Tumorigenicity Assay)
將未轉染SK-Hep1 或WT、R162A、S353Y、R162A S353Y hepsin SK-Hep1 細胞分別以 PBS清洗,並用 5 mM EDTA打散,將細胞數調至 1 x 106顆 / 200 µl 不含FBS之細胞培養液,注入約 8 週大的母裸鼠(Balb/C)皮下,每隔 2~3 天觀 察老鼠皮下腫瘤組織生長情形,並在適當的時間取出腫瘤組織分析。
十、細胞生長速率實驗 (Cell Growth Rate Assay)
2x104顆未轉染SK-Hep1、WT、R162A、S353Y、R162A S353Y SK-Hep1 細胞於6 小格培養皿中,分別在 2、4、6、8 day取出並計數細胞總數。
十一、腫瘤生成能力實驗(tumorigenesis assay)
野生型、活化區突變型、酵素功能區突變型、雙突變型hepsin的SK-Hep1 肝癌細胞株,將細胞懸浮於不含血清之細胞培養基中,於6~8 週大的裸鼠(♀, Balb/c nude mice)後肢部位入針,沿皮下將細胞接種於前肢基部下方,所接種 的細胞數為 107。每週測量小鼠皮下腫瘤之長、寬,依據公式:【length(mm) × width(mm)2】/2 計算腫瘤大小 十二、大腸桿菌表現系統 挑取單一菌落接種於3ml LB broth(ampicillin 150μl/ml),於 37℃隔夜培 養。次日,取30μl 隔夜培養的菌液加入至 3 ml 新鮮的 LB broth(ampicillin 150 μl/ml),於 37℃培養至 OD600~0.6,以 IPTG 誘導表現兩小時,以離心的方式
將菌體分離,再以100μl 的 1X PBS 再懸浮菌體,將均質的菌液迅速放入液態 氮中,待菌液凝固後,再快速放入37℃水浴槽,反覆進行冷凍解凍三次,當菌 液黏稠代表菌體溶解,再以超音波震盪方式將 DNA 震碎,取適當量與 3X cracking buffer 混合,進行蛋白質電泳分析與西方墨點法分析。 十三、大腸桿菌表現系統大量表現 挑取單一菌落接種於2ml LB broth,37℃,220 rpm 隔夜培養。次日,將隔 夜培養的菌液倒入200ml LB broth(1:100 稀釋),再於37℃震盪培養箱培養, 當菌液 OD600 約為 0.6 時,加入 100μl 的 0.1M IPTG,使 IPTG 最終濃度為 0.1mM,於 37℃誘導表現 3 小時後,以 5000rpm 離心 20 分鐘(Sorvall RC-5C, GS-3 rotor)將菌體離心沈澱。以 1X PBS/EDTA 沖洗菌體一次,最後將菌體再 懸浮於lysis buffer(100mM Tris-Cl pH 7.0, 5mM EDTA, 5mM DTT)。
十四、重組 GST-hepsin 融合蛋白之純化
將所得大量表現的菌體,以French Press(壓力 18000 Ib/in2,重覆三次) 方式打破,以10000rpm,4℃30 分鐘離心(Sorvall, SS-34 rotor),分離出細菌 包涵體(inclusion body)。以 wash buffer(100mM Tris-Cl pH7.0, 5mM EDTA, 5mM DTT, 2M urea, 2﹪TritonX-100)沖洗包涵體兩次,最後一次沖洗不加 urea 與TritonX-100,所得不溶物質稱為 washed pellet。再以 U buffer(5M urea, 50mM Tris-Cl, pH8.0, 5mM EDTA, 2mM β-mercaptoethanol, 0.15mM PMSF)置於冰上 作用兩小時,溶解包涵體,之後再以4℃,10000 rpm, 30 分鐘離心收取溶解包涵 體後所得上清液,將此上清液與20 倍體積的 PBS/glycerol buffer(1X PBS, 5mM EDTA, 20﹪glycerol, 5mM β-mercaptoethanol, 0.15mM PMSF)透析 2 至 3 小 時,再更換透析緩衝液為PBS/EDTA/PMSF buffer(1XPBS, 5mM EDTA, 0.15mM PMSF)隔夜透析。次日,以 13200 rpm,4℃20 分鐘離心(Eppendorf, 5415R) 透析後的GST-hepsin 融合蛋白粗萃取液,收集其上清液待 GSH 管柱層析純化。 十五、免疫小鼠
使用 4 隻 8 週大的 Balb/c 母小鼠為免疫動物,將純化出的融合蛋白液與 complete Freund's adjuvant(Sigma)以 1:1 體積比混合,以 100μg/100μl 混 合物分別注射入小鼠腹腔及皮下。於 24 天後,將融合蛋白液與 incomplete Freund's adjuvant(Sigma),以 1:1 體積比混合,再以 30μg/100μl 混合物分 別注入小鼠腹腔及皮下。於第41 天進行第二次 boost。於一週後採取眼角血, 分離血清,做 ELISA 篩選,與 Western blotting 確認,挑選抗體效價較高的小 鼠。
十六、ELISA 篩選
將純化出的GST-hepsin 蛋白與 GST 蛋白分別與 1X PBS 透析,分別取 100 μl 蛋白液加至 96 孔盤(Nunc-IMMUNO plate),分別 coating GST-hepsin 150ng/well,GST 50ng/well,將 plate 靜置 4℃隔夜。隔日將蛋白液甩乾,並以 TBST 清洗每個 well,再以 Blocking reagent(0.05% Tween20, 0.02% NaN3, 5% skin milk, 20mM Tris-HCl pH7.5, 150mM NaCl)於 4℃blocking 隔夜,可儲存至 2 個月。
將稀釋後的血清取100μl 加至已 coating 蛋白的 plate 中,於室溫下反應 2 小時,以TBST 清洗三次後,加入 3000 倍稀釋的二級抗體 100μl 於室溫下反 應 1 小時,再以 TBST 清洗,加入 100μl Enhanced K-Blue TMB substrate (NEOGEN)呈色 5 分鐘,再加入 100μl 0.5M H2SO4 終止反應,讀取 OD450。
十七、小鼠尾靜脈注射腫瘤細胞及觀察 於實驗前一天將腫瘤細胞以1:2 進行繼代培養,培養過夜後將細胞以PBS清 洗三次後,用trypsin打下細胞、計數、離心。最後以PBS打散細胞並調整濃度為 每100µl含 5x105個細胞。注射時先將小鼠置於太陽燈下溫暖30 分鐘後,以 0.3 ml 2.5% Avertin麻醉小鼠,待小鼠昏迷,以 27 號針吸取 5x105細胞,由小鼠尾側靜 脈注入,略加壓止血後,保持小鼠體溫,待其甦醒。注射後三週,將小鼠斷頸後, 以解剖器具將肝臟及肺臟取出,以PBS清洗多餘血水,置於解剖顯微鏡下計數腫 瘤細胞群落數。 十八、小鼠脾臟內注射腫瘤細胞及觀察 細胞準備調整濃度同前所述。注射前以0.3 ml 2.5% Avertin 麻醉小鼠;待小 鼠昏迷,由小鼠背部開口,以彎鑷拉出脾臟附近脂肪,以拖曳出脾臟,並於角落 約2-3 釐米先以縫線鬆綁線圈固定,以 30 號針吸取 5x105 細胞後,由鬆綁線圈 邊緣處注細胞入小鼠脾臟,緩慢抽出針後,拉緊線圈防止細胞液流出,脾臟置入 小鼠體內後縫合,保持小鼠體溫,待其甦醒。注射二週後,將小鼠斷頸,以解剖 器具將肝臟及肺臟取出,以PBS 清洗多餘血水,置於解剖顯微鏡下計數腫瘤細 胞群落數。 十九、小鼠存活率實驗 細胞準備調整濃度同前所述。以 0.3 ml 2.5% Avertin 麻醉小鼠後,依前述方 式以尾靜脈或脾臟注射5x105 腫瘤細胞入小鼠體內,保持小鼠體溫,待其甦醒。 注射二週後,開始記錄觀察小鼠死亡時間,以解剖器具將肝臟及肺臟取出,以PBS 清洗多餘血水,置於解剖顯微鏡下計數腫瘤細胞群落數。 二十、以電子順磁共振譜儀(EPR) 測量小鼠肝臟一氧化氮生成量
欲測量小鼠分別由腹腔注入NO-trapper DETC (400 mg/Kg in saline)及FeSO4/
sodium citrate(40mg/Kg , 200mg/Kg in water),計時 30 分鐘。將小鼠斷頸,在 30 秒至1 分內迅速取出肝臟,至於預冷的Petri dish內,快速將肝臟分成小塊後,塞 入預冷1-ml syringe內,以 18-guage needle推擠組織入內徑 2.4mm 石英管中,組 織需高於5 公分且不得有空隙。以蓋子和parafilm封管後,把石英管移至液態氮 中冷凍保存至上機測量。檢體交由清大貴儀中心測量。 二十一、胚胎、組織包埋、切片 欲測量小鼠肝組織以3.7% formalin 固定過夜,第二天移至 30% sucrose 中脫 水,隔天取出,加入抗凍劑(Cryomatrix)放入液態氮(避免液態氮直接與抗凍劑直 接接觸) 後,取出包埋塊,保存於-70℃備用。將包埋好的胚胎或是組織塊,以 Leica 冷凍切片機將標本切成厚度 5μm~10μm 厚度的薄片,並貼至表面覆有 silicon 的玻片上,以供組織染色使用。 二十二、組織螢光染色法 組織切片染色以5% FBS/PBS blocking 2 小時後,與抗 TdT 酶一級抗體(稀 釋於5% FBS/PBS)在 4℃反應過夜。隔日以 0.2% Triton X-100/ PBS 緩衝液沖洗 連續3 次,每次 5 分鐘,洗去一級抗體,再以 conjugated 螢光之二級抗體(稀 釋於5% FBS/PBS)室溫作用 1 小時,重覆清洗步驟後,封片觀察螢光。
肆、實驗結果及討論
一、Flag-TC-Hepsin 質體構築並確認序列
本論文製備出野生型(WT)、活化點突變型(R162A)、活性區突變型(S353Y) 及雙點突變型(R162AS353Y)四種質體。使用 1U、2D、5U、6D 及 9U 引子(表 一)做 hepsin 全長自動序列定序分析,並確認在 Flag 起始碼與 hepsin 起始碼 之間序列為同一讀序。預期質體全長約5.3 kb,可轉譯出與文獻相同的 417 個 hepsin 胺基酸序列,並在 N 端多出 23 個標記物胺基酸 (圖一、圖二),總共 440 個胺基酸,大小約48 kDa 之 Flag-TC-Hepsin 融合蛋白。 二、利用FlAsH-EDT2進行細胞活體染色 為了利用更靈敏的方法偵測WT的表現,利用 1μM FlAsH-EDT2標定穩定 表現Flag-TC-Hepsin融合蛋白之SK-Hep1 細胞,在螢光顯微鏡下觀察活體染色 情形。結果顯示,用來稀釋染劑之緩衝液會降低細胞的貼附能力,使得細胞進 行標記作用、清洗非特異性結合時,致使細胞大量脫落,且沒經過轉染的 SK-Hep1 細胞與FlAsH-EDT2染劑非特異性結合強烈,無法以顯微鏡正常觀察。 (結果未顯示) 三、人類凝血第七因子活化切割實驗
利用短暫表現轉染方法在 HeLa 及 Sk-Hep1 細胞表現 hepsin,並藉由切割 FVII 測定 hepsin 的活性。
四、Hepsin 穩定表現細胞株形成細胞群落的能力
根據細胞生長速率實驗結果, WT 細胞較野生型 HeLa 細胞生長速率低, 表現野生型 hepsin 融合蛋白的 HeLa 細胞生長受到抑制,而兩者之間的差異 P value 等於 0.04,然而 S353Y 細胞相較於其他兩種細胞生長速率最快, S353Y 細胞與野生型 HeLa 細胞的生長並沒有特別的差異,然而與 WT 融合蛋白細胞 株之差異具有統計學意義。推測 hepsin 與 HeLa 細胞生長抑制相關,然而酵素 功能區突變 (S353Y)使 hepsin 無法有效抑制 HeLa 細胞的生長,因此其細胞的 生長能力恢復正常(圖三)。
Soft agar 實驗和細胞群落生成能力實驗類似,主要是在較嚴格的生長環境 下觀察細胞群落的生長能力。SK-Hep1 細胞在 Soft agar 形成細胞群落的能力的 實驗中,未轉染SK-Hep1 細胞、WT SK-Hep1 細胞及 S353Y SK-Hep1 細胞形成 的細胞群落數沒有差異 (圖四) 。 在 hepsin 對細胞增生能力的影響方面的分析發現,也發現表現野生型 hepsin 的細胞株對細胞的生長有明顯抑制,而對未轉染的細胞或表現突變 hepsin 的細胞則沒有影響 (圖五) 。 五、Flag-TC-Hepsin 細胞抑制裸鼠腫瘤生長功能分析 除了利用癌細胞觀察hepsin的抑制作用以外,本論文接著觀察hepsin對於腫 瘤形成及抑制的作用,當將表現WT、S353Y及未轉染的SK-Hep1 細胞後於第 23 天得到的結果整理如表三。依腫瘤大小超過大約 500 mm3作為區隔時,打入 未轉染的SK-Hep1 細胞的四隻老鼠都超過界定值,其中打入穩定表現S353Y之 六隻裸鼠之中有五隻超過界定值,而打入WT的各五隻裸鼠皆在界定範圍之 內。這四組老鼠各所形成的腫瘤平均大小約SK-Hep1 : 1588 mm3,穩定表現WT 細胞 : 289 mm3,短暫表現WT : 98 mm3及S353Y細胞: 1201 mm3。 在第 34 天
取出腫瘤,並比較大小,可觀察到WT與S353Y、SK-Hep1 細胞形成的腫瘤腫瘤 大小差異,此結果顯示WT之腫瘤形成似乎受到抑制 (圖六)。 六、Hepsin 穩定表現細胞株形成細胞群落的能力 將表現野生型及突變型hepsin 的 SK-hep1 細胞株於第一天時,以每個培養 皿 1000 顆的數量培養,並每四天更換培養基,於第十四天後固定並已結晶紫 染色觀察並照相。結果(圖七)發現相較未轉染SK-Hep1 細胞形成的群落數設, 野生型hepsin 之 SK-Hep1 明顯受抑制,二者具統計差異。 七、Hepsin 穩定表現細胞株細胞生長速率 根據細胞生長速率實驗結果,表現野生型hepsin 細胞生長速率低,而未轉 染野生型細胞生長最快,兩者之間的差異P value 等於 0.0016,推測 hepsin 與 腫瘤細胞生長抑制相關 (圖八)。 八、腫瘤生成能力實驗
將要注射入Balb/c 裸鼠體內的 SK-Hep1 穩定表現細胞株,先以 FVII 活化 能力評估其絲胺酸蛋白酶功能,確保所表達的hepsin 是否具酵素活性。以西方 墨點法的結果可以發現,表現野生型的細胞株,具活化 FVII 的能力,雖活化 效果不明顯(圖九);而表現突變型hepsin 的細胞株,則無法活化 FVII。當將 各hepsin 表現細胞株接種至 Balb/c 裸鼠,分別於第七週、第十一週犧牲實驗小 鼠,發現穩定表達 hepsinWT 的細胞株與 SK-Hep1 細胞的腫瘤生成能力沒差 異,但穩定表達hepsinR162A,S353Y 的細胞株其腫瘤大小卻相對較小。 九、GST-hepsin 融合蛋白 以BL21 為表達宿主,於 37℃,以不同濃度的 IPTG 誘導兩小時,並以只 表達GST 的載體作為實驗對照組,發現於 0.1mM IPTG 濃度的誘導條件之下, 即可誘導 GST-hepsin 的表現,所表現出來的 GST-hepsin 融合蛋白大小約為 70 kDa(圖十)。分別將有表現GST-hepsin、mHepsin(SRCR)、mHepsin(extracellular) 的菌體,經冷凍解凍與超音波震盪後,以20000xg, 4℃高速離心 20 分鐘,分離 上清液與沈澱物,進行SDS-PAGE、Western blotting 分析。發現所誘導表現的 基因重組蛋白皆在細菌破碎物的不溶部分,因此推測所表現的重組蛋白形成了 包涵體(圖十一)。 為了從包涵體內萃取基因重組蛋白質,先使用尿素(urea)將基因重組蛋 白溶解出來,再與含20%甘油(glycerol)的透析液進行透析,幫助蛋白質緩慢 再折疊(refolding)。結果顯示,經由尿素變性,再讓蛋白緩慢折疊後,的確能 夠讓蛋白質的溶解度增加,且於 37℃, 0.1mM IPTG 誘導 3 小時表現的 200ml 菌量,約可以得到2mg 的包涵體粗萃取物,以 GSH column 純化後,所得到的 蛋白質分液,取10μl 與 3X cracking buffer 混合後,以 10% SDS-PAGE 展開(圖 十二)。 十、免疫小鼠 於第二次boost 的一週之後,採集眼角血,將眼角血分離出血清,並以 1:1000 稀釋倍數稀釋血清,以會表現人類hepsinR162A, S353Y 細胞總蛋白為抗原,以 西方墨點法方式偵測免疫小鼠的血清是否能辨識不同來源的 human hepsin 蛋 白,發現編號2、4 小鼠的血清含有辨識人類 hepsin 之特異性抗體(圖十三), 之後小鼠免疫工作完成後,將進行cell fusion 的步驟。
十一、腫瘤轉移動物模型實驗(尾部靜脈注射) 小鼠尾靜脈注射 B16F1 黑色素瘤細胞 21 天後進行解剖觀察,腫瘤聚落都 集中於肺,而肝臟幾乎計數不到,但在hepsin 基因剔除小鼠進行相同實驗時, 發現雖然肺部腫瘤數與對照小鼠相近,在肝臟腫瘤數卻高出四十倍以上(圖十 四、十五)。 十二、腫瘤轉移動物模型實驗(脾臟注射) 由於利用尾靜脈注射之腫瘤細胞會經下腔靜脈流進心臟後,先經右心室流 進肺臟,再經血液循環流入肝臟,可能造成注射入腫瘤細胞大多滞留於肺部微 小血管內,極少量流入肝臟,可能使觀察結果不夠明確。為減少實驗可能變因, 實驗改採脾臟內注射腫瘤細胞,使癌細胞經肝門靜脈能直接到達肝臟,以確認 hepsin 小鼠腫瘤肝轉移是否較嚴重。結果發現,經脾臟注射腫瘤細胞,幾乎不 會在肺部生成聚落,但hepsin 基因剔除小鼠的肝臟腫瘤數更明顯高於對照小鼠 (圖十六)。 十三、小鼠存活率實驗 為證明所觀察到腫瘤細胞肝轉移情況也反應於小鼠存活率,故實驗以尾靜 脈或脾臟注射 5x105 腫瘤細胞入小鼠體內,以觀察小鼠存活率(圖十七)。由 於利用尾靜脈注射,腫瘤細胞多滯留於肺部,故小鼠死因多由於腫瘤肺轉移, 無法觀察出hepsin基因剔除小鼠與對照小鼠差異。但以脾臟注射腫瘤細胞後, 腫瘤細胞主要轉移至肝,就可明顯觀察出hepsin基因剔除小鼠與對照小鼠差 異,與腫瘤細胞肝轉移數目相符。 十四、肺癌細胞株腫瘤轉移實驗 為確定所觀察到hepsin 小鼠肝轉移較嚴重的現象,並非只針對特定腫瘤細 胞,故實驗選擇肺癌細胞株Lewis Lung Carcinoma 等不同腫瘤細胞,進行相同 腫瘤轉移小鼠實驗,結果類似黑色素瘤細胞實驗結果,在hepsin 基因剔除小鼠 的腫瘤肝轉移數較高,證明觀察到現象發生於普遍腫瘤細胞(圖十八)。 十五、利用電子順磁共振譜儀(EPR)偵測肝臟 NO 生成情況 相關文獻指出,黑色素瘤細胞經門靜脈入肝臟後,會引發肝臟產生內源性 NO 毒殺癌細胞,促使癌細胞自體凋亡,以抑制癌細胞轉移。若肝臟中具 NO 即可利用電子順磁共振譜儀(EPR)測得 NO 與注射入小鼠體內的 DETC 及硫化 鐵標定金屬形成的結合物,在g=2.04 處產生三個波形。結果發現雖然在注射 LPS 後均能測得 NO 生成,但 hepsin 基因剔除小鼠在注射黑色素瘤細胞後 8 及 24 小時,肝臟無法像野生型小鼠產生 NO(圖十九)。 十六、計數肝臟不同區域入侵癌細胞的自體凋亡比例 文獻指出,腫瘤細胞經門靜脈入侵竇間隙後,自體凋亡腫瘤細胞多集中於 竇間隙附近,且推論可能經肝組織所誘發的 NO,促使腫瘤細胞自體凋亡,以 達毒殺腫瘤細胞,抑制肝轉移的目的。利用螢光標定腫瘤細胞,分別計數比較 肝臟不同區域入侵癌細胞的自體凋亡數目,以了解癌細胞入侵肝臟後自體凋亡 比例。結果發現hepsin 基因剔除小鼠腫瘤細胞在竇間隙自體凋亡比例較低,故 推測可能與hepsin 影響肝臟的 NO 生合成,及 NO 毒殺腫瘤細胞等過程相關(圖 二十及表一)。
伍、討論 為探討第二型穿膜絲胺酸蛋白酶hepsin 可能參與腫瘤細胞轉移的調控機制,本 實驗室先前已利用hepsin 基因剔除小鼠觀察到,hepsin 可能與腫瘤細胞肝轉移的抑 制機制有關,同時,利用電子順磁共振譜儀(EPR)分析,發現基因剔除小鼠肝臟可 能無法受腫瘤細胞誘導,產生一氧化氮以毒殺腫瘤細胞。 透過細胞群落形成、細胞生長速率及裸鼠腫瘤形成實驗中,皮下種入 WT 的 HeLa 細胞,觀察 hepsin 對癌細胞生長、轉移及腫瘤的生長抑制造成的影響。根據 細胞生長速率實驗結果, WT 細胞較野生型 HeLa 細胞生長速率低,表現野生型 hepsin 融合蛋白的 HeLa 細胞生長受到抑制,而兩者之間的差異 P value 等於 0.04, 然而 S353Y 細胞相較於其他兩種細胞生長速率最快, S353Y 細胞與野生型 HeLa
細胞的生長並沒有特別的差異,然而與 WT 融合蛋白細胞株之差異具有統計學意
義。推測hepsin 與 HeLa 細胞生長抑制相關,然而酵素功能區突變 (S353Y)使 hepsin
無法有效抑制 HeLa 細胞的生長,因此其細胞的生長能力恢復正常。此推論可經由 裸鼠的腫瘤生長抑制實驗進一步證實,注入野生型 HeLa 細胞、WT 細胞及 S353Y 細胞的裸鼠皮下腫瘤組織生長速率與細胞生長速率實驗結果相符,並且不同細胞株 形成的腫瘤大小也具有差異,除了觀察裸鼠之腫瘤大小及生長速率之外,待 4~5 週後,取出腫瘤組織切片,以抗flag 抗體染色,確認該處腫瘤組織表現 hepsin 融合 蛋白,並以一般組織染色觀察該腫瘤組織的細胞分化情形。除了利用免疫染色法 外,也可萃取出腫瘤組織中的 RNA 及蛋白質做 hepsin 表現分析。由於本次實驗各 細胞之裸鼠樣本數不一,無法完整統計分析,因此未來可增加並一致裸鼠實驗樣本 數,除了皮下注入不同型hepsin 融合蛋白細胞株,觀察 hepsin 的表現與癌細胞生長 抑制之相關性外,也可經由靜脈注入表現hepsin 融合蛋白的細胞,並透過腫瘤組織 在肝臟及肺臟的形態、分佈、生長情況等病理分析更深入探討hepsin 於癌細胞轉移 作用所扮演的角色。 細胞群落形成實驗結果分析中,以野生型HeLa 細胞形成的群落數為 100 %時, WT 細胞形成的群落數為 81 %,而其他突變型細胞形成的群落數皆大於野生型 HeLa 細胞群落數,但此差異並不顯著,由於剛開始種入六小格培養皿中的細胞數為2,000 顆,培養 10 天,但由於起始細胞數量過多,造成計數細胞時的過大的群落影響計 數結果。因此,可降低起始細胞數或不同數量,提高實驗樣本數,使數據分析則更 具統計意義。
計畫中也利用N 端標記 Tetracysteine motif 的 hepsin 質體,並根據 FlAsH-EDT2 染劑與TC 專一性結合的特性作蛋白 Pulse-Chase Labeling 的動作,然而在蛋白標定 的過程發現 : (1)用以稀釋染劑之緩衝液降低細胞貼附能力,改變細胞形態 (結果未 顯示),(2)野生型 HeLa 細胞對於 FlAsH-EDT2 染劑具有非特異性結合。為了改善細 胞貼附能力下降以及形態改變的現象,欲以標定結束的細胞清洗完換置含有FBS 之 細胞生長培養液培養3 小時,但細胞形態無法在 3 小時之內完全恢復正常的形態, 且hepsin 可能經由其他作用機轉分泌至細胞培養液中,因此無法將經過標記處理的 細胞培養過久。另外,為解決細胞染色背景的問題,本實驗分別使用不同濃度之染 劑,但染劑濃度降至原本文獻使用濃度的 1/4 時,WT 還是會表現一些類似陽性反 應之螢光,降低了作為pulse-chase labeling 的可行性。
計畫第二年也利用大腸桿菌表現系統的優點是能夠大量取得基因重組蛋白,但 是往往所表達出來的外源性蛋白會形成摺疊(folding)不正確的包涵體存在於細菌 體內,造成純化上的困難,必須再以繁複的步驟將蛋白變性後再復性。計畫所選用 表達GST-hepsin 的菌種為 BL21,因為該菌種缺乏 lon 及 ompT 蛋白酵素,因此可以
保護該基因重組蛋白於細菌中被切割水解的情況。而選用GST 做為融合的蛋白,是
因為選用GST 或者是 MBP(maltose binding protein)這類融合蛋白做出來的基因重 組蛋白,溶解度會提高。
而表達mouse hepsin 的菌種為 Origami B(DE3)pLysS,該菌種的優點則是除了具 DE3 lysogen 與 pLysS 質體嚴格管控 T7 RNA polymerase 的表現以及與 BL21 同樣缺 乏lon 及 ompT 蛋白酵素之外,Origami B(DE3)pLysS 有兩個基因:Thioredoxin 與 Glutaredoxin 有突變,這兩個基因的突變可以減低在細菌表現系統雙硫鍵被還原導 致蛋白質摺疊不正確的情形。因此,理論上於該細菌表現外源性蛋白,雙硫鍵較易 形成,蛋白的結構就較接近於本身的蛋白摺疊,所表達的蛋白質也就越有可能具有 活性。再加上選用的pET-22b(+)表現載體,具有 pelB signal peptide,可將蛋白質合 成後,運送至細菌的periplasm,而在該區域的蛋白質溶解度也會較高。結果顯示, 不管大量表現人類 hepsin,或者是表現小鼠 hepsin,皆形成包涵體存在,可能是因 為:1. 沒有找到最佳的誘導條件;2. hepsin 本身結構具有較多的雙硫鍵以維持該結 構,可能因為不正確的雙硫鍵形成,而導致蛋白質摺疊與原本不同。 實驗亦藉由變性後復性的方式可取得大部分的基因重組蛋白,但所得到的復性 後蛋白質,通常不具活性,而純化後的GST-hepsin 是否仍具有酵素活性,必須再以 FVII 以及 pro-HGF 活化實驗確認。當純化 GST-hepsin 融合蛋白時,一直觀察到除 了70kDa 位置有個主要的條帶(band)為我們所要的 GST-hepsin 之外,有許多小條 帶是同樣地會與 GST-hepsin 隨著被沖提出來,經 anti-GST 與 anti-hepsin 抗體確認 後,發現以 anti-GST 抗體辨識,除了 70kDa 外,大約 30kDa 的位置有兩個主要的 條帶,可能是融合蛋白降解產物,或者是轉譯出不完整的蛋白;而以anti-hepsin 抗 體辨識,則可以觀察到於60kDa 的位置另有兩個條帶可能為 GST-hepsin 從 N 端降 解所致,此外於30kDa 的位置也有一個條帶,有可能是當 GST-hepsin 濃度高時,自 體活化所產生的重鏈(catalytic domain)。由AKTA 純化系統純化的經驗,可以發現 GST-hepsin 在以大約 2.5mM 的 GSH 沖提液,即可被沖提出來,而藉由 AKTA 純化
系統可以將之前純化出來的分液不純的情況降低,並且發現於第 21 管分液收集到
60kDa 的蛋白,但經 anti-hepsin 及 anti-GST 抗體確認後,發現那並不是 GST-hepsin 的降解物,可能是同樣會與GSH 管柱結合的蛋白污染物。
在腫瘤生成實驗結果發現,表現 hepsinR162A,S353Y#40 的細胞株其腫瘤生成 能力較低,但是表現hepsinWT#19 的細胞株腫瘤生成的能力,與不表現的 SK-Hep1 肝癌細胞株無異,這樣的結果就與Nakamura et al.的研究發現不同,造成這樣的差 異可能是由於SK-Hep1/hepsinWT#19 的 hepsin 表現量降低所致,由 FVII 活化實驗 也可以看出 hepsin 活化 FVII 的能力也較低。此外,本篇論文所用的材料為八週大 的Balb/c 母裸鼠,而 Nakamura et al.所用的為 5 週大的 Bal/c 公裸鼠,也有所不同。 根據本實驗室王忠琳學姐的論文結果, 在 HeLa 細胞株短暫表現 hepsinWT,腫瘤 生成能力較不表現hepsin 的 HeLa 細胞株差,Nakakura et al.的結果相似,但穩定表 現hepsinWT HeLa 細胞株其腫瘤生成能力與 HeLa 細胞株無異,與本篇的結果相似。
但Nakamura et al.於 2006 年發表的論文並沒有觀察表現突變型 hepsin 的卵巢癌細胞 株在活體內的腫瘤生成能力。由於發現表現突變型hepsin 的腫瘤細胞可能會影響其 腫瘤生成能力,猜測除了絲胺酸蛋白酶功能區塊會影響癌症發展,SRCR 是否也會
影響癌細胞的腫瘤生成能力,因此製備針對SRCR 的抗體就很重要了。這一個活體
內的實驗動物模式,將來可以把製備出的hepsin 抗體注射入 nude mice 體內,作為 一個抗體的功能評估實驗,並且研究hepsin 對於腫瘤生成能力的影響。 延續之前成果,本研究計畫主旨在探討hepsin 在腫瘤細胞誘導肝臟產生一氧化 氮過程中所參與的角色及相關分子機制,除設計實驗確認hepsin 對抑制腫瘤細胞肝 轉移、肝臟誘發一氧化氮機制之表型及通性外;實驗根據腫瘤細胞經門靜脈入竇間 隙,與竇間內皮細胞貼覆因子接觸,停滯以入侵肝臟組織,至宿主肝臟引發的免疫 反應及一氧化氮毒殺等抑制機制的過程,逐步進行觀察比較,以解答肝臟生成一氧 化氮毒殺腫瘤細胞機制及其中hepsin 參與角色。 第一部份實驗欲證實Hepsin 對肝抑制腫瘤細胞轉移之重要性,且此機制不只限 定於特殊細胞株。期望在基因剔除小鼠肝臟表現hepsin 蛋白後,剔除小鼠肝臟能恢 復生成一氧化氮毒殺腫瘤細胞或抑制肝臟腫瘤轉移數量,且該現象與蛋白表現量及 酵素活性相關。若重新表現hepsin 蛋白即能恢復生成一氧化氮毒殺腫瘤細胞機制, 更確信hepsin 參與調控該機制;若無法恢復此機制,但重表現 hepsin 蛋白仍能抑制 腫瘤細胞肝轉移數量,則顯示 hepsin 抑制腫瘤細胞肝轉移數量還經由其他重要機 制,而間接影響肝臟生成一氧化氮毒殺腫瘤細胞。實驗已初步證實,基因剔除小鼠 利用50μg/1.8ml PBS 表達質體尾靜脈注射表現蛋白後,確實於腫瘤細胞注射後 24 小時偵測到一氧化氮生成,14 天後腫瘤肝轉移數量也受抑制;且該現象與 hepsin 酵素活性可能相關,進一步會藉調整肝組織蛋白表現量證實此現象與hepsin 蛋白表 現量成正相關。 同時為證實此現象不單限於黑色素瘤細胞 B16F1,實驗會以大腸腫瘤細胞株
MC-38、肺腫瘤細胞株 Lewis lung cancer 等臨床較常併發肝轉移的癌症病變腫瘤細 胞測驗,以證實觀察到表型之通性;若結果相反,可能觀察之表型限定於特殊細胞 株,推論黑色素瘤細胞可能經特異機制引發相關反應,需再針對此機制討論釐清。 實驗室之前已利用肺腫瘤細胞株Lewis lung cancer,初步觀察到基因剔除鼠肝臟無 法誘導生成一氧化氮及腫瘤細胞肝轉移受抑制等相似結果。此外,hepsin 影響抑制 腫瘤細胞肝轉移受是否主要只透過一氧化氮生成機制?故實驗也將進行一氧化氮 耐受型黑色素腫瘤細胞株B16-BL6 相同的肝轉移實驗,若一氧化氮耐受型黑色素腫 瘤細胞株B16-BL6 在野生型小鼠腫瘤肝轉移即不受抑除,可間接證實一氧化氮生成 機制對肝臟抑制腫瘤細胞轉移的重要性,反之,則可推論除已知一氧化氮外,可能 還有其他更重要機制影響肝臟抑制腫瘤細胞轉移。 未來實驗將探討hepsin 導致此生理現象的可能機制,已知竇間內皮細胞活化產 生能之貼覆因子與腫瘤細胞入侵能力有密切相關,並可能與肝臟生成一氧化氮反應 有關。故實驗期望能透過比較腫瘤細胞侵入野生型及基因剔除型小鼠肝臟之數目, 觀察癌細胞侵入兩種小鼠肝臟的能力是否相同。若腫瘤細胞入侵肝組織數目無差 異,會推論兩種小鼠差異可能源自於肝組織對入侵細胞抵抗機制,如調控細胞激素 生成、影響肝細胞對細胞激素反應、一氧化氮合成脢之生合成之訊息傳遞,並其中 找出hepsin 可能參與路徑與角色。反之,若腫瘤細胞入侵肝組織數目有差異,則會
繼續比較肝組織中,與腫瘤細胞直接作用或影響腫瘤細胞入侵肝組織的可能分子, 如已知的竇間內皮細胞活化產生貼覆因子及肝組織內細胞外間質等,探討hepsin 在 貼覆因子受活化表現或細胞外間質分泌及生合成過程的相關性。 文獻已知腫瘤細胞入侵肝組織後,自體凋亡腫瘤細胞多集中於竇間隙附近,且 推論可能經肝組織所誘發的一氧化氮,促使腫瘤細胞自體凋亡。若肝組織所誘發的 一氧化氮為引發入侵肝臟腫瘤細胞自體凋亡的主要機制,基因剔除小鼠肝臟內入侵 腫瘤細胞自體凋亡比例理應減少,且即便在肝臟不同區域該比例也應該相似;反 之,則可能有其他機制也能促使腫瘤細胞自體凋亡,以抑制腫瘤細胞轉移。之前實 驗室以初步比較兩種小鼠腫瘤細胞侵入肝臟之數目與自體凋亡比例,發現不同時間 點,腫瘤細胞入侵數目無明顯差異,但在野生型小鼠肝臟中,腫瘤細胞自體凋亡比 例較高且多集中於竇間隙附近,故推論此差異可能與肝臟透發的一氧化氮毒殺腫瘤 細胞機制相關。 由於竇間內皮細胞表面的貼覆因子會受活化增加表現,且與腫瘤細胞附著與轉 移能力相關,故實驗亦會針對幾種已知受腫瘤細胞刺激生成的內皮細胞貼覆因子, 如VCAM、E-selectin及肝細胞表面與腫瘤細胞肝臟轉移相關的貼覆因子,如integrin α6β4、α5β1,比較上述貼覆因子受腫瘤細胞刺激後,在野生型與基因剔除小鼠肝組織 之表現量與分佈位置。若觀察到癌細胞入侵肝組織中的數量有差異,並找出可能造 成差異的貼覆因子,實驗將進一步比較該貼覆因子相關的活化誘導生成過程及訊息 傳遞,以找出hepsin可能作用分子或參與之訊息路徑。 除討論腫瘤細胞侵入肝臟數目及侵入後命運,並比較可能參與分子外,肝臟受 誘導生成的一氧化氮,主要源於何種細胞或應用何種分子機制,也能釐清hepsin 可 能參與角色。除能受細胞激素刺激生成的誘導型一氧化氮合成脢(iNOS)外,更有 報告顯示,肝臟受腫瘤細胞誘導合成一氧化氮的機制,是需要表皮型一氧化氮合成 脢(eNOS)參與的。已知肝細胞中廣泛存在表皮型一氧化氮合成脢,且也能受刺激 產生誘導型一氧化氮合成脢,且大量表現hepsin 蛋白;故實驗先選定野生型或基因 剔除型小鼠之初代肝細胞比較經細胞激素或黑色素瘤細胞株刺激後,誘導型及表皮 型一氧化氮合成脢生成量是否有差異,期望模擬活體內腫瘤細胞誘導肝臟生成一氧 化氮機制。實驗若能觀察受刺激後,基因剔除小鼠初代肝細胞無法生成或活化一氧 化氮合成脢,則可追溯促成一氧化氮合成脢生成的訊息傳遞機制,並探討hepsin 其 中可能參與角色。若基因剔除小鼠初代肝細胞刺激後反應與野生型相似,也能排除 此現象是由於肝細胞反應不同所造成,而hepsin 可能是透過影響細胞激素生成量或 免疫系統,以影響肝臟受腫瘤細胞透導生成一氧化氮的機制。初步實驗已證實,以 細胞激素或黑色素瘤細胞株刺激後,以西方點墨法分析野生及基因剔除小鼠初代肝 細胞生成誘導型一氧化氮合成脢蛋白量並無差異,故初步排除誘導型一氧化氮合成 脢生成差異與此機制相關性。 此外,為探討腫瘤細胞進入肝臟後引發的先天性免疫反應與肝臟一氧化氮產生 機制之相關性。比較兩種小鼠腫癌細胞植入後不同時間點,肝組織中癌細胞與白血 球浸潤數目,可確定基因剔除小鼠是否因免疫反應差異,影響肝臟受腫瘤細胞透導 生成一氧化氮的機制;另外,實驗也將比較參與肝臟內先天性免疫反應的細胞種類 及活化比例。若於兩種小鼠間有觀察到差異,則可推論hepsin 可能影響腫瘤細胞入 侵肝臟後宿主的免疫反應,且可能因此影響肝臟受誘導生成一氧化氮等抑制癌轉移
機制;反之則初步排除hepsin 可能對免疫反應造成的影響,主要差異可能源自於肝 細胞或竇間內皮細胞等。 除直接分離小鼠肝臟內免疫細胞進行分析比較,以骨髓移植模式替換基因剔除 小鼠體內免疫細胞,更能輔助觀察hepsin 是否藉免疫系統影響肝臟一氧化氮生成機 制。實驗計劃利用野生型綠螢光轉殖小鼠免疫細胞取代基因剔除小鼠免疫細胞,利 用野生型綠螢光轉殖小鼠免疫細胞確定移植完全後,將觀察移植後的基因剔除小鼠 肝臟受誘導生成一氧化氮情形及腫瘤肝轉移情況是否恢復正常受到抑制。若移植後 基因剔除小鼠腫瘤肝轉移抑制作用恢復正常,或肝臟能偵測到一氧化氮生成,則可 確定hepsin 參與於免疫系統,未來將針對 hepsin 與免疫細胞活化或訊息傳遞機制之 關係進行討論。反之,也可證明hepsin 主要經由影響肝細胞或竇間內皮細胞,促成 肝臟受腫瘤細胞誘導生成一氧化氮及抑制腫瘤細胞肝轉移。
陸、參考文獻
Chambers AF, Groom AC, MacDonald IC. Dissemination and growth of cancer cells in metastatic sites. Nat Rev Cancer. 2:563-72. 2002
Dhanasekaran SM, Barrette TR, Ghosh D, Shah R, Varambally S, Kurachi K, Pienta KJ, Rubin MA, Chinnaiyan AM.Delineation of prognostic biomarkers in prostate cancer.
Nature 412:822-6, 2001
Jiang WG. Cell adhesion molecules in the formation of liver metastasis. J Hepatobiliary
Pancreat Surg. 5:375-82,1998.
Kawamura S, Kurachi S, Deyashiki Y, Kurachi K. Complete nucleotide sequence, origin of isoform and functional characterization of the mouse Hepsin gene. Eur J Biochem. 262:755-64, 1999
Kazama Y, Hamamoto T, Foster DC, Kisiel W. Hepsin, a putative membrane- associated serine protease, activates human factor VII and initiates a pathway of blood coagulation on the cell surface leading to thrombin formation. J Biol Chem. 270:66-72, 1995
Khatib AM, Kontogiannea M, Fallavollita L, Jamison B, Meterissian S, Brodt P: Rapid induction of cytokine and E-selectin expression in the liver in response to metastatic tumor cells. Cancer Res 59:1356-61,1999
Kurachi K, Torres-Rosado A, Tsuji A. Hepsin. Methods Enzymol 244:100-14, 1994 Leytus SP, Loeb KR, Hagen FS, Kurachi K, Davie EW. A novel trypsin-like serine protease (Hepsin) with a putative transmembrane domain expressed by human liver and hepatoma cells. Biochemistry 27:1067-74, 1988
Magee JA, Araki T, Patil S, Ehrig T, True L, Humphrey PA, Catalona WJ, Watson MA, Milbrandt J. Expression profiling reveals Hepsin overexpression in prostate cancer.
Cancer Res.61:5692-6, 2001
Qi K, Qiu H, Rutherford J, Zhao Y, Nance DM, Orr FW. Direct visualization of nitric oxide release by liver cells after the arrest of metastatic tumor cells in the hepatic microvasculature. J Surg Res. 119:29-35, 2004
Scherbarth S, Orr FW: Intravital videomicroscopic evidence for regulation of metastasis by the hepatic microvasculature: effects of interleukin-1alpha on metastasis and the location of B16F1 melanoma cell arrest. Cancer Res 57:4105-10,1997
Shi Q, Xiong Q, Wang B, Le X, Khan NA, Xie K. Influence of nitric oxide synthase II gene disruption on tumor growth and metastasis. Cancer Res. 60:2579-83,2000
Somoza JR, Ho JD, Luong C, Ghate M, Sprengeler PA, Mortara K, Shrader WD,
Sperandio D, Chan H, McGrath ME, Katz BA. The structure of the extracellular region of human Hepsin reveals a serine protease domain and a novel scavenger receptor
cysteine-rich (SRCR) domain. Structure 11:1123-31, 2003
Tanimoto H, Yan Y, Clarke J, Korourian S, Shigemasa K, Parmley TH, Parham GP, O'Brien TJ. Hepsin, a cell surface serine protease identified in hepatoma cells, is overexpressed in ovarian cancer. Cancer Res.57:2884-7, 1997
Torres-Rosado A, O'Shea KS, Tsuji A, Chou SH, Kurachi K. Hepsin, a putative
cell-surface serine protease, is required for mammalian cell growth. Proc. Natl. Acad. Sci. 90:7181-5, 1993
Tsuji A, Torres-Rosado A, Arai T, Chou SH, Kurachi K. Characterization of Hepsin, a membrane bound protease. Biomed Biochim Acta.50:791-3, 1991
Tsuji A, Torres-Rosado A, Arai T, Le Beau MM, Lemons RS, Chou SH, Kurachi K. Hepsin, a cell membrane-associated protease. Characterization, tissue distribution, and gene localization. J Biol Chem. 266:16948-53, 1991
Vu TK, Liu RW, Haaksma CJ, Tomasek JJ, Howard EW. Identification and cloning of the membrane-associated serine protease, Hepsin, from mouse preimplantation embryos. J
Biol Chem. 272:31315-20, 1997
Wang HH, McIntosh AR, Hasinoff BB, MacNeil B, Rector E, Nance DM, Orr FW: Regulation of B16F1 melanoma cell metastasis by inducible functions of the hepatic microvasculature. Eur J Cancer 38:1261-70,2002
Wang HH, McIntosh AR, Hasinoff BB, Rector ES, Ahmed N, Nance DM, Orr FW. B16 melanoma cell arrest in the mouse liver induces nitric oxide release and sinusoidal
cytotoxicity: a natural hepatic defense against metastasis. Cancer Res. 60:5862-9, 2000 Wang HH, Nance DM, Orr FW: Murine hepatic microvascular adhesion molecule
expression is inducible and has a zonal distribution. Clin Exp Metastasis 17:149-55, 1999 Wang HH, Qiu H, Qi K, Orr FW. Current views concerning the influences of murine hepatic endothelial adhesive and cytotoxic properties on interactions between metastatic tumor cells and the liver. Comp Hepatol. 4:8-18, 2005
Wu Q, Yu D, Post J, Halks-Miller M, Sadler JE, Morser J.Generation and characterization of mice deficient in Hepsin, a hepatic transmembrane serine protease. J Clin Invest. 101:321-6, 1998
Yu IS, Chen HJ, Lee YS, Huang PH, Lin SR, Tsai TW, Lin SW. Mice deficient in Hepsin, a serine protease, exhibit normal embryogenesis and unchanged hepatocyte regeneration ability. Thromb Haemost. 84:865-70, 2000
Zacharski LR, Ornstein DL, Memoli VA, Rousseau SM, Kisiel W. Expression of the factor VII activating protease, Hepsin, in situ in renal cell carcinoma. Thromb
柒、圖及表
圖 一 、pFlag-TC-HepsinhWT 、pFlag-TC-HepsinhR162A*、pFlag-TC-HepsinhS353Y*、 pFlag-TC-HepsinhR162AS353Y**質體示意圖。(*)標記為胺基酸R162A突變 、 (*) 標記為胺基酸S353Y突變、 (**)標記為雙點突變型 (RS) 的Flag-TC-Hepsin 質體。
圖二、Flag-TC-Hepsin 質體自動序列定序分析圖,A. pFlag-TC-Hepsin-WT 為野生型。 B. pFlag-TC-Hepsin-R162A 為活化點突變型。C. pFlag-TC-Hepsin-S353Y 為活 性區突變型。D. pFlag-TC-Hepsin-RS 為活化點及活性區雙突變型。
A.
B.
圖三、細胞群落生成能力實驗。將2000 顆細胞種於 6 小格培養皿培養 10 天後細胞 群落生成情形。A. 細胞群落形成的情形。B. 細胞群落形成的效率,計數 6 小格培養皿形成之細胞群落數,以NT:未轉染之 HeLa 細胞數 (680 顆)為 100 %,此為三個實驗組。圖四、細胞群落生成能力實驗。將20,000 顆 HeLa 細胞與 soft agar 混合種於 6 小格 培養皿培養16 天後形成之細胞群落數。A. 未轉染之 HeLa 細胞,B. WT 細胞,C. R162A 細胞,D. S353Y 細胞,E. R162AS353Y 細胞。(n=3)
圖五、表現Hepsin 融合蛋白之 HeLa 細胞生長速率實驗。未轉染之 HeLa 細胞之 細胞數每隔24 小時以等比例增加,穩定表現 WT 細胞生長速率降低。
圖七、將表現野生型及突變型Hepsin 的 SK-hep1 細胞株於第一天時,以每個 培養皿1000 顆的數量培養,並每四天更換培養基,於第十四天後固定並已結 晶紫染色觀察並照相。(n=3)
圖八、表現 Hepsin 融合蛋白之肝癌細胞株生長速率實驗。未轉染之肝癌 細胞株每隔24 小時以等比例增加,穩定表現 hepsin 會降低細胞生長速率。
圖九、活體內 hepsin 穩定表現 SK-Hep1 細胞株之腫瘤生成能力實驗 A圖:第一次腫瘤生成能力之實驗結果,於第七週時,SK-Hep1/hepsin-mycWT19與SK-Hep1 細胞腫瘤生成能力無差異,p=0.066; SK-Hep1/hepsin-mycRS40較SK-Hep1 細胞腫瘤生成能力差,p=0.043。 B圖:第二次腫瘤生成能力之實驗結果,於第 11 週時,SK-Hep1/hepsin-mycWT19與SK-Hep1 細胞腫瘤生成能力無差異,p=0.345; SK-Hep1/hepsin-mycRS40與SK-Hep1 細胞腫瘤生成能力無差異,p=0.053。
A.
B.
﹡為 p<0.05圖十、小量誘導表現 GST-hepsin 融合蛋白 A 圖為 Coomassie blue 染色結果
◆為誘導表現的 GST-hepsin 融合蛋白,大小為 70kDa; ★為誘導表現的 GST 蛋白,大小為 26kDa。
B 圖為西方墨點法結果
1°Ab:mouse anti-GST monoclonal antibody(Zymed)1:10000 稀釋 2°Ab:goat anti-mouse HRP conjugated antibody(Chemicon)1:10000 稀 釋
圖十一、小量表現 mHepsin(SRCR)與 mHepsin(extracellular)基因重組蛋白 A 圖為 mHepsin(SRCR)小量表現之 coomassie blue 染色結果,
★為誘導表現出來的蛋白,1~7 為不同 clone 的菌。
B 圖為 mHepsin(extracellular)小量表現之 coomassie blue 染色結果, ◆為誘導出來的蛋白,1~6 為不同 clone 的菌。
圖十二、以自己 pack 的 GSH 親和力管柱純化 GST-hepsin 融合蛋 白之 coomassie blue 染色結果
箭號所指為 GST-hepsin 融合蛋白的位置, 所指為小於 GST-hepsin 大小的蛋白質。
No.2
No.1
No.3 No.4
圖十三、免疫 GST-hepsin 小鼠之血清抗體專一性實驗
No.1~4 分別為不同編號的免疫小鼠。lane1~4 為SK-Hep1/hepsinRS40的細胞 總蛋白量 10μg 2 倍序列稀釋作為抗體偵測的抗原,並以第二次boost後所 採的小鼠血清 1:1000 稀釋偵測。No.2 的C為以anti-hepsin(Cayman)偵測 10μg的SK-Hep1/hepsin-MycRS40的細胞總蛋白量的對照組。箭號所指為 hepsin位置,約為 45 kDa。
圖十四、本實驗室先前利用野生型(Hepsin+/+)及基因剔除(Hepsin-/-)小鼠進行腫瘤細 胞轉移實驗(與中研院陶祕華老師合作),經尾靜脈注射黑色素瘤細胞(B16F1) 21 天 後,黑色素瘤細胞轉移至肺及肝臟情形(上圖為肺;下圖為肝)。實驗動物為 8-12 週 母鼠。